История изучения ларвального парагонимоза. География ларвального парагонимоза
Добавил пользователь Cypher Обновлено: 01.02.2026
Паразитарные инвазии легких - наименее изученный раздел пульмонологии, в котором вопросы о жизненном цикле паразита и его взаимоотношении с организмом хозяина (в первую очередь человека) долгое время оставались на уровне представлений первой половины XX века. Так, даже таксономия возбудителя здесь была окончательно уточнена только в начале 80-х годов.
Поражение человека легочной двуусткой в России считалось "экзотической патологией" и спорадически регистрировалось в основном на территории Приморского края, являющегося одним из самых северных ареалов обитания паразитов рода Paragonimus, широко распространенных в Южной и Центральной Америке, Африке, Юго-Восточной Азии и других регионах. В то же время здесь достаточно часто пациентами стационаров различного профиля (как соматических, так и фтизиатрических) становились люди с бронхолегочной патологией неопределенной нозологической принадлежности, длительным течением и толерантностью к традиционным способам терапии. В связи с неясностью диагноза учет таких больных не велся, и только после создания во Владивостоке медицинского вуза, одной из клинических баз которого стала краевая больница, удалось выделить этот контингент пациентов в отдельную группу и начать полноценное комплексное исследование.
На Дальнем Востоке впервые были систематизированы особенности клиники, патогенеза, патологической анатомии, диагностики и лечения ларвального парагонимоза. Научные исследования выполнены авторами предлагаемой статьи совместно с учеными Харбинского университета (КНР).
Патогенез и патологическая анатомия
Среди природно-очаговых заболеваний Дальнего Востока парагонимоз - паразитарная инвазия с преимущественным поражением легких - занимает особое положение не только потому, что Приморский край является самым высокоширотным ареалом обитания парагонимид, но и потому, что именно здесь впервые была описана ларвальная (личиночная) форма этой инфекции. Парагонимоз широко распространен во всем мире, включая Евразийский, Африканский и Американский континенты, но наиболее активно он изучался в странах Азиатско-Тихоокеанского региона, на территории которых расположены основные эндемические очаги.
Жизненный цикл паразита в "классическом варианте" изучен достаточно подробно. В пресноводных водоемах из яйца выходит мирацидий, который внедряется в некоторые виды моллюсков (промежуточные хозяева) и проходит здесь стадию спороцисты, образуя церкарий. Им заражаются пресноводные раки и крабы (дополнительные хозяева), в теле которых формируются метацеркарии (инцистированные). Метацеркарии попадают в организм дефинитивного (резервуарного) хозяина при поедании термически недостаточно обработанного мяса пресноводных ракообразных.
В желудке и дуоденальном отделе кишечника дефинитивного хозяина метацеркарии выходят из цисты (эксцистируются), затем с помощью стилета и ферментов проникают через стенку кишки в брюшную полость, а далее сквозь диафрагму - в плевральные полости и легкие. Направление миграции определяется аэрофильностью возбудителя.
Основное место локализации половозрелых гельминтов - легкие. Здесь взрослые особи образуют кисты, в которых и достигают половой зрелости. Парагонимоз у человека, как считалось до недавнего времени, развивается только в виде перибронхиального кистозного поражения легких с наличием половозрелых паразитов и выделением их яиц во внешнюю среду (мокрота, испражнения). Заболевание имело достаточно четко очерченные клинико-рентгенологические и лабораторные характеристики. Однако в конце 70-х годов в результате независимых исследований японскими и отечественными учеными была установлена возможность длительного обитания личинок в организме дефинитивного хозяина без превращения их в половозрелую форму. В отличие от зарубежных биологов, описавших "мышечные личинки" парагонимов у диких и домашних теплокровных животных, в Приморье ларвальная форма парагонимоза была установлена на основании клинических и экспериментальных исследований. Сегодня можно считать доказанным, что ряд видов парагонимид может вызывать ларвальную инвазию, что зависит в основном от отношений хозяин - паразит, сложившихся в ходе эволюции.
Цикл развития паразита при ларвальном парагонимозе останавливается на стадии личинки (эксцистированный метацеркарий), которая, активно мигрируя из кишечника в легкие, повреждает органы и серозные покровы брюшной и грудной полости. Адекватная экспериментальная картина этой формы парагонимоза получена на белых беспородных крысах, у других животных чаще развивается типичное заболевание с кистозным поражением легких.
Почти у половины больных ларвальный парагонимоз начинается с абдоминального синдрома, который возникает через несколько часов или суток от момента заражения и проявляется болями, а также симптомами кишечной и желудочной диспепсии.
Как показали эксперименты на мышах, протеаза метацеркариев вызывает экссудацию с высоким содержанием эозинофилов и нейтрофилов в перитонеальном выпоте. Морфологически в это время регистрируется картина катарального энтерита с очаговой микродеструкцией кишечной стенки (паразитарные ходы). В лимфатических узлах брюшной полости возникают реактивные неспецифические изменения.
По ходу миграции личинки могут оказаться в мышечных массивах передней брюшной стенки и субсерозных отделах париетальной брюшины. В эксперименте они проникают в различные органы, в том числе и в почки, инициируя развитие паранефрита и межуточного нефрита. К концу первых суток опыта личинки внедряются в диафрагму, проходят через нее и оказываются в грудной полости. В печени также прослеживаются паразитарные ходы и формируется картина межуточного гепатита.
Часть личинок достигает легких, не превращаясь там, однако, в половозрелых паразитов. Локализуясь парабронхиально и мигрируя в легких, личинки обусловливают формирование сложной морфологической картины, когда альтеративно-экссудативные процессы сочетаются с продуктивно-склеротическими. Тем не менее признаки аллергического компонента воспаления присутствуют на всех этапах инвазии: доля эозинофилов в составе тканевых клеточных коопераций доходит до 10-17%. По ходу миграции личинок кроме альтеративно-продуктивных регистрировались и гранулематозные процессы.
Учитывая, что и сами паразиты, и их фрагменты могут быть отнесены к персистирующим антигенным структурам, подобная динамика тканевых реакций является закономерной, и гигантоклеточные гранулемы с высоким содержанием эозинофилов могут считаться относительно специфичными для данного вида инвазии.
Описанный патоморфогенез ларвального парагонимоза обусловливает синдромный полиморфизм болезни, сложности прижизненной клинической, параклинической и биопсийной диагностики.
Клиника и диагностика
Токсико-аллергический синдром, возникающий вслед за абдоминальным или одновременно с ним, наблюдается у подавляющего большинства больных. Его наиболее частые симптомы - общая слабость, потливость, лихорадка, боли в суставах, уртикарная сыпь, похудание. Тяжесть синдрома соответствует выраженности острых воспалительных изменений в органах дыхания. Длительность этих симптомов - около 1,5-3 месяцев, иногда более. Параллельно токсико-аллергическому развивается и главный синдром - легочный. Симптоматика его малоспецифична и заключается, как правило, в болях в грудной клетке, кашле, одышке. Патоморфогенетической основой этого синдрома кроме описанных изменений легких служит выпотной плеврит и иногда перикардит (фибринозный, серозный, серозно-фибринозный). Различают ранние и поздние (реинвазивные) плевриты, исходом которых являются плевральные сращения.
Заболевание протекает с длительной временной утратой трудоспособности, плохо поддается лечению и часто служит фоновым состоянием для обострения хронических болезней бронхо-легочной системы, таких как предсуществующий хронический бронхит, бронхиальная астма, эмфизема легких и др.
С морфологической точки зрения можно выделить ряд изменений, характерных для данного вида инвазии. В остром периоде болезни - это альтеративно-экссудативные реакции с выраженной эозинофилией клеточных коопераций по ходу миграции паразита. В подострой и хронической фазе развиваются пролиферативно-склеротические процессы, также сопровождающиеся эозинофилией. Учитывая волнообразный характер течения болезни и постоянство передвижения личинок, обычно можно видеть пеструю картину чередования экссудативных и продуктивных тканевых реакций. Основу прижизненной диагностики составляет серологическое исследование, биопсия является методом выбора, ценность которого более высока для ориентировочной и дифференциальной диагностики. Наличие личинок в гистологических срезах при биопсии можно считать исключительным феноменом. Более вероятно обнаружение паразитарных ходов, выполненных в зависимости от давности детритом или грануляциями. Не исключено также формирование макрофагальных и эпителиоидных саркоидоподобных гранулем, отличающихся от схожих проявлений гиперергии замедленного типа достаточно выраженной эозинофилией. На основе проведенных экспериментов можно говорить и о неспецифических межуточных реакциях в почках, печени, миокарде, легких.
Параклинические исследования также указывают на высокую специфичность для ларвальной формы инвазии умеренного лейкоцитоза периферической крови с выраженной эозинофилией (до 10% и более) и ускорение СОЭ. Особое место в диагностическом спектре занимают серологические реакции на основе антигена, приготовленного из взрослых трематод: реакция непрямой гемагглютинации, реакция латекс-агглютинации, реакция связывания комплемента, иммуноферментный анализ. Среди них наиболее чувствительны РНГА и ИФА. Последний также хорошо зарекомендовал себя как метод скрининга.
Существование ларвального парагонимоза у человека доказано на примере заболевания, вызываемого Paragonimus westermani ichunensis, личиночный характер инвазии парагонимами вида japonicus и pulmonalis у теплокровных животных подробно рассмотрен в работах японских ученых. Однако анализ литературы позволяет обоснованно распространить этот феномен и на другие виды парагонимид. Описания нетипичного течения парагонимоза, сходные с клинико-морфологическими проявлениями ларвальной формы заболевания, часто встречаются во время обзоров вспышек этой инфекции на разных континентах. Учитывая трудности в постановке диагноза, клинические маски ларвального парагонимоза и обострение сочетанной патологии, можно предположить, что феномен личиночного паразитизма парагонимид распространен гораздо шире, чем считалось до сих пор, и требует дополнительных клинико-экспериментальных и морфологических исследований.
Парагонимоз, как и другие гельминтозы, является причиной разнообразных нарушений обменных процессов в организме человека, что связано с аллергическими, механическими, токсическими и другими видами воздействий гельминтов. В настоящее время при наличии высокоэффективных антигельминтных препаратов лечение должно быть прежде всего этиотропным. На фоне эффективной антигельминтной терапии через сравнительно короткие сроки (3-6 месяцев) часто наблюдается нормализация показателей всех обменных процессов, которые нарушались в процессе инвазии. Однако определенные клинико-морфологические нарушения в ряде случаев требуют дальнейших реабилитационных мероприятий.
Битионол (битин), предложенный японскими специалистами, с эффектом использовался в 60-е годы при типичных формах парагонимоза (М.Yokogawa et al., 1961). Нами было проведено исследование эффективности применения битина при самостоятельной ларвальной форме парагонимоза in vivo и in vitro. К сожалению, применение этого препарата при ларвальной форме инвазии оказалось неэффективным. У большинства больных не было получено даже клинического эффекта, у части больных наблюдался медленный, сходный с самопроизвольным регресс симптоматики, а в каждом 5-м случае через 1-2 месяца развивался рецидив. Аналогичные результаты были получены на экспериментальной модели ларвального парагонимоза.
В 80-е годы стал использоваться празиквантел (билтрицид, азинокс). Механизм действия препарата связан с повышением проницаемости клеточных мембран паразита для ионов кальция. Это вызывает сокращение мускулатуры паразита, переходящее в спастический паралич. Применение билтрицида ознаменовало появление второго препарата для лечения парагонимоза, как и для лечения других трематодозов. Он высокоэффективен при зрелой форме парагонимоза у 90-95% больных.
Билтрицид быстро всасывается в кишечнике, выводится преимущественно почками в течение 4 суток, из них 90% - в течение 1-х суток. Противопоказан в 1-м триместре беременности, следует осторожно назначать больным с заболеваниями печени. Препарат хорошо переносится, побочные явления незначительны. Однако могут наблюдаться тошнота, головная боль, сонливость, боли в эпигастрии, аллергические реакции. Описанные явления исчезают после окончания приема препарата.
Эффективность билтрицида при личиночном парагонимозе по исследованиям авторов высока - 89%, но ниже, чем при типичной форме заболевания. Билтрицид впервые был применен нами при ларвальном парагонимозе в дозе 40-60 мг/кг веса тела. При однодневном курсе лечения дозу делят на 2-3 приема после еды. Эффект билтрицида изучен у 100 больных ларвальным парагонимозом. На фоне явного клинического улучшения уже в ранние сроки (7-10 дней) после курса этиотропного лечения реакция иммунодиффузии (РИД) у 95% больных стала отрицательной. Лишь у 5% больных РИД еще некоторое время оставалась положительной. Примерно у 11% больных через 3-6 месяцев РИД стала вновь положительной, что указывало на отсутствие излечения. Этим больным через 4-6 месяцев был проведен эффективный повторный курс лечения билтрицидом.
На основании собственного опыта мы считаем, что удлинение схемы терапии бильтрицидом при личиночной форме парагонимоза не следует применять. Проведенные исследования по увеличению дозы до 70 мг/кг массы тела или увеличению длительности лечения до 2 дней показали, что существенных дополнительных клинических и лабораторных эффектов при этом не наблюдается. А
вторы проводили исследования эффективности применения аналога бильтрицида - отечественного препарата азинокса. Исследования показали, что эффективность препарата составила лишь 50-60%. Существенно ниже, чем при приеме билтрицида.
Среди клинико-морфологических последствий перенесенного ларвального парагонимоза отмечены интерстициальные изменения в легких и плевросклероз, которые у ряда больных могут нарушать функцию внешнего дыхания. Таким больным рекомендуются стандартные методики рассасывающей медикаментозной терапии, комплекс физиотерапевтических процедур, грязелечение, курортно-климатическое лечение, дыхательная гимнастика, массаж грудной клетки, отказ от курения, общеукрепляющие процедуры - полноценное питание, правильный режим труда и отдыха.
Профилактика парагонимоза весьма проста. В эндемичных для этого вида паразитарной инвазии районах Дальнего Востока нельзя употреблять в пищу блюда, включающие сырое или термически недостаточно обработанное мясо пресноводных ракообразных, дикой и домашней свиньи, а также хищных животных.
История изучения ларвального парагонимоза. География ларвального парагонимоза
ГБОУ ВПО «Волгоградский государственный медицинский университет», Павших Борцов пл., 1, Волгоград, Российская федерация, 400131
Волгоградский государственный медицинский университет, Волгоград, Россия
Кафедры патологической анатомии, судебной медицины, биологии ФГБОУ ВО «Волгоградский государственный медицинский университет» Минздрава России, Волгоград, Россия
ГБОУ ВПО «Воронежский государственный медицинский университет им. Н.Н. Бурденко», Воронеж, Россия
Легочный ларвальный парагонимоз, имитирующий рак легкого
Журнал: Архив патологии. 2018;80(2): 60‑63
Ларвальный парагонимоз — паразитарное заболевание, вызываемое личинками легочного сосальщика. В отличие от классического варианта парагонимоз ларвальный протекает с большим количеством клинических проявлений, что усложняет диагностику ларвального парагонимоза, так как обилие клинических проявлений приводит к ложной диагностике других заболеваний. Еще одной отличительной чертой данной формы парагонимоза является склонность к генерализации и имитации клинической картины злокачественных новообразований. Приведен пример ларвальной формы парагонимоза с поражением легких, плевры, сердца, печени, правой почки, селезенки, желудка и малого сальника. Диагностические мероприятия не дали точного представления о природе заболевания, поэтому была выполнена диагностическая торакоскопия и взята биопсия из субплевральных диссеминатов с последующим срочным гистологическим заключением, указавшим на наличие железистого рака. Это обстоятельство стало причиной для атипической резекции пораженной доли, однако на 2-е сутки послеоперационного периода пациент умер в результате тромбоэмболии легочной артерии. Посмертно поставлен основной диагноз: хронический, легочный генерализованный парагонимоз (кистозная и пневмосклеротические фазы) с синдромом опухоли.
Парагонимоз — паразитарное заболевание человека из группы трематодозов, вызываемое чаще всего легочным сосальщиком Paragonimus Westermani (легочная двуустка). Взрослый легочный сосальщик — гельминт буро-красного цвета, тело яйцевидной формы, выпуклое со стороны спинки и сплюснутое на брюшной стороне, с развитой мускулатурой. Имеет хорошо видимые невооруженным глазом присоски и шипики, с помощью которых крепится в организме хозяина. Яйца золотисто-коричневого цвета, овальной формы, снабжены крышечкой [1].
Эндемичными регионами парагонимоза являются Азия, Африка и Южная Америка [2, 3]. В Российской Федерации данный вид парагонимоза характерен для территории Дальнего Востока (низовье реки Амура и южное побережье Охотского моря) [4].
Заражение человека происходит чаще всего при употреблении в пищу сырых или недостаточно проваренных, слабопросоленных крабов, раков или креветок. Известно 48 видов легочного сосальщика, из них 16 способны заражать человека и вызывать парагонимоз [4, 5]. Все сосальщики поражают человека, находясь в стадии метацеркариев. С помощью стилетов они пронизывают стенку начального отдела тонкой кишки и попадают в брюшную полость. Затем личинки мигрируют через диафрагму в плевральную полость, попутно инвазируя некоторые органы брюшной полости, в частности поджелудочную железу, печень, малый сальник, селезенку и желудок. После попадания в плевральную полость личинки некоторое время проводят на париетальной плевре, затем, проникая на висцеральную, внедряются в легочную ткань, где достигают зрелости. Однако, согласно проведенным исследованиям [6, 7], не все виды парагонимов в организме человека способны достигать половой зрелости. Именно в таком случае следует говорить о ларвальном (личиночный) парагонимозе. Это обусловлено тем, что отдельные виды легочного сосальщика, такие как P. westermani ichunensis, P. miyazakii, P. huatungensis, могут использовать человека и некоторые виды животных как резервуарных хозяев, и если у животных нет никакой реакции на инвазию, то у человека формируется редкая, труднодиагностируемая патология.
В легочной паренхиме вокруг паразитов развивается гранулематозное воспаление с последующей фиброзной инкапсуляцией с формированием кист и возможным проникновением гельминтов в просвет бронхиол. Диаметр кист может достигать 2 см, их количество варьирует в зависимости от тяжести инфекционного процесса [8].
Редкость данной патологии, а также нетипичная клиническая картина затрудняют дифференциальную диагностику и приводят к ложной диагностике других патологий. В литературе описаны случаи выявления легочной формы парагонимоза, имитирующих симптомы туберкулеза легких и плевры [9—12], рецидивирующего рака легких [13] или опухолевых метастазов в легких [4, 14], церебральной формы с начальной клиникой геморрагического инсульта и лихорадочным синдромом и судорогами [15], абдоминальной формы с поражением двуусткой поджелудочной железы (рассмотренные как кистозно-солидная опухоль) [16].
Для диагностики ларвального парагонимоза большое значение имеют общий анализ крови, который выявляет эозинофилию [1—5], положительные результаты иммуноферментного анализа и полимеразной цепной реакции [3, 4, 17], рентгенография и компьютерная томография (КТ) грудной клетки, при которых выявляются очаговые уплотнения, а также результаты позитронно-эмиссионной томографии [3, 14, 17].
В качестве диагностического примера в связи со сложностями клинической и патоморфологической диагностики из-за нетипичной клинической картины приводим случай заболевания парагонимозом больного, который находился на лечении в областном онкологическом диспансере в 2016 г.
Больной Б., 66 лет, поступил в онкологический диспансер с предварительным диагнозом: диссеминированное злокачественное новообразование легких, правосторонний рецидивирующий плеврит, дыхательная недостаточность (НД) II—III степени; ишемическая болезнь сердца; кардиосклероз (Н-I); хроническая обструктивная болезнь легких (ХОБЛ); стадия опухолевого процесса IV; клиническая группа II.
При поступлении больной жаловался на одышку при минимальной физической нагрузке, ощущение тяжести и тянущую боль в правой половине грудной клетки. Состояние больного средней степени тяжести. Отставаний грудной клетки в акте дыхания нет, дыхание ритмичное, перкуторный легочный звук тимпанический, притуплен в нижних отделах справа. Аускультативно: дыхание везикулярное, ослабленное, в нижних отделах слева не прослушивается. Общий анализ крови: Нb 122 г/л, эр. 4,28·10 12 /л, тр. 203·10 9 /л, л. 8,3·10 9 /л; СОЭ 41 мм/ч. Биохимический анализ крови: мочевина 9,1 ммоль/л, креатинин 132,3 мкмоль/л, общий билирубин 20 мкмоль/л, общий белок крови 62,8 г/л, АЛТ 183,4 ед/л. Для уточнения диагноза и определения тактики лечения проведена КТ грудной клетки, при которой обнаружены осумкованный плеврит левого легкого, правосторонний пневмоторакс с явлением компрессии нижней доли правого легкого, а также выраженный пневмосклероз. Сравнительный анализ с предыдущим результатом КТ подтвердил отсутствие динамики изменений в легких. На основании общего осмотра, лабораторных анализов и данных КТ грудной клетки выставлен основной диагноз: подозрение на рак легкого. Сопутствующие заболевания: специфический плеврит слева; ХОБЛ; пневмосклероз; ДН II—III степени; ишемическая болезнь сердца; кардиосклероз Н-I.
Назначена плановая операция в объеме диагностической торакоскопии справа и плевродеза. В ходе операции при осмотре плевральной полости: плевра покрыта фибрином, контактно кровоточит. Нижняя доля правого легкого в спавшемся состоянии, в дыхании практически не участвует, отмечаются множественные субплевральные диссеминаты. В проекции слияния верхней полой и непарной вены визуализируется лимфатический узел диаметром до 1 см. Произведено вскрытие плевры, взята биопсия лимфатического узла и при срочном гистологическом исследовании поставлен диагноз: лимфаденит. Принято решение выполнить атипичную резекцию нижней доли правого легкого. В ходе операции дополнительно установлен торакопорт в пятом межреберье, атипически удален участок нижней доли с отсевами, при срочном гистологическом исследовании биоптата обнаружены единичные железистые структуры, идентифицированные как железистый рак. Под аэростатическим контролем введено 10 г мелкодисперсного талька (плевродез). Плевральная полость дренирована в третьем и седьмом межреберье по Бюлау. Рана ушита послойно. На следующие сутки после операции пациент жаловался лишь на общую слабость и на боль в послеоперационной ране. По дренажам из плевральной полости отделялась светлая жидкость. Больной переведен из отделения реанимации в хирургическое отделение. В 5 ч утра на 2-е сутки после операции пациент внезапно потерял сознание. Для проведения реанимационных мероприятий он в срочном порядке был переведен в отделение реанимации, где была констатирована смерть.
При патолого-анатомическом исследовании в плевре, легочной паренхиме, миокарде, печени, селезенке, почке, стенке желудка и малом сальнике обнаружены множественные кисты различных размеров. Макроскопические признаки тромбоэмболии правой ветви легочной артерии с геморрагическим инфарктом в правой нижней доле. Резкое полнокровие головного мозга и внутренних органов. Изменения, характерные для ХОБЛ. Утолщение стенок бронхов разного калибра со слизистым содержимым, множественные очаги пониженной воздушности в паренхиме легких. Толщина стенки правого желудочка 1,3 см, левого 2 см. Масса сердца 600 г (легочное сердце).
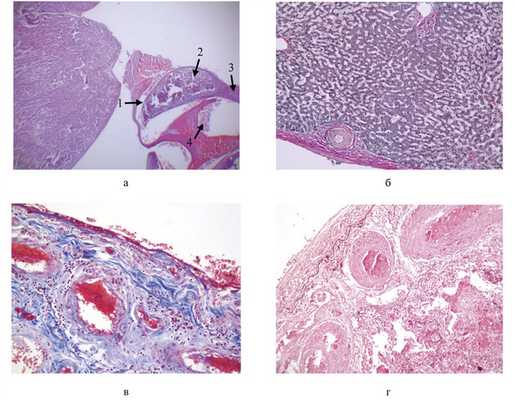
При гистологическом исследовании материала в головном мозге определяется выраженный периваскулярный и перицеллюлярный отек, в миокарде — выраженный интерстициальный отек с воспалительными инфильтратами, содержавшими лимфоциты, плазматические клетки, эозинофилы. Гипертрофированные мышечные волокна с множественными кистами и наличием в них личиночных форм паразита со сформировавшимися соединительнотканными капсулами. В области перикарда определяются прилегающие к нему фрагменты метацеркарии легочной двуустки со скоплениями эритроцитов (см. рисунок, Кистозно-пневмосклеротическая фаза генерализованного ларвального парагонимоза. а — погибшая метацеркария легочной двуустки у перикарда: 1 — кутикула личинки, 2 — тело личинки, 3 — хвост личинки, 4 — cкопление эритроцитов. ШИК-реакция, ×100; б — паразитарная киста в капсуле печени с выраженным фиброзом. Окраска по ван Гизону, ×200; в— соединительнотканные кисты легочной двуустки, располагающиеся под плеврой. Окраска по Маллори, ×400; г— соединительнотканные кисты легочной двуустки, располагающиеся под плеврой. Окраска орсеином, ×400. а). В печени (см. рисунок, б) непосредственно под капсулой и в паренхиме множественные паразитарные кисты с наличием погибших паразитов. В паренхиме правой почки паразитарные кисты, дистрофические изменения эпителия канальцев, очаговая лимфоидно-клеточная инфильтрация по периферии кист и в интерстиции. В ткани легкого (см. рисунок, в, г) множество паразитарных кист, часть из которых замещена фиброзной тканью. Межальвеолярные перегородки утолщены, с очаговой лимфоидно-плазмоцитарной инфильтрацией преимущественно вокруг кист. В селезенке умеренная гиперплазия белой пульпы, паразитарные кисты с наличием эритроцитов в центральной части. В желудке слизистая оболочка с диффузной воспалительной инфильтрацией и тенденцией к формированию эрозии, с участками фиброзирования и дискомплексации желез, обнаружены паразитарные кисты на серозной оболочке и в ней. В жировой ткани малого сальника множественные паразитарные кисты.
Данное наблюдение демонстрирует сложности диагностики кистозно-пневмосклеротической фазы генерализованного ларвального парагонимоза, протекавшего с опухолевым синдромом. Особенность наблюдения заключается в том, что у больного диссеминированный парагонимоз был с полиорганным поражением и образованием множественных фиброзирующихся кист в пораженных органах. Парагонимоз не диагностирован своевременно, специфическая терапия не проводилась, что способствовало прогрессированию воспалительного процесса в легких с вовлечением многих органов, развитием легочного сердца, тромбоэмболии легочной артерии, послужившей непосредственной причиной смерти. Расхождение диагнозов обусловлено редкой патологией с нетипичной клинической картиной (категория II).
2.1 Новое в проблеме парагонимозов: ларвальный парагонимоз человека и животных
В начале 60-х годов в краевую клиническую больницу Приморья (г. Владивосток) все чаще стали поступать больные с клиникой острых воспалительных изменений органов дыхания, а главное - с необъяснимо высокой эозинофилией крови.
Последняя больше всего беспокоила врачей, так как оставалась у пациентов достаточно длительно и не поддавалась терапевтической коррекции. Бронхо-легочный же синдром постепенно, в течение 1-3 месяцев, регрессировал, часто, правда, давая рецидивы, несмотря на противовоспалительную и десенсибилизирующую (в том числе глюкокортикоидную) терапию. Часть больных (до 20%) в связи с подозрением на туберкулез лечилась во фтизиатрических стационарах, но также без особого эффекта.
Вначале все проявления заболевания расценивались как синдром Леф- флера с гиперэозинофильной реакцией крови, но уже вскоре стало понятно, что причиной болезни является какой-то неизвестный фактор, персистирующий в организме больного, практически не реагируя на неспецифическую терапию. Уменьшение интенсивности бронхолегочной симптоматики, также как и разрешение рецидивов на фоне проводимого лечения, скорее всего проходило самопроизвольно. При тщательном изучении анамнеза у многих больных удалось выявить один общий факт: прием в пищу сырых речных раков.
Уже тогда были высказаны предположения о парагонимозной этиологии заболевания (Г. И. Суханова, 1967-1975), тем более что природные очаги парагонимоза на Дальнем Востоке были установлены еще в 1927-1928 годах. С тех пор это заболевание у человека в Приморском крае регистрировалось различными авторами в единичных случаях - 15-20 наблюдений за 40 лет, и проблемы в связи с редкостью инвазии не существовало. В краевую же клинику больных с «синдромом Леффлера» поступало по нескольку десятков в год.
Это заставило нас обратиться к заведующему паразитологической лабораторией Тихоокеанского научно-исследовательского института рыбного
хозяйства и океанографии (ТИНРО) Ю. В Курочкину, который и подтвердил пораженность метацеркариями парагонима раков из рек, где предположительно заражались указанные пациенты.
Однако в литературе тех лет описывалась совершенно иная клиника парагонимоза. Указывалось, что самыми достоверными клиническими признаками этой инвазии являются кровохарканье, кисты в легких и наличие яиц паразита в мокроте и испражнениях, чего не было ни у одного из наших больных.
Все это побудило к проведению экспериментальных исследований. Попытки заражения белых крыс метацеркариями парагонима, выделенными из речных раков (рис. 14), оказались, на первый взгляд, неудачными - типичный парагонимоз у животных не развивался На вскрытиях через 8 и даже 16 недель после заражения, когда паразит уже несомненно должен быть половозрелым и локализоваться в легочных кистах, лишь в единичных случаях мы видели по 1-2 полости, содержащие неразвитые личинки парагонимов. Затем, во время одной из секций в диафрагме крысы было обнаружено множество метацеркариев, которые были найдены также и в мышцах конечностей, и - особенно много - в межреберной мускулатуре (рис. 15). Было не ясно, как долго могли личинки находиться в поперечно-полосатых мышцах.
В последующих экспериментах при вскрытии в разные сроки 28 зараженных белых крыс было установ
лено’ что эксцистирование метацер- кариев в кишечнике происходит уже в течение первых 3-4 часов. От 80 до 100% личинок, пройдя через стенку кишечника в брюшинную полость, проникали в диафрагму, а также в другие мышечные массивы в первые же сутки. Здесь личинки задерживались. При исследовании животных через 2, 7, 10, 25 суток и через 2 и 4 месяца отмечен незначительный рост метацеркариев, не сопровождавшийся их созреванием.
Стало ясно, что открыта новая форма жизнедеятельности парагони- мов, которые в организме животных локализуются преимущественно в мышечных массивах (поперечно-полосатые волокна) и существуют там в личиночной стадии.
Интересно отметить, что в параллельных опытах на собаках, зараженных метацеркариями из тех же раков, что и крысы, развивалась картина типичного легочного парагонимоза со стадией половозрелого паразита и образованием кист (рис. 16).
животным метацеркариев Рага- §отти$ м>ев1егтат (I. Мгуагакл, 8. НаЪе, 1976, 1978). Авторы установили, что даже через большие сроки после заражения (до 331 дня) личинки приостанавливали свое развитие, но оставались жизнеспособными и практически всегда локализовались в мышцах (так называемые «мышечные личинки»). Японские ученые также зарегистрировали случаи спонтанной зараженности личинками парагонима мяса диких кабанов (I.
М]уагак1 е1 а1., 1976; 1. 1УПуа2ак1, 1978). Так впервые было установлено существование второго, дополнительного промежуточного (резервуарно- го) хозяина в биологическом цикле трематод рода Рага§оттш. Был выявлен ранее неизвестный путь заражения парагонимозом дефинитивных хозяев через поедание сырого (или полусырого) мяса различных видов млекопитающих (дикого кабана, грызунов и др.). По-видимому, этот путь заражения является основным для хищников, не питающихся в природе ракообразными (тигры, леопарды), и он также не исключен для человека. В Японии было зарегистрировано много случаев заболевания парагонимозом у людей, никогда не употреблявших в пищу раков или крабов. Не лишним будет вспомнить, что один из первых экземпляров парагонима обнаружил Вестерман, бывший директором амстердамского зоопарка, в легком у погибшего в зоопарке тигра.
Проведенный эксперимент дал ответ на вопрос, где же локализуются парагонимы у зараженных крыс, если они отсутствуют в легких. Аналогичный вопрос возникал и при обследовании людей. К тому времени были разработаны серологические реакции для диагностики парагонимоза, которые оказались положительными у наших больных. Поэтому с открытием возможности длительной персистенции личинок парагонима в мышцах крыс стала ясна возможность такой же ситуации и у человека.
Этот термин был признан среди паразитологов и вошел в современные монографии и учебники, в том числе и в фундаментальный труд по гельминтологии I. М|'уа2а1е$- Iегтат ккипепш и др.
Так, анализ литературы показывает, что случаи парагонимоза, не сопровождающиеся образованием легочных кист и выделением яиц паразита, описывались задолго до открытия «мышечных личинок» у теплокровных животных и описания ларвального парагонимоза человека.
Н. Н. Озерецковский (1979) сообщили о 6 подобных случаях на Дальнем Востоке России, а Янг и соавт. еще в 1959 г. среди 300 наблюдений типичного парагонимоза у жителей о. Тайвань выделили, но никак не объяснили «странное» течение заболевания, характеризовавшееся развитием плевритов, перикардитов и пневмонических инфильтратов при высокой эозинофилии крови без формирования паразитарных кист (8. Р. Уап§ е1 а1„ 1959).
Японские исследователи (8. НауазЫ, Н. Уатато1о, 1974; М. Уокоцауа е1 а1., 1974; А. КаЪауазЫ е! а1., 1975) также упоминали в своих работах, посвященных парагони- мозу, вызванному Рага%оттш тгуагакп, о подобном течении заболевания. При изучении инвазии в Се
верном Китае с серологической идентификацией этиологического агента как Рага§оттш и>ез1егтат и Рага^оттш ккипепт Чунг и соавт. описывали у части больных бронхит, эозинофилию крови, эпилептические приступы, экссудативные плевриты и спонтанный пневмоторакс при резко положительной реакции связывания комплемента с параго- нимозным антигеном при отсутствии в мокроте и кале яиц паразита и без образования типичных кист (Н. Ь. СЬип§ е1 а1., 1978, 1981).
Таким образом, выделение ларвальных парагонимозов в самостоятельную группу должно привлечь внимание исследователей к дальнейшему изучению всех возможных видов парагонимов, дающих эту форму паразитизма у животных и человека в эндемичных регионах.
География ларвального парагонимоза в Приморском крае
2) распространенность инвазии среди населения по данным анамнеза госпитализированных больных, 3) эпидемиологическое обследование населения Уссурийского района края.
Для этого, начиная с осени 1975 г., в летние сезоны изучались пресноводные раки в водоемах Приморья, по возможности в тех регионах, где заражались ранее обследованные больные. Заражение происходило в весенне-летне-осен- ний период и было обычно связано с выездами на места отдыха у рек, на рыбалку, сельхозработы.
Основные очаги инфекции зарегистрированы во время экспедиций 1975-1977 гг. в бассейне двух наиболее крупных рек края: Уссури и Раздольная, а также нескольких рек, впадающих в озеро Ханка. Зараженных раков не обнаружено только в реках Шкотовка, Артемов- ка и Партизанская. Раки СатЪгоШез с1аипсиа из реки Комаровки (приток Раздольной) были инфицированы метацеркариями трематод рода Рага§оттш в 100% случаев. В реках, впадающих в озеро Ханка, инфицированными оказались до 30% раков. Интенсивность инвазии также была различной: от 350 (река Ко- маровка) до 17 метацеркариев на одно животное (реки, впадающие в озеро Ханка).
При изучении карты становится ясным, что инфицированные пресноводные раки выявлены в реках, имеющих связь с Китаем. Весьма вероятно, что это определяющий фактор существования природного очага парагонимоза в Приморском крае, так как зараженность ракообразных в водоемах соседнего государства имеет
повсеместный характер (рис. 19). С высокой степенью вероятности можно предположить, что в реках восточного побережья, отделенных от западных районов водоразделом хребта Сихотэ-Алинь и не охваченных проведенными экспедициями, очагов парагонимоза нет. В нашей практике не было ни одного больного, заразившегося в районах во
сточной и юго-восточной частей Приморского края.
Наиболее часто заражение происходило в бассейне реки Раздольной и ее притока - реки Комаров- ки, реже оно регистрировалось в бассейнах рек, впадающих в озеро Ханка. Большинство больных поступало из Уссурийского (река Ко- маровка), Яковлевского (река Раздольная), Михайловского и Черниговского (река Илистая) районов. Данные по этим параметрам представлены в таблице 2.
Следует заметить, что большинство детей с положительными серологическими пробами на парагонимоз чувствовало себя вполне удовлетворительно, но у более чем половины из них удалось выявить те или иные симптомы заболевания: боли в животе и расстройства стула, боли в груди и длительный кашель, лейкоцитоз, ускорение СОЭ и эози- нофилию периферической крови.
У 71 ребенка при рентгеноскопии были найдены: деформация легочного рисунка (35), уплотнение корней легких (17), адгезивные изменения плевры (29). Удовлетворительное состояние детей указывало на то, что течение инвазии может быть достаточно легким. Возможно, здесь имело место и некоторое «привыкание»,
и защитный иммунитет при повторном инфицировании - клинический аналог «толерантной реакции», полученной японскими учеными в эксперименте (Р. Ната^таеЫ., 1991).
Среди 4796 взрослых жителей Уссурийского района группа риска - лица, употреблявшие в пищу недостаточно термически обработанных ракообразных - составила 135 человек.
По ходу обследования были выявлены 2 человека в активной фазе болезни и еще 9 человек, в течение 2 предшествующих лет лечившихся в городской больнице Уссурийска с диагнозами синдрома Леффлера, эозинофильной пневмонии, эозинофильной лейкемоидной реакции. Ретроспективный анализ историй болезни, дополнительный сбор анамнеза, а также положительная РНГА, поставленная у части из них, подтвердили диагноз ларвального парагонимоза.
Кроме этих больных за 3 года (1976-1978) через терапевтическое отделение уссурийской городской больницы прошли еще 10 больных из других мест обследованного района с аналогичными диагнозами. Изучение историй болезни здесь также подтвердил наличие ларвального парагонимоза. Таким образом, по самым «скромным подсчетам» количество заболевших в Уссурийском районе составило 19 человек за 3 года. Эта цифра, конечно же, меньше показателя истинной заболеваемости, поскольку часть пациентов могла «скрываться» за диагнозами других болезней.
Показательна в этом отношении история болезни пациента Б., 19 лет, жителя г. Уссурийска.
Заболел остро, в августе 1977 г. После неэффективного амбулаторного лечения по поводу «острого бронхита»
4 февраля 1978 г. госпитализирован в терапевтическое отделение городской больницы Уссурийска. К тому времени жаловался на боли в груди слева, сухой кашель, одышку, резкую слабость, потливость, головные боли, повышение температуры до 38°С. При физикальном обследовании отмечалось укорочение перкуторного звука слева под углом лопатки, там же выслушивалось ослабленное дыхание, а над областью сердца - шум трения перикарда. В анализе крови - лейкоцитоз (15,2г 10 9 /л) с эозинофилией (42%), СОЭ 10 мм в час.
Рентгенологически: экссудативный плеврит слева, экссудативный перикардит. Диагностирован синдром Леффлера. Больной направлен в краевую клиническую больницу.
Здесь в дополнение к анамнезу выяснена связь заболевания с приемом в пищу сырых раков из притока реки Раздольной - через 2-3 часа у больного были рвота и боли в животе. Заболевание развилось через 2-3 недели после означенного пищевого эксцесса. РИГА с парагонимозным антигеном от 7 апреля 1978 г. оказалась положительной в разведении 1:1280, РЛА- 1:64. В мокроте и испражнениях яйца паразита не обнаружены. Диагностирован ларвальный парагонимоз.
В течение 1978 г. Б три раза лечился в краевой клинической больнице, проведя в стационаре в общей сложности 88 дней. Повторные поступления были обусловлены симптомами токсико-аллергического характера: периодические повышения температуры тела, мигрирующие боли в грудной клетке, астенизация. Проведено три 10-дневных курса битионолотерапии (курсовая доза 25-30 г) в апреле, июне и октябре 1978 г. Стойкого терапевтического эффекта не отмечено.
Постепенное улучшение общего состояния больного и снижение титра РИГА до 1:80 произошло только к концу октября 1978 г., что вполне укладывалось в обычные сроки динамики и не- леченного ларвального парагонимоза.
Повторные эпидемиологические исследования в Приморского крае проведены в 1989 г. группой сотрудников кафедр внутренних болезней, детских болезней, патологической анатомии и эпидемиологии Владивостокского государственного медицинского института (Г. Ц. Полежаева, 1990). Обследовано 3897 человек, вновь изучена пораженность парагонимозом промежуточных хозяев, оценены социально-бытовые и другие факторы, имеющие значение в формировании эндемических очагов.
Очаги ларвального парагонимоза обнаружены в четырех городах и пяти районах Приморского края, расположенных в бассейне рек Уссури, Раздольной и их притоков. Наибольшая частота положительных серологических реакций выявлена среди взрослого населения Уссурийского и Спасского районов (до 3,8±1,2%) и среди детей из сел, расположенных по берегам рек Комаровки, Илистой и Уссури (до 6%).
Ларвальный парагонимоз был впервые зарегистрирован в Надеждинском районе. Перечисленные регионы были отнесены к очагам повышенного риска заражения, что подтверждено высокой степенью пораженности метацеркариями парагонима пресноводных ракообразных из соответствующих водоемов. Как и во время предыдущих обследований, обсемененность раков в реке Комаровке составила 100% при наличии более чем 300 личинок в каждом животном. В северных районах края заселенность водоемов промежуточными хозяевами была меньшей при снижении также показателей их пораженности.
Таким образом, изучение эпидемиологии ларвального парагонимоза в Приморском крае показывает, что зараженность промежуточных
хозяев регистрируется повсеместно в реках и других пресноводных водоемах западной части Приморья, имеющих общий бассейн с Китаем. В условиях усиливающегося воздействия человека на природу, растущих миграционных потоков из Китая и стран Юго-Восточной Азии могут произойти изменения на экосистемном уровне с формированием новых эндемичных очагов. Это возводит ларвальный парагонимоз, эффективная профилактика которого невозможна без учета территориального распространения паразита, в ранг важнейших медико-экологических проблем региона.
ЛАРВАЛЬНЫЙ (ЛИЧИНОЧНЫЙ) ПАРАГОНИМОЗ
Рис. 7-17. а. Рентгенограмма грудной клетки пациента с типичным парагонимозом: кольцевидная тень паразитарной кисты в левом лёгком (указана стрелкой), увеличение прикорневых лимфатических узлов. б. Томограмма левого лёгкого пациентки с типичным парагонимозом: множественные паразитарные кисты (указаны стрелками) (по Miyazaki)
ПАТОГЕНЕЗ И ПАТОЛОГИЧЕСКАЯ АНАТОМИЯ
Патогенез ЛП связан с механическими повреждениями органов и тканей мигрирующими личинками, аллергическими реакциями организма в результате сенсибилизации и токсического воздействия продуктов жизнедеятельности гельминта. Как показали эксперименты на мышах, при проникновении личинок парагонимусов в брюшную полость протеаза метацеркариев вызывает экссудацию с высоким содержанием эозинофилов и нейтрофилов в перитонеальном выпоте.
Рис. 7-18. Личинка парагонима в диафрагме крысы (1-й день инвазии). Гистологический препарат, ув. 40х.
Гистологически в это время регистрируется картина катарального энтерита с очаговой микродеструкцией кишечной стенки - образованием паразитарных ходов. В лимфатических узлах брюшной полости возникают реактивные неспецифические изменения. К концу первых суток после экспериментального заражения личинки внедряются в диафрагму, а затем - в плевральную полость и легкие. Мигрирующие личинки могут оказаться в мышцах передней брюшной стенки и субсерозных отделах париетальной брюшины, различных органах. В почках личинки возбудителя инициируют развитие паранефрита, межуточного нефрита. В печени также прослеживаются паразитарные ходы и формируется картина межуточного гепатита. Достигая легких, личинки не превращаются в половозрелых паразитов (рис. 7-19). Мигрируя в легких, личинки обусловливают развитие альтеративно-экссудативных изменений, формирование гранулем и пневмосклероза. Эозинофильным гранулоцитам принадлежит важная роль в формировании воспалительного ответа на всех этапах инвазии, их содержание в пораженных гельминтами тканях составляет 10 - 17%. Описанный патоморфогенез ларвального парагонимоза обусловливает синдромный полиморфизм болезни [9 - 11].
КЛИНИКА
В большинстве случаев клинические проявления ЛП могут быть представлены 4 синдромами: абдоминальным, токсико-аллергическим, легочным и неврологическим. Возможно также бессимптомное, или латентное, течение инвазии [12 - 14].
Абдоминальный синдром, как правило, мало выражен и быстро проходит. У половины больных наблюдаются симптомы острого гастроэнтерита: схваткообразные боли в животе (у 88,8%), тошнота (у 25%), одно-, двухкратная рвота (у 24,1%), диарея - обычно не чаще 3 раз в сутки (у 48,3%). У 10,5% отмечается
Рис. 7-19. Личинка паразита из легкого больного с ларвальным парагонимозом. Длина личинки 1,2 мм, половые органы не сформированы, строение тела соответствует эксцистированному метацеркарию
увеличение печени и у 8,9% - перитонеальный выпот без симптомов раздражения брюшины. У детей в половине случаев наблюдаются гепатоспленомегалия и лимфаденопатия [15].
Токсико-аллергический синдром наблюдается у подавляющего большинства больных. Наиболее частыми его симптомами являются общая слабость (у 67,7%), лихорадка (у 57,3%), потливость (у 59,3%), похудание (у 29%), боли в суставах (у 8,5%), уртикарная сыпь (у 6,5%). Эти расстройства могут возникать с самого начала инвазии параллельно с абдоминальным синдромом, но чаще нарастают по мере развития легочного синдрома и соответствуют выраженности воспалительных изменений в легких.
Легочный синдром наблюдается у всех больных ЛП. Большинство больных считают его появление началом заболевания. Боль в грудной клетке, кашель и одышка, повышение температуры возникают остро. Боль в грудной клетке встречаются в 88,7% случаев, имеет непостоянный, мигрирующий характер и часто бывает связана с актом дыхания. Наиболее характерная начальная локализация боли - в подреберьях, что обусловлено повреждениями диафрагмальной плевры личинками парагонима, мигрирующими в легкие. Острота боли постепенно снижается, но она длительно сохраняется на протяжении всего периода болезни. У больных развивается диафрагмальный плеврит. Симптоматика его крайне скудна, часто только повторные рентгенологические исследования обнаруживают признаки перенесенного процесса: уплощенность и деформацию диафрагмы, плевральные сращения, облитерацию плевральных синусов. Кашель - второй по частоте симптом ЛП. Он наблюдается у 81% больных, причем в половине случаев бывает кратковременным и маловыраженным. Прожилки крови в мокроте обнаруживаются редко. Одышка отмечается меньше, чем у половины больных (у 41,9%). Больные могут предъявлять жалобы на «скрипы» в груди, которые являются признаком фибринозного плеврита. В некоторых случаях эпизоды экспираторной одышки и приступы удушья, напоминающие БА, появляются через несколько месяцев после начала инвазии. Развитие ЛП при БА приводит, как правило, к обострению последней.
Физикальные находки, как правило, неспецифичны. Укорочение перкуторного звука, выявляемое у 87,9% больных, обычно обусловлено наличием плеврального выпота, фибринозными наложениями, утолщением и сращением плевральных листков, грубый шум трения плевры определяется даже пальпаторно у каждого пятого пациента. Обращает на себя внимание скудность перкуторных и аускультативных данных при наличии выраженных очаговых и инфильтративных изменений в легких на рентгенограммах. Ослабление дыхания над областью затемнений в легких, обнаруживаемых рентгенологически, отмечается всего в 11,3% случаев, сухие хрипы - в 14,1%, влажные - в 11,3%. Бедность симптоматики связана в первую очередь с тем, что основные воспалительные изменения при ЛП локализуются в интерстициальной ткани. Наиболее частый аускультативный феномен - шум трения плевры, поскольку плеврит - одно из характерных проявлений легочного синдрома. Плевриты при ЛП имеют фибринозный, серозный, серозно-фибринозный и, редко, геморрагический характер. В 19,5% случаев экссудативный плеврит возникает в первый месяц болезни. Плеврит, выявляемый впервые через 4 - 6 мес от начала инвазии, является следствием продолжающейся активной миграции личинок.
Неврологический синдром встречается у 2,5% больных и проявляется, в основном, головной болью. Могут иметь место признаки раздражения менингеальных оболочек, симптомы вестибулопатии.
Читайте также:
