Клетки крови при миелодиспластических синдромах - нарушения функции
Добавил пользователь Дмитрий К. Обновлено: 28.01.2026
Миелодиспластический синдром (МДС) - это не одна какая-то болезнь, это целая группа различных патологических состояний костного мозга (КМ), отнесенных к гематологии, но пока не причисленных к лейкозам, хотя болезнь оставляет высокий риск перехода в более тяжелую форму (лейкоз).
Суть МДС заключается в нарушении костномозгового кроветворения на миелоидной линии в отношении какого-то одного клона клеток или затрагивающего несколько популяций. В любом случае для миелодиспластического синдрома характерным признаком будет изменение качественного и количественного состава периферической крови.
Коротко о гемопоэзе
Кроветворение (гемопоэз) - процесс, проходящий много стадий, на каждой из которых клетки крови приобретают новые качества (дифференцируются). Конечным результатом этого процесса является выход в периферическую кровь зрелых (или созревающих, но уже имеющих определенные «навыки»), полноценных, способных осуществлять свои функциональные задачи, форменных элементов крови:
- Красных кровяных телец - эритроцитов;
- Белых клеток - лейкоцитов;
- Кровяных пластинок (бляшек Биццоцеро) - тромбоцитов.
Кроветворение начинается от стволовой клетки, способной, дифференцироваться и давать жизнь всем линиям (росткам) гемопоэза. Миелоидный и лимфоидный ростки пошли от специализированных, обладающих высокой пролиферативной активностью, способных к дифференцировке плюрипотентных клеток.
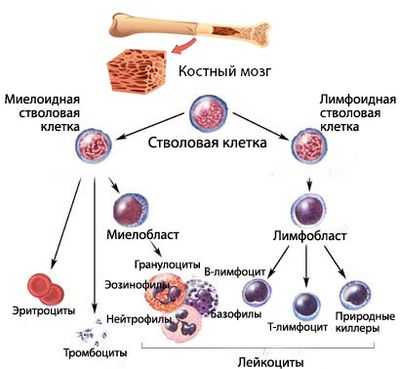
Сбой кроветворения в миелоидном направлении приводит к тому, что сам аномальный клон в некоторой степени теряет возможность продолжать линию (воспроизводить потомство, поэтому количество клеток того ростка, на котором возникла проблема, падает). Естественно, нарушается и созревание полноценных клеток. В результате этого, уменьшается численность одной или нескольких популяций форменных элементов, а также, ввиду ухудшения качества клеток, не в лучшую сторону меняются их функциональные возможности.
Вытекающие из подобных событий последствия - синдром, имеющий различные варианты клинических проявлений, то есть, представляющий собой группу гетерогенных патологических состояний, которая и названа миелодиспластическим синдромом.
Позиция МДС в Международной классификации болезней
Международная классификация болезней десятого пересмотра (МКБ-10), принятая Всемирной организацией здравоохранения (ВОЗ) в Швейцарии Женева, 1989), вступила в силу на территории Российской Федерации в 1997 году. Между тем, в отношении многих патологических состояний в 2010 году были внесены изменения. Нововведения коснулись и гематологической патологии, в том числе, миелодиспластического синдрома. По МКБ-10 в блок диагнозов D37-D48 МДС входит под своим кодом - D46, который имеет 7 или 9 вариантов определений заболеваний или диагнозов (в России, наряду с классификацией ВОЗ, могут использоваться и другие классификации, например, FAB, где вообще только 5 вариантов, поэтому в разных справочниках кодирование также может иметь отличия):

пример МДС с избытком бластов
Примечание: так часто встречающееся определение «рефрактерная» в данном случае объясняет безуспешность лечения железосодержащими и витаминными лекарственными средствами. Рефрактерная анемия устойчива к подобным мерам воздействия, не реагирует на них и нуждается в других терапевтических мероприятиях.
Общая характеристика синдрома
Аномалия генетического материала на уровне полипотентной кроветворной стволовой клетки, мутация ее, а также клеток предшественниц кроветворения, наличие генетически неполноценных клонов приводят к тому, что в клеточном звене системы иммунитета происходят существенные изменения, глубина которых, однако, зависит от того, по каким линиям (одной или нескольким?) пошли нарушения в кроветворении. В зависимости от этого можно ожидать в крови:
- Моноцитопению (уменьшение клеток одного вида);
- Бицитопению (нарушения идут в двух ростках);
- Панцитопению (сбой пошел в трех направлениях, поэтому резко снижено количество белых и красных клеток крови, а также тромбоцитов).
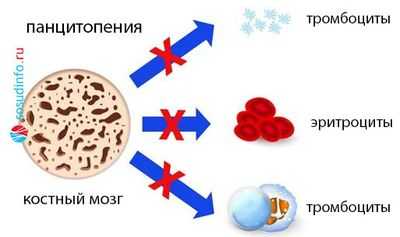
В КМ - аналогично: нормоклеточность, гиперклеточность либо гипоклеточность (миелограмма покажет, какой росток пострадал).
Клинические проявления описываемого синдрома также соответствуют причине, спрятанной на уровне кроветворения:
- Анемия;
- Геморрагический синдром (при снижении численности и нарушении функции тромбоцитов);
- Сочетание анемического и геморрагического синдромов;
- Инфекционный синдром (реже);
- Увеличение селезенки, лимфаденопатия, постоянное повышение температуры тела (эти симптомы присутствуют не так и часто, поэтому относятся к факультативным признакам).
Между тем, опираясь на данные многочисленный исследований МДС (изменение численности и морфологических характеристик клеток крови и костного мозга), гематологи пришли к выводу, что рано или поздно конечным итогом миелодиспластического синдрома станет острый или хронический миелоидный лейкоз (ОМЛ либо ХМЛ), а все эти анемии (рефрактерные) являются лишь промежуточным (временным) состоянием болезни. В связи с этим МДС нередко называют «предлейкозом», «предлейкемией», «тлеющим» или «дремлющим» лейкозом. Все зависит от количества миелобластов - клеток-родоначальниц гранулоцитарного ряда.
Если рефрактерная анемия протекает с избытком бластов (>20% по данным ВОЗ или >30% согласно классификации FAB), то гематологи склоняются к диагнозу - миелоидный лейкоз. В ситуациях, когда численность бластных клеток вплотную не подходит к этому порогу, диагноз пациента остается прежним - миелодиспластический синдром.
Патологическое состояние главного кроветворного органа может сформироваться у человека в любом возрастном периоде (от грудного - до глубокой старости). У детей болезнь чаще всего дебютирует между 3 и 5 годами, хотя, в целом, в детском возрасте риск заболеть совсем низкий. Среди взрослых самыми уязвимыми становятся пожилые люди (60 лет и старше). Например, такой распространенной и рискующей перейти в острый лейкоз форме, как РЦМД, наиболее подвержены люди в возрасте от 70 до 80 лет. Общая частота встречаемости миелодиспластического синдрома колеблется в пределах 3-5 случаев на 100 тысяч населения (не так и редко), причем, мужчины страдают данной патологией несколько чаще, нежели женщины.
Причина первичных форм заболевания остается невыясненной. Основными вероятными «виновниками» вторичного МДС считаются:
- Воздействие ионизирующего излучения;
- Влияние антропогенных неблагоприятных факторов окружающей среды (химических соединений, созданных человеком);
- Последствия химио- и радиотерапии (после лечения опухолевых процессов);
- Инфекционные агенты (бактерии, вирусы).
Следует отметить, что до сих пор МДС, передаваемого по наследству или возникающего в кругу близких родственников, отмечено не было, однако из наблюдений определена группа пациентов, имеющих повышенный риск формирования синдрома. Это дети и взрослые люди, страдающие болезнью Дауна, анемией Фанкони, синдромами Луи-Бар и Блума.
Лечатся все по-разному
Следует сразу настроить пациента, что лечение МДС не будет одинаковым для всех его разновидностей. Набор терапевтических мероприятий рассматривается в индивидуальном порядке, исходя из формы болезни и категории риска, которой принадлежит пациент (согласно клинической классификации Международной Прогностической Системы - IPSS для МДС: низкий, промежуточный 1 и 2, высокий). Словом, существуют определенные каноны, которых доктор придерживается, прежде чем приступить к непосредственному лечению. К примеру:
- Люди, не перешагнувшие 60-летний рубеж, имеющие минимальные признаки болезни, но отнесенные к категории промежуточного или высокого риска с ожидаемой выживаемостью 0,3 - 1,8 года, подвергаются высокоинтенсивной терапии;
- Пациенты, принадлежащие к группе промежуточного и низкого риска с ожидаемой выживаемостью 5-12 лет, проходят лечение низкой интенсивности;
- Молодые люди и больные среднего возраста (до 60 лет) с относительно неплохими показателями (ожидаемая выживаемость от полугода до 5 лет) первоначально лечатся по схемам низкой интенсивности, хотя в любой момент им грозит оказаться в группе, получающей более жесткое лечение (высокие дозы химиотерапии, пересадка КМ).
Таким образом, схемы лечения миелодиспластического синдрома довольно сложны и знает их только врач, получивший в свое время определенную специализацию (гематолог). Он в своей лечебной тактике опирается на рекомендации, разработанные Британским комитетом по стандартизации в гематологии (редакция 2009 года). Читателю же, на наш взгляд, достаточно познакомиться с основными методами проведения терапевтических мероприятий, особо не вникая в тонкости, не ставя диагноз и не причисляя себя или своих близких к той или иной группе риска. И еще, наверное, не помешает знать, что:
- Лечение высокой интенсивности - это, во-первых, обязательное пребывание в специализированном стационаре, во-вторых, назначение высоких доз химиотерапии и, возможно, подготовка к пересадке стволовых клеток и сама пересадка;
- Низкоинтенсивная терапия подразумевает пребывание в больнице (или даже в условиях дневного стационара) время от времени для получения заместительной терапии, низких доз химиопрепаратов, симптоматического лечения.
К сожалению, способа избавиться от такого тяжелого недуга, как МДС, раз и навсегда, пока не придумали. Разве что пересадка главного кроветворного органа (костного мозга) могла бы решить проблему, однако она тоже сопряжена с определенными трудностями (иммунологическое типирование, поиск совместимого донора, высокая стоимость операции, если искать донора по всему миру). Правда, в последние годы, как на территории Российской Федерации и ближайшей соседки - Беларуси, так и на территории других государств бывшего СССР, создаются новые лаборатории тканевого типирования, объединяющие свои реестры в единый банк, чтобы иметь возможность помочь друг другу. На них и возлагаются будущие надежды.
Лечение

Если врач считает, что патологический процесс идет как бы доброкачественно (если можно так выразиться), с небольшим количеством бластов, то больные группы низкого риска, периодически получающие заместительное и поддерживающее лечение (эритроцитарную массу, тромбовзвесь), могут довольно продолжительное время работать и вести почти привычный образ жизни. В основном, лечение таких больных выглядит следующим образом:
- Больной направляется в стационар, чтобы не допустить значительного снижения гемоглобина и развития тяжелого анемического синдрома, поэтому борьбу с ним (анемическим синдромом) считают первостепенной задачей (переливание эритроцитарной массы, заготовленной от доноров);
- Не упускается из виду и такое проявление МДС, как геморрагический синдром, возникающий на почве снижения числа и функциональной неполноценности тромбоцитов. В принципе, симптоматическая терапия, которая позволяет удерживать количество форменных элементов на нужном уровне (гемотрансфузии - эрмасса, тромбовзвесь и т. д.), в общем-то, всегда присутствует в схеме лечения больных, имеющих относительно благоприятную форму болезни;
- Получая от случая к случаю донорские эритроциты, организм больного начинает перегружаться железом, что ликвидируется применением медикаментозных средств, образующих комплексы с этим химическим элементом (эксиджад, десферол);
- Иной раз больные нуждаются в назначении низких доз «химии» (цитарабин, децитабин), а также иммунодепрессивных средства для предотвращения иммунной агрессии против костного мозга (леналидомид), с добавлением к ним ATG (антимоноцитарный глобулин) и циклоспорина;
- Присоединение инфекционного агента требует лечения антибиотиками и противогрибковыми препаратами.
Гораздо сложнее лечить формы миелодиспластического синдрома с избытком бластов, входящие в категорию высокого риска, когда химиотерапевтические препараты почти не приносят желаемого результата и не «отправляют» больного в долгосрочную ремиссию. Однако это не значит, что от них отказываются вовсе, ведь новые, недавно разработанные лекарства, дают некоторую надежду в отношении МДС и даже применяются для лечения ОМЛ (острого миелобластного лейкоза). Однако при таких обстоятельствах существуют рекомендации разработчиков - применять подобные средства для лечения больных, не достигших 60-летнего возраста и имеющих неплохой иммунологический статус, в противном случае - есть риск развития серьезных осложнений, способных преждевременно прервать жизнь.
Пересадка стволовых клеток (возможна тоже только до 60 лет) на сегодняшний день - единственный способ избавить человека от страданий на долгие-долгие годы. К сожалению, трансплантация КМ - операция хоть и несложная в техническом плане, но трудновыполнимая в плане подбора по лейкоцитарной системе HLA совместимого с реципиентом (больным) донора (идентичными, то есть, имеющими абсолютно одинаковый набор генов являются только однояйцевые близнецы - это идеальные доноры друг другу).
Частные симптомы и диагностика
Клинические проявления и степень их выраженности по причине многообразия форм МДС позволяют себе широкие вариации. Случайной находкой синдром выступает редко (это бывает, если человек неплохо себя чувствует, а анализы назначаются в силу других обстоятельств). В основном же, больные направляются в поликлинику с определенными жалобами (постоянное ощущение усталости, одышка, физическая слабость, головокружения, частые подъемы температуры тела), где после тестирования крови становятся очевидными и другие признаки миелодиспластического синдрома:
- Цитопения (снижение количества полноценных форменных элементов крови);
- Анемия (низкий гемоглобин, мало эритроцитов), которая и определяет симптомы, заставившие пойти к врачу;
- Нейтропения (недостаточное содержание в крови нейтрофильных лейкоцитов, обладающих способностью поглощать бактериальные клетки в очаге воспаления - она становится причиной частых инфекций и лихорадки);
- Тромбоцитопения (уменьшение численности тромбоцитов, что обуславливает появление геморрагического синдрома - кровотечений, мелкоточечных подкожных кровоизлияний, синяков).
Между тем, отдельные пациенты относительно долго могут жить и не подозревать, что здоровье «пошатнулось». И тогда МДС становится случайной находкой уже на стадии проведения общего анализа крови.
Чаще всего поводом все же обратиться в поликлинику служат жалобы больного, которые в наибольшей степени связаны с анемией. Пробовать повысить уровень красного пигмента крови (Hb) и содержание красных кровяных телец (Er) препаратами железа и витаминами бесполезно, лечение успехов не приносит, ведь анемия при МДС - рефрактерная. При подозрении на МДС, которое возникает в ходе проведения общего анализа крови (ОАК), добавляются другие исследования:

- Подсчет молодых форм красного ростка, которым уже «позволено» присутствовать в циркулирующей крови - ретикулоцитов, они «подскажут», насколько быстро идет процесс воспроизводства новых зрелых кровяных телец;
- Цитологическое исследование аспирата КМ (у пожилых пациентов данный тест не принадлежит к обязательным анализам);
трепанбиопсия костного мозга
Трепанобиопсия (процедура обязательна для всех больных) - после изучения морфологических особенностей гистологический анализ развеет сомнения или подтвердит подозрения;
Безусловно, диагностика миелодиспластического синдрома, начинается с жалоб больного и ОАК, но в дальнейшем опирается на более сложные лабораторные исследования. Здесь врачу есть над чем подумать, чтобы правильно оценить нарушения кроветворения, ведь изменения клеточного состава и морфологических особенностей клеток крови и костного мозга могут быть весьма многочисленны и многообразны. Впрочем, как и сама болезнь…

костный мозг при МДС
Прогноз и рекомендации
Прогноз в отношении продолжительности жизни при миелодиспластическом синдроме не очень оптимистичный, хотя многое зависит от разновидности болезни, степени риска и возрастной категории больного. В целом, пациенты, строго выполняющие рекомендации лечащего врача и получающие периодически поддерживающее лечение, могут рассчитывать прожить пять, а то и десять лет. Однако активное течение злокачественной формы болезни оставляет мало шансов - если не был найден донор и не пересажена стволовая клетка, жизнь может прерваться на 1-2 году от начала патологического процесса. Причиной смерти в большинстве случаев становится острый миелоидный лейкоз, который развился на почве вторичного МДС.
В заключение хочется дать совет людям, столкнувшимся с подобной проблемой и желающим продлить свою жизнь или жизнь близким: никогда не слушать рекомендации того, кто почерпнул сведения о болезнях из сомнительных источников (подобная информация вовсю «гуляет» на просторах Интернета) и возомнил себя доктором. Ни народными средствами, ни специальными физическими упражнениями миелодиспластический синдром не лечится. Нужно следовать рекомендациям врача и тогда, возможно, лечение будет успешным.
Миелодиспластический синдром
Миелодиспластический синдром - группа гематологических заболеваний, при которых наблюдаются цитопения, диспластические изменения костного мозга и высокий риск возникновения острого лейкоза. Характерные симптомы отсутствуют, выявляются признаки анемии, нейтропении и тромбоцитопении. Диагноз устанавливается с учетом данных лабораторных анализов: полного анализа периферической крови, гистологического и цитологического исследования биоптата и аспирата костного мозга и т. д. Дифференциальный диагноз может представлять значительные затруднения. Лечение - переливание компонентов крови, химиотерапия, иммуносупрессивная терапия, пересадка костного мозга.

Общие сведения
Миелодиспластический синдром - группа заболеваний и состояний с нарушениями миелоидного кроветворения и высоким риском развития острого лейкоза. Вероятность развития увеличивается с возрастом, в 80% случаев данный синдром диагностируется у людей старше 60 лет. Мужчины страдают несколько чаще женщин. У детей миелодиспластический синдром практически не встречается. В последние десятилетия гематологи отмечают увеличение заболеваемости среди лиц трудоспособного возраста. Предполагается, что причиной «омоложения» болезни могло стать существенное ухудшение экологической обстановки.
До недавнего времени лечение миелодиспластического синдрома было только симптоматическим. Сегодня специалисты разрабатывают новые методы терапии, однако эффективное лечение этой группы болезней все еще остается одной из самых сложных проблем современной гематологии. Пока прогноз при миелодиспластическом синдроме, в основном, зависит от особенностей течения болезни, наличия или отсутствия осложнений. Лечение осуществляют специалисты в сфере онкологии и гематологии.

Причины и классификация миелодиспластического синдрома
С учетом причин развития различают два типа миелодиспластического синдрома: первичный (идиопатический) и вторичный. Идиопатический вариант выявляется в 80-90% случаев, диагностируется преимущественно у пациентов старше 60 лет. Причины возникновения установить не удается. В числе факторов риска первичного миелодиспластического синдрома - курение, повышенный уровень радиации при выполнении профессиональных обязанностей или проживании в неблагоприятной экологической зоне, частый контакт с бензином, пестицидами и органическими растворителям, некоторые наследственные и врожденные заболевания (нейрофиброматоз, анемия Фанкони, синдром Дауна).
Вторичный вариант миелодиспластического синдрома наблюдается в 10-20% случаев, может возникать в любом возрасте. Причиной развития становится химиотерапия или радиотерапия по поводу какого-то онкологического заболевания. В число лекарственных средств с доказанной способностью вызывать миелодиспластический синдром включают циклофосфан, подофиллотоксины, антрациклины (доксорубицин) и ингибиторы топоизомеразы (иринотекан, топотекан). Вторичный вариант отличается более высокой резистентностью к лечению, более высоким риском развития острого лейкоза и более неблагоприятным прогнозом.
В современной редакции классификации ВОЗ различают следующие типы миелодиспластического синдрома:
- Рефрактерная анемия. Сохраняется более полугода. В анализе крови бласты отсутствуют либо единичные. В костном мозге дисплазия эритроидного ростка.
- Рефрактерная анемия с кольцевыми сидеробластами. Сохраняется более полугода. В анализе крови бласты отсутствуют. В костном мозге дисплазия эритроидного ростка.
- Рефрактерная цитопения с многолинейной дисплазией. В анализе крови тельца Ауэра отсутствуют, бласты отсутствуют либо единичные, выявляются панцитопения и увеличение количества моноцитов. В костном мозге диспластические изменения менее 10% клеток в 1 миелоидной клеточной линии, бластов менее 5%, телец Ауэра нет.
- Рефрактерная анемия с избытком бластов-1. В анализе крови тельца Ауэра отсутствуют, бластов более 5%, цитопения и увеличение количества моноцитов. В костном мозге дисплазия одной либо нескольких клеточных линий, бластов 5-9%, телец Ауэра нет.
- Рефрактерная анемия с избытком бластов-2. В анализе крови увеличение количества моноцитов, цитопения, бластов 5-19%, могут выявляться тельца Ауэра. В костном мозге дисплазия одной либо нескольких клеточных линий, бластов 10-19%, обнаруживаются тельца Ауэра.
- Неклассифицируемый миелодиспластический синдром. В анализе крови цитопения, бласты отсутствуют либо единичные, тельца Ауэра отсутствуют. В костном мозге дисплазия одного мегакариоцитарного либо гранулоцитарного ростка, бластов более 5%, тельца Ауэра отсутствуют.
- Миелодиспластический синдром, ассоциированный с изолированной делецией 5q. В анализе крови анемия, бластов более 5%, возможен тромбоцитоз. В костном мозге более 5% бластов, тельца Ауэра отсутствуют, изолированная делеция 5q.
Симптомы миелодиспластического синдрома
Клиническая симптоматика определяется степенью нарушений миелопоэза. При мягко протекающих расстройствах возможно длительное бессимптомное или стертое течение. Из-за слабой выраженности клинических проявлений некоторые больные не обращаются к врачам, и миелодиспластический синдром обнаруживается во время проведения очередного медицинского осмотра. При преобладании анемии наблюдаются слабость, одышка, плохая переносимость физических нагрузок, бледность кожных покровов, головокружения и обморочные состояния.
При миелодиспластическом синдроме с тромбоцитопенией возникает повышенная кровоточивость, отмечаются десневые и носовые кровотечения, на коже появляются петехии. Возможны подкожные кровоизлияния и меноррагии. Миелодиспластический синдром с выраженными нейтропенией и агранулоцитозом проявляется частыми простудами, стоматитом, синуситом или стрептодермией. В тяжелых случаях возможно развитие пневмонии или сепсиса. Инфекционные заболевания нередко вызываются грибками, вирусами или условно-патогенными микробами. У каждого пятого пациента с миелодиспластическим синдромом выявляется увеличение лимфоузлов, селезенки и печени.
Диагностика миелодиспластического синдрома
Диагноз выставляется с учетом данных лабораторных исследований: анализа периферической крови, биопсии костного мозга с последующим цитологическим исследованием, цитохимических и цитогенетических тестов. В анализе периферической крови больных миелодиспластическим синдромом обычно обнаруживается панцитопения, реже выявляется дву- или одноростковая цитопения. У 90% пациентов наблюдается нормоцитарная либо макроцитарная анемия, у 60% - нейтропения и лейкопения. У большинства больных миелодиспластическим синдромом отмечается тромбоцитопения.
При исследовании костного мозга количество клеток обычно нормальное либо повышенное. Уже на ранних стадиях обнаруживаются признаки дизэритропоэза. Количество бластов зависит от формы миелодиспластического синдрома, может быть нормальным либо увеличенным. В последующем наблюдаются дисгранулоцитопоэз и дисмегакариоцитопоэз. У некоторых больных признаки дисплазии костного мозга выражены очень слабо. В процессе цитогенетического исследования у ¾ больных выявляются хромосомные нарушения. Дифференциальный диагноз миелодиспластического синдрома проводят с В12-дефицитной анемией, фолиево-дефицитной анемией, апластической анемией, острым миелолейкозом и другими острыми лейкозами.
Лечение и прогноз при миелодиспластическом синдроме
Тактика лечения определяется выраженностью клинической симптоматики и лабораторных изменений. При отсутствии явных признаков анемии, геморрагического синдрома и инфекционных осложнений осуществляется наблюдение. При миелодиспластическом синдроме с выраженной анемией, тромбоцитопенией и нейтропенией, а также при высоком риске возникновения острого лейкоза назначают сопроводительную терапию, химиотерапию и иммуносупрессивную терапию. При необходимости осуществляют пересадку костного мозга.
Сопроводительная терапия является самым распространенным методом лечения миелодиспластического синдрома. Предусматривает внутривенные инфузии компонентов крови. При длительном применении может провоцировать повышение уровня железа, влекущее за собой нарушения деятельности жизненно важных органов, поэтому переливания гемокомпонентов производят при одновременном приеме хелаторов (лекарственных средств, связывающих железо и способствующих его выведению).
Иммуносупрессоры эффективны при лечении миелодиспластического синдрома с отсутствием хромосомных аномалий, наличием гена HLA-DR15 и гипоклеточном костном мозге. Химиотерапию применяют при невозможности трансплантации костного мозга. Высокие дозы препаратов используют при трансформации миелодиспластического синдрома в острый лейкоз, а также при рефрактерных анемиях с избытком бластов при нормоклеточном и гиперклеточном костном мозге, низкие - при невозможности пересадки костного мозга. Наряду с перечисленными средствами пациентам назначают гипометилирующие средства (азацитидин). Наиболее надежным способом достижения полноценной длительной ремиссии является трансплантация костного мозга.
Прогноз зависит от типа миелодиспластического синдрома, количества хромосомных аномалий, необходимости в регулярных переливаниях компонентов крови, выраженности клинических проявлений и наличия осложнений. Различают 5 групп риска. Средняя выживаемость больных миелодиспластическим синдромом, входящих в группу с самым низким уровнем риска, составляет более 11 лет; с самым высоким - около 8 месяцев. Вероятность отторжения костного мозга после трансплантации - около 10%.
Хронический миелолейкоз
Хронический миелолейкоз - это злокачественное миелопролиферативное заболевание, характеризующееся преимущественным поражением гранулоцитарного ростка. Может долгое время протекать бессимптомно. Проявляется склонностью к субфебрилитету, ощущением полноты в животе, частыми инфекциями и увеличением селезенки. Наблюдаются анемия и изменение уровня тромбоцитов, сопровождающиеся слабостью, бледностью и повышенной кровоточивостью. На заключительной стадии развиваются лихорадка, лимфоаденопатия и кожная сыпь. Диагноз устанавливается с учетом анамнеза, клинической картины и данных лабораторных исследований. Лечение - химиотерапия, радиотерапия, пересадка костного мозга.
МКБ-10

Хронический миелолейкоз - онкологическое заболевание, возникающее в результате хромосомной мутации с поражением полипотентных стволовых клеток и последующей неконтролируемой пролиферацией зрелых гранулоцитов. Составляет 15% от общего количества гемобластозов у взрослых и 9% от общего числа лейкозов во всех возрастных группах. Обычно развивается после 30 лет, пик заболеваемости хроническим миелолейкозом приходится на возраст 45-55 лет. Дети до 10 лет страдают исключительно редко.
Хронический миелолейкоз одинаково распространен у женщин и у мужчин. Из-за бессимптомного или малосимптомного течения может становиться случайной находкой при исследовании анализа крови, взятого в связи с другим заболеванием или во время профилактического осмотра. У части больных хронический миелолейкоз выявляется на заключительных стадиях, что ограничивает возможности терапии и ухудшает показатели выживаемости. Лечение проводят специалисты в области онкологии и гематологии.
Причины
Хронический миелолейкоз считается первым заболеванием, при котором достоверно установлена связь между развитием патологии и определенным генетическим нарушением. В 95% случаев подтвержденной причиной хронического миелолейкоза является хромосомная транслокация, известная как «филадельфийская хромосома». Суть транслокации заключается во взаимной замене участков 9 и 22 хромосом. В результате такой замены формируется устойчивая открытая рамка считывания. Образование рамки вызывает ускорение деления клеток и подавляет механизм восстановления ДНК, что увеличивает вероятность возникновения других генетических аномалий.
В числе возможных факторов, способствующих появлению филадельфийской хромосомы у больных хроническим миелолейкозом, называют ионизирующее облучение и контакт с некоторыми химическими соединениями.
Патогенез
Итогом мутации становится усиленная пролиферация полипотентных стволовых клеток. При хроническом миелолейкозе пролиферируют преимущественно зрелые гранулоциты, но аномальный клон включает в себя и другие клетки крови: эритроциты, моноциты, мегакариоциты, реже - В- и Т-лифоциты. Обычные гемопоэтические клетки при этом не исчезают и после подавления аномального клона могут служить основой для нормальной пролиферации кровяных клеток. Для хронического миелолейкоза характерно стадийное течение.
- При первой, хронической (неактивной) фазе отмечается постепенное усугубление патологических изменений при сохранении удовлетворительного общего состояния.
- Во второй фазе хронического миелолейкоза - фазе акселерации изменения становятся явными, развиваются прогрессирующие анемия и тромбоцитопения.
- Заключительной стадией хронического миелолейкоза является бластный криз, сопровождающийся быстрой экстрамедуллярной пролиферацией бластных клеток.
Источником бластов становятся лимфатические узлы, кости, кожа, ЦНС и т. д. В фазе бластного криза состояние больного хроническим миелолейкозом резко ухудшается, развиваются тяжелые осложнения, завершающиеся гибелью больного. У некоторых пациентов фаза акселерации отсутствует, хроническая фаза сразу сменяется бластным кризом.
Симптомы хронического миелолейкоза
Клиническая картина определяется стадией заболевания. Хроническая фаза в среднем продолжается 2-3 года, в некоторых случаях - до 10 лет. Для этой фазы хронического миелолейкоза характерно бессимптомное течение или постепенное появление «легких» симптомов: слабости, некоторого недомогания, снижения трудоспособности и чувства переполнения живота. При объективном осмотре больного хроническим миелолейкозом может обнаруживаться увеличение селезенки. По анализам крови выявляется повышение количества гранулоцитов до 50-200 тыс./мкл при бессимптомном течении заболевания и до 200-1000 тыс./мкл при «легких» признаках.
На начальных стадиях хронического миелолейкоза возможно некоторое снижение уровня гемоглобина. В последующем развивается нормохромная нормоцитарная анемия. При исследовании мазка крови пациентов с хроническим миелолейкозом отмечается преобладание молодых форм гранулоцитов: миелоцитов, промиелоцитов, миелобластов. Наблюдаются отклонения от нормального уровня зернистости в ту или иную сторону (обильная или очень скудная). Цитоплазма клеток незрелая, базофильная. Определяется анизоцитоз. При отсутствии лечения хроническая фаза переходит в фазу акселерации.
О начале фазы акселерации может свидетельствовать как изменение лабораторных показателей, так и ухудшение состояния пациентов. Возможно нарастание слабости, увеличение печени и прогрессирующее увеличение селезенки. У больных хроническим миелолейкозом выявляются клинические признаки анемии и тромбоцитопении или тробоцитоза: бледность, быстрая утомляемость, головокружения, петехии, кровоизлияния, повышенная кровоточивость. Несмотря на проводимое лечение, в крови пациентов с хроническим миелолейкозом постепенно увеличивается количество лейкоцитов. При этом отмечается возрастание уровня метамиелоцитов и миелоцитов, возможно появление единичных бластных клеток.
Бластный криз сопровождается резким ухудшением состояния больного хроническим миелолейкозом. Возникают новые хромосомные аномалии, моноклоновое новообразование трансформируется в поликлоновое. Отмечается нарастание клеточного атипизма при угнетении нормальных ростков кроветворения. Наблюдаются ярко выраженные анемия и тромбоцитопения. Суммарное количество бластов и промиелоцитов в периферической крови составляет более 30%, в костном мозге - более 50%. Пациенты с хроническим миелолейкозом теряют вес и аппетит. Возникают экстрамедуллярные очаги незрелых клеток (хлоромы). Развиваются кровотечения и тяжелые инфекционные осложнения.
Диагностика
Диагноз устанавливается на основании клинической картины и результатов лабораторных исследований. Первое подозрение на хронический миелолейкоз часто возникает при повышении уровня гранулоцитов в общем анализе крови, назначенном в порядке профилактического осмотра или обследования в связи с другим заболеванием. Для уточнения диагноза могут использоваться данные гистологического исследования материала, полученного при стернальной пункции костного мозга, однако окончательный диагноз «хронический миелолейкоз» выставляется при выявлении филадельфийской хромосомы при помощи ПЦР, флюоресцентной гибридизации или цитогенетического исследования.
Вопрос о возможности постановки диагноза хронический миелолейкоз при отсутствии филадельфийской хромосомы остается дискутабельным. Многие исследователи считают, что подобные случаи могут объясняться комплексными хромосомными нарушениями, из-за которых выявление данной транслокации становится затруднительным. В ряде случаев филадельфийскую хромосому можно обнаружить при использовании ПЦР с обратной транскрипцией. При отрицательных результатах исследования и нетипичном течении заболевания обычно говорят не о хроническом миелолейкозе, а о недифференцированном миелопролиферативном/миелодиспластическом расстройстве.
Лечение хронического миелолейкоза
Тактику лечения определяют в зависимости от фазы заболевания и выраженности клинических проявлений. В хронической фазе при бессимптомном течении и слабо выраженных лабораторных изменениях ограничиваются общеукрепляющими мероприятиями. Больным хроническим миелолейкозом рекомендуют соблюдать режим труда и отдыха, принимать пищу, богатую витаминами и т. д. Лечение может включать:
- Монохимиотерапию. При повышении уровня лейкоцитов используют бусульфан. После нормализации лабораторных показателей и уменьшения селезенки пациентам с хроническим миелолейкозом назначают поддерживающую терапию или курсовое лечение бусульфаном. При бластных кризах осуществляют лечение гидроксикарбамидом.
- Радиотерапию. Облучение обычно используют при лейкоцитозе в сочетании со спленомегалией. При снижении уровня лейкоцитов делают паузу продолжительностью не менее месяца, а затем переходят на поддерживающую терапию бусульфаном. Радиотерапию также назначают при хлоромах.
- Полихимиотерапию. В прогрессирующей фазе хронического миелолейкоза возможно использование одного химиопрепарата или полихимиотерапии. Применяют митобронитол, гексафосфамид или хлорэтиламиноурацил. Как и в хронической фазе, проводят интенсивную терапию до стабилизации лабораторных показателей, в последующем переходят на поддерживающие дозы. Курсы полиохимиотерапии при хроническом миелолейкозе повторяют 3-4 раза в год.
- Гемокоррекцию. При неэффективности терапии используют лейкоцитаферез. При выраженной тромбоцитопении, анемии выполняют переливания тромбоконцентрата и эритроцитарной массы.
- ТКМ.Пересадку костного мозга проводят в первой фазе хронического миелолейкоза. Продолжительной ремиссии удается достичь у 70% пациентов.
- Удаление селезенки. При наличии показаний осуществляют спленэктомию. Экстренная спленэктомия показана при разрыве или угрозе разрыва селезенки, плановая - при гемолитических кризах, «блуждающей» селезенке, рецидивирующих периспленитах и резко выраженной спленомегалии, сопровождающейся нарушением функций органов брюшной полости.
Прогноз
Прогноз при хроническом миелолейкозе зависит от множества факторов, определяющим из которых является момент начала лечения (в хронической фазе, фазе активации или в период бластного криза). В качестве неблагоприятных прогностических признаков хронического миелолейкоза рассматривают значительное увеличение печени и селезенки (печень выступает из-под края реберной дуги на 6 и более см, селезенка - на 15 и более см), лейкоцитоз свыше 100x10 9 /л, тромбоцитопению менее 150x10 9 /л, тромбоцитоз более 500х10 9 /л, повышение уровня бластных клеток в периферической крови до 1% и более, повышение суммарного уровня промиелоцитов и бластных клеток в периферической крови до 30% и более.
Вероятность неблагоприятного исхода при хроническом миелолейкозе возрастает по мере увеличения количества признаков. Причиной гибели становятся инфекционные осложнения или тяжелые геморрагии. Средняя продолжительность жизни пациентов с хроническим миелолейкозом составляет 2,5 года, однако при своевременном начале терапии и благоприятном течении заболевания этот показатель может увеличиваться до нескольких десятков лет.
Миелома: признаки, симптомы, лечение и прогнозы

Миелома или миеломная болезнь - это избыток в организме неправильных, измененных плазмоцитов - клеток, которые производят антитела - белки, защищающие организм от бактерий и вирусов. Они вытесняют нормальные клетки крови, накапливаются в костном мозге Костный мозг - это мягкая внутренняя часть некоторых костей, в которой вырастают все клетки крови. и формируют опухоль, повреждающую кости и почки, а также нарушающую работу иммунной системы.
Как развивается миелома?
Заболевание начинается с появления в организме измененных клеток иммунной системы. В норме в ней присутствует несколько их типов, в том числе:
- Т-лимфоциты, одна часть которых уничтожает микробы и неправильные клетки, а вторая помогает повысить или замедлить активность работы иммунитета.
- В-лимфоциты, которые реагируют на инфекцию и превращаются в плазматические клетки, вырабатывающие антитела, или иммуноглобулины - белки, защищающие организм от бактерий и вирусов. Большая их часть находится в костном мозге - мягких внутренних тканях костей, в котором образуются все виды клеток крови:
- Эритроциты, переносящие кислород от легких к другим тканям.
- Лейкоциты, которые борются с инфекциями.
- Тромбоциты, образующие сгустки и прекращающие кровотечение.
В результате влияния различных факторов, в том числе ожирения, наследственных особенностей, генетических заболеваний или случайных сбоев плазматические клетки мутируют - изменяются. После чего начинают бесконтрольно расти, размножаться и нарушать нормальное кроветворение - создание эритроцитов, лейкоцитов и тромбоцитов. Кроме того, они вырабатывают антитела - особый белок М-протеин, или парапротеин, который не способен участвовать в работе иммунной системы и защищать организм. Со временем их становится больше, они превращаются в опухоль - плазмоцитому, или во множественную миелому - несколько подобных новообразований в различных частях тела.
Неправильные клетки скапливаются в органах, включая почки и печень, из-за чего снижается выделение разжижающих кровь соединений, а обмен веществ в тканях нарушается. Разрушают они и кости, из которых выходит кальций, что приводит к тяжелым последствиям - от переломов и болей до развития комы - бессознательного состояния.
Причина развития миеломы
Врачи и ученые не знают точных причин ее возникновения - им известны только факторы, повышающие вероятность этого события:
- Чем старше человек, тем выше его риски - в большинстве случаев заболевание выявляется у людей не моложе 65 лет. Она может развиться и у молодых, но это происходит довольно редко - менее чем в 1% всех случаев оно обнаруживается до 35 лет. Средний возраст пациентов составляет 66-70 лет.
- Генетика. Наличие кровных родственников с миеломой - родителей, детей, братьев или сестер увеличивает шансы возникновения подобных опухолей у членов их семьи.
- К подобным факторам относят и пол - шансы возникновения данного типа онкологии у мужчин немного выше, чем у женщин. На сегодняшний день причины такой разницы врачам не известны.
- Ожирение. Люди с лишним весом подвергаются повышенному риску развития некоторых типов опасных опухолей, включая миелому, рак поджелудочной и предстательной желез, почек, желчного пузыря, кишечника, эндометрия, пищевода, яичников, шейки матки и молочной железы. Чем выше у человека индекс массы тела Индекс массы тела равен весу в килограммах, разделенному на квадрат роста в метрах. ИМТ = кг/м 2 . , тем с большей вероятностью у него разовьется опасное новообразование. Ожирение приводит к усилению воспалительных процессов в организме, вынуждает кровеносные сосуды расти, а также изменяет уровень различных гормонов, которые могут способствовать размножению измененных клеток.
- Раса: у чернокожих людей миелома встречается в 2 раза чаще, чем у представителей других рас.
- В довольно редких случаях вероятность развития онкологии повышается из-за воздействия рентгеновских лучей или других видов излучения.
Наличие других заболеваний плазматических клеток также повышает риски. К ним относятся:
- Моноклональная гаммапатия неясного генеза - присутствие в костном мозге неправильных плазматических клеток, производящих ненормальный белок. Он нарушает работу различных тканей и систем, например, почек. Часто никаких симптомов у обладателей такого состояния нет, но в некоторых случаях оно способно превращаться в миелому.
- Солитарная плазмоцитома - состоящая из измененных плазмоцитов опухоль, расположенная либо в кости, либо в других органах - например, в пищеварительной системе или дыхательных путях. Примерно 65-84% ее случаев перерождаются в онкологию в течение 10 лет.
Симптомы и признаки миеломы
Как правило, на ранних этапах заболевание выявляют редко, поскольку оно обычно не беспокоит своего обладателя до того момента, пока поражения не станут довольно серьезными. Симптомы миеломы могут выглядеть следующим образом:
Проблемы с костями:
- Боль в любой области тела, но чаще всего - в спине, бедрах и черепе.
- Остеопороз - снижение плотности костной ткани и нарушение ее строения из-за вымывания из нее кальция - во всем организме или только в том месте, где располагается опухоль.
- Переломы, возникающие при незначительных травмах или небольшой нагрузке.
Низкие показатели крови:
- Анемия: пониженное количество переносящих кислород клеток, что приводит к слабости, неспособности переносить нормальную и привычную нагрузку, головокружениям и одышке - ощущению нехватки воздуха.
- Тромбоцитопения: недостаток образующих сгустки крови тромбоцитов может вызвать развитие серьезных кровотечений даже при незначительных ссадинах, порезах или синяках.
- Лейкопения: нехватка защищающих нас лейкоцитов снижает устойчивость к различным инфекциям.
Гиперкальциемия - высокий уровень кальция в крови из-за его выхода из костей:
- Сильная жажда.
- Учащенное мочеиспускание.
- Обезвоживание.
- Проблемы с почками, вплоть до недостаточности - отказа органов.
- Сильные запоры.
- Боли в животе.
- Потеря аппетита.
- Слабость.
- Сонливость.
- Спутанность сознания.
- Если уровень кальция критически повышается, человек может даже впасть в кому - бессознательное состояние.
Повреждение нервной системы. Ослабленные кости позвоночника могут стать хрупкими, разрушиться и давить на нервы, вызывая:
- внезапную сильную боль в спине;
- онемение, чаще в ногах;
- слабость мышц, обычно в нижних конечностях.
Некоторые белки, вырабатываемые клетками миеломы, токсичны - ядовиты для нервов. Их поражение также способно привести к слабости, онемению и ощущению покалывания.
У некоторых пациентов избыток этих веществ приводит к «загустению» крови - повышению ее вязкости. Такое состояние замедляет приток этой жизненно важной жидкости к мозгу и может вызвать головокружения, нарушения сознания и развитие симптомов инсульта Инсульт - это острое нарушение кровообращения в головном мозге - слабость мышц на одной стороне тела и невнятная речь.
Кроме того, измененные белки повреждают почки. На ранних этапах заболевания никаких симптомов это не вызывает, но признаки их поражения можно увидеть по анализам крови или мочи. Когда эти органы начинают отказывать, они перестают выводить лишние соль и жидкость, а также продукты жизнедеятельности тела, что приводит к слабости, зуду, затрудненному дыханию и отечности ног.
Больные миеломой нередко страдают от различных инфекций, чаще всего от пневмонии - воспаления легких, обычно плохо реагируют на лечение и долго восстанавливаются.

Диагностика миеломы
Обследование - очень важный процесс для любого пациента, поскольку в его ходе врачи не просто выявляют заболевание. Они выясняют, насколько серьезно успел пострадать организм и представляют примерные прогнозы пациента, что позволяет им подбирать самую подходящую в каждом конкретном случае терапию.
Полную диагностику миеломы можно пройти в онкологическом центре «Лапино-2».
У нас есть самое современное оборудование, собственная лаборатория и все необходимые специалисты - кандидаты и доктора медицинских наук с огромным опытом работы.
В нашем центре нет очередей, все процедуры проводятся вовремя, а выполненные у нас исследования не приходится переделывать - их результатам доверяют все лечебные учреждения.
Обследование начинается с анализов крови и мочи и измерения в них количества:
- Эритроцитов, лейкоцитов и тромбоцитов, уровень которых может падать при скоплении слишком большого количества измененных клеток. Чаще всего у пациентов обнаруживается анемия - нехватка эритроцитов.
- Креатинина - вещества, образующегося в ходе белкового обмена. При повреждении почек в организме его становится больше, а перспективы выздоровления ухудшаются.
- Альбумина - белка, поддерживающего давление, доставляющего в ткани различные химические соединения и участвующего в обмене веществ. Его количество у пациентов с миеломой нередко понижается.
- Кальция, количество которого растет при разрушении костей.
- Антител, или иммуноглобулинов - белков, защищающих организм от бактерий и вирусов: IgA, IgD, IgE, IgG и IgM. Уровень одних типов таких веществ может быть очень высоким, а других - крайне низким.
- Анализ на определение типа измененных антител - М-протеина или парапротеина.
- b2-микроглобулина - белка, присутствующего на поверхности практически всех клеток организма. Его содержание в крови при воспалительных процессах, миеломе, лимфоме и некоторых других заболеваниях повышается.
- Белка Бенс-Джонса, выделяемого опухолевыми клетками.
- Суточный анализ мочи, показывающий количество миеломного белка и качество работы почек.
Для выявления измененных плазматических клеток в костном мозге врачи проводят биопсию - забирают небольшое его количество с помощью иглы и передают образец на исследование в лабораторию.
Рентген - помогает обнаруживать разрушение костей. С той же целью проводится компьютерная томография, КТ - в ходе сканирования специальный аппарат создает четкое изображение и позволяет подробно изучать повреждения частей скелета.
Магнитно-резонансная томография, МРТ - подробно показывает состояние мягких тканей, головного, костного и спинного мозга. МРТ обнаруживает даже те плазмоцитомы Плазмоцитома - это опухоль, состоящая из измененных плазмоцитов - клеток, производящих антитела - белки, защищающие организм от бактерий и вирусов. , которые нельзя увидеть на обычном рентгеновском снимке.
Позитронно-эмиссионная томография, ПЭТ. Исследование проводится после приема пациентом небольшой дозы радиоактивного сахара, способного накапливаться в опасных клетках. Метод не дает четкой «картинки» внутренних органов, но позволяет обнаруживать любые очаги заболевания во всех областях тела.
Стадии миеломы
Сразу после выявления заболевания врачи определяют его стадию - выясняют, насколько серьезно успел пострадать организм. Данная информация необходима им для представления примерных прогнозов пациента и подбора самого подходящего для него лечения.
Стадирование миеломы проводится на основе 4 факторов:
- Количества в крови альбумина - белка, который поддерживает давление, доставляет в ткани различные химические соединения и участвует в обмене веществ.
- Количества в крови b2-микроглобулина - белка, присутствующего на поверхности практически всех клеток организма. Его содержание в крови при воспалительных процессах, миеломе, лимфоме и некоторых других заболеваниях повышается.
- Количества в крови ЛДГ, лактатдегидрогеназы - содержащегося почти во всех клетках тела белка, участвующего в выработке энергии из глюкозы.
- Цитогенетические аномалии в измененных клетках: неправильное количество или нарушение строения хромосом, каждая из которых представляет из себя одну молекулу ДНК, хранящую генетический материал. Такие изменения могут означать ухудшение прогноза. Например, потеря части 17-й хромосомы, а также обмен материалом между 4 и 14, либо между 14 и 16 считаются высокорисковыми, поскольку они значительно ухудшают перспективы пациента. Все остальные аномалии относят к стандартному риску.
Всего врачи выделяют 3 стадии миеломы:
I: Уровень альбумина 3,5 грамм/децилитр 1 децилитр = 100 кубических сантиметров, или 1/10 литра или выше, b2-микроглобулина менее 3,5 мг/л, ЛДГ в норме, цитогенетические изменения стандартного риска.
II: Ко второму этапу заболевания причисляют все состояния, показатели которых нельзя отнести к I или III стадии.
III: Уровень b2-микроглобулина составляет 5,5 мг/л или более, цитогенетические аномалии высокого риска, и/или высокий ЛДГ.

Лечение миеломы
Борьба с миеломой - сложная задача, требующая участия множества докторов различных специальностей: онколога, химиотерапевта, невролога, уролога и других. Чем больше информации о состоянии организма и течении заболевания они получают друг от друга, тем больше факторов им удается учесть.
В онкологическом центре «Лапино-2» проводится полная диагностика и любое лечение миеломы.
Каждый случай мы рассматриваем индивидуально - все наши пациенты получают терапию, назначенную по решению консилиума врачей, кандидатов и докторов медицинских наук с большим опытом работы. Такой подход позволяет нам подбирать наилучшие варианты воздействия на измененные клетки и наносить минимум вреда здоровым тканям.
Мы используем только самое современное оборудование и оригинальные препараты, дающие предсказуемый результат.
С нами вам не придется терять время - обследование и лечение у нас проводятся без очереди и задержек, точно в срок.
Для лечения миеломы врачи применяют несколько методов:
Медикаментозная терапия
Химиотерапия - разрушение или предотвращение роста измененных клеток с помощью специальных препаратов. К ним относят: Циклофосфамид, Этопозид, Доксорубицин, Мелфалан и Бендамустин. Они попадают в кровоток и достигают почти всех участков дела, воздействуя на любые очаги заболевания.
Кортикостероиды - мощные противовоспалительные средства, такие как Дексаметазон и Преднизолон, являются важной частью терапии. Их можно использовать как отдельно, так и в сочетании с другими лекарствами.
Иммуномодуляторы - вещества, которые воздействуют на собственную иммунную систему человека и помогают ей бороться с заболеванием: Леналидомид и Помалидомид.
Ингибиторы протеасом - не позволяют расщепляться белкам, необходимым для деления клеток: Бортезомиб, Карфилзомиб и Иксазомиб.
Ингибиторы гистондеацетилазы, такие как Панобиностат - влияют на активность определенных генов в клетках.
Моноклональные антитела: вещества, искусственно разработанные для атаки на конкретную цель - например, белки на поверхности миеломных клеток. К ним относят Даратумумаб и Элотузумаб.
Бисфосфонаты - лекарства, которые замедляют процесс ослабления костей и уменьшают возникающие в них боли: Памидронат. золедроновая кислота и Деносумаб.
Трансплантация стволовых клеток - пересадка костного мозга, клетки которого могут становиться красными кровяными тельцами, переносящими кислород по телу, лейкоцитами, помогающими бороться с инфекциями, и тромбоцитами, останавливающими кровотечения. Сначала пациенту назначают высокодозную химиотерапию, уничтожающую поврежденный костный мозг, после чего вводят новые, здоровые кроветворные клетки.
Трансплантация бывает аутологичной - с использованием заранее собранного собственного материала, или аллогенной - с применением клеток другого человека - донора.
Лучевая терапия: уничтожение очагов заболевания с помощью радиации - один из самых подходящих вариантов для борьбы с одиночными плазмоцитомами Плазмоцитома - это опухоль, состоящая из измененных плазмоцитов - клеток, производящих антитела - белки, защищающие организм от бактерий и вирусов. . Ее применяют для лечения поврежденных миеломой участков костей, которые не ответили на химиотерапию или другие препараты, болят или могут сломаться.
Поддерживающая терапия
ВВИГ - внутривенное введение нормальных антител - белков иммуноглобулинов, необходимых для борьбы с инфекцией.
Эритропоэтин - препарат, повышающий количество эритроцитов, переносящих кислород от легких к другим тканям.
Плазмаферез - процедура, позволяющая удалять миеломные белки и снижать вязкость крови.

7 курс химиотерапии при редком заболевании- миелома.
Прогноз и выживаемость при миеломе
Прогнозы каждого человека индивидуальны и зависят от большого количества факторов, таких как общее состояние здоровья, возраст, тип и этап заболевания, а также ответ на терапию.
Врачи представляют примерные перспективы, ориентируясь на специальный показатель - «пятилетнюю выживаемость». Он представляет из себя статистические данные о проценте оставшихся в живых пациентов спустя 5 или более лет с даты постановки диагноза. Никаких данных о шансах конкретного больного он не дает и не учитывает ничего, кроме стадии.
Для данного типа онкологии цифры выглядят следующим образом:
- на локализованном этапе, пока в организме присутствует одиночная плазмоцитома Плазмоцитома - это опухоль, состоящая из измененных плазмоцитов - клеток, производящих антитела - белки, защищающие организм от бактерий и вирусов. , то есть одна опухоль в кости или вне ее - около 75%;
- при множественной миеломе - примерно 53%.
Важно отметить, что «пятилетняя выживаемость» никак не принимает в расчет критичные моменты - возраст, качество работы почек и общее состояние здоровья, степень изменения опухолевых клеток, а также уровни белков и других веществ в крови.
Кроме того, эти числа получены по данным за прошлые годы и не учитывают новые возможности, которые дают недавно появившиеся препараты и методы лечения. Наука не стоит на месте, а значит сегодняшние пациенты могут иметь гораздо лучшие шансы, чем те, для кого была составлена данная статистика.
Читайте также:
