Кровеносные сосуды при лучевой болезни. Морфология сосудов после лучевого поражения
Добавил пользователь Валентин П. Обновлено: 22.01.2026
Радиационный некроз твердых тканей зубов возникает после воздействия ионизирующего излучения в связи с лечением злокачественных новообразований, заболеваний крови,скелета и других органов и систем, а также от действия профессиональных факторов.
Патогенез (что происходит?) во время Радиационного (постлучевого) некроза:
До настоящего времени нет единого мнения о механизме и характере изменений в тканях зуба и полости рта в результате радиационного излучения. Одни исследователи склонны относить лучевые нарушения тканей зубов к некариозным поражениям. Другие считают, что после радиационного облучения активно развивается кариес зубов наряду с некариозными поражениями.
Патогенез лучевого поражения зубов до сих пор окончательно не выяснен. Обсуждаются данные о сосудистых, морфологических и дегенеративных нарушениях в пульпе. Предполагают влияние на зубы ксеросто-мии, развивающейся после лучевого воздействия. Не исключается иммунодепрессивное действие ионизирующего излучения. Некоторые исследователи полагают, что в облученном организме происходит специфическое подавление металлосодержаших ферментных систем (в первую очередь железосодержащих), участвующих в процессе тканевого дыхания в аэробной фазе. Нарушение аэробной фазы тканевого дыхания влечет за собой накопление в тканях организма, в том числе в пульпе зуба, недоокисленных продуктов метаболизма, а также стойкое нарушение их дальнейшего окисления.
Таким образом, в результате воздействия ионизирующего излучения именно эти процессы, происходящие в пульпе зуба, приводят к нарушению трофики и физиологических процессов реминерализации эмали и дентина. Особенно это выражено при сочетании с нарушением функции слюнных желез, вызываемой облучением, с последующим дисбалансом реминерализующих механизмов в среде эмаль - слюна.
Симптомы Радиационного (постлучевого) некроза:
Проявления постлучевого поражения зубов и тканей полости рта достаточно характерны. Прежде всего практически у всех больных отмечаются радиомукозит слизистой оболочки губ, щек, языка, потеря или извращение вкусовых ощущений, выраженная ксеростомия и соответственно сухость в полости рта.
Обычно спустя 3-6 мес после лучевого воздействия эмаль зубов утрачивает характерный блеск, становится тусклой, серовато-блеклой. Отмечаются ломкость, стертость жевательной и вестибулярной поверхностей зубов. На этом фоне появляются участки некроза, вначале локальные, а затем по типу циркулярного поражения зубов. Обычно они темного цвета, заполнены рыхлой некротической массой, безболезненные. Отсутствие болевого симптома - характерная особенность радиационного поражения зубов. Постепенно участки некроза расширяются и захватывают значительную часть зуба. Удаление некротических масс из очага поражения, как правило, безболезненное, поэтому делать это надо осторожно.
Без радикальных лечебных мероприятий через 1-2 года пораженными оказываются более 96 % зубов.
Интенсивность лучевого поражения зубов в известной степени зависит от зоны и дозы облучения. Эти поражения, напоминающие кариес, безболезненны даже при зондировании, показатель электроодонтометрии понижен до 15-25 мкА.
Образовавшиеся в зубах полости имеют неровные изъеденные края, которые в пределах эмали прозрачные и хрупкие. Располагаются полости на атипичных для кариеса поверхностях зубов. Кариозная полость обычно заполнена серой массой, удаление ее малоболезненно или безболезненно. Ранее и вновь поставленные пломбы выпадают.
Анамнез позволяет дифференцировать указанные поражения, наметить меры лечения и профилактики.
Лечение Радиационного (постлучевого) некроза:
При поражении твердых тканей коронки зуба лечение прово дят в несколько этапов. Вначале осто рожно удаляют некротические массы из дефектов зубов вручную экскава тором, чтобы не внедриться в полость зуба, а затем вводят кальцифицирующую пасту, состоящую из равных час тей порошка глицерофосфата кальция, оксида цинка и глицерина. Пасту накладывают тонким слоем на дно и стенки образовавшейся полости и закрывают временным пломбировоч ным материалом.
Следующий этап отсроченного лечения зубов проводят через 1-1,5 мес. Он состоит в удале нии нежизнеспособных, некротизированных тканей зуба при помощи бора до минерализованного участка дентина или эмали, после чего вновь накладывают кальцифицирующую пасту и пломбируют зубы стеклоиономерными цементами.
При более глубоких поражениях устраняют имеющиеся некротические дефекты стеклоиономерными цементами и через 3-4 мес, если этого требует косметическая реставрация передних зубов, часть стеклоиономера удаляют, а сверху накладывают композитный пломбировочный материал.
Профилактика Радиационного (постлучевого) некроза:
Для уменьшения прямого действия радиации на зубы изготавливают индивидуальную свинцовую каппу, которую больной надевает непосредственно перед каждой процедурой лучевой терапии. Необходимо также уменьшить опосредованное действие проникающей радиации путем предварительного (перед облучением) проведения месячного курса общей и местной реминерализующей терапии в сочетании с комплексом антиоксидантов.
Если профилактические мероприятия перед облучением не проводили, то после лучевой терапии необходимо провести весь курс комплексного лечения в течение 5-6 мес, сочетая его со стоматологическими вмешательствами.
Обычно через 3-4 нед комплексной реминерализующей и антиоксидантной терапии появляется гиперестезия дентина. Это хороший признак, свидетельствующий о восстановлении жизнеспособности пульпы зуба.
К каким докторам следует обращаться если у Вас Радиационный (постлучевой) некроз:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Радиационного (постлучевого) некроза, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Кардиопатии, обусловленные радиотерапией
Данная работа представляет собой систематический обзор литературы Национальной медицинской библиотеки США по теме «кардиопатии, обусловленные воздействием химиотерапии и лучевой терапии». В обзор включены все источники, найденные по ключевым словам: «cardiopathy-induced radiotherapy»
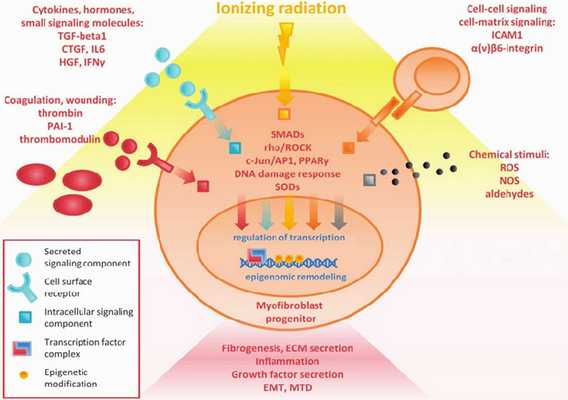
Введение
Совокупность изменений сердца под воздействием лучевой терапии получила название «радиационно-индуцированной болезни сердца», которая включает в себя целый комплекс изменений, возникающий в результате лучевого повреждения миокарда, перикарда, клапанного аппарата, коронарных артерий, проводящей системы сердца [21].
Таким образом, применение химиотерапии и лучевой терапии при лечении онкологических больных приводит к развитию хронической сердечной недостаточности (ХСН).
По результатам фармако — экономических анализов, на лечение ХСН в странах Европы и США ежегодно расходуется 1-2% всего бюджета здравоохранения, что в 5 раз превышает затраты, направленные на лечение всех форм злокачественных новообразований [Фомин И. В. и др. , 2006].
Кардиопатии, обусловленные радиотерапией
В последние десятилетия проблема поражений сердца вследствие радиотерапии приобрела новое значение, прежде всего в связи с существенным увеличением в современном мире числа лиц, подвергшихся радиационному воздействию, как локальному, так и общему. Это касается прежде всего пациентов с ходжскинской лимфой, для которых сердечно-сосудистые осложнения в последующие 30-40 лет после облучения являются основной причиной смерти, больных с раком лёгкого, молочной железы (чаще левостороннего), пациентов, перенёсших трансплантацию, сочетающиеся с тотальным облучением [1, 2, 21].
В настоящее время минимальный порог эффективной лучевой дозы безопасной для сердца не известен. В большинстве случаев стандартная суммарная доза облучения для пациентов с лимфомой Ходжкина составляет 30Гр, для пациентов с раком молочной железы 45-50Гр, и между величиной суммарного облучения и сердечной заболеваемостью последующие годы существует прямая пропорциональная зависимость. С дозой облучения напрямую связана продолжительность жизни больного, которая снижается в результате ускоренного прогрессирование коронароатеросклероза, фиброзных изменений клапанов (чаще левосторонних), перикарда с возникновение фибринозного, реже экссудативного плеврита, самого миокарда с развитием диастолической дисфункции и скорейшего развития терминальной ХСН. 3
В тоже время анализ заболеваемости ССЗ у людей, выживших после взрыва атомной бомбы и многолетнее наблюдения за ликвидаторами аварии на Чернобыльской АЭС показали, что даже малые дозы облучения 1 Гр и менее способны повлиять на состояние сердечной мышцы. Множество исследований показывают, что радиационное облучение области сердца в любой дозе представляет риск для возникновения сердечных событий [ 6].
Постлучевая кардиомиопатия — это гетерогенное заболевание, характеризующиеся дозозависимым прогрессирующим снижением сократительного резерва миокарда, снижением ФВ ЛЖ, повышением жёсткости сердца как за счёт миокарда, так и за счёт перикарда и преждевременной смертью [1].
Патогенез
Механизм развития (Рисунок 3) постлучевых повреждений полностью не изучен, но известно, что ионизирующие облучение приводит к микроваскулярным нарушениям, повреждению эндотелия с повышением проницаемости сосудистой стенки, микротромбозу со снижением количества функционирующих капилляров — всё это является следствием запуска воспалительного ответа и причиной активации фиброзного замещения кардиомиоцитов. В миокарде увеличивается содержание коллагена I и III типов, которые вызывают снижение эластических свойств мышцы, повышая конечно-диастолическое давление [7].
Радиационные повреждения сердца включают в себя остро и хронически протекающие изменения. Сразу же после облучения повреждённые эндотелиоциты высвобождают факторы адгезии и пролиферации, активируются клетки воспаления с выделением провоспалительных цитокинов, таких как интерлейкины-1, 6, 8, фактор некроза опухоли-β, основной фактор роста фибробластов, инсулин-подобный фактор роста, соединительнотканный факторы роста, матриксные металлопротеазы разрушающие базальную мембраны сосудов, происходит активацию проонкогенов, c-myc и c-jun, которые поддерживают фиброз в тканях сердца [6, 21].
В позднем периоде происходят глубокие фибринозные изменения, протекающие десятилетия бессимптомно и приводящее в конечном счёте к развитию рестриктивной кардиопатией с умеренным снижением насосной функции ЛЖ или реже дилатационной с выраженными нарушениями показателей диастолической функции ЛЖ [8].
Важным моментом в развитии радио-индуцированной кардиопатии является её растянутое во времени развитие, что приближает её к антрациклинновой кардиопатии и предполагает наличие реорганизации многих белковых структур клетки, митохондриальных белков, повреждения митохондриальной ДНК и оксидативного стресса в её основе [9].
В патогенезе лучевой кардиопатии принимают участие уже известный гипоксия-индуцированный фактор1-α, интерлейкин-1, блокирование рецепторов которого как и в случае с воздействием Доксорубицина препятствует снижению ФВ, но при этом не оказывает влияние на процессы фиброза, ядерный фактор kappa B, представляющий собой белковый комплекс, регулирующий транскрипцию ДНК и участвующий в клеточном ответе на различные стрессовые воздействия, на оксидативный стресс в частности и выявленные недавно в качестве участников длительного асептического воспаления представители каликреин-кининновой системы, работающие посредством митоген-активируемых протеинкиназ [1].
Диагностика
При лучевом поражении сердца ЭКГ изменения обычно выражаются в неспецифических смещениях сегмента ST, низком вольтаже зубцов, появлении и прогрессировании нарушений ритма сердца, развитии внутрижелудочковых блокад, иногда атриовентрикулярных блокад, что, конечно, имеет лишь вспомогательное значения для диагностики кардиопатий.
Широко изучается выявление ЭХОКГ-признаков диастолической дисфункции, как наиболее ранних предвестников развития СН, однако в настоящее время отсутствуют практические руководства по раннему выявлению постлучевой кардиопатии с помощью показателей расслабления миокарда. Несмотря на это большинством экспертов поддерживает обязательное проведение ЭХОКГ спустя 10 лет после проведённой лучевой терапии в качестве мониторинга [2].
Натрий-уретические пептиды и тропонины могут быть использованы в качестве оценки степени лучевого повреждения миокарда, но опять-таки, определённых рекомендаций по их использованию в плане диагностики кардиопатий, обусловленных радиотерапией, не существует [117].
Главный приоритет в диагностике развивающегося интерстициального фиброза миокарда, основного морфологического проявления радиационного воздействия, принадлежит дорогостоящим методикам: МРТ с контрастным усилением, позволяющие выявить по эффекту задержки гадолиния признаки фиброза, происходящие после облучения средостения, перфузионная сцинтиграфия с 99mTс-МИБИ, однофотонная эмиссионная томография, способная визуализировать временные дефекты микроперфузии миокарда, попавшего под облучение, объём которых статистически коррелирует с лучевой нагрузкой 11.
В мировой литературе приводятся данные о применении радионуклиидной ангиографии, определение потребления миокардом кислорода в покое и при физической нагрузке в качестве скрининговых методов диагностики пациентов, прошедших радиотерапию, а также выявление радиационных повреждений сердца посредством обнаружения экстравазальных скоплений альбумина в миокарде [8, 13-17].
Радиопротекция и лечение
Современные методики лучевой терапии способствуют сокращению дозы облучения и уменьшению поля облучения, но неизвестно способствует ли это безопасности или просто оттягивает во времени проявление осложнений, так как, отсутствуют статистически достоверные данные, свидетельствующие об уменьшении долгосрочных событий.
К методикам, способствующим избежать повреждения сердца, относятся:
трёхмерное планирование облучения,
дыхательное стробирование с модуляцией интенсивности облучения,
использование свинцовых блоков для защиты сердца,
Техническое усовершенствование радиотерапевтической аппаратуры, развитие клинической дозиметрии, разработка предлучевой топометрии с использованием компьютерной техники служат основой повышения эффективности лучевой терапии при лечении опухолей. Наличие рентгеносимулятора, компьютерного томографа, возможность использования магнитно-резонансного и позитронного эмиссионного томографа позволяют весьма точно определить границы мишени, подлежащей облучению. Даже такая мелочь, как синхронизация лучевой терапии с дыханием, позволяет уменьшить дозу ионизирующего излучения в органах риска (сердце и лёгкие) и, тем самым, снизить вероятность развития лучевых осложнений.
Экспериментально на крысах были проведены попытки уменьшить лучевой воздействие на сердце путём синхронизации пучка облучения с сердечным циклом, тем самым оказывая воздействие в тот момент, когда миокард находится в состоянии относительной гипоксии [18].
На прогноз пациентов, подвергнутых радиотерапии, влияет возраст, так как известно, что риск поражения сердечно-сосудистой системы при радиационном облучении наиболее высок у лиц молодого возраста, перенесших радиотерапию до 40 лет облучение зоны средостения у детей и подростков, больных лимфогранулематозом, сопровождается ростом кардиальной смертности уже в течение первых пяти лет после облучения [10].
Сердечная смертность значительно увеличивается даже после облучения небольшой дозой в 5Гр в случае присоединения антракциклинов.
Несмотря на то, что радиационные поражения сердечно-сосудистой системы могут возникать в отсутствие факторов риска кардиологических заболеваний, необходимо помнить, что классические факторы риска (артериальная гипертензия, курение и гиперлипидемия) увеличивают риск прогрессирования радиационно обусловленных изменений сердца и требуют более агрессивной терапии [19].
Фармакологические методы предупреждения последствий лучевого воздействия в настоящее время не известны, но идут исследования в направлении препаратов, воздействующих на каликреин-кининовую систему. Так известно, что тучные клетки неожиданно оказывают протективную роль для сердца, посредством подавления активности эндотелина-1. Экспериментальные методы по использованию блокатора эндотелинновых рецепторов Бозентана в настоящее время не дали каких-либо положительных результатов. Также проводятся работы по изучению радиопротективных свойств Пентоксифиллина [4].
Описаны попытки экспериментального воздействия на процесс миокардиального фиброза и оксидативный стресс, индуцированные ионизирующей радиацией, с помощью статинов, гормона мелатонина, известного своими мощными кардиопротективными свойствами, витаминов С, Е, N-ацетилхолина. [20]
В эксперименте на мышах назначение Талидомида, известного седативного препарата, за которым были замечены возможности активировать созревание сосудистой стенки за счёт размножения перицитов, не приводило к защите сердца от радиационного повреждения [21].
В будущем должны быть проведены исследования по оценке эффективности профилактического приёма и-АПФ, ингибиторов минералкортикоидных рецепторов, аллопуринола.
Есть сведения о положительном лечебном эффекте пересадки мезенхимальных стволовых клеток пациенту с радиационной кардиопатией и перикардитом [22].
И наконец, пациенты с радио-индуцированной рестриктивной кардиопатией имеют наихудший прогноз после трансплантации сердца, им чаще требуется механическая поддержка в период ожидании трансплантанта с замещением функции правого желудочка и у них нередко почечная и дыхательная недостаточность вследствие лучевого повреждения соответствующих органов [23].
Однако, выживаемость таких пациентов, согласно данным клиники Мейо, после ортотопической трансплантации сердца в течение 1, 5, 10 лет составила 91, 7%, 75% и 46, 7% соответственно [24].
Таким образом, -радио-индуцированные кардиопатии, несмотря на низкую частоту развития, должны иметь должное внимание со стороны специалистов онкологии и кардиологии. В настоящее время существуют практические руководства, позволяющие уменьшить риск возникновения кардиопатии на фоне химиотерапии. В отношении профилактики радиационного повреждения миокарда ведутся дальнейшие работы.
Список литературы
Mawad R. , Gooley T. A. , Rajendran J. G. , Fisher D. R. et. al. Radiolabeled anti-CD45 antibody with reduced-intensity conditioning and allogeneic transplantation for younger patients with advanced acute myeloid leukemia or myelodysplastic syndrome. Biol Blood Marrow Transplant. 2014 Sep;20 (9): 1363-8. doi: 10. 1016/j. bbmt. 2014. 05. 014. Epub 2014 May 20.
Gyenes G. , Fornander T. , Carlens P. , Glas U. et. al. Myocardial damage in breast cancer patients treated with adjuvant radiotherapy: a prospective study. Int J Radiat Oncol Biol Phys. 1996 Nov 1;36 (4): 899-905.
Mezzaroma E. , Mikkelsen R. B. , Toldo S. , Mauro A. G. et. al. Role of interleukin-1 in radiation induced cardiomyopathy. Mol Med. 2015 Mar 26. doi: 10. 2119/molmed. 2014. 00243.
Lipshultz S. E. , et al; American Heart Association Congenital Heart Defects Committee of the Council on Cardiovascular Disease in the Young, Council on Basic Cardiovascular Sciences, Council on Cardiovascular and Stroke Nursing, Council on Cardiovascular Radiology. (2013) Long-term cardiovascular toxicity in children, adolescents, and young adultswho receive cancer therapy: pathophysiology, course, monitoring, management, prevention, and research directions: a scientific statement from the American Heart Association. Circulation. 128: 1927-95. doi: 10. 1161/CIR. 0b013e3182a88099
Jaworski C, Mariani JA, Wheeler G, Kaye DM. (2013) Cardiac complications of thoracic irradiation. J Am Coll Cardiol. 61: 2319-28. doi: 10. 1016/j. jacc. 2013. 01. 090.
Lipshultz SE, Adams MJ. (2010) Cardiotoxicity after childhood cancer: beginning with the end in mind. J Clin Oncol. 28: 1276-1281. doi: 10. 1200/JCO. 2009. 26. 5751
Taunk N. K. , Haffty B. G. , Kostis J. B. , Goyal S. Radiation-induced heart disease: pathologic abnormalities and putative mechanisms. Front Oncol. 2015 Feb 18;5: 39. doi: 10. 3389/fonc. 2015. 00039. ECollection 2015
Azimzadeh O. , Scherthan H. , Sarioglu H. , Barjaktarovic Z. et. al. Rapid proteomic remodeling of cardiac tissue caused by total body ionizing radiation. Proteomics. 2011 Aug;11 (16): 3299-311. doi: 10. 1002/pmic. 201100178.
Mezzaroma E. , Di X. , Graves P. , Toldo S. et. al. A mouse model of radiation-induced cardiomyopathy. Int J Cardiol. 2012 Apr 19;156 (2): 231-3. doi: 10. 1016/j. ijcard. 2012. 01. 038. Epub 2012 Feb 16.
Herrmann J. , Lerman A. , Sandhu N. P. , Villarraga H. R. et. al. Evaluation and management of patients with heart disease and cancer: cardio-oncology. Mayo Clin Proc. 2014 Sep;89 (9): 1287-306. doi: 10. 1016/j. mayocp. 2014. 05. 013.
Umezawa R. , Ota H. , Takanami K. , Ichinose A. et. al. MRI findings of radiation-induced myocardial damage in patients with oesophageal cancer. Clin Radiol. 2014 Dec;69 (12): 1273-9. Doi: 10. 1016/j. crad. 2014. 08. 010.
van Nimwegen F. A. , Schaapveld M. , Janus C. P. , Krol A. D. et. al. Cardiovascular Disease After Hodgkin Lymphoma Treatment: 40-Year Disease Risk. JAMA Intern Med. 2015 Apr 27. doi: 10. 1001/jamainternmed. 2015. 1180.
Dogan I. , Sezen O. , Sonmez B. , Zengin A. Y. et. al. Myocardial perfusion alterations observed months after radiotherapy are related to the cellular damage. Nuklearmedizin. 2010;49 (6): 209-15. doi: 10. 3413/nukmed-0315-10-05.
Burns R. J. , Bar-Shlomo B. Z. , Druck M. N. , Herman J. G. et. al. Detection of radiation cardiomyopathy by gated radionuclide angiography. Am J Med. 1983 Feb;74 (2): 297-302.
Lipshultz S. E, Adams M. J. Cardiotoxicity after childhood cancer: beginning with the end in mind. J Clin Oncol. 2010 Mar 10;28 (8): 1276-81. doi: 10. 1200/JCO. 2009. 26. 5751. Epub 2010 Feb 8.
Gladstone D. J. , Flanagan M. F. , Southworth J. B. , Hadley V. et. al. Radiation-induced cardiomyopathy as a function of radiation beam gating to the cardiac cycle. Phys Med Biol. 2004 Apr 21;49 (8): 1475-84.
Hong R. A. , Iimura T. , Sumida K. N. , Eager R. M. Cardio-oncology/onco-cardiology. Clin Cardiol. 2010 Dec;33 (12): 733-7. doi: 10. 1002/clc. 20823.
Wagdi P, Fluri M. , Aeschbacher B. , Fikrle A. , Meier B. Cardioprotection in patients undergoing chemo- and/or radiotherapy for neoplastic disease. A pilot study. Jpn Heart J. 1996 May;37 (3): 353-9.
Hoving S, Seemann I, Visser NL, te Poele JA, Stewart FA. Thalidomide is not able to inhibit radiation-induced heart disease. Int J Radiat Biol (2013) 89 (9): 685-91. doi: 10. 3109/09553002. 2013. 788797
Kursova L. V. , Konoplyannikov A. G. , Kal'sina S. Sh. , Baboyan S. B. Allogenic cardiomyoblasts raised from human mesenchymal stem cells in the therapy of radiation cardiomyopathy and pericarditis: case report. Bull Exp Biol Med. 2014 May;157 (1): 143-5. doi: 10. 1007/s10517-014-2510-4. Epub 2014 Jun 10.
Shah S. , Nohria A. Advanced heart failure due to cancer therapy. Curr Cardiol Rep. 2015 Apr;17 (4): 16. doi: 10. 1007/s11886-015-0570-3.
Saxena P. , Joyce L. D. , Daly R. C. et. al. Cardiac transplantation for radiation-induced cardiomyopathy: the Mayo Clinic experience. Ann Thorac Surg. 2014 Dec;98 (6): 2115-21. doi: 10. 1016/j. athoracsur. 2014. 06. 056
Нарушение кровообращения в конечностях

Большинство пациентов началом своего заболевания считают возникновение болей в мышцах нижних конечностей. Однако, за 2-3 года до их возникновения у многих пациентов отмечаются повышенная усталость мышц ног при физических нагрузках, зябкость и похолодание стоп. На ранних стадиях характерны повышенная чувствительность к низким температурам и чувство онемения пораженной конечности. Больные вынуждены независимо от погоды ходить постоянно в теплых носках. Могут отмечаться гипотрофия мышц, выпадение волос, медленный рост ногтей на пальцах ног. Пациенты, как правило, не обращают внимания на эти «продромальные» явления, так как они не вызывают нарушения функции конечности и не ограничивают трудоспособности.
Основным клиническим признаком недостаточности кровоснабжения ног является симптом перемежающейся хромоты. Чаще всего он проявляется болями в икроножных мышцах, которые возникают при ходьбе и заставляют пациента остановиться. После кратковременного отдыха боль прекращается и пациент вновь способен пройти определенное расстояние. Вначале боли носят периодический характер и чаще возникают после длительной физической нагрузки, особенно после интенсивной ходьбы. При подъеме в гору или по лестнице боли возникают значительно быстрее, чем при ходьбе по ровному месту. Снижении нагрузки улучшает самочувствие больного, и, сам того не замечая, он старается уменьшить скорость передвижения. При окклюзии аорты или подвздошных артерий ишемические мышечные боли могут локализоваться в ягодичных мышцах, пояснице и мышцах бедра («высокая перемежающаяся хромота»). В ранней стадии этот вид перемежающейся хромоты проявляется как тянущие болезненные ощущения в области ягодиц и по задней поверхности бедер. Врачи часто трактуют эти боли как проявление пояснично-крестцового рдикулита. При прогрессированиизаболевания боли становятся постоянным спутником во время ходьбы. Они появляются через определенное расстояние, заставляют больного останавливаться и отдыхать. По мере развития заболевания, расстояние при ходьбе сокращается, а времени для отдыха требуется больше. А когда кровоток становится недостаточным для удовлетворения метаболических потребностей тканей конечности в отсутствие движений, появляется боль в покое. Она обычно возникает ночью, когда больной находится в горизонтальном положении и ощущается в пальцах и стопе. Боль вынуждает пациента опускать ногу с постели каждые 2-3 часа. Боль в покое - грозный симптом, указывающий на критическое нарушение кровообращения в конечности и скорое развитие язвенно-некротических изменений мягких тканей стопы, вплоть до гангрены. Окклюзия бифуркации аорты и подвздошных артерий (синдром Лериша) проявляется симптомами хронической артериальной недостаточности обеих ног и нарушением функции тазовых органов, таких как импотенция и недержание газов.
При осмотре пораженной конечности выявляют бледность и истончение кожных покровов, выпадение волос и гипотрофию мышц. На нарушение кровоснабжения ног указывают также снижение кожной температуры и отсутствие пульсации артерий на всех уровнях дистальнее места окклюзии.
Стадии хронической ишемии
Выраженность болевого синдрома при различных функциональных состояниях и трофические нарушения отражают степень нарушения артериального кровообращения в конечности и позволяют определить стадию заболевания. В клинической практике широко используется классификация выраженности хронической ишемии нижних конечностей Fontaine - Покровского, которая выделяет четыре стадии (табл. 3. ).
В настоящее время третью и четвертую стадии принято объединять под общим названием «критическая ишемия». Выделение больных с этими степенями ишемии в отдельную группу связано с высокой вероятностью ампутации и необходимостью их стационарного лечения в сосудистых отделениях.
Степени острой ишемии
Острый тромбоз и эмболия проявляются синдромом острой ишемии конечности. При этом у больного внезапно возникает боль в пораженной конечности, появляются чувство онемения и похолодания, расстраивается поверхностная и глубокая чувствительность. При выраженной ишемии быстро нарушаются активные движения в конечности, вплоть до полной обездвиженности. Появление субфасциального отека мышц служит признаком тяжелой ишемии конечности. Самым грозным признаком острой артериальной непроходимости служит ишемическая мышечная контрактура с нарушением пассивных движений в суставах. Этот симптом свидетельствует о начинающихся некробиотических изменениях в мягких тканях и угрозе гангрены конечности. Степень выраженности клинических проявлений и скорость их нарастания зависит от состояния коллатерального кровообращения в пораженной конечности и отражает степень ее ишемии. По клиническим признакам различают три степени острой ишемии конечности (табл. 4. ).
Более точно оценить степень нарушения кровообращения в конечности, уровень и распространенность поражения позволяют инструментальные методы диагностики.
Инструментальная диагностика
Пациентам с ишемией конечностей в первую очередь необходимо выполнить ультразвуковое допплеровское исследование. Этот метод дает возможность определить уровень окклюзии и объективно оценить степень нарушения кровоснабжения дистальных отделов пораженной конечности.
При допплерографии производят измерение максимального артериального систолического давления на разных сегментах конечности и рассчитывают так называемые индексы давления. Чаще всего определяют лодыжечно-плечевой индекс (ЛПИ), который выражает соотношение давление в артериях голени и плечевой артерии. В норме данный индекс равен или превышает единицу. Индекс ниже 0, 9 почти всегда отражает наличие гемодинамически значимого стеноза или окклюзии магистральной артерии. Величина этого показателя ниже 0, 3 отражает критическое снижение кровообращения и угрозу развития гангрены конечности. Более полную информацию о состоянии артериального русла дает ультразвуковое ангиосканирование. Метод позволяет точно определить степень и протяженность поражения сосуда и выбрать адекватный метод хирургического вмешательства.
Тактика лечения
Определение стадии хронической ишемии у конкретного больного имеет принципиальное значение, так как это определяет тактику лечения. При наличии I или II «А» стадии ишемии больному проводится главным образом только консервативная терапия. При наличии II «Б» стадии ишемии лечение начинают с консервативной терапии и в зависимости от ее эффективности может быть принято два решения: или продолжить консервативную терапию, или выполнить больному реконструктивную сосудистую операцию, особенно если больной настаивает на улучшении качества жизни и уменьшении перемежающейся хромоты. Определение лодыжечно-плечевого индекса в сочетании с тредмил-тестом позволяет уточнить стадию заболевания и выделить среди больных с «перемежающейся хромотой» пациентов, близких к критической ишемии. Больные, не способные пройти 200 м или прошедшие данное расстояние, но время восстановления лодыжечно-плечевого индекса у которых превышает 15-16 минут, нуждаются в хирургическом восстановлении магистрального кровотока.
Другой принципиальный подход должен быть к больным с III и IV стадиями ишемии. При этих степенях ишемии конечности наилучшие результаты дает реконструктивная сосудистая операция. При IV стадии ишемии реконструктивная операция сочетается с некрэктомией или малой ампутацией. При невозможности улучшения кровообращения у больных с критической ишемией производят ампутацию конечности. Следует подчеркнуть, что 90% ампутаций нижних конечностей во всем мире выполняется именно по поводу критической ишемии. На фоне сахарного диабета критическая ишемия встречается примерно в 5 раз чаще.
Тактика лечения острой артериальной непроходимости зависит от причины ее вызвавшей и определяется степенью ишемии конечности (табл. 5). При умеренной ишемии крайней необходимости в экстренной операции нет и существует возможность для проведения пробной консервативной терапии. Это может быть антикоагулянтная терапия, катетерный тромболизис или катетерная тромбэктомия. При безуспешности подобного лечения больным показана срочная тромбэмболэктомия или реконструктивная операция на магистральных сосудах. Выраженная острая ишемия конечности требует экстренного восстановления артериального кровотока. В этой ситуации только полноценное хирургическое устранение окклюзии обеспечивает сохранение жизнеспособности конечности и восстановление ее функции. При тотальной ишемической контрактуре конечности восстановление артериального кровотока противопоказано в связи с развитием некорригируемого постишемического синдрома и угрозой полиорганной недостаточности. В подобной ситуации срочная первичная ампутация конечности может быть единственно возможной мерой спасения жизни больного.
Ни возраст больного, ни наличие ИБС, ни перенесенные ранее инфаркты миокарда, ни артериальная гипертензия, ни другие заболевания не являются противопоказанием для проведения сосудистой операции. Противопоказаниями могут служить лишь сердечная недостаточность 2Б-3 степени, наличие крайней степени хронической почечной недостаточности, требующей проведения гемодиализа и тяжелая декомпенсированная легочная недостаточность.
Методы хирургического лечениия
Техника большинства реконструктивных сосудистых операций хорошо отработана. Изучение многолетних отдаленных результатов выявило малые различия в проходимости различных шунтов при дистальном анастомозе с подколенной артерией выше щели коленного сустава. Поэтому в этой позиции все чаще используются синтетические протезы из политетрафторэтилена. При необходимости шунтирования артерий с дистальным анастомозом ниже щели коленного сустава предпочтительнее использовать большую подкожную вену больного.
В последнее десятилетие в лечении облитерирующих заболеваний артерий нижних конечностей все шире используются эндовазальные вмешательства. Стентирование артерий нижних конечностей выполняют начиная со II стадии заболевания. Наиболее часто выполняется стентирование подвздошных, поверхностной бедренной и подколенной артерий. Однако, с каждым годом диапазон эндоваскулярных вмешательств расширяется. В настоящее время появилась возможность лечить миниинвазивным способом поражения и более мелких артерий. Идеальным для стентирования типом поражения является короткий концентрический стеноз или изолированная окклюзия протяженностью менее 5 см для подвздошных и менее 10 см для поверхностной бедренной артерий. Полное исчезновение или значительное уменьшение выраженности симптомов ишемии нижних конечностей отмечается в 90-95% наблюдений. Проходимость расширенного просвета подвздошных артерий в течение 5 лет после эндоваскулярных операций составляет 85-90%, бедренных артерий - 60-75%. Чем дистальнее располагается оперированный сегмент и меньше его диаметр, тем хуже результаты реваскуляризации. Причинами рестеноза в отдаленные сроки после стентирования является гиперплазия неоинтимы, реже - механическая деформация стента.
Общность патофизиологичеких механизмов развития нарушений артериального кровоснабжения в различных органах определяет и единые принципы их устранения. Знание их, как выразился П. Эрлих, освободит нас от необходимости отливать свою «магическую пулю» для каждой болезни. Лечение нарушений любого регионарного артериального кровотока должно быть направлено на замедление основного патологического процесса, улучшение кровообращения и метаболизма в пораженной зоне и профилактику острого тромбоза. Принимая во внимание хроническое течение заболевания терапия должна быть непрерывной и пожизненной у всех пациентов, в том числе и перенесших реконструктивную операцию на магистральных артериях.
Диагностические критерии неспецифического аортоартериита
(Американская ревматологическая ассоциация, 1990) Таблица 1.
¨ Возраст менее 40 лет
¨ «Перемежающаяся хромота» верхних конечностей - быстрое развитие усталости и ощущуение дискомфорта при работе руками.
¨ Ослабление пульса на лучевой артерии, ослабление пульсации на одной или обеих плечевых артериях.
¨ Разница систолического АД на правой и левой плечевых артериях более 10 мм рт. ст.
¨ Систолический шум над подключичными артериями или брюшной аортой.
¨ Ангиографические изменения: сужение или окклюзия аорты и/или ее ветвей, не связанное с атеросклерозом, фибромускулярной дисплазией или другими причинами. Изменения обычно локальные или сегментарные.
Диагностические критерии облитерирующего тромбангиита
¨ Начало до 45 летнего возраста
¨ Отсутствие источника эмболии
¨ Отсутствие травмы
¨ Отсутствие аутоиммунного заболевания
¨ Отсутствие диабета
¨ Отсутствие гиперлипидемии
¨ Отсутствие гиперкоагуляции
¨ Нормальные проксимальные артерии
¨ Объективное доказательство дистальных окклюзий (ангиография, ангиосканирование и т. д. )
Диагностические критерии облитерирующего тромбангиита:
- Большой критерий - ишемия нижних конечностей у курящих молодых людей при отсутствии гиперлипидемии, сахарного диабета, системных заболеваний соединительной ткани, гематологической патологии или троьбоэмболии.
- Повторный мигрирующий тромбофлебит.
- Ишемия верхних конечностей.
Стадии хронической артериальной недостаточности. Таблица 3.
I - Начальные проявления (зябкость, похолодание, парестезии,
безболевая ходьба до 1 000 м).
II - Недостаточность кровообращения при функциональной нагрузке
(«перемежающаяся хромота»). Проходимое без боли расстояние:
II А - более 200 м;
II Б - менее 200 м.
III - Недостаточность кровообращения в покое (боли в покое или при
IV - Язвенно-некротические изменения конечности.
Степени острой ишемии конечности Таблица 4.
I - Онемение, парестезии, боль в покое или при физической нагрузке.
II - Двигательные расстройства и/или субфасциальный отек:
II А - Парез (ограничение активных движений) ;
II Б - Паралич (отсутствие активных движений) ;
II В - Субфасциальный отек.
III - Контрактура конечности:
III А - Парциальная контрактура;
III Б - Тотальная контрактура.
Тактика ведения больных с острой артериальной окклюзией
Характер артериальной окклюзии
Эмболия
Тромбоз
I
Баллонная ангиопластика и стентирование
Срочная реконструктивная операция
II
А
Б
Экстренное хирургическое восстановление
В
артериального кровотока + фасциотомия
III
Экстренное хирургическое восстановление артериального кровотока + фасциотомия + некрэктомия
Патологическая анатомия лучевой болезни
Костномозговая форма проявляется преимущественным поражением кроветворной ткани (красного костного мозга) и лимфоидных органов (лимфоузлы, селезёнка, MALT-структуры, тимус). В течении заболевания выделяют 4 периода.
1. Период первичной реакции на облучение. В зависимости от величины дозы первичные реакции возникают непосредственно после облучения или через несколько часов. Длительность периода зависит от тяжести поражения: при I степени отсутствует или слабо выражен, при II продолжается 1-2 суток, при III - от нескольких часов до 3-4 суток, при IV степени тяжёлая первичная реакция развивается через несколько десятков минут или в первые два часа после облучения. Первичная реакция сопровождается общей слабостью, изменением центральной нервной системы (возбуждение или сонливость, головная боль, головокружение), сердечной сосудистой системы (сердцебиение, боли в области сердца) и желудочно-кишечного тракта (рвота, тошнота). При облучении в дозе свыше 6 Гр могут развиться менингеальный синдром и очаговые неврологические проявления. При тяжёлом течении костномозговой формы первичная реакция включает радиогенную гиперемию кожи и конъюнктивы. В костном мозге непосредственно после облучения уменьшается количество ядросодержащих кроветворных клеток. В клетках обнаруживаются дистрофические изменения, угнетается их пролиферативная активность. В периферической крови наиболее важным признаком является лимфопения (лимфоциты наиболее радиочувствительны среди форменных элементов крови).
2. Период мнимого благополучия («скрытый» период) характеризуется улучшением состояния больных. Гиперемия кожи (эритема) и конъюнктивы («инъекция склер») исчезают. Однако в периферической крови сохраняется и прогрессирует лимфопения, в костном мозге нарастают гипопластические изменения. Длительность периода зависит от тяжести поражения: в крайне тяжёлых случаях он отсутствует, при тяжёлой форме продолжается 1-2 недели, при I-II степени тяжести - 4-5 недель и более.
3. Период разгара заболевания (выраженных проявлений болезни) характеризуется резким ухудшением состояния больных (кроме крайне тяжёлой формы, при которой первичная реакция без скрытого периода трансформируется в период разгара) и продолжается 1-3 недели. Основным признаком разгара болезни является гипопластическая анемия: в лёгких случаях она проявлятся умеренно выраженной лейкотромбоцитопенией, в тяжёлых - панцитопенией с агранулоцитозом и значительной тромбоцитопенией. Гипопластичекая анемия приводит к развитию иммунодефицита и инфекционных осложнений, вплоть до сепсиса. Инфекционные поражения обусловлены как экзогенными факторами, так и условно-патогенными аутоинфекционными агентами (деструктивный стоматит, некротическая ангина, пневмония, гнойный отит, некротический энтероколит, пиелонефрит, пиодермии). Нередко возникает геморрагический синдром в виде кротечений и кровоизлияний в различные органы и ткани.
Характерными признаками тяжёлого течения костномозговой формы являются выпадение волос, лучевой гастроэнтерит, менингеальный синдром и очаговые поражения головного мозга. Кишечный синдром (лучевой гастроэнтерит), проявляющийся диареей, развивается на второй неделе заболевания (с 10-14-го дня). В ряде случаев отмечается язвенный энтерит с перфорацией стенки и развитием перитонита.
Крайне тяжёлое течение костномозговой формы характеризуется быстрым угнетением кроветворения. В первые дни болезни развиваются геморрагический синдром и инфекционные осложнения, обычно в виде сепсиса, поражения кишечника и головного мозга. Смерть наступает обычно на второй неделе болезни.
4. Восстановительный период длительный, регенерация поражённых тканей происходит медленно (месяцы, годы). Прежде всего нормализуются показатели кроветворения. В костном мозге увеличивается количество кроветворных элементов, усиливается их пролиферативная активность. Сохраняющиеся при этом нарушения функции различных органов обозначаются как ближайшие последствия острой лучевой болезни. Изменения в головном и спинном мозге обозначаются термином лучевой энцефаломиелоз. Через многие годы могут развиться так называемые отдалённые последствия облучения: злокачественные опухоли, катаракта, наследственные дефекты у потомства. Чем выше доза облучения, тем тяжелее ближайшие и отдалённые последствия у выживших больных.
Кишечная форма характеризуется развитием острого радиационного гастроэнтерита. Поражение желудка и кишечника проявляется диареей и неукротимой рвотой, вследствие чего наступает эксикоз. Слизистая оболочка желудка и кишечника изъязвляется. Язвы нередко глубокие, осложняются кровотечением, перфорацией и перитонитом.
При церебральной форме в процесс могут вовлекаться любые отделы головного мозга: кора больших полушарий, базальные ганглии, мозжечок и ствол мозга. Характерен судорожный синдром. При поражении продолговатого мозга смерть наступает от паралича дыхательного и сосудодвигательного центров (бульбарный синдром).
Острая лучевая болезнь при внешнем общем неравномерном облучении. Неравномерное (преимущественно сегментарное) облучение может быть вследствие экранирования части тела человека различными сооружениями или техникой. В клинико-морфологической картине доминируют поражения преимущественно облучаемых критических органов: особенности заболевания зависят от «геометрии облучения» - от распределения по телу лучевой энергии. Особенностью этой формы лучевой болезни является минимальная выраженность изменений костного мозга. Морфологические признаки угнетения кроветворной ткани обнаруживаются только в тех костях, которые были облучены, однако за счёт нормального кроветворения в других костях выраженного костномозгового синдрома, как правило, не формируется.
При облучении преимущественно головы и шеи наблюдается выраженная первичная реакция. Если доза облучения превышает 4-5 Гр возникает гиперемия и отёчность кожи лица, в дальнейшем выпадают брови и ресницы. При облучении в дозе 10 Гр и более развивается отёк головного мозга и язвенно-некротические поражения полости рта и глотки (орофарингеальный синдром). Облучение грудного сегмента тела протекает с минимальными проявлениями первичной реакции, в основном сердечного происхождения (боли, аритмия). Облучение брюшного сегмента тела проявляется выраженной первичной реакцией и клиникой поражения органов брюшной полости, прежде всего кишечника (сегментарный лучевой энтероколит).
Сочетанные лучевые поражения. Сочетанными называют совместное воздействие внешнего гамма-облучения и радионуклидов, попадающих на кожу или внутрь организма. Основными путями проникновения радиоактивных изотопов внутрь организма являются органы дыхания и пищеварения, а также раневые и ожоговые поверхности. При острой лучевой болезни, вызванной сочетанными поражениями, более выражены воспалительные изменения покровных тканей, на которые попадают радионуклиды, менее продолжителен латентный период и существенное удлинение периода выздоровления, развивается более выраженное угнетение кроветворения. Кроме того, инкорпорированные радионуклиды проявляют тропность к определённым органам: почкам (уран), щитовидной железе (йод), костям (стронций, иттрий, цирконий), печени (церий, лантан). Остеотропные элементы приводят к лучевому некрозу кости, развитию злокачественных опухолей, особенно остеосарком и лейкемий. Во внутренних органах с депонированными радионуклидами постепенно нарастают фибропластические изменения и атрофия паренхимы с последующим развитием функциональной недостаточности поражённого органа.
Комбинированные лучевые поражения. Комбинированными называют поражения, вызванные облучением и травмой (механическое воздействие, ожоги, огнестрельное ранение). При этом травматическое и лучевое поражения отягощают друг друга («синдром взаимного отягощения»).
Нейтронные поражения. Острая лучевая болезнь, вызванная нейтронным облучением, в целом проявляется также, как и вследствие воздействия гамма-лучей, тем более, что в патогенезе нейтронного поражения велика роль вторичного гамма-излучения. Однако нейтронное облучение характеризуется значительной неравномерностью. В картине заболевания более выражены поражения желудка и кишечника, в то же время они не всегда являются неблагоприятным признаком прогноза. В тяжёлых случаях наблюдается геморрагическая инфильтрация стенки кишки, ткани брыжейки и мезентериальных лимфатических узлов, развивается эксикоз.
Выраженность первичной реакции обычно не соответствует тяжести поражения: тяжёлые первичные поражения, включая изменения кожи и слизистых оболочек, наблюдаются в относительно благоприятных случаях. Латентный период обычно короче, чем при типичной острой лучевой болезни. Раньше развивается агранулоцитоз и признаки разгара заболевания, включая инфекционные осложнения. В неосложнённых случаях восстановление костного мозга происходит быстро вследствие неравномерности облучения тела нейтронами, поэтому в одних костях развивается выраженное поражение костного мозга, в других оно минимальное. Инфекционные осложнения являются одной из основных причин смерти при нейтронном облучении, но в отличие от типичной острой лучевой болезни они развиваются в основном на фоне тяжёлых местных поражений кожи и слизистых оболочек.
Хроническая лучевая болезнь вследствие равномерного внешнего облучения. Заболевание обычно развивается через 2-5 лет от начала облучения. Клинико-морфологические проявления развиваются медленно и постепенно прогрессируют. При суммарной дозе до 1,0-1,5 Гр заболевание не развивается, при облучении в дозе от 1,0-1,5 до 4-5 Гр возникают лёгкие и среднетяжёлые формы болезни. Суммарная доза более 4-5 Гр ассоциирована с тяжёлым течением заболевания. По степени тяжести различают лёгкую, среднетяжёлую и тяжелую формы хронической лучевой болезни.
Выделяют три стадии заболевания:
1. Период формирования болезни. Основными синдромами хронической лучевой болезни являются кожный (дистрофические изменения кожи, выпадение волос), неврологический, гематологический (апластическая анемия) и геморрагический. Характерна гипофункция половых желёз.
2. Восстановительный период.
3. Период отдалённых осложнений и последствий.
Некоторые авторы добавляют к этим стадиям начальную, характеризующуюся функциональными нарушениями головного мозга.
Лёгкая форма протекает с незначительными изменениями костного мозга и других органов, выздоровление обычно наступает через 7-8 недель после прекращения облучения. При форме средней тяжести ведущим является геморрагический синдром (чаще на коже живота, груди и внутренней поверхности бёдер), гипопластическая анемия, а также атрофические изменения кожи и слизистых оболочек, особенно носоглотки и верхних дыхательных путей. Заболевание протекает длительно, годами, обострения провоцируют неспецифические факторы (инфекция, переутомление). Полное выздоровление после прекращения облучения обычно не наступает. При тяжёлой форме болезни основное значение имеет костномозговой синдром (апластическая анемия), заболевание отличается неуклонно прогрессирующим течением и завершается смертью в результате геморрагических или инфекционных осложнений.
Причины смерти острой лучевой болезнью (на примере «чернобыльских» больных):
1. Лучевая и ожоговая интоксикация (смерть на 11-30 сут) вследствие обширного некроза тканей.
2. Инфекционные осложнения (прежде всего, пневмония и сепсис, часто встречаются микст-инфекции). Смерть наступает после 2-3 нед болезни, особенно фатальны вирусные и микотические инфекции. Причиной инфекционных осложнений является фактическая гибель иммунокомпетентной ткани.
3. Острый респираторный дистресс-синдром (диффузное альвеолярное повреждение) вследствие радиогенного поражения стенок мелких сосудов лёгких и резкого повышения их проницаемости.
4. Геморрагический синдром вследствие радиогенной деструкции стенок кровеносных сосудов и тромбоцитопении (самостоятельного танатогенетического значения, как правило, не имел).
При попытке трансплантации костного мозга больные умирали при явлениях РТПХ (гомологичной болезни) или от генерализованной цитомегаловирусной инфекции, развивавшейся в посттрансплантационном периоде.
Морфология радиационных поражений
Лучевая болезнь - заболевание, развивающееся в результате действия ионизирующего излучения в дозах, превышающих допустимые.
В зависимости от характера воздействия (однократное массивное или длительное повторное в относительно малых дозах) различают соответственно острую и хроническую формы лучевой болезни.
Острая лучевая болезнь
В клиническом течении различают 4 периода:
2. Скрытый (латентный период клинического благополучия).
3. Разгара (выраженных клинических проявлений).
В зависимости от величины поглощенных доз облучения острую лучевую болезнь по тяжести подразделяют на 4 степени:
I степень - легкая (доза 100-200 рад.).
II степень - средняя (200-400 рад.).
III степень - тяжелая (400-600 рад.).
IV степень - крайне тяжелая (более 600 рад.).
В зависимости от уровня доз проявляется в нескольких клинических формах: костномозговая (600-1000 рад), кишечная (1000-2000 рад.), токсемическая (2000-5000 рад.), мозговая (нервная) (более 5000 рад.).
Патологическая анатомия
При микроскопическом исследовании наиболее характерны изменения в органах кроветворения.
В костном мозге быстро развивается аплазия, почти не остается нормальной кроветворной ткани, видны преимущественно элементы стромы и плазматические клетки.
В лимфатических узлах - распад лимфоцитов (в начале - в центральных частях фолликулов, затем - в паракортикальном слое). В период разгара заболевания на фоне резкой гиперемии различимы в основном элементы стромы и плазматические клетки.
В половых железах обнаруживается прекращение митотического деления и распад эпителия яичек, сохраняются лишь отдельные сперматогонии и клетки Сертоли; в яичниках - дистрофические и некротические изменения.
В желудочно-кишечном тракте ранние изменения проявляются деструкцией и подавлением митотической активности клеток эпителия крипт с появлением патологических митозов. В более поздние сроки преобладают расстройства крово- и лимфообращения, язвенно-некротические изменения.
В сердечно-сосудистой системе - диапедезные кровоизлияния, диффузное пропитывание стенок сосудов эритроцитами и явления плазморрагии, дистрофические изменения кардиомиоцитов, кровоизлияния в миокард, под эпикард.
В легких - обнаруживаются изменения, связанные с нарушением кровообращения и инфекционными осложнениями, среди которых особое значение придается алейкоцитарной пневмонии.
В почках - кровоизлияния, в просветах капсул клубочков накапливается белковая жидкость с примесью эритроцитов, отмечаются дистрофические изменения эпителия канальцев.
После лучевого воздействия в летальных дозах в гипофизе наступает дегрануляция хромофильных клеток; в щитовидной железе уменьшаются размеры фолликулов, гипертрофируется фолликулярный эпителий, отмечается вакуолизация и рассасывание коллоида. В коре надпочечников происходит перераспределение жировых включений, в мозговом слое уменьшение количества и иногда полный выход из клеток хромаффинных включений.
В рыхлой соединительной ткани дистрофические изменения, распад клеток, деструкция волокон и межуточного вещества.
Изменения нервной системы проявлются в виде реактивных и деструктивных процессов в сочетании с сосудистыми расстройствами и нарушениями ликворообращения с развитием отека.Типичным для острой лучевой болезни является развитие геморрагического диатеза с кровоизлияниями в кожу, серозные и слизистые оболочки, в паренхиматозные органы.
Причины смерти больных: шок, панцитопения, кровоизлияния в жизненноважные органы , кровотечения, инфекционные осложнения.
Читайте также:
