КТ, МРТ позвоночника при болезни накопления пирофосфата кальция (БНПК)
Добавил пользователь Morpheus Обновлено: 21.01.2026
Первое применение радиоактивных индикаторов относят к 1911 году и связывают с именем Дьердя де Хевеши. Молодой ученый, живший в дешевом пансионе, начал подозревать, что остатки пищи, которые он не доел, подавали ему вновь на следующий день.
Первое применение радиоактивных индикаторов относят к 1911 году и связывают с именем Дьердя де Хевеши. Молодой ученый, живший в дешевом пансионе, начал подозревать, что остатки пищи, которые он не доел, подавали ему вновь на следующий день. Он добавил радиоизотопный индикатор к несъеденной порции и с помощью детектора излучения доказал своей хозяйке, что дело обстояло именно так. Хозяйка выгнала молодого ученого из пансиона. Он же продолжал начатую работу, результатом которой стала Нобелевская премия за использование радионуклидов в качестве индикаторов в биологии Радионуклидная (радиоизотопная) диагностика охватывает все виды применения открытых радиоактивных веществ в диагностических и лечебных целях.
Клиническое применение радиоиндикаторов вошло в практику в 50-х годах. Развиваются методы, позволяющие детектировать наличие (радиометрия), кинетику (радиография) и распределение (сканирование) радиоиндикатора в исследуемом органе. Принципиально новый этап радиоизотопной визуализации связан с разработкой устройств широкого поля зрения (сцинтилляционные гамма-камеры) и метода визуализации — сцинтиграфии. Нередко термином «сцинтиграфия» обозначают исследования, проведенные с использованием как линейного сканера, так и сцинтиляционной гамма-камеры. С этим терминологическим стереотипом связано формирование неверных представлений о диагностических возможностях методов.
Сканирование и сцинтиграфия — это различные методы радиоизотопной визуализации. Сцинтиграфия существенно превосходит сканирование по объему и точности диагностической информации. Современные сцинтилляционные камеры представляют собой компьютеро-сцинтиграфические комплексы, позволяющие получать, хранить и обрабатывать изображения отдельного органа и всего тела в широком диапазоне сцинтиграфических режимов: статическом и динамическом, планарном и томографическом. Независимо от типа получаемого изображения оно всегда отражает специфическую функцию исследуемого органа. По сути, это картирование функционирующей ткани. Именно в функциональном аспекте заключается принципиальная отличительная особенность сцинтиграфии от других методов визуализации. Попытка взглянуть на результаты сцинтиграфии с анатомических или морфологических позиций — еще один ложный стереотип, влияющий на предполагаемую результативность метода.
Диагностическая направленность радиоизотопного исследования определяется используемым радиофармацевтическим препаратом (РФП). Что же такое РФП? Радиофармацевтический препарат — это химическое соединение с известными фармакологическими и фармакокинетическими характеристиками. От обычных фармацевтических средств он отличается не только радиоактивностью, но и еще одной важной особенностью — количество основного вещества настолько мало, что при введении в организм не вызывает побочных фармакологических эффектов (например, аллергических). Специфичность РФП по отношению к определенным морфофункциональным структурам определяет его органотропность. Понимание механизмов локализации РФП служит основой для адекватной интерпретации радионуклидных исследований. Введение РФП связано с небольшой дозой облучения, неспособной вызвать какие-либо неблагоприятные специфические эффекты. В этом случае принято говорить об опасности переоблучения, однако при этом не учитываются темпы развития современной радиофармацевтики.
Лучевая нагрузка определяется физическими характеристиками радиоиндикатора (период полураспада) и количеством введенного РФП. Сегодняшний день радионуклидной диагностики — использование короткоживущих радионуклидов. Наиболее популярным из них является технеций-99m (период полураспада — 6 часов). Этот искусственный радионуклид получают непосредственно перед исследованием из специальных устройств (генераторов) в форме пертехнетата и используют для приготовления различных РФП. Величины радиоактивности, вводимые для проведения одного сцинтиграфического исследования, создают уровни лучевой нагрузки в пределах 0,5-5% допустимой дозы. Важно подчеркнуть — длительность сцинтиграфического исследования, количество получаемых изображений или томографических срезов уже не влияют на «заданную» дозу облучения.
l Клиническое применение
Коротко остановимся на реальных диагностических возможностях наиболее распространенных («рутинных») сцинтиграфических исследований.
Визуализация костной системы (остеосцинтиграфия) — наиболее точный метод выявления участков нарушенного костного метаболизма. Остеотропные РФП (Тс-фосфонаты) обладают высоким сродством к кристаллам фосфата кальция, поэтому они связываются преимущественно с минеральным компонентом костной ткани. Уровень накопления РФП в различных типах костей и участках скелета обусловлен степенью остеобластической и метаболической активности, величиной кровотока, что необходимо учитывать при дифференциации нормального и патологического накопления РФП. В частности, повышенное накопление РФП наблюдается в метаэпифизарных отделах трубчатых костей, в областях с постоянной физической нагрузкой.
Заболевания костей сопровождаются патологической перестройкой костной ткани, реактивным или опухолевым костеобразованием — основными механизмами, обусловливающими изменение костного метаболизма и накопление остеотропных РФП в пораженных отделах. В зависимости от сочетания указанных процессов возрастает уровень накопления остеотропных РФП при опухолевых, воспалительных, дегенеративных, травматических заболеваниях.
Основная и наиболее ответственная задача остеосцинтиграфии — поиск метастатических и оценка распространенности опухолевых поражений скелета. Сцинтиграфическая манифестация патологии может проявиться на 3-12 месяцев раньше, чем появятся рентгенологические признаки. Связано это с тем, что локальное изменение обмена остеотропных РФП возникает на ранних фазах развития патологии, еще до появления не только рентгенологической, но и клинической симптоматики. По этой причине радионуклидное исследование обладает наибольшей эффективностью в до- и послеоперационном обследовании больных опухолями с высокой частотой метастазирования в кости (молочная железа, легкие, предстательная железа, почки).
| Рисунок 1. Остеогенная саркома бедра. Обширная область высокого накопления РФП в дистальном отделе левого бедра |
Сцинтиграфическая манифестация метастатических поражений — множественные и реже одиночные локальные зоны высокого накопления РФП («горячие» очаги). Наиболее высокие концентрации РФП отмечаются в остеобластических и смешанных метастазах, низкие — в остеолитических. Ложноположительные ошибки чаще всего связаны с выраженными остеодистрофическими изменениями, а также с травматическими повреждениями ребер и позвоночника. Опухоли костей остеогенного происхождения отличаются наиболее высокой кумуляцией РФП. Например, остеогенная саркома отличается выраженной гиперфиксацией РФП не только в элементах самой опухоли, но и в окружающих мягких тканях за счет реактивной гиперемии (рис. 1). В опухолях неостеогенного происхождения накопление РФП более низкое. Однако практически не представляется возможным дифференцировать отдельные виды опухолей по степени накопления в них РФП. Некоторые опухоли, так же как и их метастазы, могут быть накоплением РФП. К таким опухолям относится, в частности, ретикулосаркома и множественная миелома. Визуализация почек (динамическая реносцинтиграфия) — простой и точный метод одновременной оценки функционального и анатомотопографического состояния мочевыводящей системы. В основу положена регистрация транспорта нефротропного РФП и последующий расчет параметров, объективизирующих два последовательных этапа.
Анализ сосудистой фазы (ангиофазы) направлен на оценку симметричности прохождения «болюса» по почечным артериям и относительных объемов крови, поступающих к каждой почке в единицу времени. Анализ паренхиматозной фазы предусматривает характеристику относительной функции почек (вклад в суммарную очистительную способность) и времени прохождения РФП через каждую почку или ее отделы. Клиническая интерпретация в значительной степени определяется механизмом элиминации РФП. В методах динамической визуализации могут быть использованы два вида РФП:
l гломерулотропные (производные ДТПА), практически полностью фильтруются клубочками и отражают состояние и скорость клубочковой фильтрации;
l тубулотропные (аналоги гиппурана) секретируются эпителием проксимальных канальцев и отражают состояние канальцевой секреции, а также эффективного почечного кровотока. Показания к исследованию включают урологическую и нефрологическую патологию, а также заболевания, где почки являются органами-мишенями.
При различных клинических ситуациях может меняться как форма кривых, так и их количественные характеристики. Следует, однако, подчеркнуть, что характер и величины изменений малоспецифичны для конкретной патологии и прежде всего отражают тяжесть патологического процесса. Наибольшая информативность реносцинтиграфии проявляется при дифференциации одно- или двустороннего поражения почек.
Ведущий признак, определяющий сторону поражения, — асимметрия амплитудно-временных характеристик ангионефросцинтиграмм. Асимметрия сосудистых параметров, и прежде всего выраженная разница времени поступления РФП в почечные артерии, — один из критериев стеноза почечной артерии. Симметричность изменений паренхиматозной функции более характерна, в частности, для гломерулонефрита; асимметрия — довольно постоянный признак пиелонефрита не только при одно-, но и при двустороннем процессе. Аналогичные изменения могут сопровождать различные варианты аномалий почек и верхних мочевых путей (нефроптоз, удвоение собирательной системы, гидронефроз).
В основе метода визуализации печени (гепатосцинтиграфии) лежит использование меченых коллоидов, которые после внутривенного введения фагоцитируются и распределяются в морфофункциональных структурах, содержащих клетки РЭС в соответствии с локальными значениями органного кровотока. В норме в печени локализуется более 90%, в селезенке — около 5%, а в костном мозге — менее 1% введенного радиоколлоида. В зависимости от характера и тяжести патологии эти соотношения меняются. Наиболее общим показанием к гепатосцинтиграфии является гепато- и/или спленомегалия неясного генеза. Основная задача исследования — дифференциация характера и уточнение тяжести поражения печени.
Диффузные заболевания печени манифестируются изменением размера и формы изображения, распределения радиоколлоида в печени и его внеорганного накопления, параметров фагоцитарной способности РЭС и печеночного кровотока. Следует подчеркнуть, что исследование не позволяет дифференцировать клинические или клинико-морфологические формы заболевания печени (например, хронический гепатит). Наибольшая информативность метода проявляется в возможности выявления синдрома портальной гипертензии (СПГ).
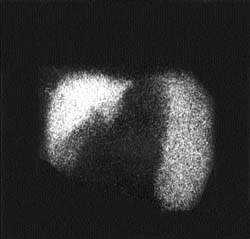 |
| Рисунок 2. Внепеченочная блокада портального кровообращения. Синдром портальной гипертензии манифестируется высоким захватом радиоколлоида увеличенной селезенкой |
Независимо от причин повышенного давления в системе воротной вены (внутри- или внепеченочные формы), сцинтиграфически СПГ манифестируется высоким захватом радиоколлоида и увеличенной селезенкой. Сочетание указанных признаков позволяет выявить СПГ с точностью до 98% (рис. 2). Очаговые поражения печени в зависимости от их распростаненности проявляются наличием одиночных или множественных дефектов накопления РФП в пределах одной или обеих долей печени (рис. 3). В практике нередко выявление участков, где отсутствует накопление РФП («холодные» очаги), прочно ассоциируют с объемными процессами, чаще всего опухолевого генеза. Это представление ложно. Достаточно широкий спектр заболеваний, связанных с вовлечением печени в патологический процесс, сцинтиграфически может манифестировать очаговыми изменениями как следствием локальных гемодинамических или функциональных нарушений (цирроз печени, амилоидоз, гистиоцитоз). Необходимо также помнить, что некоторые органные структуры (аномально расположенный желчный пузырь, молочная железа) могут «экранировать» изображение печени и формировать сцинтиграфический феномен «псевдоопухоли». Именно поэтому по характеру дефекта накопления РФП без учета клинической информации практически невозможно дифференцировать специфику очагового поражения.
A.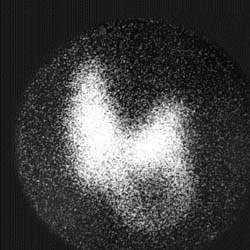 | B.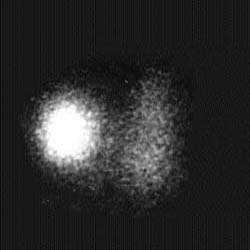 |
| Рисунок 3. Сцинтиграфические варианты узловых поражений щитовидной железы. «Холодный» узел нижнего отдела левой доли — коллоидная киста (А), «горячий» узел правой доли — тиреотоксическая аденома (Б) | |
Возможность выявления очаговой патологии зависит и от разрешающей способности гамма-камеры. Очаги менее 1 см, как правило, сцинтиграфически не манифестируются.
Визуализация желчевыделительной системы (гепатохолесцинтиграфия) основана на использовании серии гепатотропных РФП, аналогичных по своей фармакокинетике красителям (бромсульфалеин, вофавердин). После внутривенного введения они связываются с белками крови, поглощаются полигональными клетками печени и выводятся в составе желчи. Основным преимуществом гепатохолесцинтиграфии является непрерывность визуальной и количественной регистрации процесса кинетики РФП.
Визуальный анализ серии изображений позволяет выявить некоторые органические изменения желчных протоков (расширение), желчного пузыря (деформации), а также функциональные изменения двенадцатиперстной кишки.
Анализ кривых позволяет получить количественные критерии, характеризующие поглотительно-выделительную функцию печени, наполнение желчного пузыря, длительность латентного периода после желчегонного завтрака, скорость опорожнения желчного пузыря. Дискинезии желчного пузыря дифференцируются на основе изменения скорости его опорожнения (гипо- или гипермоторная дискинезия). Следует подчеркнуть, что точность радиологической оценки двигательной функции желчного пузыря превышает рентгенологическую или эхографическую. Это связано с тем, что при сравнении площадей изображения органа до и через фиксированное время после желчегонного завтрака практически невозможно учесть длительность латентного периода желчеотделения и выделить собственно фазу опорожнения желчного пузыря.
Гепатохолесцинтиграфия имеет ограниченное значение в диагностике воспалительной патологии и камней желчного пузыря. Первоочередная задача заключается в оценке тяжести нарушения проходимости шеечно-протоковой зоны и наполнения желчного пузыря. При полной обтурации пузырного протока возникает сцинтиграфический феномен «отключенного желчного пузыря».
Визуализация щитовидной железы (тиреосцинтиграфия) проводится с использованием Тс-пертехнетата и основывается на сходстве в поведении ионов йода и пертехнетата. Однако это сходство прослеживается только на начальной неорганической фазе внутритиреоидного транспорта. Пертехнетат, в отличие от йода, не переходит в органическую фазу, то есть не включается в состав тиреоидных гормонов. Эта особенность исключает возможность его использования при послеоперационном поиске метастазов рака щитовидной железы (последнее проводится только с радиоактивным йодом).
Узловые поражения щитовидной железы и дифференциальная диагностика выявленных клинически или эхографически узловых образований шеи — наиболее частое показание к тиреосцинтиграфии. Основная задача исследования — оценить степень функционирования узлов, идентифицировать солитарные или множественные образования, установить связь узлов с тиреоидной тканью. В зависимости от функциональной активности и степени накопления радиопертехнетата узлы традиционно разделяют на «горячие», «теплые» и «холодные». Однако такое деление относится только к их сцинтиграфической оценке.
Под термином «горячий» узел подразумевают ситуацию, когда РФП накапливается почти исключительно в области узла и не накапливается в других отделах органа. Подобные находки характерны для автономной тиреоидной ткани, токсической аденомы, аутоиммунного тиреоидита, врожденной аплазии доли. Отсутствие накопления РФП в окружающий узел ткани объясняется продукцией автономным узлом тиреоидных гормонов, уменьшающих выделение ТТГ и обусловливающих подавление функции нормальной ткани.
Функционально неактивные («холодные») узлы характеризуются отсутствием или резким снижением накопления радиопертехнетата. Эта менее специфическая находка сопровождает широкий спектр патологии: узловой зоб, коллоидные кисты, аденому, неспецифический струмит, в 15-25% случаев — рак щитовидной железы (рис. 3).
Наибольшие затруднения представляет идентификация «теплых» узлов. Эти узлы рассматривают как разновидность «горячих», но в отличие от последних в них отсутствует или слабо выражено функциональное подавление нормальной тиреоидной ткани. В силу этого накопление РФП в узлах может не отличаться от окружающей паренхимы и приводить к ложноотрицательным трактовкам данных сцинтиграфии.
Болезнь депонирования кристаллов пирофосфата кальция
Общие рекомендации
1. Оптимальная терапия депонирования кристаллов пирофосфата кальция (ПФК) требует как фармакологических, так и нефармакологических подходов и должна учитывать: клинические проявления (бессимптомное течение, острый артрит, хронический артрит или ОА с кристаллами ПФК), общие факторы (возраст, сопутствующие болезни), наличие предрасполагающих заболеваний (уровень доказательности IV).
Комментарий. Терапия болезни депонирования кристаллов пирофосфата кальция (БДПК), как и терапия подагры, варьирует в зависимости от проявлений болезни. К примеру, бессимптомный хондрокальциноз лечения не требует, а острый артрит из-за выраженной болезненности суставов необходимо купировать как можно быстрее. (4, 27).
3. Нестероидные противовоспалительные препараты (НПВП) перорально (при необходимости с гастропротективной терапией) и низкие дозы колхицина (0,5 мг 3-4 раза в день с или без начальной дозы в 1 мг) являются эффективными подходами к терапии острого артрита, вызванного депонированием кристаллов ПФК, тем не менее, их использование, зачастую, лимитируется токсичностью и наличием коморбидности, особенно у пожилых. Уровень доказательности Ib (побочные эффекты) и IIb (эффективность).
Комментарий. Доказательства рациональности применения НПВП и колхицина приведены по аналогии с острым артритом при подагре. Классические способы применения колхицина (1 мг, далее по 0,5 мг каждые 2 ч до наступления побочных эффектов или выздоровления) устарели и не могут использоваться из-за осложнений, наступающих в 100% случаев. Эффективность и безопасность применения низких доз колхицина при подагре доказана, и экстраполирована экспертами на острый артрит при БДПК. Длительность терапии зависит от эффекта и развития нежелательных явлений (3, 17, 27, 32).
4. Короткий курс пероральных ГК или адренокортикотропного гормона перорально/парентерально может быть эффективен при остром артрите с кристаллами ПФК в случае отсутствия ответа на внутрисуставное введение ГК и также является альтернативой колхицину и/или НПВП (уровень доказательности IIa для парентеральных ГК и III для АКТГ парентерально).
Комментарий. Ведение острого артрита с кристаллами ПФК у пожилых, а также у больных с сопутствующими заболеваниями и противопоказаниями к применению НПВП и колхицина, может представляться непростой. В таких случаях альтернативой могут являться внутрисуставное введение ГК у больных моно- и олигоартритом или ГК (перорально/парентерально) у больных полиартритом. Не отмечено значительной разницы в эффективности между внутримышечными и внутривенными инъекциями (19, 20).
5. Профилактика частых атак артрита с кристаллами ПФК может проводится низкими дозами колхицина (0,5-1 мг ежедневно) или низкими дозами НПВП (с гастропротективной терапией при необходимости). Уровень доказательности IIb для колхицина и IV для НПВП.
Комментарий. Была проведена единственной работа, в которой было показано, что у 10 больных, принимавших колхицин в низких дозах в течение 1 года, количество острых приступов снизилось с 32 до 10. Работ, в которых исследовали бы профилактический эффект НПВП, не проводилось (3,21,27).
6. Ведение и лечение больных с ОА с кристаллами ПФК такое же, как и без них (уровень доказательности Ia).
Комментарий. Терапия ОА с кристаллами ПФК должна строиться по тем же принципам, что и терапия ОА:
- разъяснение больным сути болезни и ее лечения;
- уменьшение боли и скованности суставов;
- поддержание суставной функции;
- уменьшение инвалидности;
- улучшение качества жизни;
- уменьшение прогрессирования поражения суставов.
ОА с кристаллами ПФК отличается от неосложненного ОА выраженностью воспалительных реакций и большим количеством пораженных суставов, в целом терапевтическая тактика при этих заболеваниях признана одинаковой (4,10,27,33-39).
7. При хроническом воспалительном артрите терапия включает прием НПВП (при необходимости на фоне гастропротективной терапии), колхицин (0,5—1 мг в день), низкие дозы ГК, метотрексат и гидроксихлорохин (уровень доказательности Ib для колхицина и гидроксихлорохина, III для метотрексата и IV для НПВП и ГК).
Комментарий. Для НПВП при болезни депонирования кристаллов ПФК нет данных, полученных в РКИ, поэтому рекомендация по применению НПВП вновь экстраполирована по аналогии с подагрой и ОА. Одно двойное слепое плацебо-контролируемое исследование, посвященное сравнению эффективности низких доз колхицина, было предпринято у пациентов с гонартрозом и кристаллами ПФК с персистирующими признаками воспаления. Количество больных, которых необходимо было пролечить (NNT) колхицином до достижения 30% уменьшения боли по ВАШ, достоверно отличалось от плацебо. Многоцентровое исследование не подтвердило преимущества низких доз метотрексата (15 мг) перед плацебо. По данным 6-месячного плацебо-контролируемого РКИ, в котором изучали эффективность гидроксихлорохина у 36 больных с хроническим артритом., клинический ответ был определен как процент больных с более чем 30% уменьшением суставного счета боли и припухлости (NNT=2; 95% ДИ 1-7). Значимых нежелательных явлений не наблюдалось. В настоящий момент рекомендация по применению низких доз ГК основана исключительно на мнении экспертов, РКИ не проводились (3,4,12-14,27,36,41).
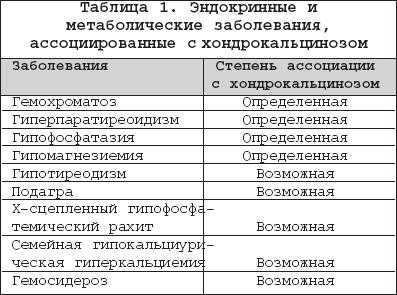
8. При выявлении сопутствующих заболеваний, таких как первичный гиперпаратиреоидизм, гемохроматоз или гипомагниемия, должно проводиться соответствующее лечение (уровень доказательности IV).
Комментарий. У больных с БДПК в 3 раза чаще встречаются первичный гиперпаратиреоидизм, а также гемохроматоз и гипомагниемия. Полагают, что больные с первичным гиперпаратиреоидизмом имеют повышенный риск острых атак артрита, вызванных кристаллами ПФК. Терапия сопутствующих заболеваний является обязательной и должна проводиться согласно стандартам для каждого из этих заболеваний. Однако, каким образом влияет и влияет ли в принципе терапия сопутствующих заболеваний на течение и исходы собственно БДПК, остается неясным (2,42-45).
9. В настоящее время не известна терапия, модифицирующая формирование или растворяющая кристаллы ПФК. Бессимптомное депонирование кристаллов ПФК не является показанием для терапии (уровень доказательности IV) (24,46-50)
КТ, МРТ позвоночника при болезни накопления пирофосфата кальция (БНПК)
В статье представлен обзор литературы, посвященный применению радиоизотопных методов диагностики в ревматологии с начала 1970-х гг. и до наших дней. Особое внимание уделено вопросам ранней и дифференциальной диагностики болей в спине (в т. ч. болей воспалительного характера, а также сакроилеита, анкилозирующего спондилита, инфекционного спондилита). Представлены возможности оценки активности артритов и спондилоартритов, в т. ч. в динамике, осуществления контроля эффективности лечения; прогнозирования течения ряда артритов и их возможной диагностики. В обзоре показано место сцинтиграфии в оценке состояния перфузионно-метаболических процессов при заболеваниях опорно-двигательного аппарата у детей. Отражены возможности динамической остеосцинтиграфии с Тс-99m пирофосфатом для оценки минерализации кости в дифференциальной диагностике у пациентов со сниженной минеральной костной плотностью. Освещен вопрос применения радиоизотопных методов в диагностике системных воспалительных и аутоиммунных заболеваний с использованием новых технологий в ядерной медицине (ОФЭКТ, ОФЭКТ/КТ, ПЭТ) и новых радиофармпрепаратов. Важное место в статье занимают диагностические возможности относительно редких заболеваний опорно-двигательного аппарата (остеонекроз, синдром SAPHO, болезнь Педжета, болезнь Эрдгейма - Честера, остеогенная фибродисплазия и др.) с помощью остеосцинтиграфии с Тс-99m
.
Ключевые слова: остеосцинтиграфия, Тс-99m пирофосфат, оценка активности артритов, контроль лечения, редкие заболевания опорно-двигательного аппарата.
Radionuclide methods in rheumatology
Prokhorova E.G. 1 , Zhilyaev G.E. 2 , Zhilyaev E.V. 3
1 Chief Clinical Hospital of the Ministry of Internal Affairs, Moscow
2 A.I. Evdokimov Moscow State University of Medicine and Dentistry
3 European Medical Center, Moscow
The paper reviews radionuclide methods used to diagnose rheumatic disorders from early 1970s till present days. Early diagnosis and differential diagnosis of back pains (including inflammatory pains, sacroiliitis, ankylosing spondylitis, and infectious spondylitis) are highlighted. The (dynamic) assessment of arthritis and spondyloarthritis activity, treatment efficacy monitoring, the prediction of arthritis course and their potential diagnosis are uncovered. The paper demonstrates the role of scintigraphy in the assessment of perfusion and metabolism in pediatric musculoskeletal disorders. Dynamic bone scintigraphy with Тс-99m pyrophosphate which assesses bone mineralization is useful in differential diagnosis of reduced mineral bone density. The role of radionuclide methods in the diagnosis of systemic inflammatory and autoimmune disorders using novel technologies of nuclear medicine (SPECT, SPECT/CT, PET) and radiopharmaceuticals is highlighted. Bone scintigraphy with Тс-99m is of special importance for the diagnosis of relatively rare musculoskeletal disorders (i.e., osteonecrosis, SAPHO syndrome, Paget's disease, Erdheim-Chester disease, osteogenic fibrodysplasia etc.).
Key words: bone scintigraphy, Тс-99m pyrophosphate, assessment of arthritis activity, treatment monitoring, rare musculoskeletal disorders.
For citation: Prokhorova E.G., Zhilyaev G.E., Zhilyaev E.V. Radionuclide methods in rheumatology // RMJ. 2016. № 22. P. 1470-1475.
В статье представлен обзор литературы, посвященный использованию радиоизотопных методов в ревматологии
В начале 1970-х гг. началось применение меченных технецием фосфатсодержащих препаратов для получения изображения скелета [1]. Метод быстро нашел применение в диагностике костных метастазов злокачественных новообразований. Уже через несколько лет было обнаружено повышенное накопление этих радиофармпрепаратов (РФП) в области воспаленных суставов при артрите и крестцово-подвздошных сочленений (КПС) при сакроилеитах различного генеза [2, 3]. Эти публикации можно считать первыми упоминаниями об использовании радиоизотопных методов в диагностике ревматических заболеваний. В дальнейшем количество исследований в этой области быстро нарастало. Расширялся спектр заболеваний, при которых радиоизотопные методы обеспечивали критически важную информацию, внедрялись новые РФП. В течение последних 10 лет наблюдается увеличение интереса к проблеме 6. Это связано как с новыми технологиями в ядерной медицине - появились однофотонная эмиссионная компьютерная томография (ОФЭКТ), однофотонная эмиссионная компьютерная томография, совмещенная с компьютерной томографией (ОФЭКТ/КТ), позитронно-эмиссионная томография (ПЭТ), так и с новыми РФП.
Радиоизотопные методы в диагностике и дифференциальной диагностике заболеваний позвоночника
Повышение накопления различных препаратов на основе фосфата в области КПС при сакроилеитах продемонстрировано в ряде исследований [2, 11]. Так, в исследовании Ian M. было показано, что повышенное накопление РФП в КПС может предшествовать появлению рентгенологических признаков сакроилеита у пациентов с определенным анкилозирующим спондилитом. Кроме того, метод позволяет выявить сакроилеит у пациентов с другими формами заболеваний суставов и позвоночника [11]. В исследовании Rothwell R.S. et al. количественная сцинтиграфия КПС позволила выявить признаки сакроилеита у 40% женщин с хроническими болями в нижней части спины. При этом показано, что в большинстве случаев эти сакроилеиты регрессировали со временем [12]. Усовершенствованная радионуклидная методика ОФЭКТ/КТ позволяет дополнительно улучшить эффективность и точность выявления сакроилеита у пациентов со спондилоартритами. Значительным преимуществом сцинтиграфии является способность с высокой специфичностью и чувствительностью выявлять целый ряд поражений позвоночника, которые, как правило, приходится дифференцировать в реальной практике при болях в спине. К таким заболеваниям и состояниям можно отнести костные метастазы (чувствительность - 74-97%, специфичность - 64-93%), спондилиты (чувствительность - 90%, специфичность - 78%); анкилозирующий спондилит (чувствительность - 26-45%, специфичность - 100%) [13]. Кроме того, с высокой точностью могут диагностироваться дисциты [14], компрессионные переломы позвонков [14]. Таким образом, сцинтиграфические методы (планарная сцинтиграфия, ОФЭКТ, ОФЭКТ/КТ) могут использоваться при дифференциальной диагностике болей в спине, особенно боли воспалительного типа, а также при подозрении на сакроилеит, анкилозирующий спондилит, инфекционные спондилиты.
Радиоизотопные методы в диагностике и дифференциальной диагностике артритов
Воспаление сустава сопровождается усилением кровотока в синовиальной оболочке, повышением метаболической активности околосуставной кости, накоплением клеток воспаления в области сустава. Эти процессы потенциально могут быть выявлены с помощью радиоизотопных методов. Преимуществом сцинтиграфии перед физикальным обследованием сустава является более высокая чувствительность. Так, при различных полиартритах продемонстрировано повышенное накопление пирофосфата, меченного Tc-99m, в т. ч. в суставах, в которых не отмечалось ни спонтанной боли, ни пальпаторной болезненности, ни припухлости [15]. Ввиду того, что радионуклидный метод позволяет оценить истинную вовлеченность всех суставов тела при полиартрите, он может быть использован для дифференциальной диагностики. Так, было показано, что количественная оценка накопления пирофосфата, меченного Tc-99m, в различных суставах позволяет с высокой точностью различать такие заболевания, как ревматоидный артрит (РА), псориатический артрит, периферическую форму анкилозирующего спондилита, артриты, ассоциированные с инфекциями, и остеоартроз (ОА) [16].
Lopes F.P.P.L. et al. [17] использовали сцинтиграфию с Тс-99m анти-СD3 (антитела, связывающиеся с Т-лимфоцитами) для оценки 2044 суставов у 77 пациентов с РА, ювенильным идиопатическим артритом, ОА и подагрическим артритом. Клиническая оценка состояла из лабораторных анализов, обследования на воспаление суставов (боль и/или отек), для пациентов с РА проведена оценка активности заболевания 28 суставов. Авторами были установлены критерии диагностики вышеперечисленных ревматических заболеваний на основе накопления Тс-99m анти-СD3. Возможность визуализации воспаленных суставов была продемонстрирована и при использовании в качестве РФП меченного Тс-99m человеческого поликлонального иммуноглобулина [9].
Для диагностики РА с успехом был использован и РФП на основе антител к фактору некроза опухоли α (ФНО-α). Так, в исследовании Roimicher L. et al. [18] в результате сцинтиграфии 198 суставов пациентов с РА и здоровых была отмечена высокая диагностическая точность: чувствительность и специфичность составили 89,8 и 97,3% соответственно. Результаты проведенной сцинтиграфии показали высокую корреляцию с признаками воспаления, выявленными с помощью МРТ кистей и запястий, у пациентов с активным РА и продемонстрировали лучшую чувствительность, чем клинический осмотр.
Kim J.Y. et al. [19] показали, что сцинтиграфическое выявление субклинических артритов может повысить чувствительность критериев диагностики РА (ACR/EULAR 2010). Диагностическая значимость радионуклидного метода при РА представляется особенно высокой с учетом того обстоятельства, что на очень ранней стадии заболевания он позволяет выявлять вовлечения суставов, не видимые при МРТ. Это было показано Buchbender C. [5] с использованием ОФЭКТ повышенного разрешения с Тс-99m дикарбоксипропандифосфонатом. По данным этого исследования, у 84,2% пациентов на ранней стадии изменений при проведении МРТ выявлено не было, хотя накопление РФП было повышено.
Радиоизотопный метод может быть полезен в диагностике ряда специфических артритов. Так, было продемонстрировано, что сцинтиграфия может с успехом применяться для диагностики бруцеллезного артрита у детей (особенно поражений тазобедренных суставов и КПС) и оказывается в этой ситуации более информативным методом, чем рентгеновское исследование [20].
ОА в соответствии с современным пониманием проблемы также является воспалительным заболеванием. Этим объясняется тот факт, что пораженные ОА суставы накапливают РФП точно так же, как и суставы при артритах.
Так, в исследовании Kim J.-Y. et al. [21] было изучено 44 височно-нижнечелюстных сустава (ВНЧС) при сцинтиграфии скелета. В тех случаях, которые клинико-рентгенологически были диагностированы как ОА ВНЧС, показатели накопления РФП в суставах были повышены. Чувствительность и специфичность метода в отношении выявления ОА ВНЧС составили 72,2 и 57,7% соответственно. При ОА коленных суставов учет локализации и выраженности накопления РФП позволяет не только диагностировать заболевание, но и прогнозировать его течение [22].
Применение радиоизотопных методов для оценки активности артритов
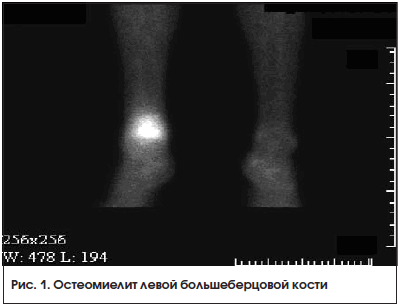
По данным зарубежных авторов [28], 3-фазная сцинтиграфия костей скелета с Тс-99m гидроксиметилендифосфонатом или с Тс-99m метилендифосфонатом в течение многих лет является стандартной методикой в диагностике остеомиелита. Чувствительность метода превышает 80%, а специфичность составляет около 50%. Низкую специфичность можно объяснить накоплением РФП во всех участках повышенного метаболизма костной ткани, независимо от основной причины. Однако комбинация ОФЭКТ и КТ повышает специфичность до 80%, а ОФЭКТ/КТ с меченными Тс-99m лейкоцитами обеспечивает чувствительность и специфичность до 90%. Чувствительность и специфичность ПЭТ с 18F-ФДГ достигает 81 и 91% соответственно.
Использование радиоизотопных методов для оценки метаболизма кости
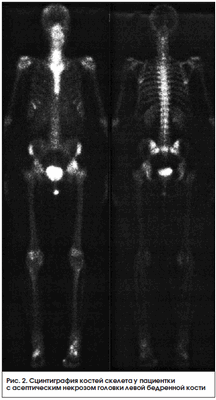
Сцинтиграфия активно используется в оценке состояния перфузионно-метаболических процессов при заболеваниях опорно-двигательного аппарата у детей. Так, по данным отечественных авторов, она выходит на 1-е место и составляет до 1/3 всех радионуклидных исследований, за рубежом эта цифра достигает 60% [29]. Остеосцинтиграфия обладает высокой чувствительностью к любым патологическим изменениям в кости. Недостатком этого метода является низкая специфичность из-за тропности РФП в участках скелета с высоким остеогенезом, однако диагностическую ценность метода можно повысить с помощью полифазной остеосцинтиграфии, позволяющей оценить не только костный, но и мягкотканный компонент. Особенно этот метод информативен при диагностике дистрофических поражений скелета, в т. ч. болезни Легга - Кальве - Пертеса, которая встречается только у детей и подростков и составляет 25-30% среди заболеваний тазобедренного сустава. Ранняя диагностика состояния кровообращения в области пораженного тазобедренного сустава необходима для выбора консервативного лечения и влияет на прогноз заболевания. Также этот метод информативен при аваскулярном некрозе взрослых, особенно у пациентов с длительным болевым синдромом при отрицательной рентгенологической картине (рис. 2).
Динамическая остеосцинтиграфия с Тс-99m пирофосфатом, как было ранее показано нами, может быть использована для оценки минерализации кости [30]. В отличие от денситометрии метод количественно оценивает не минеральную костную плотность (которая зависит как от плотности кости, так и от ее минерализации), а именно насыщенность кости кристаллами гидроксиапатита. Метод характеризует состояние кальциевого обмена и может быть полезным в дифференциальной диагностике у пациентов со сниженной минеральной костной плотностью.
Радиоизотопные методы в диагностике системных воспалительных и аутоиммунных заболеваний
Динамическая сцинтиграфия слюнных желез с Tc-99m- пертехнетатом уже давно применяется в диагностике синдрома Шегрена. Sanja Dugjnjic et al. сравнивали ее с сиалометрией [7]. По их данным, чувствительность динамической сцинтиграфии - 100%, специфичность - 80%, отрицательное прогностическое значение - 100%, положительное прогностическое значение - 91%. Чувствительность сиалометрии составила 75%. Результаты сцинтиграфии слюнных желез включены в классификационные критерии болезни Шегрена.
Височный артериит достаточно распространен у пожилых людей. Диагностика этого заболевания относительно проста, когда имеются типичные симптомы и положительная биопсия височных артерий. Однако только половина пациентов имеет положительные результаты биопсии. Другие диагностические методы, такие как допплеровская цветная сонография или ангиография поверхностной сонной артерии, не помогут отличить воспалительный или невоспалительный характер поражения височной артерии и могут быть полезными только в опытных руках. T. Reitblat et al. [31] провели 9 пациентам ОФЭКТ с Ga-67. У всех пациентов было повышено накопление галлия в височной области черепа по сравнению с контрольной группой.
Внедрение ПЭТ значительно повысило диагностические возможности ядерной медицины, в т. ч. и в диагностике васкулитов [28]. Так, ПЭТ с 18F-ФДГ имеют чувствительность при обнаружении васкулита крупных артерий более 80%. У пациентов с лихорадкой неясного генеза по результатам ПЭТ васкулит диагностируется в 17% случаев.
У пациентов с болезнью Хортона накопление 18F-ФДГ в крупных артериях было обнаружено примерно у 30% больных, в то время как увеличение накопления в плечах и бедрах наблюдалось у 94 и 89% соответственно. Следует отметить, что накопление в проксимальных мышцах характерно и для ревматической полимиалгии.
Радиоизотопные методы в диагностике редких заболеваний
Пахидермопериостоз
Alaya Z. et al. [32] собрали в течение 14 лет 6 случаев. Всем больным была проведена сцинтиграфия костей скелета, у всех пациентов наблюдалось повышенное накопление РФП в длинных трубчатых костях и КПС. Насколько эти сцинтиграфические признаки патогномоничны для данной нозологии, можно будет судить в дальнейшем с увеличением количества наблюдений.
Синдром SAPHO
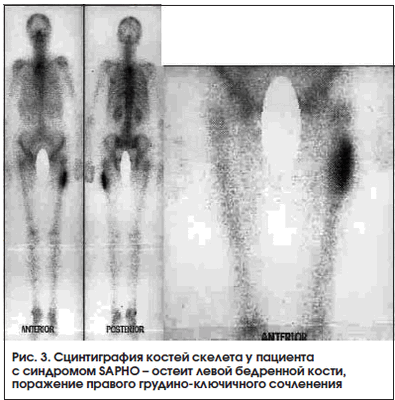
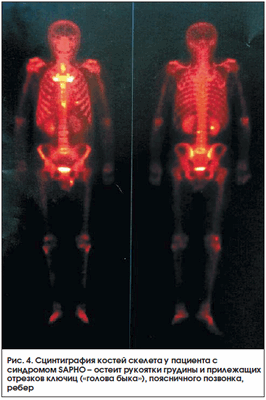
Синдром SAPHO (Synovitis, Acne, Pustulosis, Hyperostosis, Osteitis) характеризуется кожными проявлениями (ладонно-подошвенный пустулез и/или тяжелое акне) и изменениями в костях (остеит) и суставах (артриты). Данный синдром в связи с множественностью жалоб, разнообразием клинических и рентгенологических проявлений в костной системе может диагностироваться с большим запозданием. Сцинтиграфия костей скелета во многих случаях является методом, дающим достаточную информацию для постановки диагноза. Наибольшее накопление РФП при сцинтиграфии отмечается в зонах усиленного метаболизма кости (остеит) - обычно в костях, образующих грудино-ключичные («голова быка») и грудино-реберные сочленения [33]. Весьма специфичен высокий уровень накопления в трубчатых костях, что чаще встречается у детей (рис. 3, 4).
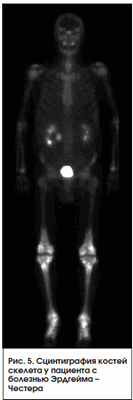
Болезнь Эрдгейма - Честера
Является редким заболеванием. Может рассматриваться как опухолевое или воспалительное заболевание и характеризуется инфильтрацией органов нелангенгарсовыми гистиоцитами. Чаще всего не диагностируется, хотя имеет патогномоничную сцинтиграфическую картину. При сцинтиграфии всего тела c Тс-99m выявляется симметричное повышение накопления РФП в концах длинных трубчатых костей нижних, а иногда и верхних конечностей [6] (рис. 5).
Остеогенная фибродисплазия
Заболевание характеризуется повышенным поглощением РФП не просто очагами, а целыми областями вдоль длинных трубчатых костей, черепа, ребер. В литературе встречаются единичные описания сцинтиграфической картины этой болезни, но картина достаточно специфична [34].
Болезнь Педжета
Очаговое поражение костей, сопровождающееся значительным повышением активности костной резорбции и остеосинтеза в них, при остеосцинтиграфии демонстрирует резкое повышение захвата РФП в вовлеченных зонах скелета. Сцинтиграфическая картина во многих случаях патогномонична.
Роль радиоизотопных методов в современной ревматологии
Методы ядерной медицины в развитых странах очень востребованы и развиваются, т. к. это единственные методы лучевой диагностики, которые основаны на принципах функционирования того или иного органа. Использование современных методов радионуклидной диагностики позволяет:
- улучшить раннюю диагностику артритов и поражений позвоночника, подтверждая воспалительную природу симптомов;
- проводить дифференциальную диагностику очаговых заболеваний позвоночника, а также боли в спине;
- оценивать активность артритов и спондилоартритов, в т. ч. в динамике, осуществляя, таким образом, контроль эффективности лечения;
- прогнозировать течение РА и ОА крупных суставов;
- диагностировать широкий круг относительно редких заболеваний опорно-двигательного аппарата (остеонекроз, синдром SAPHO, болезнь Педжета, болезнь Эрдгейма - Честера, остеогенная фибродисплазия и др.).
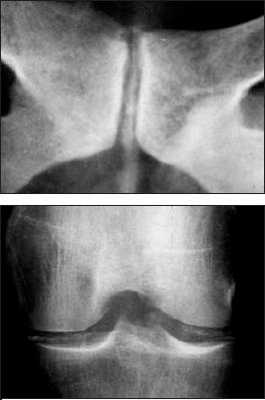
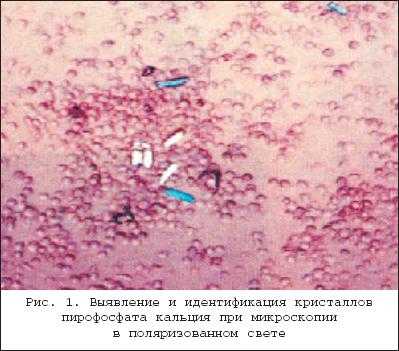
Болезнь отложения кристаллов кальция пирофосфата дигидрата (БКПД) в медицинской литературе известна под тремя названиями: «псевдоподагра», «хондрокальциноз» и «пирофосфатная артропатия». Однако приведенные определения явно не удовлетворяют современным требованиям к номенклатуре заболеваний, стремящимся к максимально полной характеристике патологического процесса. Так, термин «псевдоподагра» точно описывает клинические проявления бурного синовиального воспаления при БКПД, схожего с атакой подагрического артрита, но подобные приступы наблюдаются далеко не у всех пациентов. Термин «хондрокальциноз» описывает рентгенологическую картину отложения кристаллов пирофосфата кальция в гиалиновом хряще и других внутрисуставных структурах (менисках), наблюдаемую у пациентов с БКПД. Однако данные рентгенологические признаки (кальцификация мягких тканей) могут наблюдаться и при других состояниях. Наконец, наиболее часто встречающийся термин «пирофосфатная артропатия» свидетельствует о существующем в течение длительного времени определенном агностицизме в представлениях врачей о данном заболевании. Распространенность . БКПД - это болезнь пожилых людей, со средним возрастом пациентов 70 лет. В этом возрасте отложения пирофосфата кальция в гиалиновом хряще являются нередкой находкой. Эпидемиологические исследования (включавшие рентгенологическое обследование коленных суставов, суставов кистей и таза) свидетельствуют о прямой связи распространенности суставного хондрокальциноза с возрастом: в 65-74 года хондрокальциноз обнаруживают у 15%, в 75-84 года - у 36%, в возрасте более 84 лет - почти у 50% обследуемых независимо от присутствия симптомов. Данные по более молодым возрастным группам отсутствуют. Причины отложения кристаллов пирофосфата кальция при старении хряща остаются неясными. Отчетливых половых различий в частоте БКПД не найдено, однако вариант «псевдоподагры» наблюдается чаще у мужчин, а «псевдоостеоартроза» - у женщин. Отложение кристаллов кальция пирофосфата дигидрата представлено на рентгенограммах. Патогенез . Основным патогенетическим механизмомБКПД является образование и накопление кристаллов пирофосфата кальция . Пирофосфат (дифосфат) кальция диг и д р а т , Са2(Р2О7)2Н2О, представляет собой естественную неорганическую соль кальция, присутствующую в тканях организма. Патогенез БКПД кардинальным образом отличается от патогенеза подагры - другого распространенного заболевания из группы микрокристаллических артритов. Если при подагре образование кристаллов уратов происходит в синовиальной жидкости или во внесуставных тканях (формирование тофусов) на фоне общего повышения уровня мочевой кислоты в тканевой жидкости, то при БКПД первичной зоной кристаллообразования является толща гиалинового или волокнистого хряща при нормальном уровне кальция в других тканях организма. В норме этот процесс наблюдается при физиологической минерализации хрящевой пластинки в период роста кости, но нормальный гиалиновый хрящ не кальцифицируется. В течение последнего времени получены определенные данные, проясняющие патогенез БКПД. Установлено, что образование кристаллов пирофосфата начинается в зоне хряща, прилегающей непосредственно к мембране хондроцитов. Образование и накопление кристаллов пирофосфата могут быть результатом как повышенного локального уровня кальция, так и изменений в перицеллюлярном матриксе (протеогликанах и коллагене), приводящих к перенасыщенности присутствующего здесь пирофосфата кальция или комбинацией этих факторов. Современные достижения в молекулярной патологии и гистохимии определили потенциальные факторы, участвующие в этом процессе. Типичными морфологическими признаками, предшествующими минерализации хряща в ростовой пластинке кости, являются гипертрофия хондроцитов и их усиленный апоптоз . Эти же признаки наблюдаются в хряще при остеоартрозе (ОА) и описаны, как самые ранние морфологические признаки БКПД. Механизм связи между интенсивной продукцией протеогликанов гипертрофированными хондроцитами и образованием кристаллов при БКПД неясен. Однако электронно-микроскопические и иммунохимические исследования показали, что в гипертрофированных хондроцитах при БКПД присутствуют измененные протеогликаны, меньшего размера в сравнении с нормой, и дегенеративно измененные короткие цепиколлагена. При гипертрофии хондроцитов имеет место избыточная продукция коллагена X типа, матриксной металлопротеиназы-13 и щелочной фосфатазы, которые также влияют на процесс кальцификации. Показано, что гипертрофия хондроцитов сопровождается изменениями в продукции трансглютаминазы, фермента - представленного двумя типами: трансглютаминазой-2 (ТГ2) и фактором XIIIА. Функция трансглютаминаз заключается в посттрансляционном образовании поперечных связей в белках, происходящем как внутриклеточно, так и во внеклеточном матриксе. Наличие поперечных связей в кальций-связывающих белках постулируется как условие стабилизации матрикса и минерализации хряща ростовой пластинки. Трансглютаминазы могут модулировать кальцификацию хряща непрямым образом посредством активации мощного кристаллообразующего фактора - ростового фактора- ? . На животных моделях показано, что хондроциты гиалинового хряща экспрессируют ТГ2 и фактор XIIIА и что их активность усиливается с возрастом. ТГ2 ответственна за увеличение концентрации неорганического пирофосфата в экстрацеллюлярном пространстве хондроцитов и является основным регулятором процесса кальцификации хряща. Эти данные были подтверждены гистохимическими исследованиями на тканях человеческого мениска и суставного хряща при ОА; нарушения регуляции ТГ2 и фактора XIIIА были обнаружены как в поверхностной и глубокой зонах хряща при ОА, так и в центральной зоне дегенеративного мениска. Определенным образом в патогенезе БКПД играют роль генетические факторы. Известна семейная форма БКПД, при которой хондрокальциноз регистрируется у членов одной семьи в более молодом возрасте, чем в среднем в популяции. Существует линия мышей ( «tiptoe-walking» mouse ), характеризующаяся точечной мутацией, приводящей к дефициту фермента фосфодиэстеразы; при этом наблюдается избыточная минерализация осевого скелета. Состояния, ассоциированные с хондрокальцинозом В отличие от истинной БКПД существуют состояния, при которых отложение кристаллов пирофосфата кальция в хряще лишь сопровождает основной патологический процесс. К ним относятся травматические поражения суставов, ряд метаболических и эндокринных заболеваний, которые необходимо исключать при постановке диагноза БКПД, особенно при начале клинических проявлений в молодом возрасте. В частности, при обнаружении хондрокальциноза в отдельных суставах у молодых людей необходим тщательный сбор анамнеза, в ряде случаев позволяющий связать этот признак с предшествующей травмой сустава или хирургическим вмешательством на нем. Патогенез посттравматического кальциноза мягкотканых структур суставов (менисков в коленных и треугольного хряща в лучезапястных) идентичен наблюдаемому при естественной инволюции гиалиного хряща. Хондрокальциноз встречается при гемохроматозе - относительно редком заболевании, спектр признаков поражения опорно-двигательного аппарата при котором близок клиническим проявлениям БКПД (псевдоподагра, хондрокальциноз, хроническая артропатия). Влияние накопления железа в тканях организма на патологическую минерализацию также подтверждается обнаружением отложений кристаллов пирофосфата в суставах при гемосидерозе и гемофилической артропатии. Другие состояния и предрасполагающие факторы . Помимо гемохроматоза, известен ряд других метаболических и эндокринных заболеваний, ассоциированных с отложением кристаллов пирофосфата кальция. Обнаружение рентгенологических и клинических признаков БКПД всегда требует исключения этих состояний, особенно у молодых пациентов (табл. 1). Описаны случаи развития острого суставного воспаления, связанного с кристаллами пирофосфата, после внутрисуставного введения гиалуроната и внутривенного введения памидроната. Возможной причиной может быть нарушение равновесия между концентрациями фосфата кальция в синовиальной жидкости и окружающих тканях, приводящее к выбросу (или образованию) кристаллов в полость сустава. Клиника БКПД представлена несколькими клиническими вариантами. Наиболее часто встречается «псевдоостеоартроз» , характеризующийся умеренными болями (преимущественно механического ритма) в пораженных суставах (наиболее часто - коленных), ограничением подвижности. Также как при ОА, дегенеративный процесс может сопровождаться формированием остеофитов (узелки Бушара и Гебердена) и варусной деформацией коленных суставов (в ряде случаев вызванной асептическим некрозом медиальных мыщелков). Рентгенологические признаки хондрокальциноза обнаруживаются во многих суставах, однако клиническая значимость определяется поражением отдельных суставов, чаще всего коленных. Симптомы воспаления присутствуют (как и при идиопатическом ОА), но носят умеренный характер и не отражаются на лабораторных показателях. Признаками, позволяющими провести дифференциальный диагноз в пользу псевдоостеоартрозного варианта БКПД, являются необычная для ОА локализация пораженных суставов (лучезапястные, локтевые, плечевые, пястно-фаланговые, голеностопные суставы) и рентгенологически выявляемый в пораженных суставах хондрокальциноз. Сложным и в ряде случаев неразрешимым вопросом является интерпретация рентгенологических признаков БКПД (хондрокальциноза), определяемых у пациентов с типичной для ОА локализацией пораженых суставов - коленных, межфаланговых суставов кистей, у которых клинические проявления ОА появились раньше, чем рентгенологически регистрируемый хондрокальциноз. Сравнение данных рентгенологического исследования пораженных суставов за несколько лет и фиксирование лишь последующего появления хондрокальциноза на каком-то этапе дегенеративного процесса позволяют сделать вывод о вторичности отложения пирофосфата кальция в пораженном хряще. «Псевдоревматоидная» форма БКПД наблюдается у 5% пациентов и характеризуется симметричным поражением пястно-фаланговых суставов, обычно II-III пальцев, протекающим с утренней скованностью, иногда с формированием сгибательных контрактур и умеренным повышением острофазовых показателей. Однако в отличие от истинного ревматоидного артрита наблюдается лишь умеренное воспаление, отсутствие эрозий суставных поверхностей и хондрокальциноз. «Псевдоподагрический» вариант представляет собой наиболее известное и яркое проявление БКПД. Бурное микрокристаллическое воспаление возникает в ответ на высвобождение значительного количества кристаллов кальция пирофосфата из толщи хряща в синовиальную полость. Выраженность воспаления и его кратковременность (несколько дней, редко более недели) определили название этого варианта БКПД. Данный вариант БКПД традиционно фигурирует в перечне причин острого моноартрита (две другие - подагра и инфекционный артрит). В отличие от истинной подагры первый приступ возникает в возрасте 50 лет и старше (исключение - семейная наследственная форма БКПД), воспаление практически всегда локализовано в коленных суставах, реже в других и крайне редко - в I плюснефаланговом суставе. Женщины страдают этой формой БКПД почти с такой же частотой, как и мужчины. Как и при истинной подагре, провоцирующими факторами могут быть травма, хирургическое вмешательство, нарушение мозгового кровообращения и инфаркт миокарда. Отмечена сезонность - приступы достоверночаще возникают весной. До и между приступами острого воспаления сустав, как правило, асимптоматичен. Однако возможно развитие приступа острого воспаления отдельных суставов и у пациентов с «псевдоостеоартрозной» формой БКПД. Наиболее редко (описаны единичные случаи) БКПД проявляется псевдонейропатической артропатией , обычно коленных суставов, при которой формируется клиническая и рентгенологическая картина артропатии Шарко. В отличие от истинного сустава Шарко (встречающегося при tabes dorsalis и сирингомиелии) эта форма БКПД не сопровождается признаками поражения центральной и периферической нервной системы. Асимптомный хондрокальциноз , как уже указывалось, нередко обнаруживается у пожилых людей. У пациентов с клиническими признаками БКПД в отдельных суставах хондрокальциноз может быть выявлен и в других, клинически интактных, суставах. Считать ли асимптомный хондрокальциноз болезнью? По-видимому, здесь справедлива та же позиция, которая в настоящее время существует в отношении рентгенологических проявлений и диагноза остеоартроза - «нет симптомов - нет болезни». Подобная аналогия представляется уместной, так как и рентгенологические проявления остеоартроза (остеофиты, сужение суставной щели) и хондрокальциноз имеют отчетливую корреляцию с возрастом и могут представлять собой варианты естественной инволюции опорно-двигательного аппарата, не сопровождающиеся клиническими симптомами. Известно, что выраженность клинических проявлений БКПД не связана с выраженностью хондрокальциноза. Лечение В связи с неясностью до настоящего времени точного механизма, приводящего к формированию и накапливанию кристаллов пирофосфата кальция в гиалиновом хряще, патогенетических методов лечения этого заболевания не существует. При псевдоостеоартрозе применяется тот же комплекс лечебных мероприятий, что и при идиопатическом ОА, включающий разгрузку пораженных суставов, укрепление мыш, стабилизирующих пораженный сустав, симптоматический прием нестероидных противовоспалительных препаратов с учетом переносимости сопутствующей патологии. Принимая во внимание, что патогенез БКПД имеет общие детали с ОА (продукция хондроцитами дефектных протеогликанов), теоретически при БКПД можно ожидать эффект от приема структурно-модифицирующих препаратов, применяемых при ОА (глюкозамин, хондроитин, гиалуроновая кислота). Однако на сегодняшний день результаты подобных исследований не публиковались. Тактика при развитии острого воспаления, определяющего клинику псевдоподагры заключается, прежде всего, в исключении инфекционного артрита . Методом, позволяющим это сделать, является исследование синовиальной жидкости, включающее бактериологическое (окраска по Граму и посев) исследование и поиск в жидкости кристаллов. Визуальная характеристика синовиальной жидкости и обычное цитологическое исследование не позволяют провести дифференциальный диагноз между этими заболеваниями - высокий цитоз (вплоть до пиоидности) и преобладание нейтрофилов характерны как для БКПД, так и для инфекционного воспаления. При определенном опыте исследователя кристаллы пирофосфата кальция могут быть идентифицированы при обычной световой микроскопии (в отличие от игловидных уратов они имеют вид параллелепипедов с «обрубленными» концами, ромбов). Более достоверным способом обнаружения и идентификации кристаллов является микроскопия в поляризованном свете с применением компенсатора , при которой определяется способность кристаллов пирофосфата к слабому двойному лучепреломлению (рис. 1). Исследование в поляризованном свете позволяет обнаружить кристаллы пирофосфата кальция в 5 раз чаще, чем при обычной микроскопии. Диагноз значительно упрощается при развитии повторных приступов. Собственно, лечение приступа псевдоподагры не отличается от такового при остром приступе подагры. Эффективны традиционные НПВП, применяемые в средних и максимальных дозах. Среди современных комбинированных противовоспалительных средств, эффективных при остром приступе псевдоподагры, хорошо себя зарекомендовал Амбене - препарат, сочетающий мощную противовоспалительную активность глюкокортикостероида (дексаметазона) и НПВП (фенилбутазона), позволяющих быстро купировать приступ. Амбене выпускается в двух лекарственных формах (готовые шприцы и двойные ампулы) и назначается однократно в сутки, коротким курсом 3 инъекции в неделю ежедневно или через день. При затяжном приступе (длящемся более 3 дней, несмотря на энергичную противовоспалительную терапию) или при противопоказаниях к использованию НПВП методом выбора является введение в сустав адекватной дозы микрокристаллического глюкокортикостероида пролонгированного действия - триамцинолона ацетонида или бетаметазона дипропионата. Как правило, данная процедура проводится однократно, крайне редко возникает необходимость в повторном введении. Применение колхицина, как противорецидивного препарата при псевдоподагре, не получило распространения в связи с плохой переносимостью и отсутствием данных о его эффективности. Не подтвердилась эффективность солей магния, попытки введения которых в сустав при приступе псевдоподагры предпринимались с целью перевода кристаллов пирофосфата кальция в растворимое состояние. Таким образом, БКПД представляет собой известную, но до настоящего времени во многом загадочную нозологическую форму. Встреча с пациентом с предположительным диагнозом БКПД требует от врача как умения взвешенно подходить к интерпретации выявляемых инструментально признаков патологии (хондрокальциноза, обнаружения кристаллов пирофосфата кальция в синовиальной жидкости), так и (при подтверждении диагноза) определять тактику лечения для каждого пациента исходя из принципов достаточности и безопасности.

Литература
1. Бунчук Н.В. Болезнь отложения кристаллов пирофосфата кальция ди-
гидрата. Руководство по внутренним болезням. Ревматические болезни.
Под ред. В.А. Насоновой, Н.В. Бунчука. М. Медицина. 1997. С. 374-379.
2. Fam A. What is new about crystals other then monosodium urate?
Current Opinion in Rheumatology. 2000; V.12, N 3, p.229-233.
3. Rosenthal A. Formation of calcium pyrophosphate crystals: biologic
implications. Current Opinion in Rheumatology. 2000; V.12, N
3, p.219-222.
4. Masudu I. Calcium cristal deposition diseases. Lessons from histochemistry.
Current Opinion in Rheumatology. 2004; V.16, N 3, p.
279-281
5. Disla, E, Infante, R, Fahmy, A, et al. Recurrent acute calcium
pyrophosphate dihydrate arthritis following intra-articular
hyaluronate injection. Arthritis Rheum 1999; V. 42:p.1302-1305.
6. Wilkins, E., Dieppe, P, Maddison, P, Evison, G. Osteoarthritis
and articular chondrocalcinosis in the elderly. Ann Rheum Dis 1983;
V. 42:p.280-286.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Пройдя регистрацию вы можете добавлять в избранное понравившиеся статьи, а также получите подборку статей по вашей специальности
Читайте также:
