Лапароскопия при раке эндометрия - показания, возможности
Добавил пользователь Евгений Кузнецов Обновлено: 28.01.2026
Гистерорезектоскопия (ГРС) — это современная гинекологическая процедура, которая позволяет проводить хирургическое лечение матки без нарушения целостности ее стенки. В ходе лечения используются лазерные или электрохирургические способы удаления тканей под визуальным контролем (т.е. с применением видеосистем, которые позволяют хирургу видеть полость органа на протяжении всего хода операции).
Показания
Гистерорезектоскопия проводится с целью лечения патологических образований, измененных тканей или аномалий развития полости матки. Среди показаний к процедуре отмечаются:
- Субмукозная (расположенная под слизистой оболочкой) миома.
- Полипоз или некоторые виды одиночных полипов.
- Синдром Ашермана — внутриматочные синехии (спайки).
- Гиперплазия эндометрия в случае неэффективности лекарственной терапии или при наличии противопоказаний к ней.
- Менометроррагия (аномально длительное/обильное кровотечение из половых путей во время менструации). Оперативное лечение показано при отсутствии эффекта гормонотерапии.
- Перегородка в полости матки.
Так как гистерорезектоскопия является органосберегающей операцией, она особенно актуальна при лечении пациенток репродуктивного возраста.
Противопоказания
Гистерорезектоскопия является инвазивной процедурой, поэтому она имеет список определенных противопоказаний. В этот список входят:
- Острые или хронические воспалительные заболевания половых органов (кольпит, эндометрит, цервицит и другие).
- Сужение канала шейки матки (например, из-за рубцовых изменений).
- Онкологические заболевания половой системы на последних стадиях, метастазы в органах малого таза.
- Обильное маточное кровотечение.
- Беременность.
- Инфекционные заболевания.
С осторожностью гистерорезектоскопию назначают при пороках сердца, патологии почек, нарушении свертываемости крови и др. Иногда перед процедурой женщине назначают специальную подготовку, которая позволяет снизить риски.
Преимущества и недостатки ГРС
Гистерорезектоскопия имеет ряд преимуществ перед другими эндоскопическими и открытыми оперативными вмешательствами. Связано это, отчасти, с использованием высокотехнологичного оборудования, которое используется для ее выполнения. Так, видеоконтроль с высоким качеством разрешения, который сопровождает весь процесс операции, позволяет хирургу четко видеть размер, форму и локализацию патологических изменений. Электрохирургические или лазерные инструменты, применяющиеся в ходе процедуры, меньше травмируют ткани по сравнению с обычным скальпелем. К положительным сторонам также можно отнести небольшую продолжительность гистерорезектоскопии. Обычно операция длится не более часа.
К недостаткам процедуры можно отнести ее ограниченные возможности. Некоторые заболевания устранить при помощи данного метода не получится, поэтому хирург будет вынужден применять альтернативные методики. Кроме того, поскольку гистерорезектоскопия проводится с помощью высокотехнологичного оборудования, для ее успешного выполнения требуется опытный хирург, который хорошо знаком с работой лазерных или электрохирургических инструментов и эндоскопической техникой.
Предоперационная подготовка
Перед выполнением гистерорезектоскопии, как и при других хирургических вмешательствах, пациент должен пройти определенное обследование, в которое входят:
- Общий анализ крови, мочи, биохимический анализ крови, определение резус-фактора, мазки из влагалища, реакция Вассермана и др.
- ЭКГ, рентгенография органов грудной клетки, УЗИ органов малого таза.
- По показаниям проводятся консультации других узких специалистов.
Наиболее благоприятным временем для проведения гистерорезектоскопии является ранняя фаза менструального цикла, поэтому планировать операцию необходимо именно на этот период. В некоторых случаях, с целью подготовки женщине назначаются специальные гормональные препараты, например, агонисты гонадотропин — рилизинг гормона (аГнРГ).
Непосредственно перед процедурой необходима подготовка желудочно-кишечного тракта: пациентке назначается очистительная клизма. Перед оперативным вмешательством запрещается прием пищи и воды.
Техника выполнения ГРС
Способ обезболивания при гистерорезектоскопии может быть разным. Если предполагается небольшое по продолжительности вмешательство, то используют внутривенный наркоз. Его действие продолжается в течение 30-40 минут. Если операция обещает быть продолжительной, то применяют эндотрахеальную (масочная) или эпидуральную анестезию.

Непосредственно перед оперативным вмешательством проводится обработка половых органов и внутренней поверхности бедер антисептическими средствами. При этом пациентка находится в гинекологическом кресле. Хирург расширяет шейку матки с помощью специальных инструментов, после чего вводит гистерорезектоскоп в полость матки. Далее нагнетается специальная жидкость, которая не проводит ток (как правило, используется раствор глюкозы с сорбитолом). За счет давления жидкости, полость матки расширяется, что создает хороший обзор и необходимое пространство для различных манипуляций. При помощи гистерорезектоскопа, который выводит изображение на экран, хирург тщательно осматривает полость матки, обращает внимание на ее величину, рельефность и толщину слизистой оболочки, состояние устьев маточных труб. Тщательно изучается локализация, размеры и форма измененных тканей или патологического образования. После необходимого исследования они иссекаются при помощи лазерных или электрохирургических инструментов. Хирург старается максимально удалить патологический очаг, нередко захватывается часть нормальных тканей, что позволяет избежать рецидива заболевания.
Послеоперационные рекомендации
Период реабилитации после проведения гистерорезектоскопии всегда протекает индивидуально, в зависимости от целей и объема проведенной операции. Тем не менее, можно выделить несколько общих моментов, которые отмечаются практически всегда:
- После операции пациентка может чувствовать умеренные боли и дискомфорт внизу живота. Для того чтобы устранить эти неприятные ощущения врач назначит обезболивающие препараты.
- При гистерорезектоскопии практически всегда происходит повреждение эндометрия. Иногда он восстанавливается самостоятельно, но в некоторых случаях для улучшения его регенерации необходимо принимать препараты эстрогена. Средняя продолжительность курса составляет около трех месяцев, но по рекомендации врача она может быть большей или меньшей.
- В некоторых случаях женщине показано другое специфическое лечение. Дозировки препаратов, режим приема и продолжительность курса врач подберет индивидуально.
В целом реабилитация после гистерорезектоскопии проходит спокойно и быстро, особенно если операцию проводил опытный врач с использование современного оборудования.
Осложнения после гистерорезектоскопии
Неблагоприятные последствия после проведенной операции могут возникнуть по разным причинам. Все их условно можно разделить на три группы:
- Интраоперационные (возникшие во время операции). К ним относят кровотечение и перфорацию (сквозное повреждение) стенки матки.
- Электрохирургические. Ожоговые повреждения тканей возникают при несоблюдении техники работы с электрохирургическими инструментами.
- Послеоперационные. После гистерорезектоскопии могут развиваться воспалительные поражения стенок матки, скопление крови в полости матки, сужение цервикального канала, острые инфекционные процессы и др.
Чтобы избежать развития осложнений после проведения гистерорезектоскопии, необходима тщательная предоперационная подготовка, полное обследование перед операцией и индивидуализация тактики в каждом клиническом случае. Хирург должен иметь большой опыт проведения подобных вмешательств и иметь в своем распоряжении все необходимо оборудование и расходные материалы.
Гистерорезектоскопия позволяет женщинам избавиться от болезни, устранить болевой синдром и восстановить функцию половой системы. Например, после удаления полипа матки, у 60-80% пациенток нормализуется менструальный цикл, а в 30% случаев удается восстановить репродуктивное здоровье женщины. При лечении миомы матки с помощью гистерорезектоскопии удается восстановить детородную функцию у 76% прооперированных. Поэтому данная операция продолжает оставаться актуальной и активно выполняется в лучших медицинских учреждениях во всем мире.
Лапароскопия при раке эндометрия - показания, возможности
ФГБУ "Московский научно-исследовательский онкологический институт им. П.А. Герцена" Минздрава России
Московский научно-исследовательский онкологический институт им. П.А. Герцена
Радикальные лапароскопические операции в хирургическом лечении рака тела матки
Журнал: Российский вестник акушера-гинеколога. 2014;14(5): 60‑65
Шевчук А.С., Новикова Е.Г., Анпилогов С.В. Радикальные лапароскопические операции в хирургическом лечении рака тела матки. Российский вестник акушера-гинеколога. 2014;14(5):60‑65.
Shevchuk AS, Novikova EG, Anpilogov SV. Radical laparoscopic operations in surgical treatment for cancer of the corpus uteri. Russian Bulletin of Obstetrician-Gynecologist. 2014;14(5):60‑65. (In Russ.).
Цель исследования - сравнительный анализ ближайших результатов хирургического лечения больных раком эндометрия I стадии с помощью лапароскопического и лапаротомного доступов. Материал и методы. В отделении гинекологии Московского научно-исследовательского онкологического института им. П.А. Герцена с июля 2010 г. по декабрь 2013 г. лапароскопическая гистерэктомия с тазовой лимфаденэктомией по поводу рака эндометрия выполнена у 87 женщин. Группу сравнения составила 41 пациентка с аналогичной распространенностью опухолевого процесса, которым выполнялась операция из классического лапаротомного доступа идентичного объема с июня 2008 г. по июль 2010 г. В исследование включались больные с клиническим диагнозом рак эндометрия IА-С стадии. Результаты. Сравнительный анализ двух групп больных показал, что видеоэндоскопическая экстирпация матки с тазовой лимфаденэктомией может рассматриваться в качестве адекватной альтернативы классическим "открытым" операциям у больных со злокачественными опухолями матки I стадии, так как имеет такие преимущества, как минимальная кровопотеря, низкое число осложнений, более быстрая реабилитация больных. Заключение. Период наблюдения после видеоскопической операции в настоящее время недостаточен (медиана наблюдений - 15 мес), чтобы делать окончательные выводы.
Впервые лапароскопическая экстирпация матки выполнена в январе 1988 г. гинекологом H. Reich в США. В 1992 г. по поводу начального рака эндометрия выполнена первая видеоассистированная вагинальная гистерэктомия. Спустя 1 год гистерэктомия была дополнена тазовой лимфаденэктомией и появились первые работы по выполнению полностью видеоэндоскопической экстирпации матки, без вагинального этапа (J. Childers и соавт., 1992, 1993; H. Reich, L. Sckel, 1993).
В России первую лапароскопическую экстирпацию матки выполнили В.К. Карнаух и соавт. в 1993 г. [3]. Проблема лапароскопического доступа в лечении многих гинекологических заболеваний (миома матки, эндометриоз, доброкачественные кистозные образования яичников) в нашей стране разрабатывалась и широко освещалась в работах Л.В. Адамян и соавт. [1]. В настоящее время в нашей стране, как и в мире, он применяется также и в лечении злокачественных опухолей [2, 4].
Вопрос о применении видеоэндоскопичских методик в онкологии остается предметом дискуссий. Лапароскопические операции не позволяют провести адекватную пальпаторную ревизию, могут способствовать интраоперационному распространению злокачественных клеток на фоне карбоксиперитонеума и использования инструментов, травмирующих опухоль, таким образом могут привести к увеличению частоты рецидивов и ухудшению прогноза заболевания по сравнению с лапаротомными вмешательствами [13].
В этом аспекте предметом активных дискуссий является вопрос о возможности применения маточного манипулятора в ходе лапароскопических операций у больных раком эндометрия [6]. В частности, утверждается, что длительная механическая травматизация неоплазированного эндометрия наконечником маточного манипулятора может способствовать попаданию опухолевых клеток в сосудистое русло либо в брюшную полость по маточным трубам [9, 10]. Было показано, что существенных гистологических различий в удаленных препаратах между открытыми и лапароскопическими операциями не выявляется, и применение маточного манипулятора не влияет на правильность морфологической оценки истинной распространенности опухолевого процесса [7, 12]. Однако отмечается наличие большей частоты сосудистой инвазии опухоли, или «псевдоинвазии», обусловленной давлением внутриматочного наконечника [8, 11], что потенциально может приводить к увеличению рецидивов заболевания [5]. Помимо этого, некоторые исследователи отмечают большую частоту обнаружения опухолевых клеток в перитонеальных смывах (4,3%) после введения наконечника манипулятора у больных со злокачественными опухолями тела матки [10].
Экстирпация матки с придатками и с тазовой лимфаденэктомией в настоящее время является стандартом хирургического лечения больных раком эндометрия. Выполнение тазовой лимфаденэктомии требуется при наличии неблагоприятных факторов прогноза заболевания (низкая степень дифференцировки, серозная или светлоклеточная морфологические формы опухоли, инвазия опухоли в миометрий на глубину более половины его толщины, тотальное поражение всей полости матки), при которых риск субклинического поражения регионарных лимфатических узлов крайне высок.
Цель исследования - сравнительный анализ ближайших результатов хирургического лечения больных раком эндометрия I стадии с помощью лапароскопического и лапаротомного доступов.
Материал и методы
В отделении гинекологии института им. П.А. Герцена с июля 2010 г. по декабрь 2013 г. лапароскопическая гистерэктомия с тазовой лимфаденэктомией по поводу рака эндометрия была выполнена у 87 женщин (основная группа). Группу сравнения составила 41 пациентка с аналогичной распространенностью опухолевого процесса, которым была выполнена лапаротомная операция идентичного объема с июня 2008 г. по июль 2010 г.
Показанием к хирургическому лечению в указанном объеме явилась совокупность признаков:
1. Клиническая стадия заболевания (по классификации FIGO 2002 г, TNM 6-е издание):
- IA (T1aNoMo) в сочетании с умеренной или низкой степенью дифференцировки опухоли и тотальным поражением всей полости матки;
- IA (T1aNoMo) - рецидив либо продолженный рост опухоли после самостоятельной гормонотерапии у пациенток репродуктивного возраста;
- IB, IC (T1b,cNoMo) стадии.
2. Гистологические варианты: эндометриоидная аденокарцинома, эндометриоидная аденокарцинома с плоскоклеточной дифференцировкой, светлоклеточная аденокарцинома, аденоплоскоклеточный рак.
3. Отсутствие распространения опухоли на шейку матки и признаков метастатического поражения регионарных лимфатических узлов по данным магнитно-резонансной томографии (МРТ) и УЗИ.
Техника лапароскопической экстирпации матки у больных с опухолью эндометрия имела ряд особенностей по сравнению с аналогичной операцией, выполняемой при доброкачественной патологии (миома матки, аденомиоз). На 1-м этапе для предотвращения попадания опухолевых клеток в брюшную полость и общий кровоток коагулировались маточные трубы, собственные связки яичников, круглые и воронкотазовые связки матки с пересечением двух последних. Затем перевязывались либо клипировались маточные артерии и вены на расстоянии 1 см от места отхождения от передней ветви внутренних подвздошных сосудов. После лигирования основных сосудистых пучков матки операция продолжалась уже на фоне введения в полость матки наконечника маточного манипулятора.
Следующий этап операции - тазовая лимфаденэктомия. Условной проксимальной ее границей был уровень на 2 см выше бифуркации общей подвздошной артерии. В дистальном направлении клетчатку удаляли до вены, огибающей подвздошную кость. Наружной и внутренней границами лимфаденэктомии являлись подвздошно-поясничная мышца и пупочная артерия (ветвь внутренней подвздошной). Обтураторный нерв являлся задней границей лимфодиссекции. Удаленную клетчатку отдельно с каждой стороны извлекали из брюшной полости в контейнерах через троакарные раны.
В исследование были включены больные с клиническим диагнозом рака эндометрия стадии IА-С (FIGO, 2002). Средний возраст всех пациенток составил 55±10,5 года, при этом половина из них находились в пери- и постменопаузе.
У 63% пациенток в основной группе и у 66% в группе сравнения имелась избыточная масса тела либо ожирение, играющие определенную роль в патогенезе рака эндометрия.
Результаты
Были проанализированы основные хирургические показатели лапароскопических операций в сравнении с аналогичными лапаротомными.
Продолжительность видеоэндоскопических хирургических вмешательств варьировала от 115 до 300 мин, в среднем составила 202,3±43,1 мин, медиана 195 мин. В исследование были включены пациентки, которым впервые выполнялась лапароскопическая экстирпация матки с придатками и тазовой лимфаденэктомией. По мере освоения методики продолжительность операции закономерно снижалась («кривая обучения»). Была проанализирована продолжительность последних 41 лапароскопических операций, при этом средние значения составили 176,3±33,8 мин, медиана 180 мин. В группе сравнения продолжительность хирургического вмешательства была равна 153,9±37 мин, медиана 150 мин.
Лапароскопический доступ, несмотря на расширенный характер операции, затрагивающей области магистральных сосудов, характеризовался в большинстве случаев минимальной кровопотерей. В среднем она составила 130 мл (медиана 70 мл), при этом у 50% больных находилась в интервале от 70 до 100 мл. У одной (1,2%) пациентки в связи с ранением внутренней подвздошной вены этот показатель увеличился до 2000 мл. Отсутствие других тяжелых интраоперационных осложнений позволило рассматривать лапароскопическую методику как относительно безопасную. Кровопотеря в группе сравнения в среднем составила 400±199 мл, медиана 400 мл, что значительно выше, чем в основной группе.
Дренаж устанавливали всем пациенткам. Сроки его удаления определяли индивидуально. В течение первых 3 сут отмечался рост количества отделяемого (соответственно в среднем 96, 146 и 206 мл). Затем наступало «плато», и в ближайшие 2 сут его количество оставалось на одном уровне. С 4-го дня после операции определялась тенденция к возрастанию лимфореи. У 64% пациенток дренаж вынимался к 3-м суткам. Количество лимфокист в подвздошных областях оказалось меньше (10,3% случаев по сравнению с 41,5% в группе сравнения).

Послеоперационный период в основной группе (лапароскопия) характеризовался в целом гладким течением и минимальным числом осложнений (табл. 1).
Среди общехирургических осложнений в группе сравнения следует отметить нагноение послеоперационного шва, тромбоэмболию легочной артерии (ТЭЛА) с летальным исходом (при одинаковом проценте случаев тромбоза вен нижних конечностей), а также повторное хирургическое вмешательство по поводу кишечной непроходимости, которые не встречались после лапароскопических операций.
Послеоперационный период пребывания больных в стационаре в основной группе в среднем в 1,5 раза был меньше, чем в группе сравнения (8,9±2,6 и 13±2,5 дня соответственно).

При плановом гистологическом исследовании морфологическая форма опухоли в большинстве случаев была представлена эндометриоидной аденокарциномой. При этом высокая (G1) и умеренная (G2) степени дифференцировки опухоли встречались приблизительно в равном количестве у большинства пациенток (табл. 2).
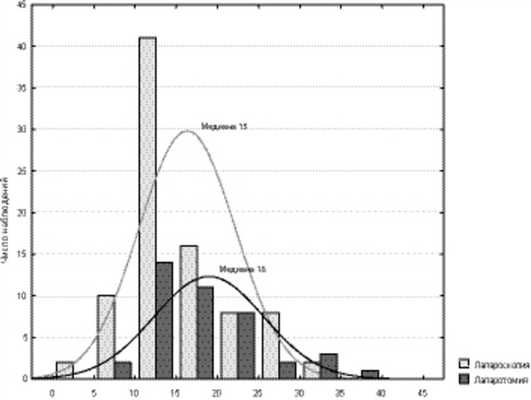
Среднее количество удаленных лимфатических узлов после лапароскопической операции на 1 больную составило 16,2±5,8, медиана 15. В 2 (2,3%) случаях подтверждено метастатическое поражение тазовых лимфатических узлов. В группе сравнения в среднем было удалено 18,8±6,6 подвздошно-обтураторных лимфоузлов, медиана 18. У одной (2,4%) пациентки были выявлены метастазы в тазовых лимфоузлах (рис. 1). Рисунок 1. Распределение пациенток обследованных групп по количеству удаленных лимфатических узлов.
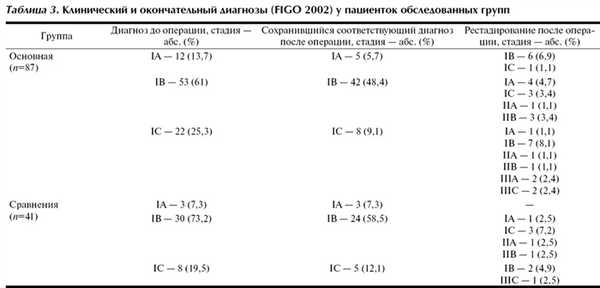
Основную долю в исследовании составили пациентки с IB стадией заболевания - 63%. Ограничения разрешающей способности инструментальных методов обследования (УЗИ, МРТ) не исключают получение ложноположительных и ложноотрицательных результатов. Сопутствующие фоновые процессы в матке (миома, аденомиоз) создают объективные трудности для правильной оценки распространенности опухоли. В связи с этим в обеих группах отмечены случаи изменения диагноза рака тела матки как в сторону увеличения, так и уменьшения стадии. У 32 (36,8%) пациенток в основной группе и у 9 (22%) в группе сравнения первичный диагноз был изменен на основании результатов планового гистологического исследования (табл. 3).
При наличии инвазивной опухоли всегда существует риск субклинического метастатического поражения регионарных лимфатических узлов. У 3 пациенток: 2 (2,4%) в основной и 1 (2,5%) в группе сравнения, в связи с этим проведено повторное определение стадии рака эндометрия на основании обнаружения микрометастазов в регионарных лимфатических узлах, что соответствовало IIIC стадии.
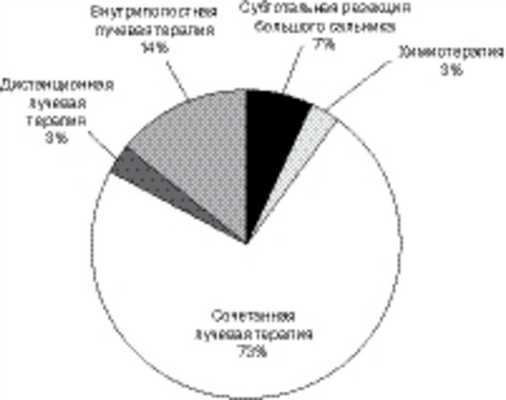
У 30 (34,4%) пациенток основной группы выполнено адъювантное дополнительное лечение (рис. 2). Рисунок 2. Адъювантное лечение у пациенток основной группы.
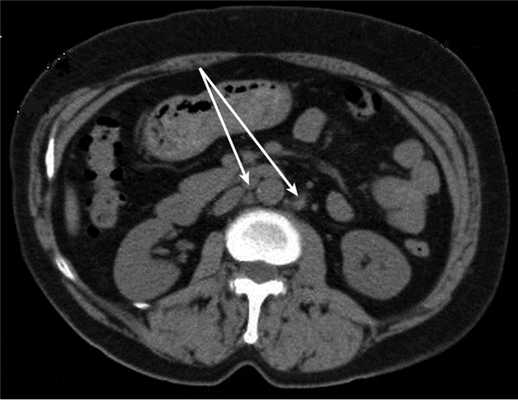
Медиана наблюдения больных основной группы в рамках проспективного исследования составила 15 мес. У одной пациентки 61 года с диагнозом рак эндометрия IIIC стадии рT1cN1Mo через 7 мес после завершения первичного комбинированного лечения диагностирован рецидив заболевания в области забрюшинных лимфатических узлов на уровне отхождения почечных сосудов до 2 см в диаметре (рис. 3). Рисунок 3. Локализация рецидива (стрелки) в забрюшинном пространстве на уровне почечных сосудов у больных основной группы.
На консилиуме принято решение выполнить циторедуктивное хирургическое вмешательство - парааортальную лимфаденэктомию. Морфологически структура опухоли была аналогична первичной неоплазии в матке, представлена низкодифференцированной эндометриоидной аденокарциномой с субтотальным замещением лимфоидной ткани. В послеоперационном периоде проведена дистанционная лучевая терапия с последующей полихимиотерапией. Пациентка жива, находится под наблюдением 2 мес.
Специфических для лапароскопических операций «port-site» метастазов либо местных рецидивов в области культи влагалища за данный период наблюдения не выявлено.
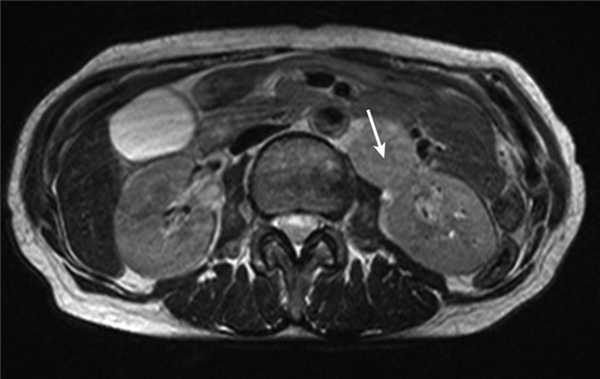
Медиана наблюдения пациенток группы сравнения составила 45,5 мес. За это время одна пациентка 64 лет была исключена из исследования в связи с летальным исходом в раннем послеоперационном периоде, возникшем на фоне ТЭЛА. В одном случае у больной 60 лет с диагнозом рак эндометрия IIA стадии (T2aNoMo) через 15 мес после окончания первичного лечения (операция с адъювантной сочетанной лучевой терапией) диагностирован рецидив заболевания: при контрольном обследовании в парааортальной зоне в области ворот левой почки выявлен конгломерат опухолевых узлов до 4 см (рис. 4). Рисунок 4. Рецидив опухоли в виде конгломерата лимфатических узлов в области ворот левой почки (стрелка) у больных группы сравнения.
Пациентке была выполнена повторная операция - парааортальная лимфаденэктомия. В качестве адъювантного противорецидивного лечения была проведена дистанционная лучевая терапия на эту зону с последующими курсами полихимиотерапии. В настоящее время пациентка жива, находится под наблюдением 6 мес без признаков прогрессирования заболевания.
Сравнительный анализ полученных результатов лечения пациенток двух выбранных групп свидетельствует о том, что лапароскопический доступ может быть представлен как альтернатива классической хирургии в радикальном лечении начального рака эндометрия. С учетом основных параметров операции, таких как продолжительность, кровопотеря, осложнения, очевидно, что видеоэндоскопические хирургические вмешательства не уступают лапаротомным, но при этом имеют свои преимущества. Среди особенностей послеоперационного периода следует отметить меньшее число осложнений, в том числе лимфокист. Легкое течение послеоперационного периода после лапароскопической операции объясняется меньшей травматичностью доступа. На основании данных планового гистологического исследования в обеих группах преобладала эндометриоидная аденокарцинома высокой и умеренной степени дифференцировки. Количество удаленных лимфатических узлов после лапароскопической и лапаротомной операции было в среднем 16,2±5,8 и 18,8±6,6 соответственно, что сопоставимо и достаточно для оценки состояния регионарных лимфатических узлов. Приблизительно в 2% случаев в каждой группе выявлены метастазы в последних. Преобладающей стадией заболевания (FIGO 2002) являлась IB (около 60% пациенток в обеих группах); ⅓ пациенток обеих групп получили дополнительное лечение (34,4% - после лапароскопический операции, 31,8% - после лапаротомной).
Таким образом, выбранные группы в целом сопоставимы по основным хирургическим позициям, результатам планового гистологического исследования и проведенному дополнительному лечению (лучевая терапия, повторная операция, химиотерапия) и могут быть использованы для оценки отдаленных онкологических результатов. Однако период наблюдения после видеоэндоскопической операции в настоящее время недостаточен (медиана составляет 15 мес), чтобы сделать окончательные выводы, которые представляются весьма перспективными. Тем не менее уже сейчас очевидно, что такие преимущества оперативной лапароскопии при раке эндометрия, как минимальная кровопотеря, низкая частота осложнений, быстрая реабилитация, являются актуальными для пациенток с точки зрения отсутствия задержек в проведении дополнительного лечения.
Выводы
1. Проведенное исследование выявило такие преимущества оперативной лапароскопии при раке эндометрия I стадии, как минимальная кровопотеря, низкое число осложнений, более быстрая реабилитация больных и поэтому обеспечение отсутствия задержек в проведении дополнительного лечения.
2. Группы пациенток, оперированных лапароскопическим и лапаротомным доступами, в целом сопоставимы по принципам хирургического лечения, результатам планового гистологического исследования и показаниям к проведению дополнительного лечения и могут быть использованы для оценки отдаленных результатов.
3. Однако период наблюдения после видеоэндоскопической операции в настоящее время недостаточен (медиана наблюдения - 15 мес), чтобы сделать окончательные выводы.
Операции при раке матки
Хирургия — основной метод лечения рака матки. Чаще всего начинают именно с операции, дополняя её курсом лучевой терапии и химиотерапии. Выбирая тип хирургического вмешательства, врач учитывает стадию опухоли, возраст и состояние здоровья женщины.

Все операции при раке матки и её придатков можно разделить на четыре группы:
- Радикальные. Цель такой операции — удалить всю опухоль целиком. Впоследствии проводится курс адъювантной химиотерапии, чтобы уничтожить оставшиеся в организме раковые клетки.
- Циторедуктивные. Проводятся в случае, когда опухоль невозможно удалить целиком, из-за больших размеров или сильного прорастания в соседние органы. Хирург старается иссечь как можно больший объем опухолевой ткани. На оставшуюся воздействуют при помощи химиотерапии или лучевой терапии. Как правило, к циторедуктивным операциям прибегают, когда рак матки распространился на всю тазовую полость и на брюшную полость.
- Диагностические. Такие хирургические вмешательства проводят для того, чтобы уточнить стадию рака, оценить, насколько сильно опухоль проросла в соседние органы, взять образцы тканей для биопсии.
- Паллиативные. Проводятся при некурабельных опухолях на поздних стадиях. Цель такой операции — уменьшить симптомы, облегчить состояние пациента, устранить сдавление опухолью внутренних органов.
Операционные «Евроонко» оснащены современным оборудованием. Наши хирурги проводят операции любой сложности при раке матки на любых стадиях.
Преимущества лапароскопических операций при раке матки
Первая лапароскопическая операция на матке была выполнена еще в 1989 году. С тех пор метод совершенствовался, показания к таким операциям расширялись. Врачи накопили большой опыт в проведении лапароскопических вмешательств. По сравнению с открытыми операциями лапароскопия имеет некоторые преимущества:
- меньше травматизация тканей;
- меньше кровопотеря;
- ниже риск некоторых осложнений;
- более короткий реабилитационный период, возможность быстрее восстановиться и вернуться к привычной жизни.
Диагностическая лапароскопия
В «Евроонко» есть возможность провести лапароскопическое ультразвуковое исследование с доплеровским картированием. Специальный ультразвуковой датчик вводят прямо в брюшную полость. Он напрямую контактирует с исследуемым органом, благодаря чему УЗ-сигнал не искажается, врач получает максимально четкое и информативное изображение, может оценить кровоток в опухолевой ткани.

Удаление опухоли
В зависимости от стадии опухоли, степени прорастания в соседние ткани и распространения в близлежащие лимфатические узлы, объем операции будет различаться. По возможности онкогинекологи стараются отдавать предпочтение лапароскопическим операциям. Но в ряде случаев приходится прибегать к открытым вмешательствам.
Гистерэктомия (экстирпация матки)
Гистерэктомия представляет собой хирургическое вмешательство, во время которого удаляют пораженную опухолью матку.
Зачастую приходится прибегать к расширенной гистерэктомии, во время которой удаляют матку вместе с шейкой и верхней частью влагалища, окружающую тазовую клетчатку и лимфатические узлы. Если в дальнейшем планируется курс лучевой терапии в области таза, выполняют транспозицию яичников: их перемещают вверх, для того чтобы они не попали в поле облучения.
Еще более серьезной операцией является эвисцерация таза, во время которой удаляют матку вместе с её придатками, шейку матки, влагалище, мочевой пузырь, прямую кишку, окружающие ткани и лимфатические узлы. К таким вмешательствам прибегают при рецидивах рака.
Удаление придатков матки
При инвазивном раке матки приходится удалять её придатки: маточные (фаллопиевы) трубы вместе с яичниками. Такая операция имеет серьезные последствия для женского организма, так как после неё наступает искусственная менопауза.
Если женщина еще не перенесла климакс, и рак матки был диагностирован на ранних стадиях, хирурги стараются сохранить яичники. В случаях, когда это возможно, врачи «Евроонко» стараются придерживаться органосохраняющей тактики.
Удаление лимфатических узлов
Во время операции по поводу рака матки могут быть удалены следующие группы лимфатических узлов:
- Тазовые. В данном случае они являются регионарными, так как непосредственно собирают лимфу от матки и других тазовых органов. Именно сюда в первую очередь попадают раковые клетки, распространяющиеся лимфогенным путем.
- Парааортальные. Находятся вокруг нижней части аорты. Сюда попадают раковые клетки, распространившиеся за пределы таза.
Операция по удалению лимфатических узлов называется лимфодиссекцией, или лимфаденоэктомией.
Лапароскопическая хирургия играет важную роль в лечении рака матки и женских половых органов. При правильном подходе лапароскопическая операция по радикальности не уступает «большой», открытой. В клиниках «Евроонко» проводится как радикальное, так и паллиативное лечение онкологических заболеваний на любых стадиях. Мы знаем, как помочь.
Гистероскопия
Гистероскопия матки — это одновременно и диагностическая, и лечебная процедура, которая позволяет осмотреть полость матки изнутри и, при необходимости, выполнить различные лечебные манипуляции, например, удалить инородные тела, полипы и др. Гистероскопия проводится с использованием специального инструментария, который вводится через влагалище.
Виды гистероскопии матки
- Диагностическая гистероскопия. Как видно из названия, данная процедура не предполагает лечебных вмешательств. В процессе диагностической гистероскопии выполняется только визуальный осмотр внутренней полости матки и цервикального канала с помощью специальной оптической системы. Поскольку хирургическое вмешательство не проводится, серьезного наркоза не требуется. В большинстве случаев достаточно местного обезболивания и седации. Восстановительный период после процедуры непродолжительный. Госпитализация не требуется.
- Хирургическая гистероскопия — это уже лечебно-диагностическое вмешательство. Оно позволяет обнаружить проблему и сразу провести ее лечение. Назначается такая процедура при уже установленном диагнозе, либо в тех случаях, когда его вероятность максимальна. Это уже полноценная операция, хоть и малотравматичная. Она требует наркоза и поэтому проводится в условиях стационара.
- Контрольная гистероскопия. Ее проводят для контроля состояния матки после проведенного хирургического лечения.
Показания к выполнению гистероскопии матки
- Бесплодие неясной этиологии.
- Привычное невынашивание беременности.
- Полипы матки и цервикального канала.
- Инородные тела в полости матки, например, внутриматочные контрацептивы.
- Патология эндометрия — гиперплазия, синехии.
- Подозрение на пороки развития матки.
- Метроррагии — внециклические маточные кровотечения.
- Кровотечения после менопаузы.
В настоящее время идет тенденция от отказа в проведении инвазивных методик сугубо с целью обследования, поскольку это так или иначе связано с определенными рисками, а необходимую информацию зачастую можно получить более безопасными методами. Это же касается и диагностической гистероскопии. Процедуру назначают только при невозможности установить диагноз другими неинвазивными методиками.
Как подготовиться к гистероскопии матки
Гистероскопия матки — это инвазивное вмешательство, сопряженное с определенными рисками. Чтобы их минимизировать, необходимо пройти обследование, и, при наличии показаний, лечение. В рамках обследования назначаются следующие анализы:
- Общий и биохимический анализ крови и мочи.
- Мазок на флору и онкоцитологию (если не проводился в течение последнего года).
- Анализ на ИППП.
- Коагулограмма.
- Определение группы крови и резус-фактора.
- ЭКГ.
- Определение маркеров инфекционных заболеваний: ВИЧ, парентеральные гепатиты, сифилис.
При обнаружении воспалительных гинекологических процессов, проводят санацию.
Планирование гистероскопии проводят в соответствии с менструальным циклом. Рекомендуется выполнять процедуру в первые дни после окончания менструации, поскольку в этот период еще нет разрастания эндометрия и легче обнаружить его патологию. Однако при наличии абсолютных врачебных показаний, процедуру можно проводить в любой день цикла. Непосредственно перед гистероскопией необходимо придерживаться следующих правил:
- Отказаться от вагинального секса за 1-2 дня до назначенной процедуры.
- Последний прием пищи должен быть не менее 6 часов до начала вмешательства. Это условие необходимо для безопасной анестезии. Наркоз может привести к расслаблению мускулатуры и затеку желудочного содержимого в дыхательные пути. Это чревато развитием асфиксии или аспирационной пневмонии, которая сложно поддается лечению.
- В день операции нужно принять душ.
- Перед операционной необходимо опорожнить мочевой пузырь, снять украшения, зубные протезы и контактные линзы.
Как проводится гистероскопия
За час до подачи пациентки в операционную проводится премедикация, целью которой является снижение тревоги, повышение переносимости наркоза и уменьшение секреторной активности желез. С этой целью назначается комбинация препаратов, содержащая наркотические анальгетики, антигистаминные, холинолитики и седативные препараты.
В операционной пациентка располагается в гинекологическом кресле и ей вводится анестезия. Вид анестезии оговаривается заранее с учетом противопоказаний, рекомендаций анестезиолога и пожеланий пациентки.
Далее приступают непосредственно к гистероскопии:
- Расширяют канал шейки матки с помощью специальных инструментов.
- Через расширенный канал в матку вводится стерильная жидкость или газ. Это необходимо, чтобы расширить ее полость и сделать доступной для осмотра и манипуляций.
- Далее через шейку вводят гистероскоп — тонкую трубку диаметром около 5 мм с оптической системой, передающей увеличенное изображение на монитор. По мере его введения, осматривается шеечный канал, внутриматочная полость и ее углы.
- После установки диагноза, проводят лечебные мероприятия с помощью того же гистероскопа, который имеет специальный канал для введения хирургических инструментов. Таким способом может быть проведено удаление полипов, подслизистых миоматозных узлов, рассечение синехий, выскабливание эндометрия и др.
- После окончания всех вмешательств, удаляется гистероскоп и введенная жидкость или газ. Пациентка отправляется в палату интенсивной терапии, где приходит в себя после наркоза под наблюдением медперсонала.
Гистероскопия не проводится при следующих состояниях:
- Наличие воспалительных процессов в женских половых органах.
- Стеноз шейки матки.
- Беременность.
- Рак шейки матки 3-4 стадии.
- Обильные маточные кровотечения.
- Декомпенсированная экстрагенитальная патология.
Гистероскопию проводят только после компенсации или излечения данных патологий.
Восстановление после гистероскопии матки
Восстановительный период после проведения гистероскопии делят на два этапа. В раннем восстановительном периоде происходит восстановление поврежденных при проведении процедуры тканей — слизистой оболочки матки, мышечной стенки, цервикального канала. Этот период длится около 2-3 недель.
Второй период занимает около полугода. В это время будет регенерироваться новый эндометрий, который должен отвечать возложенным на него функциям — разрастаться и отторгаться в процессе смены фазы менструального цикла.
Кровянистые выделения после гистероскопии
Умеренные кровянистые выделения возможны в первые 2-3 дня после гистероскопии. Это нормально, поскольку во время процедуры происходит травмирование цервикального канала, эндометрия и мышечного слоя матки. Постепенно выделения осветляются, приобретают желтоватый цвет и продолжаются еще около 2-3 недель. При развитии обильных кровотечений, следует немедленно обратиться к врачу, поскольку это может быть симптомом серьезных осложнений.
Болезненные ощущения после гистероскопии
Слабые и умеренные болезненные ощущения после гистероскопии являются вариантом нормы. Локализуются они внизу живота, могут отдавать в крестец или поясницу. Возникают они из-за растяжения полости матки и травмирования шейки. Для облегчения состояния рекомендуется назначать «сильные» НПВС типа кеторола или индометацина. Если боль нарастает, становится нестерпимой, следует немедленно обращаться за медицинской помощью, поскольку это может быть признаком серьезных осложнений.

Чтобы восстановительный период прошел благополучно, необходимо придерживаться нескольких правил:
- Принимайте все препараты, которые вам назначил врач. Как правило, речь идет об антибиотиках, которые назначаются с профилактической целью для предупреждения развития инфекций.
- Откажитесь от вагинального секса до следующих менструаций.
- На период кровянистых выделений лучше пользоваться прокладками. Тампоны категорически запрещены.
- Также во время восстановительного периода не рекомендуется пользоваться вагинальными свечами, таблетками и кремами.
- Воздержитесь от интенсивных физических нагрузок.
- Не забывайте о личной гигиене. Туалет половых органов должен осуществляться не реже 2 раз в сутки, а в идеале после каждого мочеиспускания и дефекации.
- Для предупреждения развития запоров, соблюдайте режим питания. Не забывайте о своевременном опорожнении мочевого пузыря.
Какие осложнения может вызвать гистероскопия
Как и при любом инвазивном вмешательстве, после гистероскопии возможно развитие осложнений. Наиболее грозное и опасное из них — это перфорация стенки матки, которая сопровождается кровотечениями. Для устранения перфорации требуется повторное хирургическое вмешательство для ушивания дефекта. При отсутствии лечения, может развиться перитонит.
Также могут быть и другие осложнения:
- Гематометра — скопление крови в полости матки из-за невозможности ее отхождения. Клинически проявляется нарастающими спазматическими болями внизу живота и ухудшением общего самочувствия. Для лечения могут применяться консервативные методы (назначение препаратов, улучшающих сокращение матки или спазмолитиков при патологическом сокращении шейки матки), или хирургические, при которых проводится повторное вмешательство с эвакуацией внутриматочного содержимого.
- Инфекционные осложнения. Они проявляются нарастанием температуры тела, симптомами интоксикации, болями внизу живота. Чуть позже присоединяются патологические выделения, которые могут иметь зловонный запах.
- Кровотечения. Возможны после лечебной гистероскопии, когда, например, производится удаление миоматозных узлов или полипов. При наличии обильных кровотечений, особенно если они длятся несколько дней, следует проконсультироваться с врачом.
В целом гистероскопия относится к малотравматичным вмешательствам и вероятность осложнений после нее гораздо ниже, чем при других, более обширных методах лечения.
Какие процедуры может выполнить гинеколог во время гистероскопии?
Гистероскопия — диагностическая процедура, однако, во время нее могут быть выполнены некоторые дополнительные манипуляции, в том числе лечебные:
- Биопсия — процедура, во время которой удаляют кусочек патологически измененных тканей и отправляют его в лабораторию для гистологического, цитологического исследования. Это позволяет установить более точный диагноз, подтвердить или исключить наличие в матке злокачественной опухоли.
- Гистероскопия позволяет удалять различные патологические образования, выступающие в полость матки, такие как полипы, миомы.
- Можно устранить источник кровотечения с помощью электрокоагуляции, низкой температуры (криохирургия).
- Установить устройства для контрацепции в маточные трубы.
В клинике «Евроонко» в Москве для женщин действуют специальные комплексные программы, например, гистероскопия с раздельным диагностическим выскабливанием шейки и тела матки. В стоимость услуги входит 6-часовое пребывание в комфортабельном стационаре, питание, и все сопутствующие процедуры.
Когда может выполняться гистероскопия?
Чаще всего врачи-гинекологи назначают гистероскопию в следующих ситуациях:
- Обнаружение атипичных клеток по результатам ПАП-теста.
- Вагинальные кровотечения в промежутках между месячными, в постменопаузе.
- Бесплодие — когда не получается забеременеть в течение года регулярной половой жизни.
- Частые выкидыши.
- Необходимость уточнить состояние матки при рубцах, миомах.
- Необходимость подтвердить или исключить определенные диагнозы с помощью биопсии.
Риски гистероскопии
В целом, это безопасная процедура. В течение двух дней после гистероскопии могут беспокоить небольшие кровянистые выделения из влагалища и спазмы в нижней части живота — это нормально. Более серьезные осложнения встречаются очень редко, не более чем в 1% случаев.
В «Евроонко» исследование выполняет высококвалифицированный специалист — Наталья Евгеньевна Левченко, онкогинеколог, профессор, доктор медицинских наук. В клинике применяется оборудование для гистероскопии ведущих мировых производителей, которое позволяет провести исследование максимально комфортно и безопасно.
Какие альтернативы есть у гистероскопии?
Гистероскопию можно заменить некоторыми другими диагностическими процедурами, но далеко не во всех случаях:
- Трансабдоминальное УЗИ органов малого таза через переднюю брюшную стенку помогает выявить заболевания, которые приводят к тазовым болям, нарушениям менструального цикла, вагинальным кровотечениям, бесплодию.
- Трансвагинальное УЗИ выполняется специальным датчиком, введенным через влагалище. Оно позволяет получить более информативные изображения матки и ее придатков.
- Аспирационная биопсия миометрия. Для этой процедуры не требуется гистероскопия: с помощью вагинальных зеркал визуализируют шейку матки и вводят через нее трубку, соединенную с аспиратором.
Все эти исследования не настолько информативны, как гистероскопия. Однако, если начать диагностику с них, в ряде случаев эндоскопическое исследование матки может не потребоваться. Иногда эти методы диагностики применяют как альтернативу, если для гистероскопии по тем или иным причинам имеются противопоказания.

Тюляндина Александра Сергеевна
Заведующая отделением лекарственных методов лечения злокачественных опухолей №4 НИИ клинической онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, профессор кафедры онкологии ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет), председатель Комитета молодых онкологов RUSSCOjr, член правления RUSSCO, член Комитета молодых онкологов ESMO, член Flims Alumni Club, доктор медицинских наук, Москва
Совсем недавно внедрение миниинвазивных хирургических вмешательств рассматривалось как перспективное направление в лечении гинекологических опухолей. Причины, приведшие к вышеизложенной тенденции, очевидны и связаны с попыткой улучшить качество хирургического лечения, переносимость оперативного вмешательства самой пациенткой, уменьшение длительности пребывания на койке, снижение кровопотери во время операции. Эти благие намерения привели к появлению многочисленных исследований II фазы, а также публикаций собственных наблюдений после лапароскопических и робот-ассистируемых операций в онкогинекологии.
Еще совсем недавно лапароскопические вмешательства внедрялись при распространенном раке яичников. Только после публикации работ, которые показали достоверное снижение продолжительности жизни больных, эксперты полностью отказались от хирургических вмешательств из минидоступа при данной патологии [1]. Полученные результаты связаны с несколькими причинами, это отсутствие возможности выполнить адекватную ревизию брюшной полости с целью удаления всех видимых очагов болезни, что приводит к снижению числа полных оптимальных циторедукций. Лапароскопическая операция при раке яичников имеет ценность только как диагностическая манипуляция для подтверждения диагноза и оценки распространенности процесса. За редким исключением обсуждается вопрос использования лапароскопических вмешательств у больных ранним раком яичников при органосохранных операциях. Лапароскопические операции «second look», популярные в 90-х годах XX столетия, сейчас вспоминаются как историческое наследие прошлого.
С потерей широкого распространения миниинвазивных современных методик при раке яичников активное развитие лапароскопической и робот-ассистированной хирургии продолжилось при лечении рака шейки матки и эндометрия. У больных раком шейки матки это казалось обоснованным при ранних стадиях заболевания. Проведенные ранее ретроспективные анализы по сравнению расширенных доступов и лапароскопий демонстрировали равнозначную эффективность обоих методов [2]. На основании полученных данных было инициировано рандомизированное проспективное исследование LAAC, под эгидой которого прошли все гинекологические сессии и конгрессы 2018 года [3]. Работа посвящена сравнению открытой хирургии и операций из миниинвазивных доступов с использованием лапароскопических (84,4%) или робот-ассистируемых (15,6%) вмешательств. Дизайн исследования был спланирован как non-inferiority с целью доказать, что миниинвазивная техника не уступает в эффективности обычному хирургическому вмешательству. В работу включена 631 пациентка с IА1, IА2, IB1 стадиями рака шейки матки. Участие приняли 33 центра, находящиеся в большинстве случаев на территории США, а также в нескольких странах Латинской Америки. Перед включением в исследование все центры проходили аккредитацию, которая включала оценку качества выполнения операций в объеме Piver II и III лапаротомным и миниинвазивным доступами.
Набор в исследование завершился досрочно после промежуточного анализа. В марте 2018 года были доложены неожиданные результаты исследования, которые привели к многочисленным обсуждениям данной работы на всех последующих конференциях. Конечной точкой являлось 4,5-летняя безрецидивная выживаемость (БРВ), в группе открытой хирургии данный показатель составил 96,5% и в группе мининвазивной хирургии - 86%. При проведении superiority анализа было получено достоверное увеличение 3-летней БРВ в группе лапаротомии по сравнению с группой миниинвазивных вмешательств: 97,1% и 91,2% соответственно (HR=3,74; р=0,002). Та же тенденция наблюдалась и при оценке выживаемости больных: 99,0% против 93,8% (HR 6,00; 95% CI 1,77-20,30). Частота локорегиональных рецидивов была достоверно выше в группе лапароскопических вмешательств. При этом авторы не нашли взаимосвязи с определенными центрами участниками, все возникшие рецидивы распределились между 14 центрами. Даже при опухолях менее 2 см не было получено преимуществ от использования миниинвазивных операций.
Любопытные факты по оценке качества жизни были доложены на конференции IGCS 2018 в Киото. Оказалось, что качество жизни при использовании лапароскопических и робот-ассистируемых вмешательств было достоверно выше только в первые 6 дней после операции, а в течении последующих 6 месяцев наблюдения качество жизни было сопоставимо в обеих исследуемых группах. Очевидно, что расширенные операции в объеме Piver III при любой методике, если выполнены качественно, будут иметь одинаковую частоту осложнений. Это было озвучено в исследовании LAAC: частота хирургических осложнений отмечалась в одинаковом проценте случаев при лапароскопическом (10,5%) и лапартомном (11,4%) доступах.
Главные координаторы исследования P. Ramirez, M. Frumovitz и A. Obermair, являющиеся ведущими специалистами в хирургическом лечении рака шейки матки и сделавшие ставку на миниинвазивную хирургию, не ожидали полученных результатов. Детально проанализировав выводы ретроспективных работ, они нашли множество погрешностей в выполнении этих анализов, начиная от небольшой прослеженности отдаленных результатов, что могло привести к отсутствию статистических различий между группами открытой и лапароскопической хирургии. Другим объяснением может быть то, что при выполнении лапароскопической хирургии использование маточного манипулятора может увеличить вероятность «разбрызгивания» опухолевых клеток в малом тазу. Второй причиной может быть инсуффляция CO2 - этот газ может потенцировать деление опухолевых клеток, что было показано в нескольких исследованиях [4].
Данные LAAC опубликованы в NEJM в октябре 2018 года и привели к отказу от лапароскопических операций большинством экспертов. Уже в последней версии рекомендаций NCCN 2019 года прописано, что лапароскопические вмешательства при ранних стадиях рака шейки матки не исключаются, однако должны обсуждаться с пациентками возможные риски и польза от такого подхода. Вероятнее всего в ближайшее время в большинстве рекомендаций эксперты откажутся от рутинных лапароскопических вмешательств при раке шейки матки.
Сразу же за результатами исследования LAAC на ASCO 2018 были опубликованы результаты оценки 5-летней выживаемости больных раком шейки матки c IB1 стадией по данным национального регистра США [5]. В анализ включено 2830 женщин, 982 пациентки в группе открытых операций и 910 - в группе лапароскопий. 5-летняя ОВ была достоверно выше в группе лапаротомий.
Сегодня начинает казаться, что лапароскопическая и робот-ассистируемая хирургия сохраняет свои позиции только при раке эндометрия. Однако в октябре 2018 года Cochrane публикует результаты большого анализа по сравнению лапароскопий и лапаротомий при раннем раке эндометрия [6]. Анализ 9 включенных исследований и 4389 пациенток показал, что оба метода имеют одинаковую безрецидивную и общую выживаемость. Не было получено статистически значимых различий по частоте хирургических осложнений. Авторы делают выводы о низкой достоверности в пользу преимущества лапароскопических операций. Безусловно, это ретроспективный анализ, но в будущем он приведет к инициации проспективных исследований, посвященных этой проблеме.
В заключение хочется отметить, что все развивается по синусоиде. Мы наблюдали активный тренд по внедрению лапароскопических операций в онкогинекологии за последнее десятилетие. Теперь, наоборот, отмечено явное снижение интереса и моды к этому виду хирургии. Безусловно, нельзя полностью исключать миниинвазивные вмешательства из списка возможных хирургических опций. Этот подход показан определенной группе больных с большим индексом массы тела, декомпенсированной сопутствующей патологией и не должен становиться рутинным стандартом в онкологических клиниках, как это распространено во многих стационарах России.
Таким образом, 2018 год прошел под эгидой большого разочарования в миниинвазивной хирургии в онкогинекологии.
Читайте также:
- Значение ложных голосовых связок. Зависимость голоса от голосовых складок
- Влияние имипрамина на эмоции. Расщепление комплекса ориентировочной реакции
- Туберкулез легких
- Стоматологическая диагностика. Современное состояние диагностики в стоматологии
- Дефекты развития лица эмбриона. Дефекты челюстей плода
