Лечение трипаносомоза глаз. Профилактика
Добавил пользователь Morpheus Обновлено: 21.01.2026
Управление Роспотребнадзора по Республике Марий Эл
Профилактика болезней, общих для человека и животных. Африканский трипаносомоз или «сонная болезнь» - RSS
Профилактика болезней, общих для человека и животных. Африканский трипаносомоз или «сонная болезнь»
Африканский трипаносомоз или «сонная болезнь» − заболевание людей и животных, вызываемое паразитическим простейшим вида Trypanosoma brucei, переносчиком которого является муха цеце.
Заражение человека происходит при укусе насекомого-переносчика − мухи цеце. Обычно заражение человека возбудителем западноафриканского трипаносомоза происходит недалеко от водоемов и вдоль берегов рек, в то время как заражение возбудителем восточноафриканского трипаносомoза − в саваннах и на местах недавно вырубленных тропических лесов.
Сонная болезнь эндемична в странах тропической Африки.
Основным хозяином является человек, дополнительным − свиньи.
Мухи цеце нападают в светлое время суток, преимущественно на открытой природе, некоторые антропофильные виды могут залетать в поселки. Кровь пьют и самцы, и самки. В организм переносчика трипаносомы попадают при питании кровью зараженного позвоночного животного или человека. Около 90% трипаносом, поглощенных мухой цеце, погибают.
Достаточно одного укуса зараженной мухи, чтобы человек заболел «сонной болезнью», муха со слюной за один укус выделяет около 400 тысяч трипаносом. Больной становится источником инвазии примерно с десятого дня после заражения и остается им на протяжении всего периода болезни, даже в период ремиссии и отсутствия клинических проявлений.
Заболеваемость носит сезонный характер. Пик приходится на сухой сезон года, когда мухи цеце концентрируются около оставшихся не пересохшими водоемов, интенсивно используемых населением для хозяйственных нужд.
Симптомы заболевания
После укуса мухи цеце начинается инкубационный период, который длится 1-3 недели. На месте укуса иногда формируется трипаносомидный шанкр, в котором паразиты активно размножаются, проникая в ткани, кровь и лимфу, и который исчезает через 5-7 дней. Первыми симптомами являются приступы лихорадки, головные боли и боли в суставах, часто сильно увеличиваются в размерах лимфатические узлы. У некоторых больных формируются большие вздутия шейных и затылочных узлов. Если не начать лечение, болезнь продолжает прогрессировать, вызывая анемию, нарушения в работе сердца, почек, эндокринной системы.
Профилактика
Комплекс мероприятий по предотвращению распространения заболевания включает выявление и лечение африканского трипаносомоза, общественную и индивидуальную профилактику населения, борьбу с переносчиками. Имеет значение серологическое обследование, прежде всего людей, относящихся к группе риска (охотники, лесорубы, строители дорог и др.). Обследование должно проводиться не реже двух раз в год (перед сезоном и после сезона наибольшей опасности заражения).
Сонная болезнь - Памятки для населения
Памятки для населения
Сонная болезнь
Сонная болезнь или африканский трипаносомоз − заболевание людей и животных, вызываемое паразитическим простейшим вида Trypanosoma brucei, переносчиком которого является муха цеце.
В 1896-1906 годах Уганду и бассейн реки Конго поразила эпидемия сонной болезни. Болезнетворный агент и переносчик инфекции открыл в 1902-1903 годах Дэвид Брюс. Первое эффективное лекарство атоксил (на основе мышьяка) было разработано Паулем Эрлихом и Киёси Сигой и введено в практику в 1910 году. Препарат, однако, оказался токсичным для человека и мог вызвать слепоту в 82% случаев.
Этиология
Сонная болезнь эндемична в 36 странах тропической Африки. Ежегодно регистрируется до 40 тысяч новых случаев. Вероятно, реальное число заболевших значительно больше и может составлять до 300 тысяч. Около 50 миллионов человек проживают в условиях риска заражения.
Мухи цеце нападают в светлое время суток, преимущественно на открытой природе, некоторые антропофильные виды могут залетать в поселки. Кровь пьют и самцы, и самки. В организм переносчика трипаносомы попадают при питании кровью инвазированного позвоночного животного или человека. Около 90% трипаносом, поглощенных мухой цеце, погибают.
Достаточно одного укуса зараженной мухи, чтобы человек заболел сонной болезнью, муха со слюной за один укус выделяет около 400 тысяч трипаносом. Больной становится источником инвазии примерно с десятого дня после заражения и остается им на протяжении всего периода болезни, даже в период ремиссии и отсутствия клинических проявлений.
Симптомы
После укуса мухи цеце начинается инкубационный период, который длится 1-3 недели. На месте укуса иногда формируется трипаносомидный шанкар, в котором паразиты активно размножаются, проникая в ткани, кровь и лимфу, и который исчезает через 5-7 дней. Первыми симптомами являются приступы лихорадки, головные боли и боли в суставах, часто сильно увеличиваются в размерах лимфатические узлы. У некоторых больных формируются большие вздутия шейных и затылочных узлов. Если не начать лечение, болезнь продолжает прогрессировать, вызывая анемию, нарушения в работе сердца, почек, эндокринной системы.
Комплекс мероприятий по оздоровлению очагов сонной болезни включает выявление и лечение африканского трипаносомоза, общественную и индивидуальную профилактику населения, борьбу с переносчиками. Имеет значение серологическое обследование, прежде всего людей, относящихся к группе риска (охотники, лесорубы, строители дорог и др.). Обследование должно проводиться не реже двух раз в год (перед сезоном и после сезона наибольшей опасности заражения).
Трипаносомоз
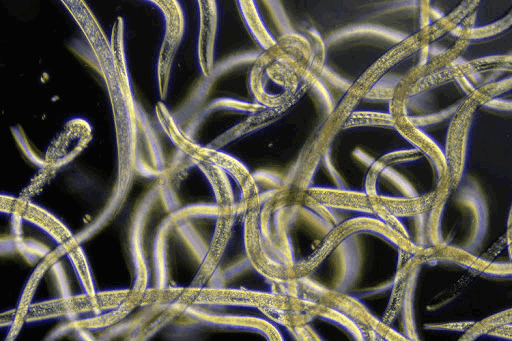
Трипаносомоз - еще одно заболевание, вызываемое простейшими, а в частности простейшими рода Trypanosome.
Патогенными для человека являются T.brucei и T.cruzi, которые занимают различные территории и передаются разными насекомыми.
Трипаносомоз, вызываемый T.brucei, также называется африканским или сонной болезнью , из названия понятно, какой район для него эндемичен.
Различают две формы африканского трипанососмоза - гамбийскую (вызываемую T.b.gambiense, распространенную в Западной и Центральной Африке) и родезийскую (вызываемую T.b.rhodesiense, эндемичной для Восточной Африки).
Данные формы имеют свои особенности:
При гамбийском трипаносомозе основным хозяином является человек, а второстепенным свинья. Переносчиком возбудителя является муха цеце (обитает в зарослях растительности по берегам рек и ручьев, проявляет наибольшую активность в светлое время суток).
При родезийской форме основными хозяевами и источником инфекции являются животные (антилопы, крупный рогатый скот, овцы) и реже человек. Возбудителя родезийского трипаносомоза также переносят мухи цеце, но обитающие в саваннах и саванных лесах, более светолюбивые и менее требовательны к влаге.
Человек заражается при укусе мухи цеце, у которой в слюнных железах содержатся инвазионные формы трипаносом (это значит, что трипаносомоз - это трансмиссивное заболевание, но также существует вертикальная передача инфекции - от матери к плоду).
После укуса мухи трипаносомы размножаются в подкожно-жировой клетчатке (на месте входных ворот инфекции формируются шанкр), далее через несколько дней распространяются по лимфатическим и кровеносным сосудам и в дальнейшем продолжают паразитировать в органах и тканях, основные это лимфатическая система, центральная нервная система и сердце. Антитела, выработанные в ответ на внедрение паразита, подавляют его размножение, но в результате изменения комбинации гликопротеинов на своей поверхности трипаносомы могут ускользнуть от иммунного ответа хозяина и запустить новый цикл размножения, с чем связано чередование обострений и ремиссий заболевания.
Больной заразен, начиная с 10 дня после укуса и в течение всего времени клинических проявлений.
Клинические проявления имеют три стадии: кожная, гемолимфатическая и стадия поражения ЦНС. Клиническая картина родезийского трипаносомоза отличается более острым и тяжелым течением и ранним поражением центральной нервной системы, прогноз более тяжелый.
При кожной стадии папула может развиться на месте укуса мухи цеце в течение нескольких дней до 2 недель. Она развивается в темновато-красный, болезненный, плотный узелок, который может изъязвляться (трипаносомный шанкр). Шанкр чаще встречается при инфицировании T. b. rhodesiense, и у туристов, нежели коренного населения.
Гемолимфатическая стадия развивается в течение нескольких месяцев при инфицировании T. b. gambiense и нескольких недель - при заражении T. b. rhodesiense. Характерны перемежающаяся лихорадка, головные боли, озноб, мышечные и суставные боли, гиперестезия, лимфаденопатия и отек лица. У светлокожих пациентов может наблюдаться эритематозная сыпь в виде кольцевых эритем до 7-10 см в диаметре. Для гамбийской формы характерен симптом Уинтерботтома (увеличение лимфоузлов в заднем шейном треугольнике).
Стадия поражения ЦНС при гамбийской форме длится от нескольких месяцев до нескольких лет после начала острой болезни. При родезийской форме болезнь более быстрая, и поражение нервной системы часто происходит в течение нескольких недель. Поражение ЦНС вызывает постоянную головную боль, неспособность сконцентрироваться, поведенческие изменения (например, прогрессирующая усталость и безразличие), дневную сонливость, тремор, атаксию и в итоге кому. Без лечения смерть наступает в течение нескольких месяцев от начала заболевания в случае T. b. rhodesiense и в течение 2-3 лет в случае T. b. gambiense. Пациенты без лечения умирают в коме от истощения или вторичных инфекций.
Для диагностики трипаносомоза используется световая микроскопия крови (тонкий или толстый мазок) или пунктата лимфоузла. Концентрация трипаносом в крови часто низкая, поэтому различные концентрационные методики увеличивают чувствительность диагностических методов. Серологической обследование часто неинформативно.
Всем пациентам с африканским трипаносомозом должна быть выполнена люмбальная пункция и исследование спинномозговой жидкости для определения стадии заболевания. При вовлечении СМЖ в патологический процесс наблюдается повышение уровней лимфоцитов (≥ 6 клеток/мкл), общего белка и неспецифического IgM.
Лечение африканского трипаносомоза зависит от вида возбудителя и стадии заболевания.
Для предотвращения африканского трипаносомоза необходимо избегать эндемичных районов и предохраняться от укусов мух цеце. Следует носить закрытую одежду, использовать репелленты.
Американский трипаносомоз (или болезнь Шагаса) вызывается T.cruzi. Болезнь характеризуется хроническим течением с преимущественным поражением сердца, желудочно-кишечного тракта и нервной системы.
Трипаносома крузи передается клопами подсемейства Triatominae (поцелуйные клопы) и эндемична в Южной и Центральной Америке, Мексике, редко в США. К носителям, помимо людей, относятся домашние собаки, опоссумы, броненосцы, крысы, еноты и многие другие животные. Значительно реже происходит передача при употреблении в пищу зараженных инфицированными клопами или их испражнениями тростникового сока или пищи, трансплацентарно от инфицированной матери плоду либо при переливании крови или трансплантации органов от инфицированного донора.
Патогенез заболевания сходен с таковым для африканского трипаносомоза.
Клинически болезнь Шагаса протекает в трех стадиях: острая, латентная и хроническая.
Острая болезнь Чагаса в эндемичных районах обычно развивается у детей и может быть бессимптомной. Симптомы могут появляться через 1-2 недели после заражения. на месте внедрения паразита появляется эритематозное поражение кожи. Если место инвазии - конъюнктива, развивается односторонний периокулярный отек с конъюнктивитом и увеличением расположенных перед ушной раковиной лимфатических узлов (симптом Романьи).
Острая болезнь Чагаса смертельна у небольшого процента пациентов. К смерти приводят острый миокардит с сердечной недостаточностью или менингоэнцефалит. У остальных симптомы утихают без лечения.
Первичная острая болезнь Чагаса у пациентов ВИЧ-инфекцией в продвинутой стадии может протекать в тяжелой и нетипичной форме - не только с поражениями кожи, но и с развитием абсцесса головного мозга.
Латентная стадия не имеет никаких клинических проявлений и может быть выявлена только при скрининговом серологическом обследовании.
Хроническая болезнь Шагаса развивается у 20-30% пациентов после латентной фазы, которая может тянуться годы или десятилетия. Вероятнее всего этому способствует аутоиммунная реакция организма с преимущественным поражением сердца и желудочно-кишечного тракта.
Сердечные нарушения обычно манифестируют нарушениями проводимости, в том числе блокадой правой ножки пучка Гиса или блокадой передней ветви левой ножки пучка Гиса. Хроническая кардиомиопатия часто приводит к слабому расширению всех полостей сердца, апикальным аневризмам и прогрессированию поражения проводящей системы сердца. У пациентов наблюдается сердечная недостаточность, обмороки, внезапная смерть из-за блокады сердца, желудочковой аритмии или тромбоэмболии.
Поражение желудочно-кишечного тракта проявляется как мегаэзофагус - дисфагия, которая может привести к легочным инфекциям или к серьезной гипотрофии. Или мегаколон, который приводит к кишечной непроходимости.
Для диагностики во время острой фазы болезни информативен анализ тонкого и толстого мазков крови, микроскопия окрашенных препаратов пунктата лимфоузлов. Напротив, для латентной инфекции или хронической болезни характерно небольшое количество паразитов в крови, в связи с чем могут быть использованы методы концентрации. Серологические исследования могут использоваться как скрининговые, положительный результат требует дообследования.
Антипаразитарное лечение показано для всех случаев болезни в острой стадии, пациентам с врождённой формой болезни либо с реактивированной инфекцией, а также детям до 18 лет в латентной стадии заболевания. Чем моложе пациент и чем раньше начато лечение, тем с большей вероятностью оно приведёт к паразитологическому выздоровлению.
Эффективность лечения снижается по мере увеличения продолжительности инфекции, а побочные эффекты более вероятны у взрослых. Лечение рекомендуется проводить лицам в возрасте до 50 лет, если нет признаков прогрессирующего повреждения сердца или желудочно-кишечного тракта. В случае пациентов старше 50 лет лечение подбирают индивидуально, с учетом возможных рисков и пользы.
При появлении выраженных симптомов хронической болезни Шагаса со стороны сердечно-сосудистой или пищеварительной системы противопаразитарные препараты не рекомендуются.
Патогенетическая терапия включает лечение сердечной недостаточности, применение кардиостимуляторов при блокаде сердца, антиаритмических препаратов, трансплантацию сердца, расширение пищевода, инъекции ботулотоксина в нижний сфинктер пищевода и оперативные вмешательства при мегаколон.
Профилактика болезни Шагаса включает мероприятия, направленные на снижение численности клопов а также меры индивидуальной защиты, например сетки на кровать при необходимости ночевать в глиняном жилье.
Будьте здоровы, путешествуйте, но не забывайте о мерах индивидуальной защиты. И если все же не удалось избежать укусов мухи цеце или поцелуйного клопа - будьте внимательны к себе, ведь даже в течение нескольких месяцев и лет могут появиться признаки паразитарного заболевания. И Вы уже знаете, куда обратиться за помощью!
Услуги, упомянутые в статье*:
Микроскопическое исследование венозной крови методом концентрации на возбудителей филяриатозов и трипаносомозов (А26.05.010.s01)
Микроскопическое исследование крови методом толстой капли на возбудителей филяриатозов, трипаносомозов (А26.05.010.s02)
*Назначение и интерпретация результатов анализов должны проводиться только лечащим врачом
Лейшманиоз
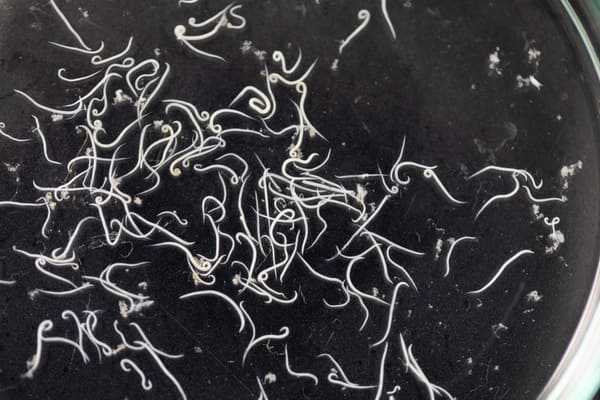
Мы продолжаем рассказывать о простейших, которые могут вызывать у человека самые разнообразные заболевания. Казалось бы - одноклеточный организм! Но все не так просто, как нам хотелось бы.
Одним из таких заболеваний является лейшманиоз - звучит жутко, но из названия понятно, что вызывается он простейшими рода Leishmania.
Лейшманиозы распространены по всему миру - инфекция у человека вызывается 20 видами Leishmania !
В зависимости от географии, они делятся на лейшманиозы Нового и Старого Света. В зависимости же от клинических проявлений - при поражении только кожи, кожи и слизистых оболочек или внутренних органов - они подразделяются на кожную, кожно-слизистую и висцеральную форму болезни соответственно.
Возбудителями кожного лейшманиоза являются L.L. major, L.L. tropica (Центральная и Юго-восточная Азия, средний Восток, Африка), L.L. aethiopica (Эфиопия, Кения, Уганда), L.L. mexicana, L.V. braziliensis (Центральная и Южная Америка, Мексика, Перу и Аргентина), L.V. guyanensis (Панама, Коста-Рика, Эквадор, Перу, Венесуэла). Последние 4 группы из них способны вызвать диффузные кожные лейшманиозы и кожно-слизистые формы заболевания. Висцеральные формы лейшманиоза чаще всего вызывают L.L. infantum, L.L. donovani (Средиземноморье, Северная Африка, Ближний Восток, Центральная и Юго-Западная Азия, Балканы, Китай, Индия, Китай, Пакистан, Центральная и Южная Америка).
Лейшманиозы - группа трансмиссивных заболеваний, это значит, что они передаются через укусы насекомых, в частности при укусах москитов видов Phlebotomus , Lutzomyia в зависимости опять же от географии. Источником инфекции и резервуаром являются человек и различные виды животных грызуны, собаки и другие - это также зависит от видов лейшманий и географического положения.
После укуса москита лейшмании могут либо оставаться в пределах кожи ограниченно или диффузно, либо распространяться на слизистые оболочки - в основном носа, ротоглотки, либо через лимфатическую систему разноситься к другим органам и тканям организма - проникать в селезенку, костный мозг, печень, кишечник и др. Висцеральный лейшманиоз является наиболее тяжелой формой заболевания. Форма и тяжесть заболевания зависят не только от вида лейшмании, но и от иммунной защиты организма, поэтому тяжелее болеют дети раннего возраста, а для пациентов с ВИЧ-инфекцией лейшманиоз рассматривается как оппортунистическое заболевание.
Поражение кожи развивается на месте укуса москита через несколько недель или даже месяцев. Множественные поражения кожи могут быть результатом неоднократных укусов. Изначально это папула, которая медленно увеличивается, в центре образуется язвочка и развивается приподнятая эритематозная граница, где сконцентрированы внутриклеточные паразиты. Язвочки чаще всего безболезненны, но присоединение вторичной бактериальной флоры может привести к прогрессированию заболевания и нагноению. Изъязвления обычно заживают спонтанно через несколько месяцев, но могут сохраняться в течение многих лет.
Диффузный кожный лейшманиоз.
Диффузная форма кожного лейшманиоза развивается редко, в основном лейшманиями Нового Света. Характеризуется распространенным утолщением кожи в форме бляшек, папул или множественных узелковых образований, особенно на лице и наружней повержности конечностей, напоминая поражения при лепре. Изъязвления и поражение слизистых оболочек чаще отсутствуют, но болезнь не проходит спонтанно и отличается склонностью к рецидивам после лечения.
Начинается с первичной кожной язвочки, как и другие формы кожного лейшманиоза. Это поражение кожи проходит спонтанно. Метастатическое распространение процесса на слизистые оболочки носа, ротоглотки могут произойти как на ранней стадии болезни, так и спустя многие годы. Патогенетически при данном процессе происходит разрушение мягких тканей и хрящей, отек носа и губ. Как правило, у пациентов появляются заложенность носа, выделения и боль. Но болевой синдром может отсутствовать. Со временем развиваются массивные поражения носа, неба или лица, обезображивающие больного. Опасно присоединение вторичной бактериальной инфекции. Летальные исходы у таких пациентов наступают из-за бактериальных осложнений и истощения.
Клинические проявления могут развиться остро (например при иммунодефицитных состояниях), но могут начать проявляться через многие месяцы. Некоренные жители могут заразиться при посещение эндемичных районов - в таком случае инкубационные=й период может длиться до 2 лет.
Характерны волнообразная лихорадка с ознобом, чаще всего два пика температуры в течение суток, гепатоспленомегалия, лимфаденопатия, истощение, отеки. Лабораторно выявляются панцитопения, гипоальбуминемия, гипергаммаглобулинемия, нарушение свертываемости крови. Поражения кожи встречаются редко. Нередко присоединяется вторичная бактериальная инфекция. При несвоевременном неадекватном лечении или его отсутствии в течение нескольких месяцев-лет наступает летальный исход.
У пациентов, у которых нет клинических проявлений (например жители эндемичных районов), либо наступает самоизлечение, либо у оставшихся в живых после успешного лечения, наблюдается резистентность к дальнейшим заражениям - формируется стойкий иммунитет. Однако возможно возникновение рецидива болезни через многие годы.
В Индии висцеральный лейшманиоз называют “кала-азар” или “черная болезнь”, так как из-за поражения надпочечников часто отмечается потемнение кожи лица, рук, живота, стоп. Примерно у 10% таких больных через несколько месяцев и до двух лет возникает посткалаазарный кожный лейшманиоз - поражение характеризуется плоскими или узловыми повреждениями кожи, в которых содержится множество паразитов - эти поражения считаются резервуаром, они способствуют распространению инфекции в этих областях.
При подозрении на лейшманиоз любой формы для подтверждения диагноза могут быть использованы следующие методы диагностики:
Микроскопия и ПЦР-исследование пунктатов органов и тканей, соскоба с пораженной области кожи
ПЦР-исследование крови может быть информативным при лейшманиозе у пациентов с ВИЧ-инфекцией
Серологическое исследование (ИФА IgG) применяется при подозрении на висцеральный лейшманиоз, но стоит помнить, что возможно получение как ложноотрицательных результатов (например, при ВИЧ-инфекции, при раннем и пожилом возрастах), так и ложноположительных (СКФ, лейкоз, сифилис, и др.). При этом серологические исследования не проводятся для определения эффективности проводимого лечения - это связано с длительным обнаружением IgG в крови после излечения.
Также может быть информативным культуральное исследование пунктатов - посев на специальные среды.
Лечение лейшманиоза является сложным, что в некоторой степени обусловлено возрастающей резистентностью микроорганизмов к применяемым препаратам. Выбор препаратов зависит от следующих факторов:
Подтвержденный диагноз лейшманиоза
Географический регион (место заражения)
Вероятная восприимчивость микроорганизма к лечению
Иммунный статус хозяина (иммунодефицитные состояния)
Подходы к лечению кожного и висцерального лейшманиоза сильно отличаются. При кожном лейшманиозе имеет большое значение клиническая тяжесть инфекции, например при кожном ограниченном лейшманиозе без риска возникновения проявления со стороны слизистых оболочек может применяться только местная терапия, в то время как при кожно-слизистом или диффузном кожном лейшманиозах необходима системная терапия. В случае висцерального лейшманиоза кала-азар при отсутствии лечения летальность составляет до 90%, здесь не стоит вопрос о необходимости терапии, выбор препаратов основан на доступности и сведениях о резистентности. А при развитии лейшманиоза на фоне прогрессирующей ВИЧ-инфекции требуется не только системная терапия противопаразитарными препаратами, но и скорейшее начало антиретровирусной терапии, без которой клинический эффект от проводимой терапии будет недостаточен.
Почему важно знать о лейшманиозе?
География путешествий человека расширяется, но для того, чтобы увеличить риск заражения лейшманиозом, не обязательно лететь в южную Африку. Риск заражения лейшманиозом остается при посещении стран ближнего зарубежья: Азербайджана, Армении, Грузии, Кыргызстана, Таджикистана, Узбекистана в пик активности переносчиков возбудителя. В России регистрируются только завозные случаи лейшманиоза. Инкубационный период развития заболевания у туристов может достигать нескольких лет, поэтому очень важны сведения о посещении и длительности пребывания на тех или иных эндемичных территориях, а также указания на взаимодействия с москитами и другими вредными насекомыми :)
Специфической профилактики не разработано, поэтому путешественникам в эндемичных областях на открытые участки кожи следует использовать средства от насекомых, содержащие диэтилтолуамид, пропитывать одежду репеллентами. Также могут быть эффективны противомоскитные сетки, сетки на кроватях, особенно если пропитать их перметрином или пиретрумом.
Микроскопическое исследование соскобов с кожи, папул и краев язв на лейшмании (А26.01.01.s01)
Микроскопическое исследование пунктатов органов кроветворения на лейшмании (А26.05.014)
Определение антител класса G к возбудителю лейшманиоза в крофи методом ИФА
Определение ДНК лейшманий в крови методом ПЦР (А26.06.053.s01)
Автор: врач-инфекционист Университетской клиники H-Clinic Анастасия Александровна Коновалова.
Медицинский редактор: руководитель Университетской клиники, к.м.н., врач-инфекционист Коннов Данила Сергеевич.
Протозоозы
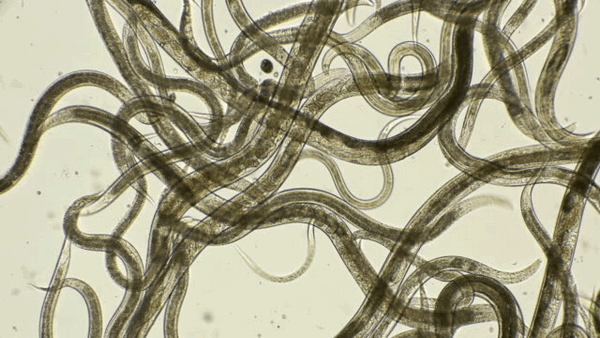
Протозойные заболевания или протозоозы - это заболевания, вызванные простейшими микроорганизмами. Такие инфекции могут быть системными (поражать весь организм) и кишечными (поражают желудочно-кишечный тракт).
К системным протозоозам относятся малярия, бабезиоз, лейшманиоз, токсоплазмоз, трипаносомоз.
В этой статье мы поговорим о простейших, которые поражают желудочно-кишечный тракт и вызывают кишечные инфекции.
Кишечные простейшие передаются фекально-оральным путем. Встречаются простейшие, а соответственно и инфекции, вызванные ими, по всеми миру, но наиболее широко распространены в областях с плохими санитарно-гигиеническими условиями и контролем за состоянием воды. Токсоплазмоз, кстати, тоже передается орально-фекальным путем, но при этом не поражает ЖКТ (подробнее по ссылке). Некоторые простейшие могут распространяться половым путем, например при орально-анальных контактах. Несколько разновидностей простейших вызывают тяжелые инфекции у пациентов с ВИЧ-инфекцией в продвинутой стадии.
Наиболее важными кишечными протозойными патогенами являются лямблии и амебы, криптоспоридии, бластоцисты и др.
Многие патогенные и непатогенные микроорганизмы могут находиться в кишечнике в одно и то же время. При этом инфекции, вызванные кишечными простейшими, в большинстве случаев характеризуются либо бессимптомным течением, либо стертой клинической симптоматикой. Настороженность по поводу паразитарных заболеваний имеет место при хронических диареях, кожных высыпаниях неясной этиологии, в некоторых случаях при длительно сохраняющейся эозинофилии в крови.
Постановка диагноза основывается на сборе эпидемиологического анамнеза, на выявлении симптомов и физикального обследования, а также на результатах лабораторного исследования кала на простейшие, а при наличии возможностей - на антигены возбудителей (криптопроридии, амебы, лямблии) или выявление генетического материала простейших с помощью молекулярно-генетических методов.
Микроскопический анализ кала является скрининговым методом диагностики, но может потребовать повторных исследований, методов концентрации и специальных окрашиваний. Наиболее информативным в этом плане может быть анализ трехдневного кала с применением специальных методов обогащения, с интервалом в две недели при первом отрицательном результате. Два последовательных отрицательных результата исследования кала на я/гельминтов и простейшие с интервалом в 14 дней позволяют исключить паразитарную (и глистную) инвазию, и дообследоваться в другом направлении.
Entamoeba histolytica/E. dispar .
Кишечный амебиаз распространен повсеместно, преимущественно в Центральной Америке, западной Южной Америке, Западной и Южной Африке и на индийском субконтиненте. В развитых странах большинство случаев происходит среди недавних иммигрантов и туристов, вернувшихся из эндемичных областей. Амебиаз является третьей по распространенности причиной смерти от паразитозов после малярии и шистосомоза.
Разновидностей амеб множество, но наиболее часто выявляются E.histolytica и E. dispar. Принято считать, что E.dispar непатогенна, но при ее выявлении в совокупности с клинической картиной заболевания, необходимость лечения рассматривается индивидуально.
Человек инфицируется при заглатывании цист с пищей или водой, или при оральных сексуальных контактах. После попадания в организм человека из цисты выходит трофозоит, который по мере продвижения по кишечнику может либо проникать в ткани кишечника, либо выводиться с калом (как в виде цист, так и в виде трофозоитов). Для заражения опасны только цисты.
В 90% случаев течение болезни бессимптомное. Если все же есть клиническая картина, то она может варьировать от легкой диареи до тяжелой дизентерии (боль в животе, диарея с кровью и слизью, снижение веса, повышение Т тела) и даже вызывать опасные осложнения: перфорацию кишечника, кишечные кровотечения и др. К факторам риска тяжелого течения относятся молодой возраст, беременность, лечение кортикостероидами, злокачественные новообразования, недоедание и алкоголизм, а также ВИЧ-инфекция.
Амебная инфекция может стать хронической и проявляться в виде диареи с болью в животе, слизью, метеоризмом, потерей веса. Могут обнаруживаться безболезненные, пальпируемые скопления - амебомы - по ходу толстого кишечника.
При внекишечном амебиазе наиболее часто поражается печень (абсцесс печени). Симптомы включают боль или дискомфорт в области печени, иррадиирующие в правое плечо, неустойчивую лихорадку, потливость, озноб, тошноту, рвоту, слабость и потерю веса. Абсцесс может перфорировать в поддиафрагмальное пространство, правую плевральную полость, правое легкое, перикард.
Основным методом диагностики, помимо общеклинических исследований (при которых можно обнаружить лейкоцитоз, эозинофилию, повышение СОЭ, повышение уровня трансаминаз печени и др.) является микроскопия кала. При этом 3х-кратное исследование повышает чувствительность до 95%. Чувствительностью до 100% обладают иммунохроматографические методы, основанные на выявлении антигена амеб в кале, кроме того они позволяют дифференцировать E.dispar и E.Histolytica. Так же могут использоваться молекулярно-генетические методы - ПЦР, и серологические методы - определение наличия антител к амебам, но серологические данные нельзя интерпретировать отдельно от других.
Из инструментального обследования информативным может быть колоноскопия, при которой выявляются характерные изъязвления стенки кишечника, а дальше проводится биопсия и гистологическое исследование материала, где могут быть выявлены трофозоиты амеб.
При подозрении на внекишечный амебиаз используют Р-графию органов грудной клетки, УЗИ органов брюшной полости, КТ с контрастированием или МРТ.
Лечение проводится только после лабораторного подтверждения диагноза. И оно включает в себя несколько схем последовательно применяемых противомикробных препаратов (действующих как на ткани кишечника, так и в просвете кишечника), в зависимости от тяжести заболевания, формы (кишечная или внекишечная), индивидуальной непереносимости препаратов и другого-другого-другого.
Лямблиоз не менее широко распространен - лямблии наиболее часто обнаруживаются при исследовании кала. Пути передачи те же, инфицирование происходит при проглатывании цист. После попадания в организм из цист выходит трофозоит, который паразитирует в тканях тонкой кишки, дозревает, а затем выводится в окружающую среду с калом в виде цист.
Характер клинических проявлений у человека, вероятно, зависит от ряда факторов, включая вирулентность изолята, паразитарную нагрузку и иммунный ответ хозяина. Половина переносит без симптомов, 15 процентов выделяют цисты без симптомов (бессимптомная инфекция встречается как у детей, так и у взрослых, а бессимптомное выделение кист может длиться шесть месяцев и более), 35-45% отмечают клинические симптомы острой или хронической инфекции.
Острый лямблиоз: диарея, недомогание, стеаторея, спазмы в животе и вздутие, метеоризм, тошнота, снижение веса, рвота, лихорадка, запор, крапивница. Симптомы обычно развиваются после инкубационного периода от 7 до 14 дней. Возникновение острых желудочно-кишечных симптомов в течение одной недели после контакта вряд ли может быть связано с инфекцией Giardia . Симптомы могут длиться от двух до четырех недель.
Симптомы хронического лямблиоза могут включать: жидкий стул, но обычно не диарея, стеаторея, потеря веса (от 10 до 20 процентов веса тела), мальабсорбция, задержка роста, недомогание, усталость, депрессия, спазмы в животе, метеоризм, отрыжка. Проявления могут усиливаться и уменьшаться в течение многих месяцев.
Нарушение всасывания может быть причиной значительной потери веса, которая может возникнуть при лямблиозе. Даже в случаях бессимптомной инфекции может возникнуть нарушение всасывания жиров, сахаров, углеводов и витаминов. Это может привести к гипоальбуминемии и дефициту витаминов A, B12 и фолиевой кислоты. Приобретенная непереносимость лактозы встречается примерно у 40 процентов пациентов - клинически это проявляется обострением кишечных симптомов после употребления молочных продуктов. Восстановление может занять много недель даже после избавления от паразита.
Осложнения: мальабсорбция, потеря веса, у путешественников длительная диарея, у детей может привести к задержке роста. Редко - сыпь, крапивница, афтозные язвы и реактивный артрит или синовит, холецистит, холангит или гранулематозный гепатит. При этом лямблиоз не ассоциирован со смертностью даже у иммунокомпрометированных лиц.
Диагностика основана на обнаружении простейших (трофозоитов или цист) при микроскопии кала, на выявлении антигена лямблий в кале иммунохроматографическими методами, обнаружении генетического материала методом ПЦР. При подозрении на лямблиоз и получении 5 негативных результата исследования кала необходимо рассмотреть возможность исследования дуоденального содержимого. Стоит помнить, что на обнаружение паразита могут влиять прием антибактериальных, антацидных препаратов, а также обследования с использованием контрастных веществ.
Лечение проводится только при лабораторном подтверждении диагноза и при наличии клинических проявлений заболевания, лечение бессимптомных носителей осуществляется в случае, если они контактируют с беременными, с больными муковисцидозом, если это дети, посещающие ДДО или работники пищевой промышленности.
Спорообразующие простейшие (Cryptosporidium parvum, Isospora belli, Cyclospora cayetanensis, Mycrosporidia)
Жизненный цикл для всех спорообразующих простейших одинаков и начинается после проглатывания спор, из которых в тонком кишечнике высвобождаются спорозоиты и начинают активно размножаться в энтероцитах, а затем способствуют развитию новых спор, выделяющихся с калом после гибели энтероцитов. При паразитировании данных микроорганизмов значительно страдает архитектоника ворсинок, что нарушает всасывание.
Из всех спорообразующих наиболее изучены криптоспоридии - о них и пойдет речь.
Путь передачи - фекально-оральный, инфицирование при проглатывании цист с водой, пищей, от человека к человеку, от животных к человеку. Факторами риска тяжелого течения могут быть ВИЧ-инфекция, трансплантация органов, дефицит IgA, гипогаммаглобулинемия и прием иммунодепрессантов.
В 30% случаев встречается бессимптомное течение. У пациентов, у которых развиваются симптомы, инкубационный период обычно составляет от 7 до 10 дней (от 2 до 28 дней). Диарея, связанная с криптоспоридиозом, может быть острой или хронической, кратковременной, прерывистой или непрерывной, скудной или обильной, с водянистым стулом до 25 л/день. Часто пациенты отмечают недомогание, тошноту и анорексию, спастические боли в животе и субфебрильную температуру. У иммунокомпетентных людей болезнь обычно проходит без лечения в течение 10-14 дней, хотя может сохраняться дольше или рецидивировать после первоначального улучшения. У людей с ослабленным иммунитетом криптоспоридиоз может стать хроническим изнурительным заболеванием с постоянной диареей и значительным истощением. Наиболее подвержены риску люди, живущие с ВИЧ, не принимающие антиретровирусную терапию и имеющие низкий уровень СД4+ менее 100-50кл/мкл.
Диагностика основана на выявлении микроорганизмов при микроскопии кала, выявлении их генетического материала методом ПЦР, обнаружение антигенов криптоспоридий в фекалиях, гистологическом исследовании биоптатов слизистой оболочки кишечника.
Если пациент с иммунодефицитом, то лечение может вызвать некоторые трудности - чаще это длительная, комбинированная терапия, которая может не дать желаемых результатов. При наличии ВИЧ-инфекции у пациента следует незамедлительно начать антиретровирусную терапию, в некоторых случаев этого бывает достаточно, но все же иногда необходимо добавить и противопаразитарные препараты.
У иммунокомпетентных лиц лечение криптоспоридиоза не требуется, если только клинические проявления не длятся более двух недель.
Распространен повсеместно. Фекально-оральный путь передачи. У людей паразитирует в толстом кишечнике, чаще встречается у пациентов с ВИЧ-инфекцией. Патогенез развития заболевания изучен не до конца. Вопрос о том, действительно ли этот паразит является патогеном для человека, остается спорным. Выделение этого паразита с диареей у пациентов с трансплантацией почек и другими иммунодефицитами коррелирует, но практически не связано со смертностью. У людей с ВИЧ-инфекцией и бластоцистозом симптомы исчезают самопроизвольно или подтверждается другая их этиология.
Клинические проявления при бластоцистозе могут включать: диарею, тошноту, анорексию, спазмы в животе, вздутие живота, метеоризм, крапивницу и усталость. Обычно описывается водянистая диарея (может быть острой или хронической). Лихорадка обычно отсутствует.
Диагностика - микроскопия и ПЦР-исследование кала, а также культуральные методы.
Пациенты с обнаруженными бластоцистами в кале и без клинических проявлений не нуждаются в лечении. Если все же есть клинические проявления, то необходимо исключить другую их этиологию, и только в случае исключения другой этиологии рассматривается вопрос о лечение.
Балантидиаз человека наиболее распространен в тропических и субтропических регионах и развивающихся странах. Путь передачи фекально-оральный, при заглатывании цист при употреблении зараженной пищи или воды. Источником инфекции являются свиньи. Эксцистация происходит в тонкой кишке, паразит колонизирует подвздошную и толстую кишки, могут проникать в ткани, цисты формируются в просвете кишечника и выделяются с калом.
Большинство случаев протекает бессимптомно. Риск развития симптомов увеличивается при сопутствующей инфекционной патологии. Симптомы могут включать тошноту, рвоту, потерю веса, боль в животе и заметную диарею с примесью крови. Фульминантное течение заболевания с перфорацией кишечника возникает редко.
Диагноз инфекции B. coli устанавливается путем обнаружения трофозоитов или цист при исследовании кала или соскобах слизистой оболочки, полученных при колоноскопии или ректороманоскопии.
Оптимальный подход к лечению балантидиаза неясен. В целом, лечение целесообразно при симптоматическом течении инфекции. Если симптомы не исчезают после проведенной терапии, необходимо повторить исследование кала для исключения другой этиологии.
Ранее считалась комменсалом. Путь передачи фекально-оральный, инфекция ассоциирована с энтеробиозом.
Инфекция может быть симптоматической или бессимптомной. Общие симптомы включают боль в животе, острую и рецидивирующую диарею, тошноту, рвоту, метеоризм. D. fragilis может проявляться периферической эозинофилией и/или эозинофильным колитом. Диарея обычно длится 1-2 недели, тогда как боль в животе может сохраняться в течение 1-2 месяцев. Из-за очень высокой связи с острицами у некоторых пациентов также может проявляться анальный зуд, инфекции нижних мочевыводящих путей.
Диагноз ставится путем обнаружения трофозоитов при микроскопии образцов стула или с помощью молекулярно-генетических методов.
У бессимптомного человека обычно не требует лечения, но инфекции, вызванные D. fragilis, следует лечить, если организм обнаруживается как единственный патоген в образцах стула пациентов с абдоминальной болью или диареей более 1 недели.
Несколько непатогенных простейших обитают в кишечном тракте и могут быть идентифицированы в образцах стула, отправленных в клиническую лабораторию для исследования яиц и паразитов. Поскольку диагностическая лаборатория может сообщить об этих непатогенных паразитах, важно уметь различать организмы, требующие лечения, и организмы, которые этого не требуют.
Непатогенные простейшие можно разделить на две группы: амебы и жгутиковые.
Читайте также:
