LIRS. SIRS. Инфекция. Определение сепсиса. CARS.
Добавил пользователь Владимир З. Обновлено: 21.01.2026
ГБУЗ МО «Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского», Москва, Россия
ФГБНУ «Научно-исследовательский институт общей реаниматологии им. В.А. Неговского» ФГБНУ «Федеральный научно-клинический центр реаниматологии и реабилитологии», Москва, Россия ,
Роль антитромбина в диагностике и лечении сепсиса
Журнал: Анестезиология и реаниматология. 2018;(3): 19‑24
Тяжесть состояния и исход заболевания при сепсисе определяются органной дисфункцией. Синдром диссеминированного внутрисосудистого свертывания крови (ДВС-синдром) признан одним из ведущих патофизиологических механизмов развития полиорганной недостаточности при сепсисе. Основным звеном ДВС-синдрома является нарушение баланса между свертывающей и противосвертывающей системами крови в сторону преобладания тромбообразования и истощения естественных антикоагулянтов, в том числе основного антикоагулянта антитромбина. В обзоре представлен анализ результатов исследований влияния антитромбина на гемостаз и воспаление. Учитывая важную роль антитромбина в патобиологии сепсиса и ДВС-синдрома, ряд исследователей считают, что устранение дефицита антитромбина может рассматриваться как одно из возможных направлений лечения этого заболевания.
Сепсис — патологический процесс, основу которого составляют генерализованная реакция воспаления (Systemic Inflammatory Response Syndrome — SIRS) и противовоспалительный синдром (Compensatory anti-inflammatory response syndrome — CARS). Определение сепсиса принято в 1992 г. Чикагской международной согласительной конференцией Американской ассоциации торакальных врачей (American College of Chest Physicians — АССР) и обществом по лечению больных, находящихся в критическом состоянии (Society of Critical Care Medicine — SCCM), в 2016 г. дополнено экспертной группой «Сепсис-3». В настоящее время сепсис определяется как «опасная для жизни органная дисфункция в результате нарушения регуляции ответа хозяина на инфекцию с вовлечением в процесс ранней активации как про-, так и антивоспалительного ответа с изменениями в неиммунологических путях, таких как кардиоваскулярный, нейронный, вегетативный, гормональный, биоэнергетический, метаболический и антикоагулянтный» [1].
Сепсис признан основной причиной смерти при возникновении инфекционных осложнений и заболеваний. Эксперты ВОЗ считают, что сепсис ежегодно приводит примерно к 6 млн случаев смерти в мире, большинство из которых можно было бы предотвратить [2].
Синдром системного воспалительного ответа, представляющий собой адаптационную реакцию организма на действия инфекционного агента, и система коагуляция априори участвуют в формировании и разрешении воспаления как компоненты иммунного ответа [3, 4]. Активация свертывания крови, формирование микротромбоза ограничивают очаг инфекции за счет блока кровотока в нем и этим препятствуют ее распространению. Локализация очага проходит под контролем общих метаболических и местных клеточных факторов и систем [5]. В случае высокой вирулентности патогена и/или неспособности систем, регулирующих воспалительный процесс, к поддержанию гомеостаза происходит распространение инфекции и тромбоза за пределы первичного очага, формируется синдром диссеминированного внутрисосудистого свертывания крови (ДВС-синдром), вовлекаются в воспалительный процесс первично непораженные органы, развивается полиорганная дисфункция [6].
Активация гемостаза происходит при повреждении эндотелия микрососудистого русла токсинами патогена, активированными иммунокомпетентными клетками крови, провоспалительными цитокинами c продукцией и высвобождением тканевого фактора (ТФ), главным образом моноцитами-макрофагами, специфическими клетками в тканях-мишенях, эндотелиальными клетками. Этот процесс рассматривается как один из основных патобиологических механизмов, запускающих тромбообразование [7]. Клетки-мишени могут высвобождать ТФ под влиянием широкого спектра стимулирующих агентов, включающих сами патогены и их токсины: пептидогликаны, липотеиновую кислоту и один из самых мощных индукторов ТФ липополисахарид. ТФ высвобождается из нейтрофилов, эндотелиальных клеток под воздействием фактора некроза опухоли альфа (TNF-α) [8—10]. Экспрессия Т.Ф. может быть стимулирована активированным фактором Х (фактор Ха), при этом ингибирование активности фактора Xa антитромбином снижает выделение ТФ [11].
В патофизиологии сепсиса система гемостаза и иммунитет проявляют свое единство. Локальное повреждение эндотелия и микротромбоз в очаге инфекции направлены первоначально на локализацию процесса воспаления, т. е. на выживание. Однако генерализация инфекции и системная воспалительная реакция ведут к неконтролируемому системному повреждению эндотелия с развитием полиорганной недостаточности [12].
ДВС-синдром является основным видом нарушения свертывания крови у больных сепсисом. Патофизиологический механизм развития ДВС-синдрома при сепсисе чрезвычайно сложен и до настоящего времени окончательно не выяснен. Частота проявления ДВС-синдрома при сепсисе достигает 50% и сопровождается более высокой летальностью, чем в его отсутствие (43 и 27% соответственно) [13—15]. Выраженность коагулопатии при сепсисе варьирует от субклинической активации свертывания крови, гиперкоагуляции с локальным венозным тромбозом до острого диссеминированного внутрисосудистого свертывания, характеризующегося массивным распространенным тромбозом микрососудистого русла и кровотечениями [16—20]. ДВС-синдром не только осложняет, но и предопределяет исход критических состояний. В руководствах по диагностике и лечению сепсиса коррекция нарушений процессов коагуляции рассматривается как неотъемлемая часть диагностики и терапии сепсиса [14], а в оценке качества оказания помощи таким пациентам учитываются объем и качество проведенной антитромботической терапии [21].
Вызванная воспалительным процессом активация свертывания крови проявляется повышенной внутрисосудистой генерацией тромбина с потреблением естественных антикоагулянтов, а так же ингибированием системы фибринолиза. Механизмами подавления активности плазмина, вероятно, являются повышение содержания ингибитора активатора плазминогена 1-го типа (PAI-1, Plasminogen activator inhibitor-1), а также активация, опосредованная тромбином — участием активируемого тромбином ингибитора фибринолиза (Thrombin activatable fibrinolysis inhibitor — TAFI) [22—24].
Тромбин, фактор Xа, комплекс ТФ—VIIa способны активировать эндотелиальные клетки, тромбоциты и лейкоциты для воспалительного ответа. Чрезмерная генерация тромбина и последующее отложение фибрина на эндотелии сосудов микроциркуляторного русла вызывают и усиливают ишемию и воспаление. Тромбообразование в микроциркуляторном русле наблюдается уже в течение 3—5 ч бактериемии и эндотоксемии [25, 26]. Данные аутопсий умерших от сепсиса подтверждают наличие тромбозов микроциркуляторного русла органов, вовлеченных в воспалительный процесс [27].
Активация гемостаза и высвобождение тканевого фактора могут являться следствием повреждения гликокаликса эндотелия, вызванного микробной клеткой, ее токсинами, цитокинами воспаления [28, 29].
Гиперкоагуляция крови и ДВС-синдром рассматриваются как независимые факторы риска летальных исходов у пациентов с сепсисом, и стратегия терапии сепсиса предусматривает предупреждение и коррекцию повышенной коагуляции [14, 26].
Связь воспаления и гемостаза рассматривается с позиции «петли усиления» — воспаление запускает и поддерживает процессы коагуляции, а продукты коагуляции поддерживают и усиливают воспаление. Этот феномен сопровождается истощением активности естественных антикоагулянтов (антитромбина, протеинов С и S), потреблением факторов свертывания [30].
Нарушение гемостаза при сепсисе и ДВС-синдроме — результат одновременно протекающих нескольких патофизиологических процессов: повышения прокоагулянтной активности крови; дисфункции физиологических антикоагулянтных систем (истощения активности антитромбина и протеина С); супрессии фибринолитической системы; активации воспаления [31]. С этой позиции рассматривается вопрос управления процессом тромбообразования путем воздействия на его основные звенья, в том числе на поддержание должной активности естественных антикоагулянтов (антитромбина, протеинов C и S), так как уже на ранних стадиях ДВС-синдрома происходит снижение их уровня. При дефиците активности антитромбина (АТ) становится невозможным адекватное функционирование всей антикоагулянтной системы [32].
АТ представляет собой гликопротеин, независимый от витамина K и синтезируемый в большей степени клетками печени, частично эндотелием. АТ содержит 432 аминокислоты с молекулярной массой 58 000 Да. АТ будучи естественным антикоагулянтом ингибирует тромбин, факторы VIIа, IXa, Ха, XIa, XIIa, трипсин, плазмин, калликреин. Широкий спектр активности АТ делает его ключевым регулятором коагуляционного каскада. Конформационные изменения в молекуле АТ после взаимодействия с пентасахаридными фрагментами гепарина обеспечивают его ковалентные связи с сериновыми протеазами (тромбин, фактор Xа), ускоряя инактивацию этих протеаз, в чем и проявляется основное антикоагулянтное действие АТ [33].
В плазме крови присутствуют две изоформы АТ-a и АТ-b, не отличающиеся друг от друга по ингибирующему действию на тромбин, но обладающие различным сродством к гепарину. Известно, что 85—95% циркулирующего АТ плазмы представлено изоформой АТ-a, 5—15% —изоформой АТ-b. Последняя имеет аффинитет к гепарину в 3—10 раз выше, чем изоформа АТ-a. Доказано, что изоформа АТ-b является более мощным ингибитором факторов Xa и IXа, чем изоформа АТ-a. При сепсисе наблюдается преимущественно потребление изоформы АТ-b. АТ ингибирует тромбин в отношении 1:1, образуя антитромбин-тромбиновый комплекс с последующим выведением его из циркуляции [34, 35]. Ингибирующее влияние АТ на тромбообразование усиливается в присутствии гепарина. После связи АТ с гепарином скорость ингибирования протеаз возрастает в 1000 раз и более [32, 36].
Тромбин служит важным звеном воспалительного процесса, поскольку способен самостоятельно индуцировать воспалительный ответ эндотелия, активировать лейкоциты с привлечением их к эндотелиоцитам, что обусловливает роллинг лейкоцитов по эндотелию и их адгезию [37—39]. Клеточные эффекты тромбина проявляются тем, что он активирует эндотелиальные рецепторы PAR-1 (Protease-activated receptor 1) — рецепторы клеточных мембран, активируемые протеиназами, инициирующими ответ клетки в регуляции провоспалительной реакции [40].
АТ определяет основной антикоагулянтный потенциал плазмы, реализуемый через инактивацию тромбина [34, 35]. Дефицит А.Т. наблюдается при состояниях, сопровождающихся воспалительными процессами и ДВС-синдромом [41, 42]. Сниженная активность АТ плазмы у пациентов с сепсисом и ДВС-синдромом — известный и доказанный факт, и уровень активности АТ может служить критерием тяжести ДВС-синдрома [42]. Общество тромбоза и гемостаза Японии (Japanese Society of Thrombosis and Hemostasis) рассматривает АТ, как «потенциально рекомендуемый» критерий для введения в систему балльной оценки риска ДВС-синдрома [43], а восполнение дефицита AT и оптимизация антикоагулянтной терапии могут стать важным направлением лечения ДВС-синдрома при сепсисе.
АТ не только оказывает влияние на коагуляцию крови, но также напрямую регулирует воспалительную реакцию. Лечебное действие АТ при инфекции впервые продемонстрировали F. Taylor и соавт. [44] на модели септического шока, вызванного внутривенным введением обезьянам летальных доз кишечной палочки. Снижение смертности при использовании АТ в эксперименте авторы связывали с ингибированием АТ генерации тромбина.
Однако блокированный сайт фактора Ха (основной ключ генерации тромбина) не может полностью предотвратить развитие полиорганной недостаточности и летального исхода, поэтому протективный эффект АТ должен быть реализован непосредственно через модуляцию воспалительной реакции [40].
T. Yamauchi и соавт. [45], S. Gando и соавт. [46]показали, что АТ может проявлять противовоспалительное действие и предупреждать возникновение эндотелиальной дисфункции, связываясь с пентасахаридсодержащими гликозаминогликанами гликокалекса.
N. Kaneider и соавт. [47], P. Souter и соавт. [48] доказали, что противовоспалительный эффект АТ осуществляется посредством прямого взаимодействия с рецепторами синдекан-4 эндотелиальных клеток, нейтрофилов, лимфоцитов и моноцитов, высвобождением простациклина, ингибированием активации нуклеарного фактора NF-κB, контролирующего экспрессию генов иммунного ответа, апоптоза, а также снижением продукции интерлейкинов (IL) IL-6, IL-8, TNF. Простациклин проявляет противовоспалительное действие подавлением активности нейтрофилов, моноцитов и тромбоцитов, блокируя синтез провоспалительных цитокинов, что препятствует адгезии лейкоцитов на эндотелии, позволяет сохранять целостность эндотелиальной выстилки сосудов, уменьшить капиллярную проницаемость.
В экспериментальных работах на моделях абдоминального сепсиса и ишемии K. Nishijima и соавт. [49], U. Koca и соавт. [50] показали, что введение АТ предотвращает индуцированное липополисахаридом повреждение сосудов легких, реперфузионное повреждение гликокаликса коронарных сосудов. Активность А.Т. при сепсисе снижается за счет его потребления в процессе образования комплексов АТ—тромбин, разрушением его эластазой, высвобождающейся из активированных лейкоцитов, нарушением синтеза в печени [33, 37].
Гепарин как синергист АТ связывается с сайтом молекулы АТ, участвующим во взаимодействии с синдеканом-4, этим он способен блокировать противовоспалительный эффект АТ [51, 52].
Вопрос возможности использования АТ как лекарственного препарата у пациентов с сепсисом и ДВС-синдром обсуждается с 1980 г. Основанием послужили исследования, показавшие, что воспаление и нарушения коагуляции играют ведущую роль в патогенезе сепсиса. Системный воспалительный ответ развивается на фоне дефицита естественных антикоагулянтов, и сниженное содержание АТ может быть причиной низкой эффективности проводимой терапии [42].
Использование терапевтических доз АТ, по данным работ J. Hoffmann и соавт. [55], M. Hayakawa и соавт. [56], при введении эндотоксина устраняло адгезию лейкоцитов на эндотелии капилляров. Однако противовоспалительное действие АТ утрачивалось, если в лечение включали гепарин. В обзоре 4 плацебо-контролируемых рандомизированных исследований применения АТ в лечении пациентов с сепсисом F. Fourrier и соавт. [57] отметили незначительное снижение 30-дневной летальности. При этом анализ в соответствии с регрессионной моделью Кокса, позволяющей учесть исходные различия между основной и контрольной группами применительно к выживаемости, выявил значительное снижение риска смерти у пациентов, получавших А.Т. Статистически значимым признано сокращение продолжительности пребывания пациентов, получавших АТ, в отделении интенсивной терапии.
По проблеме использования АТ в лечении сепсиса опубликовано более 400 научных работ. Эксперты, авторы международных рекомендаций по лечению сепсиса указывают, что имеющиеся в настоящее время данные не позволяют рекомендовать применение препарата АТ в клинической практике, однако при этом отмечают, что лечение АТ больных тяжелым сепсисом и септическим шоком с ДВС-синдромом может повысить выживаемость и привести к значительному снижению летальности [1].
Заключение
Антитромбин является основным естественным антикоагулянтом; его дефицит способствует развитию синдрома диссеминированного внутрисосудистого свертывания и усугубляет течение и исход воспалительного процесса при сепсисе. Данные литературы о влиянии антитромбина на выживаемость при сепсисе неоднозначны. Авторы исследований единодушны во мнении о ведущей роли антитромбина в патофизиологии сепсиса и рекомендуют продолжить исследования по диагностике его активности при сепсисе и возможности использования препаратов антитромбина в клинической практике.
Финансирование. Исследование не имело спонсорской поддержки.
Авторы заявляют об отсутствии конфликта интересов.
Sirs Информационный блок для самостоятельной подготовки студента к практическому занятию.
Синдром системного ответа на воспаление = Systemic Inflammatory Response Syndrome ( SIRS ) = синдром системного ответа на воспаление (ССВО).
В 1991 г. на согласительной конференции Американского общества торакальных хирургов и врачей экстренных состояний, посвященной вопросам определения сепсиса, было введено новое понятие - синдром системного ответа на воспаление - Systemic Inflammatory Response Syndrome ( SIRS ) или ССВО. Термины ССВО ( синдром системного ответа на воспаление ) и СВО ( системный воспалительный ответ ) употребляются в литературе стран СНГ и аналогичны термину SIRS. ССВО, СВО и SIRS - это одно и тоже понятие, которое является клинико-лабораторными проявлениями генерализованной формы воспалительной реакции. На согласительной конференции ( 1991 г.) был выработан ряд положений SIRS :
- тахикардия > 90 ударов в 1 мин.;
- тахипноэ > 20 в 1 мин. или Pa CO2 - 32 мм рт. ст. на фоне ИВЛ;
- температура > 38,0 град. С или < 36,0 град. С;
- количество лейкоцитов в периферической крови > 12 × 10 9 / л или < 4 × 10 9 / л либо число незрелых форм >10%;
- диагноз SIRS констатируется только в тех случаях когда выявлен очаг инфекции и два или более двух вышеуказанных критериев ( признаков);
- определено отличие SIRS от сепсиса - при начальных стадиях воспалительного процесса при SIRS инфекционный компонент может отсутствовать, а при сепсисе обязана присутствовать генерализованная внутрисосудистая инфекция, для которой характерна бактериемия.
В начальных стадиях генерализованной формы воспаления - SIRS образовывается при чрезмерной активации полипептидных и других медиаторов, а также их клеток, которые образовывают цитокиновую сеть.
В дальнейшем, генерализованное воспаление прогрессирует, происходит утрата защитной функции локального воспалительного очага и одновременно вступают в действие механизмы системной альтерации.
Цитокиновая сеть - это комплекс функционально связанных клеток, состоящий из полиморфноядерных лейкоцитов, моноцитов, макрофагов и лимфоцитов, которые выделяют цитокины и другие медиаторы воспаления ( тканевые медиаторы воспаления, лимфокины иммунной системонокины и др. биологически активные вещества ), а также - из клеток ( в эту группу входят эндотелиоциты ) любой функциональной специализации, которые отвечают на действия активационных агентов.
В связи с появлением научных работ в 1991-2001 г.г. , посвященных проблеме SIRS , рекомендации согласительной конференции в Чикаго (1991г.) были признаны слишком широкими и недостаточно специфичными. На последней конференции в 2001 г. ( Вашингтон ), посвященной выработке нового подхода к определению сепсиса, было признано отсутствие полной идентичности между SIRS и сепсисом. А также, для практической медицины было предложено использовать дополнительные ( по отношению к SIRS ) расширенные критерии диагностики сепсиса; последние состоят из ключевых и воспалительных изменений, изменений в гемодинамике, проявлений органной дисфункции и индикаторов тканевой гипоперфузии. До появления расширенных критериев диагностики сепсиса ( до 2001 г.), диагноз « сепсис» был правомочен при наличии очага инфекции и двух критериев. Решением конференции от 2001 г. (Вашингтон ) и в настоящее время, диагноз « сепсис» выставляется при наличии очага инфекции и при наличии признаков органной дисфункции имеющих место хотя бы в одной органной системы в комплексе с выявленным снижением тканевой перфузии.
PICS — коварный убийца
На современном этапе развития медицина сделала огромный скачок вперед. Многие заболевания, считавшиеся фатальными, сегодня вполне поддаются лечению. Но есть проблема, которая была актуальна как в античности, так и сегодня. Речь идет о тяжелом сепсисе, который часто осложняется полиорганной недостаточностью.
Гомер писал о «заражении крови» в своих поэмах, а Гиппократ даже пытался вылечить «аутоинтоксикацию организма» крепкими алкогольными напитками. Конечно, удавалось это крайне редко и дело было в банальной удаче, а отнюдь не в чудодейственных свойствах этанола.
По сей день патогенез сепсиса окончательно не установлен, и одна из основных задач — понять, как именно развивается полиорганная недостаточность и почему поражаются различные органы и ткани, находящиеся вдали от очага инфекции.
Сам сепсис в современной медицине рассматривается как системный иммунный ответ на инфекцию. При этом «сепсис» не тождественен «септицемии»: возбудителю вовсе не обязательно постоянно циркулировать в крови, чтобы вызвать этот самый иммунный ответ. В связи с этим гораздо чаще говорят о синдроме системного иммунного ответа — SIRS, по этой же причине посев гемокультуры может не дать нужного результата. Сущность сепсиса не в поражающем действии микроорганизма, а в нарушенном ответе на инфекцию [1].
Как же получается, что при септическом поражении страдает весь организм? Все дело в том, что при сепсисе одновременно происходит распознавание множества паттернов опасности и активация огромного количества сигнальных путей.
Патоген-ассоциированные молекулярные паттерны (PAMPs) и паттерны, ассоциированные с повреждением (DAMPs), распознаются комплементом, Toll-, NOD-, RIG-подобными рецепторами различных иммунных клеток, эпителиальных и клеток эндотелия. Все это приводит к активации разных сигнальных путей — MAPK, JAK, STAT, факторов транскрипции (например, NF-κΒ), происходит активация воспаления, но не локально, а на системном уровне [1].
Разбор механизмов развития сепсиса — тема для отдельной статьи, сейчас нас больше интересует, что такого происходит в организме, что все органы один за другим начинают выходить из строя.
Ранее считалось, что вследствие сепсиса развиваются два состояния, идущие одно за другим: синдром системного воспалительного ответа — знакомый нам SIRS, а также синдром компенсаторного противовоспалительного ответа — CARS. Вначале возникает мощный иммунный ответ — SIRS, со временем наступает иммуносупрессия: организм пытается восстановить гомеостаз, но слишком в этом «усердствует», и возникает CARS. Последний проявляется угнетением клеточного иммунитета (лимфопенией), преимущественно страдает Т-звено [2].
Такая модель предполагает, что, после жизнеугрожающего SIRS (когда имеется наибольшая опасность для жизни) наступает компенсаторная реакция (CARS), что свидетельствует о выздоровлении. Но это в корне неверно.
Согласно современным данным, SIRS и CARS возникают одновременно. При этом оказалось, что CARS не имеет никакого отношения к компенсаторным явлениям, да и вообще не является следствием SIRS. Напротив, происходит одновременная гиперактивация факторов врожденного иммунитета (цитокиновый шторм, нейтрофилия) и угнетение Т-клеточного иммунитета с лимфопенией. В результате мы имеем дизрегуляцию иммунной системы [3].
.
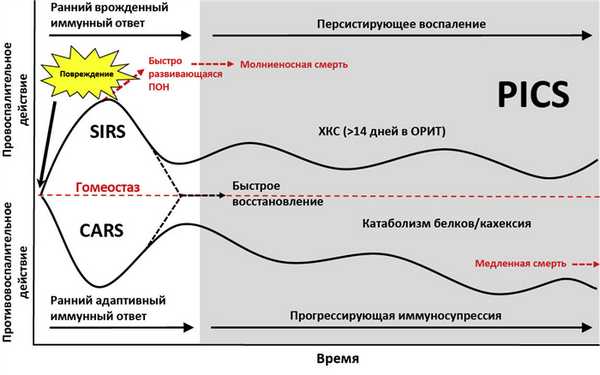
После сепсиса (или обширной травмы/ожога) происходит одновременное развитие SIRS и CARS. Ранняя смерть от полиорганной недостаточности в настоящее время происходит не так часто благодаря современным методам лечения. Далее могут быть два пути: достижение гомеостаза и ремиссия или переход в хроническое критическое состояние. Во втором случае развивается PICS, нарастает дисбаланс между врожденным и адаптивным иммунитетом, что приводит к медленной смерти [2].
Эта концепция помогла найти объяснение следующей проблеме. В случае если SIRS будет преобладать, возникнет полиорганная недостаточность (ПОН), что может привести к летальному исходу. Об этом мы хорошо осведомлены, и современные методы лечения позволяют предотвратить нежелательные последствия SIRS (см. рис.1).
Но к сожалению, на этом проблемы не заканчиваются. Если пациент не умер вследствие ПОН, далее может быть всего два варианта развития событий: либо гомеостаз иммунной системы восстановится, либо нет. В первом случае все, в общем-то, понятно: пациент выздоравливает, наступает ремиссия.
Но бывает так, что иммунная система никак не может прийти в норму. И тогда возникает синдром персистирующего воспаления, иммуносупрессии и катаболизма — PICS [2]. Если человек более 14 дней находится в отделении интенсивной терапии и у него имеется хроническая полиорганная недостаточность (или одного органа — наиболее часто страдают почки), то говорят о хроническом критическом состоянии (ХКС). ХКС — термин, широко применяющийся за рубежом к пациентам, организм которых никак не может нормализоваться. PICS является таким ХКС вследствие перенесенного сепсиса [4].
Почему так происходит? Окончательного и полного ответа на этот вопрос нет. Предполагается, что в ответ на сепсис (или травму) к очагу повреждения устремляются иммунные клетки из костного мозга, позволяя гемопоэтическим клеткам делиться и заполнять освободившееся пространство (emergency myelopoiesis — «экстренный миелопоэз»).
Но повреждение так быстро устранить не получается, поэтому в кровоток выбрасываются незрелые миелоидные клетки, не способные полноценно защитить организм, но тем не менее поддерживающие воспаление. Также экстренный миелопоэз запускает продукцию большого количества супрессорных клеток миелоидного происхождения (myeloid-derived suppressor cells — MDSCs). MDSCs как раз и обеспечивают основные эффекты PICS: сохраняют врожденный иммунитет, угнетают приобретенный (в основном Т-клеточный), продуцируют большое количество провоспалительных цитокинов [2], [3].
Как всегда, вся проблема в нарушении гомеостаза. MDSCs крайне важны в начальные сроки, когда происходит цитокиновый шторм и активация всех защитных систем организма, чтобы предотвратить чрезмерно буйную реакцию иммунитета, которая тут же приведет к полиорганной недостаточности.
Но слишком длительное действие MDSCs оказывает организму медвежью услугу: незрелые лейкоциты вкупе с ингибированием макрофагов и Т-лимфоцитов приводят к высокому риску развития нозокомиальных инфекций. Также нарастает анемия и кахексия [5].
Причина последней — в преобладании процессов катаболизма. Снижается синтез белка, ускоряется его распад, а скелетная мускулатура является наиболее объемным хранилищем белка. По пока неизвестным причинам нарушается работа митохондрий в миофибриллах, а далее запускается апоптоз (в других случаях — аутофагия).
Самое забавное, что детрит, образовавшийся вследствие гибели миофибрилл, сам является фактором, инициирующим воспаление. ДНК, АТФ, фрагменты мембраны — все они являются эндогенными DAMРs, замыкая таким образом порочный круг [4].
Диагностировать PICS можно по следующим критериям [2], [6]:
- нахождение в ОРИТ более 14 дней;
- уровень СРБ более 50 мкг/дл;
- лимфопения — менее 0,8×10 9 /л;
- снижение массы тела на 10 % в период нахождения в стационаре или ИМТ < 18;
- креатинино-ростовой индекс < 80 %;
- альбумин < 3,0 г/дл;
- преальбумин < 10 г/дл;
- ретинол-связывающий белок < 10 мкг/дл.
Критерии все еще разрабатываются и постоянно обновляются. Но если с вопросом «кто виноват?» более-менее разобрались, то «что делать?» — пока не совсем ясно. Некоторые авторы предлагают использовать препараты, ингибирующие экспансию MDSCs или некоторые иммуноадъюванты [2]. Конечно, без грамотных РКИ рекомендовать что-то конкретное невозможно.
Однозначно можно сказать, что не стоит расслабляться при кажущемся затишье после сепсиса — это затишье перед бурей.
Сепсис

Определение
Определение сепсиса показывает эволюцию взглядов на этиологию и патогенез данного состояния. Само определение неоднократно менялось, ранее считалось, что главенствующую роль в патогенезе играет системный воспалительный ответ, однако на данный момент центральную роль отводят нарушению действий воспалительной и противовоспалительной систем. Решение о необходимости изменения дефиниции было принято в 2017 году European Society of Intensive Care Medicine и Society of Critical Care Medicine.
Сепсис ― угрожающая жизни органная дисфункция, вызванная дезрегулирующим ответом организма хозяина на инфекцию.
Также на данной конференции было принято решение о ликвидации термина «тяжелый сепсис», который ранее определялся как сепсис с наличием органной дисфункции. Зачастую состояние пациента недооценивалось, и возникала путаница с определением тяжести состояния. При усугублении патологического процесса развивается состояние, называемое септическим шоком. Летальность при развитии септического шока увеличивается в разы по сравнению с сепсисом (40 % против 10 %).
Септический шок ― подвид сепсиса, в основе которого лежит нарушение циркуляции, а патологические изменения в клетках и метаболизме достаточно глубоки, чтобы в значительной степени увеличить летальность.
Диагностика
Исходя из определения и патогенеза, для скрининга сепсиса было предложено использовать шкалу qSOFA (quick Sepsis-related Organ Failure Assessment).
- Системное артериальное давление ≤ 100 мм рт. ст.;
- Частота дыхания ≥ 22 в минуту;
- Любое нарушение сознания ( < 14 баллов по Шкале комы Глазго).

При наличии ≥ 2 баллов, а также признаков наличия инфекции необходимо обратить внимание на данного пациента и оценить вероятность сепсиса по развернутой шкале SOFA. Данная шкала в отношении определения органной дисфункции имеет специфичность 96 % и чувствительность 30 %, а в отношении определения смертности ― специфичность 91 % и чувствительность 50 %. По сравнению с критериями синдрома системного воспалительного ответа (ССВО/SIRS) данная шкала имеет большую специфичность, однако меньшую чувствительность.

После прохождения скрининга и при наличии ≥ 2 баллов по qSOFA или сохранении подозрения на сепсис проводится оценка по развернутой шкале SOFA.
В критерии SOFA входит определение функций:
- Дыхания: отношение PaO2/FiO2;
- Коагуляции: уровень тромбоцитов;
- Печени: уровень билирубина;
- Сердечно-сосудистой системы: уровень артериального давления и инотропной поддержки;
- ЦНС: определение уровня по Шкале комы Глазго;
- Почек: уровень креатинина и диурез.
При наличии ≥ 2 баллов по развернутой шкале SOFA правомочно выставление сепсиса.

Таблица 1 | Критерии SOFA
После выставления диагноза проводится начальная интенсивная терапия, важной частью которой является проведение массивной инфузии, далее определяется среднее артериальное давление (СрАД), а также уровень лактата. Среднее артериальное давление определяется по формуле: СрАД = САД - ДАД + ⅓ ДАД, где САД ― систолическое артериальное давление, а ДАД ― диастолическое артериальное давление. При необходимости применения вазопрессоров для поддержания адекватного среднего артериального давления ( ≥ 65 мм рт. ст.), а также при высоком уровне лактата ( > 2 ммоль/л) выставляется диагноз септический шок.
Начальная терапия
Интенсивная терапия сепсиса должна начинаться сразу же после постановки диагноза. Рекомендации по ведению сепсиса 2012 года предлагали использовать цели, которые необходимо было достигнуть за определенное время. К сожалению, после проведения крупных испытаний данная стратегия не показала преимуществ по сравнению со стандартной терапией, а также оказалась более затратной.
После выявления сепсиса для коррекции сепсис-индуцированной гипоперфузии в начальном периоде используются кристаллоиды в объеме 30 мл/кг внутривенно в первые 3 часа. Последующая инфузия должна проводиться на основании имеющихся в наличии данных о физиологии пациента (частота сердечных сокращений, артериальное давление, артериальная сатурация кислорода, частота дыхания, температура и другие данные), полученных с помощью неинвазивных и инвазивных методов. Предпочтение желательно отдавать динамическим методам измерения.
У пациентов с септическим шоком, требующим применения вазопрессоров, необходимо поддерживать среднее артериальное давление на уровне не менее 65 мм рт. ст. Пациентам с повышенными уровнями лактата (маркер тканевой гипоперфузии) необходимо проводить интенсивную инфузионную терапию с целью его снижения до нормальных уровней.
Всем организациям здравоохранения рекомендуется разрабатывать собственные или усовершенствовать имеющиеся программы по ведению сепсиса и септического шока, методам скрининга у тяжелобольных пациентов, а также оценке риска развития сепсиса. Допустимо применение других шкал для скрининга состояния тяжелобольных пациентов: привычная шкала ССВО, LODS (Logistic Organ Disfunction System), NODS (National Organ Disfunction System).
Интенсивная терапия сепсиса
Антибактериальная терапия
До начала антибактериальной терапии необходимо взять посевы (кровь, спинномозговую жидкость, мочу, секрет из дыхательных путей, раневое отделяемое или другие жидкости организма) для определения чувствительности микроорганизмов к антибиотикам с использованием как минимум двух наборов культур: анаэробной и аэробной. Однако взятие посевов не должно существенно затягивать начало антибактериальной терапии сепсиса. Антибиотикотерапия должна начинаться в максимально ранние сроки, до 1 часа после постановки диагноза сепсиса или септического шока. Любое промедление в назначении антибактериальных средств значительно повышает смертность пациентов. Эмпирическую антимикробную терапию рекомендуется начинать с одного или нескольких антибиотиков (АБ) из двух разных классов, с широким спектром активности, действующих на предполагаемую флору (бактериальную и/или грибковую).
При выборе АБ необходимо учитывать: анатомический источник и типичную его флору, преобладающую флору в госпитале или вне его, резистентность преобладающего патогена, иммунные нарушения у пациента (нейтропения, спленэктомия, плохо контролируемая ВИЧ-инфекция, приобретенные или врожденные дефекты иммуноглобулина, системы комплемента или функции лейкоцитов), а также возраст пациента и наличие сопутствующей патологии, хронических заболеваний. Дозу и время введения необходимо оптимизировать на основании фармакодинамики/фармакокинетики и специфических свойств препаратов. Необходимо помнить о том, что у пациентов зачастую есть нарушение функции почек и/или печени, а также о возможной резистентности микроорганизмов. При применении бета-лактамных АБ важно достигнуть концентраций выше минимальной ингибирующей в течение как можно более длительного времени, в то время как для аминогликозидов и фторхинолонов главную роль играет достижение пиковой концентрации.
Деэскалацию (замена АБ широкого спектра действия на АБ более узкого спектра действия) антибактериальной терапии проводят в течение нескольких последующих дней после того, как определены микроорганизмы, вызвавшие сепсис и септический шок, и их спектр чувствительности к антибиотикам, либо наступает значительное клиническое улучшение/ухудшение. По возможности каждый день оцениваются клинические данные, и на их основании проводится решение об деэскалации. Рекомендуемая длительность антибактериальной терапии составляет 7-10 дней, что зачастую достаточно для большинства серьезных инфекций, ассоциированных с развитием сепсиса и септического шока.
При проведении антибиотикотерапии необходимо руководствоваться уровнем прокальцитонина (ПКТ), это позволяет сократить продолжительность курса, а также отменить АБ у пациентов, у которых имелись подозрение на сепсис и слабые доказательства наличия инфекции. При снижении уровня прокальцитонина более, чем на 80 % от пикового значения или снижении ПКТ менее 0,5 мкг/л необходимо прекратить введение АБ.
Контроль очага
Необходимо как можно быстрее (не позже 6‒12 часов после постановки диагноза) выявить или исключить наличие очага инфекции в организме и провести вмешательство по его удалению. Следует обратить особое внимание на внутрисосудистые девайсы (центральные венозные катетеры), так как они могут быть источниками инфекции.
Инфузионная терапия
Препаратами выбора для инфузионной терапии при развитии сепсиса и септического шока являются кристаллоиды. Предпочтительней применять сбалансированные растворы, так как они не вызывают развитие гиперхлоремического метаболического ацидоза (раствор Хартмана или Рингер-лактат), при их отсутствии допустимо применение несбалансированных растворов (Рингер или физиологический раствор NaCl 0,9 %). Недостаточно данных об использовании препаратов желатина для восстановления объема внутрисосудистого русла при сепсисе.
При необходимости инфузии значительных объемов кристаллоидов допускается добавление инфузии коллоидов (альбумина 20 %) с целью достижения плазменного уровня альбумина > 30 г/л. На основании данных проведенных исследований не рекомендуется использование при сепсисе и септическом шоке растворов гидроксиэтилкрахмала.
Вазоактивные препараты
Не рекомендуется применение низких доз допамина, так называемых «почечных», для протекции почек при сепсисе и септическом шоке!
Добутамин может назначаться пациентам, имеющим признаки тканевой гипоперфузии, на фоне адекватной инфузии и использовании других вазопрессоров. Дозу данного препарата необходимо тщательно титровать для достижения желаемого эффекта (восстановление тканевой перфузии), а при развитии аритмий или усугублении гипотензии незамедлительно прекратить его введение. Всем пациентам с септическим шоком желательно установить артериальный катетер для контроля показателей гемодинамики.
Кортикостероиды
Нет необходимости использовать глюкокортикоиды, когда на фоне инфузионной терапии и применения вазопрессоров достигнута гемодинамическая стабильность. Если же невозможно поддерживать гемодинамику на должном уровне на фоне приведенной выше терапии (инфузия + прессоры), допускается применение гидрокортизона внутривенно в дозе 200 мг/сутки.
Препараты крови
Трансфузия эритроцитов проводится при снижении уровня гемоглобина менее 70 г/л у взрослых без признаков тяжелой гипоксемии, ишемии миокарда или острого кровотечения. Эритропоэтин у пациентов с сепсисом не применяется. Свежезамороженная плазма может использоваться при нарушениях свертываемости крови перед планированием инвазивных процедур или при наличии активного кровотечения.
Трансфузия тромбоцитов проводится в зависимости от клинической необходимости при уровне:
Иммуноглобулины
Эксперты не рекомендуют использовать иммуноглобулины у пациентов с сепсисом и септическим шоком.
Очистка крови
Эффект применения различных технологий очистки крови не доказан. Необходимо провести дополнительные исследования.
Искусственная вентиляция легких (ИВЛ)
На фоне сепсиса у пациентов часто развивается сепсис-индуцированный острый респираторный дистресс синдром (ОРДС). При развитии ОРДС проводится ИВЛ со следующими параметрами:
- Целевой дыхательный объем 6 мл/кг на прогнозируемую массу тела (ПМТ). ПМТ у мужчин = 50 + 0,91 * (рост в см - 152,4), ПМТ у женщин = 45,5 + 0,91 * (рост в см -152,4);
- Верхний предел давления плато (Рplat) = 30 см вод. ст.;
- Высокий PEEP — около 10‒12 см вод. ст., для подбора оптимального PEEP можно использовать таблицы, основанные на значениях FiO2;
- Использование рекрутмент маневра и прон-позиции при отношении PaO2/FiO2 < 150 мм рт. ст.;
- Использование мышечных релаксантов в течение ≤ 48 часов у пациентов с сепсис-индуцированным ОРДС и в отношении PaO2/FiO2 < 150 мм рт. ст.;
- В особо тяжелых случаях рефрактерной гипоксемии могут использоваться альтернативные техники: экстракорпоральная мембранная оксигенация и режимы ИВЛ с инверсией отношения вдох/выдох и PEEP (airway pressure release ventilation, APRV);
- Не рекомендовано использование высокочастотной осцилляторной ИВЛ у взрослых, применение бета-2-агонистов (при отсутствии бронхоспазма), рутинная установка катетера в легочной артерии.
При проведении ИВЛ пациентам без ОРДС необходимо использовать низкие дыхательные объемы (4 ‒ 6 мл/кг), поднять изголовье кровати на 30-45° для снижения риска аспирации и развития вентилятор-ассоциированной пневмонии, а также как можно раньше начинать отучение от ИВЛ.
Седация и анальгезия
Необходимо избегать продолжительной или интермиттирующей седации пациентов, которым проводится ИВЛ. Если же все-таки необходима седация, то предпочтительнее использовать короткодействующие препараты (пропофол или дексмедетомидин).
Контроль гликемии
Рекомендуется поддержание уровня глюкозы ≤ 10 ммоль/л. При наличии двух последовательных проб крови с превышением данного уровня глюкозы необходимо незамедлительно начать введение инсулина. Мониторинг гликемии проводится каждые 1-2 часа до момента, когда уровни глюкозы и инфузия инсулина не стабилизируются; после стабилизации контроль проводится каждые 4 часа. Для измерения уровней глюкозы предпочтительнее использовать артериальную кровь. Допустимо использование портативных глюкометров, однако нужно критически относиться к результатам данных исследований.
Почечно-заместительная терапия (ПЗТ)
При развитии у пациентов с сепсисом острого повреждения почек и наличии показаний к диализу может применятся длительная или перемежающаяся почечно-заместительная терапия. Во время ПЗТ возможен контроль и изменение баланса жидкости у гемодинамически нестабильных пациентов.
Применение бикарбоната натрия
Не рекомендуется раннее применение бикарбоната натрия при индуцированном гипоперфузией лактат-ацидозе с pH ≥ 7,15.
Профилактика венозной тромбоэмболии (ВТЭ)
Рекомендуется проводить профилактику ВТЭ у пациентов с сепсисом и септическим шоком, предпочтительнее низкомолекулярными гепаринами (НМГ) либо с помощью нефракционированного гепарина (НФГ). Возможно использование механических методов профилактики (компрессионные чулки или устройства для перемежающейся пневматической компрессии) как дополнение к основной терапии или как самостоятельный метод при наличии противопоказаний к применению НМГ и НФГ .
Не рекомендуется применение антитромбина III.
Профилактика язв
У пациентов с сепсисом и септическим шоком, имеющих факторы риска желудочно-кишечного кровотечения (проведение ИВЛ > 48 часов, заболевания печени, коагулопатии, проведение ПЗТ), необходимо проводить профилактику стрессовых язв с помощью блокаторов протонной помпы или антагонистов Н2-гистаминовых рецепторов.
Питание
Рекомендуется раннее начало энтерального питания у пациентов с сепсисом. В зависимости от переносимости могут использоваться трофические/гипокалорические смеси или полное раннее энтеральное питание. Начинать парентеральное питание следует не ранее 8 суток при невозможности обеспечить раннее энтеральное питание. При непереносимости энтерального питания или наличии высокого риска аспирации может проводиться измерение остаточного объема желудка, а также использоваться пост-пилорические зонды для кормления. Пациентам с гастропарезом, диабетом или получающим седативные и вазоактивные препараты может потребоваться применение прокинетиков (метоклопрамид, домперидон). При применении прокинетиков необходим ЭКГ мониторинг для ранней детекции синдрома удлиненного QT и снижения риска внезапной смерти.
Отсутствуют данные о положительном эффекте применения омега-3-жирных кислот, внутривенного введения селена, аргинина, глютамина и карнитина.
Пресепсин — еще один маркер сепсиса
Ранняя диагностика сепсиса имеет решающее значение для проведения успешной терапии. Применение эффективной антибиотикотерапии в течение первого часа после развития гипотензии при сепсисе связано с выживаемостью в 79,9 %. Каждый час задержки такой терапии в течение первых 6 часов снижает выживаемость на 7,6 %. Согласно статистическому анализу, именно время начала эффективной антибиотикотерапии — самый сильный предиктор исходов. Медианное время для начала эффективной терапии — 6 часов. В США только 50 % пациентов с септическим шоком получают эффективную антибиотикотерапию в течение первых часов после его документирования (данные на 2006 г.).
Врожденный иммунитет — первый барьер для бактериальной инфекции
Продуктом расщепления CD14, задействованного в активации врожденного иммунитета, является растворимый подтип CD14 (sCD14-ST), или пресепсин, который начинает циркулировать после активации защитных механизмов и поэтому является маркером инфекции. Определение концентрации пресепсина может быть полезным для ранней диагностики и прогнозирования системных инфекций у пациентов. Этот биомаркер обладает высокой специфичностью, что доказывается результатами многочисленных экспериментальных и клинических исследований, в которых для сравнения использовался прокальцитонин (ПКТ). Для диагностики некоторых форм маркеры инфекционных заболеваний иногда могут быть бесполезны (инфекции мочевыводящих путей, менингит), но их исследование можно использовать для постановки неточного диагноза.
Острые инфекции довольно часто имеют неясное течение и осложняются синдромом системной воспалительной реакции (SIRS), который в данной ситуации является синонимом сепсиса, хотя стоит помнить, что SIRS может развиваться и без инфекции. Тяжелый сепсис сопровождается полиорганной недостаточностью, часто приводящей к смерти. Широкое разнообразие микроорганизмов и низкая специфичность симптомов часто приводят к нерациональному использованию антибиотиков. Поэтому разработка стратегий диагностики инфекций и оценка их тяжести по-прежнему является для врачей приоритетом. Безусловно лучший способ диагностировать инфекцию — это определить патоген в физиологически стерильной ткани. Типичной иллюстрацией может быть присутствие бактерий в мочевыводящих путях. В то время, как тесты на многие микробы и вирусы все еще разрабатываются, стратегии, основанные на этих тестах, не могут быть разработаны, и неясно, какое место они займут в практической медицине. Таким образом, использование маркеров воспаления может быть полезным для установления или исключения сепсиса, выявления пациентов, которые могут извлечь выгоду из конкретных методов лечения, а также для оценки динамики терапии и тяжести течения.
C-реактивный белок (CРБ) и прокальцитонин (ПКТ) были широко изучены в отношении инфекций, хотя их полезность все еще остается спорной. Врачи интегрировали эти маркеры в свою повседневную практику, ведь CРБ и ПКТ косвенно свидетельствуют о реакции взаимодействия патогена и человека. В ответ на IL-6 (основной инициативный провоспалительный цитокин) печень начинает выработку CРБ, в то время как ПКТ выделяется и печенью, и моноцитами, хотя его функция до сих пор неясна. Несомненно, ПКТ и СРБ являются маркерами SIRS, хотя для ПКТ более характерна бактериальная этиология SIRS.
Немного иммунологии
Врожденный иммунитет опирается на линию моноцитов-макрофагов, которые активируются путем контакта с различными элементами возбудителя. Таковыми, например, являются мембранные и структурные белки, сахара и липиды, нуклеиновые кислоты, которые называются «патоген-ассоциированными молекулярными паттернами» (PAMP). PAMP определяются рецепторами и корецепторами, которые индуцируют запуск иммунного ответа по многим механизмам. CD14, экспрессирующийся на клетках миелоидного ряда, является корецептором этой системы.
Пресепсин, растворимый подтип CD14 или sCD14-ST, является продуктом расщепления CD14, который высвобождается после связывания с бактериальным антигеном. Пресепсин стабилен в общем кровотоке и может быть определен автоматическим анализатором.Таким образом, он представляет собой потенциальный биомаркер начальной стадии системной инфекции. Литературные данные показывают, что механизмы образования пресепсина являются специфичными для инфекции. Выживание видов зависит от способности их иммунной системы распознавать патогены и обеспечивать быстрый и эффективный ответ на вторжение.
Такой ответ можно схематически разделить на врожденный и приобретенный. Хоть каждый из них обладает своим набором систем рецепторов, они имеют довольно тесную взаимосвязь. Врожденный и приобретенный иммунитеты соответствуют различным этапам иммунного ответа. Первый полагается на немедленную и эффективную защиту антимикробных пептидов, альтернативного пути комплемента и фагоцитоза. Эти эффекторы позволяют контролировать распространение патогенов.
Активация врожденного иммунитета происходит после распознавания паттерна микроорганизма рецепторами и корецепторами на мембранах моноцитов-макрофагов. Рецепторы врожденного иммунитета генетически детерминированы, крайне консервативны и обладают широким спектром молекул, с которыми они имеют сродство, что и определяет их групповую специфичность. После связывания PAMP с рецепторами эффекторные клетки активируются напрямую без какой-либо предшествующей пролиферации.
Поэтому можно считать, что врожденный иммунитет обеспечивает быстрый и эффективный ответ на микробную инвазию. Активация рецепторов врожденного иммунитета посредством внутриклеточных каскадов индуцирует экспрессию генов, ответственных за развитие дальнейшего иммунного ответа, и генов провоспалительных цитокинов. CD14 распознает различные семейства лигандов, включая липиды, пептидогликан и другие поверхностные структуры грамположительных и грамотрицательных бактерий.
Наиболее изученным PAMP является бактериальный липополисахарид (ЛПС). Для эффективного распознавания ЛПС требуется его ассоциация с сывороточным белком ЛСБ (липопротеид-связывающий белок). Являясь корецептором, CD14 не может самостоятельно запустить сигнальный каскад, поэтому необходимо его сочетание с основным toll-like рецептором (TLR), при котором образуется мультимолекулярный комплекс CD14-ЛПС-ЛСБ, активизирующий внутриклеточный сигналинг.
После активации TLR моноцит-макрофаг фагоцитирует бактериальный паттерн, связанный с рецептором, а CD14 модулирует этот процесс. Далее экспрессия CD14 на мембране моноцитов снижается посредством протеолиза и интернализации, образуя небольшой растворимый пептид.
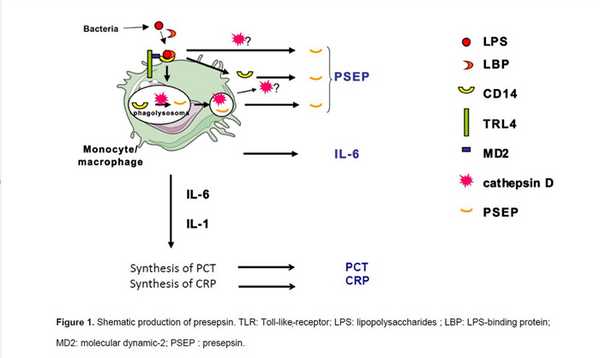
Продукт расщепления CD14 был назван растворимым CD14-подтипом (sCD14-ST), или пресепсином. Кроме того, sCD14-ST описан как регуляторный фактор. Он может модулировать клеточный и гуморальный иммунный ответ, взаимодействуя непосредственно с Т- и В-клетками. Циркулирование пресепсина может быть расценено как активация системы моноцит-макрофаг. Стоит помнить, что существуют базовая и физиологическая активности этих клеток, которые предполагают наличие пресепсина у здоровых людей. Поэтому концепция этого биомаркера подразумевает, что концентрация пресепсина должна быть определена у здоровых и больных людей, у которых она увеличивается на ранней стадии бактериальной инфекции, и это увеличение должно зависеть от интенсивности врожденного иммунитета.
Пресепсин как ранний маркер при инфекционных заболеваниях
Циркулирующие sCD14 определялись у людей с системной инфекцией, связанной с энтеробактериями, а также у новорожденных и взрослых для оценки тяжести сепсиса. В 2005 году пресепсин был описан как высокоспецифичный маркер в отношении сепсиса.Этот новый биомаркер, обнаруживаемый с помощью обычного иммуноанализа, значительно увеличивается в плазме крови на ранних стадиях сепсиса. Сегодня имеется не так много данных о кинетике пресепсина, о том, как долго устойчив его уровень во время сепсиса и особенностях его колебания. В экспериментальной модели сепсиса на кролике (лигирование и прокол слепой кишки с последующим развитием перитонита) пресепсин обнаруживался в крови животного уже через два часа после начала эксперимента. Было выяснено, что уровень пресепсина повышался раньше, чем IL-6 и ПКТ, с пиком через 3 часа и устойчивым повышением в течение по меньшей мере 5 часов. В другой работе концентрация пресепсина изучалась после стимуляции ЛПС моноцитов, собранных у 5 здоровых добровольцев. В клетках линии THP1 пресепсин был обнаружен через час после воздействия ЛПС, а его концентрация достигла максимума через 3 часа. В течение первого часа на линии PMNC наблюдалась секреция пресепсина одновременно с высвобождением IL-6. Также было описано, что при ожогах уровень пресепсина начинает увеличиваться раньше, чем ПКТ и СРБ, и остается повышенным в течение 7 дней. Все эти результаты подтверждают потенциальную пользу пресепсина в раннем обнаружении инфекционных заболеваний.

Рисунок 1 | Кинетика концентраций пресепсина (ПСП), ФНО-альфа, ИЛ-10, ИЛ-6, ПКТ и СРБ при индукции у лабораторных животных системного воспаления инфекционной природы
Пресепсин в оценке инфекционного поражения
По результатам исследований было установлено, что для выявления пациентов с инфекцией минимальное значение 399 пг/мл имеет хорошую чувствительность (80,3 %) и специфичность (78,5 %), а также лучшую эффективность, нежели другие биомаркеры, в число которых входят CРБ и ПКТ. Однако превосходство пресепсина не было показано во всех исследованиях, что может быть связано с особенностями возбудителя и течением инфекции.
Пресепсин показал лучшую эффективность по сравнению с ПКТ, оценивая 60-дневную летальность у 105 пациентов с сепсисом, но ПКТ достоверно показывал на преддиагностическую точность. Кажется очевидным, что концентрация пресепсина увеличивается в ответ именно на инфекцию, ведь его уровень был значительно ниже у 41 пациента с несептическим SIRS (333,5 пг/мл). Интересно, что у этих пациентов концентрации пресепсина не отличались от 22 нормальных участников (294,2 пг/мл) и 128 контролей (190 пг/мл).
В 83, по сравнению с 106, случаях сепсиса пресепсин обладал хорошей чувствительностью, но посредственной (61,9 %) специфичностью в отношении выявления инфекции при минимальной концентрации 600 пг/мл. Так как CD14 присутствует на мембранах циркулирующих моноцитов, можно предположить, что их количество может влиять на уровень пресепсина. Однако было установлено, что уровень пресепсина не коррелирует с количеством лейкоцитов.

В нескольких исследованиях сравнивались уровни пресепсина у пациентов с положительным и отрицательным посевами крови, и интересно, что пациенты с бактериемией имели более высокие концентрации пресепсина. Также стоит отметить одно исследование, в котором только ПКТ показывал значительную разницу между грамположительными и грамотрицательными результатами посева крови: в последнем он был более высокий уровень.
Ни пресепсин, ни ПКТ не могли дифференцировать инфекцию, вызванную S. aureus, от инфекции, вызванной E. coli. Однако было установлено, что у пациентов с кандидемией по сравнению с пациентами с отрицательным посевом крови уровень пресепсина значительно выше. Это наблюдение подтверждает вероятность влияния природы патогена и степени его инвазии на уровень пресепсина. Как было выявлено в исследованиях несептических пациентов, эффективность пресепсина может снижаться у пациентов с почечными заболеваниями. Также было показано, что оценка пресепсина вместе с ПКТ имеет большую диагностическую ценность, нежели их оценка поодиночке.
Пресепсин в оценке прогноза
Постепенное повышение уровня пресепсина связано со степенью тяжести инфекции. Исследователи из Японии выяснили, что средняя концентрация пресепсина составляет 721 пг/мл для местных инфекций, 818 пг/мл для сепсиса и 1993 пг/мл для тяжелого сепсиса. Пресепсин показал значительную способность диагностировать сепсис и септический шок. Комбинирование определения пресепсина с обычными системами оценки тяжести состояния улучшало их эффективность в выявлении более тяжелых пациентов. Пресепсин также можно использовать для прогнозирования риска смерти: его показатели для определения риска смерти близки к таковым у ПКТ. В заключение стоит еще раз отметить, что пресепсин повышается раньше других маркеров сепсиса до его клинической манифестации, и его повышение не регистрируется при неинфекционных поражениях, а также его можно использовать для оценки динамики тяжести состояния.
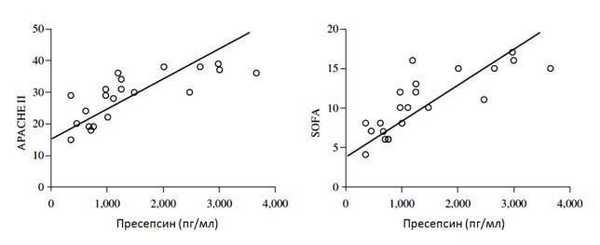
Рисунок 2 | Связь уровней пресепсина и показателей тяжести критических пациентов согласно шкалам оценки тяжести критических пациентов
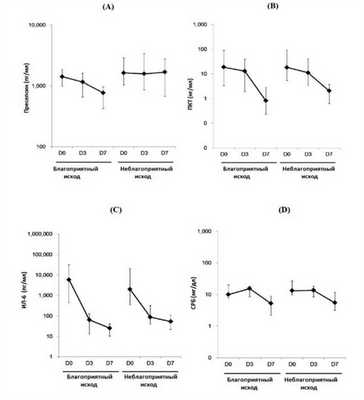
Рисунок 3 | Кинетика уровней пресепсина, ПКТ, ИЛ-6 и СРБ у септических пациентов с благоприятным и неблагоприятным прогнозом течения сепсиса согласно шкале SOFA. А - пресепсин, В - ПКТ, С - ИЛ-6, D - СБР, измерения при поступлении, на 3 и 7 день
Читайте также:
