Лучевая диагностика оссификации задней продольной связки (ОЗПС)
Добавил пользователь Владимир З. Обновлено: 02.02.2026
рогрессирующая оссифицирующая фибродисплазия (ПОФ) - редкая нозологическая форма, которая характеризуется генетически обусловленной интермиттирующей гетеротопической оссификацией и врожденными дефектами развития, прежде всего скелета. Заболевание характеризуется неуклонно прогрессирующим течением, приводит к значительным нарушениям функционального состояния опорно-двигательного аппарата, глубокой инвалидизации больных и преждевременной их смерти, причем преимущественно в детском и молодом возрасте. Основу ПОФ составляет агрессивная пролиферация фибробластов и формирование воспалительных инфильтратов в сухожилиях, связках, фасциях, подкожных тканях и мышцах, что в конечном итоге приводит к их кальцификации и окостенению. Это заболевание вызывает большой интерес, так как расшифровка его патогенеза может стать ключом к активному воздействию как на регенерацию костной ткани при многих патологических процессах, так и к профилактике гетеротопической оссификации любого генеза.
ПОФ является представителем большой группы заболеваний неизвестной природы, наиболее характерным признаком которых является развитие гетеротопического костеобразования или фибровоспалительных нарушений [1]. Гетеротопический остеогенез встречается при многих нозологических формах. Выделяют локальные травматические, параоссальные и параартикулярные окостенения. Вновь возникшая кость по своим морфологическим признакам ничем существенным не отличается от костной ткани скелета. Костеобразование в мягких тканях может быть причиной нарушения функции опорно-двигательного аппарата. Оно приводит к развитию контрактур, внесуставных анкилозов, снижению силы мышц, нейродистрофическим нарушениям. Размеры этого процесса варьируют от небольших участков оссификации до генерализованного окостенения мышц и сухожилий. Такое костеобразование является частным проявлением метапластического остеогенеза, при котором не участвуют клетки периоста и эндоста.
Прогрессивное мышечное окостенение является самостоятельной нозологической формой, характеризующейся трансформацией соединительной ткани мышечных прослоек, сухожилий и связочного аппарата в костную ткань. В литературе это заболевание называют прогрессивным оссифицирующим миозитом, остеопластической миопатией, болезнью Мюншмайера или прогрессирующей оссифицирующей фибродисплазией.
Для ПОФ наиболее характерными стигматами являются как оссификация мягких тканей, так и многочисленные дефекты развития. Чаще всего имеет место микродактилия большого пальца стопы или, реже, стоп. Нередко наблюдаются короткий большой палец кисти, гипоплазия фаланг, вальгусное отклонение первых пальцев стоп, клинодактилия пятого пальца, врожденные дефекты шейного отдела позвоночника, короткие широкие шейки бедренных костей halluх valgus. Возможны глухота, облысение волосистой части головы, нерезко выраженная задержка психического развития, гипогонадизм, аномалии развития мочек уха [2]. В литературе имеются указания на ассоциацию этого заболевания с другими дефектами развития, в частности с искривлением V пальца обеих кистей, наличием 11 грудных позвонков и соответственно 11 пар ребер. Наличие таких признаков, даже при отсутствии клинической и рентгенологической симптоматики поражения мягких тканей, позволяет диагностировать это заболевание [3].
ПОФ чаще всего начинается в первой декаде жизни, но возможен дебют в более позднем возрасте или сразу после рождения [4, 5]. Как правило, первым симптомом является развитие болезненных инфильтратов в мягких тканях, которые напоминают подкожные опухолевидные образования. Возможно развитие оссификатов и без предшествующей клинически выраженной инфильтрации. Появление инфильтратов сопровождается незначительным повышением температуры и покраснением кожи над ними. Наиболее часто они локализуются в параспинальных мышцах, мышцах плечевого и тазового пояса или на шее. Однако они могут располагаться в любом месте на туловище или конечностях. В процесс вовлекаются не только мышцы, но и другие мягкие ткани, включая апоневрозы, связки, сухожилия [6]. Образование этих инфильтратов провоцируется ушибами, оперативными вмешательствами, внутримышечными инъекциями, при этом имеют значение любого вида травмы, причем нередко они могут быть довольно легкими. При гистологическом исследовании инфильтратов определяется значительная пролиферация фибробластов, которая приводит к компрессии мышечных волокон и их дистрофии. Мононуклеарные инфильтраты располагаются в мышцах и нередко спаяны с подкожной соединительной тканью.
Через несколько недель или месяцев в области этих инфильтратов происходит отложение кальция, которое в дальнейшем заканчивается оссификацией. Гетеротопические оссификаты имеют различную локализацию и могут образовываться почти во всех тканях организма, включая скелетную мускулатуру, сухожилия, связки, суставную капсулу, жировую клетчатку. При ПОФ наиболее часто встречается оссификация шеи, позвоночника и плечевого пояса, и только позже она распространяется на другие области туловища и конечности. Неуклонное прогрессирование такой оссификации развивается в направлении от позвоночника к периферии, от головы к конечностям, от проксимальных отделов к дистальным. Помимо окостенения мышц, возможно развитие экзостозов на костях конечностей, преимущественно на метафизах длинных костей, позвоночнике, костях таза, черепа или другой локализации. Прогрессирующее течение ПОФ и выраженная оссификация ведут к тяжелым осложнениям, включая тортиколиз с вовлечением m. sternoclaidomastoideus и формированием кривошеи, деформации верхней половины грудной клетки, сколиозу и тугоподвижности суставов.
В литературе представлены описания отдельных случаев ПОФ [3, 7], хотя имеются работы, в которых авторы опираются на анализ 28-32 больных с этим заболеванием [8, 9]. R. Smith и соавт. проанализировали клиническую картину ПОФ у 28 больных, которых они наблюдали в течение 24 лет [10]. Оссификация больших скелетных мышц впервые начиналась с момента рождения и продолжалась до 16 лет включительно. Ее направленность шла с шеи и мышц верхней части спины к мышцам бедра, челюсти и мышцам вблизи крупных суставов. Скорость нарастания малоподвижности и ее выраженность не были связаны с возрастом начала болезни и первичной локализацией инфильтратов. У всех больных верификация диагноза представляла большие трудности. Правильный диагноз, как правило, ставился после появления очагов эктопической оссификации, что в среднем наблюдалось через 2,7 года от начала заболевания.
При поиске специфических генов, ответственных за развитие ПОФ, A. Shafrits и соавт. выявили повышенную экспрессию гена BMP4 (bone morphogenic protein 4 - ВМР4) и его матричной РНК (мРНК) в лимфобластоидных клетках у 26 из 32 больных с этим заболеванием [8]. Они же обнаружили суперэкспрессию гена BMP4 и его мРНК у мужчины, страдающего ПОФ, и трех его детей, которые имели это же заболевание, в то время как среди его здоровых потомков такой закономерности не наблюдалось.
BMP4 является чрезвычайно важным регуляторным белком, который индуцирует развитие мезодермы, формирование зубов, костеобразование и репарацию переломов. Семейство костных морфогенных белков относится к суперсемейству трансформирующих факторов роста. В настоящий момент идентифицировано 9 костных морфогенных белков - ВМР 1, 2, 3, 4, 5, 6, 7, 13, 14. Все они в той или иной мере задействованы в процессах формирования хряща и кости и являются частью Wnt-сигнального пути. Тот факт, что мутации в гене ВМР4 у больных ПОФ не выявлены, а суперэкспрессия этого гена установлена не у всех больных, заставляет предположить наличие мутаций среди генов, продукты которых взаимодействуют с ВМР4. В частности, показано, что для белка BMP4 имеются соответствующие рецепторы и кодирующие их синтез гены - BMPR1A, BMPR1B и BMPR2, мутации в которых, как полагают, также могут обусловливать возникновение ПОФ при соответствующей норме последовательности гена BMP4.
Естественным эндогенным фактором, ингибирующим экспрессию гена BMP4, является Noggin-протеин, синтез которого кодирует ген NOG. Мутации в гене NOG были выявлены у больных с проксимальным симфалангизмом, который по фенотипическим проявлениям имеет некоторое сходство с дефектами пальцев кисти при ПОФ. G. Lucotte и соавт. предполагают, что такой ген у больных ПОФ кодирует синтез укороченного белка, который неэффективно ингибирует экспрессию гена ВМР4, и как следствие этот ген будет суперэкспрессирован [12]. Такая точка зрения послужила поводом для M. Xu и соавт. изучить мутационную изменчивость гена NOG у 31 больного ПОФ, причем у 13 из них наблюдались семейные случаи заболевания и у 18 - спорадические [9]. Авторы не выявили в этом гене ни одной мутации. Об интактности гена NOG в детерминации ПОФ свидетельствовали и отрицательные значения лод-баллов при анализе сцепления. На основании полученных данных авторы делают заключение, что мутации в гене NOG не являются широко распространенным стигматом среди больных ПОФ и не оказывают значимого влияния на детерминацию этого заболевания.
Для выявления кандидатных хромосомных участков, предположительно несущих гены, обусловливающие возникновение ПОФ, G. Lucotte и соавт., а также G. Feldman и соавт. провели широкое скринирование 22 аутосомных хромосом с использованием большого числа ДНК-маркеров (порядка 300-400) и анализ сцепления в семьях с множественными случаями заболевания [13, 14]. Были выявлены два критических участка, предположительно несущих ген чувствительности к ПОФ, один из которых располагался на 17-й хромосоме, а другой - на 4-й хромосоме. На 17-й хромосоме кандидатный ген, предположительно детерминирующий ПОФ, в настоящее время не идентифицирован. По данным анализа сцепления он может быть локализован на хромосомном участке между мини-сателлитными маркерами D17S809 и D17S1838. На 4-й хромосоме максимальные значения лод-баллов были получены для мини-сателлитных маркеров D4S1625 и D4S2417, фланкирующих хромосомный участок, на котором локализован наряду с другими ген SMAD1.
В настоящее время идентифицированы 7 генов SMAD - 1, 2, 3, 4, 5, 6 и 7. Белки трансформирующего фактора роста-b (TGF-b) функционируют как передатчики сигналов с гена TGF-b на соответствующие рецепторы этого гена (TGF-bR) и с гена ВМР4 на рецепторы этого гена - BMPR. Основная функция гена TGF-b - ингибиция пролиферации различного рода клеток через рецепторы и белки SMAD. Стимуляция гена TGF-b ведет к активации генов SMAD2 и SMAD3, усиливая синтез соответствующих белков, которые образуют комплекс с белком SMAD4. Последний регулирует транскрипцию генов-мишеней TGF-b-сигнального пути, которых на данный момент идентифицировано 69. Вариабельность в нуклеотидной последовательности гена TGF-b обусловливает развитие фиброза при многих патологических состояниях, например при болезнях почек, легких, диабетической нефропатии и др. Мутации в гене TGF-b вызывают болезнь Камурати - Энгельмана (Camurati-Engelmann) - заболевание, характеризующееся прогрессирующим гиперостозом и склерозом диафизов трубчатых костей (диафизальная дисплазия).
С точки зрения этиопатогенеза ПОФ, в качестве гена-кандидата чувствительности к заболеванию небезынтересен ген эктонуклеотид пирофосфатазы (ENPP1), который продуцирует неорганический пирофосфат, являющийся главным ингибитором кальцификации и минерализации. Сигнал с гена TGF-b повышает экспрессию гена ENPP1, что способствует усиленной выработке неорганического пирофосфата и уменьшает интенсивность процессов минерализции и кальцификации. Мутации в гене ENPP1 вызывают аномальную оссификацию длинных связок спины и ювенильную идиопатическую оссификацию артерий [15, 16].
Таким образом, в настоящее время гены ПОФ не идентифицированы. Можно предположить, что это заболевание детерминируется разными генами, т. е. оно генетически гетерогенно. Однако не исключено, что ПОФ может быть следствием взаимодействия нескольких генов, действующих как синергисты.
Своевременная диагностика этого заболевания оставляет желать лучшего. Причина несвоевременного распознавания в основном связана с малой информированностью врачей об этой патологии и, в частности, недиагностированностью аномалии большого пальца стопы или других дефектов развития скелета, которые являются значимым маркером этого заболевания. Диагностика ПОФ базируется на двух клинико-рентгенологических критериях, а именно наличии гетеротопической оссификации мягких тканей и аномалий развития прежде всего большого пальца стопы/стоп. При этом заболевании нет какого-либо характерного лабораторного маркера. Возможно повышение сывороточного уровня щелочной фосфатазы, свидетельствующей об активации метаболизма костной ткани, а также повышение индекса кальций/фосфор. Другие показатели, включая белковые фракции и острофазовые белки, биохимические и иммунологические тесты, не имеют отклонений от нормальных величин.
При проведении дифференциального диагноза следует иметь большую группу заболеваний, характеризующихся идиопатическим фибровоспалительным процессом. К ним относятся фокальный cклеротический миозит, воспалительный фиброзный полип желудочно-кишечного тракта, кальцифицирующий фиброзный псевдотумор, склеротический перитонит. Наиболее трудной представляется дифференциация ПОФ и ювенильного дерматомиозита с кальцинозом. Если для ПОФ типичным является сочетание аномалий развития с характерным эктопическим формированием костной ткани на туловище, то при ювенильном дерматомиозите кальцификации подвержены мышцы верхних или, что более характерно, нижних конечностей [9]. При ПОФ возможно наличие умеренной миопатии, которая является вторичной по отношению к эктопическому формированию кости.
Приводим собственное наблюдение больного с ПОФ.
Больной З., 23 года. Инвалид I группы. Закончил 12 классов средней школы и 3 курса технического университета.
Наследственность не отягощена. Мать - русская, отец - мордвин. Родители и младший брат здоровы. Других детей в семье не было. Родился здоровым мальчиком, но в первые месяцы жизни не было бровей. С 6 мес до 1 года выявлен экссудативный диатез, который появился после какой-то прививки. В раннем детстве болел краснухой и ветрянкой. Наблюдалась анемия. Гемоглобин быстро нормализовался после лечения цианокобаламином. В 4-летнем возрасте дважды наблюдался отек лба, который расценили как последствие укуса комара или пчелы. В возрасте 6,5 года без видимой причины появилась отечность голени. Температура оставалась нормальной. Позже заметили ограничение подвижности в голеностопном суставе. При рентгенологическом исследовании выявлен экзостоз. В этот период, как и на всем протяжении заболевания, СОЭ не повышалась. Проведено оперативное вмешательство с целью удаления экзостоза. После снятия гипса развилась стойкая контрактура, а через 21 день после операции обнаружили распространение депозитов кальция в мягких тканях бедра и голени. По данным гистологического исследования биоптата из области послеоперационного рубца диагностировали оссифицирующий миозит. В дальнейшем больной повторно оперировался с иссечением оссифицирующих мышц ног, что приводило только к нарастанию гетеротопической оссификации. Развились стойкие сгибательные контрактуры, из-за которых с трудом передвигался. Дважды надрезали ахиллово сухожилие, что приводило лишь к кратковременному эффекту. Сформировалась деформация стопы в положении переразгибания. В 1992 г. упал с качелей на спину. Через 2 мес развился отек шеи, а после его разрешения появилась тугоподвижность в шейном отделе позвоночника. С 1992 г. стали появляться многочисленные опухолевидные образования на спине, достигающие 15x25 см и имеющие деревянистую плотность. В 2003 г. после травмы (упал на улице) появилась припухлость бедра с гиперемией кожи и повышением локальной температуры. Эта припухлость держалась не менее 1,5 мес. Одновременно наблюдалась припухлость и в области грудино-ключичной мышцы.
При поступлении. Общее состояние средней тяжести. Ходит только с помощью посторонних лиц. Нарушена осанка. Голова отклонена влево и приведена к туловищу. Не может опираться на всю ступню и передвигается на носочках. Укорочены большие пальцы стоп. Определяются множественные экзостозы, наиболее крупные в области локтевых суставов. В месте операционного рубца на правой голени - плотное образование в виде тяжа 1,5x8 см. На левой голени определяется плотный тяж 4x10 см. Выраженная деформация грудной клетки, преимущественно в области плечевого пояса, со значительным ограничением подвижности в плечевых суставах и приведением рук к туловищу. В правом плечевом суставе почти отсутствуют пассивные или активные движения. Значительное ограничение подвижности в локтевых и левом лучезапястном суставах, а также в тазобедренных и коленных. Сгибательные контрактуры коленных, плечевых и локтевых суставов. Крупные оссификаты на спине, преимущественно в верхних отделах, безболезненные при пальпации, достигающие в длину 22 см и более. Мышцы спины плотные на ощупь. Выраженная деформация позвоночника, сколиоз грудного и поясничного отделов, ограничение подвижности шейного отдела позвоночника в трех направлениях.
В клиническом анализе крови, мочи, при детальном биохимическом и иммунологическом исследовании отклонений от нормы не выявлено. На рентгенограммах туловища и конечностей имеется большое количество крупных оссификатов разной формы и размеров (рис. 1, а, б; рис. 2), а при рентгенографии дистальных отделов стоп обнаружена микродактилия больших пальцев стоп и их синкарпия, утолщение дистальных эпифизов I плюсневых костей (рис. 3).
Рис. 1. а. Крупный оссификат в области а) наружной поверхности коленного сустава (прямая проекция) и в области б) коленного сустава (боковая проекция)
Оссификация задней продольной связки
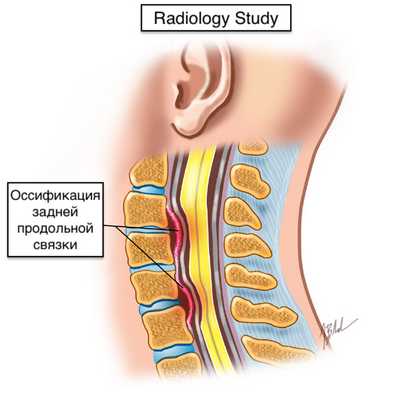
Оссификация задней продольной связки (ОЗПС) - оссификация в толще продольной связки позвоночника.
Эпидемиология:
- Заболевание обычно развивается в возрасте старше 50 лет, младше 30 лет патология встречается редко. Мужской пол более привержен к данному заболеванию 2:1. Что касаемо этнической предрасположенности в Японии данное заболевание встречается чаще, чем в других странах в 2-4% случаях.
ОЗПС присутствует у 16% пациентов с анкилозируищим спондилитом в Мексике и 23% пациентов с этим заболеванием в Канаде.
Патология:
По поводу этиологии однозначного мнения не существует.
Возможные этиологические факторы: инфекционные агенты, аутоиммунные заболевания или травмы
Генетическая предрасположенность:
- Полиморфизм гена, расположенного в 6 хромосоме (COL11А2) приводящей к изменению а-цепочки коллагена Xl типа, который ассоциируют с предраспопоженностью к ОЗПС
- Полиморфизм гена, кодирующего структуру коллагена VI типа (COL6AU -+ изменения а-цепочки коплагена VI типа, что ассоциируют с предраспопоженностью к ОЗПС.
Ассоциация:
- Гипертрофия задней продольной связки рассматривается как предвестник ОЗПС
- У 25% пациентов с ОЗПС наблюдается диффузный идиопатический скелетный гиперостоз (ДИСГ).
- ОЗПС сопровождает 16-20% случаев оссифииции желтых связок (ОЖС).
Анкилозирующий спондилит
В начальных или ранних стадиях данного заболевания определяется гипертрофированная ЗПС с единичными выключениями кальцинатов. При этом ранние изменения тяжело дифференцировать с распространенным спондилезом. У пациентов с ОЗПС отмечают большую минеральную плотность костной ткани, чем соответствующие им по возрасту здоровые люди, что возможно является предрасполагающим фактором к костеобразованию.
Макроскопические особенности:
- Массивная оссификация задней продольной связки, ограниченная нормальной кортикальной слоем кости и содержащий не изменённый костный мозг.
Формы:
- Тип 1 - Непрерывная форма - патология вдоль нескольких позвоночных сегментов.
- Тип 2 - Сегментарная форма - ограниченная оссифицированные участки позади каждого из тел позвонков.
- Тип 3 - Смешанная форма - участки оссификации, как протяжённое, так и сегментарные.
- Тип 4 - Локализованная форма - поражение не более 2 сегментов.
Клинические проявления:
Клиника миелопатии, зависящая от уровня стеноза. Клинические проявления, характерные для миелопатии, чаще развивается при диаметре спинномозгового канала менее 6 мм. При диаметре от 6 до 14 мм клинические проявления вариабельны. В более тяжёлых случаях проявления патологии обычного прогрессирующий тетра- и парапарез.
Радиологические находки:
Общие особенности:
Равномерный протяженный оссификат, расположенный вдоль задней поверхности тел позвонков, при относительно минимальных дегенеративных изменениях межпозвонковых дисков и отсутствии анкилоза дугоотростчатых суставов.
Локализация:
Чаще от среднешейного уровня (СЗ-С5) до среднегрудного уровня (Th4-Тh7)
Размеры:
От локального утолщения до протяженной непрерывной оссификации (толщина связки составляет около 2-5 мм).
Морфологические особенности:
Оссификация ЗПС приводит к уменьшению передне-заднего диаметра спинномозгового канала, что приводит к стенозу спиннопозвоночного канала, сдавление спинного мозга.
Рентгенография:
- Протяженная зона оссификации кзади от тел позвонков.
- В боковой проекции тень оссификата нередко наспаивается на тени дугоотростчатых суставов.
- При интерпретации рентгенограмм изменения могут быть настолько минимальными, что легко могут быть просмотрены, в связи с чем необходимо всегда помнить об этой патологии.
Компьютерная томография (КТ).
- Характерный вид ЗПС в виде «перевернутой буквы Т» или «галстука-бабочки» на аксиальных срезах.
- Картина оссификации ЗПС аналогичная таковой на бескострастных КТ срезах.
- Кортикальная пластинка, ограничивающая центрально расположенное костномозговое пространство, может соединиться с подлежащей покровной пластинкой.
- Тела позвонка либо быть отграниченной от нее.
- Костномозговые пространства оссифицированной ЗПС и тела позвонка не сообщаются.
Магнитно-взвешенное изображение (MPT).
T1-взвешенное изображение:
- Непрерывный оссификат расположенный кзади от тел позвонка, распространяющийся на сагиттальных изображениях на несколько уровней.
- Характерный вид ЗПС а виде «перевернутой буквы Т» или «галстука бабочки» на аксиальных изображениях.
- Сигнал обычно отличается низкой интенсивностью во всех режимах исследования
- При значительном объеме жирового компонента в костно-мозговом пространстве оссификата интенсивность сигнала может быть гиперинтесивной.
Т2-взвешенное изображение.
- Картина ОЗПС схожа с картиной на Т1.
- Визуализация спинного мозга с наличием гиперинтенсивного сигнала коррелируется с миеломаляцией и отеком.
T2-GRE
- Гипоинтенсивность сигнала оссифицированной ЗПС
- Степень стеноза нередко переоценивается из-за артефактов магнитной восприимчивости.
Дифференциальный диагноз:
Спондилез:
- Изменения ограничены обычно уровнем межтелового пространства и редко захватывают четыре и более сегментов позвоночника.
- Более выраженные, чем при ОЗПС дегенеративные изменения дугоотростчатых суставов и межгюзвонковык дисков
- Отсутствие характерной (в виде буквы Т) оссификации ЗПС
Кальцифицированная грыжа диска:
- Фокальное кальцифицированное «образование», ограниченное уровнем одного межпозвонкового диска
- Отсутствие характерной (в виде буквы Т) оссификации ЗПС
Менингиома:
- Активно накапливающее контрагг объемное образование твердой мозговой оболочки+дуральный «хвост», ровные края
- Нередко на фоне капьцификации отмечается гипоинтенсивность Т2-сигнала
- Отсутствие характерной (в виде буквы Т) оссификации ЗПС
Перидуральная кальцификация шейного отдела позвоночника у диализных пациентов:
- Неравномерная оссификация твердой мозговой оболочки, может быть циркулярной
- Пациент, получающий гемодиализ±миелопатия, чувствительные нарушения
- В дополнение к ляминэктомии/ляминопластике показана резекция твердой мозговой оболочки.
Течение и прогноз:
- Бессимптомные пациенты - наблюдение, консервативное лечение.
- Пациенты с выраженной клиникой являются претендентами корпорэктомию, ламинэктомия, ламинопластику.
Источники:
2. Li H et al: A systematic review of complications in cervical spine surgery for ossification of the posterior longitudinal ligament. Spine J. 11(11):1049-57, 2011
3. Saetia K et al: Ossification of the posterior longitudinal ligament: a review. Neurosurg Focus. 30(3):E1, 2011
4. Shin JH et al: Dorsal versus ventral surgery for cervical ossification of the posterior longitudinal ligament: considerations for approach selection and review of surgical outcomes. Neurosurg Focus. 30(3):E8, 2011
7. Matsunaga S et al: Clinical course of patients with ossification of the posterior longitudinal ligament: a minimum 10-year cohort study. J Neurosurg. 100(3 Suppl):245-8, 2004
8. Shiraishi T et al: Cervical peridural calcification in patients undergoing long- term hemodialysis. Report of two cases. 100(3 Suppl): 284-6, 2004
10. Epstein N: Diagnosis and surgical management of cervical ossification of the posterior longitudinal ligament. Spine J. 2(6):436-49, 2002
Оссификации задней продольной связки и ее роль в формировании корешкового синдрома при остеохондрозе поясничного отдела позвоночника

На основе анализа результатов хирургического лечения 222 больных остеохондрозом поясничного отдела позвоночника, осложненным корешковым синдромом, показано, что длительное консервативное лечение, включающее физиотерапию, вытяжение, мануальную терапию, при наличии объективно установленной компрессии корешков усугубляет состояние больных за счет стимуляции пролиферативных процессов в позвоночном канале. Своевременное оперативное лечение позволяет избежать осложнений основного заболевания, снизить срок нетрудоспособности и вернуть больного к обычной жизни и труду с минимальными экономическими и временными затратами.
Полный текст
Целью предлагаемой работы явился анализ результатов оперативных вмешательств у 222 больных с остеохондрозом поясничного отдела позвоночника, осложненным корешковым синдромом в результате грыжи межпозвонкового диска.
При обследовании больных особое внимание обращалось на срок возникновения корешкового синдрома, проведенное консервативное лечение, его продолжительность и интенсивность. Общеизвестно, что показанием к операции служит безуспешность консервативного лечения, однако в вопросе о том, насколько длительной должна быть консервативная терапия, мнения авторов расходятся. Одни утверждают, что оперировать необходимо при отсутствии эффекта от 2-недельного курса комплексного лечения [1, 2], другие увеличивают этот срок до нескольких месяцев [3].
Большинство (54%) пациентов обратились к нам через 6 мес после появления болей в ноге, у 16% корешковый синдром появился 3 мес, у 8% —1 мес назад, у 22% больных боли в ноге и другие проявления корешкового синдрома имелись 1—3 года. В последней группе больных проводилось длительное и интенсивное консервативное лечение, включавшее физиотерапевтические воздействия, витаминотерапию, грязелечение, различные ванны, рефлексотерапию, длительные курсы массажа и др.
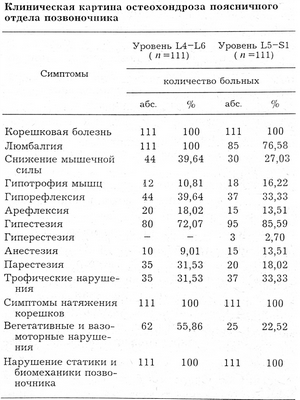
Возраст больных, обратившихся к нам, составлял от 24 до 48 лет. Мужчин было 57,3%, женщин — 42,7%. Всех пациентов беспокоили боли в ноге, 88% жаловались на боли в поясничной области. Чувствительность была изменена у 90% больных, болезненность при пальпации остистых отростков выявлялась у 94%, слабость нижних конечностей — у 33,3%, двигательные нарушения (изолированные парезы отдельных мышц) — у 8,9%. Снижение коленного рефлекса отмечено у 30,3% больных, его отсутствие — у 6,7%, снижение ахиллова рефлекса — у 7,8%, отсутствие — у 9%. Симптомы натяжения корешков выявлялись у всех больных, трофические нарушения — у 32,5%, атрофия мышц бедер и голеней обнаружена у 13,5%, вегетативные нарушения — у 39,3%, статика и биомеханика позвоночника были нарушены у всех пациентов (см. таблицу).
Клиническая картина остеохондроза поясничного отдела позвоночника
Курс консервативной терапии проходили все больные, из них 154 (69,3%) в поликлинике, а затем в стационаре и 68 (30,7%) — амбулаторно. При этом 32,8% больных было проведено до 8—12 курсов консервативного лечения, включавших различные тепловые процедуры, иглорефлексотерапию, тракционные методы. Большинство этих больных отмечали низкую эффективность лечения, причем периоды ремиссии от курса к курсу укорачивались. У 30,3% больных ремиссия длилась 3—6 мес, у 33,7% консервативная терапия не дала эффекта, 10% отмечали кратковременное улучшение, у 3,4% больных после сеанса мануальной терапии впервые появился или усилился корешковый синдром.
В обследование больных в обязательном порядке включалась компьютерная или магнитно-резонансная томография. В 32,8% случаев на томограммах определялись разной степени выраженности признаки оссификации задней продольной связки, деформированной грыжей межпозвонкового диска.
Всем больным с корешковым синдромом произведена микрохирургическая дискэктомия по методике W. Caspar [4]. Показанием к оперативному лечению служило сочетание корешкового синдрома, инвалидизирующего больного, с визуализированной томографически грыжей межпозвонкового диска.
Операцию выполняли в коленно-локтевом положении больного. Разрезом длиной 3 см обнажали и резецировали желтую связку. После коагуляции вен эпидуральной клетчатки, обнажения задней продольной связки и фиброзного кольца в диск вводили кольцевидную кюретку и вращательными движениями производили его разрушение. Введением кюреток с изогнутой под разными углами рабочей частью завершали разрушение диска. Фрагменты его удаляли специальными захватами с также изогнутыми под разными углами «губками». Количество удаленного вещества составляло приблизительно 3—4 см 3 . По окончании дискэктомии к междужковому промежутку подводили дренаж, ушивали фасцию, кожу.
У 32,8% больных после резекции желтой связки и мобилизации дурального мешка были обнаружены оссифицированная задняя продольная связка над выпавшим в позвоночный канал фрагментом диска или оссификация по типу экзостозов в виде «разводного моста» над межпозвонковым промежутком и грыжей диска. Все эти больные до операции получали длительные курсы консервативной терапии. У 7 из них оссификация была столь значительной, что было невозможно проникнуть в межпозвонковый промежуток без использования специальных штихелей и фрез. У 2 больных микродискэктомию пришлось прервать и, расширив оперативный доступ, преобразовать ее в ламинэктомию.
Вставать больным разрешали на 2-е сутки без корсета, но так, чтобы не нагружать поясничный отдел позвоночника (больной переворачивался на живот и вставал, опираясь на Руки).
В ближайшем послеоперационном периоде боли в спине исчезли у 150 (67,57%) больных, корешковые боли — у 180 (81,08%), чувствительность восстановилась у 167 (75,23%), мышечная сила — у 178 (80,18%), ортопедическая коррекция позвоночника достигнута у 211 (95,05%).
Отдаленные результаты оперативного лечения оценивали в срок до 2 лет. Основное внимание обращали на отсутствие корешкового синдрома и возвращение больного к нормальному образу жизни. 88,6% больных вернулись к прежней работе на 7-й неделе после операции, 11,2% — на 9-й неделе. Боли в спине исчезли у 208 (93,69%) оперированных, корешковые боли — у 222 (100%)), чувствительность восстановилась у 211 (95,05%), мышечная сила — у 222 (100%), ортопедическая коррекция позвоночника произошла также у всех больных.
Приводим клинический пример.
Б о л ь н о й Т., 29 лет, обратился к нам с жалобами на ноющие боли в пояснице, иррадиирующие в правую ногу, чувство онемения в правой стопе. Впервые ноющие боли в пояснице появились 4 года назад, после поднятия тяжестей. К врачу не обращался. Боли в ноге после тяжелой физической нагрузки стали беспокоить в последние 6 мес. Больному был назначен курс консервативного лечения (физиотерапия, массаж), после чего боли утихли. Однако ремиссия была нестойкой. Последующие несколько курсов консервативного лечения эффекта не дали.
При осмотре отмечались выраженный правосторонний анталгический сколиоз, хромота на правую ногу. В неврологическом статусе: гипестезия по задненаружной поверхности бедра и голени, отсутствие ахиллова рефлекса справа, положительные симптомы натяжения с той же стороны. Боли локализовались на задней поверхности бедра и голени. На компьютерной томограмме выявлены латеральная грыжа диска L5—S1 с компрессией корешка S1 справа, оссификация задней продольной связки.
Во время операции — микрохирургической дискэктомии — обнаружена и удалена большая грыжа межпозвонкового диска, сдавливавшая корешок S1 справа, резецирована оссифицированная задняя продольная связка.
Послеоперационный период протекал без особенностей, на 2-й день больной начал ходить. Боли регрессировали сразу, чувствительность восстановилась на 2-й неделе. К работе приступил на 7-й неделе. При осмотре: деформации поясничного отдела позвоночника нет, походка свободная; симптом Ласега отрицательный, сухожильные рефлексы нижних конечностей симметричны. Исход: выздоровление. Повторно осмотрен через 2 года: жалоб нет.
Анализ данных анамнеза, методов лечения больных до операции, результатов обследования и операционных находок позволяет сделать следующие выводы. Длительное и интенсивное консервативное лечение при наличии грыжи межпозвонкового диска, визуализированной при компьютерной или магнитно-резонансной томографии, по нашим наблюдениям, дает незначительный положительный эффект, но при этом стимулирует регенеративные процессы в организме, тем самым способствуя оссификации задней продольной связки и усилению компрессии корешков. Оттягивание операции в этих случаях вредит больному, усугубляет его страдания, усложняет саму операцию и приводит к худшим результатам оперативного лечения. Поэтому мы считаем, что при наличии корешкового синдрома, подтвержденного компьютерной или магнитно-резонансной томографией, показано раннее оперативное лечение, которое в минимальные сроки и с меньшими потерями вернет больного к нормальной жизни.
Позвоночник. Форестье болезнь. +
Болезнь Форестье - невоспалительное поражение позвоночника, очень напоминающее по формальным признакам спондилез, описали в 1950 г. J. Forestier и J. Rots-Querol, предложив называть ее анкилозирующим старческим гиперостозом позвоночника. В последующих публикациях это заболевание стали описывать под названием «болезнь Форестье» или «фиксирующий лигаментоз», «фиксирующий гиперостоз» (что не соответствует принятому в отечественной литературе представлению о гиперостозе как патологическом увеличении содержания костного вещества в неизмененной костной ткани). По мнению зарубежных авторов термин «лигаментоз» не подходит по принципиальным соображениям, поскольку означает дистрофическое изменение связки, которого при этом заболевании не происходит.
Длительное время считалось, что болезнь Форестье ограничивается оссификацией связок позвоночника, но с середины 70-х гг. все большее распространение получает представление о генерализованном характере патологического процесса, который захватывает многие связки и сухожилия как позвоночника, так и периферического скелета. Первоначальные изменения в виде очагов метаплазии соединительной ткани в хрящевую, а затем кистную выявляются в местах прикрепления связок и сухожилий к костям (болезнь Форестье также характеризуется образованием остеофитов и шпор, кальцификацией мягких тканей). Наиболее постоянно процесс эктопического костеобразования отмечается в передней продольной связке позвоночника, собственной связке надколенника, местах прикрепления сухожилий мышц к подвздошным костям, подошвенном апоневрозе, иногда в задней продольной связке позвоночника.
Заболевание редкое, в 2 раза чаще встречается у мужчин, чем у женщин, преимущественно в возрасте старше 50 лет.
Болезнь Форестье может развиваться на фоне сахарного диабета, чаще наблюдается у больных с ожирением и артериальной гипертензией.
Патоморфология: Передняя продольная связка позвоночника имеет внутренний камбиальный слой и для позвоночника является надкостницей, которая при определенных условиях продуцирует костную ткань. Такие условия создаются при отрывах связки от места ее прикрепления, что приводит к характерным изменениям, обозначаемым спондилезом. При болезни Форестье передняя продольная связка также активно продуцирует кость. Этот процесс начинается вблизи межпозвонковых дисков, причем одновременно на нескольких уровнях позвоночного столба. По мере продуцирования кости передняя продольная связка отодвигается от позвоночника, все время непосредственно покрывая позвоночный столб, а, вовсе не отслаиваясь от него, как пишут некоторые авторы. Эти гиперостозные напластования, прочно сросшиеся с телами позвонков, покрывают их спереди и по бокам, лишая их в конце концов всякой подвижности.
•при болезни Форестье в первую очередь поражается грудной отдел, причем больше его средняя часть справа, откуда процесс обычно и начинается, постепенно захватывая другие отделы
•вслед за грудным отделом наиболее часто мощное подсвязочное костеобразование происходит в поясничном отделе, причем больше слева: вблизи межпозвонковых дисков образуются мощные клювообразные разрастания, идущие от тел смежных позвонков навстречу друг другу и огибающие диск (по мнению некоторых авторов после грудного отдела - поражается шейный); иногда их ошибочно расценивают как спондилез (вероятно приводимые в литературе данные о высокой частоте спондилеза объясняются той же ошибкой)
•пока не произошло полного сращения этих скобообразных разрастаний, движения в сегменте сохраняются
Частота фиксирующего гиперостоза с возрастом повышается.
Клинические проявления: характерны жалобы на дискомфорт, скованность, реже на боли в грудном отделе позвоночника. Эти ощущения усиливаются утром после сна, к концу рабочего дня, после физической нагрузки, длительного нахождения в одной позе, на холоде. При распространении процесса на шейный и поясничный отделы позвоночника указанные ощущения могут отмечаться и в этих отделах. У одних больных неприятные ощущения постоянны, у других возникают эпизодически. Степень выраженности их варьирует, но редко бывает значительной.
Нередко, особенно в преклонном возрасте, жалобы полностью отсутствуют. В единичных случаях при очень значительном утолщении передней продольной связки позвоночника может возникнуть сдавление пищевода, что затрудняет прохождение твердой пищи.
Параллелизм между клинической или рентгенологической картиной заболевания отсутствует.
Первые клинические симптомы могут начаться за 10-15 лет до появления характерных рентгенологических изменений.
В то же время, иногда болевой синдром (разной выраженности и характера) нельзя с полной уверенностью отнести к симптомам именно этой патологии, поскольку у пациентов, как правило, имеются и другие дистрофические изменения позвоночника.
Чаще всего больных беспокоят:
•скованность в грудном (реже в шейном и поясничном) отделе позвоночника в утренние и вечерние часы
•иногда дисфагия (вследствие давления шейными остеофитами на пищевод)
•боли в пяточных костях, локтевых суставах и плечевых суставах, реже в области таза
•отмечаются локальные участки болезненности мягких тканей, кальцификация связок надколенника, ахилловых сухожилий, квадрицепсов
Боли обычно кратковременные, но могут принимать стойкий характер.
Количество периферических гиперостозов, выявленных рентгенологически, всегда значительно превышает число болевых зон. Видимо, клиническая симптоматика определяется не самими гиперостозами связок и сухожилий, а эпизодическим развитием реактивного воспаления этих структур в процессе оссификации.
При осмотре больных существенных внешних изменений со стороны опорно-двигательного аппарата не отмечается.
Могут наблюдаться лишь:
1.ограничение движений в грудном теле позвоночника
2.небольшое усиление грудного кифоза
3.болезненность при надавливании на остистые отростки позвонков в этом отделе
В случае значительной выраженности периферических гиперостозов, особенно в локтевых или пяточных областях, их можно пропальпировать. При реактивном воспалении этих структур отмечаются локальная болезненность, иногда припухлость окружающих тканей.
В случае оссификации задней продольной связки позвоночника и сдавления спинного мозга развиваются неврологические нарушения, характерные для шейной миелопатии, вплоть до тетраплегии.
Рентгенологическая картина фиксирующего гиперостоза позвоночника, если рассматривать изменения на уровне одного сегмента, особенно в начале заболевания, ничем не отличается от таковой при спондилезе поскольку в том и в другом случае механизм костеобразования и его локализация одинаковы.
Но причины этих изменений различны:
•при спондилезе костеобразование происходит на одном ограниченном участке, протекает быстро и прекращается
•при болезни Форестье оно начинается сразу на многих участках и длительно, неуклонно нарастает
Причина, вызывающая костеобразовательную функцию передней продольной связки, пока неизвестна.
На ранних этапах заболевания отличить болезнь Форестье от остеохондроза и спондилеза, если рассматривать лишь один сегмент и при анализе снимка в прямой проекции невозможно. Облегчает задачу выявление распространенного процесса при болезни Форестье, для чего иногда необходимо исследовать все отделы позвоночника и необходим просмотр рентгенограмм, произведенных в боковой проекции:
•при остеохондрозе и спондилезе позвоночника отчетливо видно, что оссификации подверглись лишь структуры на уровне межпозвоночных дисков
•для болезни Форестье характерна оссификация передней продольной связки как на уровне межпозвоночных дисков, так и прежде всего на уровне тел позвонков
На поздних этапах болезни имеются обширные и массивные поднадкостничные костные напластования, сплошной полосой покрывающие передние и боковые поверхности тел позвонков, сливающиеся с ними и огибающие межпозвонковые диски. Толщина костных напластований иногда более или менее равномерная, но чаще различается не только на уровне разных сегментов, но и на уровне тел позвонков и дисков и может достигать 1-1,5 см. Высота дисков нормальная или несколько уменьшена, если ее уменьшение произошло до начала гиперостоза. Если гиперостозу предшествовал выраженный остеохондроз, то и его признаки сохраняются: умеренное или значительное уменьшение высоты дисков, краевые костные разрастания по типу остеохондроза, субхондральный остеосклероз. Поверх этих образований - мощные распространенные или сплошные костные напластования. На этом этапе высота дисков уже, конечно, не меняется.
Все анатомические образования на заднем участке позвоночного столба при фиксирующем гиперостозе изменений не претерпевают. Дугоотростчатые, крестцово-подвздошные, реберно-позвоночные суставы не страдают.
На рентгеновских снимках в прямой проекции в выраженных случаях позвоночник окружен по бокам лентовидными образованиями костной плотности с неровными контурами, как бы стекающими вдоль позвоночного столба, выгибаясь на уровне межпозвоночных дисков и соприкасаясь с телами позвонков. Позвоночник на определенных уровнях становится как бы закованным вновь образованной костной тканью (анкилозирующий гиперостоз позвоночника).
Специфика гиперостоза на различных уровня позвоночного столба:
•При вовлечении в процесс шейного отдела костные напластования видны обычно не в виде сплошной полосы, а фрагментарно на уровне от СIII до ТII-ТIII.
•Поражение грудного отдела всегда больше выражено в его средней части и справа.
•Поясничный отдел поражается на всем протяжении, но вначале костеобразование идет в основном в околодисковых зонах, больше слева. Мощные костные разрастания в околодисковых зонах придают позвоночнику характерный вид.
Каких-либо характерных лабораторных изменений, в том числе повышения показателей воспаления, при исследовании крови не находят; довольно часто отмечают гипергликемию.
Дифференциальная диагностика
1. На ранней стадии формирования фиксирующего гиперостоза его необходимо дифференцировать прежде всего от спондилеза, а в случае поражения поясничного отдела такое разделение требуется даже при выраженных формах заболевания. Правильный диагноз помогают установить распространенность поражений при фиксирующем гиперостозе и исследование трудного отдела в сомнительных случаях. Рентгенографию необходимо проводить обязательно в двух проекциях.
2. Начальные формы болезни Форестье необходимо отличать также от болезни Бехтерева (анкилозирующий спондилит).
Для фиксирующего гиперостоза характерно:
•узлы костеобразования вблизи межпозвонковых дисков
•даже в начальных стадиях, отсутствие остеопороза, поражений крестцово-подвздошных и дугоотростчатых суставов, изменений крови и биохимических показателей
•пожилой возраст больных
Болезнь же Бехтерева сопровождается:
•изменением тел позвонков, принимающих прямоугольную форму с заостренными углами
•образованием тонких нежных костных перемычек от позвонка к позвонку через диски
•выраженным остеопорозом позвоночника
•поражением, как правило, крестцово-подвздошных суставов, реже дугоотростчатых
•характерными изменениями крови и биохимических показателей
•возникает преимущественно у лиц молодого возраста
Рентгенологическая картина сформировавшегося выраженного фиксирующего гиперостоза настолько патогномонична, что дифференциальной диагностики не требуется.
Диагноз основывается на данных рентгенографии позвоночника.
Диагноз болезни Форестье считается достоверным, если:
•определяется непрерывное окостенение передней продольной связки на протяжении не менее четырех последовательных сегментов позвоночника вдоль переднелатеральной его части
•при условии отсутствия в этой области признаков остеохондроза, а также рентгенологических признаков сакроилеита.
•при рентгенографии различных отделов периферического скелета выявляются окостенение мест прикрепления сухожилий и связок к костям в виде шпор, бахромы, а иногда оссификация капсул суставов
Стеноз позвоночного канала, остеофиты позвонков и оссификация связок
Стеноз позвоночного канала как самостоятельное заболевание чаще всего рассматривается на поясничном уровне позвоночника. Но встречается стеноз позвоночного канала и на шейном и грудном уровне позвоночника. Стеноз позвоночного канала связан с врожденными или приобретенными анатомическими изменениями в самих позвонках (костные остеофиты), а также в хрящевых и связочных образованиях, формирующих позвоночный канал.
Сужение поперечного сечения позвоночного канала может быть или следствием увеличения в размерах костных образований: дужек, суставных отростков, разрастания задних поверхностей тел позвонков, или в результате расплющивания позвонков и смещения их в просвет позвоночного канала.
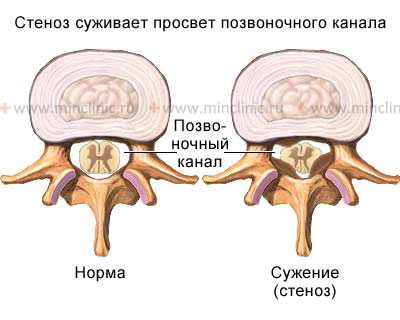
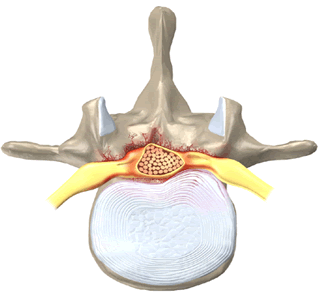
Стеноз (сужение) просвета позвоночного канала со сдавлением спинного мозга с гипертрофией задней продольной и жёлтой связки.
Также к сужению позвоночного канала приводят гипертрофия желтой и задней продольной связок, увеличение толщины суставных капсул межпозвонковых суставов, смещения межпозвонковых дисков и фиброзного кольца, участвующих в формировании позвоночного канала.
Стеноз позвоночного канала может быть равномерным со всех сторон, но чаще встречается сужение позвоночного канала спереди назад. Также стеноз позвоночного канала может наблюдаться на уровне всех или нескольких поясничных позвонков, но встречается и на уровне одного позвонка.
Сужение позвоночного канала в переднезаднем направлении может быть обусловлено его вторичным стенозом, гипертрофией задней продольной и жёлтой связки, спондилолистезом. Для установления стеноза позвоночного канала необходимо измерение канала в сагиттальной плоскости. Абсолютным стенозом принято считать уменьшение диаметра канала до 10 мм и менее. Величина в 10-15 мм соответствует частичному стенозу. Толщина задней продольной связки в норме не должна превышать 2 мм, желтой связки — 3 мм.
Стеноз позвоночного канала со сдавлением спинного мозга при спондилёзе на уровне шейного отдела позвоночника с гипертрофией задней продольной и жёлтой связки.
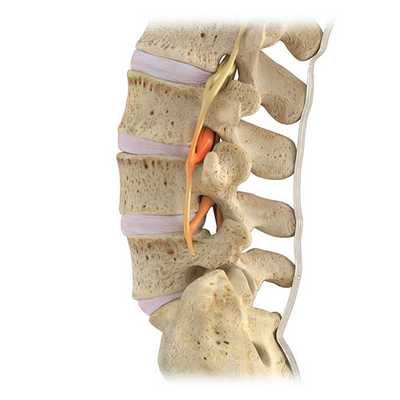
Сдавление L3 спинального нерва в межпозвонковом отверстии при экстрафораминальном стенозе (сужении просвета).
Стеноз позвоночного канала поясничного отдела позвоночника (люмбальный стеноз) — это преходящая хроническая компрессия нервных корешков конского хвоста. Стеноз поясничного отдела позвоночника (люмбальный стеноз) возникает при врожденной узости позвоночного канала на поясничном уровне, которое усиливается в результате протрузии диска и спондилёзе позвоночника.
Физические нагрузки при стенозе провоцирует у больного боли в области ягодиц, бёдер и икр, иррадиирущие по ходу седалищного нерва. Боли при стенозе позвоночного канала уменьшаются у больных в покое. Эти боли напоминают перемежающуюся хромоту сосудистого генеза и требуют консультации сосудистого хирурга для исключения заболеваний артерий нижних конечностей. На усилении болей по сравнению с состоянием покоя определяется снижение глубоких сухожильных рефлексов и чувствительности на ногах, тогда как при исследовании сосудов на УЗИ изменений не обнаруживают. Стеноз позвоночного канала поясничного отдела позвоночника (люмбальный стеноз) и шейный спондилёз часто сочетаются друг с другом у одних и тех же пациентов, что может провоцировать периодические спазмы и подёргивания мышц (фасцикуляции) на ногах при шейном спондилёзе.
Диагностика стеноза позвоночного канала, остеофитов позвоночника и оссификации связок
При диагностике стеноза позвоночного канала на обзорных рентгенограммах позвоночника (спондилограммах) могут быть видны увеличенные в размерах суставные отростки, утолщенные корни дужек, сниженная высота тел позвонков, участки склерозирования связок и остеофиты. На позитивных миелограммах видно равномерное или в виде перетяжек сужение позвоночного канала на нескольких уровнях. В дифференциально-диагностическом плане большое значение имеет получение поперечных срезов на разных уровнях при компьютерной томографии позвоночника на уровне обнаруженного стеноза позвоночного канала.
Компьютерная томография (КТ) позвоночника демонстрирует изменения при стенозе позвоночного канала.
В клинической картине при стенозе позвоночного канала могут наблюдаться монорадикулярные симптомы (при протрузии и грыжах межпозвонковых дисков, при увеличении размеров смежных суставных отростков, что приводит к уменьшению сечения межпозвонкового отверстия), или симптомы компрессионно-ишемической миелорадикулопатии, или даже синдром поперечного поражения спинного мозга.
Стеноз позвоночного канала со сдавлением спинного мозга на уровне поясничного отдела позвоночника с гипертрофией задней продольной и жёлтой связки.
Всё начинается с неврологического и ортопедического осмотра в врача. По её результатам могут быть назначены дополнительно следующие диагностические процедуры:
- пояснично-крестцового отдела позвоночника с функциональными пробами пояснично-крестцового позвоночника пояснично-крестцового отдела позвоночника
Однако основными симптомами истинного стеноза позвоночного канала являются продолжительные боли в поясничном отделе позвоночника без какой-либо «сторонности» и без иррадиации по ходу нервных корешков. Боли в пояснице могут носить постоянный характер и не меняются при перемене положения тела в пространстве (иногда в положении лежа боли даже усиливаются). По мере прогрессирования заболевания присоединяется сглаженность поясничного лордоза, появляется сколиоз, мышечные контрактуры и анталгические деформации позвоночника.
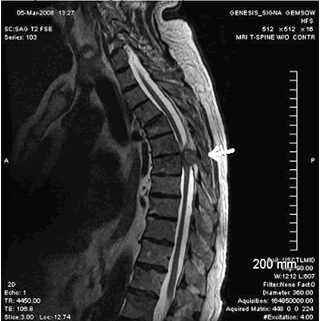
Сужение позвоночного канала со сдавлением спинного мозга на МРТ грудного отдела позвоночника опухолью.
Лечение стеноза позвоночного канала, остеофитов позвоночника и оссификации связок
При лечении стеноза позвоночного канала, в зависимости от тяжести клинических проявлений и причин возникновения стеноза позвоночного канала, у пациента возможны следующие действия, направленные на улучшение состояния больного:
- (НПВС, анальгетики, гормоны) — инъекции препаратов в полость канала (мышечная, суставная и корешковая техника) (УВЧ , СМТ и т.д.)
При определении показаний к операции в случае установления диагноза стеноза позвоночного канала следует учитывать распространенность процесса. При операциях на одном или двух уровнях позвонков и односторонних симптомах компрессии корешков может быть использована интерламинотомия или гемиламинэктомия.
При двусторонних симптомах компрессии нервно-сосудистых образований позвоночного канала и на нескольких уровнях, может быть выполнена двусторонняя гемиламинэктомия с сохранением остистых отростков и межостистой связки, иссекаются гипертрофированная желтая связка, остеофиты. Целесообразно при стенозе позвоночного канала параллельное проведение фораминотомии. В отдельных случаях стеноза позвоночного канала бывает необходимо использование стабилизирующих позвоночник металлоконструкций.
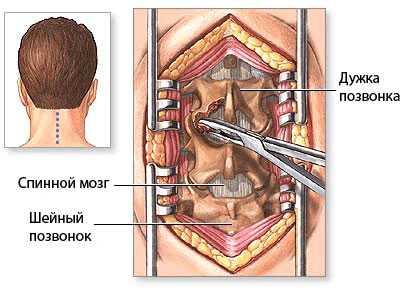
Операция гемиламинэктомия при стенозе позвоночного канала со сдавлением спинного мозга на уровне шейного отдела позвоночника с гипертрофией задней продольной и жёлтой связки.
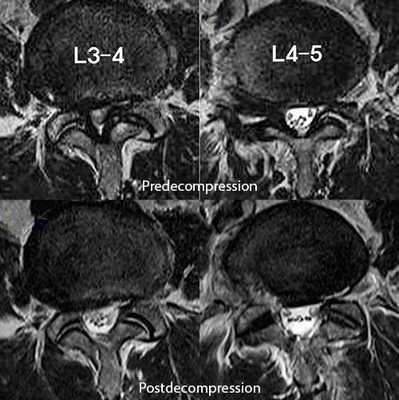
На МРТ поясничного отдела позвоночника показан стеноз позвоночного канала и состояние после операции эндоскопической декомпрессии на уровнях L3-L4 и L4-L5.
Иногда при стенозе позвоночного канала бывает целесообразно разделить операцию на два этапа. На первом этапе выполняется декомпрессия наиболее страдающих корешков спинного мозга, проводится курс интенсивной вазоактивной и нейростимулирующей терапии. И, если не достигнуто улучшение и облегчение состояния больного, можно предложить второй этап операции — более широкую декомпрессию (двустороннюю гемиламинэктомию) и создание дополнительных резервных пространств при стенозе позвоночного канала.
Стенозом поясничного отдела позвоночника страдают примерно 103 миллиона человек во всем мире и 11% пожилых людей в США. Терапией первой линии является модификация активности, обезболивание и физиотерапия. Долгосрочные преимущества эпидуральных инъекций стероидов не установлены. Отдельные пациенты с сохраняющейся болью и ограничением активности могут быть кандидатами на декомпрессивную хирургию.
Читайте также:
