Лучевая диагностика персистирующей первой межсегментарной артерии
Добавил пользователь Валентин П. Обновлено: 01.02.2026
В настоящее время среди всех возможных методов инструментальной и лабораторной оценки субклинических проявлений атеросклероза различных сосудистых бассейнов, особенно у лиц с суммарным риском 5-9 % по шкале SCORE, в стандарт обследования с позиций оценки уровня риска вошли три основных параметра:
1) признаки субклинического поражения сонных артерий (утолщение комплекса интимамедия и наличие бляшек); 2) признаки поражения сосудов нижних конечностей (снижение лодыжечно-плечевого индекса); 3) скорость распространения пульсовой волны, как интегральный показатель повышения сосудистой жесткости. Все эти параметры являются независимыми прогностическими факторами и могут выступать в качестве суррогатной точки в процессе лечения ССЗ и профилактики осложнений. В данном разделе также коротко обсуждается место дисфункции эндотелия в качестве ФР. Данный фактор не вошел пока еще в стандарты стратификации риска, но очевидно будет использоваться в качестве маркера сосудистого повреждения в ближайшем будущем.
Выявление признаков субклинического атеросклероза у лиц с лиц умеренно повышенным суммарным риском, может быть основанием для более агрессивной профилактической тактики.
17.1. Оценка субклинического атеросклероза сонных артерий
17.1.1. Методы оценки
Ультразвуковое исследование сонных артерий сегодня стало основным методом оценки состояния крупных сосудов в эпидемиологических и клинических исследованиях, благодаря тому, что обладает следующими преимуществами:
- неинвазивность;
- количественный анализ и хорошая воспроизводимость [252]
- предоставляет информацию не только о просвете сосуда, но и о состоянии самой стенки.
Стандартный протокол включает измерения на трех уровнях сосудистого русла и билатерально: в проксимальной, медиальной и дистальной точках на протяжении 1 см от бифукации по задней стенке общей сонной артерии (как наиболее отдаленной от датчика). Толщина комплекса интима-медиа (КИМ) определяется как расстояние между первой и второй эхогенной линией лоцируемого сосуда согласно методике Pignoli и Salonen. Первая линия представляет собой границу между стенкой сосуда и его просветом (tunica intima), а вторая - прослойку коллагена по краю адвентиции (tunica adventicia). В дальнейшем рассчитывается средняя толщина КИМ как среднее из всех 12-ти измерений. Воспроизводимость данного индекса достигает 95 %. Используется датчик высокого разрешения (7,5 МГц).
Как в любой ультразвуковой методике, результаты теста в не которой степени субъективны, что делает необходимым условием выполнение исследования одним и тем же специалистом при оценке в динамике.
За повышение толщины КИМ принимают значения более 0,8 и менее 1,3 мм [253]. Локальные утолщения более 1,3 считаются свидетельством присутствия АСБ. В ряде рекомендаций принято считать утолщение КИМ начиная с 0,9 мм.
Помимо этого при данном исследовании возможна оценка диаметра общей сонной артерии в конце систолы и диастолы, что позволяет рассчитать индекс растяжимости артерии по формуле:
Р = СД - ДД/ДД/АДп,
где Р - растяжимость,
СД - систолический диаметр,
ДД - диастолический диаметр,
АДп - пульсовое АД.
17.1.2. Прогностическое значение
Утолщение КИМ является важным прогностическим маркером, о чем свидетельствуют данные Cardiovascular Health Study [254], где у больных с утолщением стенки сонных артерий наблюдался более высокий риск ИБС и МИ. Связь между наличием бессимптомного атеросклеротического поражения сонных артерий у больных АГ и прогнозом изучена лучше и выявлена ассоциация АСБ в каротидных артериях с риском развития ИМ, инсульта и другой сердечно-сосудистой патологии 254. Роттердамское исследование продемонстрировало значение утолщения КИМ сонных артерий как индикатора поражений других сосудов и независимого фактора сердечно-сосудистого риска [252].
17.1.3 Оценка наличия АСБ в сонных артериях
Оценка наличия или отсутствия АСБ в сонной артерии в комбинации с измерением толщины КИМ позволяет точнее диагностировать субклинический атеросклероз, чем только измерение КИМ. Критериями наличия АСБ в сонных артериях является локальное утолщение участка сонной артерии более, чем на 50 % в сравнении с окружающими участками или утолщение участка сонной артерии более, чем 1,5 мм с протрузией его в сторону просвета сосуда.
Учитывая ограниченность применения метода ультразвукового исследования сонных артерий в самой широкой практике измерение толщины КИМ и выявление АСБ в сонных артериях для диагностики доклинического атеросклероза наиболее целесообразно у лиц с промежуточной величиной сердечнососудистого риска (5-9 % по SCORE для стран высокого риска), естественно при отсутствии доказанной ИБС, заболеваний периферических артерий, цереброваскулярной патологии, СД и аневризмы брюшного отдела аорты). Кроме того, измерение КИМ и выявление АСБ целесообразно у пациентов, имеющих родственников первой линии с ранним развитием ССО (мужчины до 55 лет и женщины до 65 лет), лицам младше 60 лет хотя бы и с одним, но резко выраженным Ф Р, а также мужчинам старше 40 лет и женщинам старше 50 лет, имеющих хотя бы 2 ФР ССЗ (особенно при наличии ожирения и/или АГ). Тест показан, если степень агрессивности терапии не ясна и требуется дополнительная информация о наличии субклинического атеросклероза или величине сердечно-сосудистого риска. Проведение теста для определения величины риска не целесообразно, если уже имеет место доказанный атеросклероз или если результаты исследования не повлияют на проводимую терапию.
На рисунке 5 представлено сравнение величин относительного риска развития осложнений ИБС у людей, не имеющих жалоб в течение 2-х летнего наблюдения в зависимости от результатов физикального и инструментального обследования. Наибольшей прогностической значимостью обладают положительный результат стресс-теста (ОР=3,7) и наличие стенотического шума на бедренных артериях (ОР=3,05). Наличие АСБ в сонных артериях занимает третью позицию (ОР=2,81), превосходя такой признак, как наличие АСБ в бедренных артериях (ОР=2,39) и утолщение КИМ сонных артерий более 0,63 мм (ОР=2,26).
Рис 5. Относительный риск развития осложнений ИБС у людей, не имеющих жалоб в течение 2-х летнего наблюдения в зависимости от результатов физикального и инструментального обследования [255].
17.2. Оценка жесткости сосудов как маркер риска
Жесткость сосудистой стенки - свойство, зависящее от количества эластических элементов в сосудистой стенке. Обратным понятием жесткости является термин податливости сосудистой стенки, характеризующий способность сосуда к увеличению объема в ответ на повышение АД. Золотой стандарт измерения жесткости - оценка скорости распространения пульсовой волны (СРПВ). В отличие от СРПВ, индекс аугментации (ИА) и центральное давление являются косвенными маркерами повышения сосудистой жесткости. Однако они дают дополнительную информацию об отраженной волне. ИА представляет собой отношение отраженной волны от нижней части аорты и артериолярного дерева и первоначальной волны, генерируемой сердцем в самом начале аорты. ИА зависит не только от сосудистой жесткости, но и от ЧСС, АД, самой отраженной волны, роста испытуемого, а также процесса сопряжения между деятельностью ЛЖ и сосудов. В связи с этим ИА нельзя считать специфическим методом оценки сосудистой жесткости, так как он отражает более сложную функцию сосудов [264].
17.2.2. Методы оценки
Все неинвазивные методы оценки сосудистой жесткости являются косвенными и оценивают некоторые суррогатные параметры, которые определяются жесткостью. Они включают три основных метода - СРПВ, анализ формы пульсовой волны на крупных артериях, а также прямое измерение взаимоотношений давления и диаметра сосуда.
В клинике в основном используется два подхода, которые являются доступными и могут быть выполнены вне специализированной лаборатории:
- СРПВ;
- анализ пульсовой волны центральных сосудов (сонных артерий, аорты или лучевой и других артерий с применением передаточной функции).
СРПВ представляет собой региональный показатель сосудистой жесткости. Этот параметр зависит от эластического модуля стенки артерии, ее геометрии (радиус и толщина стенки), а также плотности крови и уровня давления. Измерение включает оценку времени прохода пульсовой волны по анализируемому сегменту сосуда и расстояния между точками регистрации пульсовой волны. Метод считается золотым стандартом оценки сосудистой жесткости, так как имеет высокую прогностическую ценность как индикатор поражения органов-мишеней. Показатель СРПВ входит в официальный перечень рекомендуемых обследований больного с АГ для оценки степени риска, технически прост и объективен.
СРПВ более 12 м/с считается патологической и свидетельствует о существенном поражении сосудистой стенки.
Существует достаточно простой методический подход оценки жесткости артерий по расстоянию от зубца Q на ЭКГ и исчезновению тонов Короткова. Подобная функция встроена в некоторые приборы для суточного мониторирования АД и дает информацию, приближенную к показателю СРВП (Novacor). Метод может использоваться в эпидемиологических исследованиях. Его преимуществом является полная независимость результата от исследователя.
Методы регистрации пульсовой волны основаны на так называемой аппланационной тонометрии (Sphigmacor). Эта методика основана на представлении о том, что при сдавлении сосуда трансмуральное давление равно внутрисосудистому. Датчик располагают на поверхностно лежащем сосуде (например, на лучевой артерии) и сдавливают сосуд (не слишком сильно, чтобы не нарушить гемодинамику). Важно иметь твердую основу под сосудом (костные образования), что хорошо достигается при лоцировании лучевой или бедренной артерии. Труднее это выполнить в отношении плечевой артерии, которая располагается между сухожилиями, или для сонной артерии, под которой имеется жировая ткань (но считается возможным). Оптимальным местом регистрации с точки зрения физиологии является сонная артерия, которая ближе всего к аорте, но даже для сонных артерий справедлив феномен амплификации и расчет центрального АД требует поправки.
ИА рассчитывается по записи кривой давления на сонной артерии как отношение отраженной волны (давления аугментации) к пульсовому АД. В большинстве современных систем это делается автоматически путем компьютерного анализа. При наличии современного оборудования (Sphigmacor и др.) оценка индекса аугментации и центрального АД является достаточно простой методикой, требующей минимальных навыков.
17.2.3. Жесткость сосудов как ФР
Метаанализ 11 исследований свидетельствует о том, что простое измерение СРПВ между сонной и бедренной артериями обладает независимым от традиционных ФР прогностическим значением [264].
17.3. Оценка субклинического атеросклероза сосудов нижних конечностей
Лодыжечно-плечевой индекс (ЛПИ) является достаточно простым методом раннего выявления облитерирующего атеросклероза сосудов нижних конечностей, который также дает возможность оценки тяжести этого поражения. Определение ЛПИ осуществляется путем измерения уровня САД при допплерографии плечевой, заднеберцовой артерий и тыльной артерии стопы. Наиболее высокий уровень САД на одной из четырех артерий стопы должен быть разделен на максимальное САД, измеренное на плечевых артериях. Полученная величина и является значением ЛПИ.
ЛПИ = САД на лодыжке/САД на плече
(например, САД на лодыжке равно 140 мм рт.ст., а на плечевой артерии - 110 мм рт.ст., следовательно, ЛПИ = 140/110 = 1,27)
Величина ЛПИ от 1,0 до 1,3 считается нормальной.
ЛПИ>1,3 указывает на кальцинированность артерии нижних конечностей (артерия плохо поддается компрессии). Это характерно, в частности, для больных СД с явлениями медиакальциноза Менкеберга. В ряде случаев у этих пациентов медиакальциноз делает невозможным пережатие артерии и измерение ЛПИ.
ЛПИ (подтверждаемом ангиографией), при этом, как правило, имеется стенозирование одного или нескольких сосудов более чем на 50 %. ЛПИ от 0,4 до 0,9 наблюдается при такой степени обструкции кровотока, которая уже имеет клинические проявления в виде перемежающейся хромоты.
ЛПИ менее 0,4 свидетельствует о тяжелой ишемии конечности.
Снижение ЛПИ является ФР ИБС, инсульта, тран-зиторных ишемических атак, почечной недостаточности и общей смертности [265]. Именно поэтому поражение артерий нижних конечностей в настоящее время рассматривается как эквивалент ИБС и требует агрессивного подхода к лечению. Выявление бессимптомного облитерирующего атеросклероза сосудов нижних конечностей важно с точки зрения ассоциации с проявлениями атеросклероза в других сосудистых бассейнах. Так, при наличии атеросклероза сосудов нижних конечностей не менее половины пациентов имеют, как минимум, 50 % стеноз одной из почечных артерий [266]. В связи с этим очевидна необходимость оценки ЛПИ у лиц с подозрением на реноваскулярную гипертензию.
17.4. Дисфункция эндотелия
Еще один параметр, который рассматривался в качестве маркера доклинического атеросклероза, эндотелиальная дисфункция (ЭД) 267. Под ЭД понимают сниженную способность эндотелия вырабатывать релаксирующие факторы и сдвиг к преимущественной выработке медиаторов сокращения. ЭД является пусковым звеном атеросклероза и других ССЗ. Прижизненная оценка функции эндотелия сопряжена с большими техническими трудностями, а также с обилием факторов, учесть которые чрезвычайно сложно. Поэтому ЭД до сих пор не стала общепризнанным маркером риска и не вошла в стандарт оценки маркеров атеросклероза. Необходима дальнейшая работа для того, чтобы оценка ЭД стала доступным и надежным инструментом раннего выявления атеросклероза.
17.5. Коронарный кальций
Кальцификация коронарных артерий является неотъемлемой частью атеросклеротического процесса. Включения кальция обнаруживаются практически исключительно в пораженных атеросклерозом артериях и не встречаются в интактных сосудах [272, 273]. Небольшое количество коронарного кальция можно обнаружить уже на ранних стадиях атеросклеротического процесса, однако он наиболее характерен для сформировавшихся бляшек. Несмотря на то, что отмечается положительная корреляция между количеством коронарного кальция и степенью сужения просвета артерии, эта зависимость носит нелинейный характер [274]. Вследствие процесса ремоделирования артериальной стенки кальций не концентрируется исключительно в области значимого стенозирования [275]. На данный момент нет данных о взаимосвязи между кальцификацией коронарных артерий и вероятностью ее разрыва [276].
В настоящее время основными методами оценки коронарного кальция являются электронно-лучевая компьютерная томография (ЭЛКТ) и МСКТ. Методика его количественного подсчета основана на коэффициенте ослабления рентгеновского излучения, который выражается в единицах Хаунсфилда. На основании значения полученного в результате индекса кальцификации коронарных артерий (индекса Агатстона) пациенты могут быть разделены на следующие группы: менее 10 (соответствует минимальной кальцификации коронарных артерий), 11-99 (умеренная кальцификация), 100-400 (повышенная кальцификация) и более 400 (распространенная кальцификация) [277]. Значения индекса Агатстона менее 100 ассоциируются с низкой (менее 3 %) вероятностью выявления значимого стенозирования коронарных артерий при ангиографии. Чувствительность коронарного кальция в отношении гемодинамически значимого атеросклероза очень высока (95-98 %), однако специфичность этой методики значительно ниже 280. Основными показаниями к определению коронарного кальция в настоящее время являются необходимость исключения ИБС у пациентов с не вполне типичным болевым синдромом в грудной клетке и уточнение риска ССЗ у пациентов с промежуточным суммарным риском. Несмотря на наличие информации о том, что коронарный кальций может иметь большую информативность, чем расчет суммарного риска с помощью стандартных калькуляторов, особенно у женщин, современные рекомендации [282] не поддерживают дополнительного определения коронарного кальция в группах с низким и высоким суммарным риском.
Лучевая диагностика персистирующей первой межсегментарной артерии
На основания изучения данных современной литературы уточнены основные этапы развития сосудов головного мозга в антенатальном периоде развития. Систематизированы имеющиеся сведения об аномалиях развития сосудов мозга (аномалия Киммерле, персистирующая тригеминальная артерия, фенестрация, аплазия и гипоплазия мозговых артерий, артериовенозные мальформации), совмещены с собственными данными СКТ ангиографии сосудов мозга. Мультиспиральная компьютерно-томографическая ангиография является необходимой для исследования сосудов большого мозга. Сравнение результатов исследования с нормальной анатомией сосудов головного мозга увеличит диагностическую и лечебную эффективность, позволит отличить варианты, мимикрирующие патологию, и те аномалии, которые нуждаются в оперативном хирургическом вмешательстве. А знание развития сосудов головного мозга способствует пониманию многих анатомических фактов и решению тяжелых клинических случаев.
1. Горбунов А.В. Классификация вариантов артерий и вариантов артериального круга большого мозга человека / А.В.Горбунов // Вестник Тамбовского университета. Серия: Естественные и технические науки.- 2013.- Т. 18, В. 1.- С.277-279.
2. Каплунова О.А., Фишман А.Ю., Пивоварова В.В. Морфогенез синусов твердой оболочки головного мозга. Журнал фундаментальной медицины и биологии, 2016, №2.-С.16-22.
4. Николенко В.Н. Морфобиомеханические закономерности строения средней мозговой артерии взрослых людей / В.Н. Николенко, О.А. Фомкина, Ю.А. Неклюдов, Ю.Д. Алексеев // Саратовский научно-медицинский журнал. - 2012.- Т 8, № 1. - С.9-14.
5. Фомкина О.А. Морфобиомеханические особенности задней соединительной артерии взрослых людей / О.А. Фомкина, В.Н. Николенко, Ю.А.Гладилин // Морфология.- 2010. -Т. 136, № 4. - С.202.
6. Труфанов Г.Е. Лучевая диагностика сосудистых мальформаций и артериальных аневризм головного мозга / Г.Е. Труфанов, Т.Е. Рамешвили, В.А. Фокин, Д.В. Свистов. СПб.: «ЭЛБИ СПб». 2005. 224 с.
7. Чаплыгина Е.В. Развитие, аномалии развития и варианты артерий головного мозга / Е.В.Чаплыгина, О.А.Каплунова, В.И. Домбровский, О.П. Суханова, И.М.Блинов, Л.И.Чистолинова // Журнал анатомии и гистопатологии, 2015.-Т.4, №2 (14).-С 52-59.
8. Чаплыгина Е.В., Каплунова О.А., Домбровский В.И., Суханова О.П., Блинов И.М. Персистирующая тригеминальная артерия. Фундаментальные исследования № 1 (часть 8) 2015, стр. 1730-1734.
9. Чаплыгина Е.В., Каплунова О.А., Домбровский В.И., Суханова О.П., Блинов И.М., Фишман А.Ю., Муканян С.С. Морфофункциональная характеристика аномалии Киммерле. Морфология, 2015, Т.147, №3, С.27-31.
10. Conway E.M. Molecular mechanisms of blood vessel growth / E.M. Conway, D. Collen, P.Carmeliet // Cardiovascular Res.- 2001.- V. 49. -P. 507-521.
11. Eichmann A. Vascular development: from precursor cells to branched arterial and venous networks / A. Eichmann, L. Yuan, D. Moyon F. Lenoble, L. Pardanaud, C. Breant // Int. J. Dev. Biol. 2005. V. 49. P. 259-267.
14. Niederberger E. Anatomic variants of the anterior part of the cerebral arterial circle at multidetector computed tomography angiography / E.Niederberger, J.-Y.Gauvrit, X.Morandi, B.Carsin-Nicol, T.Gauthier, J.-C. Ferre // J. of Neuroradiology. -2010. -V.37. -P. 139-147.
15. Padget D.N. The development of the cranial arteries in the human embryo / D.N. Padget // Contrib. Embryol. -1948. -V. 32. -P. 205-261.
16. Raybaud C. Normal and abnormal embryology and development of the intracranial vascular system / C. Raybaud // Neusurg. Clin. N. Am. -2010. -V. 21, N. 3. P. -399-426.
Врожденные сосудистые аномалии мозга: аплазия или гипоплазия нормальных сосудов, сосуды с ненормальной морфологией - результат раннего нарушения развития сосудов мозга. Некоторые из них компенсированы и клинически бессимптомны. Другие являются причиной заболеваний и смерти в результате кровоизлияний или ишемии [13]. Несмотря на большое количество работ, посвященных возрастной, половой, билатеральной изменчивости мозговых артерий [1, 4, 5], работы, касающиеся развития [10, 11, 15, 16] и аномалий развития сосудов головного мозга, - единичные [2, 3, 7, 8, 14].
Аномалия Киммерле - наиболее часто встречающаяся аномалия развития краниовертебральной зоны - костная перемычка над бороздой позвоночной артерии атланта, встречается у 12-16% людей [9, 12], является одним из факторов риска нарушения мозгового кровообращения, особенно при сочетании с другими аномалиями черепа, головного мозга или мозговых сосудов.
Цель исследования - на основания изучения данных литературы уточнить основные этапы развития сосудов головного мозга, возможные механизмы образования их аномалий и проиллюстрировать СКТ-ангиограммами из архива кафедры лучевой диагностики ФПК и ППС РостГМУ. СКТ-ангиография была выполнена на мультисрезовом спиральном рентгеновском компьютерном томографе «Brilliance 64 Slice» («Philips Medical Systems», Нидерданды) у 650 пациентов в возрасте от 14 до 70 лет.
Материалы и методы исследования. Проанализированы спиральные компьютерные ангиотомограммы, выполненные на мультисрезовом спиральном рентгеновском компьютерном томографе «Brilliance 64 Slice» («Philips Medical Systems», Нидерданды) у 650 пациентов в возрасте от 14 до 70 лет.
Результаты исследования и их обсуждение. При анализе СКТ-ангиограмм у 91 обследованного была выявлена аномалия Киммерле (14% случаев) с одной или с двух сторон, при этом костный канал для позвоночной артерии может быть частично или полностью замкнутым (рис.1).
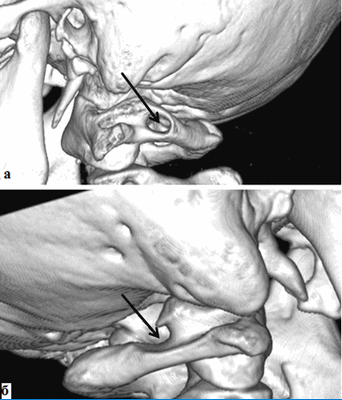
Рис. 1. Спиральная компьютерная томограмма шейного отдела позвоночного столба, а - вид слева, б - вид справа (SSD изображение оттененных поверхностей). Аномалия Киммерле. Костный канал для позвоночной артерии полностью замкнутый - (а) и частично замкнутый (б).
При проведении спиральной компьютерной ангиографии нами была обнаружена персистирующая тригеминальная артерия (рис.2) у 4 пациентов (0,6 % случаев).
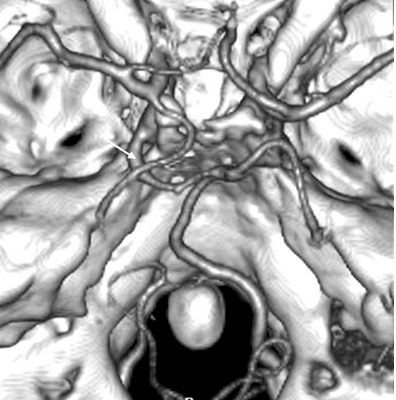
Рис. 2. СКТ ангиограмма сосудов основания мозга, вид сверху (ISSD - изображение оттененных поверхностей). Примитивная тригеминальная артерия слева (показана стрелкой). Задняя трифуркация левой внутренней сонной артерии. Гипоплазия левой позвоночной артерии.
Ангиогенез артерий мозга начинается из поверхностной лептоменингеальной сети. Многие артерии мозга образуются в результате слияния элементов сосудистой сети. Нарушение этого процесса может быть причиной фенестрации, которая характеризуется частичными просветами между 2 отчетливыми, параллельными артериями, покрытыми эндотелием. Аномалия бессимптомна, но подобно артериальным бифуркациям, склонна к образованию аневризм [13].
При выполнении СКТ ангиографии фенестрация мозговых артерий нами была выявлена в 0,03% случаев.
В процессе развития артерий головного мозга из переднего сосудистого сплетения появляются три передние мозговые артерии. Третья артерия следует курсом двух передних мозговых артерий и известна как срединная артерия мозолистого тела. Срединная артерия мозолистого тела и переднее сосудистое сплетение далее регрессируют [15]. Такая аномалия развития как добавочная передняя мозговая артерия является персистирующей срединной артерией мозолистого тела.
На 29-й день эмбриогенеза каудальная часть внутренней сонной артерии соединяется с билатеральной продольной мозговой артерией, образуя заднюю соединительную артерию. Продольные мозговые артерии начинают в краниокаудальном направлении сливаться, формируя примитивную базилярную артерию, а на 32 день позвоночные артерии начинают формировать продольный анастомоз между шейными межсегментарными артериями [15].
«Классическое» строение Виллизиева круга встречается часто, но существует большое количество вариантов его строения [1, 4, 5, 7]. Основные аномалии мозговых артерий: аплазия, гипоплазия. Наиболее часто встречаются варианты нетипичного ответвления артерий, с асимметрией диаметров и разомкнутый круг. Возможны и разнообразные сочетания вариантов и аномалий развития артерий большого мозга.
По данным Горбунова А.В. [1], большинство часто встречающихся аномалий базилярной артерии следующие: девиация (4,5% случаев), изгиб (0,6% случаев), извитость (1,9% случаев), удвоение при неслиянии (1,9% случаев), возможны и их сочетании. Нарушение соединения базилярных артерий может проявляться фенестрациями [7].
Наиболее часто встречающиеся аномалии внутричерепного отдела позвоночной артерии по данным Горбунова А.В. [1]: гипоплазия (10,9% случаев), избыточная извитость (0,6% случаев), S-образная позвоночная артерия (0,6% случаев), возможны и их сочетания.
Ангиогенез вен мозга, также как и артерий, начинается из поверхностной лептоменингеальной сети. Развитие сосуда в артерию, вену или в капилляр зависит от направления кровотока. Экспериментально доказана большая роль сигнальных молекул в артериовенозной дифференцировке и развитии архитектоники внутримозговых сосудов [11].
Артериовенозные мальформации головного мозга - наиболее часто встречающиеся сосудистые аномалии. Образование АВМ объясняют недостаточностью развития капиллярного участка кровеносной системы [6].
Типичные артериовенозные мальформации представлены тремя основными компонентами: приносящими артериями, клубком измененных сосудов мальформации и дренирующими венами [3, 6]. Артериовенозные мальформации представляют собой неправильное соединение артериальных и венозных сосудов, формирующих клубок, минуя капиллярную сеть (рис.3).
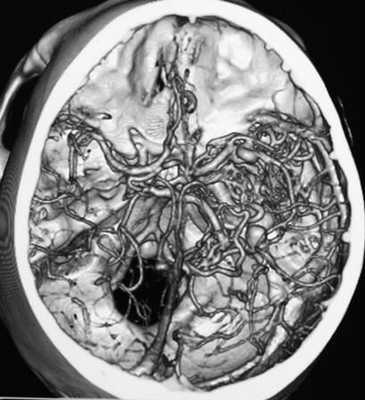
Рис. 3. СКТ ангиограмма сосудов мозга, вид сверху (SSD - изображение оттененных поверхностей). Артериовенозная мальформация в правой височной доле мозга. Питание АВМ осуществляется из бассейна правой средней мозговой мозговой артерии, оболочечных артерий и правой задней мозговой артерии; сброс крови - через множественные расширенные оболочечные вены.
На основания анализа данных литературы и собственных данных спиральной компьютерной ангиографии сосудов мозга установлено, что чаще встречаются артериовенозные мальформации глубинно расположенные в полушариях большого мозга, преимущественно в лобных, теменных, реже - в височных долях. Артериовенозные мальформации имеют форму пирамид, с основанием, расположенным параллельно поверхности коры, и вершиной, направленной к желудочку.
Мультиспиральная компьютерно-томографическая ангиография является необходимой для исследования сосудов большого мозга. Сравнение результатов исследования с нормальной анатомией сосудов головного мозга увеличит диагностическую эффективность, позволит отличить варианты, мимикрирующие патологию, и те аномалии, которые нуждаются в хирургическом вмешательстве. А знание развития сосудов мозга способствует пониманию многих анатомических фактов.
Чаплыгина Е.В. 1 Каплунова О.А. 1 Домбровский В.И. 1 Суханова О.П. 1 Блинов И.М. 1 Чистолинова Л.И. 1
На основании данных литературы уточнены основные этапы развития артерий головного мозга в антенатальном периоде развития, консолидации недифференцированной сосудистой сети в постоянные артерии. Уточнены этапы образования и регрессии кортикобазилярных анастомозов, а также возможные механизмы образования наиболее часто встречающегося персистирующего кортикобазилярного анастомоза - тригеминальной артерии. Приведены данные литературы о клиническом значении этой аномалии и сочетании её с другими аномалиями развития артерий головного мозга. Очевидно, что персистирующая тригеминальная артерия подобно большинству других аномалий развития мозговых артерий биологически менее надежна и подвержена заболеваниям. Неслучайно они часто ассоциируют друг с другом. Сведения о персистирующей тригеминальной артерии совмещены с собственными данными СКТ ангиографии артерий мозга.
2. Куртусунов Б.Т. Варианты изгибов позвоночных артерий по данным мультиспиральной компьютерной томографии // Саратовский научно-медицинский журнал. - 2010. - Т. 6, № 3. - С. 498-500.
3. Николенко В.Н., Фомкина О.А., Неклюдов Ю.А., Алексеев Ю.Д. Морфобиомеханические закономерности строения средней мозговой артерии взрослых людей // Саратовский научно-медицинский журнал. - 2012. - Т 8, № 1. - С. 9-14.
5. Фомкина О.А., Николенко В.Н., Гладилин Ю.А. Морфобиомеханические особенности задней соединительной артерии взрослых людей // Морфология. - 2010. - Т. 136, № 4. - С. 202.
6. Bai M., Guo Q., Li S. Persistent trigeminal artery/persistent trigeminal artery variant and coexisting variants of the head and neck vessels diagnosed using 3 T MRA - Clin. Radiol. - 2013. - № 68. -P. 578-585.
7. Bai M., Guo Q., Sun Y. Rare saccular aneurysm in a medial type persistent trigeminal artery trunk and literature review // Surg. Radiol. Anat. - 2014. - Vol. 36, № 3. - P. 299-302.
8. Choudri O., Heit J.J., Feroze A.H., Chang S.D., Dodd R.L., Steinberg G.K. Persistent trigeminal artery supply to an intrinsic trigeminal nerve arteriovenous malformation: A rare cause of trigeminal neuralgia // J. of Clin. Neuroscience. - 2015. - Vol. 22. - P. 409-412.
9. Cloft H.J., Razack N., Kallmes D.F. Prevalence of cerebral aneurysms in patients with persistent primitive trigeminal artery // J. Neurosurg. - 1999. - № 90. - P. 856-857.
10. Fields W.S. The significance of the persistent trigeminal artery: carotid-basilar anastomosis // Radiology. - 1968. - № 91. - P. 1096.
11. Gaughen J.R., Starke R.M., Durst C.R., Evans A.J., Jensen M.E. Persistent trigeminal artery: In situ thrombosis and associated perforating vessel infarction // J. of Clin. Neuroscience. - 2014. - № 21. - P. 1075-1077.
12. Ito Y., Watanabe H., Niwa H., Hakusui S., Ando T., Yasuda T. The protective effect of a persistent trigeminal artery on brainstem infarctions: a follow-up case-report // Int. Med. - 1998. - № 37. - P. 334-337.
13. Kathuria S., Chen J., Gregg L., Parmar Y.A., Gandhi D. Congenital arterial and venous anomalies of the brain and skull Base // Neuroimag. Clin. N. Am. - 2011. - Vol. 21. - P. 545-562.
14. Kim M.J., Kim M.S. Persistent primitive trigeminal artery: analysis of anatomical characteristics and clinical significances // Surg. Radiol. Anat. - 2015. - Vol. 37, № 1. - P. 69-74.
15. Ladner T.R., Ehtesham M., Davis B.J., Khan I.S., Ghiassi M., Singer R.J. Resolution of trigeminal neuralgia by coil embolization of a persistent primitive trigeminal artery aneurysm // J. Neurointerv. Surg. - 2014. - Vol. 6, № 3. - P. 22.
16. Lotfi M., Nabavizadeh S.A., Foroughi A.A. Aortic arch vessel anomalies associated with persistent trigeminal artery // Clin. Imaging. - 2012. - Vol. 36. - P. 218-220.
17. Luh G.Y., Bruce L., Tomsick T.A., Wallace R. The persistence of fetal carotid-vertebrobasilar anastomosis // Am. J. Radiol. - 1999. - Vol. 172. - P. 1427-1432.
18. Meckel S., Spittau B., McAuliffe W. The persistent trigeminal artery: development, imaging anatomy, variants and associated vascular pathologies // Neuroradiology. - 2013. - Vol. 55, № 1. - P. 5-16.
19. O’uchi E., O’uchi T. Persistent primitive trigeminal arteries (PTA) and its variant (PTAV): analysis of 103 cases detected in 16,415 cases of MRA over 3 years // Neuroradiology. - 2010. - Vol. 52, № 12. - P. 1111-1119.
20. Padget D.N. Designation of the embryonic intersegmental arteries in reference to the vertebral artery and subclavian stem // Anat. Rec. - 1954. - Vol. 119. - P. 349-356.
21. Padget D.N. The development of the cranial arteries in the human embryo. Contrib. Embryol // 1948. - Vol. 32. - P. 205-261.
22. Raybaud C. Normal and abnormal embryology and development of the intracranial vascular system // Neusurg. Clin. N. Am. - 2010. - Vol. 21, № 3. - P. 399-426.
23. Salas E., Ziyal I.M., Sekhar L.N., Wright D.C. Persistent trigeminal artery: an anatomic study // Neurosurgery. - 1998. - Vol. 43. - P. 557-562.
24. Saltzman G.F. Patent primitive trigeminal artery by cerebral angiography // Acta Radiol. - 1959. - Vol. 51. - P. 329-336.
25. Son B., Yang S., Sung J. et al. Bilateral persistent primitive trigeminal arteries associated with trigeminal neuralgia // Clin. Neuroradiol. - 2013. - Vol. 23. - P. 45-49.
26. Suttner N., Mura J., Tedeschi H., Ferreira M.A.T, Wen H.T., Oliviera E.D., Rhoton A.L. Persistent trigeminal artery: a unique anatomic specimen analysis and therapeutic implications // Neurosurgery. - 2000. - Vol. 47, № 2. - P. 428-434.
27. Teal J.S., Rumbaugh C.L., Bergeron R.T., Scanlan R.L., Segall H.D. Persistent carotid-superior cerebellar artery anastomosis: a variant of persistent trigeminal artery // Radiology. - 1972. - P. 335-341.
28. Uchino A., Saito N., Okada Y., Kozawa E., Mizukoshi W., Inoue K., Takahashi M. persistent trigeminal artery and its variants on MR angiography // Surg. Radiol. Anant. - 2012. - Vol. 34, № 3. - P. 271-276.
29. Uhlig S., Kurzepa J., Czekajska-Chehab E., Staskiewicz G., Polar M.K., Nastaj M., Stochmal E., Drop A. Persistent trigeminal artery as a rare cause of ischaemic lesion and migraine-like headache // Folia Morphol. (Warsz) - 2015. - Vol. 74, № 1. - P. 133-136.
Врожденные сосудистые аномалии мозга, в том числе персистирующая тригеминальная артерия - результат раннего нарушения развития сосудов мозга. Некоторые из аномалий сосудов головного мозга компенсированы и клинически бессимптомны. Другие являются причиной заболеваний и смерти в результате кровоизлияний или ишемии [13]. Необходимость в детальных знаниях аномалий развития сосудов мозга диктуется внедрением новых хирургических технологий - малоинвазивных и эндоскопических методов, что ставит перед исследователями все новые и новые задачи. С другой стороны, у анатомов появились беспрецедентные возможности для расширения представлений о вариантах и аномалиях сосудов мозга.
И, наконец, несмотря на большое количество работ, посвященных возрастной, половой, билатеральной изменчивости мозговых артерий [2, 3, 5], работы, касающиеся развития артерий головного мозга, - единичные и в основном датируются серединой прошлого века.
Цель работы - на основании данных литературы уточнить основные этапы развития артерий головного мозга, возможные механизмы образования персистирующей тригеминальной артерии и проиллюстрировать данными, полученными самостоятельно при выполнении ангиографии на мультисрезовом спиральном рентгеновском компьютерном томографе «Brilliance 64 Slice» («Philips Medical Systems», Нидерланды) у 650 пациентов в возрасте от 14 до 70 лет.
Известны основные принципы развития магистральных артерий головы [4]. Внутренние сонные артерии развиваются из 3-жаберной артерии и дорзальной аорты.
Из дорсальных аорт образуются межсегментарные артерии, которые в области шеи соединяются анастомозами. Эти продольные сосуды (билатеральные продольные мозговые артерии) располагаются параллельно дорзальной аорте и становятся позвоночными артериями. Позвоночные артерии растут в краниальном направлении до уровня продолговатого мозга, затем отклоняются медиально, соединяясь друг с другом и образуя базилярную артерию. Базилярная артерия, продолжая расти краниально, встречается с веточками внутренних сонных артерий [4].
На 2-4 неделе эмбрионального периода развития медуллярная пластинка, медуллярная бороздка и открытая нервная трубка получают питание диффузно из амниотической жидкости [1, 22]. На 5-8 неделе нервная трубка сформирована, покрыта первичной оболочкой, содержащей сосудистые петли, соединенные с дорзальной аортой и кардинальными венами. Из первичной сосудистой сети мозга кислород и питательные вещества поступают в мозг.
Padget D.N. [20, 21] изучала развитие мозговых артерий, используя метод графической реконструкции 22 срезов эмбрионов от 24 до 52 дней (4-43 мм длиной). Согласно её данным, эмбриогенез переднего отдела артериального круга большого мозга является результатом двух важных процессов: развития от краниальной порции внутренней сонной артерии ветвей, снабжающих переднюю часть мозга, и регрессии отдельных артериальных сегментов. Ею были выявлены 7 стадий в развитии артерий мозга.
На 28-29 день у эмбриона 4-5 мм длиной сонные артерии снабжают передний и средний мозг. Ромбовидный мозг снабжается через транзитные каротидно-базилярные анастомозы: тригеминальную артерию на уровне тройничного узла, ушную артерию на уровне ушного пузырька, подъязычную артерию вдоль подъязычного нерва и проатлантовую артерию (первую межсегментарную шейную - C1 артерию) по ходу первого шейного нерва. Эти артерии существуют короткое время, пока не исчезнут к 3 стадии [20, 26]. Редко они могут персистировать и функционировать как анатомические варианты или мальформации в клинических случаях (рис. 1).
На 29-й день эмбриогенеза у эмбриона 5-6 мм длиной каудальная часть внутренней сонной артерии соединяется с билатеральной продольной мозговой артерией, образуя заднюю соединительную артерию. Тригеминальная артерия истончается у своего начала от сонной артерии, как и подъязычная артерия. Продольная мозговая артерия направляется к началу вдоль среднего мозга, формируя базилярную артерию. На этой стадии проатлантовая артерия участвует в кровоснабжении заднего отдела мозга.
На 32 день у эмбриона 7-12 мм длиной от передней мозговой артерии ответвляется средняя мозговая артерия. Тригеминальная артерия может еще быть на этой стадии, но чаще уже исчезает [20]. Позвоночная артерия формируется как продольный паравертебральный анастомоз между межсегментарными шейными артериями от С7 до С1 [20, 21, 26].
Рис. 1. Схема персистирующих каротидно-базилярных анастомозов (по S. Kathuria e.a., 2011, с изменениями) [5]: 1 - внутренняя сонная артерия; 2 - базилярная артерия; 3 - задняя соединительная артерия; 4 - тригеминальная артерия; 5 - ушная артерия; 6 - подъязычная артерия; 7 - проатлантовая артерия
Тригеминальная артерия проходит вентромедиально от тройничного узла, кровоснабжает развивающийся ствол мозга до момента образования задней соединительной артерии и позвоночной артерии (рис. 2), после чего регрессирует [20, 23].
Обычно персистирующую тригеминальную артерию обнаруживают во взрослом возрасте в 0,1-0,68 % случаев у пациентов при ангиографическом исследовании [6, 18, 19, 28]. Персистирующая тригеминальная артерия соединяет кавернозный сегмент внутренней сонной артерии и базилярную артерию проксимальнее места ответвления задней соединительной артерии и кровоснабжает дистальный отдел вертебробазилярной системы и проксимальные отделы гипоплазированной базилярной артерии.

Рис. 2. СКТ ангиограмма сосудов основания мозга, вид сверху (ISSD - изображение оттененных поверхностей). Пациентка с невралгией тройничного нерва. Примитивная тригеминальная артерия слева (показана звёздочкой). Задняя трифуркация левой внутренней сонной артерии. Гипоплазия левой позвоночной артерии
При этом наблюдается односторонняя (ипсилатеральная) или двухсторонняя гипоплазия позвоночной артерии [17, 24]. Возможно сочетание персистирующей тригеминальной артерии и других сосудистых аномалий (рис. 2).
О персистирующей тригеминальной артерии часто сообщают в случаях с острым нарушением мозгового кровотока, ишемией заднего мозга или затылочной доли большого мозга [11, 16, 29], или в сочетании с аневризмами [7, 9], невралгией тройничного нерва [8, 15, 18].
Однако наиболее часто эти артерии не проявляются неврологическими симптомами [10, 27] и случайно обнаруживаются при ангиографии.
Несмотря на это, некоторые авторы [12] заявляют о возможном защитном эффекте от ишемии ствола мозга благодаря кровоснабжению его от внутренней сонной артерии именно тригеминальной артерией.
Персистирующие тригеминальные артерии в 52,6 % случаев сосуществуют с другими аномалиями развития артерий головы и шеи [6, 14, 19].
Очевидно, что персистирующая тригеминальная артерия, подобно большинству других аномалий развития мозговых артерий, биологически менее надежна. Неслучайно они часто ассоциируют друг с другом.
Предоперационное распознавание персистирующих тригеминальных артерий имеет важное значение в клинической практике при выполнении операций на гипофизе, так как их повреждение может вызвать массивное кровотечение [6].
Рецензенты:
Ефремов В.В., д.м.н., профессор кафедры нервных болезней и нейрохирургии, Ростовский государственный медицинский университет Минздрава России, г. Ростов-на-Дону;
Хлопонин П.А., д.м.н., профессор, зав. кафедрой гистологии, эмбриологии и цитологии, Ростовский государственный медицинский университет Минздрава России, г. Ростов-на-Дону.
ФГБНУ «Научно-исследовательский институт глазных болезней»
Персистирующая артерия стекловидного тела у взрослого (клиническое наблюдение)
Журнал: Вестник офтальмологии. 2020;136(4): 214‑218
В статье представлен клинический случай функционирующей фетальной артерии стекловидного тела у пациентки 69 лет. Результаты оптической когерентной томографии с функцией ангиографии свидетельствуют о наличии кровотока в проекции персистирующей гиалоидной артерии (ПГА) на поперечных срезах изображения и на снимках en-face. При биомикроскопии переднего отрезка глаза визуализировано сосудистое русло ПГА, распространяющееся по задней поверхности хрусталика в виде отдельных веточек. Уникальность данного клинического случая обусловлена малой вероятностью подобных находок у лиц пожилого возраста. Наличие у пациентки прогрессирующей катаракты указывает на необходимость индивидуального подхода при определении тактики лечения. На наш взгляд, последовательное использование технологий лазерной коагуляции и лазерной фотодеструкции ПГА позволит минимизировать риск развития гемофтальма и тракционной отслойки сетчатки во время предстоящей операции по поводу катаракты.
Дата принятия в печать:
Диагностика синдрома ППГСТ и ПГА в раннем детском возрасте не вызывает больших затруднений. Данные научной литературы о диагностике ПГА и методах выявления в ней фетального кровотока свидетельствуют об использовании таких методов, как фотографирование глазного дна, флюоресцеиновая ангиография, оптическая когерентная томография (ОКТ) и ультразвуковая допплерография [6—10]. Впервые использование метода ОКТ с функцией ангиографии (ОКТА) в диагностике ПГА продемонстрировано в работе H. Jeon и соавторов в 2019 г., в которой описаны результаты обследования молодого пациента. Выявлено наличие кровотока только в проекции Бергмейстерова сосочка, в ПГА кровоток отсутствовал, что, по мнению авторов, связано с техническими ограничениями метода [11]. Действительно, ОКТА характеризуется низким аксиальным разрешением, что обусловливает трудность дифференцировки кровотока в центральных отделах стекловидного тела. Чаще всего кровоток удается зарегистрировать только на уровне Бергмейстерова сосочка, который состоит в основном из глиальной ткани и не имеет нормального кровотока, однако этот факт вовсе не исключает наличие проходимости в проксимальной части ПГА [8]. Целесообразность и сроки проведения вмешательства (хирургического, лазерного, комбинированного) при ППГСТ и ПГА зависят от риска формирования вторичных осложнений, таких как гемофтальм, обскурационная амблиопия, косоглазие, тракционная отслойка сетчатки [12]. Имеются работы, в которых приводятся случаи разрывов ПГА с гемофтальмом на фоне задней отслойки стекловидного тела (ЗОСТ) или ее угрозе в условиях тракции СТ в области диска зрительного нерва (ДЗН), особенно в глазах с осевой миопией или артифакией у детей, подростков и людей молодого возраста [6—8, 11]. Вопрос возможного присутствия ПГА в КК у взрослых старшего поколения до настоящего времени обсуждается. В доступных источниках встречаются единичные работы, демонстрирующие очень редкие случаи, связанные с ПГА во взрослом возрасте, в частности, у пациентки 52 лет с гемофтальмом [9].
В настоящей работе представлен клинический случай ранее не выявленной ПГА у пациентки А. 69 лет. Пациентка обратилась в ФГБНУ «НИИГБ» с жалобами на снижение зрения. Левый глаз (OS) видит хуже правого глаза (OD) с детства. Более ранние визиты пациентки к офтальмологам ограничивались только подбором очков. При рефрактометрии выявлено наличие в OD простого гиперметропического астигматизма ст. 1,0d., в OS — смешанного астигматизма ст. 2,5d с превалированием миопического компонента. Максимальная острота зрения с коррекцией правого глаза равнялась 0,7, левого — 0,2. Проведение биомикроскопии выявило признаки незрелой катаракты в виде умеренных помутнений в ядре и кортикальных слоях хрусталика обоих глаз. Изменения в хрусталике OS не ограничивались возрастной катарактой. Так, на ЗКХ в парацентральной зоне и несколько назальнее отчетливо определялась так называемая точка Миттенфорда — участок фиброзных изменений с кальцификатами, от которого в СТ отходит тонкий тяж — КК, идущий по направлению к заднему отрезку глаза (рис. 1). Обнаружены фиброзные помутнения на поверхности ЗКХ диаметром до 2—2,5 мм. Их интенсивность в центре значительная, по периферии — менее выраженная, в виде полупрозрачного ободка. Определялось, но неотчетливо, сосудистое русло фетальной артерии, распространяющееся по задней поверхности хрусталика в виде отдельных веточек с красноватым оттенком (рис. 2). Последнее с большой долей вероятности указывало на наличие остаточного кровотока в русле ПГА. Результаты офтальмоскопии подтвердили S-образную, несколько вытянутую форму (рис. 3) и классический тип прикрепления КК к ДЗН (с назальной стороны). Кроме этого, отмечено Y-образное расширение КК в зонах его контакта с ЗКХ и ДЗН.
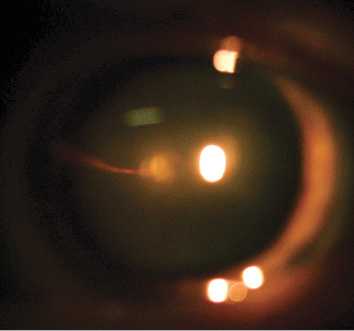
Рис. 1. Биомикроскопическая картина в области прикрепления Клокетова канала к задней капсуле хрусталика.

Рис. 2. Схематическое изображение фетальной сосудистой сети на поверхности задней капсулы хрусталика.
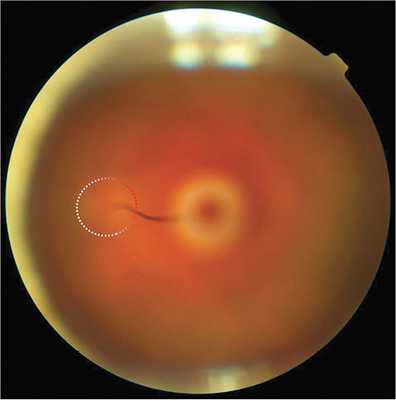
Рис. 3. Офтальмоскопическая картина: S-образный ход Клокетова канала и его Y-образное прикрепление к диску зрительного нерва.
При ультразвуковом сканировании (Voluson E8 GE, США) в B-режиме с исследованием полости стекловидного тела в различных пространственных плоскостях определялся достаточно тонкий гиперэхогенный тяж (КК) неравномерной толщины (до 1,5 мм). Отмечено, что тяж имеет плавный изгиб и берет начало от заднего полюса в проекции ДЗН, после чего, распространяясь кпереди, прикрепляется к ЗКХ с назальной стороны. В режиме цветного допплеровского картирования явных акустических признаков потоков крови в КК не было.
На поперечных срезах изображения перипапиллярной области, полученных методом ОКТА (SPECTRALIS HRA+OCT с модулем ОКТ-ангиографии, Heidelberg Engineering, Германия), отчетливо визуализировался кровоток от ретинальных и хориоидальных сосудов, а также отмечен сигнал средней рефлективности от тяжа (КК) соответственно локализации ПГА в заднем отделе стекловидного тела (рис. 4, а). Можно было бы предположить, что имеет место артефакт изображения, но присутствие кровотока подтверждалось наличием гиперрефлективного локуса в той же проекции на en-face снимках (рис. 4, б). В области сосочка Бергмейстера активный кровоток не определялся. Кроме того, проведение исследования позволило выявить наличие задней тракционной отслойки СТ и элевацию ретинального контура в зоне сосочка Бергмейстера.
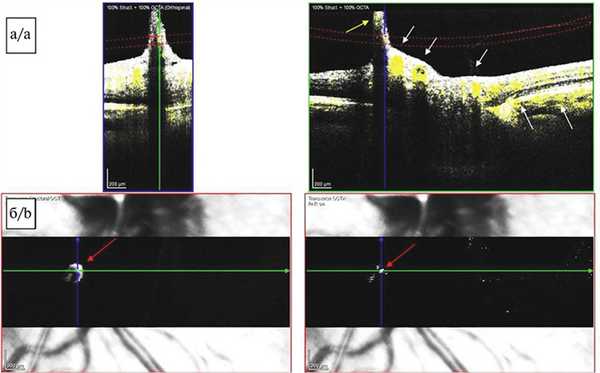
Рис. 4. Картина оптической когерентной томографии-ангиографии.
а — томограмма диска зрительного нерва, поперечный срез, сегментация на уровне заднего отдела стекловидного тела. Визуализируется сигнал кровотока от ретинальных и хориоидальных сосудов (белые стрелки), а также слабый сигнал кровотока от персистирующей гиалоидной артерии (желтая стрелка). В области сосочка Бергмейстера активный кровоток не выявлен; б — томограмма диска зрительного нерва, изображение en-face, проекция нижненазального сектора перипапиллярной области. Визуализируется гиперрефлективный участок, соответствующий сигналу кровотока в сосуде гиалоидного канала (красные стрелки).
Таким образом, указанные изменения, характеризующиеся признаками васкуляризации на поверхности ЗКХ с помутнениями и наличием кровотока в ПГА со стороны сетчатки, укладываются в клиническую картину смешанной формы синдрома ППГСТ, т.е. сочетающую в себе признаки передней и задней его форм. Если пользоваться рабочей классификацией синдрома ППГСТ у детей, предложенной Т.В. Судовской [13], рассматриваемые изменения по выраженности клинических проявлений могут соответствовать II степени из четырех возможных.
Заключение
Уникальность данного клинического случая обусловлена невысокой вероятностью подобных находок у лиц пожилого возраста, а также потенциальной информативностью оптической когерентной томографии-ангиографии в определении функционирования персистирующей гиалоидной артерии.
Наличие персистирующей гиалоидной артерии у пациентки 69 лет с прогрессирующей катарактой указывает на необходимость индивидуального подхода при определении тактики лечения. На наш взгляд, оправдано использование комбинированной лазерной хирургии, которая должна предшествовать операции по поводу катаракты. Последовательное применение технологий лазерной коагуляции и лазерной фотодеструкции фетального сосуда позволит минимизировать риск развития гемофтальма и тракционной отслойки сетчатки во время хирургии катаракты.
Участие авторов:
Концепция и дизайн исследования: Гамидов А.А., Макашова Н.В.
Сбор и обработка материала: Гамидов А.А., Дуржинская М.Х., Сакалова Е.Д., Велиева И.А.
Список сокращений
ВСА — внутренняя сонная артерия
ЗСА — задняя соединительная артерия
НСА — наружная сонная артерия
ПрВчА — примитивная верхнечелюстная артерия
ПМА — передняя мозговая артерия
ПрСтА — примитивная стремянная артерия
Врожденные аномалии церебральных сосудов — редкая патология. Как правило, она представлена различными вариантами сохранения эмбрионального типа кровоснабжения мозга и отличается большим разнообразием, в связи с чем в публикациях на эту тему каждый описанный случай имеет только ему присущие особенности. Один из таких случаев диагностирован в нашей клинике.
Клиническое наблюдение
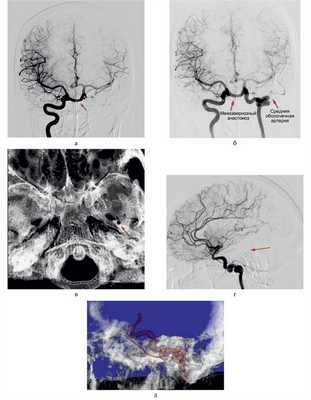
В клинику обратилась 30-летняя женщина с жалобами на периодическую головную боль. При неврологическом осмотре очаговой симптоматики не выявлено. По данным УЗИ сосудов шеи заподозрена патологическая деформация субкраниального сегмента левой внутренней сонной артерии (ВСА), что послужило поводом для выполнения селективной церебральной ангиографии. В результате исследования выявлены аномалии строения прецеребральных артерий (рис. 1): Рис. 1. Селективная церебральная ангиография больной. а — межкавернозный анастомоз между ВСА (указано стрелкой); б — аплазия сегмента А1 правой ПМА; отхождение левой средней оболочечной артерии от левой ВСА (неполный вариант стремянной артерии, указано стрелкой); в — отсутствие остистого отверстия слева (вид сверху на основание черепа), стрелкой обозначено остистое отверстие справа; г — аберрантный тип левой ВСА с прохождением через барабанную полость и последующим достижением сонного канала с переходом в терминальную часть каменистого сегмента (указано стрелкой); д — 3D-реконструкция ротационной ангиограммы в боковой проекции.
— образование межкавернозного анастомоза между ВСА посредством примитивной верхнечелюстной артерии (ПрВчА);
— аберрантный тип левой ВСА, которая входит в пирамиду височной кости через нижний барабанный канал и далее через барабанную полость достигает сонного канала — интратимпанический ход;
— отхождение левой средней оболочечной артерии от аберрантной левой ВСА при агенезии остистого отверстия слева — неполный вариант примитивной стремянной артерии (ПрСтА);
— аплазия сегмента А1 правой передней мозговой артерии (ПМА);
— смещение точки гемодинамического равновесия в левый каротидный бассейн на фоне передней трифуркации левой ВСА, с одновременным заполнением обоих полушарий справа и перетоком по задней соединительной артерии из вертебробазилярного бассейна слева.
В ходе эмбрионального развития артериальная система головного мозга проходит сложный многоэтапный путь формирования [1]. Нарушение эмбриогенеза на любом из этапов обусловливает сохранение после рождения особенностей кровоснабжения головного мозга, присущих внутриутробному строению.
Передние отделы артериального круга образуются из вентральной и дорсальной аорт, I‒III артериальных дуг, а также ПрВчА, дорсальной офтальмической, вентральной офтальмической и артерий и ПМА [1—3]. Вертебробазилярный бассейн образуется из парных продольных невральных артерий [2, 3], которые формируются в результате слияния вентральных ветвей радикулярных артерий по средней линии, тем самым обусловливая метамерный характер строения. Выше III шейного позвонка радикулярные артерии отсутствуют, и их функцию берут на себя эмбриональные анастомозы, тем самым сохраняя метамерный характер развития кровоснабжения головного мозга, присущий спинальному кровоснабжению.
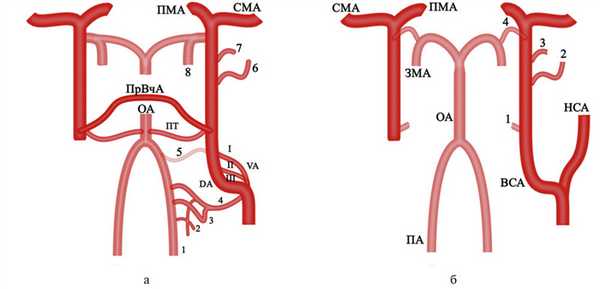
Связь артериальных бассейнов осуществляется посредством каротидно-базилярных анастомозов, к которым относятся: проатлантовая межсегментарная артерия (I и II типа), подъязычная, ушная и тройничная артерии, а также недавно описанная транскливальная артерия (которая может являться как отдельной формой каротидно-базилярного анастомоза, так и крайним вариантом подъязычной или проатлантовой межсегментарной (I типа) артерий [3—7]. Далее в ходе развития вертебробазилярного и каротидного бассейнов происходит регрессия эмбриональных артерий, что приводит к персистированию примитивных артерий, формирующих «незрелые» пути коллатерального кровотока между каротидным и вертебробазилярным бассейнами (рис. 2). Рис. 2. Этапы формирования артериального круга головного мозга. а — связь артериальных бассейнов посредством каротидно-базилярных анастомозов: 1 — продольные невральные дуги; 2 — проатлантовая межсегментарная артерия II типа; 3 — проатлантовая межсегментарная артерия I типа; 4 — примитивная подъязычная артерия (отходит одним стволом с проатлантовой межсегментарной артерией I типа); 5 — примитивная ушная артерия (существование ее оспаривается); 6 — дорсальная офтальмическая артерия; 7 — вентральная офтальмическая артерия; 8 — каудальная (задняя) ветвь ВСА; ОА — основная артерия; ПА — позвоночная артерия; ПМА — передняя мозговая артерия; ПТ — примитивная тройничная артерия; ПрВчА — примитивная верхнечелюстная артерия (межкавернозный анастомоз); СМА — средняя мозговая артерия; VA — вентральная аорта; DA — дорсальная аорта; I, II, III — артериальные дуги; б — регрессия эмбриональных артерий: 1 — задненижняя гипофизарная артерия (остаток ПрВчА); 2 — инфралатеральный ствол; 3 — глазничная артерия; 4 ЗСА — задняя соединительная артерия; ЗМА — задняя мозговая артерия; НСА — наружная сонная артерия; ОА — основная артерия; ПА — позвоночная артерия; ПМА — передняя мозговая артерия; СМА — средняя мозговая артерия.
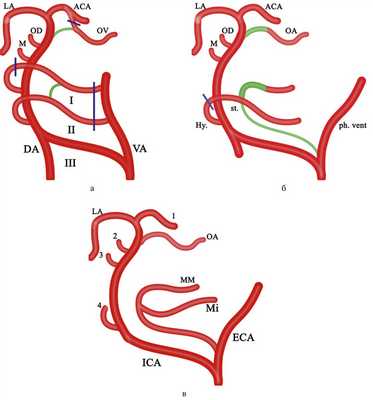
Развитие ВСА и наружной сонной артерии (НСА) тесно связано между собой. Их обособление происходит при регрессии или перемещении ряда эмбриональных сосудов. НСА образуется из сегментов вентральной аорты, лежащих между I—III аортальными дугами, при регрессии вентральных порций аортальных дуг. ВСА формируется из III аортальной дуги, дорсальной аорты, ПрВчА, дорсальной офтальмической, вентральной офтальмической артерий и ПМА. В последующем ряд артерий регрессирует или меня-ет бассейн отхождения [1—3]. Так, остатками дорсальной глазничной артерии и ПрВчА являются инфралатеральный ствол и задненижняя гипофизарная артерия соответственно, а стременная артерия, трансформирующаяся в верхнечелюстную, изначально отходит от гиоидной артерии (ветви ВСА) [3] (рис. 3). Рис. 3. Схема формирования каротидных артерий и их ветвей (адаптировано из P. Lasjaunias и соавт., 1984 [3]). а, б, в — последовательные этапы развития сосудистой системы головного мозга. Зеленым цветом выделены вновь появившиеся связи, синим — регрессия участков артерий: I, II, III — аортальные дуги; VA — вентральная аорта; DA — дорсальная аорта; М — примитивная верхнечелюстная артерия; OD — дорсальная офтальмическая артерия; OV — вентральная офтальмическая артерия; АСА — передняя мозговая артерия; LA — продольная невральная система; Hy — гиоидная артерия; st — стремянная артерия; ph. vent. — вентральная глоточная артерия; ММ — средняя оболочечная артерия; Мi — верхнечелюстная артерия; ICA — внутренняя сонная артерия; ECA — наружная сонная артерия; 1 — ПМА — передняя мозговая артерия; 2 — инфралатеральный ствол; 3 — задненижняя гипофизарная артерия; 4 — каротидно-барабанная артерия.
Описанная трансформация сосудов обусловливает наличие анастомотических связей между бассейнами ВСА и НСА, которые представляют дополнительный путь коллатерального кровотока, в частности при агенезии ВСА. По мнению P. Lasjaunias и A. Santoyo-Vazquez [3], сегментарная агенезия ВСА приводит к инволюции всех проксимально расположенных сегментов артерии и персистированию эмбриональных анастомозов, посредством которых осуществляется коллатеральный кровоток. Так, в случае аберрантного варианта ВСА отмечается агенезия цервикального сегмента истинной ВСА (III аортальной дуги). В таком случае коллатеральный кровоток осуществляется за счет гипертрофированной нижней барабанной артерии (ветвь восходящей артерии глотки), проходящей через нижний барабанный канал в барабанную полость и анастомозирующей с гиоидной артерией (ветвь ВСА). Гипертрофия как нижней барабанной, так и гиоидной артерии при ангиографическом исследовании создает иллюзию наличия шейного сегмента ВСА. Только особенности хода артерий — прохождение через нижний барабанный канал и барабанную полость позволяют говорить об аберрантном варианте ВСА.
Аберрантная ВСА часто сочетается с ПрСтА, что обусловлено общностью происхождения — ПрСтА является ветвью гиоидной артерии [1, 3, 8]. Первое описание ПрВчА принадлежит Hyrtl (1836), и к настоящему времени описан 61 случай [8, 9, 10]. ПрСтА, являясь ветвью гиоидной артерии, формирует среднюю оболочечную и верхнюю челюстную артерии, которые в дальнейшем присоединяются к НСА, тем самым обосабливаясь от ВСА. При нарушении эмбриогенеза возможно три варианта строения ПрСтА [1]:
1) отхождение средней оболочечной и верхнечелюстной артерий от ВСА. Данный вариант ассоциируется с гигантскими аневризмами и синдромом PHACES (Posterior fossa malformations—hemangiomas—arterial anomalies—cardiac defects—eye abnormalities—sternal cleft syndrome), включающим пороки развития задней черепной ямки, гемангиомы лица и шеи, пороки развития артерий, врожденные пороки сердца, патологию глаз и расщелину грудины;
2) отхождение средней оболочечной артерии от каменистого отдела ВСА, для этого варианта характерно отсутствие остистого отверстия на стороне отхождения ПрСтА;
3) отхождение средней оболочечной артерии от ВСА на уровне рваного отверстия.
В представленном нами наблюдении отмечен второй вариант строения ПрСтА.
Межкавернозный анастомоз (ПрВчА) впервые описан T. Lie [11] в 1968 г. К настоящему времени описано всего 20 случаев межкавернозных анастомозов (см. таблицу). Публикации о случаях выявления межкавернозного анастомоза ПрВчА отходит от медиальной поверхности заднего колена каротидного сифона и соединяется с противоположной ВСА, проходя по дну или позади спинки турецкого седла [11—28]. G. Huber и R. Shane Tubbs [17, 27] описали прохождение анастомоза кпереди от гипофиза. Отличительными признаками ПрВчА является агенезия или гипоплазия ВСА с ипсилатеральной аплазией сегмента А1 ПМА.
В большинстве представленных описаний клинические проявления, типичные для агенезии ма-гистральной артерии, несущей кровь к головному мозгу, в виде недостаточности кровоснабжения полушария мозга отсутствовали, а аномальный путь коллатерального кровоснабжения полушария выявлялся случайно. Характерно сочетание порока развития с аневризмами каротидного бассейна в 28,6% наблюдений, отражающее повышенную гемодинамическую нагрузку на доминирующий каротидный бассейн. Помимо этого, в ранее опубликованных данных в большинстве случаев описана агенезия ВСА проксимальнее анастомоза с отсутствием костного канала сонной артерии, что говорит о врожденном пороке развития. Лишь в 3 наблюдениях отмечено наличие костного канала сонной артерии на стороне агенезии, что может свидетельствовать о приобретенном характере окклюзии ВСА [21, 23, 26].
Возвращаясь к описанию представленного нами наблюдения, заметим, что в литературе описаны только случаи сочетания межкавернозного анастомоза с фактическим отсутствием ВСА и аплазией ипсилатерального сегмента А1 ПМА, тогда как в нашем наблюдении впервые отмечено сочетание межкавернозного анастомоза и аберрантного типа ВСА с сохранением ее проходимости и аплазии контралатерального сегмента А1 правой ПМА в сочетании с неполным вариантом ПрСтА. Возможно, патологическая извитость аберрантной сонной артерии, которая наблюдается и в нашем случае, в итоге приведет к окклюзии ВСА на фоне компенсированного коллатерального кровоснабжения левого каротидного бассейна по межкавернозному анастомозу и задней соединительной артерии из вертебробазилярного бассейна.
Таким образом, наше клиническое наблюдение представляет исключительный интерес ввиду крайне редкого сочетания пороков эмбрионального развития артериального круга и появления сосудов, компенсирующих утрату сегмента магистральной артерии. Коллатеральное кровоснабжение левого каротидного бассейна на стороне агенезии ВСА осуществляется как за счет межкавернозного анастомоза (ПрВчА), так и за счет гипертрофированной ветви восходящей артерии глотки (аберрантный вариант ВСА). Данное наблюдение интересно также с позиции изучения возможной компенсации кровотока при агенезии одного из сегментов ВСА. В клинической практике следует учитывать наличие подобных особенностей как при лечении опухолей турецкого седла (особенности прохождения ПрВчА), так и в практике отоларингологов (интратимпанический ход ВСА).
Авторы заявляют об отсутствии конфликта интересов.
Комментарий
Описанное авторами наблюдение и обзор литературы, посвященные аномалиям церебральных сосудов, представляют несомненный интерес не только для молодых специалистов, но и для опытных клиницистов. Особенность данного наблюдения — сочетание пороков эмбрионального развития артериального круга головного мозга с сохранением артерий, формирующихся на определенном этапе развития церебральных сосудов — межкавернозного анастомоза и примитивной стремянной артерии. Чаще всего такие анастомозы формируются в качестве коллатералей при агенезии ВСА. Примечательно, что в данном случае, несмотря на аберрантный тип ипсилатеральной ВСА, она сохранена. Важная часть работы, основанная на литературных данных, - описание внутриутробных этапов развития сосудистой системы головного мозга. Знание эмбриогенеза церебральных артерий дает понимание возможных анатомических вариантов, встречающихся как у клинически здоровых лиц, так и при патологии.
Читайте также:
- Пульпит у детей: причины, симптомы и лечение
- Условия развития инфекции. Патогенность. Инфицирующая доза. Скорость размножения микроорганизмов. Входные ворота инфекции. Тропизм. Пантропизм.
- Проявление гипертрофии отделов сердца на ЭКГ. Формы зубцов электрокардиограммы при гипертрофии
- Дисморфофобия
- Синдром гипербилирубинемии функциональной
