Лучевая терапия эндокринной офтальмопатии. Техника
Добавил пользователь Alex Обновлено: 22.01.2026
Причины возникновения эндокринной офтальмопатии
Единого мнения относительно причин развития ЭОП не существует до сегодняшнего дня. Однако большинство суждений сходятся на том, что некие изменения тканей орбиты вызывают в организме патологический иммунный ответ, в результате чего, в эти ткани проникают антитела, что вызывает их воспаление и отек, а в спустя 1 или 2 года, и рубцевание поверхности. По одной из гипотез, клетки ткани щитовидной железы, а также ретроорбитального пространства имеют общие фрагменты антигенов (эпитопы), которые, вследствие некоторых причин, начинают восприниматься иммунной системой, как чужеродные. В качестве аргумента, авторы выдвигают тот факт, что ЭОП в 90% случаев сопутствует диффузному токсическому зобу, при достижении эутиреоза выраженность глазных симптомов снижается, а уровень антител при данном сочетании заболеваний к рецептору тиреотропного гормона высок. По другой версии, ЭОП представляется самостоятельным заболеванием с преимущественным поражением орбитальных тканей. Аргументом, свидетельствующим в пользу этой теории является отсутствие дисфункции щитовидной железы примерно в 10% случаев ЭОП.
И все же, причина ЭОП, кроется не в поражении щитовидной железы, поэтому и регуляция ее функций, не способна обратить развитие данного заболевания вспять. Скорее всего, аутоиммунный процесс может затрагивать эндокринную железу вместе с мышцами глаза и клетчаткой орбиты. Правда, восстановление естественного гормонального уровня щитовидной железы способен облегчить течение эндокринной офтальмопатии, хотя в ряде случаев это не помогает затормозить ее прогрессирование.
Большинство пациентов с ЭОП отмечают гипертиреоидное состояние, но в 20% случаев может отмечаться эутиреоз. Кроме того, изредка даже выявляются патологии, сопровождающиеся снижением уровня тиреоидных гормонов, такие как тиреоидит Хашимото или рак щитовидной железы. Глазные симптомы, при наличии гипертиреоза, как правило, развиваются в течение 1,5 лет.
Заболеваемость в среднем составляет примерно 16 случаев женщин и 2,9 случаев мужчин из 100 тыс. человек в популяции. Таким образом, у женщин предрасположенность к этому заболеванию гораздо выше, но более тяжелые случаи отмечались у мужчин. Болезнь проявляется к возрасту 30-50 лет, а тяжесть проявлений обычно нарастает с возрастом (после 50 лет).
Проявления эндокринной офтальмопатии
Симптомокомплекс ЭОП, как правило, обусловлен наличием сопутствующих патологий щитовидной железы, добавляющих свои характерные проявления. При этом, глазными проявлениями эндокринной офтальмопатии принято считать ретракцию века (подтянутость кверху), чувство сдавления и боль, нарушение цветовосприятия, сухость глаз, экзофтальм (выступание кпереди глазного яблока), отек конъюнктивы (хемоз), периорбитальный отек, ограничение движений глазным яблоком, приводящее к значимым функциональным, а также косметическим нарушениям. Подобные симптомы могут быть односторонними или наблюдаться на обоих глазах. Проявление их и выраженность напрямую связаны со стадией заболевания.
Множество симптомов ЭОП, названы именами авторов, которые впервые их описали, так:
- Симптом Гифферда-Энроса - это отек век;
- Симптом Дальримпля - ретракция века, сопровождающаяся широким раскрытием глазных щелей;
- Симптом Кохера - это видимость участка склеры между радужкой и верхним веком при взгляде вниз;
- Симптом Штельвага - редкое мигание;
- Симптом Мебиуса-Грефе-Минза - это отсутствие согласованности в движениях глазных яблок;
- Синдром Похина - загиб век при закрытии;
- Симптом Роденбаха - это дрожание век;
- Симптом Еллинека - пигментация век.
Подавляющее большинство случаев эндокринной офтальмопатии к потере зрения не ведут, но они вызывают его ухудшение, вследствие развития диплопии, кератопатии, компрессионной оптиконейропатии.
Диагностика
Выраженная клиническая картина ЭОП не требует для ее диагностики специальных исследований, достаточно офтальмологического осмотра. Он включает: исследование оптических сред, визометрию, периметрию, проверку цветового зрения и согласованности движений глаз. Измерение степени экзофтальма проводят экзофтальмометром Гертеля. При затруднениях, а также с целью оценки состояния двигательных мышц глаза и тканей в ретробульбарной области могут быть назначены УЗИ, МРТ или КТ. При сочетании ЭОП и тиреоидной патологии исследуется гормональный статус (лабораторные исследования уровня общих Т3, Т4 и связанных Т3, Т4 и ТТГ). На наличие ЭОП также может указывать повышение экскреции гликозамингликанов с мочой, присутствие в крови антитиреоглобулиновых или ацетилхолинэстеразных антител, экзоофтальмогенного Ig и офтальмопатического Ig, альфа-галактозил -АТ, АТ к микросомальной фракции, AT к глазному протеину.
Классификация
Сегодня для ЭОП существует несколько классификаций. Самая простая, выделяет два типа заболевания, которые, впрочем, друг друга не исключают. К первому типу относят ЭОП, сопровождающуюся минимальными признаками рестриктивной миопатии и воспаления, ко второму - ЭОП, сопровождающуюся значительными их проявлениями.
Зарубежные специалисты используют классификацию NOSPECS.
В России принято применять классификацию Баранова.
Степени
- 1 Экзофтальм незначительный (15,9 ± 0,2мм), веки имеют припухлость, периодически возникает ощущение «песка», изредка слезотечение. Нарушений со стороны функции двигательных мышц глаз нет.
- 2(средняя тяжесть) Экзофтальм умеренный (17,9 ± 0,2мм), наблюдаются нерезкие изменения со стороны конъюнктивы, легкое либо умеренное нарушение функции экстраокулярных мышц, стойкое ощущение «песка», нестойкая диплопия, слезотечение, светобоязнь.
- 3(тяжелая) Экзофтальм резко выражен (22,2 ±1,1мм), наблюдается нарушение смыкания век, стойкая диплопия, изъязвление роговицы, выраженные нарушения функции двигательных мышц глаза, признаки атрофии ЗН.
Вместе с тем, существует классификация Бровкиной, включающая три формы ЭОП: отечный экзофтальм, тиреотоксический экзофтальм, эндокринную миопатию. Каждая из выделенных форм со временем переходит в последующую более тяжелую.
Лечение эндокринной офтальмопатии
Метод лечение ЭОП обусловлен стадией процесса и наличием сопутствующих патологий щитовидной железы. Однако существуют и общие рекомендации, придерживаться которых следует в обязательном порядке:
- Отказ от курения.
- Применение средств увлажнения глаза (капли, глазные гели);
- Поддержание нормальной функции щитовидной железы.
Наличие нарушений функции щитовидной железы, требует проведения ее коррекции под контролем эндокринолога. В случае гипотиреоза, применяется терапия тироксином, при гипертиреозе, назначаются тиреостатические препараты. При отсутствии эффективности консервативного лечения, может быть назначено хирургическое удаление части либо всей щитовидной железы.
Лечение ЭОП консервативными методами. Для устранения признаков воспаления и отека, зачастую системно назначают глюкокортикоиды либо стероидные препараты. Они призваны снизить продукцию мукополисахаридов клетками-фибробластами, занимающих важное место в иммунных реакциях. Для применения глюкокортикоидов (метилпреднизолон, преднизолон) существует много различных схем, которые рассчитаны на курсы от нескольких недель и до нескольких месяцев. Альтернативным вариантом применения стероидов может быть циклоспорин. Нередко его используют и в комбинациях с ними. Тяжелое воспаление или компрессионная оптиконейропатия может потребовать проведения пульс-терапии (введение в короткое время сверхвысоких доз). Оценку ее эффективности проводят спустя 48 часов. При отсутствии таковой, целесообразно проведение хирургической декомпрессии.
В странах СНГ до сих пор довольно широко применяют ретробульбарные введения глюкокортикоидов. Однако за рубежом от подобного метода лечения данной патологии уже отказались по причине его высокой травматичности и риска образования рубцов в месте введения раствора. Кроме того, эффективность глюкокортикоидов больше связана с системным действием, а не с местным. Две эти точки зрения давно являются предметом дискуссий, именно поэтому применение данного метода введения целиком остается на усмотрении врача.
При лечении умеренного или тяжелого воспаления, диплопии и снижения зрения возможно применение лучевой терапии. Ее действие оказывает повреждающий эффект на лимфоциты и фибробласты. Ожидаемый результат проявляется спустя несколько недель. Так как рентгеновское излучение на время может усиливать процесс воспаления, пациентам в первые недели облучения, назначают стероидные препараты. Наилучший эффект от лучевой терапии достигается при стадии активного воспаления, терапия которого начата в сроки до семи месяцев от начала заболевания, или в комбинации с глюкокортикоидными средствами. К его возможным рискам можно отнести развитие катаракты, лучевой оптиконейропатии, лучевой ретинопатии. Так, одно из исследований при облучении, зафиксировало образование катаракты у 12% пациентов. Применение лучевой терапии не рекомендовано у больных сахарным диабетом вследствие риска прогрессирования ретинопатии.
Хирургическое лечение ЭОП. Примерно 5% пациентов с данным заболеванием нуждаются в хирургическом его лечении. Нередко хирургия ЭОП проводится в несколько этапов. При отсутствии серьезных осложнений заболевания, таких как компрессионная оптиконейропатия и тяжелое поражение роговицы, операция должно быть отложена до затихания активного процесса воспаления либо проводиться на стадии рубцовых изменений. Не менее важен и порядок выполнения вмешательств.
Декомпрессию орбиты, нередко проводят и в качестве первого этапа хирургического лечения компрессионной оптиконейропатии, и при отсутствии эффективности консервативной терапии. Возможными осложнениями ее могут стать: кровотечение, потеря чувствительности периорбитальной зоны, диплопия, синусит, смещение век, смещение глазного яблока, слепота.
Хирургия косоглазия, как правило, выполняется в периоде ремиссии ЭОП, при стабильности угла отклонения глаза не менее полугода. Лечение проводят, в первую очередь, для минимизации диплопии. Достижение постоянного бинокулярного зрения, как правило, бывает затруднительно, или одного вмешательства просто недостаточно.
С целью уменьшения легкого или умеренного экзофтальма, зачастую назначают операцию по удлинению век. Она является альтернативой введению в толщу верхнего века ботокса и триамцинолона субконъюнктивально. Не исключено также проведение боковой тарзоррафии - сшивания латеральных краев, которая позволяет уменьшить ретракцию века.
На заключительном этапе хирургического лечения ЭОП, обычно выполняют блефаропластику и пластику слезных точек.
Перспективные направления лечения ЭОП. На сегодняшний момент уже разрабатываются новые препараты и методы для успешного лечения ЭОП. Исследуется эффективность приема микроэлемента селена, являющегося антиоксидантом, противоопухолевого средства ритуксимаба, ингибиторов фактора опухолевого некроза - этанерцепта, инфликсимаба, даклизумаба.
Существуют и методы лечения ЭОП, не являющиеся основными, но способные с успехом в некоторых ситуациях применяться. К примеру, введение никотинамида и пентоксифиллина, которые блокируют синтез мукополисахаридов в ретроорбитальной области.
Один из потенциальных медиаторов патологических процессов в орбите - это инсулиноподобный фактор роста-1. Поэтому, при лечении ЭОП начинают применять аналог соматостатина - октреотид, к которому в ретробульбарных тканях имеются рецепторы. В последнее время проходит последние клинические исследования длительно действующий аналог соматостатина - ланреотид.
Роль плазмофереза или внутривенного введения иммуноглобулина при лечении ЭОП до настоящего времени изучены недостаточно. Применение последнего, при сравнении с пероральным приемом преднизолона, показало в одном из последних исследований аналогичный эффект при значительно меньшем количестве побочных действий.
В медицинском центре «Московская Глазная Клиника» все желающие могут пройти обследование на самой современной диагностической аппаратуре, а по результатам - получить консультацию высококлассного специалиста. Клиника консультирует детей от 4 лет. Мы открыты семь дней в неделю и работаем ежедневно с 9 ч до 21 ч. Наши специалисты помогут выявить причину снижения зрения, и проведут грамотное лечение выявленных патологий.
Лучевая терапия эндокринной офтальмопатии. Техника
ФГУ Эндокринологический научный центр Минздравсоцразвития России
Медицинский радиологический научный центр РАМН, Москва
Клиническое течение эндокринной офтальмопатии при болезни Грейвса в зависимости от эффекта радиойодтерапии
Журнал: Проблемы эндокринологии. 2011;57(3): 17‑20
Шеремета М.С., Свириденко Н.Ю., Беловалова И.М., Гарбузов П.И. Клиническое течение эндокринной офтальмопатии при болезни Грейвса в зависимости от эффекта радиойодтерапии. Проблемы эндокринологии. 2011;57(3):17‑20.
Sheremeta MS, Sviridenko NIu, Belovalova IM, Garbuzov PI. The clinical course of endocrine ophthalmopathy in patients presenting with Graves' disease depending on the effect of radioiodine therapy. Problemy Endokrinologii. 2011;57(3):17‑20. (In Russ.).
Исследовали течение эндокринной офтальмопатии (ЭОП) после радиойодтерапии (РЙТ) болезни Грейвса в зависимости от наличия или отсутствия эффекта от РЙТ (пострадиационного гипотиреоза), определяли факторы риска прогрессирования ЭОП после РЙТ. В проспективном исследовании участвовали 38 пациентов (76 глаз). В зависимости от исхода РЙТ пациенты были разделены на две группы: 1-я группа - 19 больных (38 глаз) с сохранившимся тиреотоксикозом, продолжающие принимать тиреостатики, 2-я группа - 19 пациентов (38 глаз), у которых на ранних сроках после РЙТ (3 и 6 мес) развился гипотиреоз, и они получали заместительную терапию левотироксином. Достижение пострадиационного гипотиреоза имело существенное значение для клинического течения ЭОП. В 1-й группе ЭОП оставалась активной на протяжении всего срока наблюдения (12 мес); интегральный показатель тяжести ЭОП существенно не изменился. Во 2-й группе после развития гипотиреоза активные формы ЭОП не выявлялись, интегральный показатель тяжести ЭОП значимо снизился. Через 12 мес в 1-й группе уровень антител к рецептору ТТГ (АТ рТТГ) оказался существенно выше, чем во 2-й группе. После РЙТ скорость регрессии симптомов ЭОП определяется эффективностью абляции щитовидной железы. Персистенция АТ рТТГ ≥10 Ед/л ассоциирована с ухудшением течения ЭОП после РЙТ.
Цель настоящей работы — исследование течения ЭОП после РЙТ у пациентов с БГ в зависимости от наличия или отсутствия эффекта от РЙТ (пострадиационного гипотиреоза), а также определение факторов риска прогрессирования ЭОП после лечения 131 I.
Материал и методы
В проспективном исследовании участвовали 38 пациентов с БГ (76 глаз). В зависимости от исхода РЙТ пациенты были разделены на две группы. 1-ю группу составили 19 больных (38 глаз), у которых после РЙТ сохранялся тиреотоксикоз при всех визитах и они продолжали принимать тиреостатики. Во 2-ю группу вошли 19 пациентов (38 глаз), у которых на ранних сроках наблюдения после РЙТ (3 и 6 мес) развился гипотиреоз, и им была назначена заместительная терапия левотироксином. Отдельно была проанализирована группа пациентов (10 человек, 20 глаз), у которых гипотиреоз развился в первые 3 мес после РЙТ. Пациенты 1-й и 2-й групп перед РЙТ не различались по возрасту — 41,4 года (17; 61) и 42,4 года (22; 62), индексу массы тела (ИМТ), количеству курящих в группах, стажу — ЭОП 23,5 мес (6; 72) и 26,0 мес (6; 120) и длительности лечения тиреотоксикоза (p>0,1 для всех параметров). Средний уровень АТ рТТГ в обеих группах не имел достоверных отличий — 19,8 (0,02; 128) Ед/л и 17,6 (1,48; 67) Ед/л (p=0,696).
Группы различались средней введенной TA (13,1±5,3 мКи и 10,7±5,6 мКи соответственно; р=0,056), средним объемом щитовидной железы (ЩЖ): 40,4 мл (6,4; 60) и 26,4 мл (5,4; 82) (p=0,003), активностью ЭОП [1-я группа — 3,9 балла (2; 7), 2-я группа — 3,3 балла (2; 6), p=0,023]; в 1-й группе больных с активной формой ЭОП было больше (χ 2 =7,516, p=0,006). В 1-й группе преобладали пациенты с более выраженными симптомами ЭОП, что выражалось более высоким интегральным показателем тяжести ЭОП (1,1±0,6 и 0,5±0,6 соответственно, p=0,0007) и большей частотой выявления признаков оптической нейропатии (χ 2 =11,400, p=0,001). Критерием исключения являлись тяжелые формы ЭОП, требующие экстренного лечения.
Диагностику БГ и контроль лечения проводили на базе ФГУ ЭНЦ: уровни ТТГ, свТ4, свТ3 определяли на автоматическом анализаторе Vitros («Johnson & Johnson»). Границы нормы для базального уровня ТТГ 0,25—3,5 мЕд/л, свТ4 9,0—20,0 пмоль/л, свТ3 4,26—8,1 пмоль/л.
УЗИ ЩЖ проводили на ультразвуковом сканере Hewlett Packard Image Point HX датчиком с переменной частотой 7,5-10 МГц, а также в режиме допплеровского исследования. АТ рТТГ определяли радиорецепторным методом с использованием свиного рТТГ на наборах Brahms (Германия). Границы нормы для определения АТ рТТГ: до 1 Ед/л — отрицательный результат, 1—1,5 Ед/л — серая зона, более 1,5 Ед/л — положительный результат.
Офтальмологические исследования проводились в офтальмологическом отделении ЦКБ РАН (зав. — д.м.н. В.Г. Лихванцева). Всем пациентам выполнялась визометрия, тонометрия, биомикроскопия, компьютерная периметрия, экзофтальмометрия, офтальмоскопия. Наличие диплопии оценивали по шкале Гормана [5]. Активность и тяжесть верифицировали соответственно рекомендациям EUGOGO [6]. Активность ЭОП оценивалась по шкале клинической активности CAS [7, 8]. CAS ≥3 указывал на активную стадию ЭОП. Тяжесть ЭОП оценивали по классификации NOSPECS [9], выделяя легкую, среднюю и тяжелую степень заболевания соответственно рекомендациям EUGOGO.
РЙТ проводили на базе отделения Радиохирургического лечения открытыми радионуклидами (зав. — д.м.н. В.В. Крылов), МРНЦ РАМН (Обнинск). Наблюдение осуществлялось через 3, 6 и 12 мес после РЙТ.
Компьютерный анализ полученных результатов проводили с помощью пакета прикладных статистических программ SAS (Statistical Analysis System, «SAS Institute Inc.», США) с применением стандартных алгоритмов вариационной статистики, включая корреляционный анализ и анализ таблиц сопряженности, а также различные типы межгруппового сравнения распределений изучаемых показателей. Данные в тексте и в таблицах представлены в виде М±SD (М —средняя арифметическая, SD — среднеквадратичное отклонение) или Me [25; 75] (Me — медиана, 25 и 75 — 1-й и 3-й квартили). Критический уровень значимости при проверке статистических гипотез принимался равным 0,05.
Результаты и обсуждение
Через 3 мес после РЙТ тиреотоксикоз сохранялся у большинства пациентов 1-й группы (68,4%), несмотря на прием тиреостатиков, и только у 21% пациентов 2-й группы (без лечения). Через 6 и 12 мес тиреотоксикоз выявлялся в 1-й группе на фоне приема тиреостатиков (32 и 30%) и во 2-й группе (5,6 и 0%) на фоне приема левотироксина. Частота медикаментозного эутиреоза увеличивалась в динамике в 1-й группе (21, 68, 70%) и во 2-й группе (47, 50, 100%). Некомпенсированный гипотиреоз выявлялся через 3 мес у пациентов обеих групп (10,6 и 31,6%), через 6 мес только у пациентов 2-й группы (44,4%) и отсутствовал у пациентов обеих групп через 12 мес.
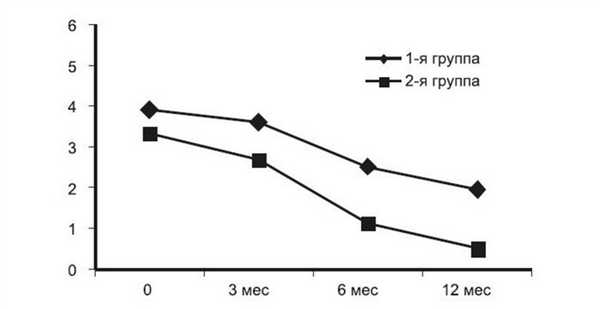
Пострадиационные изменения функции ЩЖ сопровождались снижением среднего интегрального показателя активности процесса в орбите у пациентов обеих групп через 3, 6 и 12 мес (рис. 1). Рисунок 1. Динамика среднего интегрального показателя активности ЭОП (CAS) у пациентов с БГ в зависимости от эффекта РЙТ. Этот показатель был выше у пациентов 1-й группы при исследовании на всех сроках (р=0,023, p=0,004, p=0,0000, p=0,0000 соответственно). Индекс уменьшения активности был достоверно выше у пациентов 2-й группы на 2-м (6 мес) и 3-м (12 мес) визитах (p=0,017 и p=0,028).
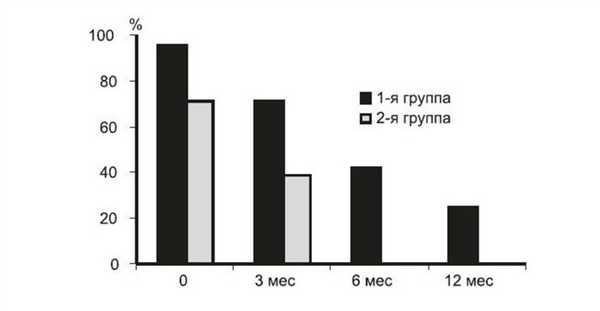
Следует отметить, что, несмотря на одинаковый стаж ЭОП на момент проведения РЙТ, в 1-й группе активность ЭОП сохранялась и через 12 мес, тогда как во 2-й группе уже через 6 мес активных форм ЭОП выявлено не было; они не появились и к 12-му месяцу (р=0,004, p=0,006, p=0,0000, p=0,0002 соответственно) (рис. 2). Рисунок 2. Динамика частоты выявления активных форм ЭОП (CAS >3) в зависимости от эффекта РЙТ.
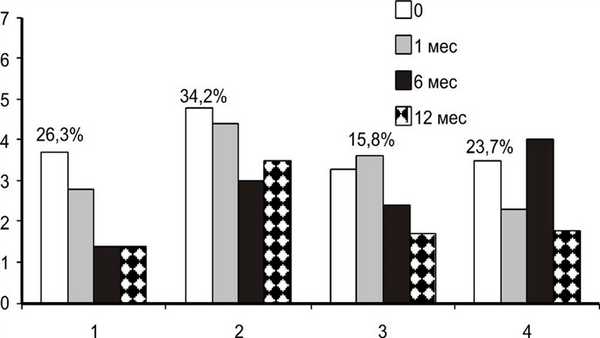
Наряду с общими тенденциями в клиническом течении ЭОП, характерными для каждой из анализируемых групп, выявлены различия и внутри этих групп. Так, у 34,2% больных 1-й группы активность ЭОП по шкале CAS постепенно снижалась (3,7—2,8—1,4—1,4 балла); у 26,3% пациентов активность ЭОП оставалась высокой и незначимо уменьшилась к 6-му (р=0,517) и 12-му месяцам (р=0,347) (4,8-4,4-3,0-3,5 балла); у 23,7% отмечено прогрессирование на 3-м месяце (p=0,000) наблюдения, с быстрым регрессом к 6-му (р=0,000) и 12-му месяцам (р=0,000) (3,3—4,8—2,4—1,7 балла). У 15,8% больных наблюдалась реактивация процесса к 6-му месяцу (p=0,013) с переходом в неактивную фазу к 12-му месяцу (р=0,015) (3,5-2,3-4,0-1,8 балла) (рис. 3). Рисунок 3. Динамика активности в 1-й группе (отсутствие эффекта) после РЙТ. Здесь и на рис. 4: 1 — положительная динамика; 2 — без динамики; 3 — отрицательная динамика через 3 мес; 4 — отрицательная динамика через 6 мес. Следует отметить, что независимо от реактивации ЭОП в ранние сроки наблюдения, к 12-му месяцу отмечалось достоверное снижение ее активности.
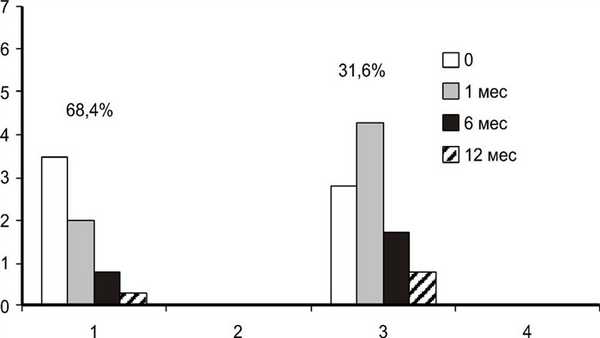
Во 2-й группе у большинства пациентов (68,4%) активность ЭОП по шкале CAS постепенно снижалась (3,5—2,0—0,8—0,3 балла), у остальных 31,6% отмечена отрицательная динамика через 3 мес (p=0,000), но быстрое снижение к 6-му (р=0,000) и 12-му месяцам (р=0,000) (2,8—4,3—1,7—0,8 балла) (рис. 4). Рисунок 4. Динамика активности во 2-й группе (пострадиационный гипотиреоз) после РЙТ.
РЙТ сопровождалась снижением продукции АТ рТТГ. Исходно достоверных различий в АТ рТТГ у пациентов 1-й и 2-й групп выявлено не было: 14,0±14,8 и 13,1±14,4 Ед/л соответственно (р=0,696). Однако через 12 мес в 1-й группе уровень АТ рТТГ оказался достоверно выше, чем во 2-й группе (10,8±8,3 и 2,9±2,0 Ед/л соответственно, p=0,0003), где развился пострадиационный гипотиреоз. Разница между исходными и конечными (12 мес) показателями АТ рТТГ в 1-й группе (-4,9±9,5) и 2-й группе (-5,6±8,2) оказалась статистически достоверной (р=0,018, р=0,0004). Персистенция АТ рТТГ ≥10 Ед/л (RR=5,4; p<0,01) является фактором риска ухудшения течения ЭОП после РЙТ БГ.
Таким образом, установлено, что достижение пострадиационного гипотиреоза имеет существенное значение для клинического течения ЭОП. В 1-й группе, где гипотиреоз не развился, активность ЭОП сохранялась на протяжении всего срока наблюдения (12 мес). Во 2-й группе к моменту развития гипотиреоза (6 мес) активные формы ЭОП уже не выявлялись (p=0,0000).
Анализ динамики тяжести ЭОП выявил во 2-й группе значимое увеличение доли легких форм к 12 мес наблюдения (р=0,035) за счет уменьшения доли средних и тяжелых форм (р=0,050). К этому сроку во 2-й группе имело место достоверное снижение среднего интегрального показателя тяжести (p=0,043). В 1-й группе доля легких форм оставалась примерно на одном уровне; доля средних форм за счет снижения тяжелых увеличилась незначительно (p=0,059).
Выводы
1. После радиойодтерапии болезни Грейвса скорость регрессии симптомов ЭОП определяется эффективностью абляции щитовидной железы: декомпенсация тиреотоксикоза ухудшает течение ЭОП в постлучевом периоде.
2. Сроки наступления пострадиационного гипотиреоза (3/6 мес) не отражаются на клиническом течении ЭОП.
Что такое эндокринная офтальмопатия, ее симптомы и методы лечения

Эндокринная офтальмопатия (офтальмопатия Грейвса) - аутоиммунное офтальмологическое заболевание, характерное для женщин.
Несмотря на то, что это офтальмологическая патология, она может протекать бессимптоматично.
Что такое эндокринная офтальмопатия?
Эндокринная офтальмопатия также называется ассоциированной орбитопатей и офтальмопатей Грейвса, но в офтальмологии чаще употребляется название ЭОП.
Заболевание в основном сопровождается болезнями эндокринного характера, которое говорит о следующих нарушениях:
- патологии щитовидной железы;
- нарушение гормонально уровня;
- аутоиммунные заболевания;
- поражения орбитальной ткани.
Среди нетипичных симптомов можно отметить тремор рук и учащенное сердцебиение.
Еще один вид заболевания - отечная форма, которая может развиваться на обоих глазах, но крайне редко это происходит одновременно.
Внимание! Очевидный признак такой болезни - птоз верхнего века (опущение), при этом в вечернее время суток глазная щель восстанавливается.
Несмотря на то, что заболеванию подвержены оба глаза, их поражение происходит в разное время. Иногда интервал между распространением заболевания двух глаз достигает нескольких месяцев.
Код заболевания по МКБ 10: Н06.2.
Симптомы заболевания
К симптомам болезни относятся:
Также одним из признаков болезни является набухание слизистой оболочки глаза между веками.
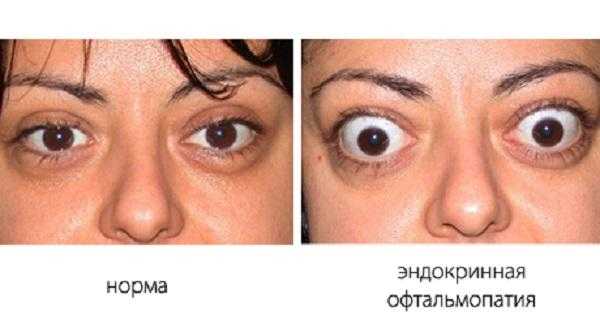

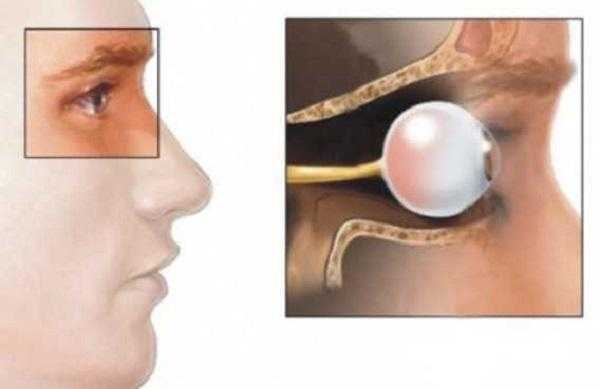
Причины болезни
Современная медицина не может дать точного ответа на вопрос, что может стать причиной ЭОП.
Осторожно! Судя по всему, вызывает это заболевание поражение клеток тканей щитовидной железы и ретроорбитального пространства. Вследствие этого новообразованные ткани начинают распознаваться организмом как чужеродные тела.
С другой стороны, протекание такой патологии обусловлено дисфункцией клетчатки и мышцами глаза.
Но наиболее подвержены такому недугу женщины: по статистике на 100 000 человек приходится 16 со стороны женской части населения, в то время как на то же количество людей приходится всего три мужчины с ЭОП.
При остром развитии заболевания его признаки видны достаточно отчетливо, при этом не требуется особых методов осмотра, кроме стандартных:
Также производится сбор анамнеза, по которому можно установить причину и характер заболевания.
При лечении эндокринной офтальмопатии специалист ставит перед собой три цели: устранение непосредственно фаторов риска, приводящих к заболеванию, поддержание эутиреоза и предотвращение развития кератопатий (последствий заболевания).
Важно! По большей мере лечение происходит с применением тироксина, но иногда при необходимости удалить орган зрения полностью в качестве медикаментозного средства используют и другие препараты.
В любом случае для профилактики в постреабилитационный период применяют «искусственные слезы».
Лучевая терапия
Лучевая терапия - один из вариантов лечения, большинство показаний к которому рекомендуют именно этот метод.
Технически такой способ представляет собой облучение области глазного яблока для тех, у кого болезнь проходит в агрессивной форме.
Но такой метод может иметь ряд последствий, в том числе - лучевое поражение, которое противопоказано для пациентов офтальмологических отделений.
В процессе лечения применяются такие препараты, как соматостатин (подобные лекарства замедляют распространение заболевания), а также иммуноглобулин.
Клиническое действие последнего пока недостаточно изучено, поэтому его введение требует консультации лечащего врача.
Хирургическое лечение
Оперативное вмешательство - последняя мера, к которой прибегают врачи.
Нужно знать! Как правило, это требуется в случаях, если медикаментозные меры оказываются бездейственными или если симптомы показывают себя слишком ярко.
В частности, вмешательство хирургов требуется при декомпрессии орбиты глазного яблока, а также при необходимости пластики мышц, отвечающих за движение глазного яблока.
Прогнозы лечения заболевания
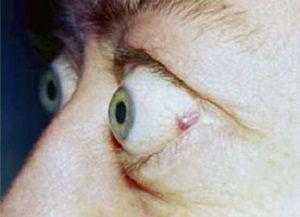
Обычно при эндокринной офтальмопатии выносятся неблагоприятные прогнозы, поэтому после лечения необходимо длительное наблюдение как со стороны офтальмолога, так и со стороны эндокринолога.
Обычно этот период составляет до полугода вне зависимости от возраста пациента.
Лишь в одном из десяти случаев наблюдается ухудшение состояния пациента (так называемый регресс экзофтальма), в остальных ситуациях можно говорить о стабилизации процесса восстановления.
Лечение эндокринной офтальмопатии во время беременности
Если говорить о будущей маме - данная болезнь не представляет никакой опасности для нее.
Более того - в силу того, что патология не является опасной в принципе, офтальмологи пока не сформировали ни курс лечения, ни предписания профилактических мер.

Единственное, что стоит учитывать беременным при диагностировании эндокринной офтальмопатии - это последствия.
Главным образом это тиреотоксикоз и токсический зоб, которые могут возникать в результате патологии и требуют лечения под контролем специалистов.
Меры профилактики
Основные цели профилактики - устранение нарушений в функциях желез, отвечающих за соответствующие процессы в организме.
В первую очередь это касается гормонов, но для предотвращения сбоев в их работе нужно ежегодно сдавать анализы.
Кроме того - необходимо хотя бы раз в год посещать эндокринолога, который может вовремя обнаружить проблему.
Полезное видео
В данном видео вы узнаете о хирургическом лечении эндокринной офтальмопатии:
Если речь идет о начальной стадии болезни - стоит обратить внимание на состояние своей щитовидной железы, но при хронической форме эндокринной офтальмопатии возможно хирургическое удаление части органа, отвечающего за выделение соответствующих гормонов.
Дополнительно к этому требуется лечение с применением гормональных препаратов (для этого необходимо пройти обследование, так как у некоторых пациентов наблюдается невосприимчивость к лекарствам подобного рода).
Эндокринная офтальмопатия
Актуальность проблемы эндокринной офтальмопатии (ЭОП) в настоящее время не вызывает сомнений. Это связано с тем, что относительно недавно появились методы объективной оценки состояния глазного яблока и тканей орбиты при помощи ультразвукового исследования (УЗИ), компьютерной томографии (КТ) и магнитно-резонансной томографии (МРТ). В то же время недостаточно изучены этиология и патогенез ЭОП, что, несомненно, влияет на обоснованность и эффективность различных методов лечения.
Ключевые слова
Для цитирования:
For citation:
ЭОП — патологическое изменение органа зрения, клинически характеризующееся в разной степени выраженными экзофтальмом и ограничением подвижности глазных яблок. При ЭОП происходит утолщение ретробульбарных мягких тканей и мышц орбиты. Ранее считалось, что ЭОП — проявление диффузного токсического зуба (ДТЗ), один из его симптомов. В настоящее время эта концепция пересмотрена. ЭОП диагностируют как при ДТЗ (причем поражение глаз может возникать задолго до появления ДТЗ или после медикаментозного или хирургического его лечения), так и при хроническом аутоиммунном тиреоидите, а также у лиц без признаков заболеваний щитовидной железы (эутиреоидная болезнь Грейвса). Поэтому многие авторы считают неправомочными термин ’’эндокринная офтальмопатия”, предлагая заменить его на термин "аутоиммунная офтальмопатия", тем самым подчеркивая самостоятельность заболевания [3]. Однако мы будем пользоваться наиболее употребимым в литературе и в практике клинической эндокринологии термином "эндокринная офтальмопатия".
Этиология и патогенез. Клинические проявления
В литературе обсуждается патогенетическая связь ЭОП с патологическими изменениями в щитовидной железе. В качестве возможного механизма рассматривается перекрестное реагирование антител к ткани щитовидной железы с мышцами орбиты, наиболее часто встречающееся при ДТЗ [3, 5]. На это указывают частое сочетание двух заболеваний (в 90—91% случаев при ЭОП диагностируют ДТЗ), наличие утолщения или отека мышц орбиты при МРТ у всех больных с ДТЗ, спонтанные ремиссии офтальмопатии при достижении медикаментозного или хирургического эу- тиреоза. Практически одновременное развитие гипертиреоза и офтальмопатии у большинства пациентов может свидетельствовать в пользу единого для обоих заболеваний патогенетического фактора, скорее всего, единых иммунологических механизмов. Перекрестным реагированием тиреоидных антител с мышцами орбиты можно объяснить корреляцию между тяжестью гипертиреоза и поражения глаз. При ЭОП, как при аутоиммунном процессе в щитовидной железе, отмечается повышенный титр антител к анти-ос-галактозе [2].
По мнению других авторов, ЭОП — самостоятельное аутоиммунное заболевание с преимущественным поражением ретробульбарной клетчатки и глазодвигательных мышц. ДТЗ и ЭОП имеют разную иммуногенетическую природу: корреляция между титром антител к аутоантигенам глазодвигательных мышц и титром тиреоидных антител отсутствует. Маркером ЭОП служат антитела к мембранам глазодвигательных мышц (антитела к белкам с мол. массой 35 и 64 кД, антитела, стимулирующие рЬст миобластов, а также иммуноглобулины М и G) [2], маркером ДТЗ — антитериоидные антитела [5]. Однако у многих больных ЭОП антитела к глазодвигательным мышцам не выявляются. Поэтому правомочна гипотеза об участии в патогенезе заболевания антител к фибробластам соединительной ткани орбиты. Доказано, что и в норме в соединительной ткани и мышцах орбит имеются только Т-лимфоциты CD8 по сравнению со скелетными мышцами, в которых CD4 и CD8 содержатся в равных соотношениях. Кроме того, в мышцах орбиты имеется больше макрофагов и сосудов, чем в мышцах другой локализации [2]. Возможно, фибробласты орбиты имеют собственные антигенные детерминанты, которые и распознает иммунная система.
Кроме соединительной ткани, в патологическом процессе могут участвовать эндотелий сосудов и жировая ткань орбиты [2]. В них выявлены молекулы эндотелиальной адгезии лимфоцитов 1, молекулы сосудистой адгезии лимфоцитов 1, межклеточные молекулы адгезии 1 и антигены системы HLA. Активация антигенных детерминант происходит под действием медиаторов воспаления, что в свою очередь привлекает в очаг иммунного воспаления лимфоциты. Межклеточные молекулы адгезии 1 повышают экспрессию генов системы HLA на поверхности фибробластов, что приводит к повышению активности Т-хелперов и запускает реакции клеточного иммунитета в ретробульбарной соединительной ткани.
Предполагается, что к ЭОП существует генетическая предрасположенность. При исследовании популяции венгров выявлено, что при ЭОП отмечается наличие специфических HLA-антигенов, чаще всего HLA-B8. ДТЗ в этой популяции ассоциирован с HLA В8, DR3, DR7. При обследовании пациентов с ЭОП из других популяций обнаружена корреляция заболевания с иными антигенами. Например, у японцев при эутиреоидной болезни Грейвса выявлено повышение содержания Dpw2, причем при ДТЗ с ЭОП отмечено снижение уровня этого антигена. Однако гетерогенность иммунологических маркеров в различных популяциях позволяет предположить, что генетические факторы оказывают меньшее влияние на развитие заболевания, чем факторы окружающей среды [5].
Риск развития ЭОП повышается при наличии эритроцитарных Р-антигенов (группа крови системы Р). Р-антигены экспрессируются не только на эритроцитах, но и на фибробластах, в том числе и ретробульбарных.
На ризвитие ЭОП влияют и другие причины. Отмечен параллелизм между тяжестью ЭОП и курением, что связывают с иммунотропным и зобогенным действием никотина. Иммунотропное действие никотина заключается в угнетении активности Т-лимфоцитов, повышении активности острофазовых белков, компонентов комплемента, интерлейкина-1. У курильщиков повышен уровень тиреоглобулина, что может свидетельствовать о деструкции щитовидной железы тиоцианатами табачного дыма. Это приводит к повышению уровня аутоантигенов щитовидной железы, прогрессированию аутоиммунного процесса и перекрестному реагированию с тканями орбиты [5].
В качестве возможного этиологического фактора рассматривается ионизирующая радиация, которая приводит к высвобождению аутоантигенов щитовидной железы, повышению содержания аутоантител с перекрестным реагированием или активизации Т-лимфоцитов. В литературе есть указания на большую вероятность прогрессирования поражений глаз при лечении тиреотоксикоза радиоактивным йодом по сравнению с терапией ти- реостатиками или с оперативным лечением. Однако большинство американских исследователей не отмечают прогрессирования или увеличения частоты возникновения ЭОП после лечения ДТЗ радиоактивным йодом.
На рис. 1 представлен патогенез ЭОП. Под действием пусковых механизмов, возможно, вирусной или бактериальной инфекции (ретровирусы, Yersinia enterocolitica), токсинов, курения, радиации, стресса у генетически предрасположенных лиц на мембранах экстраокулярных мышц и других тканей орбиты экспрессируются аутоантигены [4].
При ЭОП имеется парциальный антигенспеци- фический дефект Т-супрессоров. Это делает возможным выживание и размножение клонов Т-хелперов, направленных против аутоантигенов щитовидной железы и орбиты. Дефект иммунологического контроля усугубляется при гипертиреозе (уменьшение количества Т-супрессоров обнаружено при декомпенсированном ДТЗ). При ДТЗ уменьшается также активность естественных киллеров, что приводит к синтезу аутоантител В-клет- ками, которые могут перекрестно реагировать с тканями орбиты. В ответ на появление аутоантигенов Т-лимфоциты и макрофаги инфильтруют мышцы орбиты, высвобождая цитокины. К цитокинам относятся интерлейкин-1, фактор некроза опухолей, у-интерферон, трансформирующий фактор роста р, тромбоцитассоциированный фактор роста, инсулиноподобный фактор роста 1 (ИФР-1) [5].
Цитокины стимулируют пролиферацию фибробластов ретробульбарного интерстиция, выработку коллагена и гликозаминогликанов. Гликозаминогликаны с белками образуют протеогликаны,
Рис. 1. Патогенез ЭОП.
ТО — ткани орбиты, ЩЖ — щитовидная железа, CD4 — Т-лимфоцит-хелпер, CD8 — Т-лимфоцит-супрессор/киллер, Вл-В-лимфоцит, ЕК — естественные киллеры, Rp — собственные рецепторы Т-лимфоцитов, Rp ТТГ-рецептор к ТТГ, МА — молекулы адгезии, Y — иммуноглобулины, продуцируемые В-лимфоцитами.
способные связывать воду и вызывать отек мягких тканей орбиты [2].
Отек ретробульбарной клетчатки и экстраокулярных мышц вызывает протрузию глазного яблока, что может приводить к недостаточному смыканию глазных щелей с утратой защитной функции век. Возникают боль, слезотечение, светобоязнь. По мере прогрессирования процесса нарушается венозный отток, что приводит к хемозу и периорбитальному отеку. При сдавлении зрительного нерва возникают нечеткость изображения, нарушение восприятия цвета, изменение полей зрения, отек соска зрительного нерва. Развивается фиброз экстраокулярных мышц, что может привести к диплопии. При ЭОП моджет быть как двусторонний, так и односторонний экзофтальм, хотя последний встречается реже [3].
Единой общеклинической классификации ЭОП нет. Из предложенных в настоящее время наиболее известны следующие.
В. Баранов и В. Потин различают 3 степени ЭОП:
- Небольшой экзофтальм (15,9 ± 0,2 мм), припухлость век без изменения конъюнктивы и выраженных нарушений глазодвигательных функций.
- Умеренный экзофтальм (17,9 ± 0,2 мм), отек и инфильтрация век без изменений конъюнктивы, умеренное нарушение функций глазодвигательных нервов, диплопия, ощущение песка в глазах, слезоточивость, боли при движении глазных яблок.
- Выраженный экзофтальм (22,8 ± 0,2 мм), неполное закрытие глазной щели, резкое ограничение подвижности глазных яблок, стойкая выраженная диплопия, изъязвление роговицы, признаки атрофии зрительных нервов.
Следует отметить, что величина экзофтальма не может служить достоверным диагностическим тестом, так как в норме выпуклость глазных яблок варьирует от 12 до 22 мм.
А. Бровкина и соавт. (1985 г.) выделяют 3 формы офтальмопатии:
- Тиреотоксический экзофтальм: незначительная протрузия глазных яблок, ретракция верхнего века (симптом Кохера), отставание верхнего века при опускании глаз (симптом Грефе), тремор закрытых век (симптом Розенбаха), блеск глаз (симптом Краузе), недостаточность конвергенции (симптом Мебиуса), некоторое недоведение глазных яблок кнаружи.
- Отечный экзофтальм (25—29 мм и более): отек периорбитальных тканей: протрузия глаз (чаще двусторонняя), резко выражены симптомы Грефе и Мебиуса, ограничение подвижности глазных яблок, диплопия. По мере прогрессирования процесса наступают полная офтальмоплегия, не- смыкание глазных щелей (лагофтальм), нарастают боли в орбите, изъязвления роговицы, белый хемоз конъюнктивы, переходящий в красный, застойные диски зрительных нервов с последующей атрофией, венозный стаз. Может иметь место ретробульбарный неврит со снижением остроты зрения, развитием центральной скотомы, нарушением восприятия зеленого цвета. С учетом морфологических изменений в клетчатке выделяют 3 стадии отечного экзофтальма: 1) клеточная инфильтрация, 2) переход в фиброз, 3) фиброз.
- Эндокринная миопатия начинается со слабости чаще верхней прямой и наружной прямой глазодвигательных мышц, что приводит к диплопии и ограничению отведения глаз кверху и кнаружи, развиваются косоглазие, отклонение глазного яблока книзу. Глазодвигательные мышцы утолщаются и уплотняются; прогрессируют их коллагеновая пролиферация, атрофия и жировая инфильтрация. Протрузия глаза и патологические изменения роговицы нехарактерны.
Используемая в зврубежной литературе классификация NOSPECS (табл. 1), впервые предложенная в 1969 г. Вернером и усовершенствованная в 1997 г., наиболее полно и объективно отражает состояние глазного яблока. Оценку может проводить не только офтальмолог, но и эндокринолог при помощи простых неинвазивных методов [4].
Кроме того, предложен индекс активности ЭОП [4]: 1) спонтанные боли в глазнице, 2) боли при движении глаз, 3) покраснение век, 4) отек век, 5) инъекция конъюнктивы, 6) хемоз, 7) отек соска зрительного нерва.
Для более полной оценки и стандартизации данных, полученных при обследовании больного, предложена стандартная форма диагностики (табл. 2). При помощи этой формы можно проводить сопоставление, анализировать данные, полученные в различных клиниках [4].
Радиойодтерапия болезни Грейвса как фактор риска эндокринной офтальмопатии
Еще в 1973 и 1976 гг. R. Wasnich и R. Jackson описали 2 случая эндокринной офтальмопатии (ЭО), возникшей после наружного облучения передней поверхности шеи по поводу опухоли (лимфомы Ходжкина). Дальнейшие наблюдения показали, что лечение болезни Грейвса (БГ) радиоактивным йодом ( 131 I) способно ухудшать течение ЭО. Так, L. De Groot и соавт., наблюдая за 264 пациентами после облучения 131 I по поводу БГ, обнаружили прогрессирование ЭО у 4% больных после 1-го курса терапии и у 12% — после последующих сеансов.
L. Bartalena и соавт. констатировали появление или значительное прогрессирование ЭО у 15% из 150 больных, леченных 131 I. В то же время на фоне терапии глюкокортикоидами (ГК) ухудшение течения ЭО отмечалось только у 10% больных. В других исследованиях показано, что прогрессирование ЭО после лечения 131 I без назначения ГК наблюдалось в 18—30% случаев. Наряду с этим существует мнение, что 131 I не влияет на частоту появления клинических симптомов в орбите, и к прогрессированию глазных симптомов приводит не облучение, а гипотиреоз, возникший после него. Связь между лечением и появлением или прогрессированием ЭО не ясна. Тем не менее имеются данные о неблагоприятном воздействии повышенного уровня антител к рецептору тиреотропного гормона (ТТГ) в сыворотке крови после обучения 131 I на течение ЭО.
Настоящий обзор посвящен обзору представленной проблемы.
Радиотерапия
Радиотерапия — использование с лечебной целью излучений естественных и искусственных радиоактивных веществ. Вскоре после открытия радиоактивности было обнаружено ее биологическое действие, а в 1901 г. французские врачи Е. Benie и A. Danlo применили излучение с лечебной целью. В зависимости от локализации болезненного процесса и его характера для лечебных воздействий используют а-, р- и у-излучение. у-Излучение характеризуется малой проникающей способностью и высокой относительной биологической эффективностью, используется в лучевой терапии. р-Излу- чение представляет собой поток электронов или позитронов, обладающих ионизирующими свойствами, используется в радиоизотопной диагностике и лучевой терапии. у-Излучение так же, как и рентгеновское, является электромагнитным излучением, но возникает при распаде радиоактивных изотопов, обычно “Со, l 37 Cs или 226 Ra [4]. Действие ионизирующего излучения связано с образованием свободных радикалов в среде микроокружения клеток. Свободные радикалы и оксиданты взаимодействуют с молекулами ДНК, вызывая большое количество разнообразных нарушений ее структуры. Это ведет к дефектам восстановительных функций клетки и, в конце концов, к ее гибели. Во всех случаях применения лучевой терапии в медицине радиационное воздействие направлено на повреждение опухоли или избыточной массы ткани при сохранении окружающих здоровых тканей [6].
Несмотря на более чем полувековой опыт применения 13 Ч, не существует общепринятого алгоритма определения эффективной дозы |3| 1 [36]. Проведены многочисленные исследования по определению оптимальной дозы изотопа с целью предупреждения развития перманентного гипотиреоза. При этом использовали различные режимы: низкие дозы (80 МБк), фиксированные дозы (185, 370 и 555 МБк) [35] и дозы, рассчитанные на основе размера щитовидной железы (ЩЖ) и уровня захвата 13| 1 [44, 61]. Использование дозы радиоизотопа, пропорциональной размеру ЩЖ, теоретически повышает вероятность излечения. Кроме того, измерение уровня захвата изотопа тканями ЩЖ позволяет выявлять пациентов с максимальным и минимальным захватом |3| 1, что помогает предсказать неудачный исход терапии 13 'I [47]. Несмотря на преимущество индивидуально рассчитанных доз, увеличения частоты излечения по сравнению с фиксированными дозами не наблюдалось [44]. Более того, не существует четких доказательств преимущества индивидуально рассчитанных доз над режимом фиксированных доз в развитии постлучевого гипотиреоза, ценой меньшей лучевой нагрузки [65], поэтому многие центры используют фиксированную дозу [41]. Согласно заключению A. Es- fahani и соавт. [30], фиксированная доза 370 МБк оптимальна относительно стоимости лечения, его продолжительности и частоты посещения пациентом клиники (психологический фактор). У пациентов моложе 20 лет, имеющих зоб большого размера, высокий исходный уровень тироксина, и увеличенное время захвата йода, а также у больных, получавших тиреостатики, отмечается более низкий процент успешной терапии, поэтому Е. Alexander и Р. Larsen [8] считают, что фиксированная доза для лечения таких больных должна быть больше или равна 402 МБк, однако и при такой дозе результат неуспешного лечения составляет 5—10%.
Введенный в организм 13| 1 избирательно поглощается ЩЖ. Это свойство используется при лечении БГ и дифференцированного рака ЩЖ. Разрушающее действие 131 I на ткань ЩЖ оказывают 0- частицы, которые обладают небольшой длиной пробега в тканях (90% энергии распада 0-частиц в тиреоидной ткани поглощается в пределах 1 — 2 мм). у-Кванты, испускаемые 13| 1, не оказывают заметного биологического действия (из-за своей высокой проникающей способности), но позволяют следить за местопребыванием и количеством 131 I в организме [3].
Целью лечения БГ [2] является достижение эутиреоидного или гипотиреоидного состояния путем разрушения ткани ЩЖ. Несмотря на то что метод является высокоэффективным, A. Allahaba- dia и соавт. [9] показали, что невозможно рассчитать индивидуально дозу, позволяющую достичь эутиреоидного состояния.
Течение ЭО после радиойодтерапии
Данные о воздействии 13| 1 на течение ЭО противоречивы. В ряде исследований показано, что |3, 1 не влияет на прогрессирование заболевания [37], однако результаты других работ противоречат таким заключениям [17, 59]. Следует отметить, что большинство проведенных исследований были ретроспективными и нерандомизированными, с недостаточным контролем. Кроме того, в них использовались разные методы оценки патологии органа зрения [17].
Результаты рандомизированных исследований более однородны: прогрессирование ЭО наблюдается в 15—37% случаев [17]. В исследованиях L. Bartalena и соавт. [12] прогрессирование ЭО отмечено у 35% больных, получавших 13| 1, и отсутствовало у пациентов, получавших помимо 131 I терапию ГК. Более того, в группе больных, получавших ГК, было выявлено улучшение состояния органа зрения. Более крупное исследование, проведенное L. Tallstedt и соавт. [62], показало, что частота прогрессирования ЭО выше после лечения |3| 1 (33%), чем после тиреоидэктомии (16%) и терапии тиреостатиками (10%).
М. Gupta и соавт. [38] исследовали влияние |3| 1 на изменение объема экстраокулярных мышц с помощью магнитно-резонансной томографии орбит и экзофтальмометрии по Гертелю. Результаты исследования показали, что 131 I не повышает риск возникновения или развития ЭО.
Патогенез '^-ассоциированной офтальмопатии
Предполагается, что прогрессирование ЭО после лечения |31 1 связано с выбросом антигенов из поврежденной радиацией ткани ЩЖ с последующей активацией аутоиммунных реакций, направленных против идентичных антигенных детерминант ЩЖ и орбиты [12]. Терапия |3| 1 приводит к выбросу компонентов тиреопероксидазы в кровяное русло [55] и сопровождается повышением активности антител к рецептору ТТГ [32]. Кроме того, после курса 131 I отмечается активация Т-лимфоцитов крови [64] и усиленная продукция тиреоидных антител в течение последующих 2 лет [7].
Несмотря на то что однократное введение |3 Ч, возможно, связано с риском ухудшения течения ЭО, повторное введение 131 I в организм пациента, по некоторым данным, способно оказать на него положительное влияние за счет снижения уровня антигенов ткани ЩЖ и удаления интратиреоидных активированных Т-лимфоцитов [19].
Рекомендации по проведению радиойодтерапии, принятые Европейской группой врачей по изучению офтальмопатии Грейвса (EUGOGO) 2007
По объединенным данным EUGOGO, после терапии |31 1 примерно у 15% пациентов ЭО прогрессирует [15], что предполагает наличие факторов риска, этому способствующих.
- Прогрессирование ЭО было отмечено в 23% случаев у курильщиков и только в 6% случаев — у некурящих пациентов [16].
Другим фактором риска является тяжесть тиреотоксикоза до начала лечения, так как ЭО выражена у лиц с более высокой концентрацией тиреоидных гормонов.
- Высокий уровень трийодтиронина [62], антител к рецептору ТТГ [28, 50] также повышает риск прогрессирования ЭО после терапии 131 I.
Кроме того, прогрессирование ЭО чаще наблюдается у больных с несвоевременной компенсацией гипотиреоза.
- Раннее назначение пациенту левотироксина, не позднее чем через 2 нед после 131 I (при условии его назначения в достаточной активности), снижает частоту ухудшения или возникновения ЭО [63].
- Пациентам при среднетяжелом течении БГ рекомендуется проведение терапии 131 I на фоне ГК (преднизолон в таблетках в дозе 0,5 мг на 1 кг массы тела в течение 1 мес с постепенным снижением дозы в течение 3 мес до полной отмены).
Необходимость назначения больным с минимальными проявлениями ЭО (компенсированная ЭО, отсутствие ухудшения в предшествующие 2—3 мес, отсутствие хемоза) обсуждается.
Р. Perros и соавт. [58] считают, что 13| 1 не вызывает прогрессирования ЭО в этой группе пациентов, если у них не допускается развитие гипотиреоза. По мнению авторов, таким больным не показана превентивная терапия ГК, но необходимо предупреждение гипотиреоза.
Противоположного мнения придерживаются В. Dederichs и соавт. [25], которые полагают, что ГК в малых дозах показаны даже при отсутствии симптомов ЭО на начало проведения терапии 131 I.
У больных с тяжелой ЭО лечение 131 I следует осуществлять после введения высоких доз ГК и/ или радиотерапии орбит, или хирургической декомпрессии орбит [14].
Факторы риска развития ЭО
Курение. У пациентов с БГ серьезным фактором риска для развития ЭО является курение [69].
Согласно данным метаанализа, проведенного Р. Vestergaard [69], курильщики с БГ подвержены развитию ЭО в 4 раза чаще некурящих.
- Риск развития ЭО прямо пропорционален количеству выкуриваемых сигарет, причем при отказе от курения риск снижается [21]. Кроме того, показано, что курение повышает риск прогрессирования ЭО после лечения 131 I [15].
- Во многих работах отмечены больший процент курящих среди больных со всеми аутоиммунными заболеваниями ЩЖ и увеличение его среди больных ЭО [17, 27, 48].
- Тем не менее связь между количеством выкуриваемых сигарет и тяжестью ЭО остается спорной. Наряду с отсутствием данных о влиянии числа выкуриваемых сигарет на течение заболевания [15], имеются свидетельства об утяжелении ЭО при курении [43]. Также отмечено, что курение влияет на эффективность как лечения БГ 131 I, так и лучевой терапии орбиты и терапии ГК [37].
- Прекращение курения — обязательное условие перед началом лечения тиреотоксикоза и ЭО, особенно для женщин [13, 69].
Механизм действия табачного дыма на течение ЭО не ясен, но есть основание предполагать, что курение ассоциировано с повышением уровня тиреоглобулина [57] и развитием гипоксии в тканях, в том числе и орбитальных, что индуцирует дополнительное освобождение цитокинов [15]. R. Utiger [67] полагает, что табачный дым влияет на структуру рецептора ТТГ, делая его более иммуногенным у курящих.
Пол. Согласно данным G. Bartley и соавт. [18], женщины болеют ЭО в 5 раз чаще мужчин, но это, видимо, лишь отражает тот факт, что женщины более подвержены БГ. Мужчины в возрасте старше 60 лет имеют более тяжелые формы заболевания [54].
Беременность. У беременных, особенно во II и III триместрах, даже в период ремиссии тиреотоксикоза меняется уровень цитокинов ТЫ- и Th2- профиля [45], что, по некоторым данным, повышает вероятность возникновения ЭО. Симптомы ЭО могут появляться и в III триместре [1].
Использование тиреостатиков при проведении радиойодтерапии
В мировой клинической практике накоплен большой опыт назначения антитиреоидных средств до или после проведения терапии 131 I. Однако отсутствует единое мнение относительно влияния тиреостатиков на исход лечения |3| 1 и продолжительность достигнутого эффекта. В некоторой степени это связано с ретроспективной оценкой, неоднородностью выборки пациентов и вероятностью того, что антитиреоидная терапия проводилась лишь пациентам с более тяжелым тиреотоксикозом, разными режимами применения 131 I и отсутствием исследования уровня тиреоидных гормонов и ТТГ до лечения. Последнее важно, поскольку передозировка тиреостатиков влияет на кинетику йода с потенциальным риском снижения эффективной дозы 13| 1, удерживаемой в ткани ЩЖ
У пожилых пациентов с тяжелым тиреотоксикозом общепринятым является достижение эутиреоидного состояния до терапии 131 I с целью предупреждения обострения тиреотоксикоза из-за возможного выхода большого количества тиреоидных гормонов в кровь из разрушенной ткани ЩЖ [23]. Однако в литературе приведены данные о том, что уровень тиреоидных гормонов не повышается после лечения 131 I без применения тиреостатиков
Антитиреоидная терапия, которую заканчивают незадолго до введения 131 I, не предупреждает транзиторного увеличения уровня тиреоидных гормонов в сыворотке крови, однако такое повышение клинически практически не проявляется, если добиться нормального уровня этих гормонов до отмены тиреостатиков [20]. В исследованиях R. Mole и соавт. [53] и A. Forssberg [34] было показано, что антитиреоидные препараты из группы тиомочевины так же, как и другие вещества, содержащие сульфгидрильные (-SH) группы, являются радиопротекторами, снижая летальность у подвергшихся радиации лабораторных животных и бактерий. Ра- диопротективным эффектом пропилтиоурацила можно объяснить значительное (28,6%) снижение эффективности 131 I у пациентов, которые принимали препарат за 7 дней до введения |3 Ч, по сравнению с больными, не получавшими антитиреоидные препараты (только в 75,5% случаев) [24]. В другом исследовании было показано, что наибольший процент низкой эффективности 131 I был у пациентов, продолжавших прием антитиреоидных препаратов во время лечения 131 I [29]. В более поздних исследованиях установлено, что радиопротектив- ный эффект пропилтиоурацила сохраняется в течение 7—55 дней после окончания приема антитиреоидных препаратов [66].
Очевидно, что пропилтиоурацил приводит к относительной резистентности тканей ЩЖ к |31 1. В случае, если прием пропилтиоурацила не был прекращен как минимум за 2 нед до начала терапии 131 I, следует применять большие дозы изотопа с целью преодоления радиорезистентности.
Введение |3| 1 больным с БГ ассоциировано с транзиторным повышением уровня антител к рецепторам ТТГ [22, 54]. В литературе обсуждается возможный иммуносупрессивный эффект антитиреоидных препаратов на продукцию антител к рецепторам ТТГ [22, 71]. Некоторые исследования показали что метимазол влияет на продукцию антител к рецепторам ТТГ, снижая их концентрацию [50].
- ATdrade и соавт. [10] установили, что снижение базального уровня антител, вызванное метима- золом до начала терапии 131 I, снижает 13| 1-индуци- рованное повышение уровня антител. Клиническое значение увеличения уровня антител после применения |31 1 остается невыясненным. L. Chio- vato и соавт. [22] предположили, что повышение уровня антител после терапии 131 I вызвано высвобождением молекул рецепторов ТТГ из разрушенных фолликулярных клеток. Поскольку рецепторы к ТТГ являются мембранными белками, 131 I-инду- цированное повышение уровня антител к ним является маркером разрушения клеток и, возможно, благоприятным прогностическим фактором при лечении 131 I. A. Kung и соавт. [50] исследовали влияние введения метимазола до 131 I на прогрессирование ЭО. Согласно их данным, несмотря на то что метимазол предупреждает повышение уровня антител после |3| 1, это не влияет на течение ЭО.
Исследования о влиянии на исход лечения антитиреоидными средствами, проводимого после 131 I, менее многочисленны. Было показано, что высокий уровень свободного Т4 через 1 мес после назначения 131 I и/или необходимость временного назначения пациенту тиреостатической терапии сопряжены с высоким риском рецидива тиреотоксикоза [5].
Заключение
Эндокринная офтальмопатия — ассоциированное с БГ самостоятельное аутоиммунное заболевание, которое значительно снижает качество жизни пациента и в тяжелых случаях ведет к потере зрения. Перспективным методом лечения БГ является терапия 131 I. Однако его использование ограничено в связи с мнением многих авторов о том, что 131 I способствует прогрессированию офтальмопатии. В данной статье проведен обзор имеющихся исследований о влиянии терапии 131 I на течение ЭО. Согласно обзору литературы, мнения авторов на проблему не совпадают, что, вероятно, вызвано разной методологией исследований, разными подходами к диагностике офтальмопатии, определению тяжести и активности процесса, отсутствием общепринятой классификации. В настоящее время основным методом лечения тиреотоксикоза при БГ большинство исследователей признают применение 131 I, однако с целью снижения возможного риска прогрессирования офтальмопатии или ее возникновения рекомендуют проводить терапию ГК.
Читайте также:
