Материматическая модель респираторного тракта. Дыхательный контур в уравнении
Добавил пользователь Skiper Обновлено: 08.01.2026
Использование двух типов датчиков обеспечивает необходимые звуковые и световые тревоги при несоответствии установок респиратора и действительных параметров вентиляции пациента. Датчики обеспечивают получение респиратором информации, необходимой для функционирования звуковых и световых тревог. Самые важные тревоги следующие:
1. ограничение максимального давления в дыхательных путях (P max),
2. контроль максимальной частоты дыхательных движений (f max)
3. контроль минимальной величины дыхательного объема (VT min).
Основная задача датчика потока - анализ выдыхаемого воздуха. Датчик измеряет величину потока, затем микропроцессор респиратора интегрирует этот показатель и вычисляет объем выдыхаемого больным воздуха. Последний должен соответствовать объему, установленному врачом на панели респиратора и вдуваемому в легкие пациента. Основное предназначение датчика давления - контроль этого параметра в дыхательных путях больного для предупреждения баротравмы и утечек воздуха.
Помимо этого, благодаря информации, которую получает респиратор от датчиков потока и давления, аппарат осуществляет процесс отклика на дыхательную попытку больного. Этот отклик называется триггированием, а устройство, которое обеспечивает отклик триггером. Триггер (англ. trigger) означает спусковой крючок.
Существует два типа триггера - по потоку и давлению. Триггер по потоку реагирует на изменения потока воздуха в дыхательном контуре, триггер по давлению - на изменения давления в дыхательных путях при попытке больного совершить вдох. Он может располагаться по отношению к больному проксимально и дистально (см. рис. 1.2 б). Триггер по потоку чувствительнее такового по давлению (рис. 1.5). Кроме того, проксимальный триггер по давлению чувствительнее дистального.
Помимо указанных двух характеристик триггера есть еще одна, не менее важная - время отклика на дыхательную попытку больного. Она обычно не указывается компанией-производителем, поэтому необходимую информацию приходится искать в работах независимых исследователей. В разных моделях респираторов это время составляет от 100 до 500 мс. В ряде аппаратов ИВЛ низкое время отклика реализуется с помощью двух датчиков потока - на вдохе и на выдохе (рис.1.6). Через контур респиратора подается небольшой постоянный, базовый, поток 3-5 л/мин, который проходит мимо больного. Показания датчиков сравниваются респиратором. Если датчик на выдохе регистрирует тот же поток, что и датчик на вдохе, то респиратор понимает, что дыхательных попыток нет. Если больной делает попытку вдоха, то часть базового потока попадает в дыхательные пути. Датчик потока на выдохе регистрирует уменьшение базового потока, что является сигналом для триггирования и подачи механического вдоха.
В некоторых современных респираторах потоковый триггер функционирует без базового потока. Респиратор просто подготавливает поток свежего газа, а при появлении попытки вдоха подает его дыхательные пути. Для функционирования описанной системы должны быть соблюдены высокие технические требования к чувствительности триггера.
5.3. Мониторинг дыхания (респираторный мониторинг).
Понятие респираторного мониторинга включает мониторинг газообмена, а также мониторинг механики легких и грудной клетки.
5.3.1.Мониторинг газообмена
Мониторинг газообмена подразумевает анализ газового состава артериальной и венозной крови, а также выдыхаемого воздуха. Для оценки адекватности газообмена имеет значение определение рН, концентрации бикарбонатов и величины анионного провала. С дидактической точки зрения, можно разделить мониторинг газообмена на мониторинг оксигенации и мониторинг вентиляции.
Мониторинг оксигенации
При проведении мониторинга оксигенации врач должен получить ответы на три вопроса:
•Сколько кислорода может быть доставлено к тканям?
•Какой ценой достался этот кислород организму?
•Как его усвоили ткани?
Для ответа на первый вопрос оценивают напряжение кислорода (рaО2) и насыщения (сатурации) гемоглобина кислородом в артериальной крови (SaО2). Зная эти величины, по формуле рассчитывают содержание кислорода в артериальной крови (Cа - content arterial)
Cа = (0,00138 × SatО2 × Hb) + (0,003 × рa О2)
Умножая эту величину на величину сердечного выброса (CO - cardiac output), измеренного, например, методом термодилюции, можно рассчитать доставку кислорода (DО2 - delivery of oxygen) к тканям:
Не зная, какую долю сердечного выброса получает каждый отдельный орган (например, мозг), нельзя подсчитать, какое точное количество кислорода ему достается.
Для ответа на второй вопрос сравнивают напряжение кислорода в артериальной крови (рaО2) и в воздухе альвеол (РАО2). Величину РАО2 можно или измерить прямо, или рассчитать из так называемого уравнения альвеолярного газа. Прямое измерение возможно при помощи метода быстрой оксиметрии. При использовании этого метода непрерывно измеряют напряжение кислорода во вдыхаемом и выдыхаемом газе. Приборы, предоставляющие возможность измерения этих показателей, обладают низкой инерционностью, оцениваемой по очень быстрому времени отклика (600 мсек и менее).
Для определения РАО 2 интерес представляют конечные порции выдыхаемого газа, то есть фактически газ, выдыхаемый из альвеол. Эффективность обмена кислорода оценивается на основе расчета альвеолоартериального градиента по кислороду:
Р(А- а)О2
Этот показатель имеет нелинейный характер даже у здорового человека и зависит от содержания кислорода во вдыхаемой смеси (FiО2.): при дыхании воздухом он равен 10, при дыхании 100%-ным кислородом - около 100. Кроме того, он зависит от нарушений вентиляционно-перфузионных отношений и изменений венозной сатурации.
Для оценки эффективности кислородообмена большее практическое значение имеет расчет индексов оксигенации. Один из наиболее часто используемых индексов рассчитывается как частное от деления напряжения кислорода в артериальной крови к процентному содержанию кислорода во вдыхаемой смеси, выраженному в долях единицы:
рaО2 / FiО2
В норме этот показатель превышает 350-400 мм рт.ст. Снижение его ниже 300 мм рт.ст. является признаком острого повреждения легких, ниже 200 мм рт.ст. - острого респираторного дистресс-синдрома.
Расчет РАО 2 возможен с помощью уравнения альвеолярного газа, которое с этой целью используется в упрощенном варианте.
Немного физиологии
Уравнение альвеолярного газа в полной его форме представляет собой следующее математическое выражение:
РАО2 = РIО2 - (PAСО2 /RQ) +(PAСО2 × FiО2 × (1 - RQ)/RQ),
где РАО2 - напряжение кислорода в альвеолярном газе, PAС О2 - напряжение углекислоты в альвеолярном газе, РIО2 - напряжение кислорода во вдыхаемом воздухе, FiО2 - доля кислорода во вдыхаемом воздухе, RQ - респираторный коэффициент (respiratory quotent).
Обычно это уравнение используют для расчета респираторного коэффициента, а не РАО2. Данный коэффициент зависит от сопряжения процессов потребления кислорода и выделения углекислоты периферическими тканями, что определяется характером использующихся нутриентов - белков, жиров или углеводов. Он самый высокий при использовании углеводов (1,0), самый низкий при преимущественном поступлении в организм жиров (0,7).
Напряжение кислорода во вдыхаемом воздухе рассчитывается следующим образом:
РIО2 = (барометрическое давление - 47) × FiО2
Величины РАО2 и PAСО2 измеряют прямо в конечно-выдыхаемых порциях дыхательной смеси (то есть в альвеолярном воздухе) методами капнографии и быстрой оксиметрии.
Используя уравнение альвеолярного газа, можно рассчитать респираторный коэффициент, то есть фактически поглощение кислорода и выделение углекислоты на единицу объема вдыхаемого и выдыхаемого воздуха. Сопоставив эти показатели с величиной минутного объема вентиляции, можно оценить величину потребления организмом энергии и подобрать эффективную нутритивную поддержку.
Если величину респираторного коэффициента считать неизменной в течение коротких промежутков времени, то уравнение альвеолярного газа упрощается:
РАО2 = РIО2 - (1,25 × PAСО2),
Измеряя конечно-выдыхаемые величины PAСО2, можно вычислить РАО2. Из этого уравнения следует, что в норме при дыхании воздухом РАО2 равно 100-110 мм рт.ст., при дыхании чистым кислородом - 550 мм рт.ст.
Для ответа на третий вопрос оценивают потребление кислорода и эффективность его обмена. Потребление кислорода может быть рассчитано при помощи прямого и обратного методов Фика.
При использовании прямого метода Фика необходимо измерение напряжения кислорода в воздухе альвеол (РАО2) с помощью метода быстрой оксиметрии. Зная напряжение кислорода во вдыхаемом воздухе (РIО2) и в выдыхаемом воздухе (РА О2), измерив минутный объем дыхания с помощью спирометрии, можно рассчитать количество поступившего в организм и оставшегося в легких кислорода. Вычитая из первой величины вторую, рассчитывают потребление кислорода.
При использовании непрямого метода Фика потребление организмом кислорода является производным сердечного выброса и разницы в содержании кислорода в артериальной (Cа) и венозной (Сv) крови
Содержание кислорода в венозной крови считают по той же формуле, что и Ca, только используют показатели напряжения кислорода и сатурации гемоглобина не в артериальной, а в венозной крови.
Сv = (0,003 х рvО2) + (0,00138 х SvО2 х Hb)
Напряжение кислорода в артериальной и венозной крови, а также сатурацию гемоглобина измеряют инвазивными и неинвазивными способами. При инвазивных способах возможна дискретная и непрерывная оценка. При дискретной оценке повторно исследуют кровь из артерии или вены в газоанализаторе. Для непрерывной оценки SvО2 используют фиброоптические катетеры. Чтобы определить потребление кислорода для всего организма, этот катетер устанавливают в легочную артерию, то есть в сосуд, содержащий смешанную венозную кровь от всего организма. Необходимо предостеречь от использования для анализа крови, взятой из периферической вены. Эта кровь отражает доставку и потребление кислорода только в том периферическом участке, от которого она оттекает, и не может служить средством оценки оксигенации венозной крови в целом. В отличие от венозной, артериальная кровь практически одинакова в любой артерии, и поэтому нет разницы, что анализировать - кровь из аорты, сонной или лучевой артерии.
Кроме описанных методов, возможно также чрескожное (транскутанное) определение р О2 (как впрочем и рСО2), при помощи специальных датчиков с прогреванием кожи под ними. Показания этих датчиков хорошо согласуются с прямым определением рО2 и рСО2 в артериальной крови у детей. Однако нет единого мнения исследователей в вопросе, можно ли метод применять у взрослых пациентов.
Для неинвазивной оценки сатурации гемоглобина артериальной крови используют пульсоксиметрию. Принцип пульсоксиметрии основан на пропускании через ткани пальца или мочки уха параинфракрасного излучения. Излучение частично проходит через ткани, частично задерживается оксигенированным гемоглобином. Величина поглощенного излучения непрерывно меняется с каждым пульсовым сокращением. Анализ этой изменяющейся величины составляет основу пульсоксиметрической оценки сатурации гемоглобина артериальной крови (рис. 5.16).
Измерение потребления и доставки кислорода позволяет оценить зависимость первого показателя от второго. В норме потребление не зависит от доставки. Однако если доставка снижается, то наступает определенный момент, когда потребление тоже начинает снижаться. В тканях постепенно прекращаются зависимые от кислорода процессы (цикл трикарбоновых кислот) и нарастает накопление лактата из-за незавершенного анаэробного гликолиза. Эти взаимоотношения отображаются характерной кривой (рис. 5.17). Большинство исследователей считает, что при сепсисе эта кривая смещается вправо, отражая нарушение утилизации кислорода тканями.
Для изучения указанных процессов нужны независимые методы оценки потребления кислорода (прямой метод Фика с использованием быстрой оксиметрии и спирометрии) и доставки кислорода (непрямой метод Фика с использованием термодилюции и анализа газового состава крови). В ряде научных исследований авторы пытаются получить информацию о доставке и потреблении, используя для измерения и того, и другого показателя только один непрямой метод. Такой подход является методологически неправильным, так как нельзя изучить зависимость или независимость этих двух показателей, сам процесс измерения которых (одним методом!) делает их зависимыми друг от друга.
Мониторинг вентиляции
Мониторинг вентиляции чаще всего сводится к анализу содержания углекислого газа в выдыхаемом воздухе с помощью капнографии и прямому определению напряжения СО2 в крови с использованием газоанализатора.
При проведении анализа содержания углекислого газа нужно соблюдать ряд методологических условий. Главное из них - необходимость определенного промежутка времени перед проведением анализа после изменения параметров вентиляции легких. В организме существуют большие резервуары углекислоты с различной емкостью и скоростью наполнения и высвобождения СО2. Это приводит к значительной отсрочке стабилизации уровня СО2 - через 10 мин после гипервентиляции и 40 мин после гиповентиляции (J.J. Marini, A.P. Wheeler, 1997).
Прямое определение рСО2 в артериальной крови производят обычно одновременно с определением рО2 при заборе проб артериальной крови. Динамический контроль напряжения углекислого газа можно проводить, используя пробы венозной крови, где рСО2 обычно выше на 3-8 мм рт.ст., чем в артерии. Для анализа берут кровь из центральной вены или легочной артерии, но не из периферической вены.
При анализе выдыхаемого газа концентрация СО2 чаще всего представляют в качестве функции времени, реже - функции объема выдыхаемого газа. Изменения СО 2 во времени менее информативны, однако позволяют оценить степень нарушения вентиляционно-перфузионных отношений по форме кривой, мониторировать ритм дыхания, определить наличие гипо- и гипервентиляции (рис. 5.18). При отсутствии изменений нормальной кривой можно оценить напряжение углекислого газа в артериальной крови (рaСО2) по его напряжению в конечно-выдыхаемых (end tidal) порциях альвеолярного воздуха (рETСО 2 ). В норме величина градиента рaСО 2 - рETСО 2 равна 3-8 мм рт.ст. При развитии грубых нарушений вентиляционно-перфузионных отношений (ТЭЛА, ОРДС, аспирации крови и желудочного содержимого в трахею) этот градиент значительно возрастает. Изменяется также форма кривой напряжения углекислого газа в конечно-выдыхаемом воздухе. Минимизация величины рaСО 2 - рETСО 2 может использоваться как метод подбора оптимального РЕЕР.
Более информативно представление концентрации СО 2 в качестве функции объема выдыхаемого газа. Это позволяет определить, кроме указанных показателей, также среднюю концентрацию СО 2 в выдыхаемом газе и рассчитать величину дыхательного мертвого пространства, соотнесенного с дыхательным объемом (рис. 5.19).
Мониторинг механических свойств легких и грудной клетки
Показатели, имеющие клиническое значение для оценки динамики легочных нарушений - податливость (compliance - С), сопротивление (resistance - R), среднее давление в дыхательных путях (mPaw) и аутоРЕЕР.
Податливость.
Податливость - это изменение объема (volume, V), соотнесенное к изменениям давления (pressure, P):
С = ∆V/ ∆P.
Различают податливость легких (СL), грудной клетки (СW) и респираторной системы (СRS), но на практике оценивают обычно только последний показатель. Для расчета величины ∆V при проведении ИВЛ следует учитывать потери части дыхательного объема (VT) в контуре респиратора. Для приблизительного расчета используют специальную величину - фактор компрессии дыхательного контура (circuit compression factor - Сcf). Для большинства дыхательных контуров она считается равной 3 мл кислородно-воздушной смеси на каждый сантиметр водного столба пикового давления, подаваемого респиратором при вдохе.
Для измерения податливости нужно «выключить» с помощью медикаментов спонтанное дыхание больного и измерить давление в дыхательных путях во время пауз вдоха и выдоха (создать так называемые пассивные условия). Для чего нужны эти паузы? Нас интересует давление во всей респираторной системе, но измерить можно только давление на конце интубационной трубки. Чтобы это измеряемое давление отражало показатели давления в альвеолах, в бронхах, трахее и у конца интубационной трубки, создаются короткие паузы в конце вдоха и выдоха. Вследствие этого величины давления в разных частях респираторной системы временно уравниваются. Податливость респираторной системы определяется следующим образом:
СRS = VT × Сcf / PplatoInsp - PplatoExsp,
где PplatoInsp - давление на плато вдоха (inspiration) в условиях окончания вдоха и остановки потока, PplatoExsp - давление на плато выдоха (expiration) в условиях окончания выдоха и остановки потока (рис. 5.20). Нижняя граница нормы для величины податливости системы грудная клетка-легкие - 120-150 мл/см вод. ст. или 1,5-2 мл/см вод.ст на 1 кг массы тела.
Для раздельной оценки податливости грудной клетки и легких необходимо дополнительное измерение давления в пищеводе, которое отражает внутриплевральное давление. В настоящее время средствами раздельной оценки податливости легких и грудной клетки снабжены некоторые современные аппараты ИВЛ, что позволяет оптимизировать проведение респираторной поддержки при тяжелых дыхательных расстройствах.
Сопротивление
Различают инспираторное сопротивление дыхательных путей и экспираторное. Экспираторное сопротивление всегда больше, чем инспираторное, причем эта разница возрастает при патологии. Однако на практике обычно оценивают только инспираторное сопротивление (рис. 5.21):
RI = PD - PplatoInsp /Flow,
где RI - инспираторное сопротивление, Flow - поток (обычно пиковый поток респиратора), PD - пиковое давление в дыхательных путях, PplatoInsp - давление на плато вдоха (в условиях окончания вдоха и остановки потока). Верхняя граница инспираторного сопротивления - 5 см вод.ст./л∙сек. Увеличение инспираторного сопротивления свидетельствует об ухудшении проходимости трахео-бронхиального дерева из-за бронхоспазма, отека, скопления мокроты.
Среднее давление в дыхательных путях
С некоторой долей упрощения можно считать, что среднее давление в альвеолах (alveolar mean pressure, mPalv) соответствует среднему давлению в дыхательных путях (airways mean pressure, mPaw). Среднее давление в альвеолах - это усредненное давление, которое растягивает альвеолы и грудную клетку. Следовательно, mPalv и mPaw определяют артериальную оксигенацию и сопротивление венозному возврату. Для клинических целей нужно понимать, что mPaw увеличивается при возрастании минутного объема дыхания, положительного давления в дыхательных путях в конце выдоха (positive end-expiratory pressure, РЕЕР) и времени вдоха. Эти факторы, с одной стороны, повышают оксигенацию, с другой - снижают венозный возврат и повышают опасность баро- и волюмотравмы легких.
АутоРЕЕР
АутоРЕЕР представляет собой разницу между общим (тотальным) РЕЕР и установленным врачом на панели респиратора показателем положительного давления в дыхательных путях к концу выдоха. Тотальный РЕЕР определяют по показаниям манометра респиратора в конце вдоха при создании экспираторной паузы. Наличие аутоРЕЕР свидетельствует о затруднении выдоха (рис. 5.22). Имеется две основные причины этого состояния. Первая причина - повышение сопротивления в дыхательных путях во время выдоха, вследствие чего вдох начинается при не полностью законченном выдохе. Такая ситуация вызывает постепенное нарастание количества воздуха, задержанного в легких - так называемую дыхательную гиперинфляцию (рис. 5.23). Вторая причина аутоРЕЕР - появление активности мышц вдоха во время не полностью закончившегося выдоха. Мышечная активность отражает несинхронность работы аппарата ИВЛ и дыхательных попыток больного.
Первую причину аутоРЕЕР можно компенсировать увеличением пикового потока вдоха на панели респиратора. Это приводит к укорочению времени вдоха и удлинению времени выдоха. В результате пациент успевает выдохнуть до того, как наступит новый вдох. Причиной гиперинфляции может быть нерациональное использование паузы вдоха, что вызывает избыточное удлинение фазы вдоха. Это состояние компенсируется при исключении паузы вдоха.
Во втором случае появление аутоРЕЕР свидетельствует о нерациональном подборе режимов вентиляции, причиной чего могут быть недостаточные минутный объем дыхания, чувствительность триггера, содержание кислорода во вдыхаемой смеси, аппаратный РЕЕР. Одним из способов подбора оптимального аппаратного РЕЕР является его постепенное повышение до того уровня, когда исчезает аутоРЕЕР.
Расчет податливости, сопротивления, среднего давления в дыхательных путях и аутоРЕЕР производится на основе анализа обычных кривых, отражающих изменение давления в дыхательных путях, объема и потока газа во времени: кривые «давление в дыхательных путях - время», «поток воздуха - время», «объем воздуха - время» (рис. 5.23) Современные респираторы позволяют получать информацию также в виде петель давление-объем (P-V-петля) и поток-объем (F-V-петля) (рис. 5.24).
Принципиально новой информации они не несут, но делают ее представление более наглядным. Например, появление характерного «клюва» на петле давление-объем свидетельствует о снижении податливости легких и их перерастяжении вдуваемым дыхательным объемом. Разорванность петли поток-объем свидетельствует о наличии утечек в контуре аппарата ИВЛ.
Материматическая модель респираторного тракта. Дыхательный контур в уравнении
Дыхательный контур служит для соединения респиратора с эндотрахеальной или трахеостомческой трубкой. По строению различаются однонаправленные (однолинейные) и двунаправленные (двухлинейные) дыхательные контуры. В первом случае выдох пациента производится через различные типы клапанов сразу в атмосферу. Во втором случае выдох пациента попадает сначала в линию выдоха, потом направляется в респиратор и выводится в атмосферу через клапан выдоха.
По своему назначению различают анестезиологические дыхательные контуры, которые предназначены для наркозных аппаратов и контуры для аппаратов ИВЛ. Также контуры могут быть обогреваемыми, то есть иметь встроенный нагревательный элемент и температурный датчик и необогреваемыми. В последнем случае, если планируется подогрев такого контура, нагревательный элемент и температурный датчик монтируются в него при подготовке респиратора к работе. Также дыхательные контуры различаются в зависимости от материала, из которого они изготовлены.
В эпоху пандемии коронавирусной инфекции сформировались две основные стратегии респираторной поддержки при данной патологии, которые перетекают по нарастанию инвазивности из одной в другую при неэффективности менее инвазивной. Самая первая, начальная, стратегия подразумевает использование кислородной маски или назальных канюль с подачей увлажненного кислорода.

Следующий уровень респираторной поддержки: использование высокопоточной назальной оксигенации или неинвазивной вентиляции через маску. Эти этапы уже подразумевают использование специальных дыхательных контуров. В случае с высокопоточной назальной оксигенацией используется однонаправленный контур для подачи нагретой и увлажненной дыхательной смеси с определенной концентрацией кислорода и определенным потоком. При проведении неинвазивной вентиляции легких через лицевую маску (CPAP и другие аналогичные методики) могут использоваться как однолинейный, так и двухлинейный варианты дыхательного контура. При использовании однолинейного дыхательного контура с утечкой обязательно размещение вирусно-бактериального дыхательного фильтра на линии вдоха, а также между пациентом и клапаном выдоха для снижения как обсеменения помещения, так и вирусной нагрузки на персонал. Если планируется использовать двухлинейный дыхательный контур, то вирусно-бактериальные фильтры размещаются на патрубках вдоха и выдоха. Если используется вирусно-бактериальный фильтр с функцией тепловлагообмена, то его можно разместить между дыхательным контуром и маской пациента.
Следует отметить, что при использовании неинвазивных методов респираторной поддержки пациентов с коронавирусной инфекцией (высокопоточная назальная оксигенация, неинвазивная вентиляция легких) отмечается массивное обсеменение окружающей среды и высокая вирусная нагрузка на персонал. Это связано с самими методиками такой респираторной поддержки, которые подразумевают высокий уровень утечки дыхательной смеси в атмосферу и диктует особое внимание персонала, который занимается лечением таких пациентов, к средствам индивидуальной защиты. В организационном плане целесообразно выделять для пациентов, получающих неиназивную респираторную поддержку, отдельные палаты и отделять их от пациентов, находящихся на искусственной вентиляции легких.
При неэффективности неинвазивной респираторной поддержки прибегают к стандартной (инвазивной) искусственной вентиляции легких через эндотрахеальную или трахеостомическую трубку. При этом используется двухлинейный дыхательный контур с двумя вирусно-бактериальными фильтрами (на патрубках вдоха и выдоха) или один вирусно-бактериальный фильтр с функцией тепловлагообмена на дистальном конце дыхательного контура (обычно после Y-образного коннектора). В последнем случае увлажнитель не используется. Также недопустимо совместное применение дыхательных фильтров, расположенных на дистальном конце дыхательного контура (после Y-образного коннектора), с увлажнителями дыхательной смеси, так как это приводит к накоплению влажной и теплой дыхательной смеси в пространстве между увлажнителем и фильтром.

Особое внимание следует уделить организации санации трахеобронхиального дерева у пациентов с коронавирусной инфекцией. В связи с тем, что данная процедура является одной из наиболее опасных в плане вирусной нагрузки на персонал, целесообразно использовать специальные закрытые системы санации, которые размещаются между контуром и эндотрахеальной (трахеостомической) трубкой и позволяют избежать разгерметизации контура. Существенным плюсом таких систем является тот факт, что при их использовании не прекращается проведение искусственной вентиляции легких в процессе санации трахеобронхиального дерева, что снижает риск гипоксии у пациента во время процедуры. При отсутствии таких систем для санации необходимо использовать специальные гофрированные переходники с портом для санации, которые размещаются между дыхательным контуром и эндотрахеальной (трахеостомической) трубкой.
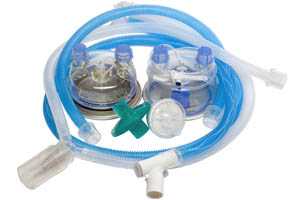
Дыхательные фильтры применяются при проведении пациентам искусственной вентиляции легких, анестезиологического пособия и других видов респираторной терапии. Они подразделяются на тепловлагообменные и барьерные (бактериальные и бактериально-вирусные). Кроме того, фильтры могут сочетать в себе несколько функций.
Задачей тепловлагообменных фильтров служит сохранение тепла и влаги в дыхательном контуре. Это имеет значение при проведении продолжительных операций, при длительной искусственной вентиляции легких в палате интенсивной терапии, операционной или при транспортировке пациентов. Увлажненная и согретая газовая смесь предотвращает повреждение реснитчатого эпителия слизистой дыхательных путей, нарушение дренажа мокроты в просвете бронхов, развитие бронхиальной обструкции, ателектазирование, снижает риск развития инфекционных осложнений.
Использование барьерных фильтров также имеет огромное значение. Во-первых, они позволяют отказаться от частой стерилизации многоразовых дыхательных контуров при проведении анестезии. При условии смены бактериального фильтра, находящегося дистальнее Y-образного тройника, исключается попадание инфекционных агентов в контур, что позволяет его использовать в течение всего операционного дня. Во-вторых, использование барьерных фильтров позволяет избежать перекрестного инфицирования пациентов в палате интенсивной терапии.
Сами бактериально-вирусные фильтры были разработаны в 1963 году и предназначались для стерилизации комнатного воздуха. Рассматривается три принципа удаления частиц:
- Физическое удаление частиц, имеющих размер более 1 мкм;
- Инерционное удаление для частиц размером 0,5-1 мкм;
- Диффузный захват за счет включения частиц размером менее 0,5 мкм в броуновское движение.
По механизму действия все фильтры можно разделить на действующие по принципу механической фильтрации и электростатической фильтрации. Также фильтры можно разделить на гигроскопические и гидрофобные. В гигроскопических фильтрах в качестве фильтрующей основы применяется специальная бумага, обработанная химическими веществами, которые задерживают воду. За счет непрерывного процесса конденсации и испарения жидкости в фильтрующем слое происходит согревание и увлажнение вдыхаемого газа. Гидрофобные фильтры устроены таким образом, что не пропускают жидкость сквозь фильтрующий слой. Для изготовления мембран таких фильтров используются преимущественно гидрофобные синтетические материалы: механическая мембрана — стеклянные микроволокна, вспененный полимер (полиуретаны), электростатическая мембрана содержит полипропиленовые волокна. Капельки жидкости, не проникающие в фильтрующий слой, конденсируются на фильтрующей поверхности, увлажняя вдыхаемый воздух. Бактерии, вирусы, пылевые частички фильтруются благодаря малому размеру пор и электростатическому полю. Гарантия непроницаемости гидрофобной мембраны для воды является одновременно гарантией непроницаемости для инфекций, распространяющихся воздушно-капельным путем, а способность фильтров задерживать клетки крови, крупные белковые молекулы и другие биологические жидкости является защитой от парентеральных вирусных гепатитов B, C, D и ВИЧ-инфекции, что подтверждено рядом клинических испытаний.
Микрофлора дыхательных путей у здорового человека может быть представлена стрептококками, дифтероидами, моракселлами, псевдомонадами. Помимо этого, встречаются нейссерии, коринебактерии, стафилококки. Встречаются и патогенные штаммы: менингококки, гноеродные стрептококки, пневмококки, возбудители коклюша. В случае проведения искусственной вентиляции легких пациенту с респираторной инфекцией, пневмонией, число имеющихся инфекционных агентов может быть значительно большим. Роль этих микроорганизмов в перекрестном инфицировании пациентов бывает достаточно значительной.
Эффективность современных дыхательных фильтров для использования их в роли барьера разнообразной флоры очень высока. Данные многочисленных исследований оценивают степень бактериальной и вирусной фильтрации фильтров различных производителей как 99,999%. При этом одинаково эффективны как механические, так и электростатические фильтры.
Основные правила при использовании бактериальных и тепловлагообменных фильтров включают в себя:
- Четкое представление о том, какой фильтр используется и каковы его возможности;
- Размещение фильтра в непосредственной близости к пациенту, наиболее проксимально, так как при этом учитывается возможность непреднамеренной экстубации, деканюляции или перегиба трубки;
- Соблюдение строгого правила: один фильтр — один пациент, а также сроков эксплуатации фильтра;
- Немедленную замену дыхательного фильтра в случае его загрязнения биологическими жидкостями.
Наша компания готова предоставить вашему вниманию очень широкий выбор тепловлагообменных, бактериальных и вирусно-бактериальных фильтров. Подробнее ознакомиться с ними вы можете в нашем каталоге.
ДЫХАТЕЛЬНЫЕ КОНТУРЫ
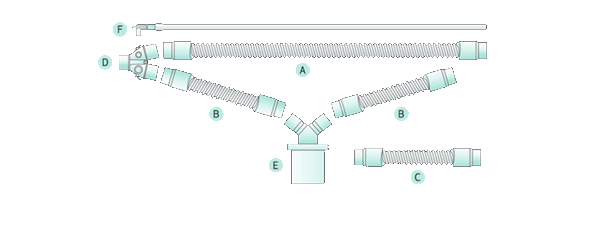
Дыхательный контур является крайне важной частью анестезиологического рабочего места, от которого непосредственно зависит безопасность пациента и удобство работы анестезиолога. Мы предлагаем одноразовые анестезиологические дыхательные контуры для реверсивных систем, изготовленные из этилвинилацетата.
Анестезиологический дыхательный контур может иметь гофрированные дыхательные шланги как постоянной длины (неконфигурируемые), так и переменной длины (конфигурируемые). Преимущество конфигурируемых дыхательных контуров состоит в том, что они позволяют устанавливать минимально необходимую длину дыхательных шлангов, регулируя тем самым объем мертвого пространства контура. Кроме того, такие контуры при хранении занимают меньше места. К недостаткам таких контуров относится тот факт, что они чаще повреждаются по сравнению с некофигурируемыми.
Анестезиологический дыхательный контур из гофрированных трубок (неконфигурируемый) имеет в своем составе два дыхательных шланга различной длины (от 90 до 180 см в зависимости от назначения контура), Y-образный коннектор, угловой адаптер с портом типа Люэра и дыхательный мешок различной емкости (3, 2 или 1 литра), а также переходники для присоединения шлангов к патрубкам вдоха и выдоха наркозного аппарата. Порт Люэра на угловом адаптере позволяет подключать к нему линию газового мониторинга. Различают контуры для взрослых пациентов (с дыхательным мешком 3, 2 или 1 литр) и педиатрические (с дыхательным мешком на 1 или 2 литра).
Анестезиологический дыхательный контур с конфигурируемой гофрированной трубкой включает в себя два конфигурируемых дыхательных шланга, которые позволяют изменять их длину, Y-образный коннектор, угловой адаптер с портом типа Люэра, дыхательный мешок различной емкости (3, 2 или 1 литра) и переходники для присоединения шлангов к патрубкам наркозного аппарата. Наличие на угловом адаптере порта Люэра позволяет подключать к нему линию газового мониторинга. В наличии имеются дыхательные контуры для взрослых с дыхательным мешком объемом 2 или 3 литра, а также педиатрические с дыхательным мешком объемом 1 или 2 литра. Длина контура от 100 до 180 см (в полностью расправленном состоянии).
Читайте также:
