Медленная фаза рассасывания кости. Влияние паратгормона на почки
Добавил пользователь Евгений Кузнецов Обновлено: 22.01.2026
Остеопороз и его осложнения — переломы костей — представляют значительную медико-социальную проблему. Ежегодно вследствие остеопороза возникают переломы костей у 1,3 млн американцев и у 40 тыс. канадцев. Во Франции каждая вторая, а в Австралии каждая пятая женщина в возрасте около 70 лет страдает от переломов, вызванных остеопорозом. Возникновение остеопороза в пожилом возрасте у женщин обусловлено уменьшением выработки эстрогенов. Однако снижение минеральной плотности кости происходит не только с возрастом, но еще в большей степени при всех состояниях, приводящих к изменению баланса гормонов гипоталамо-гипофизарной системы, щитовидной и паращитовидных желез, надпочечников.
В связи с изложенным целью настоящей работы явилось обобщение данных литературы о влиянии гормонов на возникновение и развитие остеопороза.
Костная ткань — это динамичная метаболически активная система. В зависимости от выполняемой функции различают кортикальную и трабекулярную кость. Первая составляет три четверти всей скелетной массы, формирует диафизы трубчатых костей, имеет малую порозность, выполняет функцию опоры для мягких тканей и передачи мышечного сокращения из одной части тела в другую. Трабекулярная костная ткань составляет одну четвертую часть массы скелета, формирует кости аксиального скелета и эпифизы трубчатых костей, имеет высокую порозность и обеспечивает нормальную жизнедеятельность костного мозга. Для этого в трабекулярных костях имеются полости размером от 500 до 1000 мкм, расположенные между костными пластинками толщиной 100—150 мкм.
Основу жизнедеятельности костной ткани составляет функционирование двух видов клеток: остеокластов, резорбирующих кость, и остеобластов, ответственных за ее образование. Родоначальники этих клеток до конца не выяснены, хотя наиболее вероятными для остеокластов считаются гемопоэтические клетки моноциты-макрофаги, а для остеобластов — клетки стромы, из которых возникают преостеобласты.
В течение жизни происходит постоянное обновление костей, проявляющееся в рассасывании отдельных, очень маленьких участков ткани, с почти одновременным формированием новой кости. Этот процесс имеет огромное эволюционное значение, так как позволяет удалять возникающие в процессе жизнедеятельности микротравмы и микротрещины костей. Ежегодно 25 % массы трабекулярных костей и лишь 2—3 % кортикальных — обновляются.
Ключевые слова
Для цитирования:
For citation:
Остеопороз и его осложнения — переломы костей — представляют значительную медико-социальную проблему. Ежегодно вследствие остеопороза возникают переломы костей у 1,3 млн американцев и у 40 тыс. канадцев [12, 37]. Во Франции каждая вторая, а в Австралии каждая пятая женщина в возрасте около 70 лет страдает от переломов, вызванных остеопорозом [2, 35]. Возникновение остеопороза в пожилом возрасте у женщин обусловлено' ■уменьшением ' выработки эстрогенов [6]. Однако снижение минеральной плотности кости происходит не только с возрастом, но еще в большей степени при всех состояниях, приводящих к изменению баланса гормонов гипоталамо-гипофизарной системы, щитовидной и паращитовидных желез, надпочечников.
Костная ткань — это динамичная метаболически активная система. В зависимости от выполняемой функции различают кортикальную и трабекулярную кость. Первая составляет три четверти всей скелетной массы, формирует диафизы трубчатых костей, имеет малую порозность, выполняет функцию опоры для мягких тканей и передачи мышечного сокращения из одной части тела в другую. Трабекулярная костная ткань составляет одну четвертую часть массы скелета, формирует кости аксиального скелета и эпифизы трубчатых костей, имеет высокую порозность и обеспечивает нормальную жизнедеятельность костного мозга. Для этого в трабекулярных костях имеются полости размером от 500 до 1000 мкм, расположенные между костными пластинками толщиной 100—150 мкм [42].
Основу жизнедеятельности костной ткани составляет функционирование двух видов клеток: остеокластов, резорбирующих кость, и остеобластов, ответственных за ее образование. Родоначальники этих клеток до конца не выяснены, хотя наиболее вероятными для остеокластов считаются гемопоэтические клетки моноциты-макрофаги, а для остеобластов — клетки стромы, из которых возникают преостеобласты [40].
В течение жизни происходит постоянное обновление костей, проявляющееся в рассасывании отдельных, очень маленьких участков ткани, с почти одновременным формированием новой кости. Этот процесс имеет огромное эволюционное значение, так как позволяет удалять возникающие в процессе жизнедеятельности микротравмы и микротрещины костей. Ежегодно 25 % массы трабекулярных костей и лишь 2—3 % кортикальных — обновляются [49].
Процесс ремоделирования кости делится на пять фаз [42]. В здоровом взрослом организме в состоянии покоя находится до 80 % трабекулярной и 95 % кортикальной костной ткани. Фаза активации, возникающая в каждом участке кости с интервалом 2—3 года, включает в себя пролиферацию и активацию предшественников остеокластов в гемопоэтической ткани, поступление и прикрепление мультиядерных остеокластов к поверхности резорбируемого участка. Следующая фаза — резорбция кости — продолжается приблизительно 1—3 нед. На клеточном уровне этот процесс заключается в расплавлении неорганического матрикса кости с последующей деградацией органического, что происходит с обязательным поступлением в участки резорбции ионов водорода и лизосомальных энзимов остеокластов [3, 56]. Переходная фаза длится 1 — 2 нед. В это время в резорбированной полости появляются остеобласты в результате как деления клеток, так и поступления из других участков. Новообразование кости начинается с откладывания остеобластами костного матрикса со скоростью 2—3 мкм в день, который через 5—10 дней минерализуется. Процесс костеобразования длится около 3 мес, а полный цикл обновления кости в каждом участке занимает 4—8 мес [22]. Следует отметить, что интимные механизмы этого процесса и его контроля остаются неизвестными.
На основании физиологических процессов костного ремоделирования было предложено несколько возможных вариантов возникновения остеопороза [13]. Во-первых, во всех обновляющихся точках кости резорбирующая активность остеокластов больше костеобразующих возможностей остеобластов; во-вторых, резкое увеличение количества обновляющихся участков по всему скелету приводит к общей резорбции кости, так как длительность фазы резорбции короче фазы формирования новой кости.
В патогенезе развития остеопороза оба этих механизма имеют место. Так, при остеопорозе, возникающем сначала в метаболически более активной трабекулярной ткани, уменьшаются количество и толщина пластинок, полости, находящиеся между пластинами, увеличиваются за счет перфораций последних. Эти изменения обусловлены нарушением баланса между глубиной резорбированных полостей и толщиной вновь возникающих пластинок [43].
Одним из наиболее активных гормонов, влияющих на процессы обновления кости, является паратиреоидный гормон (ПТГ). Основная его функция заключается в поддержании в организме гомеостаза кальция. Уменьшение концентрации кальция в плазме приводит к выбросу паращитовидными железами гормона, который, воздействуя на почки, увеличивает реабсорбцию кальция в канальцах и экскрецию фосфатов, а на уровне костной ткани вызывает ее резорбцию и выход кальция во внеклеточную жидкость [10].
Уже через 30 мин после введения ПТГ количество и активность остеокластов увеличиваются. Однако эта реакция не наблюдается при воздействии ПТГ на изолированные остеокласты, а происходит лишь при добавлении к ним остеобластов. Дальнейшие исследования показали, что остеобласты и их предшественники имеют на своей поверхностной мембране рецепторы к ПТГ [53], в то время как на остеокластах таких рецепторов не обнаружено. На основании полученных результатов было предположено [47] существование связи между ПТГ-активными остеобластами и ПТГ-нечувствитель- ными остеокластами. Оказалось, что остеобласты являются основным звеном, запускающим и контролирующим резорбцию кости. Под воздействием ПТГ наблюдается пролиферация остеобластов, морфологически они из округлой формы приобретают звездообразную, происходит деполяризация мембраны и изменяется ферментативная активность, ингибируется синтез коллагена, остеокальцина и щелочной фосфатазы, увеличивается синтез коллагеназы. С целью стимуляции остеокластов к резорбции остеобласты выделяют водорастворимый фактор размером 0,5—2,0 кД, который блокируется ингибиторами липоксигеназы [31]. Внутриклеточные механизмы влияния ПТГ на остеобласты заключаются в резком увеличении концентрации кальция внутри клеток, что в свою очередь приводит к увеличению фосфорилирования белков стимуляцией протеинкиназы С. Выявлена положительная корреляция между способностью ПТГ увеличивать концентрацию кальция в остеобластах и возможностью последних вызывать резорбцию кости [22].
Указанные изменения возникают при повышении концентрации ПТГ в плазме. В то же время практически невозможно объяснить стимулирующее действие малых доз ПТГ на костеобразование [21].
У женщин в период постменопаузы отмечается отрицательный баланс кальция, хотя его концентрация в плазме повышается и снижается до нормального уровня при заместительной гормональной терапии [41]. Противоречивые результаты получены при исследовании ПТГ в постменопаузе. В раннем периоде концентрация ПТГ несколько снижается, через 3 года после наступления не меняется или незначительно повышается, а при проведении эстрогенотерапии уровень ПТГ возвращается к исходным показателям [34]. У больных с переломами позвонков, вызванных остеопорозом, выявлено снижение концентрации ПТГ, однако при переломах шейки бедра каких-либо его изменений не обнаружено.
Антагонистом ПТГ является кальцитонин (КТ). Уже через несколько минут после добавления КТ к культуре остеокластов отмечается уменьшение количества ядер в них, а затем и общего количества, значительно снижается подвижность и их резорбционная способность, они покидают поверхность кости. Такая быстрая реакция остеокластов обусловлена тем, что они имеют на своей мембране рецепторы к КТ [38]. Молекулярные механизмы воздействия КТ на остеокласты связаны с увеличением образования циклического аденозинмонофосфата в них [39]. Кроме этого, остеокласты под воздействием КТ начинают вырабатывать пептид, называемый кальцитонин- генсвязанный пептид, который, действуя на остеобласты, заставляет их синтезировать циклический аденозинмонофосфат [32].
У здоровых людей имеется разница в концентрации КТ в плазме в зависимости от пола и возраста: у женщин эти значения ниже, чем у мужчин [54], с возрастом наблюдается уменьшение концентрации КТ в плазме. Снижение выработки половых гормонов как у мужчин, так и у женщин приводит к уменьшению секреции КТ, также обнаружена выраженная положительная корреляция между уровнем эстрогенов и КТ [46]. У женщин с остеопорозом концентрация КТ гораздо ниже, чем у женщин того же возраста, но без остеопороза. Введение КТ больным с остеопорозом способствует некоторому повышению минеральной плотности кости [33], хотя этот эффект наблюдается в течение 1 года [7]. В то же время проведение эстрогенотерапии при менопаузе приводит к повышению секреции КТ [14]. Это подтверждается и в исследованиях in vitro, в которых было показано прямое стимулирующее действие экстрогенов на выработку КТ клетками щитовидной железы [15]. Однако следует отметить, что разницы в минеральной плотности кости у больных с субтотальной тиреоидэктомией и здоровыми людьми не наблюдалось [23].
Наиболее часто остеопороз поражает женщин со сниженной гормональной функцией яичников, вне зависимости от причин, вызывающих это состояние. Позднее менархе, менопауза, аменорея у спортсменок и балетных танцоров, оперативное удаление яичников, пролактинсекретирующие опухоли, синдром Тернера приводят к деминерализации кости [28]. Чаще всего эти изменения возникают уже через год после наступления уменьшения концентрации эстрогенов в плазме. Заместительная эстрогенотерапии снижает потерю массы кости и даже приводит к ее увеличению [29].
Механизм действия эстрогенов на процессы обновления кости остается спорной проблемой. В условиях дефицита эстрогенов наблюдаются как замедление формирования новой кости, так и ускоренная костная резорбция. В последнее время
опубликованы работы, в которых показано наличие рецепторов к эстрогенам на мембране остеобластов [9, 26]. Однако до этих исследований считалось, что эстрогены дают защитный эффект от воздействия ПТГ на костную ткань, а также увеличивают продукцию эндогенного КТ [34, 51].
Уменьшение выработки андрогенов как первичного генеза, так и вторичного (вследствие гипогонадотропного гипогонадизма) приводит к остеопорозу [24]. Отмечается положительная корреляционная зависимость между уровнем тестостерона в плазме и массой кости при различных формах гипогонадизма [II]. У таких больных терапия тестостероном и его метаболитами увеличивает минерализацию кости и ее массу [17]. Несмотря на четкую связь между уровнем выработки андрогенов и состоянием костной системы, механизмы их влияния на процессы образования и обновления кости остаются мало изученными.
Роль других половых гормонов в процессах ремоделирования кости остается неизвестной, хотя имеются отдельные клинические наблюдения. Гиперпролактинемия сопровождается значительным снижением минеральной плотности кости, а терапия этого состояния способствует увеличению показателя |25]. У мужчин с гиперпролактинемией также отмечается уменьшение массы кости, а нормализация уровня тестостерона и пролактина вызывает ее увеличение (16].
Глюкокортикоиды (ГК) оказывают значительное влияние на процессы обновления кости. Считается, что 50 % больных с болезнью Иценко — Кушинга и 30—50 % больных, хронически принимающих ГК, страдают остеопорозом. Оперативное лечение детей с болезнью Иценко — Кушинга повышает минеральную плотность кости [45].
Воздействие ГК на кости обусловлено множеством факторов, среди которых основное значение имеет нарушение обмена кальция, связанное с уменьшением его абсорбции в кишечнике и увеличением экскреции с мочой, снижение выработки половых гормонов на всех уровнях и непосредственное влияние на клетки костной ткани (50].
Наиболее противоречивые данный получены при изучении прямого действия ГК на костную ткань. В физиологических дозах в первые сутки ГК усиливают функцию остеобластов и их способность синтезировать коллаген, а в последующем эта активность резко снижается [5]. ГК ингибируют превращения предшественников остеобластов, уменьшают время их активности, т. е. угнетают костеобразование. Воздействие ГК на остеокласты осуществляется, по-видимому, опосредованно через остеобласты. Несмотря на то что ГК увеличивают мобилизацию минералов кости усилением резорбции, они ингибируют созревание предшественников остеокластов и количество их снижается [52].
Одним из множества эффектов тиреоидных гормонов является их способность оказывать влияние на процессы обновления кости. В условиях гипертиреоза наблюдается повышение количества обновляющихся участков, уменьшаются как фаза резорбции, так и костеобразования, т. е. усиливается костный метаболизм [2]. Эти изменения приводят к отрицательному балансу кальция и уменьшению минеральной плотности кости, умеренной гиперкальциемии, снижению концентрации ПТГ и увеличению потери кальция и фосфора с мочой. Отрицательное действие повышения выработки тиреоидных гормонов на кости обусловлено непосредственным увеличением количества остеокластов и их активности, а также стимуляцией остеобластов [36].
В условиях гипотиреоза наблюдается уменьшение количества обновляющихся участков, резко увеличивается продолжительность всех фаз цикла ремоделирования, снижается резорбционная активность остеокластов, уменьшается способность остеобластов к формированию кости и ее минерализации [55].
Интересная особенность выявлена при лечении гипотиреоза тиреоидными препаратами. Все они вызывают остеопороз, хотя сроки его возникновения, по данным разных авторов, колеблются от 6 мес до 10 лет [12, 44]. По нашему мнению, такие разноречивые данные могут быть обусловлены различной дозировкой используемых препаратов.
Сахарный диабет (СД) наряду с метаболическими нарушениями различных органов и систем организма сопровождается изменениями в костной системе. У больных СД I типа длительностью более 5 лет отмечается уменьшение минеральной плотности кости по сравнению со здоровыми людьми того же возраста и пола [30, 57]. Особенно значительные изменения отмечаются у больных, заболевших в детском и юношеском возрасте, с большими дозами инсулина и плохим контролем. Отмечается изменение обмена кальция, проявляющееся увеличением экскреции кальция и фосфора, что приводит к уменьшению их концентраций в плазме. На этом фоне наблюдается парадоксальное уменьшение концентрации ПТГ в плазме у больных как без нарушения функции почек, так и со снижением их функционального состояния (19]. При этом уровень КТ не изменяется [48]. В патогенезе развития остеопороза у больных СД основное значение придается метаболическим и гормональным изменениям, диабетической ангиопатии [20]. Следует также отметить, что выявлены рецепторы к инсулину в остеобластах [27], в то же время механизмы его влияния на процессы обновления кости остаются неизвестными.
Гормон роста — один из важнейших гормонов при росте костей, особенно их эпифизов. Он оказывает активирующее влияние на остеобласты локальным выделением соматомеди- на С, известного как инсулиноподобный фактор роста I. Этот пептид вызывает пролиферацию остеобластов, стимулирует синтез ДНК и протеинов. С возрастом продукция гормона роста снижается, однако это уменьшение не коррелирует с возрастными изменениями костной ткани. Использование гормона роста при остеопорозе оказалось неэффективным [1].
Анализ литературных публикаций показывает, что в течение жизни происходит постоянное обновление костной ткани. Наиболее активно на этот процесс оказывают влияние ПТГ и КТ через активацию или ингибирование клеточных элементов кости. Дефицит эстрогенов одна из самых широко распространенных причин остеопороза приводит к снижению костеобразования и ускорению резорбции кости. Выявлена четкая связь между состоянием костной системы и недостатком андрогенов и инсулина, избытком глюкокортикоидов, пролактина и гормонов щитовидной железы, хотя большинство вопросов этой проблемы далеки от разрешения. Характер и интенсивность процессов ремоделирования кости в значительной степени зависят от состояния гормонального баланса организма, но многие механизмы этого взаимодействия требуют дальнейшего изучения.
Паратгормон в крови
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
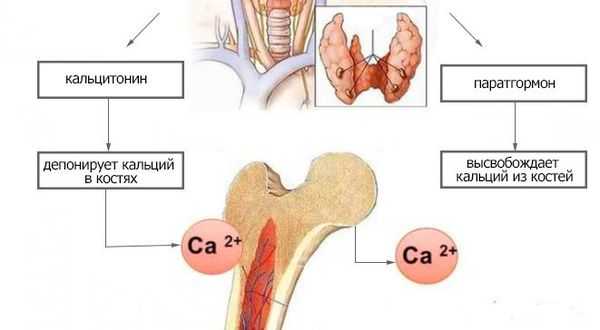
Паратгормон - полипептид, состоящий из 84 аминокислотных остатков, образуется и секретируется паращитовидными железами в виде высокомолекулярного прогормона. Прогормон после выхода из клеток подвергается протеолизу с образованием паратгормона. Продукцию, секрецию и гидролитическое расщепление паратиреоидного гормона регулирует концентрация кальция в крови. Снижение её приводит к стимуляции синтеза и высвобождению гормона, а понижение вызывает обратный эффект. Паратгормон повышает концентрацию кальция и фосфатов в крови. Паратиреоидный гормон действует на остеобласты, вызывая повышение деминерализации костной ткани. Активен не только сам гормон, но и его аминоконцевой пептид (1-34 аминокислоты). Он образуется при гидролизе паратиреоидного гормона в гепатоцитах и почках в тем большем количестве, чем ниже концентрация кальция в крови. В остеокластах активизируются ферменты, разрушающие промежуточное вещество кости, а в клетках проксимальных канальцев почек ингибируется обратная реабсорбция фосфатов. В кишечнике усиливается всасывание кальция.
Кальций является одним из необходимых элементов в жизнедеятельности млекопитающих. Он участвует в выполнении ряда важных внеклеточных и внутриклеточных функций.
Концентрация внеклеточного и внутриклеточного кальция жестко регулируется направленным транспортом через клеточную мембрану и мембрану внутриклеточных органелл. Такой избирательный транспорт приводит к огромной разнице в концентрациях внеклеточного и внутриклеточного кальция (более чем в 1000 раз). Столь значительная разница делает кальций удобным внутриклеточным мессенжером. Так, в скелетных мышцах временное повышение цитозольной концентрации кальция приводит к его взаимодействию с кальций-связывающими белками - тропонином С и кальмодулином, инициируя мышечное сокращение. Процесс возбуждения и сокращения в миокардиоцитах и гладкой мускулатуре также является кальций-зависимым. Кроме того, внутриклеточная концентрация кальция регулирует ряд других клеточных процессов путем активации протеинкиназ и фосфорилирования ферментов. Кальций вовлечен в действие и других клеточных мессенжеров - циклического аденозин-монофосфата (цАМФ) и инозитол-1,4,5-трифосфата и таким образом опосредует клеточный ответ на множество гормонов, среди которых эпинефрии, глюкагон, вазопрессин, холецистокинин.
Всего в организме человека находится около 27 000 ммоль (приблизительно 1 кг) кальция в форме гидроксиапатита в костях и только 70 ммоль во внутриклеточной и внеклеточной жидкости. Внеклеточный кальций представлен тремя формами: неионизированный (или связанный с белками, в основном с альбумином) - около 45-50 %, ионизированный (двухвалентные катионы) - около 45 % , и в составе кальций-анионных комплексов - около 5 % . Поэтому на общую концентрацию кальция существенно влияет содержание альбумина в крови (при определении концентрации общего кальция всегда рекомендуют корректировать этот показатель в зависимости от содержания альбумина в сыворотке). Физиологические эффекты кальция вызываются ионизированным кальцием (Са++).
Концентрация ионизированного кальция в крови поддерживается в очень узком диапазоне - 1,0-1,3 мМоль/л путем регуляции потока Са++ в и из скелета, а также через эпителий почечных канальцев и кишечника. Причем, как видно на схеме, такую устойчивую концентрацию Са++ во внеклеточной жидкости удается поддерживать, несмотря на значительные количества поступающего с пищей, мобилизующегося из костей и фильтрующегося почками кальция (например из 10 г Са++ в первичном почечном фильтрате реабсорбируется обратно в кровь 9,8 г).
Гомеостаз кальция представляет собой очень сложный сбалансированный и многокомпонентный механизм, основными звеньями которого являются кальциевые рецепторы на клеточных мембранах, распознающие минимальные колебания уровня кальция и запускающие клеточные механизмы контроля (например снижение кальция приводит к увеличению секреции паратгормона и уменьшению секреции кальцитонина), и эффекторные органы и ткани (кости, почки, кишечник), реагирующие на кальцийтропные гормоны путем соответствующего изменения транспорта Са++.
Метаболизм кальция теснейшим образом взаимосвязан с метаболизмом фосфора (в основном фосфата - -РО4), а их концентрации в крови находятся в обратной зависимости. Эта взаимосвязь особенно актуальна для неорганических соединений фосфата кальция, которые представляют непосредственную опасность для организма вследствие их нерастворимости в крови. Так, произведение концентраций общего кальция и общего фосфата крови поддерживается в очень строгом диапазоне, не превышающем в норме 4 (при измерении в ммоль/л), так как при значении этого показателя выше 5 начинается активная преципитация солей фосфата кальция, вызывающая повреждение сосудов (и быстрое развитие атеросклероза), кальцификацию мягких тканей и блокаду мелких артерий.
Основными гормональными медиаторами кальциевого гомеостаза выступают паратгормон, витамин D и кальцитонин.
Паратгормон, вырабатываемый секреторными клетками околощитовидных желез, играет центральную роль в кальциевом гомеостазе. Его координированные действия на кости, почки и кишечник приводят к увеличению транспорта кальция во внеклеточную жидкость и повышению концентрации кальция в крови.
Паратгормон представляет собой 84-аминокислотный белок массой 9500 Da, кодируемый геном, расположенным на коротком плече 11-й хромосомы. Он образуется в виде 115-аминокислотного пре-про-паратгормона, который попадая в эндоплазматический ретикулюм, теряет 25-аминокислотный участок. Промежуточный про-паратгормон траспортируется в аппарат Гольджи, где от него отщепляется гексапептидный N-концевой фрагмент и формируется конечная молекула гормона. Паратгормон имеет чрезвычайно короткий период полураспада в циркулирующей крови (2-3 мин), в результате чего он расщепляется на С-концевой и N-концевой фрагменты. Только N-концевой фрагмент (1-34 амнокислотные остатки) сохраняет физиологическую активность. Непосредственным регулятором синтеза и секреции паратгормона выступает концентрация Са++ в крови. Паратгормон соединяется со специфическими рецепторами клеток-мишеней: почечных и костных клеток, фибробластов, хондроцитов, миоцитов сосудов, жировых клеток и плацентарных трофобластов.
Действие паратгормона на почки
В дистальном нефроне расположены как рецепторы паратгормона, так и кальциевые рецепторы, что позволяет внеклеточному Са++ оказывать не только прямой (через кальциевые рецепторы), но и опосредованный, (через модуляцию уровня паратгормона в крови) эффект на почечный компонент кальциевого гомеостаза. Внутриклеточным медиатором действия паратгормона выступает ц-АМФ, экскреция которого с мочой является биохимическим маркером активности околощитовидных желез. Почечные эффекты действия паратгормона включают:
- увеличение реабсорбции Са++ в дистальных канальцах (в то же время при избыточном выделении паратгормона экскреция Са++ с мочой возрастает из-за увеличения фильтрации кальция вследствие гиперкальциемии);
- увеличение экскреции фосфата (действуя на проксимальные и дистальные канальцы, паратгормон ингибирует Na-зависимый транспорт фосфата);
- увеличение экскреции бикарбоната из-за угнетения его реабсорбции в проксимальных канальцах, что приводит к ощелачиванию мочи (а при избыточной секреции паратгормона - к определенной форме тубулярного ацидоза вследствие интенсивного выведения из канальцев щелочного аниона);
- увеличение клиренса свободной воды и, тем самым, объема мочи;
- увеличение активности витамин D-la-гидроксилазы, синтезирующей активную форму витамина D3, которая катализирует механизм всасывания кальция в кишечнике, таким образом влияя на дигестивную составляющую обмена кальция.
Соответственно с выше изложенным при первичном гиперпаратиреозе вследствие избыточного действия паратгормона его почечные эффекты будут проявляться в виде гиперкальцийурии, гипофосфатемии, гиперхлоремического ацидоза, полиурии, полидипсии и увеличенной экскреции нефрогенной фракции цАМФ.
Действие паратгормона на кости
Паратгормон оказыает как анаболический, так и катаболический эффекты на костную ткань, которые могут быть разграничены как ранняя фаза действия (мобилизация Са++ из костей для быстрого восстановления баланса с внеклеточной жидкостью) и поздняя фаза, во время которой стимулируется синтез костных ферментов (таких как лизосомальные энзимы), промотирующих резорбцию и ремоделирование костной ткани. Первичной точкой приложения паратгормона в костях являются остеобласты, так как остеокласты, по-видимому, не имеют рецепторов паратгормона. Под действием паратгормона остеобласты вырабатывают разнообразные медиаторы, среди которых особое место занимают провоспалительный цитокин интерлейкин-6 и фактор дифференцировки остеокластов, оказывающие мощное стимулирующее действие на дифференциацию и пролиферацию остеокластов. Остеобласты могут также тормозить функцию остеокластов, вырабатывая остеопротегерин. Таким образом, резорбция костей остеокластами стимулируется опосредованно через остеобласты. При этом увеличивается высвобождение щелочной фосфатазы и экскреция с мочой гидроксипролина - маркера разрушения костного матрикса.
Уникальное двойственное действие паратгормона на костную ткань было открыто еще в 30-е годы XX века, когда удалось установить не только резорбтивное, но и анаболическое действие его на костную ткань. Однако лишь 50 лет спустя на основе экспериментальных исследований с рекомбинантным паратгормоном стало известно, что длительное постоянное влияние избытка паратгормона оказывает остеорезорбтивное действие, а пульсовое интермиттирующее поступление его в кровь стимулирует ремоделирование костной ткани [87]. На сегодняшний день только препарат синтетического паратгормона (teriparatide) обладает лечебным эффектом в отношении остеопороза (а не просто приостанавливает его прогрессирование) из числа разрешенных к применению FDA США.
Действие паратгормона на кишечник
Пратгормон не оказывает прямого действия на желудочно-кишечную абсорбцию кальция. Эти эффекты его опосредуются через регуляцию синтеза активного (l,25(OH)2D3) витамина D в почках.
Другие эффекты паратгормона
В опытах in vitro были обнаружены и другие эффекты паратгормона, физиологическая роль которых еще не вполне понятна. Так, выяснена возможность изменения кровотока в сосудах кишечника, усиления липолиза в адипоцитах, увеличения глюконеогенеза в печени и почках.
Витамин D3, уже упомянутый выше, является вторым сильным гуморальным агентом в системе регуляции кальциевого гомеостаза. Его мощное однонаправленное действие, вызывающее повышение всасывания кальция в кишечнике и увеличение концентрации Са++ в крови, оправдывает другое название этого фактора - гормон D. Биосинтез витамина D представляет собой сложный многоэтапный процесс. В крови человека могут одновременно находиться около 30 метаболитов, дериватов или предшественников наиболее активной 1,25(ОН)2-дигидроксилированной формы гормона. Первым этапом синтеза является гидроксилирование в положении 25 углеродного атома стирольного кольца витамина D, который или поступает с пищей (эргокальциферол) или образуется в коже под влиянием ультрафиолетовых лучей (холекальциферол). На втором этапе происходит повторное гидроксилирование молекулы в положении 1а специфическим ферментом проксимальных почечных канальцев - витамин D-la-гидроксилазой. Среди множества дериватов и изоформ витамина D лишь три обладают выраженной метаболической активностью - 24,25(OH)2D3, l,24,25(OH)3D3 и l,25(OH)2D3, однако только последний действует однонаправленно и в 100 раз сильнее остальных вариантов витамина. Действуя на специфические рецепторы ядра энтероцита, витамин Dg стимулирует синтез транспортного белка, осуществляющего перенос кальция и фосфата через клеточные мембраны в кровь. Обратная отрицательная связь концентрации 1,25(ОН)2 витамина Dg и активности lа-гидроксилазы обеспечивает ауторегуляцию, не допускающую переизбытка активного витамина D4.
Существует также умеренный остеорезорбтивный эффект витамина D, который проявляется исключительно в присутствии паратгормона. Витамин Dg оказывает также тормозящее дозозависимое обратимое действие на синтез паратгормона околощитовидными железами.
Кальцитонин является третьим из основных компонентов гормональной регуляции обмена кальция, однако действие его намного слабее предыдущих двух агентов. Кальцитонин представляет собой 32 аминокислотный белок, который секретируется парафолликулярными С-клетками щитовидной железы в ответ на повышение концентрации внеклеточного Са++. Его гипокальциемическое действие осуществляется через ингибирование активности остеокластов и увеличение экскреции кальция с мочой. До сих пор физиологическая роль кальцитонина у человека окончательно не установлена, так как оказываемый им эффект на кальциевый обмен является незначительным и перекрывается другими механизмами. Полное отсутствие кальцитонина после тотальной тиреоидэктомии не сопровождается физиологическими отклонениями и не требует заместительной терапии. Значительный избыток этого гормона, например, у больных медуллярным раком щитовидной железы, не приводит к существенным нарушениям кальциевого гомеостаза.
Регуляция секреции паратгормона в норме
Основным регулятором скорости секреции паратгормона является внеклеточный кальций. Даже небольшое снижение концентрации Са++ в крови вызывает мгновенное увеличение секреции паратгормона. Этот процесс зависит от выраженности и длительности гипокальциемии. Первичное кратковременное снижение концентрации Са++ приводит к высвобождению накопленного в секреторных гранулах паратгормона в течение первых нескольких секунд. Через 15-30 мин длительности гипокальциемии увеличивается также истинный синтез паратгормона. Если стимул продолжает действовать, то в течение первых 3-12 часов (у крыс) наблюдается умеренное повышение концентрации матричной РНК гена паратгормона. Продолжительная гипокальциемия стимулирует гипертрофию и пролиферацию паратиреоцитов, обнаруживаемую через несколько дней-недель.
Кальций действует на околощитовидные железы (и другие эффекторные органы) через специфические кальциевые рецепторы. Впервые предположил существование подобных структур Brown в 1991г., а позднее рецептор был выделен, клонирован, изучены его функции и распределение. Это первый из рецепторов, обнаруженных у человека, который распознает непосредственно ион, а не органическую молекулу.
Человеческий Са++-рецептор кодируется геном на хромосоме 3ql3-21 и состоит из 1078 аминокислот. Молекула белка-рецептора состоит из большого N-концевого внеклеточного отрезка, центрального (мембранного) ядра и короткого С-концевого внутрицитоплазматического хвоста.
Открытие рецептора позволило объяснить происхождение семейной гипокальциурической гиперкальциемии (обнаружено уже более 30 различных мутаций гена рецептора у носителей этой болезни). Активирующие Са++-рецептор мутации, приводящие к семейному гипопаратиреозу, также были установлены недавно.
Са++-рецептор широко экспрессирован в организме, причем не только на органах, участвующих в метаболизме кальция (околощитовидные железы, почки, С-клетки щитовидной железы, клетки костной ткани), но и на других органах (гипофиз, плацента, кератиноциты, молочные железы, гастрин-секретирующие клетки).
Недавно обнаружен другой мембранный кальциевый рецептор, расположенный на паратиреоцитах, плаценте, проксимальных почечных канальцах, роль которого еще требует дальнейшего изучения кальциевого рецептора.
Среди других модуляторов секреции паратгормона следует отметить магний. Ионизированный магний обладает действием на секрецию паратгормона, подобным действию кальция, но гораздо менее выраженным. Высокий уровень Mg++ в крови (может встречаться при почечной недостаточности) приводит к угнетению секреции паратгормона. В то же время гипомагнезиемия вызывает не увеличение секреции паратгормона, как следовало бы ожидать, а парадоксальное ее снижение, что, очевидно, связано с внутриклеточным угнетением синтеза паратгормона при недостатке ионов магния.
Витамин D, как уже говорилось, также непосредственно влияет на синтез паратгормона через генетические транскрипционные механизмы. Кроме того, 1,25-(ОН) D супрессирует секрецию паратгормона при низком сывороточном кальции и увеличивает внутриклеточную деградацию его молекулы.
Другие гормоны человека оказывают определенное модулирующее действие на синтез и секрецию паратгормона. Так, катехоламины, действуя в основном через 6-адренэргические рецепторы, усиливают секрецию паратгормона. Это особенно выражено при гипокальциемии. Антагонисты 6-адренорецепторов в норме снижают концентрацию паратгормона в крови, однако при гиперпаратиреозе этот эффект оказывается минимальным в силу изменения чувствительности паратиреоцитов.
Глюкокортикоиды, эстрогены и прогестерон стимулируют секрецию паратгормона. Кроме того, эстрогены могут модулировать чувствительность паратиреоцитов к Са++, влияют стимулирующе на транскрипцию гена паратгормона и его синтез.
Секреция паратгормона регулируется также ритмом его высвобождения в кровь. Так, помимо стабильной тонической секреции установлено пульсовой выброс его, занимающий в общей сложности 25 % всего объема. При остро возникающей гипокальциемии или гиперкальциемии первой реагирует именно пульсовая составляющая секреции, а затем, после первых 30 минут, реагирует и тоническая секреция.
Гипокальциемия и гиперкальциемия: аспекты диагностики и лечения

Врач гинеколог-эндокринолог. Стаж 16+ лет. Принимает в Университетской клинике в Санкт-Петербурге. Стоимость приема 2000 руб.
- Запись опубликована: 18.09.2020
- Reading time: 5 минут чтения
Поддерживать нормальный уровень кальция в крови жизненно важно. Основные органы и элементы, вовлеченные в этот процесс, - желудочно-кишечный тракт, почки и кости, гормоны паратиреоидного гормона (ПТГ) и 1,25-дигидроксихолекальциферол (1,25-D 3). Последний также регулирует всасывание кальция в кишечнике.
Более 98% от общего кальция в организме находится в костях, из которых около 1% является динамичным и может проникать во внеклеточную жидкость посредством различных физических, химических и клеточных механизмов. И ПТГ, и 1,25-D 3 стимулируют остеокласты и вызывают резорбцию костей, что приводит к увеличению содержания кальция во внеклеточной жидкости. ПТГ также способствует образованию и реабсорбции кальция в дистальных отделах почечных канальцев.
Кальций в крови присутствует в 3 разных фракциях:
- 50% кальция биологически активен - кальций ионизированный;
- 40% связывается с белками и не фильтруется почками;
- 10% связан с анионами, такими как бикарбонаты, цитраты, сульфаты, фосфаты, лактаты.
Большая часть кальция, связанного с белками, связывается с альбумином, а остальная часть - с глобулинами.
Заболевания, при которых снижается общий белок, также снижают общий кальций, но мало влияют на ионизированный кальций. Каждые 10 г/л альбумина связывает 0,2 ммоль/л кальция, поэтому в случае гипоальбуминемии уровень кальция в крови следует соответственно пересчитать.
На это также влияет pH внеклеточной жидкости. Ацидемия снижает его связывание с белками, что приводит к увеличению ионизированного кальция. Каждое снижение pH увеличивает ионизированный кальций на 0,05 ммоль/л. Поправки на кальций для содержания альбумина или pH плохо репрезентативны для исследования ионизированного кальция. Последнее может выполнить большинство лабораторий, поэтому следует учитывать возможную патологию пациента, исследуя этот показатель.
Гипокальциемия
Гипокальциемия - это часто диагностируемая биохимическая аномалия, которая в более легких случаях может протекать бессимптомно и быть серьезной при угрожающих жизни кризах. Нормальный уровень кальция в крови составляет от 2,1 до 2,6 ммоль/л. Уровень ниже нормы называется гипокальциемией.
Наиболее частые причины:
Низкий уровень витамина D в крови . Чаще всего встречается у людей с низким уровнем солнечного света и низким содержанием витамина D. Потребность в витамине D особенно повышена у беременных и сразу после родов. Это связано с гипокальциемией у младенцев, находящихся на грудном вскармливании. Гипокальциемия с дефицитом витамина D также часто наблюдается у пациентов, применяющих противосудорожных средств, которые активируют ферменты, способствующие деградации витамина D.
В исследованиях оценивали уровни витамина D в крови детей, живущих в учреждениях для больных с плохо контролируемой эпилепсией. Его дефицит был выявлен у 75% пациентов. Основными факторами, вызывающими остеомаляцию, были недоедание и минимальное воздействие солнечного света.
У пациентов с заболеваниями тонкой кишки, такими как целиакия, гипокальциемия может быть следствием снижения всасывания витамина D и кальция. Гипокальциемия редко наблюдалась у лиц, принимавших продукты с низким содержанием кальция, если уровень витамина D у них был в норме.
Дисфункция паращитовидных желез . Чаще всего это вызвано хирургическим вмешательством на щитовидной железе или другими ятрогенными поражениями. Но также может быть идиопатическим, если причина остается неясной.
Снижение уровня ПТГ в крови приводит к потере кальция почками из-за нарушения образования 1,25-D3. В редких случаях аналогичные биохимические изменения может имитировать резистентность тканей к ПТГ, даже если уровни ПТГ в крови высоки. Это состояние называется псевдогипопаратиреозом, который является генетически гетерогенным заболеванием. У некоторых пациентов могут быть дефекты развития скелета (например, наследственная остеодистрофия Олбрайта), а у родственников пациентов могут быть нарушения метаболизма кальция различной степени. Иногда есть только фенотипические признаки этого синдрома.
Редкие причины : инфильтрация паращитовидных желез тяжелыми металлами (при гемохроматозе, талассемии), медью - при болезни Вильсона, метастазами - при онкологических заболеваниях. Также могут нарушить функцию паращитовидных желез дефицит или передозировка магния.
Клинические симптомы и обследование
Острая гипокальциемия носит симптоматический характер и требует немедленной медицинской помощи и госпитализации. Если уровень кальция в крови снижается постепенно, пациент может долгое время не ощущать симптомов.
Наиболее частые симптомы гипокальциеми:
- парестезии;
- мышечные спазмы;
- судороги;
- онемение вокруг губ.
Гипокальциемия также может проявляться ларингоспазмом, нервно-мышечной раздражительностью, когнитивными нарушениями, изменениями личности, удлинением интервала QT на электрокардиограмме или изменениями, имитирующими инфаркт миокарда или сердечную недостаточность.
Важно выяснить в семейном анамнезе возможную причину наследственного гипопаратиреоза. Генетические аномалии подозреваются по причине роста или умственной отсталости, нарушениях слуха.
Также является показанием для дальнейшего исследования операция на голове или шее в анамнезе. При осмотре пациента следует оценить наличие рубца в области шеи.
Гипокальциемия характеризуется симптомами Хвостека и Труссо.
- Симптом Хвостека выражается подергиванием верхней губы при перкуссии щеки перед мочкой уха на 2 см ниже разрастания челюсти (п. лицевой проекции).
- Симптом Труссо более точен. Если поместить тонометр на руку, надуть его выше систолического артериального давления и удерживать в течение 3 минут - возникает спазм мышц запястья.
Диагностическое обследование
При гипопаратиреозе выявляют низкий уровень кальция, ПТГ, 1,25-D3, гиперфосфатемию, гиперкальциурию. Рекомендуется тестирование на ионизированный кальций, особенно у тяжелых пациентов.
Лечение острой гипокальциемии
Когда общий уровень кальция составляет менее 1,9 ммоль/л или уровень ионизированного кальция менее 1 ммоль/л, или когда возникают симптомы гипокальциемии проводится внутривенное вливание кальция. Чтобы избежать экстравазации и раздражения окружающих тканей, что особенно характерно для хлорида кальция, рекомендуется вводить через центральный венозный катетер глюконат кальция.
1-2 мл 10%. ампулы глюконата кальция разводят в 50-100 мл декстрозы. Фосфаты и бикарбонаты нельзя добавлять вместе, чтобы избежать выпадения осадка.
При необходимости следует также назначать пероральные добавки кальция и витамин D. Следует устранять дефицит магния или алкалоз. Устойчивость периферических тканей к ПТГ может сохраняться в течение нескольких дней.
Лечение хронической гипокальциемии
В зависимости от причины следует назначать добавки кальция и магния, 25 (ОН) витамина D или 1,25 (ОН) витамина D. Пациентам следует сообщить, какие продукты питания или другие лекарства могут влиять на всасывание кальция.
При гипопаратиреозе целью лечения является поддержание количества кальция в крови в более низком диапазоне нормы, не вызывая гиперкальциурии и избегая образования камней в почках.
Обычно назначаются с добавками кальция аналоги активного витамина D (альфакальцидол или кальцитриол). Тиазидные диуретики могут снижать выведение кальция с мочой.
Гиперкальциемия
Гиперкальциемия - это состояние, при котором поступление кальция во внеклеточную жидкость превышает его утилизацию или удаление.
Первичный гиперпаратиреоз
Наиболее частые причины гиперкальциемии:
- Первичный гиперпаратиреоз . Это наиболее частая причина гиперкальциемии, обнаруживаемая более чем у половины пациентов. Патология чаще всего встречается у женщин и связана с доброкачественной аденомой паращитовидной железы. Карциномы паращитовидных желез очень редки. Повышенный уровень ПТГ в крови увеличивает количество 1,25-D3, что приводит к увеличению реабсорбции кальция в почечных канальцах и усилению резорбции костей. Заболевание диагностируется по выраженному увеличению ПТГ и небольшому увеличению кальция в крови при нормальной функции почек. После диагностики камней в почках, когда камни содержат до 6% кальция, у этих пациентов может быть первичный гиперпаратиреоз.
- Злокачественные новообразования . Гиперкальциемия вызывается прямым разрушением костей или секретируемыми ими кальциевыми факторами. Гиперкальциемия чаще всего вызывается плоскоклеточной карциномой легких, метастатическим раком груди. Также существует значительный риск миеломы, Т-клеточных опухолей, почечно-клеточной карциномы и других плоскоклеточных опухолей. Ряд опухолей продуцирует ПТГ-подобный белок, который действует аналогично ПТГ, но не может быть обнаружен обычными тестами.
- Тиазидные диуретики . Они увеличивают реабсорбцию кальция. Гиперкальциемия корректируется после отмены препарата. Гиперкальциемия часто встречается у более молодых пациентов, что вызвано ускоренной резорбцией костей. Особенно ярко выражено при почечной недостаточности.
- Гранулематозные заболевания (саркоидоз, туберкулез, проказа). Клетки гранулематозной ткани способны активировать витамин D, который увеличивает количество кальция в крови.
- Семейная гипокальциальная гиперкальциемия. Это аутосомно-доминантное наследственное заболевание, которое вызывает легкую гиперкальциемию, умеренную гипофосфатемию и снижение выведения кальция почками. Наследственная мутация рецептора кальция. Уровни ПТГ в норме.
- Тиреотоксикоз . Избыток гормонов щитовидной железы стимулирует остеокласты и увеличивает резорбцию костей;
- Отравление витамином D .
Чаще всего наблюдается гипокальциемия у пациентов с почечной недостаточностью. Правда, у этих пациентов бывают случаи и чрезмерного содержания кальция в крови. Обычно это происходит, когда основное заболевание (саркоидоз, миелома, травма) вызывает гиперкальциемию, и это становится причиной почечной недостаточности.
При длительной почечной недостаточности паращитовидные железы гиперплазируют и начинают функционировать автономно. После трансплантации почки эта вегетативная функция паращитовидных желез сохраняется, и наблюдается гиперкальциемия.
Симптомы гиперкальциемии зависят от количества кальция и скорости его увеличения.
Легкая гиперкальциемия, характерная для первичного гиперпаратиреоза, обычно протекает бессимптомно.
Более выраженная гиперкальциемия обычно вызывает неврологические, желудочно-кишечные и почечные симптомы.
- Неврологические симптомы варьируются от легкой сонливости до слабости, депрессии, летаргии, ступора или комы;
- Желудочно-кишечные симптомы - запор, тошнота, рвота, анорексия, язва желудка.
Гиперкальциурия может привести к нефрогенному недиабетическому диабету, что приводит к уменьшению объема циркулирующей крови и замедлению скорости клубочковой фильтрации. Это приводит к еще более быстрому увеличению количества кальция в крови. Гиперкальциемия также может привести к образованию камней в почках или кальцинозу.
Лечение гиперкальциемии
Лечение гиперкальциемии зависит от ее тяжести и причины. Во-первых, можно прекратить прием отягчающих состояние препаратов, таких как тиазидные диуретики. Во-вторых, следует избегать иммобилизации.
Рекомендуется пить больше жидкости, чтобы увеличить объем циркулирующей крови и снизить влияние агента на функцию почек.
Легкая гиперкальциемия
Чаще всего вызывается первичным гиперпаратиреозом. Хирургическое лечение при таком состоянии не показано, но пациенты должны находиться под наблюдением и оцениваться на предмет симптомов, артериального давления, уровня кальция, функции почек, экскреции кальция с мочой, визуализационных исследований почечнокаменной болезни, минеральной плотности костей.
Показания к операции на паращитовидных железах:
- содержание кальция > 2,85 ммоль/л;
- эпизоды опасной для жизни гиперкальциемии;
- снижение клиренса креатинина;
- камни в почках;
- повышенное выведение кальция с мочой;
- снижение минеральной плотности костей (>2 SD).
Умеренная гиперкальциемия
Обычно это пациенты с симптомами. Тактика лечения зависит от тяжести симптомов и обычно коррелирует со скоростью повышения уровня кальция в крови.
- Назначаются внутривенные вливания раствора хлорида натрия.
- Если есть опасения перегрузки жидкостью (сердечная недостаточность), может быть назначен петлевой диуретик.
Если этих препаратов недостаточно, можно назначить бисфосфонат.
Тяжелая гиперкальциемия
Тяжелая гиперкальциемия диагностируется при пороге >3,375 ммоль/л кальция в крови. Это состояние требует срочного лечения, так как жизнь пациента находится в опасности.
- Сначала вводятся внутривенные жидкости, бисфосфонаты и другие агенты.
- При повышенном уровне ПТГ проводится неотложная паратиреоидэктомия.
Поддержание нормального уровня кальция в крови особенно важно, и в случае отклонений от нормы в результатах анализов уровень кальция следует скорректировать и своевременно назначить соответствующее лечение.
Гиперпаратиреоз - симптомы и лечение
Что такое гиперпаратиреоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Курашова О. Н., эндокринолога со стажем в 28 лет.
Над статьей доктора Курашова О. Н. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Гиперпаратиреоз — это эндокринное заболевание, развивающееся при чрезмерном количестве паратиреоидного гормона (паратгормона) в организме, который выделяется околощитовидными железами.
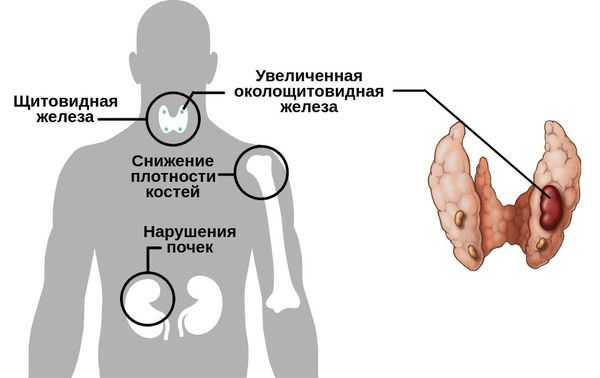
Существуют разные формы данного нарушения.
Первичный гиперпаратиреоз помимо нарушения околощитовидных желёз и избыточного выделения паратиреоидного гормона сопровождается верхне-нормальным или повышенным содержанием кальция в крови. Среди эндокринных заболеваний он встречается довольно часто: по распространённости эта форма гиперпаратиреоза находится на третьем месте после сахарного диабета и патологий щитовидной железы.
Ежегодная заболеваемость первичной формой составляет около 0,4-18,8% случаев на 10000 человек, а после 55 лет — до 2% случаев. [6] [12] У женщин эта патология возникает чаще, чем у мужчин — примерно 3:1. Преобладающее число случаев первичного гиперпаратиреоза у женщин приходится на первое десятилетия после менопаузы.
Первичный гиперпаратиреоз может быть как самостоятельным заболеванием, так и сочетаться с другими наследственными болезнями эндокринной системы. [1] [12] Он проявляется многосимптомным поражением различных органов и систем, что приводит к значительному снижению качества жизни с последующей инвалидизацией, а также к риску преждевременной смерти.
Причины возникновения связаны с развитием в одной или нескольких околощитовидных железах таких патологий, как:
- солитарная аденома — до 80-85% случаев;
- гиперплазия (диффузное увеличение желёз) — до 10-15 % случаев;
- рак — до 1-5% случаев;
- спорадические заболевания — до 90-95% случаев.
В 5% случаев на возникновение первичного гиперпаратиреоза влияет наследственность.
При вторичном гиперпаратиреозе кроме общих клинических признаков заболевания отличается снижением кальция и повышением фосфора в крови. Эта форма болезни обычно развивается как реакция компенсации и сочетает в себе усиленный синтез паратгормона и изменения в паращитовидных железах. Как правило, обнаруживается при синдроме недостаточного всасывания кальция в тонком кишечнике, дефиците витамина D и хронической почечной недостаточности.
Третичный гиперпаратиреоз развивается в случае аденомы околощитовидной железы и повышенном выделении паратгормона в условиях длительного вторичного гиперпаратиреоза.
Псевдогиперпаратиреоз развиваться п ри других злокачественных опухолях, которые способны продуцировать вещество, похожее на паратгормон.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы гиперпаратиреоза
Гиперпаратиреоз протекает длительно и бессимптомно и может быть выявлен случайно во время обследования по поводу другого заболевания.
У пациентов с гиперпарат иреозом одновременно возникают симптомы поражения различных органов и систем: язва желудка, остеопорозные проявления, мочекаменная и желчнокаменная болезни и другие. При пальпации шеи в зоне паращитовидных желёз можно нащупать достаточно большую "аденому".
Развивается быстрая утомляемость при физической повседневной нагрузке, мышечная слабость, ноющая головная боль, затруднение при ходьбе (особенно во время подъёма по лестнице или при преодолении больших расстояний), формируется как бы переваливающаяся походка.
У большинства людей с гиперпаратиреозом нарушено восприятие и память, они эмоционально неуравновешенны, тревожны, депрессивны.
При опросе пациенты с подозрением на нарушение функции околощитовидных желёз обычно жалуются на:
- длительно существующие боли в костях рук и ног, неровности и деформирующие изменения, возникающие при надавливании, частые судороги в ногах;
- эмоциональную неустойчивость, беспокойство и нарушение концентрации внимания, возникающее при нахождении в обществе;
- частое желание пить жидкость — вплоть до жажды с учащённым мочеиспусканием (не связанное с сахарным или несахарным диабетом);
- прерывистое нарушение сна и значительную утомляемость при выполнении любой работы;
- неуверенность и шаткость при ходьбе;
- повышенную потливость всего тела и конечностей;
- периодические сердцебиения днём и ночью;
- искривления и переломы (в основном трубчатых костей) при непредсказуемых обстоятельствах (даже при движениях лёжа в постели) — возникает в позднем периоде заболевания, сопровождается ноющими болями в позвоночнике.
Если патологический процесс в костях продолжает развиваться, это может стать причиной расшатывания и выпадения здоровых зубов, а также деформации костей скелета, в связи с которой пациенты становятся ниже ростом. Возникающие переломы очень медленно восстанавливаются, часто с деформациями р ук и ног и образованием непрочных суставов. На конечностях появляются кальцинаты — результат отложения солей.
У женщин с повышенной функцией щитовидной железы в менопаузе риск костных осложнений возрастает.
В большинстве случаев первые проявления гиперпаратиреоза сопровождаются:
- давно диагностированными нарушениями опорно-двигательного аппарата;
- хроническими заболеваниями почек (мочекаменная болезнь, отложение солей кальция в почках);
- нарушениями желудочно-кишечного тракта (панкреатит и кальцинат поджелудочной железы);
- выраженными, ранее нелеченными нейрокогнитивными и психическими расстройствами; в сочетании с гипертрофией миокарда левого желудочка (утолщением стенок сердца), а также нарушением проводимости и ритма сердца — зависят от уровня паратгормона.
При развитии поражения сосудов в виде кальциноза и склероза нарушается питание тканей и органов, а повышенный уровень кальция в крови способствует развитию и ухудшению ишемической болезни сердца.
Гиперпаратиреоз с нехарактерными симптомами и постепенным началом часто сопровождается:
- тошнотой, периодическими желудочными болями, рвотой, метеоризмом, снижением аппетита, резким падением веса;
- возникновением пептических язв с кровотечениями;
- поражением поджелудочной железы и желчного пузыря;
- на поздних стадиях — нефрокальцинозом, признаками прогрессирующей почечной недостаточности с последующей уремией (крайне опасным отравлением организма).
Патогенез гиперпаратиреоза
Кальций является важным компонентом, который влияет на прочность костей и обменные процессы в организме. В норме уровень кальция, а также фосфора поддерживает паратгормон, выделяемый околощитовидными железами.
При аденоме или ином нарушении этих желёз взаимосвязь кальция и паратгормона нарушается: если раньше повышенное содержания кальция сдерживало уровень паратгормона, то теперь развивается дефект рецепторов, чувствительных к кальцию, которые расположены на поверхности главных клеток паращитовидных желёз.
В связи с этим в организме происходит ряд нарушений:
- активируются остеобласты (молодые клетки костей) и увеличивается количество остеокластов (клеток, уничтожающих старые костные ткани), что приводит к ускорению естественного разрушения (растворения) костей и костеобразования — если уровень паратгормона повышен довольно длительно, то процессы разрушения начинают преобладать;
- снижается почечный порог обратного всасывания фосфатов (проявляется гипофосфатемией и гиперфосфатурией);
- в кишечнике всасывается дополнительное количество кальция; [2][7][9]
- в случае гиперплазии (увеличения количества клеток паращитовидных желёз) происходит нерегулируемая гиперпродукция паратгормона. [17]
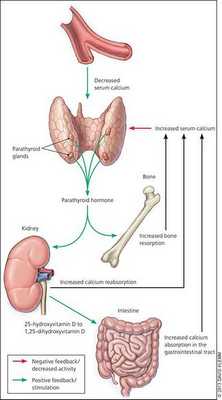
При избытке паратгормона усиливается выведение из костной ткани кальция и фосфора. Клинически это проявляется изменениями в костях: их искривлением и размягчением, возникновением переломов. При этом уровень кальция в костях снижается, а его уровень в крови заметно увеличивается, т. е. возникает гиперкальциемия. Она проявляется мышечной слабостью, избыточным выделением минералов с мочой при усиленном мочеиспускании и постоянной жаждой, что приводит к почечнокаменной болезни и нефрокальцинозу — накоплению и отложению солей кальция в главной ткани почек. Также избыток кальция в крови становится причиной нарушения тонуса сосудов и возникновения артериальной гипертензии. [1] [12]
У пациентов с первичным гиперпаратиреозом часто наблюдается острая нехватка витамина D, а после оперативного лечения заболевания повышается вероятность развития синдрома голодных костей — последствия гиперкальциемии. [15]
Классификация и стадии развития гиперпаратиреоза
Как уже говорилось, бывает первичный, вторичный и третичный гиперпаратиреоз. При этом первичную форму заболевания разделяют на три вида:
- субклинический — заболевание развивается без явных проявлений, можно заподозрить только по результатам биохимии крови;
- клинический — возникают выраженные симптомы болезни (нарушения опорно-двигательного аппарата, почек и ЖКТ);
- острый первичный — возникновение гиперкальциемического криза.
Согласно МКБ 10, выделяют четыре формы заболевания:
- первичный гиперпаратиреоз;
- вторичный гиперпаратиреоз;
- иные формы гиперпаратиреоза;
- неуточнённый гиперпаратиреоз.
Другая классификация гиперпаратиреоза, опубликованная в 2014 году, по степени выраженности симптомов разделяет заболевание на три формы:
- нормокальциемическую — определяется неизменными показателями общего и ионизированного кальция (с поправкой на альбумин), а также паратгормона за весь период наблюдения (двукратное определение этих показателей с интервалом в 3-6 месяцев);
- мягкую — можно установить при появлении жалоб (низкотравматичных переломов) и лабораторном подтверждении умеренно повышенного уровня кальция и паратгормона в крови;
- манифестную — возникает впервые, причём остро, сопровождается нарушениями костной ткани или внутренних органов, возникает риск развития гиперкальциемического криза.
В зависимости от того, какие именно органы или системы поражены, выделяют:
- костный гиперпаратиреоз — де формация конечностей, внезапные переломы, возникающие как бы сами по себе, остеопороз с возможными кистозными образованиями, болезнь Реклингхаузена;
- висцеральный гиперпаратиреоз — поражением внутренних органов:
- почечный — отличается тяжёлым течением, возникают частые приступы почечной колики, возможно развитие почечной недостаточности;
- желудочно-кишечный — холецистит, панкреатит, язвенная болезнь желудка и двенадцатиперстной кишки;
- смешанный гиперпаратиреоз — одновременное возникновение костных и висцеральных нарушений.
Осложнения гиперпаратиреоза
Длительное течение заболевания сказывается на формировании костей. Так, н а поздних стадиях вовремя не диагностированного гиперпаратиреоза наблюдаются:
- разрушение дистальных или концевых фаланг конечностей;
- сужение дистального отдела ключиц;
- очаги разрушения костей черепа;
- бурые опухоли длинных костей.
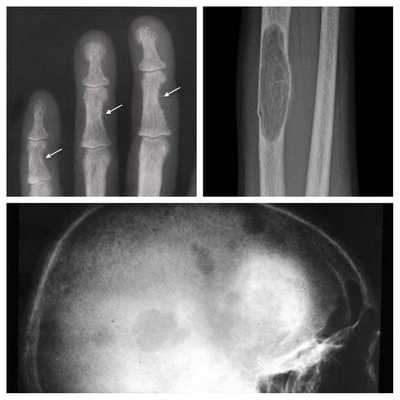
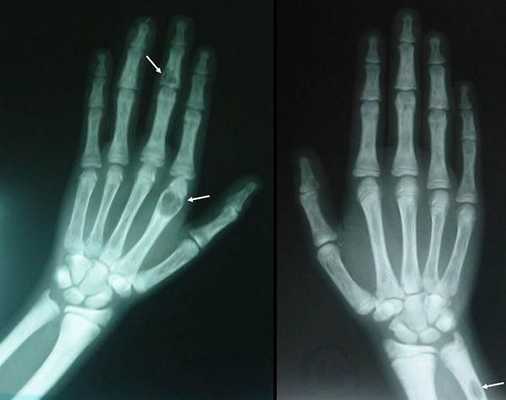
Самое тяжёлое осложнение гиперпаратиреоза — гиперкальциемический криз. Он возникает внезапно после резкого повышения уровня кальция в крови до 3,5-5 ммоль/л (в норме этот показатель составляет 2,15-2,50 ммоль/л). [17] Проявляется резким обострением всех симптомов гиперпаратиреоза.
Пусковые механизмы осложнения — острые инфекционные заболевания (чаще всего ОРВИ), внезапный перелом, длительный постельный режим, беременность, бесконтрольный приём препаратов, содержащих кальций и витамин D, а также тиазидных мочегонных средств.
Риск возникновения криза зависит от того, насколько повышен уровень кальция в крови. [17]
Читайте также:
- КТ, МРТ при первичном синовиальном хондроматозе височно-нижнечелюстного сустава (ВНЧС)
- Брюшная часть аорты. Топография брюшной аорты. Синтопия брюшной части аорты.
- Техника, этапы операции ревизии несвязанного эндопротеза плечевого сустава
- Диагностика розеткообразующей глионейрональной опухоли по КТ, МРТ
- Синдром Альфреда Фогта (Alfred Vogt)
