Механизм экспорта иРНК из ядра
Добавил пользователь Валентин П. Обновлено: 21.01.2026
Ядерно-цитоплазматический транспорт (или же нуклеоцитоплазматический транспорт) можно разделить на активный и пассивный. Пассивный транспорт протекает за счет диффузии веществ через ядерные поры. Активный транспорт субстратов - специфический процесс, требующий энергетических затрат. Для достижения этой субстрат-специфичности ядерно-цитоплазматического транспорта существуют селективные белковые рецепторы, называемые транспортинами. Эти белки иногда делят соответственно их роли в транспорте на импортины и экспортины. Импортины переносят субстраты из цитоплазмы в ядро, а экспортины - в обратном направлении.
Установлено, что ионы и молекулы размером меньше 9 нм и молекулярным весом менее 60кДа перемещаются через ядерную пору путем пассивной диффузии через узкие каналы (зазоры) между индивидуальными компонентами поры. Транспорт остальных молекул через ЯПК является активным (регулируемым) и требует во многих случаях энергетических затрат. Внутрь ядра активно импортируются ядерные, рибосомальные и сплайсосомные белки, а из ядра активно экспортируются мРНК, тРНК, сплайсосомная РНК и пре-рибосомы. Кроме того, между ядром и цитоплазмой через пору постоянно транспортируются так называемые “шатлинг”-белки (факторы регуляции транспорта; от англ. shuttle - двигаться взад и вперед, курсировать), связывающиеся с транспортируемыми молекулами и нуклеопоринами и обеспечивающими точное и направленное прохождение молекул через отдельные компоненты поры. И, наконец, через эндоплазматический ретикулум, мембраны которого прямо соединяются с наружной мембраной ядерной поры, осуществляется транспорт интегральных мембранных белков и, в частности, белков ламины.
Активный транспорт субстрата из цитоплазмы в ядро или обратно можно в самых общих чертах представить следующим образом. Сначала в донорном компартменте (то есть том, откуда субстрат транспортируется) происходит образование комплекса груз/транспортины. Затем этот комплекс заякоривается на белках ядерной поры и транслоцируется через нее в акцепторный компартмент (то есть в тот, куда происходит транспорт). На следующей стадии комплекс диссоциирует, а груз высвобождается. Наконец, транспортины, принимавшие участие в образовании комплекса, ретранспортируются в донорный компартмент. За некоторыми исключениями, источником энергии для активного ядерно-цитоплазматического транспорта служит гидролиз GTP GTP-азой Ran , осуществляемый в ходе так называемого Ran-цикла.
Разные субстраты могут импортироваться в ядро и экспортироваться из него разными способами и при участии разных транспортинов. Но не следует думать, что эти пути транспорта абсолютно независимы друг от друга. Во-первых, большая их часть использует систему Ran-цикла как энергетический ресурс. Во-вторых, некоторые транспортины, например, такие как импортин-бета, могут принимать участие в транспорте нескольких субстратов.
Регуляция транспорта молекул через ядерную пору.
Поскольку активный транспорт молекул между ядром и цитоплазмой, осуществляемый ЯПК, является жизненно важным для обеспечения различных внутриклеточных процессов, то он контролируется многими факторами. Они включают в себя 3 взаимодействующих между собой системы: 1) комплекс биохимических регуляторов, находящихся в ядре или в цитоплазме и связывающихся с сигнальными последовательностями транспортируемой молекулы и белками ядерной поры; 2) комплекс нуклеопоринов, формирующих ЯПК и способных взаимодействовать друг с другом и биохимическими регуляторами, и 3) структурный комплекс поры, состоящий из набора индивидуальных компонентов, специфически меняющих пространственную организацию в процессе транспорта молекул и обеспечивающих, таким образом, их более эффективный перенос в нужном направлении. Рассмотрим коротко, как регулируется транспорт этими тремя системами.
Первая система .
Биохимические регуляторы насчитывают 5 основных типов белков, участвующих, как в импорте, так и в экспорте молекул: 1) транспортины (импортин a, импортин b и ряд других факторов); 2) Ran-белок (гуанозинтрифосфатаза), 3) ГТФ (гуанозинтрифосфат), 4) белок р10, а также 5) набор дополнительных белков, обеспечивающих активацию, ингибирование или изменение структурной конформации перечисленных выше белков, а также их транспорт между ядром и цитоплазмой. Функциональная роль каждого из перечисленных регуляторов была установлена в исследованиях, проведенных либо в системе in vitro (с использованием экстрактов из ооцитов амфибий), либо in vivo (преимущественно в экспериментах с дрожжевыми клетками).
Транспортины играют роль рецепторных белков, которые через белки-посредники (адапторные белки) или напрямую связываются с сигнальными участками транспортируемой молекулы. Ran -это белок, который способен утилизировать энергию ГТФ. Он может иметь два состояния: связан либо с ГТФ (Ran-ГТФ) либо с ГДФ (Ran-ГДФ). Ran плохо гидролизует ГТФ, и для изменения его состояния необходимы дополнительные белки, находящиеся в ядре (RCCI) и в цитоплазме (RanGAP1, RanBP1, и RanBP2). Обе формы Ran присутствуют и в ядре и в цитоплазме, однако концентрация Ran-ГТФ выше в ядре, в то время как Ran-ГДФ обнаруживается преимущественно в цитоплазме.
Предполагается, что белок р10 регулирует доступ транспортируемых комплексов в центральный канал поры со стороны цитоплазмы, возможно за счет его взаимодействия с нуклеопоринами, формирующими периферические компоненты поры (запирающая гранула транспортера, внутренние филаменты и другие). Однако основная функция этого белка заключается в том, что он способен связываться с Ran белком (в различных его формах) и транспортировать его в ядро или в цитоплазму.
Процесс импорта молекул в ядро изучен в настоящее время более подробно, чем их экспорт. Первым требованием к транспортируемой молекуле является наличие в ее структуре сигнальной последовательности. Предполагается, что процесс импорта белка в ядро включает в себя несколько последовательных этапов: сначала импортин b связывается с импортином a, который затем напрямую или через адапторные белки узнает сигнальную последовательность в транспортируемой молекуле и связывается с ней. Этот тройной комплекс, благодаря взаимодействию импортина b с одним из периферических нуклеопоринов, закрепляется на периферическом компоненте поры, возможно, на цитоплазматической фибрилле. Параллельно с этим Ran -белок связывается в цитоплазме с ГТФ, после чего этот комплекс также закрепляется на цитоплазматической фибрилле, благодаря взаимодействию Ran -белка с нуклеопорином, недалеко от первого комплекса. Все эти процессы происходят без потребления энергии.
Затем два комплекса взаимодействуют между собой и белком р10, обеспечивающим подготовку периферического отдела центрального канала для транспорта (предполагается, что р10 может открывать вход в центральный канал поры со стороны цитоплазмы). При этом происходит гидролиз ГТФ, и весь сформированный комплекс перемещается с цитоплазматической фибриллы в центральную часть поры и далее транспортируется внутрь ядра. Цитоплазматический вход в центральный канал поры после этого закрывается, а переместившийся в ядро комплекс отделяется от перенесенной молекулы и распадается на димер, состоящий из импортинов a и b, и Ran -ГДФ. Последний комплекс с помощью специфического фактора опять переводится в Ran -ГТФ, который затем разъединяет импортин a и импортин b.
В последнее время появились данные о том, что многие молекулы могут импортироваться в ядро без участия Ran и, соответственно, без потребления энергии. При этом соответствующие транспортины и адапторные белки связываются в цитоплазме с импортируемым субстратом, и этот комплекс проходит через ядерную пору в ядро. В ядре транспортные факторы этого комплекса взаимодействуют с Ran-ГТФ, что приводит к высвобождению импортированного субстрата за счет превращения Ran-ГТФ в Ran-ГДФ. Затем транспортные факторы опять связываются с Ran-ГТФ и этот комплекс возвращается в цитоплазму.
Предполагается, что многие из перечисленных выше биохимических факторов могут принимать участие в регуляции не только импорта, но и экспорта белков, а также РНК из ядра в цитоплазму. Однако процесс экспорта мРНК из ядра является более сложным по сравнению с импортом или экспортом белков, поскольку находится под контролем многих дополнительных факторов, включающих различные РНК-связывающие белки. Так, например, показано, что при экспорте мРНК из ядра она направляется в центральный канал поры 5’-концом, и важную роль в этом процессе, вероятно, играют кэп-связывающие белки, находящиеся на 5’-конце мРНК. Показано также, что для каждого класса РНК (мРНК, тРНК, рРНК, сплайсосомных РНК) существуют свои специфические белки-переносчики, одни из которых отсоединяются от РНК в процессе ее транспорта через пору и остаются в ядре, в то время как другие сопровождают молекулу РНК в цитоплазму.
При экспорте молекул Ran-ГТФ образует комплекс с транспортинами, соответствующими адапторными белками и экспортируемым субстратом. Весь этот сложный комплекс проходит через пору в цитоплазму. Здесь цитоплазматические факторы RanGAP1, RanBP1, и RanBP2 стимулируют гидролиз ГТФ, что вызывает распад транспортированного комплекса с высвобождением Ran-ГДФ. То есть выделяющаяся при этом энергия используется для освобождения транспортируемых молекул от их переносчиков. Белок р10, который за счет небольших размеров (м.в. 10кДа) может свободно диффундировать между ядром и цитоплазмой, связывается в цитоплазме с Ran-ГДФ и транспортирует его в ядро. В ядре находится связанный с хроматином фактор RCCI, который вызывает высвобождение ГДФ и переход Ran в ГТФ-связанную форму. Процесс циркуляции Ran между ядром и цитоплазмой носит название ГТФ-азного цикла Ran. Таким образом, можно предположить, что градиент концентрации Ran, постоянно поддерживаемый между ядром и цитоплазмой, представляет механизм, определяющий направленность транспорта.
Вторая система .
Из 50 предполагаемых нуклеопоринов (Nup), входящих в состав ядерной поры высших эукариот, в настоящее время описано около 40 белков, 25 из которых уже секвенированы. Практически все белки ядерной поры охарактеризованы дрожжей (30 белков), а экспериментальные данные, полученные на высших организмах, являются малочисленными. Распределение многих нуклеопоринов на различных структурных компонентах поры было изучено иммуногистохимически с использованием антител к этим белкам.
Установлено, что белки ЯПК можно условно разделить на 3 группы: первая содержит в своем составе белки со специфическими повторяющимися последовательностями (типа FXFG и др.), которые узнаются биохимическими факторами; вторая содержит белки, не имеющие таких последовательностей, а третья включает так называемые интегральные белки, локализующиеся либо в мембране ядерной оболочки, формирующей пору, либо в участке поры, находящемся в просвете между ядерными мембранами. Сравнительный анализ нуклеопоринов у высших и низших эукариот показал наличие 30-50% гомологии для 4 пар белков: Nup62/Nsp1p; Nup107/Nup84; Nup155/Nup170; Nup98/Nup116 (первыми в парах указаны белки высших, вторыми - белки низших эукариот; названия белков приводятся согласно общепринятой в литературе классификации). В последнее время было установлено, что нуклеопорины могут образовывать сложные комплексы, состоящие из 5-7 белков, что, вероятно, отражает их участие в формировании индивидуальных компонентов поры. Некоторые из нуклеопоринов, такие, как Nup188, Nup170, Nup157, Nic 96, POM152 составляют до 25% массы ядерных пор и присутствуют в 10-20 копиях на одну пору.
Получены доказательства того, что нуклеопорины принимают непосредственное участие в регуляции транспорта молекул через ЯПК. Благодаря их взаимному контакту, а также взаимодействию с биохимическими факторами, несущими транспортируемую молекулу, они могут обеспечивать ее последовательную передачу, подобно эстафетной палочке, из одного участка ядерной поры в другой. Некоторые из нуклеопоринов могут, очевидно, напрямую связываться с транспортируемой молекулой. Так, например, Nup153 и Nup98, входящие в состав баскет-фибрилл, содержат РНК-связывающие домены, а Nup358 и CAN/Nup214, располагающиеся на цитоплазматических фибриллах поры, узнают сигнальные последовательности некоторых белков. Транспорт молекул через центральные компоненты поры находится под контролем белка Nup62, который является самым представительным и распределен вдоль всего центрального канала.
Третья система .
Использование высокоразрешающего сканирующего электронного микроскопа позволило впервые зафиксировать конформационные изменения индивидуальных компонентов ЯПК в процессе молекулярного транспорта. Было показано, что экспорт гигантской мРНК, синтезируемой генами колец Бальбиани у хирономуса, сопровождается циклической реорганизацией баскета и транспортера, функционирующих, как система открывающихся и закрывающихся диафрагм.
Согласно наблюдениям, сделанным нами в сканирующем электронном микроскопе, в неактивной поре оба входа в центральный канал поры закрыты периферическими гранулами транспортера. Кроме того, вход в пору со стороны ядра дополнительно закрыт фибриллами баскета. На первом этапе экспорта молекула РНК, упакованная в процессе транскрипции с белками в 50 нм РНП частицу, перемещается внутри ядра к поре и прикрепляется к верхушке баскета. Предполагается, что Nup153 и Nup98, входящие в состав баскета, принимают активное участие в этом событии. Баскет-фибриллы формируют увеличивающееся в размере кольцо, которое постепенно захватывает частицу, и она погружается внутрь баскета. Поскольку максимальный диаметр центрального канала ЯПК составляет всего 26 нм, РНП частица внутри баскета декомпактизуется в 26 нм фибриллу. Было также обнаружено, что РНП частица вращается внутри баскета, что, вероятно, связано с необходимостью ее транспортировки в пору 5’-концом. Таким образом, баскет структура выполняет как бы роль “таможни”, проверяя и подготавливая молекулу РНП к транспорту через пору.
На следующем этапе в периферической грануле транспортера со стороны ядра открывается отверстие и РНП фибрилла начинает перемещаться внутрь поры. Внутренний диаметр центральных цилиндров транспортера, имевший до этого размер 10 нм, расширяется до 26 нм, и фибрилла транспортируется через них дальше, в сторону цитоплазмы. Периферическая гранула транспортера со стороны цитоплазмы также формирует отверстие диаметром 26 нм, и РНП фибрилла постепенно полностью выходит в цитоплазму, где начинается процесс трансляции. После окончания транспорта все компоненты ЯПК быстро возвращаются в исходное состояние. Было установлено, что в процессе транспорта периферические гранулы транспортера могут перемещаться в вертикальном направлении на 5 нм, а сама пора - уплощаться или вытягиваться, способствуя, таким образом, более эффективному перемещению транспортируемой молекулы. Все эти данные свидетельствуют о том, что ЯПК является очень пластичной и динамичной структурой, непосредственно участвующей в регуляции транспорта. Вместе с тем следует отметить, что в последние годы появились данные о том, что пора может активно транспортировать до 300 и более небольших молекул в секунду. Это предполагает наличие каких-то дополнительных и пока неизвестных нам механизмов обеспечивающих такую высокую скорость перемещения молекул через пору. Поскольку пора с одной стороны тесно связана с ламиной и, следовательно, с ядерным матриксом, а с другой - через ядерную оболочку с цитоскелетом, процесс транспорта через ЯПК может также регулироваться на уровне этих внутриклеточных структур.
Импорт.
Ядерно-цитоплазматический транспорт
Материальный обмен между ядром и цитоплазмой клетки осуществляется посредством ядерных пор — транспортных каналов, пронизывающих двухслойную ядерную оболочку. Переход макромолекул из ядра в цитоплазму и в обратном направлении называется ядерно-цитоплазматическим транспортом.
Содержание
Структура
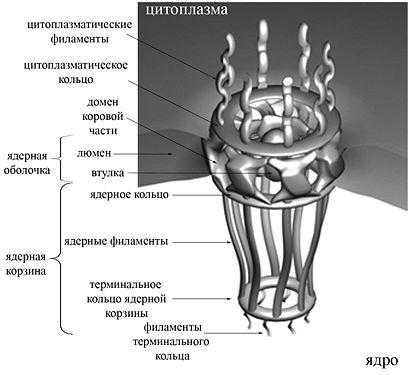
Ядерные поры — это не просто перфорации, а сложно устроенные, многофункциональные регулируемые структуры, организованные приблизительно 30 белками — нуклеопоринами. Белковая составляющая ядерной поры обозначается термином «комплекс ядерной поры» (англ., nuclear pore complex, NPC). Масса комплекса ядерной поры колеблется в пределах от ~44 МДа в клетках дрожжей до ~125 МДа у позвоночных.
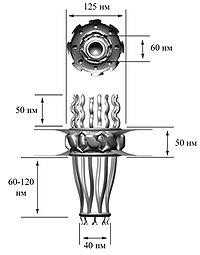
По данным электронной микроскопии, ядерные поры в поперечном сечении имеют форму «восьмиспицевого тележного колеса», то есть имеют ось симметрии восьмого порядка. Эти данные подтверждает тот факт, что молекулы нуклеопоринов присутствуют в составе ядерной поры в количестве, кратном восьми. Проницаемый для молекул канал располагается в центре структуры. Комплекс ядерной поры заякорен на ядерной оболочке с помощью трансмембранной части, от которой к просвету канала обращены структуры, получившие название спиц (англ., spokes), по аналогии со спицами тележного колеса. Эта коровая часть поры, построенная из восьми доменов, с цитоплазматической и ядерной сторон ограничена соответственно цитоплазматическим и ядерным кольцами (англ., rings; у низших эукариот они отсутствуют). К ядерному кольцу прикреплены белковые направленные внутрь ядра тяжи (ядерные филаменты, англ., filaments), к концам которых крепится терминальное кольцо (англ., terminal ring). Вся эта структура носит название ядерной корзины (англ., nuclear basket). К цитоплазматическому кольцу также прикреплены направленные в цитоплазму тяжи — цитоплазматические филаменты. В центре ядерной поры видна электрон-плотная частица, «втулка» или транспортер (англ., plug).
Свойства ядерных пор
Количество ядерных пор на одно ядро может колебаться от 190 у дрожжей, 3000-5000 в клетках человека, до 50 млн в зрелых ооцитах шпорцевой лягушки (Xenopus laevis). Этот показатель может также варьировать в зависимости от типа клетки, гормонального статуса и стадии клеточного цикла. Например, в клетках позвоночных количество ядерных пор удваивается на протяжении S фазы, одновременно с удвоением хромосом. При разборке ядерной оболочки во время митоза ядерные поры позвоночных распадаются на субкомплексы с массами около миллиона дальтон. Показано, что разборка комплекса ядерной поры инициируется циклин B-зависимой киназой, фосфорилирующей нуклеопорины. После завершения клеточного деления ядерные поры собираются de novo. Ядерные поры интерфазного ядра перемещаются большими массивами, а не независимо друг от друга, причем эти перемещения происходят синхронно с перемещениями ядерной ламины. Это служит доказательством того, что ядерные поры механически связаны между собой и формируют единую систему (англ., NPC network).
Нуклеопорины
Нуклепорины, белки из которых постоены ядерные поры, делят на три подгруппы. К первой относят трансмембранные белки, заякоривающие комплекс в ядерной оболочке. Нуклепорины второй группы содержат характерный аминокислотный мотив — несколько раз повторенные FG, FXFG или GLFG — последовательности (так называемые FG-повторы, где F — фенилаланин, G — глицин, L — лейцин, X — любая аминокислота). Функция FG-повторов, по-видимому, заключается в связывании транспортных факторов, необходимых для осуществления ядерно-цитоплазматического транспорта. Белки третьей подгруппы не имеют ни мембранных доменов, ни FG- повторов, наиболее консервативны среди всех нуклеопоринов, их роль, по-видимому, заключается в обеспечении связывания FG-содержащих нуклепоринов с трансмембранными. Нуклеопорины также отличаются по своей мобильности в составе ядерной поры. Некоторые белки связаны с конкретной порой на протяжении всего клеточного цикла, в то время как другие полностью обновляются всего за несколько минут.
Ядерно-цитоплазматическим транспортом называется материальный обмен между ядром и цитоплазмой клетки. Ядерно-цитоплазматический транспорт можно разделить на две категории: активный транспорт, требующий затрат энергии, а также специальных белков-рецепторов, и пассивный транспорт, протекающий путем простой диффузии молекул через канал ядерной поры.
Пассивный транспорт
Молекулы небольших размеров (ионы, метаболиты, мононуклеотиды и т. д.) способны пассивно диффундировать в ядро. Проводимость ядерных пор для молекул разных размеров различна. Белки массой менее 15 кДа быстро проникают в ядро, в то время как для белка массой более 30 кДа на это требуется определенное время. Белковые молекулы массой более 60-70 кДа, по-видимому, вообще не могут пассивно проходить через ядерные поры. Впрочем, пропускная способность ядерных пор для пассивной диффузии может изменяться в зависимости от типа клетки и стадии клеточного цикла.
Активный транспорт

Цикл Ran.
1. Транслокация Ran-ГТФ в цитоплазму в комплексе с транспортинами. 2. Гидролиз ГТФ. Собственная ГФАзная активность Ran активируется цитоплазматическим белком RanGAP. 3. Ran-ГДФ реимпортируется в ядро при участии белка NTF2. 4. ГДФ в активном центре Ran заменяется на ГТФ под действием ядерного белка RCC1 (фактора обмена нуклеотидов).
Пропускная способность ядерной поры для активного транспорта значительно выше. Так рибосомные субчастицы размерами до нескольких мегадальтон транспортируются из ядра в цитоплазму через ядерные поры, и нет никаких оснований предполагать, что процесс транспорта сопровождается частичной разборкой этих субчастиц. Системы активного транспорта обеспечивают весь макромолекулярный обмен между ядром и цитоплазмой. Молекулы РНК, синтезируемые в ядре, поступают через поры в цитоплазму, а в ядро попадают белки участвующие в ядерном метаболизме. Причем одни белки должны поступать в ядро конститутивно (например, гистоны), а другие в ответ на определенные стимулы (например, транскрипционные факторы). У ядерных белков идентифицированы специальные последовательности, отвечающие за их локализацию. Самая распространенная из них, так называемый «классический» сигнал ядерной локализации — NLS (от англ., Nuclear Localization Signal), представляет собой один или два участка положительно заряженных аминокислот, аргинина и лизина. Транслокация белков в ядро, в отличие от транслокации в митохондрии и эндоплазматический ретикулум, не сопровождается отщеплением этой сигнальной последовательности и разворачиванием полипептидной цепи. NLS-содержащие белки, как и все другие субстраты систем ядерного транспорта, переносятся в ядро в комплексе со специальными белками — транспортинами или кариоферинами (англ., transportins, karyopherins). Каждый транспортин или комплекс транспортинов для осуществления своей функции должен обладать тремя активностями: во-первых, он должен узнавать и связывать транспортируемый субстрат, во-вторых, заякориваться на ядерной поре, и в-третьих, связывать небольшой белок — GTPазу Ran, относящуюся к семейству Ras-подобных ГТФаз и служащую для сопряжения транспорта с гидролизом ГТФ, что придает процессу необратимость (снабжает его энергией). Собственно акт гидролиза ГТФ осуществляется непосредственно этим белком. Фактор обмена нуклеотидов (англ., GTPase Еxchange Factor, GEF) для Ran, хроматин-связывающй белок RCC1, локализован строго в ядре, а активаторы ГТФазной активности (англ., GTPase Activation Protein, GAP) RanGAP1 и некоторые другие белки — строго в цитоплазме. Эта асимметричная локализация приводит к формированию градиента: в ядре находится преимущественно ГТФ-связанная форма Ran, в цитоплазме, наоборот, ГДФ-связанная. Ran используется для снабжения энергией как процессов импорта, так и процессов экспорта различных субстратов, а вся схема носит название Ran-цикла (англ., Ran-cycle). Ran-цикл снабжает энергией и экспорт, и импорт, используя общий принципиальный механизм, ключевыми стадиями которого являются гидролиз ГТФ в цитоплазме и обмен ГДФ на ГТФ в ядре.
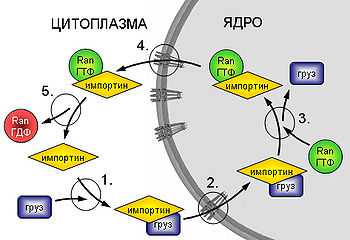
Схема импорта белков в ядро.
1. Образование комплекса груз-рецептор (импортин). 2. Заякоривание комплекса на белках ядерной поры и собственно транслокация. 3. Диссоциация комплекса груз-импортин под воздействием Ran-ГТФ, высвобождение груза, образование комплекса Ran-ГТФ-импортин. 4. Реэкспорт образовавшегося комплекса в цитоплазму. 5. Гидролиз ГТФ и диссоциация комплекса.
Механизм импорта белков в ядро
Рассмотрим механизм поступления субстратов в ядро на примере импорта NLS-содержащих белков. Первой стадией транспортировки является узнавание субстрата транспортинами, в данном случае комплексом импортинов-α/β (транспортины участвующие в транспорте в ядро называются импортинами, а из ядра — экспортинами). Затем образовавшийся комплекс заякоривается на белках ядерной поры с цитоплазматической стороны и транслоцируется через канал в ядро, где с ним связывается Ran-ГТФ, что вызывает диссоциацию комплекса и высвобождение груза. После чего импортины в комплексе с Ran-ГТФ направляются обратно в цитоплазму, где Ran под действием RanGAP1 гидролизует ГТФ (ГТФ => ГДФ + PO4 3- ). Комплекс Ran-ГДФ-импортины α/β нестабилен и диссоциирует. Ran-ГДФ поступает обратно в ядро при помощи собственного переносчика, димерного белка NTF2. В ядре под действием белка RanGEF, ГДФ в активном центре Ran заменяется на ГТФ и цикл, тем самым, замыкается.
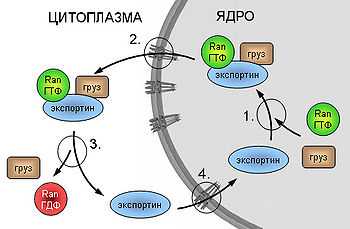
Схема экспорта белков из ядра.
1. Образование комплекса груз-экспортин-Ran-ГТФ. 2. Заякоривание комплекса на белках ядерной поры и собственно транслокация. 3. Гидролиз ГТФ, диссоциация комплекса и высвобождение груза. 4. Реимпорт высвободившегося экспортина.
Механизм экспорта белков из ядра
Теперь рассмотрим механизм экспорта из ядра на примере белков, содержащих сигналы ядерного экспорта (англ., Nuclear Export Signal, NES). Для последовательностей этих сигналов характерно содержание гидрофобных аминокислот. Первой стадией транспортировки здесь также является рецепция субстрата специфическим экспортином Crm1 (англ., Chromosome Region Maintenance) и образование комплекса. Главным отличием механизмов импорта является тот факт, что в состав транслоцирующегося комплекса в случае экспорта помимо субстрата и Crm1 входит и Ran-ГТФ, то есть сопряжение с циклом Ran происходит на стадии транслокации, а не на стадии реимпорта рецептора. После прохождения через ядерную пору в цитоплазму, Ran расщепляет ГТФ, комплекс теряет стабильность и диссоциирует, высвобождая груз.
Транспортные процессы между ядром и цитоплазмой

Когда речь заходит о различиях между про- и эукариотическими клетками, то первым, что можно услышать в ответ, будет замечание о том, что эукариоты обладают ограниченным мембранами ядром, тогда как прокариоты являются безъядерными. И хотя у про- и эукариотов еще множество иных отличий, тем не менее основным признаком, по которому эти организмы делят на два домена, является именно наличие либо отсутствие ядра, что указывает на фундаментальное значение этого органоида. Ядро представляет собой не просто один из многих компартментов внутри клетки, но берет на себя функции основного регулятора ее жизнедеятельности.
Чтобы понять, как же ядро исполняет возложенные на него обязанности, и почему его наличие настолько преображает внутриклеточные процессы, обратимся к его устройству. Ядерная оболочка состоит из двух концентрических фосфолипидных мембран — наружной и внутренней, — удаленных друг от друга на 30 нм (рис. 1).

Рисунок 1 | Ядерная оболочка, цитоплазматическая сторона (атомно-силовая микроскопия).
Надо сказать, такая двухслойная оболочка представляет собой куда более серьезный барьер, чем одинарная цитоплазматическая мембрана, окружающая клетку. Наружная мембрана ядерной оболочки неразрывно связана с лабиринтами ЭПР, а внутренняя мембрана — с сетью промежуточных филаментов, которая сформирована белком ламином и называется ядерной пластинкой, служащей местом прикрепления хромосом. Как и любой другой мембранный компонент, ядерная оболочка обладает избирательной проницаемостью, что необходимо для контролируемого перемещения различных соединений между ядром и цитоплазмой. Такое свойство ядерной оболочке обеспечивают белковые комплексы нуклеопоринов, представляющих собой ядерные поры (nuclear pore complex, NPC), которые в огромном количестве (от двух до пяти тысяч в клетках позвоночных) испещряют мембраны, окружающие ядро (рис. 2).
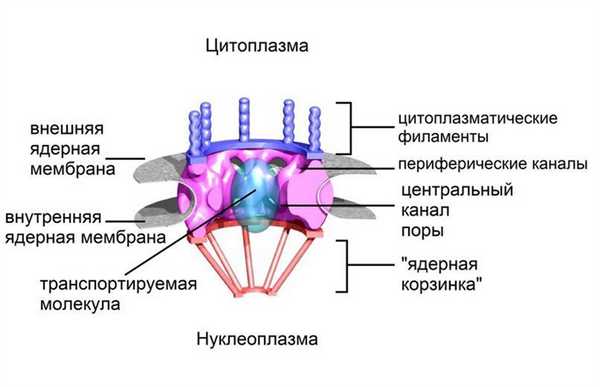
Рисунок 2 | Схематичная структура NPC.
В состав одного комплекса ядерной поры входят различные виды нуклеопоринов (коих около 30-ти), скомпонованных в субкомплексы, каждый из которых представлен несколькими копиями, в результате чего полностью собранный NPC включает в себя от 500 до 1000 отдельных белков. NPC соединяют наружную и внутреннюю мембраны оболочки ядра, формируя при этом водные каналы. Благодаря методам криоэлектронной микроскопии и томографии стало возможным внимательное рассмотрение структуры ядерных пор: центральный канал каждой поры окружен тремя последовательно уходящими вглубь кольцевыми структурами, к которым как со стороны цитоплазмы, так и со стороны ядра прикрепляются белковые нити, что в совокупности по своему виду напоминает корзину (да собственно, так и называется — nuclear basket). Транспорт солей, нуклеотидов, небольших молекул и компонентов, требующихся для синтеза ДНК и РНК, осуществляется через NPC путем пассивной диффузии (рис. 3).
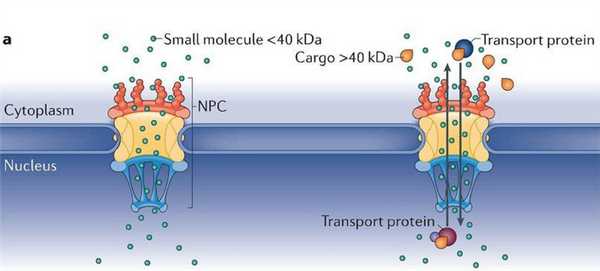
Механизм ядерного транспорта молекул, размер которых не превышает 40 кДа (и диаметром 4-5 нм), заключается в прохождении через NPC без специфического распознавания, путем пассивной диффузии. Более крупные молекулы (белки, некоторые мРНК) связываются с транспортными рецепторами, распознающими особые аминокислотные последовательности (NLS, NES). Пояснения в тексте.
Для импорта в ядро крупных белков, размером крупнее 40-65 кДа, требуется участие транспортных рецепторов, которые чувствительны к сигналам, посылаемым транспортируемыми белками. Одним только созданием диффузионного барьера и контролем ядерно-цитоплазматического транспорта функции NPC не ограничиваются. Данные белковые комплексы задействованы также в таких ядерных процессах, как восстановление ДНК, клеточный цикл, организация хроматина, регуляция транскрипции, созревание РНК (рис. 4).
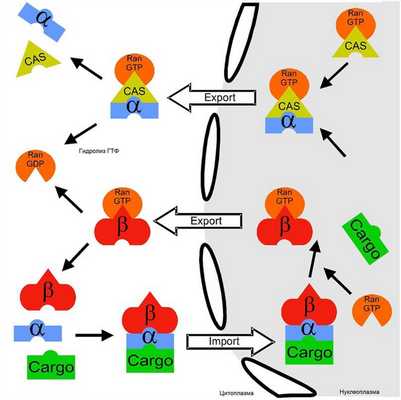
Рисунок 4 | Схематичное представление механизмов ядерно-цитоплазматического импорта и экспорта. Пояснения в тексте.
Обратимся более подробно к упомянутым сигналам, необходимым для переноса крупных белков в ядро или из него. Растворимые транспортные рецепторы семейства кариоферинов распознают в структуре белков специфические аминокислотные последовательности, к которым относятся сигнал ядерной локализации (NLS) и сигнал ядерного экспорта (NES). Распознав нужный участок (типичным признаком NLS является повторение нескольких положительно заряженных аминокислот — лизин, аргинин), транспортные рецепторы либо связываются с ним напрямую, либо с помощью адапторных молекул, в результате чего запускается процесс транслокационных изменений.
Передача сигнала может происходить путем различных механизмов, которые классифицируют по функциональным особенностям NLS.
Например, первыми описанными сигнальными последовательностями были короткие, богатые лизином участки, которые впоследствии стали относить к классическим NLS. Такие NLS связывают домен ARM на С-терминальном конце импортина-α, выполняющего роль адапторного белка, а он, в свою очередь, связывает транспортный рецептор импортин-β, взаимодействуя с доменом αIBB на его N-терминальном конце, то есть, формируется трехкомпонентный комплекс, включающий в себя перемещаемый белок, адаптор и транспортный рецептор. В противоположность данному типу NLS, неклассические NLS связываются с транспортным рецептором без участия адапторных молекул. Например, к белкам, непосредственно распознаваемым импортином-β, относятся рибосомальные белки, транскрипционный фактор CREB, вирусные белки Rev и Tat вируса иммунодефицита человека, SREBP-2, белок Rex Т-лимфотропного вируса человека 1-го типа, циклин В1, Smad3 и т. д.
Теперь, когда с сигнальными последовательностями относительно разобрались, встает вопрос: «А что же с рецепторами?».
У них также имеются важные структурные особенности, обеспечивающие взаимодействие с белками и их перенос. В частности, рецепторы ядерного транспорта, постоянно перемещающиеся между ядром и цитоплазмой, в большинстве своем относятся к семейству β-кариоферина, каждый представитель которого «узнает» специфичную для него группу белков или РНК.
Характерным признаком членов данного семейства рецепторных белков является наличие многоповторных HEAT-мотивов, сформированных двумя антипараллельными амфифильными спиралями, соединенными линкерной областью. Именно эти структуры ответственны за узнавание транспортируемых белков, опосредованное ГТФазой Ran, а также за высвобождение белков после переноса. Таким образом, ГТФаза Ran и белок, который необходимо протащить через ядерную пору, связываются с суперспиралью рецептора изнутри, а нуклеопорины связываются с рецепторами через FG-мотивы снаружи, и таким образом, путем многократных последовательных связываний и разобщений NPC с рецептором белок транспортируется через пору. Кроме того, важно, чтобы комплексы ядерных пор поддерживали гидрофобное микроокружение, поскольку это критично для рецептор-опосредованного транспорта.
По данным кристаллографического анализа комплекса FG-мотива импортина-β, данный рецептор обладает несколькими гидрофобными карманами на выпуклой поверхности, которые предназначены для взаимодействия с гидрофобными остатками FG-Nup (встречаются в составе нуклеопоринов, составляющих комплексы ядерных пор). Отсюда также следует, что помимо размера белка его гидрофобность тесно связана с его способностью проходить через ядерные поры. Однако сильная поверхностная гидрофобность и сильные связи с нуклеопоринами не объясняют в полной мере скорость перемещения белка через NPC, поскольку гидрофобные белки застревают в NPC на некоторое время и не так-то легко высвобождаются в цито-/нуклеоплазму.
При импорте какого-либо белка со стороны ядра к транспортному комплексу присоединяется уже неоднократно упоминаемая ГТФаза Ran, что необходимо для диссоциации импортина-β и высвобождения переносимого субстрата в кариолимфу (рис. 5, 6).

После связывания транспортируемой молекулы в цитоплазме импортины способны взаимодействовать с белками NPC и проходить через центральный канал поры. Оказавшись внутри ядра, комплекс импортина с транспортируемой им молекулой связывается с ГТФазой Ran, что ведет к конформационным изменениям, способствующим высвобождению груза. После высвобождения белка импортин и ГТФаза перебрасываются в цитоплазму.
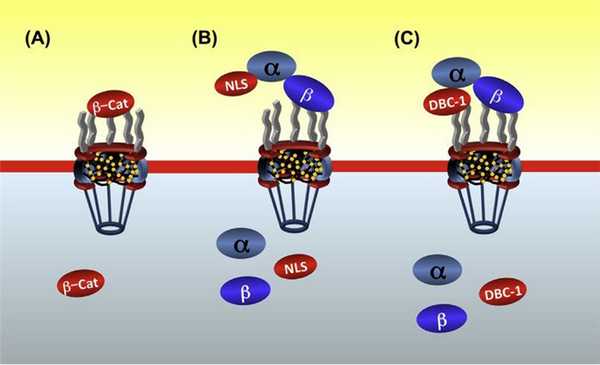
А — рецептор-независимый импорт (бета-катенин взаимодействует с белками NPC напрямую).
В — классический рецептор-зависимый импорт транспортируемой молекулы с образованием комплекса с α- и β-импортинами.
С — особый способ, характерный для некоторых типов белковых молекул, когда возможно взаимодействие как с нуклеопоринами без посредников, так и с участием импортинов.
Ran представляет собой гуаниннуклеотидсвязывающий белок, который может находиться в форме Ran-ГТФ или Ran-ГДФ, в зависимости от того, в каком компартменте клетки он находится. Внутри ядра белок Ran-GEF (фактор обмена гуаниновых нуклеотидов) заботится о том, чтобы Ran оставался связанным с ГТФ. После диссоциации импортинов (как α, так и β) каждый из них своим путем возвращается назад в цитоплазму, чтобы снова участвовать в импорте белков. Импортин-α экспортируется в цитоплазму по Ran-зависимому механизму с помощью рецепторов CAS (cellular apoptosis susceptibility — клеточной чувствительности к апоптозу). Импортин-β выносится из ядра в комплексе с ГТФазой Ran, что препятствует его повторному связыванию с импортином-α в ядре.
Перешедшая таким образом в цитоплазму ГТФаза Ran в комплексе с импортином-β связывается ГТФаза-активирующим белком (GAP), и буквально в следующее мгновение ГТФ гидролизуется до ГДФ. После гидролиза импортин и Ran-ГДФ диссоциируют на отдельные компоненты, и импортин готов для следующего цикла импорта белков внутрь ядра. А Ran-ГДФ, в свою очередь, доставляется назад транспортным фактором NTF-2 (не относится к семейству импортина-β), который специфичен для Ran. В ядре Ran снова принимает форму ГТФ-связанного белка и готовится выполнять свои функции как в качестве помощника для высвобождения транспортируемого белка при импорте в ядро, так и для формирования транспортного комплекса при экспорте белковых молекул из ядра.
Кроме того, существует путь транспорта между ядром и цитоплазмой, для которого участие транспортных рецепторов, таких как импортин-β, не является ключевым моментом. В этом случае перемещаемый белок связывается напрямую с белками NPC (такой транспорт описан, например, для белка Vpr ВИЧ), катализируя свой перенос самостоятельно, без участия каких-либо растворимых факторов.
Через каждую пору ядерной мембраны возможен как импорт, так и экспорт белков (рис. 7).

Экспортины связываются с ГТФазой Ran и экспортируемым белком в ядре; весь комплекс преодолевает центральный канал и оказывается в цитоплазме. Ran-GAP (совместно с RANBP1 и RANBP2) активирует гидролиз ГТФ, связанного с Ran. В итоге Ran-ГДФ взаимодействует с NTF2 и передислоцируется в ядро, где с помощью RAN-обменного фактора RCC1 восстанавливается уровень Ran-ГТФ.
Как уже было сказано выше, размер транспортируемого белка не является единственной детерминантой, предполагающей активный или пассивный транспорт. В том числе это подтверждается тем, что хотя крупные белки и не могут диффундировать через ядерные поры, тем не менее далеко не все небольшие молекулы свободно проникают через ядерную оболочку, напротив, многие из них все равно транспортируются по механизму активного транспорта, т. к. этот процесс подвержен более строгой регуляции.
Например, активный транспорт предполагает вовлечение определенных сигнальных путей, тогда как в отсутствие сигнала нуклеопорины не проявляют аффинных свойств к субстратам. В то же время, мнение ученых о механизмах пассивного транспорта разнятся. Одни придерживаются представления о том, что по краю NPC, вокруг центрального канала поры, располагается восемь маленьких каналов, через которые небольшие молекулы и ионы беспрепятственно диффундируют внутрь ядра (рис. 3).
Другие ученые предполагают, что существует все же только один канал, по которому осуществляется как диффузия, так и активный транспорт. Долгое время считалось, что пассивный транспорт никак не регулируется, кроме как размером пропускного канала, однако позже была выяснена зависимость пропускной способности NPC от концентрации ионов кальция в просвете ядерных пор, что дает возможность для управления и пассивным транспортом молекул.
Расшифрована структура молекулярного механизма, экспортирующего матричную РНК из ядра клетки
Ученым стала более понятна работа крошечного двигателя, выполняющего одну из самых важных биологических функций. С помощью сверхмощного источника рентгеновского излучения Advanced Light Source - синхротрона Национальной лаборатории Лоренса Беркли ( Lawrence Berkeley National Laboratory ) Министерства энергетики США - расшифрована молекулярная структура клеточного механизма, осуществляющего экспорт матричной РНК из ядра клетки.
Матричная РНК ( мРНК ) передает генетическую информацию из ядра в цитоплазму, где на ее основе синтезируются белки - «рабочие лошадки» биологии. Однако ключевой белковый комплекс, помогающий переносить матричную РНК из ядра, был до сих пор изучен недостаточно.
«Наше исследование описывает, как этот белковый комплекс работает на молекулярном уровне», - говорит Бен Монпети (Ben Montpetit), постдокторант лаборатории Карстена Вайса (Karsten Weis), Университет Калифорнии, Беркли ( University of California, Berkeley ), США.
Ученые исследовали белок Dbp5 , ассоциированный с ядерной мембраной клеток грибов, растений и животных. В этих организмах он изменяет форму матричной РНК, что является одним из звеньев цепочки событий, необходимых для ее экспорта из ядра клетки.
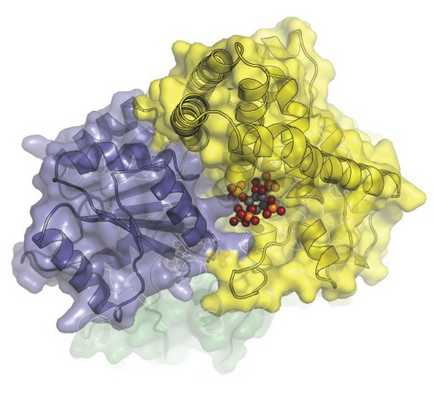
Молекулярный механизм, осуществляющий экспорт матричной РНК из ядра клетки в цитоплазму. На этом изображении белки Dbp5 (сине-серый) и Gle1 (желтый) связаны гексакисфосфатом инозитола ( IP6 ) (цветные сферы). (Изображение: Karsten Weis’ and James Berger’s labs)
Но это только верхушка айсберга. Белок Dbp5 относится к классу ферментов, называемых DEAD-box АТФазами , выполняющих жизненно важную функцию ремоделирования РНК во всех живых организмах - от человека до деревьев и одноклеточных бактерий.
«DEAD-box белки сохранены у всех биологических видов, поэтому знание того, как они работают в данном случае, проливает свет на их функции повсюду в природе», - поясняет Монпети.
Чтобы расшифровать структуру белка Dbp5 дрожжевых клеток на ключевых этапах работы фермента - когда он активируется другим белком, Gle1 , и когда связывается с РНК - ученые использовали синхротрон. Структуры были получены с разрешением от 1 до 4 ангстрем (1 ангстрем равен диаметру атома водорода).
Среди наиболее интересных открытий - роль молекулы, которая, как было известно, участвует в транспорте РНК, но чья точная функция оставалась загадкой. Ученые установили, что эта молекула, называемая гексакисфосфатом инозитола (inositol hexakisphosphate, IP6 ), связывает Gle1 с Dbp5. Это стабилизирует оба белка на время, достаточное для того, чтобы Gle1 активировал Dbp5.
«IP6 действует как молекулярный клей», - объясняет Монпети. «Это один из первых примеров малой эндогенной молекулы, связывающей большие белковые. Зная это, ученые теперь могут продумать, как можно использовать молекулу IP6 для регуляции экспорта матричной РНК в различных условиях, например, при ответе на стресс».
Исследование углубит понимание класса редких, но тяжелых заболеваний, называемых летальными врожденными синдромами контрактур . Вызывающие их мутации обнаружены в генах, кодирующих как Gle1, так и IP6. Теперь, когда роль белка Gle1 в транспорте мРНК раскрыта более глубоко, открываются перспективы для разработки методов лечения, мишенью которых будет его функция.
Модель белкового комплекса в действии: Gle1 (желтый) связывает Dbp5 (зеленый и сине-серый), в результате чего Dbp5 высвобождает РНК (оранжевая). (Видео: Karsten Weis’ and James Berger’s labs)
Исследование, проведенное совместно с биохимиками Натаном Томсеном (Nathan Thomsen) и Джеймсом Бергером (James Berger), также из Университета Калифорнии, Беркли, опубликовано он-лайн в журнале Nature .
© «Расшифрована структура молекулярного механизма, экспортирующего матричную РНК из ядра клетки». Полная или частичная перепечатка материала разрешается при обязательной незакрытой от индексации, незапрещенной для следования робота активной гиперссылке на сайт LifeSciencesToday.
Еще об экспорте матричной РНК из ядра клетки в цитоплазму
Матричные РНК путешествуют из ядра в цитоплазму в белковых «дорожных чемоданах»

Экспорт матричных РНК через комплекс ядерной поры (фиолетовые структуры) как это представляется изнутри клеточного ядра. Голубым показана мембрана клеточного ядра. Красные сферы представляют отдельные позиции матричных РНК. (Рис. Max Brauner/Uni Bonn)
Ученым из Института физической и теоретической химии Боннского университета ( Instituts für Physikalische und Theoretische Chemie Bonn ) впервые удалось в реальном времени зафиксировать экспорт важного информационного носителя биологических клеток, практически не изменив его молекулярную структуру. Исследование показывает, как матричные РНК покидают ядерную мембрану клетки и выходят из ядра в цитоплазму.
Статья об этом исследовании опубликована в журнале Proceedings of the National Academy of Sciences .
План всех живых существ записан в их генетическом материале. У высших организмов он хранится в хорошо защищенном ядре клетки. «Здесь круглосуточно работает своего рода ксерокс, делающий копии информации, необходимые в данный момент» - объясняет первый автор статьи Ян Петер Зибрассе (Jan Peter Siebrasse). Копии содержат информацию, которая необходима клеткам для синтеза жизненно важных ферментов и других строительных материалов. Эти копии и есть матричные РНК, которые случайным образом перемещаются к мембране клеточного ядра, а оттуда через ядерные поры в цитоплазму, которая, как желе, заполняет внутреннее пространство клетки.
Ученые выяснили, что, прежде чем, наконец, выйти из ядра, РНК ненадолго задерживается у ядерной поры - вероятно, для прохождения окончательного «контроля качества», или просто потому, что должна адаптироваться к структуре порового комплекса. Процесс экспорта длится всего лишь от нескольких сотых долей секунды до нескольких секунд. «По всей вероятности, этот процесс требует гораздо большего времени для более крупных, объемных молекул РНК, чем для более мелких», - добавляет ведущий автор публикации профессор Ульрих Кубичек (Ulrich Kubitscheck), руководитель рабочей группы биофизической химии.
Любопытно, что только примерно каждое четвертое столкновение матричных РНК с мембраной клеточного ядра заканчивается успешным экспортом. Здесь можно выделить два типа процессов: с одной стороны, кратковременные столкновения с ядерной мембраной, когда, предположительно, не происходит попадания в ядерные поры; с другой стороны, те переносы, которые медленно прерываются, возможно, потому, что молекула не проходит контроль качества.

Ядра клеток железы ротовой полости: клеточным ядрам соответствуют внутренние овальные области. Матричные РНК в ядрах помечены флуоресцентными красителями и светятся при облучении лазером. (Фото: Jan Peter Siebrasse/Uni Bonn)
Для транспортировки РНК упаковывается в «дорожный чемодан» из белков. Поэтому некоторые из коллег профессора Кубичека предполагают существование помощников за пределами ядра клетки, которые «протаскивают» «чемодан» через поры - теория, проверкой которой сейчас занимается физик и молекулярный биолог Ян Петер Зибрассе.
Что именно происходит на пути от «копировального аппарата» к ядерным порам, было выяснено за последние годы, в частности, рабочей группой того же профессора Кубичека. Основные эксперименты в этой области были проведены биологом доктором Романом Вейтом (Roman Veith). Для этих экспериментов матричные РНК были изменены таким образом, что светились при освещении лазером. Это позволило ученым проследить путь отдельных молекул, содержащих копии генетического материала, в живых клетках железы ротовой полости комара со скоростью до 500 кадров в секунду. Это наблюдение было сделано с помощью светового микроскопа с высокоскоростной камерой.
Теперь, когда процессы переноса «копий» к ядерной мембране стали понятны, профессор Кубичек и его коллеги обратились к процессу транспорта непосредственно через ядерные поры. Чтобы наблюдать этот процесс, нескольких лет своей работы ученые посвятили конструированию высокочувствительного светового микроскопа с подсветкой цели. С помощью такого микроскопа можно получать детальные изображения живых образцов и, в процессе высокочастотной съемки, достигать очень хорошего контраста.
Вопрос о том, как РНК экспортируется из ядра в цитоплазму клетки, представляет для биологии фундаментальный интерес. За последние годы состоялись две публикации об исследованиях в этой области, проведенных группами из США и Израиля. Однако в этих исследованиях вынужденная модификация мРНК, по крайней мере, вдвое увеличила объем молекул. В отличие от этих работ боннская группа модифицировала матричные РНК очень незначительно.
© «Матричные РНК путешествуют из ядра в цитоплазму в белковых «дорожных чемоданах»». Полная или частичная перепечатка материала разрешается при обязательной незакрытой от индексации, незапрещенной для следования робота активной гиперссылке на сайт LifeSciencesToday.
Читайте также:
