Методика установки транспилорического зонда у новорожденного
Добавил пользователь Morpheus Обновлено: 21.01.2026
Правильно подобранное лечебное питание для пациентов в стационаре является одним из компонентов процесса выздоровления. Особую актуальность нутриционная поддержка имеет для пациентов отделений реанимации и интенсивной терапии, как взрослых, так и детей. Коррекция нутриционного статуса в ОРИТ является самостоятельным видом патогенетически направленного лечебного воздействия. Для этого используются методы энтерального и парентерального питания. О современных аспектах энтерального питания (ЭП) у детей рассказала врач-анестезиолог-реаниматолог отделения АиР № 1 ГДИКБ Минска Тамара Волошко.
Особенности нутритивной терапии
Тамара Волошко:
Пациенты в отделении реанимации испытывают стресс и чувство голода независимо от того, находятся ли они в сознании и сами дышат, на ИВЛ или в медикаментозной коме. Для жизнедеятельности организму необходимо определенное количество энергии и строительных субстратов. Мы можем это обеспечить энтеральным либо парентеральным способом.
Американская и Европейская ассоциации по питанию расходятся в определениях энтерального питания. Так, европейцы включают в это понятие и зондовое питание, и сипинги (специализированные смести, которые пациент самостоятельно поглощает маленькими глотками или через трубочку). По американской версии, к энтеральному питанию относится только то, что попадает в ЖКТ, минуя ротовую полость, то есть через зонд.
Специалист обратила внимание на то, что некоторые врачи до сих пор путают понятия «искусственное питание» и «энтеральное питание».
Например, если ребенок через зонд получает протертую пищу, это искусственное питание. При энтеральном используются специализированные лечебные смеси с патогенетически направленным воздействием на организм. Это самостоятельный вид нутритивно-метаболической терапии.
Преимущества ЭП в сравнении с парентеральным:
- компоненты специализированной смеси, попадая в ЖКТ, помогают выработке необходимых гормонов, ферментов, стимулируют нейроэндокринные процессы, способствуют выработке мукозального слоя слизистой кишечника и правильному функционированию лимфоидной ткани ЖКТ;
- не требует соблюдения условий строгой стерильности;
- предотвращает развитие атрофических процессов в ЖКТ;
- более экономичное.
Интересные данные приводят американцы: на одного пациента на ЭП тратится 9 долларов в день, на парентеральном — 55. Помимо этого пациенты на парентеральном питании более длительно задерживаются в ОРИТ, что ведет к дополнительным расходам.
Противопоказания к искусственному питанию: рефрактерный шок; нескорригированная гиповолемия; гиперлактатемия более 4 ммоль/л; декомпенсированный ацидоз (рН менее 7,2); некупируемая артериальная гипоксемия — рО2 менее 60 мм рт. ст.; гиперкапния — рСО2 более 80 мм рт. ст.
Тамара Волошко:
Выставленный диагноз шока не является строгим противопоказанием к назначению ЭП. Следует принимать во внимание дозировки вазопрессоров, которые пациент получает при шоке, рассматривая вопрос о назначении раннего ЭП. Всегда должен быть индивидуальный подход.
Когда назначать и начинать ЭП?
ЭП необходимо назначить, когда пациент:
- не может самостоятельно есть пищу (отсутствие сознания, нарушение глотания и пр.);
- не должен есть пищу (острый панкреатит, желудочно-кишечное кровотечение, механическая кишечная непроходимость, резко выраженная гастроинтестинальная недостаточность и др.);
- не хочет есть пищу (нервная анорексия, инфекции и пр.);
- когда обычное питание неадекватно потребностям (травмы, ожоги, катаболизм).
ЭП может быть начато через 6-12 часов с момента поступления в ОАиР или перенесенного оперативного вмешательства, травмы, шока. Если у пациента на момент поступления уже установлен тонкокишечный зонд — через 2 часа. Энтеральное питание, начатое в течение 24-48 часов, считается ранним и правильным. Более позднее начало требует от врача аргументации.
Если через 24-48 часов из-за высоких остаточных объемов в желудке еще нет возможности кормить пациента адекватно, следует провести зонд в подвздошную кишку любым методом (слепым, эндоскопически или под контролем рентгена).
Врачи-анестезиологи-реаниматологи часто заостряют свое внимание на перфузии, оксигенации тканей, но иногда забывают о кишечнике. Вот только кишечник терпит такое невнимание лишь до определенной степени. Поэтому известный из литературы постулат «Если кишка работает, то используй ее» в последнее время все чаще дополняют: «А если нет, то заставь работать». Имеется в виду, что если у пациента по каким-то определенным причинам не функционирует желудок, например, имеется парез, то необходимо кормить его, проведя зонд в тонкий кишечник.
Положительные эффекты раннего ЭП:
- предотвращает атрофию слизистой ЖКТ и ассоциированной с кишечником лимфоидной ткани;
- снижает выраженность стрессовой реакции;
- достоверно увеличивает мезентеральный и печеночный кровоток;
- снижает частоту желудочно-кишечных кровотечений из острых язв;
- уменьшает риск инфекционных осложнений за счет предотвращения транслокации бактерий и эндотоксинов в портальный кровоток.
Питание через зонд
По продолжительности ЭП выделяют краткосрочное (до 3 недель), средней продолжительности (от 3 недель до 6 месяцев), длительное (более 6 месяцев). В зависимости от предполагаемых сроков решается вопрос о доступе в ЖКТ.
Если предполагается, что пациент будет на лечебном питании максимум до месяца, то используются зонды, устанавливаемые через рот или через нос. Зонд проводится в желудок или тонкий кишечник (при наличии проблем с эвакуацией пищи из желудка). Если пациент будет получать лечебное питание больше месяца, то это является прямым показанием для выполнения стомы.
Золотым стандартом является чрескожная эндоскопическая гастростомия. При длительном лечебном питании выполняется хирургическая гастро- или дуоденостомия. Точка приложения зонда — в желудок или кишечник — определяется исходя из условий применения с учетом преимуществ для конкретного пациента (см. табл. 1).
Таблица 1. Преимущества и условия применения желудочного и кишечного зондов.
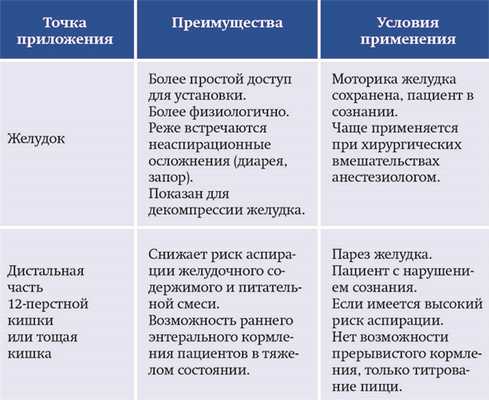
Существует три основных материала, из которых изготавливаются зонды, — поливинилхлорид, силикон и полиуретан.
Наименее предпочтителен поливинилхлорид из-за жесткости, он быстро затвердевает и может приводить к пролежням в ЖКТ. Такие зонды нельзя оставлять более 5 дней. В качестве размягчителей производители добавляют фталаты либо полиадипаты (время использования увеличивается до 15 дней). Однако фталаты при контакте с липидными массами создают ядовитые соединения, опасные для детей. Поэтому мы в своем отделении не используем зонды из поливинилхлорида. Зонды из силикона можно устанавливать на срок до 30 дней, из полиуретана — до 45 дней.
Золотым стандартом установки постпилорических зондов является эндоскопический способ. Классический способ проведения зонда с оливой в кишечник у детей затруднен из-за анатомических особенностей пилороантрального отдела желудка в детском возрасте.
Введение дуоденального зонда через нос предпочтительнее: его легче установить, он меньше беспокоит пациента, сохраняется возможность дополнительного орального кормления.
Режимы ЭП через зонд
Поступление смеси через зонд возможно двумя путями: пассивным (гравитационно-капельным) либо активным (ручной или аппаратный). Среди режимов ЭП выделяют два основных: непрерывное и болюсное питание. Каждый из них имеет свои преимущества и недостатки. Болюсный режим более физиологичен, однако пациентам на интенсивной терапии чаще требуется непрерывное кормление. Оно снижает риск аспирации, диареи, но имеет и недостаток: нарушается кислотный баланс, возникает риск дисбиоза.
Объемы ЭП в зависимости от режима:
- Непрерывное (продленное). Дети: 1-2 мл/кг/ч, увеличивать на 0,25-1 мл/кг/ч. Взрослые: 25-50 мл/ч, увеличивать на 25-50 мл/ч.
- Болюсное (фракционное). Дети: 2-4 мл/кг первые сутки, увеличивается на 1-2 мл/кг на вторые сутки. Взрослые: 50-100 мл, каждые 3-4 часа увеличивают на 50 мл, максимум 250-300 мл.
- Трофическое — при невозможности обеспечить адекватные объемы. Скорость непрерывной инфузии через постпилорический зонд для детей — от 0,25 до 1 мл/кг/ч, для взрослых 20-30 мл/ч. Есть вариант болюсного, для детей — 1-1,5 мл/кг.
Про трофическое ЭП часто забывают. Конечно, оно не покрывает энергозатраты или потребность в белках, но позволяет создать условия для того, чтобы кишка питалась и не погибла. Трофическое питание возможно организовать при любом состоянии пациента, и это обязательно нужно делать.
Определение толерантности к ЭП
При установке назогастрального зонда:
1. Ввести зонд, декомпрессия 10 минут.
2. Опустить зонд на 50 см, декомпрессия 10 минут (отсутствие кишечного содержимого).
3. Ввести 2 мл/кг воды. Закрыть зонд на 30 минут.
4. Опустить зонд и открыть на 30 минут.
5. Оценить объем полученного остатка (влияет на то, с каких цифр начинать):
■ менее 50 %: начать зондовое питание — разовая доза 2-4 мл/кг;
■ 50-75 %: начать трофическое питание — разовая доза 1-1,5 мл/кг;
■ более 75 %: начать парентеральное питание.
При установке тонкокишечного зонда:
1. Вводить 2 мл/кг/ч воды при открытом назогастральном зонде.
2. Через 1 час прекратить введение и закрыть назогастральный зонд на 30 минут.
3. Опустить назогастральный зонд и открыть на 30 минут.
4. Оценить объем полученного остатка:
■ менее 30 % — продолжать зондовое питание 1,5-2 мл/кг/ч;
■ не более 75 % — продолжать зондовое питание 0,5 мл/кг/ч;
■ более 75 % — исключить механическую кишечную непроходимость и продолжить зондовое питание 0,25 мл/кг/ч; через 1-2 часа повторить тест.
Количественная диагностика гастроинтестинальной недостаточности
Мы применяем балльную систему оценки гастроинтестинальной недостаточности (см. табл. 2), по ней легко определить степень тяжести и показания к ЭП, стандартному или полуэлементному, либо необходимость парентерального питания. Следует знать, что звуки кишечной перистальтики не могут полностью исключать гастроинтестинальную недостаточность. Самым надежным признаком восстановления моторной и эвакуаторной функции кишечника является отхождение газов и появление первого стула.
Таблица 2. Количественная оценка гастроинтестинальной недостаточности.Пациентам с сепсисом следует начинать раннее ЭП сразу после стабилизации гемодинамики. Исключение — пациенты с септическим шоком, им назначается отсроченное ЭП (через 48 часов). При наличии противопоказаний к ЭП показано парентеральное питание.
Для пациентов после операций на органах брюшной полости или пищевода раннее ЭП предпочтительнее отсроченного. Для пациентов в тяжелом состоянии с осложнениями после хирургических вмешательств на брюшной полости и пищеводе и невозможности принимать пищу через рот ЭП предпочтительнее парентерального при условии, что нет несостоятельности анастомоза кишечника, обструкции кишечника, синдрома абдоминального компартмента.
Ключевые моменты ЭП у детей
Тамара Волошко поделилась основными подходами к ЭП, которые являются результатом компиляции зарубежного, отечественного и собственного опыта и применяются в отделении АиР № 1 ГДИКБ Минска.
Ультразвуковой контроль позиции зонда для питания у новорожденных: проспективное исследование
* Для корреспонденции: Горбачев Владимир Ильич — д-р мед. наук, профессор, заведующий кафедрой анестезиологии и реаниматологии ИГМАПО — филиал ФГБОУ ДПО РМАНПО МЗ РФ, Иркутск, Россия; e-mail: gorbachevvi@yandex
Реферат
АКТУАЛЬНОСТЬ. В последнее десятилетие произошло переосмысление ценности нутритивной поддержки у пациентов отделения интенсивной терапии новорожденных. Согласно Американским и Европейским рекомендациям по нутритивной терапии, энтеральное кормление является предпочтительным методом питания для пациентов с функционирующим желудочно-кишечным трактом. Недоношенные дети в критическом состоянии, как правило, имеют низкую толерантность к энтеральной нагрузке при гастральном кормлении. Обширные исследования показывают, что использование транспилорического кормления сопоставимо по эффективности с оперативной фундопликацией. Наиболее часто для подтверждения правильного положения транспилорического зонда используется рентгенологический метод контроля. ЦЕЛЬ ИССЛЕДОВАНИЯ. Повышение эффективности контроля положения транспилорического зонда. МАТЕРИАЛЫ И МЕТОДЫ. Все пациенты, включенные в исследование, имели низкую толерантность к энтеральной нагрузке при кормлении через гастральный зонд. Использование ультразвукового контроля при проведении данной манипуляции обеспечивало альтернативный метод контроля положения зонда без необходимости облучения пациента. Перед процедурой установки зонда пилорический канал и постпилорическая область были визуализированы у 100 % пациентов. РЕЗУЛЬТАТЫ. После проведения манипуляции, по данным сонографии, у 94,1 % пациентов зонд для кормления находился за пределами пилорического отдела желудка (в двенадцатиперстной кишке). Более чем в половине наблюдений имело место полное совпадение заключений рентгенографии и ультразвукового исследования. В 41,2 % случаев рентгенолог не смог определить точное расположение дистального конца зонда между отделами двенадцатиперстной и тощей кишки. ВЫВОДЫ. Постановка питательного зонда за пределами привратника у тяжелобольных младенцев и новорожденных может привести к улучшению результатов лечения. Полученные данные свидетельствуют, что ультразвуковая визуализация зонда статистически достовернее рентгенологического контроля. Использование ультразвука для визуализации процесса установки питательного зонда за пределы привратника может исключить дополнительное использование рентгенографии.
КЛЮЧЕВЫЕ СЛОВА: младенцы, интенсивная терапия, критические состояния, питательный зонд
Поступила: 21.01.2022
Принята к печати: 11.03.2022
Дата онлайн-публикации: 29.04.2022
Читать статью в PDF
Введение
В научной литературе приведено достаточно данных о необходимости поддержания энтерального кормления у пациентов в критическом состоянии [1, 3]. Проблема, связанная с недостаточной толерантностью к энтеральной нагрузке, особенно широко распространена в отделении интенсивной терапии новорожденных [2]. Гастроэзофагеальный рефлюкс является основным клиническим проявлением сниженной толерантности к энтеральному питанию. Американское общество парентерального и энтерального питания рекомендует постпилорическое введение питательных смесей пациентам с высоким риском аспирации и/или при непереносимости кормления при питании через гастральный зонд. По данным литературы, проведение нутритивной поддержки через питательный зонд, установленный за пределы пилорического отдела желудка, продемонстрировало достаточный терапевтический эффект, что в ряде случаев позволяет начать эффективное энтеральное питание, минимизируя количество возможных последствий голодания. При этом размещение питательного зонда за пределы привратника является достаточно сложной и трудоемкой манипуляцией [4]. Успешность установки зонда, по данным литературы, весьма вариабельна, по разным источникам — от 45 до 87 %. Показанием для установки зонда за пилорическим отделом желудка является прежде всего невозможность гастрального кормления: тяжелый желудочно-пищеводный рефлюкс, непереносимость энтерального питания при проведении неинвазивной искусственной вентиляции легких, нарушение моторики и/или парез желудка [1]. Постановка транспилорического зонда, как правило, происходит «вслепую», с последующим рентгенологическим контролем. Известно несколько методов, способствующих эффективному проведению постпилорического питания у детей, но в настоящее время не существует согласованного стандартного протокола постановки питательного зонда и контроля его положения [5]. При этом «неудачное» размещение питательного зонда через пилорический отдел желудка приводит к «излишнему» использованию рентгенографии и задержке начала необходимой нутритивной поддержки. Рентгенография является малоэффективным методом контроля и несет в себе потенциально вредные дозы радиации [6]. Кроме того, недостатком рентгенологического исследования является неточное определение положения конца зонда и невозможность его визуализации в режиме реального времени [7]. Ультразвуковое исследование пилорического отдела желудка является эффективным и безопасным методом наблюдения за положением питательного зонда без необходимости облучения пациента [8].
Цель исследования — повышение эффективности контроля положения питательного зонда.
Материалы и методы
Исследование проводилось на базе областного государственного автономного учреждения здравоохранения «Городская Ивано-Матренинская детская клиническая больница», г. Иркутск, с июня по ноябрь 2021 г. В исследование были включены 17 пациентов в возрасте от 10 до 90 дней жизни. Все пациенты, включенные в исследование, нуждались в проведении интенсивной терапии и имели низкую толерантность к энтеральной нагрузке при кормлении через гастральный зонд. В исследование не были включены пациенты с врожденными пороками развития и дети после оперативного вмешательства на органах желудочно-кишечного тракта, а также дети с противопоказаниями для энтерального питания. Для проведения процедуры размещения питательного зонда была организована бригада, состоящая из двух врачей-реаниматологов, которые имели достаточные знания и опыт в постановке зондов для энтерального питания. Один из врачей обладал достаточными теоретическими и практическими знаниями в ультразвуковой диагностике и выполнял контрольную функцию. В исследовании были использованы поливинилхлоридные зонды размером 5 Fr или 6 Fr, длиной 50 см. Зонды вводились назогастрально и продвигались до появления сопротивления, с последующим постепенным введением до заранее отмеченной метки. Глубина введения зонда была индивидуальной. При введении зонда через носовой ход необходимая глубина введения питательного зонда включала сумму расстояний: от ноздри до козелка уха, от козелка до средней точки между мечевидным отростком и пупком, от средней точки между мечевидным отростком и пупком до середины реберной дуги (рис. 1). С целью придания зонду упругости использовался металлический проводник с витым мягким кончиком. В исследовании использовался портативный ультразвуковой сканер Mindray М7 (Китай). Пациентов помещали в положение лежа на спине, ультразвуковое сканирование проводилось с использованием линейного трансдьюсера 10-12 МГц. При проведении исследования использовался серошкальный режим (В-режим). Для этой цели датчик позиционировали в субкостальной области, визуализировали антральную часть желудка между печенью и поджелудочной железой, далее лоцировался пилорический канал и постпилорическая область — двенадцатиперстная кишка (рис. 2). После четкой визуализации пилорического канала приступали к процессу установки зонда для энтерального питания. При размещении применялся следующий алгоритм: зонд, установленный назогастрально, плавно продвигался до появления сопротивления. Зонд фиксировался и с последующим интервалом в 5 мин продвигался в среднем на 1 см. После 3-4 манипуляций выполняли исследование пилорического канала, где визуализировали питательный зонд. Далее врач, выполняющий постановку зонда, медленно продвигал его до заранее отмеренной метки. В это время врач, выполнявший ультразвуковой контроль, визуализировал ход зонда по пилорическому каналу. В завершение, чтобы убедиться, что дистальный конец питательного зонда находится в постпилорической области, извлекался проводник и в зонд вводилось 5-10 мл 0,9 % раствора натрия хлорида. Если в просвете двенадцатиперстной кишки появлялось анэхогенное содержимое после введения физиологического раствора, то постановка считалось успешной (рис. 3, 4). После успешной процедуры установки транспилорического зонда его расположение подтверждалось рентгенологически (рис. 5, на данном снимке в зонд был введен рентген контрастный препарат — урографин 0,5 мл для улучшения визуализации зонда). Врачи, описывающие рентгенограммы, не имели информации о результатах ультразвукового исследования. Побочных эффектов во время проведения процедуры у недоношенных детей не было. Статистическая обработка проводилась с использованием метода непараметрического анализа данных. Статистический анализ проводился с использованием программы STATISTICA 13.3. Номинальные данные описывались с указанием абсолютных значений и процентных долей. Количественные данные представлены в виде медианы и квартилей (25-75 % границы интерквартильного отрезка). Сравнение статистических показателей проводилось с помощью критерия χ 2 Пирсона. За уровень статистической значимости принято значение р < 0,05. Прогностическая модель, характеризующая зависимость количественной переменной от факторов веса пациентов и времени установки зонда, исследовалась с помощью метода линейной регрессии. Проведение исследования одобрено локальным этическим комитетом ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, Иркутск (протокол № 10 от 28 ноября 2021 г.). Все законные представители детей добровольно выразили свое согласие на участие в медицинском исследовании.
Рис. 1. Определение необходимой глубины введения зонда. При введении транспилорического зонда через носовой ход необходимая глубина введения включает сумму расстояний: 1 — от ноздри до козелка уха; 2 — от козелка до средней точки между мечевидным отростком и пупком; 3 — от средней точки мечевидным отростком и пупком до середины реберной дуги
Fig. 1. Determination of the required depth of insertion of the tube. The required depth of introduction of the transpyloric tube includes three distances: 1 — from the nostril to the tragus of the ear; 2 — from the tragus to the midpoint between the xiphoid process and the navel; 3 — from the midpoint of the xiphoid process and the navel to the middle of the costal arch
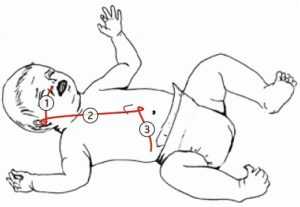
Рис. 2. Эхографическая визуализация пилорического отдела желудка: 1 — тело поджелудочной железы; 2 — пилорический канал; 3 — селезеночная вена; 4 — паренхима печени; 5 — желудок
Fig. 2. Echo-graphic visualization of the pyloric part of the stomach: 1 — body of the pancreas; 2 — pyloric canal; 3 — splenic vein; 4 — liver parenchyma; 5 — stomach
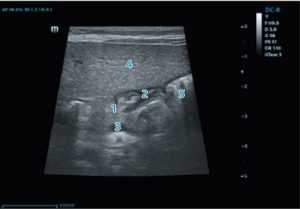
Рис. 3. Продвижение питательного зонда по пилорическому каналу: 1 — тело поджелудочной железы; 2 — пилорический канал; 3 — селезеночная вена; 4 — паренхима печени. Проекция зонда указана стрелкой — виден двойной параллельный контур
Fig. 3. Advancement of the nutrient tube along the pyloric canal 1 — body of the pancreas; 2 — pyloric canal; 3 — splenic vein; 4 — parenchyma of the liver. The projection of the probe is indicated by an arrow — a double parallel contour is visible
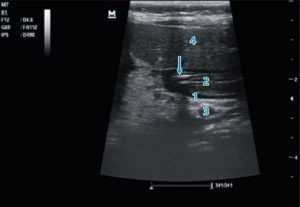
Рис. 4. Изменения эхогенности в постпилорической зоне: 1 — тело поджелудочной железы; 2 — пилорический канал с анэхогенным содержимым; 3 — селезеночная вена; 4 — паренхима печени. Проекция зонда указана стрелками — виден двойной параллельный контур
Fig. 4. Changes in echogenicity in the postpyloric zone: 1 — body of the pancreas, 2 — pyloric canal with anechoic contents, 3 — splenic vein, 4 — liver parenchyma. In the picture, the projection of the probe is indicated by arrows — a double parallel contour is visible
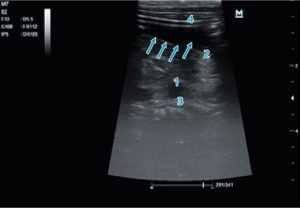
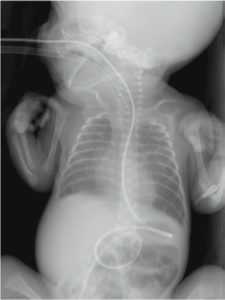
Рис. 5. Обзорная рентгенограмма грудной клетки и живота в прямой проекции. В питательный зонд введен рентгеноконтрастный препарат. На снимке видно, что конец зонда расположен за пределами привратника
Fig. 5. Plain radiograph of the chest and abdominal organs. An X-ray contrast agent was introduced into the tube. The image shows that the end of the probe is located outside the pylorus
Результаты исследования
При оценке с помощью ультрасонографии, проведенной перед процедурой установки зонда для кормления, пилорический отдел и постпилорическая область были визуализированы у 17 (100 %) пациентов. Возраст пациентов составил от 10 до 90 дней, М — 26 дней; Q1-3 45 дней. Диапазон веса: 0,8-2,6 кг, М — 1,8 кг; Q1-3 [1,3-2,3] кг. Время завершения ультразвукового исследования в среднем составило 19 мин (диапазон 3-30 мин), М — 17 мин; Q1-3 [14-25,5] мин. У 16 пациентов (94,1 %) питательный зонд был визуализирован в пилорическом отделе желудка и двенадцатиперстной кишке. В 10 исследованиях (58,8 %) имело место полное совпадение заключений рентгенологического и ультразвукового исследования. В 7 случаях (41,2 %) рентгенолог не смог определить точное расположение дистального конца зонда между отделом двенадцатиперстной и тощей кишки. У 1 пациента (5,9 %) сонограмма была неправильно интерпретирована, конец зонда был визуализирован в пилорическом канале, в то время как рентгенологически позиция зонда имела иное расположение. В ходе исследования было выявлено статистически значимое различие в верификации ультразвукового контроля постановки зонда в сравнении с рентгенологическим исследованием (р < 0,05). Значение критерия χ 2 составило 5,8, а критическое значение χ 2 — 3,8 при уровне значимости p = 0,05.
В связи с низкими резервами питательных веществ и более высокими потребностями в энергии и пластических материалах новорожденные более чувствительны к гиперкатаболическим процессам, что требует разработки четкого алгоритма проведения нутритивной поддержки. Понимание необходимости поддержания нутритивной поддержки у недоношенных детей в тяжелом состоянии инициирует максимально раннее ее начало. Ранний переход с парентерального питания к энтеральному кормлению способствует профилактике синдрома транслокации бактериальной флоры «голодной» кишки. Однако многочисленные исследования демонстрируют тот факт, что недоношенные младенцы очень часто неспособны переносить гастральное кормление. Проведенные научные работы по выявлению оптимального метода кормления противоречивы. Большая часть из них показывает, что использование транспилорического кормления сопоставимо по эффективности с оперативной фундопликацией. Использование ультразвукового метода визуализации положения питательного зонда является эффективным и безопасным, он может предотвратить избыточную лучевую нагрузку при проведении рентгенографии. Большинство опубликованных работ применения ультразвукового исследования в постановке питательного зонда проводились у взрослых и детей старше года. В одноцентровом ретроспективном исследовании, проведенном под руководством Итиро Осава, показатель успешности постановки транспилорического зонда в группе с ультразвуковым контролем был выше, чем в группе «слепого» введения. Хотя визуализация привратника с помощью ультразвука относительно проста, установка питательного зонда с ультразвуковой навигацией может быть затруднительна, поскольку мягкий, податливый зонд нелегко провести через пилорический канал. Использование металлического проводника с витым мягким концом облегчает процесс продвижения. Мы пришли к выводу, что использование ультрасонографии при размещении питательного зонда возможно и имеет определенные преимущества по сравнению с обычной рентгенографией. Этот метод контроля с успехом может быть применен в отделениях интенсивной терапии новорожденных и детей, в которых доступен портативный ультразвуковой аппарат.
Заключение
Обширные исследования показывают, что использование транспилорического кормления сопоставимо по эффективности с оперативной фундопликацией. Постановка питательного зонда за пределами пилорического отдела желудка у тяжелобольных младенцев может привести к улучшению результатов лечения, однако процесс проведения зонда через верхние отделы желудочно-кишечного тракта может быть проблематичным. Полученные данные свидетельствуют, что ультразвуковая визуализация зонда имеет статистически значимые преимущества в сравнении с рентгенологическим контролем. Использование ультразвукового исследования для визуализации процесса установки питательного зонда может исключить дополнительное использование рентгенографии.
Этическое утверждение. Исследование было одобрено локальным этическим комитетом ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, Иркутск, Россия (протокол № 10 от 28 ноября 2021 г.).
Ethics approval. The present study protocol was approved by the local Ethics Committee of the Russian Medical Academy of Continuous Professional Education, Irkutsk, Russia (reference No 10, 28/11/2021).
Информация о финансировании. Авторы заявляют об отсутствии внешнего финансирования при проведении исследования.
Funding source. This study was not supported by any external sources of funding.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Disclosure. The authors declare that they have no competing interests.
Вклад авторов. Все авторы в равной степени участвовали в разработке концепции статьи, получении и анализе фактических данных, написании и редактировании текста статьи, проверке и утверждении текста статьи.
Author contribution. All authors according to the ICMJE criteria participated in the development of the concept of the article, obtaining and analyzing factual data, writing and editing the text of the article, checking and approving the text of the article.
Лучшая практика по введению назогастрального зонда в педиатрии (Nutrition in Clinical Practice, сентябрь 2018)
В журнале Nutrition in Clinical Practice 06 сентября 2018 г. опубликованы рекомендации American Society for Parenteral and Enteral Nutrition по лучшей практике введения и подтверждения правильного расположения назогастрального зонда в педиатрии.
Существует 2 метода определения длины назогастрального зонда:
1. Нос - ушная раковина - мечевидный отросток - середина между пупком и мечевидным отростком (так называемый метод NEMU).
2. Нос - ушная раковина - мечевидный отросток (метод NEX).
В проведенных исследованиях по оценки данных 2х методов измерения длины назогастрального зонда для введения, метод с измерением до середины между пупком и мечевидным отростком (метод NEMU) показал преимущество по точности: 97% по точности, по сравнению с 59% при методе с измерением только до мечевидного отростка.
Было обнаружено, что метод с измерением только до мечевидного отростка часто приводил к высокому расположению зонда в пищеводе, что повышало риск аспирации и угрожало безопасности ребенка.
В настоящее время способы верификации расположения назогастрального зонда варьируют между больницами, между отделениями и между медиками. Самыми распространенными методами верификации являются аускультация, аспирация с визуальной инспекцией желудочного сока, замер рН желудочного отделяемого, и рентгенографическая верификация.
Существует предупреждение, что нельзя использовать аускультацию и визуальную инспекцию желудочного сока как способы верификации, так как эти оба метода не являются подтверждающими и могут дать ложное подтверждение якобы зонд находится в желудке.
Несмотря на данное предупреждение, было обнаружено, что медики продолжают широко применять данные методы верификации и у детей, и у взрослых пациентов.
На основании доказательств, даются следующие рекомендации:
1) Необходимо проводить обучение:
- необходимо проводить обучение всех медиков, которые вводят назогастральный зонд.
- обучение должно включать компетенцию подтверждения правильного расположения зонда, замер рН, определение необходимости в рентгенологической оценке, документирование расположения зонда, и как пациент перенес процедуру.
- необходимо обучение врачей, интерпретирующих рентгенограммы по верификации расположения зонда.
2) Необходимо применять надлежащий метод введения назогастрального зонда и метод его фиксации:
- применяйте метод Нос - ушная раковина - мечевидный отросток - середина между пупком и мечевидным отростком (так называемый метод NEMU) для определения длины введения зонда.
- задокументируйте метку на зонде (в сантиметрах) у выхода из носа при периодических проверках расположения зонда (согласно разнарядке в больнице).
- если применяется назогастральный зонд со стилетом, и если в зонд вводилась стерильная вода с целью смазки стилета и легкого извлечения стилета после введения зонда, то необходимо аспирировать весь введенный объем стерильной воды и утилизировать эту воду. Необходима повторная аспирация желудочного содержимого для тестирования рН.
3) Выполните измерение рН желудочного содержимого:
- применяйте тестирование желудочного рН как метод первой линии для подтверждения локализации назогастрального зонда.
- результат рН 1 - 5,5 без изменения в клиническом статусе пациента является индикатором того, что зонд находится в желудке.
- если зонд применяется для перемежающегося энтерального питания и/или введения лекарств, то необходимо утвердить расписание частоты верификации расположения назогастрального зонда.
- при непрерывном энтеральном питании, определите частоту проведения верификации расположения зонда с документированием результатов.
4) Проводите рентгенографию у любого пациента, у которого имеются любые сомнения в корректном расположении назогастрального зонда, при следующих ситуациях:
- при трудностях с введением зонда.
- введение зонда у пациентов с высоким риском неправильного расположения зонда. К данным пациентам относятся пациенты с переломами костей лица в анамнезе, неврологическая травма/инсульт/исходная патология, респираторные проблемы, сниженный или отсутствие рвотного рефлекса, а также у критически больных пациентов.
- у любого пациента, у которого состояние ухудшилось вскоре после введения назогастрального зонда.
5) Улучшите интерпретацию и заключение по радиографии:
- направление на радиографию должно четко содержать запрос "Для верификации расположения назогастрального зонда".
- заключение радиографии должно содержать данные о пути зонда, локализации кончика зонда и с подтверждением того, что зонд расположен в требуемом месте и может применяться по назначению.
Подробнее смотрите в прикрепленном файле.
Посмотреть другие обзоры
Автор обзора
Автор обзоров мировой медицинской периодики на портале MedElement - врач общей практики, хирург Талант Иманалиевич Кадыров.
Закончил Киргизский Государственный медицинский институт (красный диплом), в совершенстве владеет английским языком. Имеет опыт работы хирургом в Чуйской областной больнице; в настоящий момент ведет частную практику.
Регулярное повышение квалификации: курсы Advanced Cardiac Life Support, International Trauma Life Support, Family Practice Review and Update Course (Англия, США, Канада).
Методика установки транспилорического зонда у новорожденного
В настоящее время способы верификации расположения назогастрального зонда варьируют между больницами, между отделениями и между медиками. Самыми распространенными методами верификации являются аускультация, аспирация с визуальной инспекцией желудочного сока, замер рН желудочного отделяемого, и ренгенографическая верификация.
Ленкова А.А. Обзор «Pediatric gastroesophageal reflux clinical practice guidelines 2018» // Сборник материалов Республиканской НПК. Лаборатория интеллекта. - 2018. - 23 ноября. С. 12-20.
За уходящий 2018 год было опубликовано несколько международных согласительных документов по диагностике и лечению ГЭРБ. В феврале и марте 2018 г. вышли в свет Лионский консенсус и рекомендации Американской и Европейской гастроэнтерологической ассоциации по ведению детей больных ГЭРБ. Ряд положений этого документа на доказательной основе уточняет имевшиеся до сих пор (ранее аналогичный документ был выпущен в 2009 году) спорные моменты и проблемные положения в диагностике и лечении пациентов с ГЭРБ. Качество доказательств оценивается с использованием системы GRADE.
Американская и Европейская гастроэнтерологическая ассоциации по ведению детей больных ГЭРБ провела трехдневное совещание для выработки консенсуса. Все рекомендации по диагностике и лечению детей больных ГЭРБ были обсуждены и доработаны. В тех случаях, когда не было рандомизированного контролируемого исследования (РКИ, терапевтические вопросы) по какому-либо вопросу, использовалось мнение экспертов. Группа экспертов проводила голосование по каждой из рекомендаций.
При таком подходе были разработаны рекомендации по диагностике и лечению детей с ГЭРБ для стандартизации и улучшения качества оказываемой медицинской помощи [1].
Рассматриваемые вопросы:
1. Определение ГЭР/ГЭРБ у младенцев и детей 0-18 лет ГЭР - заброс содержимого желудка в пищевод с или без срыгивания и рвоты.
ГЭРБ - состояние, когда ГЭР приводит к неприятным симптомам, которые влияют на повседневную жизнедеятельность и/или приводят к возникновению осложнений.
Резистентность ГЭРБ - ГЭРБ, не реагирующая на оптимальное лечение через восемь недель после начала лечения.
Оптимальная терапия - максимальная фармакологическая и/или нефармакологическая терапия в доступных медицинских учреждениях в области практики узких специалистов (Умеренная сила рекомендации по использованию определения ГЭР/ГЭРБ у младенцев и детей).
2. Что такое симптомы «красного флага», диагностические подсказки в дифференциальной диагностике ГЭРБ?
При проведении медицинского обследования по поводу ГЭР важно отличить ГЭР от ГЭРБ, выявить возможные осложнения ГЭРБ, а также исключить более тревожные расстройства, требующие дальнейшее обследование и лечение. Младенцы и дети представляют широкий спектр неспецифических симптомов, которые могут быть интерпретированы как симптомы ГЭРБ, но надежность этих клинических проявлений, как следствие ГЭР, не всегда ясно. Поскольку это может привести как к недостаточной диагностике и лечению, так и гипердиагностике. Поэтому рабочая группа сочла важным обеспечить обзор общих симптомов и признаков для выявления ГЭРБ. Уточнение «красных флагов» (сигнализаторов) должно гарантировать дальнейшее обследование специалистами здравоохранения для исключения осложнений ГЭРБ и выявления основных расстройств, представляющих собой признаки или симптомы ГЭР, особенно регургитация и / или рвота.
Диагностический подход к младенцам (возраст 0-12 месяцев) с частым срыгиванием и / или рвотой.
Дети до одного года, у которых в анамнезе имеются частые срыгивания должны быть тщательно изучены. Возраст, когда начались симптомы, режим питания (временной промежуток приема пищи, объем еды при каждом кормлении, разновидность еды, качество грудного молока, методы измельчения пищи, размер пищи, добавки к еде, ограничение аллергенов, промежуток времени между приемами еды), картина срыгиваний/рвоты (ночная, сразу после еды, после некоторого времени после приема пищи, переваренной/непереваренной пищей), наследственность, наличие возможных экологических триггеров (психоэмоциональное состояние в семье, активное и пассивное курение в семье), весовая траектория ребенка, предшествующие фармакологические и диетические вмешательства и наличие сигнализаторов «красных флагов» (таблица 2). Физиологический ГЭР редко начинается раньше 1 недели и позже 6 месяцев жизни.
Диагностический подход к детям (возраст 12 месяцев - 18 лет) с частым срыгиванием и / или рвотой.
Начало симптомов ГЭРБ после шестимесячного возраста или их продолжительность после 12 месяцев повышает вероятность альтернативных диагнозов для ребенка. Поскольку эти симптомы не уникальны для ГЭРБ, рекомендовано направление к детскому гастроэнтерологу для дальнейшего обследования. Цель дополнительного обследования - исключить имитирование или осложнения ГЭРБ. Диагностика может включать в себя лабораторные анализы, контрастные изображения, эндоскопию верхних отделов желудочно-кишечного тракта и/или комбинированный внутрипросветный многоканальный импеданс-pH-мониторинг пищевода, в зависимости от симптомов.
3. Какие диагностические мероприятия имеют дополнительную ценность для сбора анамнеза и медицинского осмотра младенцев и детей с подозрением на ГЭРБ?
1. Исследование контрастным барием.
Основываясь на мнениях экспертов, рабочая группа предлагает не использовать исследование контрастным барием для диагностики ГЭРБ у младенцев и детей (Слабая рекомендация).
Основываясь на мнениях экспертов, рабочая группа предлагает использовать исследования контрастным барием, чтобы исключить анатомические аномалии (Слабая рекомендация).
2. Ультрасонография.
По мнению экспертов, рабочая группа предлагает не использовать УЗИ для диагностики ГЭРБ у младенцев и детей (слабая рекомендация).
Основываясь на мнениях экспертов, рабочая группа предлагает использовать УЗИ для исключения анатомических аномалий (Слабая рекомендация).
3. Эзофаго-гастродуоденоскопия (ЭГДС) с биопсией/без нее.
Рабочая группа предлагает не использовать эзофаго-гастро-дуоденоскопию для диагностики ГЭРБ у младенцев и детей (Слабая рекомендация).
Основываясь на экспертном заключении, рабочая группа предлагает использовать эзофаго-гастро-дуоденоскопию с биопсией для оценки осложнений ГЭРБ, в случае подозрения заболевания слизистой оболочки или предшествующей терапии (Сильная рекомендация).
4. Экстраэзофагеальные биомаркеры.
Рабочая группа предполагает, что пепсин слюны не следует использовать для диагностики ГЭРБ у младенцев и детей (сильная рекомендация).
Исходя из мнения экспертов, рабочая группа предлагает не использовать имеющиеся в настоящее время экстраэзофагеальные биомаркеры (пепсин, липидный индекс макрофагов, билирубин) для диагностики ГЭРБ у младенцев и детей (Сильная рекомендация).
5. Манометрия.
Основываясь на мнениях экспертов, рабочая группа предлагает не использовать манометрию для диагностики ГЭРБ у младенцев и детей (Сильная рекомендация).
На основе мнения экспертов, рабочая группа предлагает рассмотреть вопрос об использовании манометрии, когда подозревается нарушение моторики ЖКТ (Сильная рекомендация).
6. Сцинтиграфия.
Основываясь на мнениях экспертов, рабочая группа предполагает, что сцинтиграфия не должна быть использована для диагностики ГЭРБ у младенцев и детей (Сильная рекомендация).
7. Кормление через транспилорический/кишечный зонд.
Основываясь на экспертном заключении, рабочая группа предлагает не осуществлять кормление через транспилорический/кишечный зонд для диагностики ГЭРБ у младенцев и детей (Умеренная рекомендация).
8. Ингибиторы протонной помпы (ИПП).
Основываясь на экспертном заключении, рабочая группа предполагает, что использование ИПП не должно проводиться в качестве диагностического теста для ГЭРБ у младенцев (Слабая рекомендация).
Основываясь на мнениях экспертов, рабочая группа предполагает, что использование ИПП не должно быть в качестве диагностического теста для ГЭРБ у пациентов с экстраэзофагеальными симптомами (Слабая рекомендация).
9. Комбинированный внутрипросветный многоканальный импеданс-pH-мониторинг.
Основываясь на экспертном заключении, рабочая группа предлагает рассмотреть возможность использования теста pHMII в следующих ситуациях:
9.1. Соотнести постоянные опасные симптомы с осложнениями от кислотного и некислотного гастроэзофагеального рефлюкса (Сильная рекомендация).
9.2. Уточнение роли кислотного и некислотного рефлюкса в этиологии эзофагита и других признаков и симптомов, указывающих на ГЭРБ (Слабая рекомендация)
9.4. Дифференцировки неэрозивной рефлюксной болезни, гиперчувствительного пищевода и функциональной изжоги у пациентов с нормальной эндоскопией (Слабая рекомендация).
Таблица 1. Симптомы и признаки, которые могут быть связаны с гастроэзофагеальной рефлюксной болезнью (ГЭРБ) у младенцев и детей 0-18 лет
| Симптомы | Признаки |
| Общие | |
| 1. Дискомфорт / Раздражительность ** 2. Отсутствие прибавки в весе 3. Отказ от питания 4. Шейная дистония (Синдром Сандифера) | 1. Патологическая стираемость зубов 2. Анемия |
| Желудочно-кишечные | |
| 1. Повторная регургитация с/без рвот(ы) у более старшего ребенка 2. Изжога / боль в груди *** 3. Боли в эпигастрии *** 4. Гематемезис (кровавая рвота) 5. Дисфагия/одинофагия | 1. Эзофагит 2. Стриктура пищевода 3. Пищевод Барретта |
| Респираторные | |
| 1. Клокочущее дыхание 2. Стридор 3. Кашель 4. Охриплость голоса | 1. Апноэ 2. Короткие разрешенные необъяснимые события 3. Астма 4. Повторяющаяся пневмония, связанная с аспирацией 5. Повторяющийся отит среднего уха |
** - Если чрезмерная раздражительность и боль являются единственным проявлением, то это вряд ли связано с ГЭРБ
*** - Типичные симптомы ГЭРБ у детей старшего возраста
Таблица 2. Симптомы и признаки «красного флага», которые указывают не на ГЭРБ
| Симптомы и признаки | Замечания |
| Общие | |
| 1. Потеря веса 2. Вялость 3. Фебрилитет 4. Чрезмерная раздражительность/боль | Может быть вызвано с любыми состояниями, в том числе системной инфекцией. |
| 5. Дизурия | Может быть инфекция мочевых путей, особенно у детей грудного и раннего возраста. |
| 6. Начало регургитации / рвоты > 6 месяцев, или увеличение/сохранение > 12-18 месяцев. | Позднее начало, а также увеличение симптомов или сохранение после младенчества, может указывать на другие заболевания, кроме ГЭРБ. |
| Неврологические | |
| 1. Выбухание родничка/ быстрое увеличение окружности головы 2. Пароксизмальные судороги 3. Макро/микроцефалия | Может быть повышенное внутричерепное давление вследствие менингита, опухоли головного мозга или гидроцефалии. |
| Желудочно-кишечные | |
| 1. Непрерывная интенсивная рвота | Показатель гипертрофического пилорического стеноза (младенцы до 2 месяцев) |
| 2. Ночная рвота | Может указывать на увеличение внутричерепного давления |
| 3. Рвота жёлчью | Может рассматриваться как симптом кишечной непроходимости. Возможные причины включают: болезнь Гиршпрунга, атрезия кишки или заворот кишки, или инвагинация. |
| 4. Гематемезис (кровавая рвота) | Может указывать на потенциально серьезное кровотечение из пищевода, желудка или тонкой кишки, возможно связанное с ГЭРБ, происходящее из пептической язвы 1 , разрывов Маллори-Вейсс 2 или рефлюкс-эзофагита. |
| 5. Хроническая диарея | Может указывать на пищевую белковую гастроэнтеропатию 3 |
| 6. Ректальное кровотечение | Может указывать на множество состояний, включая бактериальный гастроэнтерит, воспалительные заболевания кишечника, а также острые хирургические состояния и пищевую белковую гастроэнтеропатию, ректальное кровотечение, вызванное проктоколитом. |
| 7. Вздутие живота | Может указывать на обструкцию, дисмотильность или анатомические аномалии |
2 Связано с многократной рвотой
3 Чаще у младенцев с экземой и / или с наследственной атопической болезнью.
Читайте также:
- Влияние кровотока на МРТ головного мозга. Перфузионная и диффузионная МРТ
- Проводящий путь реакции зрачков на свет (сужения зрачков)
- Алгоритм обследования при ретрокохлеарном нарушении слуха (слухового нерва)
- Влияние декомпрессии на факторы свертывания крови. Фактор Хагемана при декомпрессии
- Болезнь Беста: причины, симптомы и лечение
