Мониторинг питания и гликемии у тяжелого пациента. Принципы
Добавил пользователь Alex Обновлено: 22.01.2026
провизор первой категории и заведующая аптекой. Автор многочисленных работ по фармакологии и фармакотерапии (Днепропетровск).
Общая информация: что такое гликемия при сахарном диабете
Для СД 2 типа характерно постоянное ухудшение функции бета-клеток, поэтому лечение должно быть динамичным, предусматривающим постепенное увеличение медикаментозного вмешательства по мере прогрессирования заболевания.В идеале уровень глюкозы в крови должен поддерживаться в пределах, близких к норме: до еды глюкоза крови 5-7 ммоль/л и гликированный гемоглобин (HbА1c) менее 7 %. Тем не менее, исключительно гипогликемическая терапия не обеспечивает адекватного лечения пациентов с СД 2 типа. Необходимы контроль уровня липидов и артериального давления.
Агрессивное снижение уровня глюкозы — не лучшая стратегия для широкого круга пациентов. Так, у пациентов с высоким риском сердечно-сосудистых заболеваний снижение уровня HbА1c до 6 % или ниже может увеличить риск сердечно-сосудистой катастрофы.
Терапия СД 2 типа должна быть основана на индивидуальной стратификации риска. Исследования группы ученых под руководством Фриды Моррисон, опубликованные в Archives of Internal Medicine, 2011 год, показали, что у пациентов, посещающих эндокринолога каждые две недели, уровень глюкозы крови, HbAc1 и ЛПНП, падает быстрее и контролируется лучше, чем у больных, которые наносят визит врачу один раз в месяц или реже. Значительный вклад в успех лечения вносит и сам пациент, соблюдая диету и следуя рекомендациям по образу жизни.
Фармакотерапия СД 2 типа
Раннее начало фармакотерапии СД 2 типа способствует улучшению гликемического контроля и снижает вероятность долгосрочных осложнений.Что касается вопроса о том, чем лечить сахарный диабет 2 типа и какие конкретно использовать препараты, то здесь все будет зависеть от выбранной схемы лечения.
- инсулинорезистентность тканей;
- недостаточная секреция инсулина;
- чрезмерная или неадекватная секреция глюкагона.
Метформин
- эффективность;
- отсутствие увеличения веса;
- низкая вероятность гипогликемии;
- низкий уровень побочных эффектов;
- хорошая переносимость;
- невысокая стоимость.
Схема 1. Список гипогликемических препаратов, используемых при сахарном диабете 2 типа

Дозу метформина титруют в течение 1-2 месяцев, определяя наиболее эффективную методом подбора. Терапевтически активная дозировка составляет не менее 2000 мг метформина в сутки. Для снижения риска побочных эффектов со стороны желудочно-кишечного тракта препарат принимают во время или после еды несколько раз в день.
Метформин снижает риск развития деменции, ассоциированной с СД 2 типа. Это было доказано в масштабном исследовании 2013 года с участием 14 891 пациента, разделенных на четыре группы в зависимости от того, какой препарат они принимали. На протяжении всего эксперимента больным проводилась монотерапия метформином, препаратами сульфонилмочевины, тиазолидиндионами и инсулинами. В течение пяти лет после начала лечения метформином деменция была диагностирована у 1487 (9 %) больных. Это на 20 % ниже, чем в группе сульфонилмочевины и на 23 % ниже группы тиазолидиндионов (данные Colayco DC, et al., журнал Diabetes Carе, 2011 год).
Двухкомпонентная схема лечения
- ингибиторам ДПП-4 — при подъеме уровня глюкозы и натощак, и после еды;
- агонистам ГПП-1 рецепторов — при значительном повышении глюкозы крови после еды;
- тиазолидиндионам — при лечении пациентов с метаболическим синдромом и/или безалкогольным жировым гепатозом.
Отмена пероральных препаратов и монотерапия инсулином при СД 2 типа ассоциируется с увеличением веса и гипогликемией, в то время как комбинированное лечение снижает эти риски.
Таблица 1. Группы лекарств, используемых при сахарном диабете 2 типа
Таблица 2. Список лекарственных препаратов (таблетированные, растворы), используемых при сахарном диабете 2 типа
Трехкомпонентная терапия СД 2 типа
- пероральный препарат, принадлежащий к другому классу гипогликемических средств, нежели первые два компонента схемы лечения;
- инсулин;
- инъекционный эксенатид. Препараты группы тиазолидиндионов не рекомендуются в качестве третьего средства схемы. Так, данные Американской ассоциации эндокринологов свидетельствуют о повышении риска инфаркта миокарда у пациентов, принимающих роксиглитазон. Поэтому его рекомендуют назначать только тем пациентам, которым не удается контролировать уровень глюкозы с помощью других препаратов.
У пациентов с высоким риском сердечно-сосудистых заболеваний снижение уровня HbА1c до 6 % или ниже может увеличить риск сердечно-сосудистой катастрофы. Так, наблюдение за группой из 44 628 пациентов, проведенное американскими учеными под руководством Даниэля Колайко (Danielle C. Colayco), показало, что у пациентов с уровнем HbA1c менее 6 % сердечно-сосудистые проблемы отмечались на 20 % чаще, чем у больных со средним уровнем HbA1c 6-8 %.
Эксперимент, проведенный исследовательской группой ACCORD (Action to Control Cardiovascular Risk in Diabetes), показал, что падение уровня HbAc1 ниже 6 % у пациентов группы риска привело к росту пятилетней смертности от инфаркта миокарда.
Данные исследователей под руководством Gerstein HC, публикация в журнале The new England journal of medicine, 2011 год
В отношении еще одного известного тиазолидиндиона — пиоглитазона — также появилась настораживающая информация о повышении риска развития рака мочевого пузыря на фоне приема. Американская ассоциация по контролю за лекарственными препаратами FDA не рекомендует назначать пиоглитазон пациентам с раком мочевого пузыря в анамнезе.
Агонисты ГПП1‑рецепторов имеют отличный от других гипогликемических препаратов механизм действия. Они имитируют эндогенный инкретиновый ГПП-1 и таким образом стимулируют глюкозозависимое высвобождение инсулина. Кроме того, агонисты ГПП1‑рецепторов способствуют снижению уровня глюкагона.
Сочетание эксенатида — самого известного препарата этой группы — с одним или двумя пероральными (например, метформином и/или препаратами сульфонилмочевины) привлекает своей простотой и высокой эффективностью.
Инсулин как дополнение
Многие пациенты с СД 2 типа, у которых не представляется возможным контролировать заболевание с помощью пероральных гипогликемических препаратов, нуждаются в инсулинотерапии. Комбинация пероральных препаратов, понижающих сахар, и инсулина при диабете 2 типа эффективно снижает уровень глюкозы в крови.
К пероральным гипогликемическим средствам целесообразно добавлять однократную утреннюю инъекцию инсулина средней или длительной продолжительности. Такой подход может обеспечить лучший гликемический контроль меньшими дозами инсулина.
Группа британских ученых под руководством Николаса А. Райта (Nicholas A Wright) в ходе шестилетнего рандомизированного исследования доказала, что отмена пероральных препаратов и монотерапия инсулином при СД 2 типа ассоциируется с вероятностью увеличения веса и гипогликемии, в то время как комбинированное лечение снижает эти риски. Данные эксперимента опубликованы в Internal Medicine в 1998 году.
Инсулин может быть использован у лиц с выраженной гипергликемией, а также назначен временно в период общего заболевания, беременности, стресса, медицинской процедуры или операции. С прогрессированием СД 2 типа потребность в инсулине возрастает и могут понадобиться дополнительные дозы базального инсулина (средней и длительной продолжительности действия), а также введение болюсного инсулина (короткого или быстрого действия).
Принимая решение, с какими пероральными гипогликемическими средствами лучше комбинировать инсулин, следует руководствоваться общими принципами построения многокомпонентной схемы лечения СД 2 типа. Известно, например, что добавление инсулина перед сном на фоне лечения метформином приводит к увеличению веса в два раза реже, чем комбинированное лечение инсулином и препаратами сульфонилмочевины или двукратная монотерапия инсулином (данные H. Yki-Järvinen L. Ryysy K. Nikkilä, Internal Medicine, 1999 год).
На фоне лечения болюсным инсулином необходимо отменить пероральные препараты, усиливающие секрецию инсулина (препараты сульфонилмочевины и меглитиниды). При этом терапия метформином должна быть продолжена.
Мониторинг питания и гликемии у тяжелого пациента. Принципы
Для цитирования: Значение непрерывного мониторинга гликемии у пациентов с сахарным диабетом. РМЖ. 2008;28:1845.
Сегодня непрерывный длительный мониторинг гликемии находит все более широкое применение как в научной сфере, так и в ежедневной практике эндокринологов и диабетологов. Без сомнения, в дальнейшем этот революционный подход позволит значительно расширить и углубить представление о целевых параметрах и качестве компенсации углеводного обмена, став неотъемлемым инструментом оптимизации управления сахарным диабетом (СД) как 1, так и 2 типа.
Литература
1. Шилов А.М., Авшалумов А.С., Синицина Е.Н., Марковский В.Б.. «Клиническое значение суточного мониторирования гликемии у больных с нарушением углеводного обмена». Эффективная фармакотерапия в эндокринологии, 1-2008, с.32-35.
2. Kannel WB, Mc Gee DL: Diabetes and cardiovascular diseases: the Framingham Study. JAMA 241:2035-2038, 1979.
3. Laakso L, Lehto S: Epidemiology of macrovascular disease in diabetes. Diabetes Rev 5:294-315, 1997.
4. Boland E., Monsod T., Delucia M. et al. Limitations of conventional methods of self-monitoring of blood glucose: lessons learned from 3 days of continuous glucose sensing in pediatric patients with type 1 diabetes // Diabetes Care. - 2001. - Vol. 24. - P. 1858-1862.
5. DCCT Research Group: The relationship of a glycemic exposure (HbA1c) to the risk of development and progression of retinopathy in the Diabetes Control and Complications Trial. Diabetes 44:968-983, 1995.
6. Diabetes Control and Complications Trial Research Group: The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 329:977-986, 1993.
7. Hay L., Wilmshurst E., Fulcher G. Unrecognized hypo- and hyperglycemia in well-controlled patients with type 2 diabetes mellitus: the results of continuous glucose monitoring // Diabetes Thechnol. Ther. - 2003. - Vol. 5. - P. 19-26.
8. Stratton IM, Adler AI, Neil HA, Matthews DR, Manley SE, Cull CA, Hadden D, Turner RC, Holman RR: Association of glycaemia with macrovascular and microvascular complications of type 2 diabetes (UKPDS 35): prospective observational study. BMJ 321:405-412, 2000.
9. Eastman RC, Javitt JC, Herman WH, Dasbach EJ, Zbrozek AS, Dong F, Manninen D, Gardfield SA, Copley-Merriman C, Maier W, Eastman JF, Kotsanos J, Cowie CC, Harris M: Model of complications of NIDDM 1: Model constructions and assumptions. Diabetes Care 20:725-734, 1997.
10. Gaede P, Vedel P, Larsen N, Jensen GVH, Parving HH, Pedersen O: Multifactorial intervention and cardiovascular disease in patients with type 2 diabetes. N Engl J Med 348:383-393, 2003.
11. Monnier L, Mas E, Ginet C, Michel F, Villon L, Cristol JP, Colette C: Activation of oxidative stress by acute glucose fluctuations compared with sustained chronic hyperglycemia in patients with type 2 diabetes. JAMA 295:1681-1687, 2006.
Клиническое значение суточного мониторирования гликемии у больных с нарушением углеводного обмена
Сахарный диабет - эндокринно-обменное заболевание, характеризующееся хронической гипергликемией, сопровождающейся нарушением всех видов обмена веществ, которые обусловлены абсолютной или относительной недостаточностью инсулина, развивающейся вследствие генетической предрасположенностью к воздействию многих эндогенных и экзогенных факторов. Несмотря на значительные успехи в области диабетологии, достигнутые в последние 20 лет, СД стойко занимает третье место по частоте встречаемости среди населения земного шара, после СС и онкологических заболеваний, с тенденцией к удвоению каждые 10-15 лет (3, 4, 7).
- КЛЮЧЕВЫЕ СЛОВА: сахарный диабет, гипергликемия, Гептрал
Таблица 2. Рекомендуемые показатели углеводного и липидного обмена, снижающих риск сосудистых осложнений
Рисунок 1. Диаграмма и график суточного мониторирования (3 дня) с расчетом в % выхода из нормальных границ гликемического профиля
Рисунок 3. Динамика суточного мониторирования гликемического профиля до (А) и после (Б) лечения (6 месяцев) у больного М. 56 лет
Согласно заключению экспертов ВОЗ, представленного в Кейптауне на Всемирном конгрессе диабетологов в 2006 году, к 2025 году прогнозируется рост больных СД до 380 млн человек, что составит 7% от населения земного мира (5, 10).
Согласно современным представлениям о регуляции метаболизма глюкозы, основу патогенеза СД 2 типа составляют два патофизиологических дефекта, контролирующих динамику уровней гликемии:
инсулинорезистентность (ИР) - снижение чувствительности к инсулину инсулинозависимых тканей (мышечная, жировая, печеночная);
нарушение функции ß-клеток поджелудочной железы (десенситизация клеток) (5).
Суммарно, на первом этапе (доклиническая форма СД 2 типа) гипергликемия (ГГ) обусловлена снижением потребления глюкозы мышечной, жировой тканями в результате первичной ИР и компенсаторной гиперпродукции глюкозы печенью. В ответ на гипергликемию, для сохранения нормального гомеокинеза глюкозы, происходит повышенная секреция инсулина ß-клетками поджелудочной железы - гиперинсулинемия (ГИ). Сохраняющаяся или прогрессирующая «первичная» ИР на фоне неадекватной секреции инсулина ведут к развитию нарушения толерантности к глюкозе (НТГ).
На втором этапе хроническая персистирующая ГГ сопровождается глюкозотоксичностью, что способствует развитию вторичной ИР и десенситизации ß-клеток поджелудочной железы, с ухудшением их секреторной активности (2, 4, 11).
К моменту клинической манифистации СД 2 типа у большинства пациентов уже присутствуют выше описанные компоненты, при этом глюкозотоксичность - неэнзиматическое гликирование белков ведет к развитию нейро-, микро- и ангиопатий, лежащих в основе СС, неврологических, почечных и периферических сосудистых заболеваний. Исследования последних лет указывают на ведущую роль уровней гликемии натощак и постпрандиальной гипергликемии (1-2 часа после приема пищи) в процессе гликирования белков при СД (6, 8, 12).
Нарушения метаболизма глюкозы при ИР облигатно сопровождаются повышенным высвобождением свободных жирных кислот (СЖК) из висцерального депо жировой ткани. Избыточное накопление СЖК в островках поджелудочной железы оказывает липотоксический эффект на функциональную активность ß-клеток. В свою очередь, избыточное поступление СЖК в воротную вену печени препятствует адекватной деятельности печени в снижении концентрации инсулина в крови, ведет к прогрессированию ИР и увеличению синтеза атерогенных липопротеидов. Атерогенная дислипидемия при СД 2 типа характеризуется повышением уровня триглицеридов - гипертриглицеридемия (ГТг), увеличением количества высокоатерогенных мелких плотных липопротеидов низкой плотности (ЛПОНП) и снижением антиатерогенных липопротеидов высокой плотности (ЛПВП).
Фоновая и постпрандальная ГГ сопровождается интенсивным образованием активных свободных радикалов, которые через оксидативные механизмы, связываясь с молекулами липидов, приводят к увеличению продуктов перекисного окисления липидов (ПОЛ) и способствуют раннему развитию атеросклероза, формированию высоких цифр АД, повышению риска ИБС. Гипертриглицеридемия у больных СД 2 типа в два раза увеличивает риск ИБС, снижение уровня ХС ЛПВП - в 4 раза, а при преобладании мелких плотных частиц ХС ЛПНП - в 6 раз (12).
В настоящее время, гипергликемия и гиперинсулинемия рассматриваются как одни из ведущих независимых факторов риска ССЗ, что позволило Американской кардиологической ассоциации причислить СД 2 типа к сердечно-сосудистым заболеваниям (1, 9, 10).
Так, в Фрамингемском эпидемиологическом исследовании была показана связь нарастания риска застойной сердечной недостаточности у больных СД: у молодых мужчин, страдающих СД, недостаточность кровообращения встречалась в 4 раза чаще, а у женщин с СД - в 8 раз чаще по сравнению с аналогичной возрастной группой пациентов без СД (1, 9, 13). В связи с этим, в январе 2007 года были опубликованы совместные рекомендации Европейского общества кардиологов и Европейской ассоциации лечения сахарного диабета по комплексному лечению ХСН в сочетании с СД, которые представлены в таблице 1 (10).
В исследовании UKPDS (UK Prospective Diabetes Study) было продемонстрировано, что при естественном прогрессировании СД 2, количество нормально функционирующих ß-клеток поджелудочной железы уменьшается со скоростью 5% в год, а повышение уровня гликированного гемоглобина (HbA1c) на 1% повышает риск смертности, связанный с СД на 21%, развитие ИМ - на 14%, прогрессирование болезней периферических сосудов - на 43%, микрососудистых осложнений - на 37%, экстракции катаракты - на 19%, что требует более тщательного контроля за уровнем гликемии и компенсации углеводного обмена (5, 11, 14).
В соответствии с рекомендациями European Diabetes Policy Group приняты более жесткие критерии компенсации углеводного и липидного обменов (таблица 2).
Учитывая патогенетические процессы, лежащие в основе прогрессирования СД и развития его осложнений, тактика лечения должна быть направлена на уменьшение ИР, нормализацию уровней глюкозы натощак и постпрандиальной гликемии, снижение концентрации HbA1c до нормы - ≤ 6%, коррекцию дислипидемии в сторону антиатерогенности, достижение целевого уровня АД - ≤ 130/85 мм рт. ст. (3, 7).
Контроль гликированного гемоглобина достаточно осуществлять раз в 3 месяца, т.к. этот показатель изменяется в течение длительного периода времени, соответствующего длительности жизни эритроцитов.
Контроль гликемии обычно осуществляется с помощью индивидуальных глюкометров, но как показывает практика, точечные измерения не дают полноценной картины колебаний гликемии в течение суток. Особенно проблематично выявить скрытую гипогликемию в ночное время, которая может спровоцировать комплекс патологических реакций с развитием «рикошетной» гипергликемии.
В последние годы в практическую медицину активно внедряются методы длительного мониторирования глюкозы - Continuous Glucose Monitoring System (CGMS), которые позволяют идентифицировать периоды спонтанной постпрандиальной гипергликемии и скрытой гипогликемии. Эти методы, в сопоставлении с почасовым дневником пациента, обеспечивают информацию о направлении, величине, продолжительности, частоте и причинах изменений глюкозы в крови, позволяя, таким образом, более адекватно осуществлять контроль за течением болезни и лечением больных СД.
Система постоянного мониторирования глюкозы - CGMS - дает возможность круглосуточно (288 раз в сутки) контролировать уровни гликемии, на протяжении 3-4 дней, с количественным анализом и графическим представлением полученных результатов, что позволяет лечащему врачу, в сопоставлении с дневником пациента, составить четкое представление о характере метаболизма глюкозы в организме и наметить рациональные пути лечения. Система постоянного мониторирования глюкозы - CGMS - состоит из монитора (аппарата), блока соединения с компьютером, программного обеспечения и одноразового сенсора. Сенсор фиксируется подкожно сроком до 3-4 дней, тестирование глюкозы происходит автоматически в интерстициальной жидкости 288 раз в сутки. Перед установкой датчика-сенсора врачом индивидуально задаются допустимые границы колебаний гликемии (диапазон компенсации). Результаты записываются в память монитора и через 3-4 дня врач, анализируя информацию, корректирует дозы инсулина и схему лечения. При расшифровке данных врач и пациент получают графики изменения гликемии на протяжении суток, по которым компьютерная программа высчитывает процент отклонений регистрируемых параметров глюкозы как «гипогликемия» или «гипергликемия» (рисунок 1).
Под нашим наблюдением находилось 75 пациентов с СД 2 типа, которым в программу обследования и до и после лечения (через 3 и 6 месяцев) была включена система непрерывного мониторирования уровня глюкозы - CGMS GOLD.
Среди 75 пациентов с СД 2 типа было 26 женщин (34,7%) и 49 мужчин (65,3%). Возраст пациентов колебался от 45 до 60 лет и в целом по группе больных СД 2 типа средний возраст составил 54,8 ± 3,8 лет, статистически не отличался в подгруппах (женщины, мужчины). Длительность анамнеза заболевания с момента постановки диагноза СД 2 типа не превышала 5 лет и в среднем составила 3,9 ± 0,8 лет.
На момент первичного обследования только у 9 пациентов СД 2 типа (12%) показатели мониторинга гликемического профиля и уровень гликированного гемоглобина (не более 6,5%) соответствовали критериям компенсации, что позволило не проводить коррекции терапии сахароснижающими препаратами.
В зависимости от исходного суточного колебания уровней гликемии (по данным первичного мониторинга) определяли режим приема инсулиновых сенситайзеров - бигуанидов (начальная доза метформина - 850 мг/сутки). Через 5-7 дней при отсутствии побочного эффекта со стороны желудочно-кишечного тракта дозу метформина увеличивали до 1000-2000 мг/сут. К инсулиновым сенситайзерам добавляли комплексную терапию: фибраты (Трайкор 145 мг, 1-2 раза в сутки), антиоксиданты (Актовеегин 800-1000 мг/сутки), гепатопротекторы (Гептрал 400 мг, 1-2 раза в сутки, липоевая кислота 0,025 г, 2-3 раза в день).
Результаты обследования до и после лечения (6 месяцев) представлены в таблице 3.
К концу контрольного исследования у 71 пациента (94,7%) по данным суточного мониторирования гликемии удалось достигнуть компенсации углеводного обмена - минимальных колебаний гликемического профиля в пределах допустимых границ (рисунок 3).
Полное парентеральное питание и мониторинг уровня глюкозы у больных в раннем послеоперационном периоде
Одной из актуальных задач в интенсивной терапии является своевременная диагностика и коррекция гипо- и гипергликемических состояний [1]. Высокий уровень глюкозы крови у больных, находящихся в отделении интенсивной терапии и реанимации (ОИТР) сопровождается повышением частоты развития дисфункции жизненно важных систем организма, гнойно-воспалительных осложнений и летальности по сравнению с пациентами, у которых регистрируются нормальные значения глюкозы крови [12, 17, 20, 21]. С другой стороны, гипергликемия на стресс, в частности на хирургическое вмешательство, обусловливает адаптационную реакцию в виде "мобилизации источников энергии" для поддержания функции жизненно важных систем организма (ЦНС, кровообращение). Интенсивная терапия, реанимационные мероприятия предполагают применение лекарственных средств, способных вызвать гипергликемию. К ним относится искусственное лечебное питание, инфузия катехоламинов, введение кортикостероидов, применение препаратов крови, назначение иммуносупрессивных лекарственных средств. Гипергликемия рассматривается в качестве неблагоприятного фактора у больных с острым инфарктом миокарда, черепно-мозговой травмой, сепсисом, ожогами, у пациентов, находящихся на искусственной вентиляции легких [11, 22]. Важное значение, при развитии тех или иных осложнений, на наш взгляд, должен играть не только высокий или низкий уровень глюкозы крови, но и общая длительность периода во время которого эти значения регистрировались.
Исследования демонстрируют, что причинами острого нарушения углеводного обмена могут стать обширные хирургические вмешательства, сепсис, тяжелая травма, полиорганная дисфункция, шок [5, 20]. Данные вышеуказанных и других авторов характеризуются различным уровнем доказательства и получены при исследовании пациентов, находившихся в отделениях интенсивной терапии и реанимации (ОИТР), терапевтического или хирургического профиля, у которых имел место или отсутствовал сахарный диабет [11, 14].
Таким образом, поддержание глюкозы крови по целевой концентрации является трудной и нерешенной задачей. Протоколы, алгоритмы и методы мониторинга глюкозы постоянно изучаются в условиях ОИТР, внедряются высокие технологии своевременной диагностики и коррекции нарушений углеводного баланса [6, 25]. Оценку уровня гликемии, как показателя тяжести клинического состояния больного, следует рассматривать в качестве важного диагностического критерия, который часто сопровождает развитие серьезных осложнений. В международном руководстве 2008 г. по лечению тяжелого сепсиса и септического шока экспертами настоятельно рекомендуется обеспечение контроля уровня глюкозы, при этом уровень глюкозы - 8,3 ммоль/л не является абсолютным значением, которого необходимо строго придерживаться [7].
Определение уровня глюкозы в крови является рутинным исследованием, проводимым у большинства больных, находящихся в отделении интенсивной терапии и реанимации. Очевидно, что технологии быстрого и точного измерения глюкозы приобретают особую значимость при обширных хирургических вмешательствах, у пациентов с осложненном течением послеоперационного периода, у больных сахарным диабетом [10, 25].
Контроль уровня глюкозы в крови в условиях отделения интенсивной терапии и реанимации может осуществляться различными методами. В зависимости от тяжести клинического состояния, характера основного и сопутствующих заболеваний, наличия тех или иных осложнений, лабораторно-технической оснащенности медицинского учреждения кратность оценки гликемии сильно варьирует. Стандартное биохимическое исследование крови включает оценку гликемии, как правило, один раз в сутки. В условиях отделения интенсивной терапии и реанимации контроль уровня глюкозы в крови осуществляется при определении кислотно-основного и газового состава артериальной крови, а также при назначении сахарного профиля или мониторинга за уровнем глюкозы каждый час с помощью глюкометра или тест-полосок. В каждом из указанных протоколов оценки уровня гликемии применяются различные методы определения глюкозы в крови.
Авторами подчеркивается актуальность тщательного контроля гликемии и необходимости разработки и внедрения удобных способов мониторинга уровня глюкозы и контроля эффективности проводимой инсулинотерапии [4]. Одним из перспективных методов такого контроля у больных сахарным диабетом, у пациентов находящихся в ОИТР рассматривается система постоянного мониторинга глюкозы (CGMS Medtronic MiniMed Guardian RT). Применение методов постоянного мониторирования глюкозы, позволяющих в реальном времени диагностировать гипо- или гипергликемические состояния представляется особенно важным в практике отделений интенсивной терапии и реанимации.
Не менее актуальным является вопрос сопоставления уровня гликемии и проведения адекватного искусственного лечебного питания в послеоперационном периоде. Протоколы для парентерального питания с требуемым для больного определенным количеством калорий (20-35 ккал/кг/сут) обусловливают необходимость назначения инфузий, например раствора "три в одном", со скоростью введения от 60 до 105 мл/час.
Целью настоящего исследования явилось изучение возможности обеспечения безопасности больных в раннем послеоперационном периоде с помощью постоянного мониторинга уровня глюкозы при проведении полного парентерального питания.
Материал и методы. Данная работа представляет проспективное, наблюдательное и неконтролируемое исследование 10 пациентов в раннем послеоперационном периоде, у которых в течение 72 часов проводилось парентеральное питание и мониторинг уровня глюкозы крови и в интерстициальной жидкости подкожно-жировой клетчатки. В отделении общей реанимации и интенсивной терапии РНЦХ им акад. Б.В. Петровского РАМН нами применялась система для постоянного мониторирования глюкозы с помощью подкожного датчика (CGMS Medtronic MiniMed Guardian RT). Система включает монитор, трансмиттер, одноразовый сенсор, станцию соединения с компьютером, которая позволяет измерять уровень глюкозы глюкозооксидазным методом 288 раз/сут (каждые 5 минут). Результаты измерения уровня глюкозы доступны в режиме реального времени и записываются в память монитора, что позволяет их проанализировать с помощью специального программного обеспечения. Система имеет возможность сигнализировать об изменении уровня глюкозы выше и ниже заданных целевых показателей.
Сенсор устанавливается в подкожно-жировую клетчатку переднебоковой поверхности бедра или плеча сроком до 3 суток. После установки сенсор соединяется с трансмиттером, и на экране монитора появляется сигнал инициации работы сенсора. Первые 2 часа 20 минут система тестирует сенсор, после чего требуется первый раз ввести калибровку. Калибровка системы постоянного мониторинга глюкозы CGMS Medtronic MiniMed Guardian RT и контроль уровня гликемии проводились регулярно каждые 6 часов портативным прибором Accu-Chek Active, принцип измерения которого состоит в рефлексионном фотометрическом определении уровня глюкозы в цельной капиллярной крови. Биохимическим анализатором Konelab 30 (глюкозооксидазный метод) регистрировали один раз в сутки, при этом определяли уровень глюкозы в венозной крови. В настоящее время система для постоянного мониторинга глюкозы представлена несколькими поколениями приборов: это монитор CGMS Medtronic MiniMed Guardian RT и инсулиновая помпа для постоянной подкожной инфузии инсулина Paradigm RT 722 Medtronic MiniMed. Метод нашел широкое применение в амбулаторных и домашних условиях у пациентов, страдающих сахарным диабетом.
В ходе исследования изучали частоту регистрации низких и повышенных значений глюкозы, ее динамику в подкожно-жировой ткани при проведении полного парентерального питания у пациентов в 1-3 сутки послеоперационного периода. Нами обследовано 10 (мужчин/женщин - 5/5) пациентов, в том числе 8 были выполнены операции по поводу онкологических заболеваний желудочно-кишечного тракта (экстирпация пищевода с одномоментной пластикой желудочной трубкой - 3, гастрэктомия/резекции желудка и поджелудочной железы - 3, энтеростомия - 1, панкреатодуоденальная резекция - 1) и двое - по поводу неонкологических заболеваний. У одного больного объем операции включал дренирование забрюшинной флегмоны и резекция хвоста поджелудочной железы, у второго - экстирпация пищевода с одномоментной пластикой желудочной трубкой по поводу кардиоспазма IV ст. Средний возраст пациентов составил 58±7,8 лет, масса тела - 65±13,5 кг, индекс массы тела 23±5 кг/м 2 . Критериями включения в исследование являлись: оперативное вмешательство на органах ЖКТ, ранний послеоперационный период, необходимость парентерального питания не менее чем 3-5 сут. Сахарный диабет являлся критерием исключения из исследования. Сердечно-сосудистые заболевания (ИБС, ГБ 2 ст.) отмечены у 60% больных.
Все пациенты в послеоперационном периоде получали полное парентеральное питание в центральную вену. Для парентерального питания применяли препарат "Кабивен центральный" (Fresenius Kabi) 1540 мл, содержащий глюкозу (безводная), жиры и аминокислоты - 150 г, 60 г и 51 г соответственно. Скорость введения раствора составила 60-65 мл/час (1±0,3 мл/кг/час). Целевые значения глюкозы составили от 3,5 ммоль/л до 10,5 ммоль/л. При повышении уровня глюкозы более 10,5-11 ммоль/л проводилась инсулинотерапия в виде подкожных или внутривенных болюсных введений 4-6 Ед.
Результаты исследования и их обсуждение. Клиническое состояние больных в послеоперационном периоде характеризовалось, как средней тяжести течения и было обусловлено, объемом оперативного вмешательства и наличием сопутствующих заболеваний. Рассчитанный по формуле Харриса-Бенедикта основной обмен в среднем по группе составил 1200±180 ккал/сут.
У больных, находящихся в ОРИТ, количество и скорость введения углеводов может значительно варьировать и зависит от выбранной тактики проведения искусственного лечебного питания. Поэтому, важным вопросом остается выбор растворов для парентерального питания. Их состав может отличаться по содержанию глюкозы и жиров. Преимущества и недостатки применения парентерального питания с высоким соотношением углеводы/липиды регулярно обсуждаются на страницах специализированных медицинских журналах. Физиологическое значение углеводов (олиго- и полисахаридов) трудно переоценить. Тем не менее, введение концентрированных растворов глюкозы (>15-20%) на фоне стрессорной гипергликемии, обусловленной хирургическим вмешательством, будет сопровождаться усилением гипергликемии, эскалацией инсулинотерапии. Еще более актуальной проблемой является коррекция гипергликемии у пациентов сахарным диабетом или с нарушением толерантности к глюкозе и снижение дыхательного коэффициента у больных с дыхательной недостаточностью. Мы согласны с мнением Bouletreau P. и соавт. (2005), которые приходят к заключению, что соотношение глюкоза/липиды определяет азотистый баланс в организме при проведении парентерального питания. Но введение растворов с высокими значениями этого индекса (Г/Ж - 80/20) затрудняет коррекцию уровня глюкозы крови [3]. Об угрозе развития гипергликемии при проведении парентерального питания указывается в работе McMahon M.M. (2004). В нашем наблюдении соотношение глюкоза/липиды в калориях составил 55/45%.
Скорость введения глюкозы и обеспечение энергетического баланса в среднем по группе составили 3±0,6 г/кг/сут (0,1±0,03 мг/кг/час) и 20±4,8 ккал/кг/сут, соответственно, и осуществлялось согласно рекомендациям ESPEN (2000), AKE (2002).
Мониторинг уровня глюкозы в течение 3-х суток проведения полного парентерального питания продемонстрировал, что введение раствора "Кабивен центральный" со скоростью 60-65 мл/час не сопровождается выраженным повышением уровня глюкозы, требующим назначение инсулинотерапии. Мониторинг с применением метода CGMS продемонстрировал, что максимальные значения в среднем по группе составили 10,8±1,4 ммоль/л и варьировали от 8,5 до 13 ммоль/л. У 4-х больных регистрировали значения глюкозы выше 11 ммоль/л еще до назначения парентерального питания. Введение в виде болюсной инъекции инсулина 4-6 Ед, подкожно сопровождалось нормализацией уровня глюкозы.
Увеличение поступления углеводов (скорость инфузии, концентрированные растворы) или введение отдельных нутриентов может обусловливать рост уровня гликемии, необходимость введения инсулина и проведения более тщательного контроля уровня глюкозы для своевременной диагностики гипогликемии. Патофизиологические механизмы гипергликемии включают: нарушение водно-электролитного баланса, угнетение моторики желудочно-кишечного тракта, повышение осмолярности крови, угнетение клеточного иммунитета (фагоцитарная активность), блокирование путем гликозилирования активных участков белковых молекул (альбумин, иммуноглобулин и др.).
Постоянная инфузия Кабивена со скоростью 60-65 мл/час у больных с нормальной толерантностью к глюкозе обеспечивала необходимый белково-энергетический баланс, не приводила к превышению целевой концентрации уровня глюкозы и не требовала инсулинотерапии. В среднем по группе минимальные значения, которые отмечались на фоне проведения парентерального питания -регистрировали 4,5±0,77 ммоль/л. Ни у одного из больных не возникли эпизоды гипогликемии. Послеоперационная летальность у больных данной группы отсутствовала.
Общая длительность периода, при котором регистрировались повышенные значения глюкозы, не различались с таковыми, указанными в протоколах других исследователей и составила в среднем 7,5 час. [24].
Выводы.
1. Метод постоянного мониторинга (CGMS Medtronic MiniMed Guardian RT) позволяет повысить безопасность проведения полного парентерального питания у больных в раннем послеоперационном периоде - своевременно выявлять и корригировать эпизоды значимого изменения уровня глюкозы.
2. Применение парентерального питания (Кабивен центральный, 1540 мл) со скоростью 60-65 мл/час у больных, оперированных на ЖКТ, у которых сахарный диабет отсутствовал в анамнезе, не сопровождается повышением уровня глюкозы, не требует проведения интенсивной инсулинотерапии.
Таблица. Значения глюкозы, которые регистрировались во время постоянного мониторинга глюкозы_
| Параметры | Значения | |
| Больные со значением уровня глюкозы: | < 3 ммоль/л | нет |
| 4,4-6,6 ммоль/л | 1 (10%) | |
| 8,9-10,9 ммоль/л | 6 (60%) | |
| > 11 ммоль/л | 3 (30%)* | |
| Минимальные значения в группе, (M±5) | 4,5**±0,77 ммоль/л | |
| Максимальные значения в группе, (M±5) | 10,8±1,4 ммоль/л | |
| Общее время в течение которого регистрировались высокие значения глюкозы > 10,9 ммоль/л) | 7,5±6 час. | |
| Необходимость в инсулинотерапии во время проведения парентерального питания (Кабивен) | нет | |
Непрерывный мониторинг гликемии, или Тайное становится явным

Правильное питание, адекватная физическая активность, прием лекарственных средств, контроль гликемии — все это можно назвать ключом к здоровью для больных сахарным диабетом. Это является профилактикой возможных осложнений СД и основой долголетия, поддержания высокого качества жизни пациента.
Современный уровень развития диагностических методов в медицине, в том числе в диабетологии, сделал доступным для любого человека самостоятельный контроль содержания сахара в крови — без участия медицинских учреждений, в любой момент жизни, с минимальными затратами времени — на портативных индивидуальных глюкометрах. Однако, на вопрос о частоте измерения сахара крови большинство пациентов отвечают, что исследуют сахар крови в лучшем случае ежедневно натощак, а некоторые — всего 1-2 раза в неделю.
Зачем нужен мониторинг уровня сахара в крови?
Как важен самоконтроль для диабетика? Сахар в крови ─ очень вариабельный показатель. Он реагирует на любые, даже незаметные для самого пациента изменения окружающей и внутренней среды, участвуя в механизмах адаптации организма. Очень важны любые изменения этого показателя — повышение (гипергликемия) или снижение ниже нормы (гипогликемия).
Состояние гипергликемии может быть спровоцировано следующими факторами:
- прием углеводистой пищи;
- эмоциональный стресс;
- длительная тяжелая физическая работа;
- повышение температуры тела и артериального давления;
- обострение хронического заболевания или острая патология — состояния, сопровождающиеся выработкой контринсулярных гормонов.
- умеренная физическая работа;
- голодание или отсутствие приема углеводистой пищи.
Нарушение функции эндокринных желез (гипотиреоз, гипокортицизм) приводит к снижению сахара в крови (гипогликемии). Если у здорового человека в подобных ситуациях нормализация концентрации глюкозы происходит за счет изменения внутренних механизмов регуляции, то пациенту с сахарным диабетом требуется проведение коррекции самостоятельно или с участием медицинского персонала. В противном случае отсутствие или несвоевременность этих мероприятий могут привести к трагическим последствиям.
Важно знать, что длительная гипергликемия, связанная с нарушением питания, недостаточной физической нагрузкой или неадекватной дозой сахароснижающих средств, ведет к хроническому необратимому поражению органов-мишеней, ускоряя патологические процессы и приводя к развитию осложнений (ангиопатия, нефропатия, ретинопатия, гастропатия и т.п.). Опасными являются и частые большие колебания от гипо- до гипергликемии.
Самоконтроль гликемии пациентом
В связи с вышесказанным, в последней редакции «Алгоритмов специализированной медицинской помощи больным сахарным диабетом» (2015 г.) уделено особое внимание мониторингу больных СД. Так, самоконтроль гликемии должен проводиться несколько раз в день в дебюте заболевания или при декомпенсации, а на терапии сахароснижающими препаратами — ежедневно не менее 2-х исследований в разное время суток и 1 раз в неделю — не менее 4-х раз в день. На инсулинотерапии контроль гликемии должен проводиться еще чаще, не менее 4-х раз ежедневно. Чтобы адекватно оценить состояние углеводного обмена, определить риски развития осложнений, используется такой показатель, как гликированный гемоглобин (HbA1C). Однако, этот показатель дает нам информацию о том, какой средний сахар был у пациента в течение последних 3-х месяцев, но никак не характеризует ситуацию более короткого промежутка времени. Вот и получается, что вся ответственность за контролем сахара, а значит и поддержание компенсации, лежит полностью на пациенте.
Тем не менее, даже при выполнении всех рекомендаций и тщательном самоконтроле за рамками остается информация о динамике сахара в остальное время суток, и мы не можем дать гарантии об отсутствии гипер- или гипогликемии.
Непрерывный длительный мониторинг гликемии
Но медицина находится в постоянном развитии. В последние годы появился и активно используется метод суточного мониторирования гликемии. Суть метода — в постоянном автоматическом измерении уровня сахара крови во внутриклеточной (интерстициальной) жидкости в течение нескольких суток. Для такого мониторирования используется специализированный программно-аппаратный комплекс CGMS (Continuous Glucose Monitoring System) - высокочувствительный метод контроля уровня глюкозы в крови.
В состав системы входят три модуля:
- высокочувствительный платиновый сенсор;
- трансмиттер и монитор;
- устройство для экспорта данных из трансмиттера в компьютер.
Сенсор (рис.1) — это индивидуальное одноразовое устройство, регистрирующее уровень сахара в интерстициальной жидкости, устанавливается подкожно с помощью специального устройства, практически без болевых ощущений (рис.2).
После установки, к сенсору прикрепляется трансмиттер — маленькое устройство, используемое для передачи сигнала от сенсора на монитор с помощью технологии Bluetooth. Монитор подвешивается на пояс пациента и находится там на протяжении всего периода исследования (рис.3). Удобство беспроводной передачи сигнала очевидно: нет риска, что проводок повредится во время движений тела и исследование прервется, и, следовательно, пациент чувствует себя более свободным.

Рис.1: Сенсор

Рис. 2: Устройство для установки сенсора

Рис.3: Трансмиттер iPro

Рис. 4: Система устройств для передачи данных на компьютер
Продолжительность исследования — 3-5 дней. Монитор автоматически измеряет сахар крови через каждые 10 секунд и один раз в 5 минут записывает среднее значение (от собранных показаний). На протяжении исследования необходимо несколько раз калибровать монитор по сахару крови из пальца. Для этого требуется параллельное проведения самоконтроля сахара на глюкометре. Монитор позволяет вносить информацию о событиях в жизни пациента (прием пищи или лекарственных препаратов, физические нагрузки и т.д.). Это помогает улучшить качество интерпретации собранных данных. После завершения исследования вся полученная цифровая информация импортируется в компьютер (рис.4) и анализируется лечащим врачом. Результаты мониторирования представляются в виде графиков (рис.5) и сводных таблиц (рис.6) с вычисленными средними значениями показателей сахара, границами отклонений от них, соотношением гипергликемии и гипогликемии в процентах за различные периоды времени.
Автоматизированный мониторинг гликемии предоставляет лечащему врачу необходимый объем фактической информации о характере изменений уровня сахара в течении суток и позволяет выявить тенденции отклонений. На основании этих данных врач назначает правильную тактику лечения или проводит своевременную корректировку терапии.
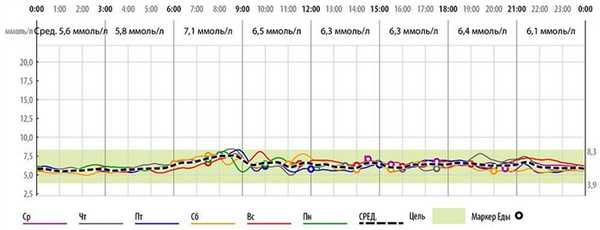
Рис.5: Пример графического изображения полученных за время исследования данных
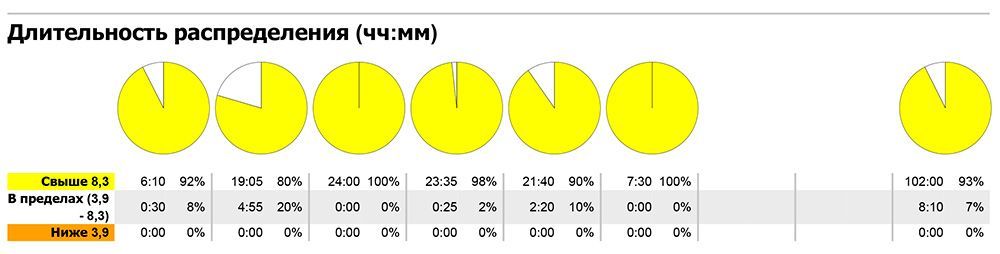
Рис.6: Пример сводной таблицы данных непрерывного мониторирования гликемии
Роль и эксклюзивность метода CGMS
Любая корректировка терапии может основываться только на достоверных данных, и метод CGMS становится неотъемлемой частью ведения пациентов с нарушенным углеводным обменом. Надо отметить, что возможности применения метода не ограничиваются только пациентами с сахарным диабетом. С его помощью можно диагностировать гипогликемические состояния у людей, не страдающих СД, а также проанализировать изменения гликемии у пациентов с ожирением и обнаружить нарушения углеводного обмена на самых ранних стадиях.
У пациентов с сахарным диабетом методика используется для диагностики следующих состояний:
- постпрандиальная гипергликемия, позволяющая оценить эффективность сахароснижающей терапии и скорость всасывания различных углеводов;
- ночные гипогликемии;
- реакция сахара крови на физическую нагрузку;
- скрытые бессимптомные гипогликемии и т.д.
Собранная и проанализированная информация дает возможность индивидуально корректировать терапию, периодичность и время приема сахароснижающих средств, график и степень физической активности и, конечно же, питание, его качественные и количественные характеристики.
Повторное мониторирование гликемии после коррекции терапии позволяет объективно оценить эффективность изменений (рис.7).
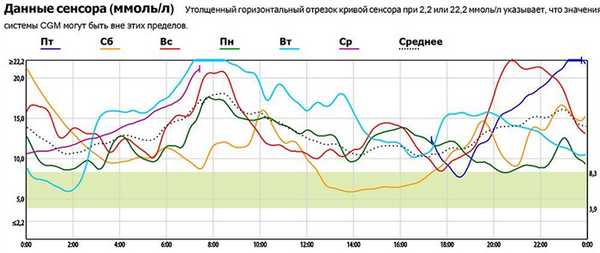

Рис.7: Данные CGMS после коррекции терапии и режима: достигнуты целевые значения гликемии
Где можно выполнить непрерывный мониторинг гликемии?
В московской многопрофильной клинике ЦЭЛТ суточное мониторирование гликемии проводится на аппарате iPro Medtronic (США) амбулаторно.
В стоимость исследования входит:
- одноразовый сенсор;
- установка системы;
- дистанционное сопровождение врачом в течение всего периода проведения исследования;
- расшифровка данных и консультация врача-эндокринолога.
Установку CGMS-монитора и расшифровку результатов исследования в клинике ЦЭЛТ проводит врач-эндокринолог. После расшифровки данных пациент получает рекомендации по коррекции питания, образа жизни, лечению.
Читайте также:
