Мутация генов супрессоров как причина развития рака
Добавил пользователь Валентин П. Обновлено: 27.01.2026
Нарушения функций вышерассмотренных белков, контролирующих апоптоз и/или клеточный цикл (p 53 , pRb, p16 INK4a , pARF и др.) отменяют запрет на пролиферацию клеток с различными аномалиями, в том числе и с генетическими изменениями, что увеличивает вероятность появления онкогенных клеточных клонов. Эту группу белков принято называть "gatekeepers" - "сторожи". Наряду с этим идентифицирован ряд компонентов специализированных систем распознавания и репарации повреждений ДНК, дисфункция которых также вызывает генетическую нестабильность, предопределяющую развитие новообразований. Они получили название "caretakers" - "смотрители". Эта вторая группа белков и является предметом рассмотрения данного раздела.
В зависимости от типа повреждений ДНК могут активироваться три типа репарационных систем: а) системы репарации двунитевых разрывов ДНК; б) системы репарации неспаренных оснований ("mismatch repair"); и, в) системы эксцизионной репарации. Описаны наследственные формы новообразований, связанные с врожденными мутациями генов, продукты которых обеспечивают активацию и функционирование каждой из этих систем. Причем, некоторые из этих белков (ATM, CHK2, р53, BRCA1) активируют также и молекулы, ответственные за остановку клеточного цикла и индукцию апоптоза, выполняя, таким образом, одновременно функции и "смотрителя", и "сторожа".
3.11.1. АТМ, ATR, NBS1, CHK1 и CHK2 - компоненты систем проведения сигналов от поврежденной ДНК к различным эффекторам
Ключевую роль в интеграции сигналов от поврежденной ДНК и их дальнейшей передаче к разнообразным эффекторам играют специфические протеинкиназы ATM (Ataxia-Telangiectasia Mutated), ATR (ATM Related), NBS1, CHK1 и CHK2 (чекпойнткиназы 1, 2) - Рис. 7. Белок ATM, имеющий структурное сходство с фосфатидилинозит-3-киназой (PI3K), накапливается в местах повреждений и приобретает киназную активность, связывая фосфорилированные белки хроматина (H2AX и др.) и белки-сенсоры нарушений структуры ДНК. Причем, ATM активируется в ответ на возникновение двунитевых разрывов ДНК (вызываются g-облучением, ингибиторами топоизомераз и т.д.), тогда как другие нарушения структуры ДНК (например, сшивки оснований, вызываемые УФ-облучением или повреждения, индуцируемые алкилирующими соединениями) не активирует ATM. В этих случаях, как и при ингибировании синтеза ДНК, наблюдается функциональная активация гомолога ATM, белка ATR. Активированные формы ATM и ATR фосфорилируют ряд своих мишеней, в частности р53 (см. раздел 3.3.3), Mre11, NBS1, CHK1, CHK2 и BRCA1 (Рис. 7).
Рис. 7. Схема сигнальных путей, регулирующих реакции клетки на повреждения ДНК. Выделены компоненты, герминальные мутации которых ответственны за наследственные синдромы, характеризующиеся предрасположенностью к развитию определенных новообразований.
Причем для фосфорилирования CHK2 необходимо предварительное фосфорилирование белков комплекса Mre11/NBS1/Rad50, который, локализуясь в местах повреждений, рекрутирует к ним различные молекулы, в том числе CHK2, BRCA1, E2F и PCNA. Привлечение PCNA вызывает переключение с репликативного синтеза ДНК на репарационный и остановку клеточного цикла в S фазе; к блокированию входа и продвижения по S ведет и подавление функции E2F (см. 3.2.2). Фосфорилированные чекпойнткиназы CHK1/2, в свою очередь, фосфорилируют и инактивируют белки семейства Cdc25, что вызывает подавление активности регулируемых ими циклинзависимых киназ и быструю остановку клеточного цикла в G1 (если Cdc25A не активирует Cdk2) или в G2 (когда Cdc25C не активирует Cdc2). Кроме того, CHK1 и CHK2 амплифицируют сигналы к р53 и BRCA1, что способствует длительной задержке в G1 или G2 (см. разделы 3.3.3 и 3.11.2) и, кроме того, активизирует системы репарации ДНК (см. следующие разделы) - Рис.7.
Герминальные инактивирующие мутации обоих аллелей гена ATM вызывают атаксию-телангиэктазию (АТ) - тяжелое заболевание, характеризующееся нейродегенерацией, иммунодефицитом и повышенным риском возникновения новообразований. Примерно у 10% пациентов с АТ в молодом возрасте развиваются лимфоидные опухоли из Т- или В-клеток (лимфосаркомы, лимфогрануломатоз, различные формы лейкозов), а также рак молочной железы. Соматические гомозиготные мутации гена АТМ характерны и для некоторых форм ненаследственных лимфолейкозов (Т-клеточного пролимфоцитарного лейкоза, В-клеточного хронического лимфолейкоза и др.). Гомозиготный нокаут гена ATM у мышей также значительно увеличивает вероятность развития лимфоидных неоплазий. У индивидуумов с герминальными мутациями только одного из двух аллелей гена АТМ несколько повышена частота возникновения рака молочной железы. Онкогенный потенциал мутаций АТМ связан, очевидно, с нарушениями реакций клетки на повреждения ДНК и возникающей в связи с этим генетической нестабильностью. Так, после g-облучения в клетках с дефектным АТМ не происходит полноценной активации чекпойнтов и остановки клеточного цикла в G1, S или G2. Кроме того, в них блокирована активизация системы репарации двунитевых разрывов ДНК. В результате при инактивации АТМ резко увеличивается вероятность размножения клеточных вариантов с различными генетическими нарушениями.
Сходные последствия наблюдаются и при инактивации одной из важнейших мишеней АТМ - белка NBS1. Герминальные гомозиготные мутации гена NBS1 вызывают Ниймегенский синдром (Nijmegen Breakage Syndrome), характеризующийся иммунодефицитом, генетической нестабильностью и повышенной предрасположенностью к развитию лимфоидных новообразований (в отличие от мутаций АТМ, мутации NBS1 не вызывают атаксию и телангиэктазию). Соматические мутации гена NBS1 выявляются в 10-20% случаев ненаследственных форм острого лимфобластного лейкоза. В клетках с инактивацией NBS1 наблюдается отмена остановки в S после g-облучения и понижение эффективности работы систем репарации двунитевых разрывов ДНК вследствие нарушения функционирования комплекса Rad50/Mre11/NBS1, обеспечивающего оба механизма исправления таких повреждений - гомологичную рекомбинацию ДНК и воссоединение концов разорванной ДНК.
Потенциальным онкогенным эффектом обладают, по-видимому, и нарушения функции белка ATR. Гетерозиготный нокаут гена ATR у мышей приводит к увеличению частоты возникновения лимфосарком, фибросарком, раков печени и яичника (инактивация обоих аллелей гена ATR, в отличие от гомозиготного нокаута гена ATM, вызывает внутриутробную гибель). У людей наследственного предрасположения к развитию каких-либо новообразований, связанного с врожденными мутациями ATR пока не выявлено, но соматические мутации этого гена нередко выявляются в клетках некоторых опухолей, в частности рака желудка.
Увеличение риска развития новообразований наблюдается и при врожденных мутациях чекпойнткиназы CHK2. Оказалось, что у части пациентов с клиническими проявлениями синдрома Ли-Фраумени (см. раздел 3.3.1), но не имеющих мутаций р53, выявляются герминальные гетерозиготные мутации гена CHK2. Этот факт свидетельствует о ключевой роли нарушений сигнального пути CHK2-p53, контролирующего реакции клетки на повреждения ДНК, в возникновении сильной предрасположенности к развитию самых разных новообразований. Соматические инактивирующие мутации чекпойнткиназ CHK2 и CHK1 обнаруживаются в части случаев наиболее распространенных опухолей: рака легкого, толстой кишки, матки и др.
3.11.2. BRCA1 и BRCA2 контролируют репарацию ДНК и размножение клеток
Гены BRCA1 и BRCA2 были впервые идентифицированы как гены, врожденные мутации которых ассоциированы с наследственными формами рака молочной железы. У женщин с герминальными мутациями одного из аллелей гена BRCA1 риск развития в течение жизни рака молочной железы составляет около 85% (этот риск несколько варьирует в зависимости от местоположения и/или типа мутаций). Для опухолей яичника такой риск несколько меньше - около 50%. У носителей врожденных мутаций гена BRCA1 выше также вероятность развития опухолей толстого кишечника и простаты. При герминальных мутациях гена BRCA2 риск развития опухолей молочной железы несколько ниже, чем при мутациях BRCA1. Отличительными чертами мутаций BRCA2 являются более частое возникновение рака молочной железы у мужчин и меньший риск развития опухолей яичника. Гены BRCA1 и BRCA2 ведут себя как классические опухолевые супрессоры: для инициации опухолевого роста помимо врожденной мутации в одном из аллелей необходима и инактивация второго аллеля, которая происходит уже в соматической клетке. Как правило, мутации в генах BRCA1 и BRCA2 ведут к прекращению синтеза полноразмерного белка. Особенностью мутаций генов BRCA1 и BRCA2 является то, что они характерны для наследственных форм новообразований и значительно реже обнаруживаются в ненаследственных опухолях той же локализации.
Гены BRCA1 и BRCA2 кодируют ядерные фосфобелки (соответственно 1863 и 3495 аминокислот), которые за счет разнообразных белок-белковых взаимодействий участвуют в регуляции репарации ДНК и размножения клеток. Так, белок BRCA1 связывает белки, ответственные за гомологичную рекомбинацию и репарацию двунитевых разрывов ДНК (Rad50, Rad51, BRCA2), компоненты систем репарации неспаренных оснований ДНК (MSH2, MSH6, MLH1, ATP-MSH2 и др.), транскрипционные факторы (базальные - HDAC, р300/CBP, SWI/SNF; и сиквенс-специфические - p53, Myc, E2F, ZBRK1, ATF, рецептор эстрогенов, рецептор андрогенов), а также ряд других белков - pRb (см. II.3.2), BARD1 (опосредует убиквитинирование), BAP1 (ответственен за деубиквитинирование), Nm23 (компонент центросомы) и т.д.
Транскрипционная функция BRCA1 заключается в его способности репрессировать одни сиквенс-специфические факторы транскрипции (Myc, E2F, рецептор эстрогенов и др.) и активировать другие (р53 и др.) и модулировать таким образом активность генов, регулируемых этими факторами. При генотоксических стрессах (g-облучение и др.) транскрипционная функция BRCA1 направлена на индукцию остановки клеточного цикла по нескольких механизмам. Так, она обеспечивает усиление активности р53; включение дублирующих, р53-независимых, путей активации некоторых р53-респонсивных генов (p21 Waf1/Cip1 , GADD45), вызывающих задержку соответственно в G1 и G2 (см. раздел 3.3.3); подавление активности Myc, E2F и т.д. Одновременно активированный BRCA1, взаимодействуя с белками репарационных систем, стимулирует восстановление нормальной структуры ДНК. Рекрутируя комплексы Rad50/Mre11/NBS1, он стимулирует процессирование концов разорванной ДНК, подготавливая их либо для гомологичной рекомбинации, либо для воссоединения "конец в конец" - двух основных путей репарации двунитевых разрывов ДНК. Взаимодействуя с комплексом Rad51/BRCA2, он увеличивает эффективность процесса гомологичной рекомбинации ДНК. Связываясь с белками MSH2, MSH3, MSH6 и др., BRCA1 участвует, очевидно, также и в работе системы репарации неспаренных оснований (исправляет ошибки репликации ДНК и неправильную репарацию двунитевых разрывов ДНК) - см. раздел 3.11.3.
Помимо контроля повреждений ДНК и поддержания целостности генома BRCA1 выполняет и ряд других функций. Так, он связывает рецептор эстрогенов и репрессирует его транскрипционную функцию, сдерживая, таким образом, избыточную пролиферацию клеток молочной железы и других эстроген-зависимых органов, в частности при половом созревании и беременности. Кроме того, BRCA1, взаимодействуя с компонентами центросом (Nm23 и др.), принимает участие в обеспечении правильной сегрегации хромосом во время митоза.
Исходя из столь многочисленных функций BRCA1, становятся понятными последствия его инактивации. В клетках с дефектным BRCA1 наблюдается сильная генетическая нестабильность, т.е. повышение частоты возникновения спонтанных или индуцированных мутагенами генетических изменений - генных мутаций, хромосомных транслокаций, анеуплоидии и т.д. Кроме того, отменяется сдерживание пролиферации эстроген-зависимых клеток, что и объясняет, очевидно, возникновение опухолей именно молочной железы и яичника.
Функции белка BRCA2 изучены хуже. Как и BRCA1 он обладает репарационными и транскрипционными активностями. Связывая Rad51 (гомолог бактериального белка RecA), BRCA2 увеличивает его способность катализировать рекомбинации ДНК, обеспечивающие репарацию двунитевых разрывов ДНК. Транскрипционная функция BRCA2 связана, очевидно, со способностью рекрутировать P/CAF (p300/CBP Associated Factors), ацетилирующие гистоны и ремоделирующие хроматин. Однако физиологические гены-мишени BRCA2 пока не идентифицированы. Тем не менее о важности транскрипционной активности BRCA2 для его супрессорной функции может свидетельствовать тот факт, что обнаруживаемые в опухолях молочной железы мутации поражают именно транскрипционный домен. У мышей гомозиготный нокаут резко уменьшает жизнеспособность эмбрионов, а у выживших животных развиваются злокачественные тимомы. На клеточном уровне инактивация BRCA2 приводит к гиперчувствительности к различным генотоксическим агентам (УФ- и g-облучению, химическию мутагенам), повышению частоты встречаемости незарепарированных двунитевых разрывов ДНК и различных перестроек хромосом. Механизмы специфического возникновения у пациентов с герминальными мутациями BRCA2 опухолей молочной железы, яичника и простаты пока не установлены.
3.11.3. MSH2, MSH6, MLH1 и PMS2 - компоненты систем репарации неспаренных оснований ДНК
Риск развития новообразований значительно повышается и при врожденных дефектах системы репарации неспаренных оснований (mismatch repair), исправляющей главным образом ошибки репликации ДНК и неточности репарации двунитевых разрывов. В результате таких ошибок и потери комплементарности нитей ДНК возникают петли, которые распознаются комплексами белков MSH2/MSH6 или MSH2/MSH3 (они отличаются по способности узнавать разные типы петель, образующиеся при замене оснований, инсерциях и делециях). Эти комплексы рекрутируют к местам с нарушенной структурой ДНК комплексы белков MLH1/PMS2 или MLH1/MLH3, которые, в свою очередь, привлекают экзо- и эндонуклеазы, осуществляющие эксцизию аномального фрагмента ДНК, а также факторы репликации (PCNA, ДНК-полимеразы), обеспечивающие застройку бреши и восстановление нормальной структуры ДНК.
Врожденные гетерозиготные мутации по меньшей мере четырех из компонентов этой системы - MSH2, MLH1, MSH6 и PMS2 - вызывают синдром Линча. Главной чертой этого синдрома является развитие в молодом возрасте опухолей толстой кишки (так называемый наследственный неполипозный колоректальный рак) и/или опухолей яичника. Преимущественное возникновение опухолей кишечника, вероятно, связано с высочайшим пролиферативным потенциалом клеток на дне кишечных крипт, что естественно ведет и к более частому появлению ошибок репликации, которые должны исправляться именно системами репарации неспаренных оснований. Естественно, что бурно размножающиеся полустволовые (амплифицирующие) клетки кишечного эпителия накапливают необходимый для развития опухолей набор мутаций быстрее, чем медленно размножающиеся клетки.
Возникновение опухолей при дисфункции MSH2, MLH1, MSH3 или PMS2 связано, очевидно, с повышенной вероятностью мутаций в протоонкогенах и опухолевых супрессорах. Действительно, при мутациях гена MSH2 или MLH1 частота точечных мутаций во всех локусах увеличивается на 1-2 порядка, а в наследственных колоректальных раках, как правило, обнаруживаются точечные мутации в генах b-катенина, АРС, TbR-II, Smad2, Smad4 и т.д., которые, по-видимому, и являются причиной развития новообразований. Маркером инактивации любого из генов репарации неспаренных оснований является легко выявляемая нестабильность микросателлитных последовательностей ДНК. Нарушения функции генов MSH2, MLH1, MSH3, MSH6 и PMS2, приводящие к нестабильности микросателлитов, характерны и для некоторых форм спорадических (ненаследственных) опухолей: они обнаруживаются в 13-15% опухолей толстой кишки, рака желудка и эндометрия, но значительно реже (<2%) в других новообразованиях.
Описаны единичные случаи герминальных мутаций обоих аллелей гена MLH1, которые приводили к развитию еще во внутриутробном возрасте лимфосарком, лейкозов и нейрофиброматоза. Это объясняется видимо тем, что при полной инактивации системы репарации ошибок репликации ДНК и бурном размножении в эмбриогенезе клеток всех тканей, необходимое для образования опухоли количество мутаций успевает накопиться в каких-то клетках задолго до рождения, тогда как при гетерозиготных мутациях темп мутирования ниже и накопление мутаций до критического уровня продолжается в интенсивно размножающихся клетках взрослого организма. С этой точки зрения пока непонятно, почему у мышей как с гетерозиготным, так и с гомозиготным нокаутом гена MSH2 или гена MLH1, также развиваются лимфомы и саркомы, а не опухоли кишечника. (Впрочем, следует заметить, что мыши сильно отличаются от человека и по типу спонтанно развивающихся опухолей: у человека большую часть новообразований представляют различные формы рака, возникающие из эпителиоцитов, тогда как у мышей такие опухоли достаточно редки, а возникают, как правило, лимфомы и саркомы). Природу таких различий еще предстоит выяснить.
3.11.4.Компоненты системы эксцизионной репарации ДНК и пигментная ксеродерма
Система эксцизионной репарации узнает и исправляет сшивки оснований (тиминовые димеры и др.), образующиеся, например, после УФ-облучения или оксидативного стресса. Она включает множество компонентов. Распознавание тиминовых димеров осуществляется белковым комплексом XPC-hHR23, который вызывает рекрутирование к месту повреждения фактора TFIIH - сложного белкового комплекса, состоящего из 9 субъединиц и обладающего разными активностями, в том числе хеликазной и транскрипционной. Привлеченный фактор TFIIH катализирует раскрытие поврежденного участка ДНК и способствует сборке репарационного комплекса. Затем к дефектному участку последовательно рекрутируются белки XPG, XPA, комплекс RPA и, наконец, белки XPF-ERCC1, являющиеся эндонуклеазами. Именно они и осуществляют эксцизию поврежденного участка ДНК (обычно вырезается 24-32 нуклеотида) и инициируют застройку бреши по неповрежденной матрице и восстановление нормальной структуры ДНК.
Герминальные гетерозиготные мутации компонентов системы эксцизионной репарации, в частности генов XPA, XPB, XPC, XPD, XPF, XPG, ведут к возникновению пигментной ксеродермы - наследственного заболевания, характеризующегося повышенной чувствительностью к ультрафиолетовому облучению и развитием множественных опухолей кожи на местах, подвергающихся солнечному облучению. Интересно, что, несмотря на участие эксцизионной репарации в исправлении дефектов, вызванных не только УФ-облучением, но и мутагенами/канцерогенами, частота возникновения других форм опухолей при пигментной ксеродерме почти не увеличивается. При этом у трансгенных мышей с аналогичными дефектами системы эксцизионной репарации отмечается повышение частоты индукции новообразований химическими канцерогенами. Преимущественное возникновение у пациентов с пигментной ксеродермой исключительно опухолей кожи может указывать на незначительную роль химических факторов, загрязняющих окружающую среду, в развитии опухолей внутренних органов у человека.
Генетический анализ на рак
Генетические анализы на рак - это тесты, которые помогают выявить наследственные (доставшиеся от родителей) и соматические (возникшие в течение жизни) мутации, связанные с онкологическими заболеваниями. Можно выявлять прицельно определенные мутации или проанализировать всю последовательность ДНК, что позволяет обнаруживать до 85% и более генетических нарушений, способствующих развитию злокачественных опухолей.
У здорового человека генетические анализы на рак помогают выявить носительство наследственных мутаций, повышенный риск развития онкозаболеваний и своевременно принять меры по профилактике. У людей с уже диагностированной злокачественной опухолью генетическое тестирование помогает определить подтип новообразования, уточнить прогноз, подобрать наиболее эффективное лечение.
Рак — заболевание, которое ежегодно уносит миллионы жизней, уступая среди причин смертности только сердечно-сосудистым патологиям. Ученые и врачи-онкологи уже давно ведут с ним борьбу, постоянно внедряя новые средства, которые помогают сохранить жизни всё большего числа пациентов. За последние десятилетия поле сражения сильно сместилось с гистологического и клеточного уровня на молекулярно-генетический.
Если раньше было лишь известно, что при раке меняется внешний вид и поведение клеток, то теперь ученые стремятся разобраться в процессах на уровне генов и отдельных молекул. Это стало возможным с развитием молекулярной биологии, и на этом поприще достигнуты немалые успехи.
Каждая клетка человеческого организма содержит около 30 тысяч генов. Среди них есть те, которые контролируют рост и размножение клетки, ее продолжительность жизни, отвечают за «починку» поврежденной ДНК.
Рак развивается из-за мутаций, в результате которых эти гены начинают работать неправильно. Генетические дефекты возникают случайно или при воздействии внешних факторов: курения, ультрафиолетового излучения, канцерогенов в пище и окружающей среде. Некоторые мутации (наследственные) человек получает от родителей, другие (приобретенные) — в течение жизни. [8]
Наследуемая природа злокачественных новообразований доказана для некоторых локализаций. Наиболее часто встречаются рак груди, яичников, поджелудочной железы, толстой кишки, рак желудка и меланома. По различным данным, доля наследственных форм в структуре онкологических заболеваний составляет:
- 10-17% - Рак яичников. [1]
- 5-10% - Колоректальный рак. [3]
- 5-10% - Рак груди. [1]
- 10% - Рак поджелудочной железы. [5,7]
- 5-10% - Рак желудка. [7]
- 5-10% - Меланома. [6,7]
Каждый рак уникален, несет собственный набор мутаций. И эти различия могут сильно влиять на прогноз, чувствительность раковых клеток к тем или иным лекарственным препаратам. Выяснить это помогают специальные генетические анализы.
Что такое генетический тест
Перед тем, как рассказать о генетических тестах, давайте разберемся что такое гены и ДНК. ДНК - это макромолекула (очень большая), которая хранит и передает генетическую информацию. Ген - это участок ДНК, в котором зашифрована информация о белке. Совокупность генов конкретного организма называется генотипом.
Генетические тесты - это очень большой спектр анализов, с помощью которых можно исследовать генотип и отдельные гены человека, а также инфекционных агентов, которые вызывают у него заболевания. Такие исследования нашли широкое распространение в медицине, судебной экспертизе, криминалистике, профессиональном спорте и даже сельском хозяйстве. Наиболее популярные методы, с помощью которых они проводятся: секвенирование, полимеразная цепная реакция (ПЦР), фрагментный анализ и др.
Огромное значение генетическое тестирование имеет и в онкологии, поскольку все злокачественные опухоли являются следствием накопления особых мутаций в клетках организма. А их выявление позволяет поставить точный диагноз, назначить эффективное современное лечение, подтвердить или опровергнуть наследственную природу рака, а также оценить прогноз заболевания.
Выявление наследственных мутаций позволяет разработать план профилактики рака или его обнаружения на ранних стадиях. Например, некоторым пациентам может быть показано изменение образа жизни, в других случаях обсуждается вопрос проведения превентивных операций по удалению органа-мишени, кому-то может быть показано регулярное прохождение углубленного медицинского осмотра, который направлен на выявление опухоли на начальной стадии. [4,8]
Преимущества генетического тестирования в определении предрасположенности к раку
Генетические исследования в онкологии помогают решать важные задачи:
- Обнаружить наследственные мутации и оценить риск развития рака, своевременно принять профилактические меры.
- Разобраться, есть ли у человека генетические дефекты, связанные с повышенным риском онкологических заболеваний, которые он может передать своим детям.
- Составить «молекулярно-генетический портрет» опухоли и выяснить, к каким препаратам она чувствительна.
- Устранить беспокойство человека и его родственников, если оно имеется.
Все генетические исследования на мутации, связанные с раком, можно разделить на две большие группы: те, которые проводят у здоровых людей, чтобы выявить риски, и те, которые проводят у онкологических больных, чтобы изучить опухолевые клетки и подобрать правильное лечение. Для каждой группы есть свои показания. Вне зависимости от полученных результатов исследования, необходимо получить консультацию онкогенетика. [4]
Анализы для людей, у которых уже диагностирован рак
Обычно такие исследования назначают при поздних стадиях онкологических заболеваний, когда стандартные методы лечения не помогают. Эти анализы применяют для диагностики заболевания, подбора персонализированной терапии и оценки прогноза.
Наиболее распространенные исследования из этой группы:
- При меланоме: исследования мутация в гене BRAF.
- При немелкоклеточном раке легкого: гены EGFR, BRAF, ALK.
- При раке толстой и прямой кишки: ген KRAS.
- При раке молочной железы: ген HER2.
- При раке яичников: гены BRCA1, BRCA2.
Эти мутации будут встречаться только в опухолевых клетках. В остальных, здоровых, тканях организма указанные гены будут функционировать нормально. [1,3,5,6,7]
Анализы для здоровых людей, направленные на оценку рисков
Наследственные мутации человек получает от родителей. Они присутствуют в половых клетках, а значит, их получат все клетки тела человека. В настоящее время с помощью генетического теста можно определить повышенный риск развития следующих типов рака:
- яичников;
- молочной железы;
- щитовидной железы;
- толстой кишки;
- поджелудочной железы;
- простаты;
- желудка;
- почки.
Кроме того, генетические исследования помогают оценить риск меланомы, сарком — злокачественных опухолей из соединительной ткани.
Эксперты из Американского общества клинической онкологии (American Society of Clinical Oncology) рекомендуют рассмотреть возможность проведения генетических исследований на наследственные мутации людям, у которых в семье часто встречались определенные типы злокачественных опухолей, если такой диагноз был установлен у близких родственников. Правильное решение о необходимости обследования помогут принять онколог, клинический генетик. [2]

Что показывает анализ?
Генетические тесты показывают, в каких генах произошли изменения, связанные с повышенным риском рака. Выделяют две группы генов, в которых могут возникать такие мутации.
Протоонкогены кодируют белки, активирующие деление клеток. В норме они должны «включаться» лишь в определенное время. Если в протоонкогене возникает мутация, либо он становится чрезмерно активным (например, из-за увеличения количества копий), он превращается в онкоген, и нормальная клетка становится опухолевой.
Распространенные примеры онкогенов — EGFR и HER2. Эти белки-рецепторы встроены в клеточную мембрану. При активации они запускают цепочку биохимических реакций, в результате чего клетка начинает активно, бесконтрольно размножаться. Все мутации в протоонкогенах — приобретенные, они не наследуются.
Гены-супрессоры опухолей ограничивают размножение клеток, восстанавливают поврежденную ДНК, отвечают за «смерть» отработавших своё клеток. Рак возникает из-за того, что в результате мутаций эти гены перестают справляться со своей функцией. Например, гены BRCA1 и BRCA2 отвечают за репарацию ДНК. При наследственных мутациях в них у женщин повышен риск того, что будет диагностирован рак молочной железы, яичников. [6,8]
«Евроонко» сотрудничает с ведущими зарубежными лабораториями. Они применяют современные технологии секвенирования, которые помогают быстро изучить ДНК человека и выявить изменения в сотнях генов:
- замену оснований — «букв» генетического кода;
- делеции — утрату участка хромосомы;
- инсерции — «лишние» вставки ДНК в хромосомах;
- изменение числа копий определенного гена;
- фьюжн-мутации — слияние генов, в результате которого образуется новый, гибридный ген;
- мутационную нагрузку опухоли.
Какие гены вызывают онкологические заболевания
Как мы уже говорили выше, в образовании злокачественной опухоли имеют значение две большие группы генов: протоонкогены и гены-супрессоры опухоли. Если протоонкоген мутировал и перестал выполнять свою функцию, он превращается в онкоген. Наиболее известные онкогены это HER2/neu - эпидермальный фактор роста, который важную роль в развитии агрессивного рака молочной железы, гены семейства RAS, которые кодируют сигнальные белки, передающие информацию о размножении. Информация о некоторых онкогенах и вызываемых ими злокачественных новообразованиях представлена в таблице:
| Протоонкоген | Тип нарушений | Виды опухоли |
| PDGFB, EGF, TGFA, VEGF, FGFA, FGFB | Гиперэкспрессия либо амплификация | Злокачественные новообразования молочной железы, желудка |
| PDGFRB, PDGFRA, EGFR, HER2/NEU, RET, MET, ROS, VEGFR | Гиперэкспрессия либо амплификация | Плоскоклеточные злокачественные новообразования, глиобластомы, рак молочной железы и яичников |
| ABL | Слияние с геном BCR | Острый лимфолейкоз |
| RAF/MIL, MOS, BCR, PIM1, AKT | Мутации, слияние | Рак желудка, легких, толстой кишки, поджелудочной железы, нейробластома |
| FOSB, FRA1, FRA2, JUND, BCL3, MYB | Гиперэкспрессия, амплификация | Рак желудка, кишечника, яичников, легких, лимфома Беркитта, нейробластома |
| BAX, BCL2A, BCL2B | Гиперэкспрессия, транслокация | Фолликулярная В-клеточная лимфома |
Наиболее известными генами-супрессорами являются BRCA 1 и 2, которые участвуют в процессах репарации ДНК, p53 - белок, запускающий процесс клеточного цикла и ее гибель при накоплении повреждений ДНК. Также к ним относятся и следующие: [6]
| Ген-супрессор | Эффект зародышевых мутаций | Эффект соматических мутаций |
| Р53 | Синдром Ли-Фраумени | Рак толстой кишки, легкого, молочной железы и др. |
| RB | Ретинобластома | Различные опухоли |
| p16/INK4A | Наследственная меланома | Рак поджелудочной железы, глиома и др. |
| ATM | Синдром Луи-Бар | Рак молочной железы, легких, опухоли лимфатической системы |
| MSH2, MLH1 | Наследственный рак толстой кишки и эндометрия | Рак толстой кишки, рак эндометрия |
| BRCA1, BRCA2 | Наследственный рак молочной железы и яичников | Редко мутируют в спорадических опухолях |
| APC | Семейный аденоматозный полипоз толстой кишки | Рак толстой кишки |
| PTEN / MMAC1 | Болезнь Коудена | Рак эндометрия, простаты, почек, молочной железы, опухоли мозга и др. |
Что делать, если мутации выявлены?
В результате проведения анализа пациент получает заключение, в котором представлена информация о проведенных исследованиях. При выявлении одной или нескольких мутаций рекомендуется обратиться к онкологу, генетику или онкогенетику, чтобы составить план дальнейших действий. Он может включать проведение следующих мероприятий:
У пациентов с уже диагностированным раком выявленные мутации помогут подобрать оптимальный метод лечения, в том числе назначение таргетной терапии и иммунотерапии. [1,4,6]
Существуют ли противопоказания?
Генетические тесты могут нести некоторые негативные эффекты. Когда здоровый человек узнаёт, что у него мутация, связанная с повышенным риском рака, это может стать сильным эмоциональным потрясением. Врач порекомендует рассказать об этом членам семьи, чтобы они тоже знали о рисках, и это может сделать семейную атмосферу более напряженной. Сам по себе генетический анализ стоит недешево. Если его проводят у онкологического больного для подбора персонализированной терапии, рекомендованные по результатам исследования препараты тоже могут оказаться очень дорогими.
Как происходит сдача анализа?
Если речь идет о наследственных мутациях, для анализа достаточно сдать кровь из вены. Для составления «молекулярно-генетического портрета» рака чаще всего нужен биоптат — образец ткани злокачественной опухоли. Существует и более современная методика — жидкостная биопсия, когда исследуют ДНК опухолевых клеток, циркулирующую в крови. [8]
Насколько достоверны результаты?
Точность обнаружения мутаций с помощью современных генетических исследований составляет почти 95%.
Что может повлиять на точность результата?
Для того чтобы анализ показал достоверный результат, врач-онколог должен правильно провести биопсию, соблюдать технику фиксации (специальной обработки) ткани. Организация, которая отправляет материал в лабораторию, должна соблюдать правила транспортировки. В противном случае провести исследование не получится.

Расшифровка анализа
Если анализ на наследственные мутации показал отрицательный результат, это значит, что у человека нет генетических дефектов, повышающих риск развития тех или иных злокачественных опухолей. Но это не значит, что он никогда не заболеет раком. Просто его риски несколько ниже. Аналогично положительный результат не говорит о том, что у пациента обязательно будет диагностировано онкологическое заболевание. У него повышены риски, и, возможно, потребуются некоторые профилактические мероприятия.
Иногда результат исследования на наследственные мутации сомнителен. В таких случаях многие онкологи и клинические генетики предпочитают считать, что риск рака всё же повышен, и рекомендуют некоторые меры профилактики. В ряде случаев ситуацию помогают прояснить анализы близких родственников.
Иногда обнаруживают неизвестные изменения в генах. Непонятно, то ли это вариант нормы, то ли нейтральная мутация, то ли она повышает риск рака.
Если анализ проводится у онкологического пациента для подбора эффективного лечения, лаборатория высылает лечащему врачу отчет, в котором указывает:
- обнаруженные мутации;
- список научных публикаций, в которых эти мутации фигурируют;
- препараты, одобренные для лечения рака с такими генетическими дефектами;
- препараты, которые в настоящее время не одобрены для лечения данного типа рака, но успешно применяются для борьбы с другими злокачественными опухолями с аналогичными мутациями.
На основе этой информации онколог принимает решение по поводу дальнейшего лечения. [6,8]
Генетические исследования на рак в «Евроонко»
Мы знаем, как помочь, если в другой клинике сказали, что больше ничего нельзя сделать, или лечение, назначенное ранее, перестало помогать. Свяжитесь с нами.
Мутации при раке
Тело человека состоит примерно из 37 триллионов клеток. Информация о строении и функциях каждой из них закодирована в ДНК. Любая злокачественная опухоль является результатом нарушения работы тех или иных генов, а главная причина этого кроется в мутациях. Некоторые из них человек получает с рождения, и они присутствуют во всех клетках тела. А некоторые возникают уже в течение жизни под влиянием тех или иных факторов — эти мутации будут обнаруживаться только в потомках той клетки, в которой изначально возникла «поломка».
На этой странице мы собрали всю информацию о генетических нарушениях, связанных с онкологическими заболеваниями, представленную на нашем сайте.

Как часто в клетках тела человека происходят мутации?
Мутагенез — процесс непрерывный. Он происходит на всех этапах развития любого организма: в половых клетках, с самых первых дней существования эмбриона и на протяжении всей жизни. К счастью, далеко не все мутации вредны. Многие из них нейтральные (то есть не приносят ни вреда, ни пользы), а некоторые даже дают организму определенные преимущества.
Мутации — это главный двигатель эволюции живых организмов. В 2018 году были опубликованы результаты исследования, во время которого ученые обнаружили, что у 20-летних людей на одну клетку слизистой оболочки пищевода в среднем приходится по 100 мутаций, а у людей более старшего возраста — по 2000. Большинство из них не опасны, но некоторые затрагивают онкогены.
Чаще всего рак связан именно с соматическими, приобретенными, мутациями. Согласно современным представлениям, наследственные мутации ответственны за развитие лишь 5-10% онкопатологий. А по результатам исследования, опубликованного в 2020 году, наследственные мутации, связанные с раком, встречаются у каждого восьмого онкологического больного.
Почему мутации приводят к онкологическим заболеваниям?
Конечно же, далеко не все мутации и далеко не во всех генах приводят к развитию онкологических заболеваний. Чтобы нормальная клетка стала злокачественной, нарушения должны произойти в определенных генах:
Протоонкогены
Это гены, которые в результате мутаций способны превращаться в онкогены. В свою очередь, онкогены — это дефектные гены, которые способствуют развитию злокачественной опухоли, например, путем бесконтрольного размножения клеток. Характерный пример — EGFR.
Гены-супрессоры опухолевого роста
В норме они «сдерживают» клетки и не дают им стать злокачественными. Когда в этих генах возникают мутации, они перестают выполнять свои функции. Например, к этой категории относится ген TP53, кодирующий белок p53.
Гены репарации ДНК
Чаще всего их относят к генам-супрессорам опухолевого роста, но иногда выделяют в отдельную группу. Белки, кодируемые этими генами, исправляют «ошибки», возникающие в ДНК. Например, продукты генов BRCA1 и BRCA2 восстанавливают двухцепочечные разрывы в ДНК путем гомологичной рекомбинации — процесса, при котором поврежденная хромосома использует свою «сестру-близнеца» в качестве шаблона для репарации. Когда эти гены перестают правильно работать из-за мутаций, ДНК не может нормально восстанавливаться, и в ней накапливается еще больше повреждений.

Что способствует развитию мутаций, которые приводят к раку?
Мутации, связанные с онкозаболеваниями, бывают двух основных видов. Наследственные мутации происходят в половых клетках, и затем они будут присутствовать во всех клетках тела ребенка. Соматические мутации присутствуют только в клетках, в которых они изначально возникли, и в их потомках — например, только в злокачественной опухоли.
Обычно, чтобы нормальная клетка превратилась в злокачественную, в ней должен возникнуть целый набор мутаций. В каждом конкретном случае невозможно точно сказать, что именно послужило причиной. Скорее всего, единой причины и нет. На организм человека постоянно действует множество факторов, и многие из них могут способствовать поломкам в генах.
Вот список некоторых распространенных факторов риска, способствующих развитию рака:
Некоторые инфекции, например, ВПЧ
Неблагоприятная экологическая ситуация, воздействие вредных веществ на работе
Пол — многие онкологические заболевания чаще встречаются у мужчин или женщин
Семейный анамнез: рак у близких родственников
Большое количество красного и обработанного мяса (говядина, свинина, баранина, фастфуд, сосиски и колбасы, бекон и пр.)
Распространенные мутации при раке
Мутации в гене EGFR — белка-рецептора эпидермального фактора роста, который находится на поверхности клеток и активирует их размножение
T790M — один из вариантов мутации в гене EGFR
Мутации в гене ROS1 — белка, который встроен в клеточную мембрану и передает сигналы, играющие роль в росте и дифференцировке клеток
Мутации в гене BRAF. Белок, который он кодирует, участвует в регуляции делений клеток путем активации специфического сигнального пути.
Слияние генов с участием NTRK — когда из двух генов получается “неправильный”, гибридный. Гены NTRK кодируют белки Trk, которые выполняют разные функции, в том числе защищают клетки от апоптоза.
Мутации в гене ALK — белка, встроенного в клеточную мембрану, который передает сигналы, связанные с ростом, миграцией клеток, образованием новых кровеносных сосудов
Мутации в генах BRCA — белков, которые помогают восстанавливать ДНК, когда в обеих ее цепочках происходят разрывы
Мутации в генах RAS — белков, которые передают сигналы внутри клеток и регулируют клеточные деления. Семейство RAS включает три гена: KRAS, NRAS и HRAS.
Мутации в PIK3CA — гене, который кодирует белок PI3K, участвующий в регуляции важных процессов в клетках
Мутации в HRR — группе генов, продукты которых участвуют в репарации ДНК при двухцепочечных разрывах
Мутации в TP53 — гене, кодирующем белок p53, «страж генома», который останавливает размножение клеток с поврежденной ДНК и «приказывает» им совершить «самоубийство».
Результатом некоторых мутаций может стать микросателлитная нестабильность — состояние, при котором нарушается восстановление ДНК, и она приобретает повышенную склонность к мутациям.
Почему важно изучать мутации при онкологических заболеваниях?
Для врачей-онкологов важно знать, какие мутации произошли в раковых клетках у конкретного пациента. Это помогает решать важные задачи:
- судить о степени агрессивности рака, выстраивать прогноз;
- определять тип, подтип некоторых злокачественных опухолей;
- подбирать наиболее эффективные противоопухолевые препараты;
- назначать персонализированную терапию при запущенном раке, когда не помогают стандартные схемы лечения из протоколов.
Выявление мутаций, связанных с раком, у здоровых людей помогает оценивать риск развития онкологического заболевания, проводить профилактику и решать, кому назначать дополнительные скрининговые исследования.
А ученым знания о мутациях в опухолевых клетках помогают создавать новые лекарства.


Как определяют мутации при раке?
В федеральной сети клиник экспертной онкологии «Евроонко» доступны все современные исследования для выявления мутаций при раке:
Что такое эпигенетические изменения, и какую роль они играют в онкологии?
Не меньшую (а может быть, даже и более важную) роль, чем мутации, в развитии рака играют эпигенетические изменения. Этим термином называют такие модификации, которые не меняют последовательность генетического кода, но влияют на активность генов.
Чаще всего встречаются две разновидности эпигенетических изменений (но есть и другие):
- Метилирование ДНК — присоединение к ее определенным участкам метильных групп. Чаще всего они заставляют «молчать» определенные гены. В норме у человека метилирован 1% всего генома. В некоторых раковых клетках этот показатель ниже. За счет этого в них могут «включаться» онкогены.
- Модификации гистонов. ДНК организована таким образом, что напоминает бусы — эта структура называется нуклеосомой. В качестве бусинок выступают особые белки — гистоны. Они обмотаны нитями ДНК и влияют на активность генов. Даже небольшие изменения в гистонах могут сильно повлиять на регуляцию работы генов, заставить некоторые из них «замолчать» или, напротив, активировать.

Эпигенетика — очень интересная наука. Возможно, со временем она поможет ученым создать еще больше эффективных препаратов для лечения рака.

Почему у многих курильщиков не развивается рак легких? 20 апреля 2022

С возрастом у людей накапливается много мутаций, способных привес. 27 декабря 2021
Как родинка превращается в меланому? 08 декабря 2021
Лечение пациентов проводится в соответствии со стандартами и рекомендациями наиболее авторитетных онкологических сообществ. «Евроонко» является партнёром Фонда борьбы с раком. ВНИМАНИЮ ПАЦИЕНТОВ: Рекомендации по лечению даются только после консультации у специалиста. Ваши персональные данные обрабатываются на сайте в целях его корректного функционирования. Если вы не согласны с обработкой ваших персональных данных, просим вас покинуть сайт. Оставаясь на сайте, вы даёте согласие на обработку ваших персональных данных.
Сведения и материалы, размещенные на сайте , подготовлены исключительно в информационных целях и не являются медицинской консультацией или заключением. Авторы информационных материалов сайта не могут гарантировать применимость такой информации для целей третьих лиц и не несут ответственности за решения третьих лиц и связанные с ними возможные прямые или косвенные потери и/или ущерб, возникшие в результате использования информации или какой-либо ее части, содержащейся на сайте.
Мутации в генах BRCA
Аббревиатурой BRCA обозначают два гена — BRCA1 и BRCA2. С английского языка их название переводится как «ген рака молочной железы» (BReast CAncer gene).
Несмотря на такое название, гены BRCA1 и BRCA2 сами по себе не приводят к раку. Они есть в клетках любого здорового человека и выполняют важные функции. Риск злокачественной опухоли повышается, когда функция этих генов нарушается из-за мутаций.
В норме белки, которые кодируют эти гены, нужны, чтобы восстанавливать поврежденную ДНК. Если в них возникают дефекты, то эта функция нарушается, поврежденная ДНК не восстанавливается должным образом, в клетке накапливаются генетические поломки, и она может превратиться в раковую.
По статистике, мутации в генах BRCA1 и BRCA2 встречаются у одного из 300-800 людей. У носителей повышен риск рака молочной железы, яичников, фаллопиевых труб, брюшины, предстательной железы, поджелудочной железы, желудка, желчного пузыря и желчных протоков, меланомы. Если человек наследует некоторые мутации от обоих родителей, у него развивается анемия Фанкони, повышается риск развития некоторых злокачественных опухолей и острого миелоидного лейкоза.
Какие функции выполняют гены BRCA1 и BRCA2 в норме?
Гены BRCA1 и BRCA2 находятся в разных хромосомах — соответственно в длинном плече (q) хромосомы 17 в положении 21.31 и в длинном плече (q) хромосомы 13 в положении 13.1. Но они выполняют схожие функции.

Оба белка, которые кодируются этими генами, устраняют двунитевые разрывы ДНК посредством гомологичной рекомбинации. Все хромосомы в клетках человека парные. Когда в одной из хромосом повреждены обе нити ДНК, сестринская хромосома «жертвует» ей одну цепочку аналогичного фрагмента своей ДНК, и по ней, как по шаблону, восстанавливается вторая цепочка.
Гены BRCA играют важную роль в этом процессе. Они являются генами-супрессорами опухолей. Если в них происходят мутации, геном становится нестабильным. Из-за накопившихся генетических дефектов нормальная клетка превращается в опухолевую и дает начало злокачественному новообразованию.
Как происходит мутация, и чем это грозит?
Все мутации в генах делят на две большие группы:
- Наследственные (герминальные) человек получает от родителей. Например, если у матери или у отца есть дефект в гене BRCA1 или BRCA2, ребенок получит его с вероятностью 50%, и он будет присутствовать во всех клетках тела. Мутация BRCA наследуется по аутосомно-доминантному типу, то есть достаточно, чтобы она присутствовала только в одной из парных хромосом. Даже если второй ген будет нормальным, функция белка нарушается, и это грозит повышенным риском рака.
- Соматические мутации возникают в течение жизни, например, из-за воздействия на организм ионизирующих излучений, химических канцерогенов. В этом случае генетический дефект возникнет только в некоторых клетках. И это тоже может привести к раку.
На данный момент известно множество разных видов мутаций в генах BRCA. Это могут быть делеции (потеря участка хромосомы), инсерции (лишние вставки в ДНК), однонуклеотидные полиморфизмы (замена отдельных «букв» генетического кода).
Насколько сильно повышается риск рака?
Рак молочной железы — самая распространенная «женская» злокачественная опухоль. По данным экспертов из США, это заболевание будет диагностировано в течение жизни у каждой восьмой женщины. У мужчин такая опухоль тоже может возникнуть, но риск намного ниже — 0,1% в течение жизни. При нарушенной функции генов BRCA риски существенно повышены.
При мутациях в BRCA1:
- Риск развития рака молочной железы у женщин к 70 годам: 44-78%.
- Риск развития рака молочной железы у мужчин к 70 годам: 0,22-2,8%.
При мутациях в BRCA2:
- Риск развития рака молочной железы у женщин к 70 годам: 31-56%.
- Риск развития рака молочной железы у мужчин к 70 годам: 3,2-12%.
Рак молочной железы, связанный с наследственными мутациями, составляет 5-10% от всех случаев. В 35% случаев за его развитие ответственны дефекты в гене BRCA1, в 25% случаев — в гене BRCA2.
Риск заболеть раком яичников в течение жизни для среднестатистической женщины составляет около 1,3%. При мутациях в гене BRCA1 он повышается до 18-54%, в гене BRCA2 — до 2,4-19%.
Кому нужно провериться на мутации BRCA?
Консультация клинического генетика и анализы на мутации в генах BRCA показаны в следующих случаях:
- Рак молочной железы у женщины выявлен в возрасте младше 50 лет.
- Злокачественные опухоли в обеих молочных железах. по данным иммуногистохимического исследования, на поверхности опухолевых клеток отсутствуют рецепторы к гормонам эстрогенам и прогестерону, белок-рецептор HER2.
- Медуллярный рак молочной железы — редкий гистологический тип опухоли, по статистике часто бывает связан с мутациями.
- Первично-множественные злокачественные новообразования (ПМЗН) — когда у пациента диагностируют сразу две или более разных злокачественных опухолей. Чаще всего речь идет о раке молочной железы и яичников.
- Рак яичников, маточных труб, поражение злокачественными клетками брюшины в любом возрасте.
- Рак молочной железы у мужчины.
- Мутации в генах BRCA1 и BRCA2 особенно распространены в этнической группе евреев ашкенази, им рекомендуется провериться, даже когда нет других факторов риска.
Также рекомендуется проверяться людям, у которых отягощен семейный анамнез: если рак молочной железы был диагностирован у близкой родственницы до 50 лет, рак яичников в любом возрасте, двусторонние опухоли в молочной железе, первично-множественные злокачественные опухоли, если рак молочной железы диагностирован в любом возрасте у двух близких родственниц, у родственника-мужчины.
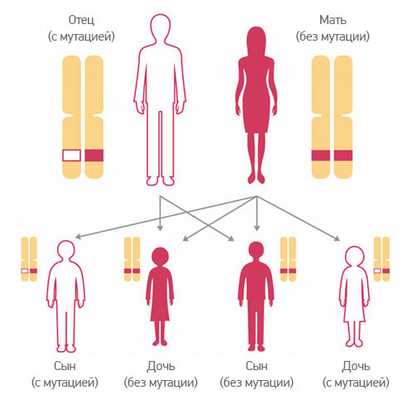
Наследование мутаций в генах BRCA. Розовым обозначены нормальные участки хромосом, белая — участок с мутацией. В данном случае носителем является отец, он передал «неправильный» ген одному из сыновей и одной из дочерей (50%). Двум другим детям (50%) достались нормальные гены. Источник
Если есть эти факторы риска, сначала логично проверить на мутации BRCA члена семьи, у которого был диагностирован рак. Затем проводят анализы на обнаруженные мутации у его близких родственников. Детям до 18 лет эти исследования не обязательны, потому что эффективных мер профилактики в детском возрасте не существует.
Зная о наличии мутации BRCA у онкологического больного, врач может назначить более эффективное лечение, правильно оценить прогноз. У здоровых людей эта информация помогает своевременно принять некоторые меры профилактики.
Как выявить мутации BRCA?
Мутации выявляют разными способами, наиболее современный — метод секвенирования следующего поколения (Next-Generation Sequencing, NGS). Он позволяет выявить максимум разных генетических дефектов. «Евроонко» сотрудничает с ведущими зарубежными лабораториями, которые проводят такие исследования.
Что означает результат?
Если из лаборатории пришел положительный результат, это означает, что в опухолевых клетках есть мутация BRCA.
Если результат отрицательный, это еще не означает, что гены в клетке работают абсолютно нормально. Во-первых, мутации BRCA бывают очень разными. Большинство из них можно выявить, но некоторые редкие не изучены, и анализы их не обнаруживают. Во-вторых, даже если гены BRCA1 и BRCA2 имеют нормальную структуру, мутации, способствующие развитию рака, могут быть в других генах. Многие из них также можно обнаружить с помощью метода NGS.
Иногда результат бывает неопределенным. Это означает, что обнаружена некая мутация, но нет доказательств, что она повышает риск рака.
Если результат анализа на мутации BRCA отрицательный, но есть факторы, явно указывающие на то, что рак может быть наследственным, нужно снова проконсультироваться с клиническим генетиком. Врач решит, что делать дальше.
Что делать, если обнаружен генетический дефект? Можно ли снизить риск рака?
Женщины, у которых обнаружены мутации в генах BRCA1 и BRCA2, нуждаются в более тщательном наблюдении. Девушка должна уметь проводить самообследование молочной железы и с 18 лет делать это раз в месяц. С 25 лет рекомендуется ежегодно являться на осмотры к маммологу.
Кроме того, эксперты рекомендуют с 25 до 30 лет ежегодно проходить МРТ молочных желез, если ее невозможно выполнять — маммографию. С 30 лет показаны ежегодные маммографии и МРТ с контрастом.
Чтобы снизить риски, врач может предложить одну из двух мер:
- Профилактическое лечение тамоксифеном — гормональным препаратом, который блокирует эффекты эстрогенов.
- Профилактическое удаление молочных желез и/или яичников. После двусторонней мастэктомии риск рака молочной железы снижается на 90-95%.
Как лечат рак молочной железы с мутациями BRCA?
Наличие этих мутаций влияет на прогноз и выбор тактики лечения. У таких женщин повышен риск возникновения второй злокачественной опухоли в той же или другой молочной железе, поэтому зачастую хирурги рекомендуют двустороннюю мастэктомию, в то время как у пациентки без мутаций можно было бы обойтись органосохраняющей операцией.
Опухоли молочной железы с дефектами в генах BRCA1 и BRCA2 часто являются тройными негативными, то есть у них отсутствуют рецепторы к гормонам эстрогенам и прогестерону, белок-рецептор HER2. Такой рак сложнее лечить, против него неэффективны гормональные и некоторые таргетные препараты. Прогноз менее благоприятный.
Так как гены BRCA участвуют в репарации ДНК, то раковые клетки, в которых их функция нарушена, более чувствительны к химиопрепаратам, повреждающим ДНК, таким как цисплатин. Если опухолевые клетки имеют рецепторы к половым гормонам, они чувствительны к химиопрепаратам из группы таксанов.
Рост опухоли могут остановить ингибиторы PARP — препараты, которые нарушают восстановление поврежденной ДНК. В результате в раковых клетках накапливается еще больше мутаций, что и приводит к их гибели. К этой группе относятся препараты олапариб (Линпарза), рукапариб (Рубрака).
В «Евроонко» применяются наиболее современные анализы для выявления мутаций в генах BRCA1 и BRCA2, проводится лечение злокачественных опухолей в соответствии с современными международными протоколами. Мы знаем, как бороться с раком в сложных случаях. У нашего онколога вы можете получить консультацию, узнать о ваших рисках и о том, какие виды скрининга рекомендуется регулярно проходить в вашем случае.
Читайте также:
