Нарушение клеточного цикла как причина рака
Добавил пользователь Дмитрий К. Обновлено: 21.01.2026
Многие факторы вовлечены в процесс возникновения нерегулируемой пролиферации клеток, возникающей при раке.
Клеточная кинетика
Время деления - время, необходимое клетке для совершения полного цикла клеточного деления (см. рисунок Клеточный цикл [The cell cycle] Клеточный цикл ) и для появления 2 дочерних клеток. Раковые клетки, в особенности происходящие из красного костного мозга или лимфатической системы, обычно имеют более короткий жизненный цикл, и, как правило, меньшее количество клеток находится в фазе G0 (фазе покоя). За начальным экспоненциальным ростом опухоли следует фаза плато, где смертность клеток и образование дочерних клеток находятся примерно на одном уровне. Замедление роста клеток может быть связано с истощением запасов питательных веществ и кислорода в быстрорастущей опухоли. В мелких опухолях доля активно делящихся клеток гораздо выше, чем в опухолях больших размеров.
Субпопуляция клеток в новообразовании часто имеет свойства стволовых клеток. Таким образом, эти клетки способны переходить в стадию пролиферации. Они также менее восприимчивы к воздействию противоопухолевых препаратов и лучевой терапии. Предполагается, что именно они ответственны за рост раковых опухолей после химиотерапиии и/или лучевой терапии.
Клеточная кинетика отдельных видов рака является важным фактором при разработке режимов назначения антинеопластических препаратов и может влиять на схемы дозирования и временные интервалы приема медикаментов. Многие противоопухолевые препараты, например, антиметаболиты, наиболее эффективны, при активном делении клеток. Некоторые препараты действуют только в определенной фазе клеточного цикла, требуя длительного назначения, чтобы поймать клетки в фазу наибольшей чувствительности.
Клеточный цикл
G0 = фаза покоя (отсутствие деления клеток); G1 = фаза начального роста (от 12 часов до нескольких дней); S = Синтез ДНК (обычно от 2 до 4 часов); G2 = подготовка клетки к митозу (от 2 до 4 часов) - в клетках имеется удвоенное количество ДНК ; M1 = митоз (от 1 до 2 ч).
Рост раковой опухоли и метастазирование
По мере роста рака, питательные вещества поступают к нему путем прямой диффузии из кровотока. Местный рост обеспечивается ферментами (например, протеазами), которые уничтожают прилежащие ткани. По мере увеличения объема раковая опухоль может выделять факторы ангиогенеза, такие как фактор роста эндотелия сосудов (VEGF), которые способствуют формированию новых кровеносных сосудов, необходимых для дальнейшего роста.
Раковая опухоль может высвобождать клетки в кровоток на очень ранней стадии развития. В моделях на животных опухоль размером 1 см в среднем выбрасывает > 1 млн клеток/24 часа в венозное русло. Циркулирующие раковые клетки обнаруживаются у многих пациентов с поздними стадиями рака и в некоторых случаях даже при отсутствии распространения опухоли. Хотя большинство циркулирующих раковых клеток погибают, отдельные клетки могут проникать в ткани, вызывая метастазы в отдаленных местах. Метастазы растут по тому же принципу, что и первичные раковые опухоли, и в последствии могут порождать другие метастазы. Большинство пациентов с раком умирают от метастазов, а не от первичного рака.
Эксперименты показывают, что к важнейшим особенностям клеток относятся способности к инвазии, миграции, успешной имплантации и стимуляции роста новых кровеносных сосудов, что, вероятно, отражает особенности отдельного клона клеток в первичной опухоли.
Иммунная система и рак
Раковые клетки часто имеют на своей клеточной поверхности опухолевые антигены (неоантигены), которые могут быть распознаны иммунной системой как "чужие", что приводит к иммунной атаке. Если иммунная атака эффективна, рак может никогда не развиться. При полном уничтожении злокачественных клеток рак никогда не возникнет. Однако некоторые раковые клетки обладают способностью (или приобретают ее) избегать обнаружения и/или разрушения иммунной системой, что позволяет им размножаться.
Остается непонятным, почему люди с врожденным или приобретенным иммунодефицитом Первичные иммунодефициты Иммунодефицитные состояния связаны или предрасполагают пациентов к осложнениям различного рода, в том числе к инфекциям, аутоиммунным нарушениям, лимфомам и другим онкозаболеваниям. Первичные. Прочитайте дополнительные сведения имеют повышенный риск возникновения только некоторых малораспространенных типов раковых заболеваний (таких как меланома, почечно-клеточный рак, лимфома), а не более распространенных видов рака легких, молочной железы, простаты, толстой кишки. При эффективной работе иммунной системы большинство злокачественных опухолей вызываются вирусами.
Под селективным (например, эволюционного отбора) давлением раковые клетки могут экспрессировать белки контрольных точек. Белки контрольных точек - это молекулы клеточной оболочки, которые оповещают Т-клетки о том, что клетка, на которой они находятся, нормальна и не должна подвергаться атаке. Примером является лиганд запрограммированной смерти 1 (PD-L1), белок, который распознается молекулой PD-1 на Т-лимфоцитах; когда PD-L1 связывается с PD-1 на поверхности Т-лимфоцитов, иммунная атака предотварщается. Лечение рака с использованием моноклональных антител, известных как ингибиторы контрольных точек, блокирующих PD-L1 или PD-1, позволяет иммунной системе атаковать защищенные раковые клетки. Антиген 4 цитотоксических Т-лимфоцитов (CTLA-4) - это еще один белок контрольной точки, предотвращающий атаку иммунной системы, который может аналогичным образом блокироваться специфическим антителом. Поскольку белки контрольной точки могут присутствовать и в нормальных клетках, терапия с использованием ингибиторов контрольной точки может индуцировать аутоиммунный ответ.
Генетически модифицированные Т-клетки (известные, как Т-клетки с химерными рецепторами антигена [CAR-T]) также могут быть использованы в иммунотерапии. Во время данного процесса Т-клетки забираются у пациента и генетически модифицируются для экспрессии рецепторов, содержащих домен распознавания специфического антигена, связанного с внутриклеточными сигнальными доменами, которые активируют Т-клетку. После реинфузии модифицированные Т-клетки могут атаковать клетки, несущие этот антиген-мишень. Как правило, таргетный антиген является линиеспецифическим, но не онкоспецифичным. CAR-T-клеточная терапия наиболее эффективна против В-клеточных раковых заболеваний, таких как В-клеточный острый лимфобластный лейкоз Острый лимфобластный лейкоз (ОЛЛ) Острый лимфобластный лейкоз (ОЛЛ) является наиболее частым онкологическим заболеванием у детей, но поражает также и взрослых всех возрастов. Злокачественная трансформация и неконтролируемая. Прочитайте дополнительные сведения и плазмоклеточная миелома Множественная миелома Множественная миелома является злокачественной плазмоклеточной опухолью, продуцирующей моноклональные иммуноглобулины, которые внедряются в прилежащую костную ткань и разрушают ее. К характерным. Прочитайте дополнительные сведенияМолекулярные нарушения
Причиной появления злокачественных клеток являются генетические мутации, и поэтому они имеют место при всех видах рака. Они изменяют количество или функцию белковых структур, которые регулируют рост и деление клеток, а также репарацию ДНК. Две большие группы мутировавших генов:
Нарушение клеточного цикла как причина рака
Чубенко Вячеслав Андреевич
Заведующий отделением химиотерапии Санкт-Петербургского клинического научно-практического центра специализированных видов медицинской помощи (онкологического),
кандидат медицинских наук, Санкт-Петербург
Моисеенко Владимир Михайлович
Директор ГБУЗ «Санкт-Петербургский клинический научно-практический центр специализированных видов медицинской помощи (онкологический)», Заслуженный врач РФ, Лауреат премии Правительства РФ, Председатель регионального отделения RUSSCO, главный редактор Практических рекомендаций RUSSCO, член-корреспондент РАН, профессор, доктор медицинских наук, Санкт-Петербург
Одним из признаков злокачественной опухоли является изменение метаболических свойств клеток [1]. К ним относятся:
- нарушение регуляции утилизации глюкозы и аминокислот,
- активация «новых» способов получения питательных веществ,
- использование промежуточных продуктов гликолиза и цикла трикарбоновых кислот для биосинтеза никотинамидадениндинуклеотида фосфата (НАДФ),
- повышенная потребность в азоте,
- изменения в регуляции генов метаболизма,
- метаболические взаимодействия с микроокружением [2].
Особенностью является выраженная гетерогенность энергетического гомеостаза опухолевых клеток вследствие огромного числа причин, в том числе:
- молекулярного фенотипа (KRAS-мутация; Her2/neu гиперэкспрессия; EGFR-мутация; BRCA-мутация и др.),
- стадии опухолевого процесса,
- локализации первичной опухоли или метастаза,
- размера опухоли,
- этапа клеточного цикла (S-фаза, M-фаза, G0, ),
- условий микроокружения [3].
Более 100 лет прошло с тех пор, как Отто Варбург провел первые экспериментальные исследования метаболизма в опухолевых клетках, 74 года с момента внедрения Сидни Фарбер антифолатов в лечение лейкоза и 20 лет изучения взаимосвязи онкогенов и способов потребления энергии [4]. Однако, к сожалению, на сегодняшний день подобные аспекты не учитываются при планировании лекарственной терапии. Кроме того, без внимания остаются метаболические особенности клеток микроокружения (например, фибробластов) и иммунной системы, которые играют ключевую роль в инициации опухоли и ее прогрессии. Безусловно, терапевтические воздействия на ключевые метаболические мишени как в опухолевых клетках, так и в ее микроокружении, могут быть перспективной стратегией с точки зрения влияния на контроль злокачественного роста и продолжительность жизни больных. К ним относятся:
- исключение важнейших метаболитов,
- голодание и ограничение калорий, кетодиета,
- физические нагрузки,
- ингибирование отдельных этапов метаболизма,
- использование метаболических особенностей опухолей как «ахиллесову пяту»,
- перегрузка клеток глюкозой,
- борьба с закислением микроокружения,
- потенцирование эффективности стандартной терапии.
Исключение важнейших метаболитов
Впервые в 1988 году Prager M. и Baechtel F. продемонстрировали зависимость роста клеток рака почки от наличия в среде аспарагиназы [5]. Данный фермент гидролизует основные энергетические субстраты светлоклеточного рака, такие как аспарагин и глутамин (около 2-3%). К 6 дню эксперимента лишь 6% злокачественных клеток оставались жизнеспособными по сравнению с 66% в обычных условиях. На сегодняшний день аспарагиназа входит в стандарты лечения острого лимфобластного лейкоза у детей [6]. Интересно отметить, что эффективность подобного лечения коррелирует с экспрессией аспарагин синтетазы в злокачественных клетках. Li H. с соавторами протестировали 225 метаболитов в 928 клеточных линиях 20 типов опухолей [7]. Оказалось, что в случае снижения функции данного фермента в различных видах опухолей (чаще при раке желудка и печени) отмечалось значительное подавление опухолевого роста. Эти результаты позволяют предположить, что лечение аспарагиназой в случае наличия предиктивного маркера (отсутствие фермента или его гиперметилирование) может рассматриваться как перспективный метод метаболической терапии различных солидных опухолей [7].
Голодание и ограничение калорий, кетодиета
Ограничение калорий, изменение характера питания и различные диетические подходы зарекомендовали себя в лечении различных заболеваний, в том числе трудноизлечимой эпилепсии у детей, сахарного диабета 2 типа, ожирения, дисбактериоза. В исследовании II фазы (DIRECT) продемонстрирована эффективность голод-имитирующей диеты у больных ранним раком молочной железы на фоне неоадъювантной химиотерапии по сравнению с обычным режимом питания [8]. При этом оценивался как клинический ответ, так и влияние на качество жизни (восприятие болезни, переносимость химиотерапии). Голод-имитирующая диета включала в себя растительную пищу с низким содержанием аминокислот. Она представляла собой суп, бульон, витамины и чай в течение 3-х дней до цикла химиотерапии и в день цитостатического лечения. При этом калорийность рациона снижалась с первого (~1200 ккал) до 2-4 дня (~200 ккал). В итоге у больных на фоне депривации основных энергетических субстратов была более выражена стрессоустойчивость и лучшая переносимость проводимой химиотерапии. Кроме того, согласно опросникам по качеству жизни, у них нарастали показатели эмоционального, физического, ролевого, когнитивного и социального функционирования. При этом снижались параметры усталости, тошноты и бессонницы [8]. Таким образом, подобный подход может быть рассмотрен как дополнительная опция к проводимой стандартной терапии.
Кетогенная диета (КД) - это режим питания с высоким содержанием жиров, несколько ограниченным потреблением белков и очень низким содержанием углеводов, который имитирует метаболизм в состоянии голодания, вызывая выработку кетоновых тел [9]. Соотношение основных нутриентов представлено в таблице 1.
Таблица 1. Характеристика кетогенной диеты.
| Нутриент | Стандартная диета (%) | Кетогенная диета (%) |
|---|---|---|
| Углеводы | 62 | 3 |
| Жиры | 6 | 72 |
| Белки | 27 | 15 |
| Энергетический состав (ккал/гр) | 4,4 | 7,2 |
| Жиры/ углеводы + белки | 0,07 | 4 |
Особенностью КД, в отличие от голодания, является сохранение калорий, необходимых для энергетического метаболизма клеток. В норме образование кетоновых тел происходит в печени за счет продукции ацетил кофермента А (ацетил-коА) и окисления жирных кислот. Кетогенез контролируется инсулином и глюкагоном. Зачем нужны кетоновые тела? Они являются альтернативным источником энергии для клеток головного мозга, поперечнополосатой и сердечной мускулатуры, однако не могут использоваться раковыми клетками.
Как известно, основным источником энергии для опухоли является глюкоза. Для того, чтобы поддерживать высокий пролиферативный потенциал в злокачественных клетках, активирован гликолиз даже в присутствии кислорода (эффект Варбурга). Таким образом, терапевтический подход в депривации основного нутриента может быть эффективным с точки зрения торможения их роста. В случае КД опухолевые клетки имеют ограниченный доступ к глюкозе и не могут использовать кетоновые тела для производства энергии в связи с измененной функцией митохондрий, а также снижением ферментативной активности потребления кетонов [9].
Положительным аспектом КД является возможность потенцировать эффект химиотерапии или лучевой терапии, например, при раке легкого или нейробластоме [9]. Кроме того, наблюдается синергизм при применении ингибиторов контрольных точек [9]. В экспериментальных работах было показано, что 3-β-гидроксибутират подавляет экспрессию PD-L1 в миелоидных клетках, увеличивая число CXCR3+ Т-клеток и экспрессию интерферона 1. Ключевым механизмом является активация AMPK, которая фосфорилирует PD-L1, что приводит к его последующей деградации [9].
Что касается клинических результатов, то в рандомизированном исследовании применения КД у больных раком молочной железы, получающих стандартную химиотерапию, было отмечено значительное снижение фактора некроза опухоли α (ФНО-α) после 12 недель терапии (р<0,001), повышение интерлейкина-10 (ИЛ-10) (р<0,001), снижение уровня инсулина (р<0,002), а также уменьшение размеров опухоли и снижение стадии процесса при местнораспространенном новообразовании по сравнению с контрольной группой (27 и 6 мм, р=0,01) [10].
Эпидемиологические исследования демонстрируют снижение риска развития около 13 видов злокачественных опухолей на фоне физической активности [11]. Очевидно, что в основе этого эффекта лежит перепрограммирование метаболических процессов в организме в целом. При этом предклинические исследования на грызунах показывают, что бег на колесе, на беговой дорожке или плавание снижают частоту возникновения опухолей, их рост и метастазирование независимо от выбранной модели (перевиваемые или индуцированные) [11]. С чем это может быть связано? Физические упражнения изменяют возможные регуляторные механизмы роста злокачественных опухолей, что неизбежно сопровождается выраженными метаболическими изменениями. К ним относятся: изменение кровотока, регуляция pH, активация симпатической нервной системы, гипертермия, изменение концентрации половых гормонов и гормонов стресса (инсулин, лептин, глюкокортикоиды, катехоламины), изменение уровня циркулирующих экзосом, цитокинов и миокинов, а также факторов роста, деактивация сигнальных путей (HIPPO/YAP или Akt/mTOR), повышение активности иммунной системы за счет эпинефрин-зависимой стимуляции (ИФН1, NK-клетки), снижение функции опухолевой лактатдегидрогеназы (ЛДГ) и, тем самым, подавление секреции лактата в микроокружении [11].
В недавно опубликованном клиническом исследовании влияния физической нагрузки на эффективность неоадъювантной химиотерапии у больных раком пищевода было установлено значительное уменьшение объема опухоли по сравнению с контрольной группой: TRG 1-3 n=15/20 (75%) и n=7/19 (36,8%), p=0,025, соответственно. При этом было отмечено сокращение размеров региональных лимфатических узлов (42,9% и 15,8%, р=0,089, соответственно) и изменение иммунологических показателей (CD3, CD8, ИЛ-6, VEGF, ИФН1, ФНО-α) [11].
Ингибирование отдельных этапов метаболизма
Важным аспектом, с учетом гетерогенности опухолевого метаболизма, является поиск предиктивных маркеров перед назначением препаратов, влияющих на отдельные этапы энергетического гомеостаза. Например, к ним относятся:
Использование метаболических особенностей опухолей как «ахиллесову пяту» (витамин С и ферроптоз)
Ферроптоз - это один из сравнительно недавно открытых (в 2012 г.) механизмов клеточной гибели. В отличие от некроза, апоптоза, пироптоза или аутофагии, он обусловлен накоплением в клетке свободных радикалов (активных форм кислорода) из-за железо-опосредованного перекисного окисления липидов [13]. Считается, что опухолевые клетки в большей степени подвержены ферроптозу в связи с их выраженной пролиферативной и метаболической активностью. Данное обстоятельство делает подобный механизм клеточной гибели перспективной терапевтической мишенью.
Витамин С является незаменимым микроэлементом благодаря множеству функций, которые он выполняет в организме. Его «незаменимость» у человека определяется отсутствием фермента гулонолактон оксидазы, необходимого для синтеза витамина С в связи с окислением глюкозы. Витамин С в организме является кофактором гидроксилирования пролина и лизина, необходимых для синтеза коллагена типа 1. Кроме того, его стандартные дозы являются компонентом антиоксидантной защиты [14].
Одно из первых рандомизированных исследований, в котором оценивалась эффективность витамина С у больных злокачественными опухолями, было проведено Creagan E. с соавторами в 1979 г. Значимых различий с точки зрения общей выживаемости, лечебного эффекта и качества жизни достигнуто не было. Похожие данные были получены Moertel с соавторами у больных метастатическим колоректальным раком [14].
В последующих экспериментальных работах была предпринята попытка объяснить полученные негативные результаты. Оказалось, что основное терапевтическое значение имеет доза препарата и способ его введения. Предклинические и клинические исследования показали, что при внутривенном введении в высоких дозах витамин С оказывает противоопухолевое действие. Благодаря сложной фармакокинетике подобный эффект наблюдается при достижении его концентрации в плазме не менее 0,25 ммоль. Регуляция транспорта витамина С в опухолевую ткань осуществляется транспортерами (SVCT и GLUT), экспрессия которых зависит от типа клеток. Основным противоопухолевым механизмом действия витамина С является индукция образования свободных радикалов вследствие реакции Фентона. Важно отметить, что помимо общепризнанных прооксидантных эффектов, витамин С модулирует ферменты TET, способствующие деметилированию ДНК, и действует как кофактор гидроксилаз HIF, активность которых необходима для протеасомной деградации HIF-1α. Указанные особенности открывают новые возможности лечения опухолей со специфическими молекулярными дефектами (например, наличие KRAS-мутации, гиперэкспрессия HIF-1α или изменения TET2, IDH1/2 и WT1). Более того, действие витамина С на уровне ДНК может стать рациональной основой для комбинированной терапии с ингибиторами PARP и гипометилирующими агентами. На сегодняшний день растет число публикаций о клинической эффективности высоких доз витамина С [14]. В нашей клинической практике у пожилого больного с диссеминированным колоректальным раком (KRAS-мутация) при прогрессировании после 3-х линий лекарственной терапии было отмечено снижение биомаркера РЭА с 1661 до 188 нг/мл и торможение роста метастатических очагов на фоне внутрипеченочной инфузии высоких до витамина С при отсутствии клинически значимых побочных эффектов и субъективном улучшении общего состояния.
Перегрузка клетки глюкозой (гипертермия с перекислением)
Борьба с закислением микроокружения
Кислотность (pH) является одной из важнейших особенностей метаболизма опухолевой клетки. Обычно наблюдается внеклеточный ацидоз и внутриклеточный алкалоз или ощелачивание. Подобный градиент обеспечивает возможность пролиферации клеток, защиту от апоптоза, метаболическую адаптацию, миграцию и инвазивную способность клеток, активность микроокружения (иммунной системы и фибробластов). Безусловно, понимание механизмов pH-зависимого поведения клеток обеспечит развитие новой терапевтической стратегии опухолей [16].
В предклинических работах было показано, что у мышей на фоне приема бикарбоната натрия наблюдается меньшее число метастазов и увеличивается продолжительность жизни. Кроме того, алкализация микроокружения потенцирует эффект ингибиторов контрольных точек. Клинические исследования также подтверждают подобную гипотезу. У больных диссеминированным раком поджелудочной железы наблюдалось значительное увеличение продолжительности жизни на фоне приема бикарбоната по сравнению с контрольной группой (15,4 и 10,8 мес. соответственно; р<0,005) [16].
Потенцирование эффективности стандартной терапии
Оксид азота (NO) является стабильным свободным радикалом, который участвует во многих физиологических и патологических процессах в организме. В предклинических работах было показано, что NO повышает эффективность химио- и лучевой терапии, особенно в случае выраженной гипоксии в опухоли, за счет усиления кровотока и снижения потребления кислорода [17]. В качестве терапевтической стратегии было предложено введение доноров NO. Однако данный подход оказался весьма токсичным в связи с системной вазодилатацией и гипотензией, а также малоэффективным из-за замедления кровотока в опухоли, усугубления гипоксии и снижения pH. Альтернативой является стимуляция продукции NO за счет назначения L-аргинина как эндогенного субстрата фермента синтетазы оксида азота (NOS). Существует 3 изоформы данного белка. При этом в опухолевой ткани, как и при воспалении, и гипоксии, значение приобретает NOS2. Наибольшая экспрессия фермента наблюдается в клетках рака молочной железы, рака легкого, а также в церебральных метастазах. Назначение L-аргинина активно используется для лечения больных с эндотелиальной дисфункцией и генетической патологией митохондрий для улучшения микроциркуляции. При этом подобный подход нивелирует гемодинамические нарушения, которые обусловлены гиперпродукцией NO. В этой связи достаточно перспективным является применение L-аргинина в NOS-экспрессирующих опухолях в качестве сенсибилизатора к повреждению ДНК на фоне стандартной терапии в результате NO-индуцированного подавления метаболизма. В качестве доказательства подобной концепции было проведено исследование у 63 больных с метастатическим поражением головного мозга. Одна группа больных (n=31) получала 10 г L-аргинина внутрь за 1 час перед каждой фракцией облучения (1,6 Гр, 20 фракций, СОД 32 Гр). Другой группе (n=32) проводилось только облучение головного мозга. Объективный ответ составил 22% в группе контроля и 77,4% в группе L-аргинина (р<0,001) соответственно. При этом клинический эффект наблюдался у 93,5% больных по сравнению с контрольной группой (50%) [17].
Таким образом, метаболизм опухолевой клетки является сложным и пластичным процессом с выраженной гетерогенностью в зависимости от различных факторов. Безусловно, на сегодняшний день предпринимаются попытки поиска ключевых мишеней энергетического гомеостаза опухолевой клетки с целью терапевтического воздействия для увеличения продолжительности жизни больных. Без сомнения, подобное направление является перспективной стратегией лекарственной терапии злокачественных опухолей. Основными проблемами, которые требуют решения, являются:
Клеточная и молекулярная основа опухолевого роста
Раковые клетки
Раковые клетки (злокачественные, атипичные, опухолевые клетки) - это клетки, которые в результате мутаций изменили свой внешний вид и функции, перестали быть похожими на нормальные клетки в соответствующей ткани. Наиболее характерные свойства раковых клеток: «бессмертие», способность к бесконтрольному размножению и распространению в организме. Строго говоря, раковыми можно назвать только клетки злокачественных опухолей из эпителиальных тканей. По отношению к другим злокачественным новообразованиям термин «рак» не применяют.

Чем раковые клетки отличаются от нормальных?
Для того чтобы организм человека правильно работал как единое целое, каждая клетка в нем должна подчиняться общим правилам и обладать некоторыми основополагающими свойствами:
- находиться в отведенном ей месте: это обеспечивается за счет клеточной адгезии, то есть способности клеток «слипаться» между собой;
- размножаться только тогда, когда это необходимо;
- специализироваться на выполнении определенных функций: для этого каждая клетка сознательно себя ограничивает, активирует одни гены и «отключает» другие;
- «чинить» свою ДНК, если в ней произошли «поломки», мутации;
- совершить «самоубийство», если в ней произошли непоправимые патологические изменения, или если она «состарилась».
Во многом эти функции обеспечиваются за счет того, что клетки в организме постоянно «общаются» между собой и реагируют на определенные сигнальные молекулы. Раковая клетка эти сигналы игнорирует. Она начинает жить так, как будто она тут одна и не должна считаться с интересами соседей:
Не перестает размножаться. Сколько бы своих копий ни создала опухолевая клетка, она не останавится. Злокачественная опухоль постоянно растет и распространяется в организме.
Не слипается с соседними клетками. На поверхности «бунтарей» исчезают молекулы, которые удерживают их в нужном месте среди соседей. За счет этого раковая клетка может отрываться от первичной опухоли и путешествовать по организму. Во время этого путешествия она погибает или оседает в каком-нибудь органе, создает свои клоны и образует новый опухолевый очаг — метастаз.
Не специализируются. Раковая клетка не становится специализированной и не выполняет полезные для организма функции. Процесс клеточной специализации называется дифференцировкой. Чем ниже степень дифференцировки, тем агрессивнее ведет себя рак.
Не «ремонтируют» свою ДНК. В итоге в опухолевых клетках накапливается все больше мутаций, они становятся менее дифференцированными и быстрее размножаются. Они не подвержены апоптозу — запрограммированной клеточной смерти.
При предраковых состояниях клетки тоже теряют свойства нормальных. Но они отличаются и от раковых, в первую очередь тем, что не могут распространяться в организме.
Особая разновидность злокачественных опухолей — так называемый «рак на месте» (in situ). Клетки уже являются раковыми, но пока еще не распространились за пределы своей изначальной локализации. Технически карцинома in situ — не рак, но ее принято рассматривать как самую раннюю стадию рака.
Каковы причины появления раковых клеток?
Почему в теле конкретного человека возникли раковые клетки — вопрос во многом риторический.
Каждая живая клетка функционирует и размножается в соответствии с заложенной в ней генетической информацией. При возникновении определенных мутаций эти тонкие механизмы регуляции сбиваются, и может произойти злокачественное перерождение.
Сложно сказать, что именно привело к таким мутациям в каждом конкретном случае. Современным врачам и ученым известны лишь факторы риска, которые повышают вероятность злокачественного перерождения и развития заболевания. Вот основные из них:
- Неблагоприятная экологическая ситуация.
- Курение.
- Чрезмерное употребление алкоголя.
- Профессиональные вредности, контакт с канцерогенными веществами и различными излучениями на производстве.
- Ожирение, избыточная масса тела.
- Ультрафиолетовое излучение солнца и соляриев.
- Малоподвижный образ жизни.
- Возраст: со временем мутации накапливаются, поэтому вероятность возникновения в организме раковых клеток повышена у пожилых людей.
- Нездоровое питание: преобладание в рационе животных жиров, красного и обработанного мяса.
Ни один из этих факторов не приводит со стопроцентной вероятностью к развитию злокачественной опухоли.
Какие бывают типы генов рака?
Не все мутации одинаково опасны. К раку приводят те, которые возникают в определенных генах:
Онкогены активируют размножение клеток. Злокачественное перерождение происходит, когда они становятся слишком активны. В качестве примера можно привести ген, который кодирует белок HER2. Этот белок-рецептор находится на поверхности клетки и заставляет ее размножаться.
Гены-супрессоры опухолей сдерживают размножение клеток, восстанавливают поврежденную ДНК, вызывают апоптоз — запрограммированную клеточную смерть. Примеры таких генов: BRCA1, BRCA2, TP53 (кодирует белок p53 — «страж генома», который запускает апоптоз в поврежденных клетках).
Мутации, которые приводят к раку, могут быть наследственными (возникают в половых клетках) и соматическими (возникают в клетках тела в течение жизни).
Основные характеристики и строение раковых клеток
Раковые клетки обладают тремя основополагающими характеристиками, за счет которых так опасны онкологические заболевания:
- Способность к бесконтрольному размножению.
- Способность к инвазии — прорастанию в окружающие ткани.
- Способность к метастазированию — распространению в организме и образованию новых очагов в различных органах.
Не всякая опухолевая клетка — раковая. Раком или карциномой называют злокачественные опухоли из эпителиальной ткани, которая выстилает кожу, слизистые оболочки внутренних органов, образует железы. Из соединительной ткани (костной, жировой, мышечной, хрящевой, кровеносных сосудов) развиваются саркомы. Злокачественные заболевания органов кроветворения называют лейкозами. Опухоли из клеток иммунной системы — лимфомы и миеломы.
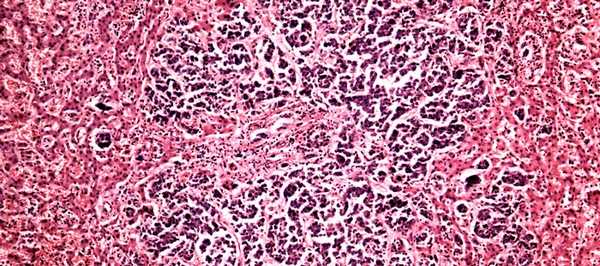
Как выглядят раковые клетки под микроскопом?
Если коротко, то они сильно отличаются от нормальных, тех, что ожидает увидеть патологоанатом, когда рассматривает под микроскопом фрагмент ткани. Раковые клетки имеют более крупные или мелкие размеры, неправильную форму, аномальное ядро. Если нормальные клетки в одной ткани все примерно одинаковых размеров, то раковые зачастую разные. Ядро содержит очень много ДНК, поэтому оно крупнее (его размеры тоже вариабельны), а при окрашивании специальными веществами выглядит более темным.
Из нормальных клеток образуются определенные структуры, например, железы. Раковые клетки располагаются более хаотично. Например, они образуют железы искаженной, неправильной формы или непонятные массы, которые на железы совсем не похожи.
Как развиваются раковые клетки, какие этапы проходят в своем развитии?
Раковые опухоли растут за счет деления клеток, которые входят в их состав. Во время деления злокачественная клетка образует две своих копии, таким образом, рост происходит в геометрической прогрессии. Например, для того чтобы образовалась опухоль размером 1 см, нужно около 30 удвоений. Через 40 удвоений новообразование достигает веса 1 кг, и этот размер считается критическим, смертельным для пациента.
Согласно современным представлениям, за рост злокачественной опухоли отвечают так называемые стволовые опухолевые клетки. Они активно делятся, в то время как другие опухолевые клетки просто существуют. Современные ученые заняты поиском методов лечения, направленных против этих стволовых клеток.
Время удвоения опухолевых клеток бывает разным. Например, при лейкозе это происходит за 4 дня, а при раковых новообразованиях толстой кишки — за 2 года. Проходит много времени, прежде чем опухоль достигнет настолько больших размеров, что станет проявляться какими-либо симптомами. Например, если у онкологического больного появились некоторые жалобы, и после этого он прожил год, вероятно, опухоль в его организме на момент появления жалоб существовала уже около трех лет, просто он об этом не знал.
Пока раковая опухоль небольшая, ей вполне хватает кислорода. Но по мере роста она все сильнее испытывает кислородное голодание — гипоксию. Чтобы обеспечить свои потребности, опухолевые клетки вырабатывают вещества, которые стимулируют образование кровеносных сосудов — ангиогенез.
По мере роста опухоли происходит инвазия — распространение раковых клеток в окружающие ткани. Они вырабатывают ферменты, которые разрушают нормальные клетки.
Некоторые из них отрываются от материнской опухоли, проникают в кровеносные и лимфатические сосуды, образуют в них вторичные очаги — метастазы. В этом самая главная опасность злокачественных опухолей. Именно метастатические очаги становятся причиной гибели многих онкологических пациентов.

Ликвидация раковых клеток: что помогает их уничтожить?
С раковыми клетками можно бороться разными способами. Например, удалить их из организма хирургическим путем. Но это возможно лишь в случаях, если опухоль не успела сильно распространиться в организме. Даже если можно выполнить радикальную операцию, никогда нет стопроцентной гарантии того, что в организме не остались микроскопические опухолевые очаги, которые в будущем станут причиной рецидива. Поэтому зачастую хирургические вмешательства дополняют адъювантной и неоадъювантной терапией.
Другие методы лечения:
- Химиопрепараты обладают разными механизмами действия, но все они сводятся к повреждению и уничтожению быстро размножающихся клеток. В первую очередь, конечно же, раковых, но страдают и некоторые нормальные ткани, из-за этого могут возникать серьезные побочные эффекты.
- Лучевая терапия действует аналогично химиопрепаратам, поражая быстро размножающиеся клетки.
- Таргетные препараты воздействуют на молекулы, которые помогают раковым клеткам быстро размножаться, выживать и защищаться от иммунной системы. Например, существуют блокаторы HER2, о котором речь шла выше, ингибиторы VEGF — вещества, с помощью которого опухолевые клетки «выращивают» для себя кровеносные сосуды.
- Иммунотерапия помогает иммунной системе обнаруживать и уничтожать опухолевые клетки.
В «Евроонко» применяются наиболее современные оригинальные препараты для борьбы с раком. У нас есть возможность провести молекулярно-генетический анализ опухолевой ткани, разобраться, из-за каких мутаций клетки стали злокачественными, и назначить наиболее эффективную персонализированную терапию. Свяжитесь с нами, мы знаем, как помочь.
Мутации при раке
Тело человека состоит примерно из 37 триллионов клеток. Информация о строении и функциях каждой из них закодирована в ДНК. Любая злокачественная опухоль является результатом нарушения работы тех или иных генов, а главная причина этого кроется в мутациях. Некоторые из них человек получает с рождения, и они присутствуют во всех клетках тела. А некоторые возникают уже в течение жизни под влиянием тех или иных факторов — эти мутации будут обнаруживаться только в потомках той клетки, в которой изначально возникла «поломка».
На этой странице мы собрали всю информацию о генетических нарушениях, связанных с онкологическими заболеваниями, представленную на нашем сайте.

Как часто в клетках тела человека происходят мутации?
Мутагенез — процесс непрерывный. Он происходит на всех этапах развития любого организма: в половых клетках, с самых первых дней существования эмбриона и на протяжении всей жизни. К счастью, далеко не все мутации вредны. Многие из них нейтральные (то есть не приносят ни вреда, ни пользы), а некоторые даже дают организму определенные преимущества.
Мутации — это главный двигатель эволюции живых организмов. В 2018 году были опубликованы результаты исследования, во время которого ученые обнаружили, что у 20-летних людей на одну клетку слизистой оболочки пищевода в среднем приходится по 100 мутаций, а у людей более старшего возраста — по 2000. Большинство из них не опасны, но некоторые затрагивают онкогены.
Чаще всего рак связан именно с соматическими, приобретенными, мутациями. Согласно современным представлениям, наследственные мутации ответственны за развитие лишь 5-10% онкопатологий. А по результатам исследования, опубликованного в 2020 году, наследственные мутации, связанные с раком, встречаются у каждого восьмого онкологического больного.
Почему мутации приводят к онкологическим заболеваниям?
Конечно же, далеко не все мутации и далеко не во всех генах приводят к развитию онкологических заболеваний. Чтобы нормальная клетка стала злокачественной, нарушения должны произойти в определенных генах:
Протоонкогены
Это гены, которые в результате мутаций способны превращаться в онкогены. В свою очередь, онкогены — это дефектные гены, которые способствуют развитию злокачественной опухоли, например, путем бесконтрольного размножения клеток. Характерный пример — EGFR.
Гены-супрессоры опухолевого роста
В норме они «сдерживают» клетки и не дают им стать злокачественными. Когда в этих генах возникают мутации, они перестают выполнять свои функции. Например, к этой категории относится ген TP53, кодирующий белок p53.
Гены репарации ДНК
Чаще всего их относят к генам-супрессорам опухолевого роста, но иногда выделяют в отдельную группу. Белки, кодируемые этими генами, исправляют «ошибки», возникающие в ДНК. Например, продукты генов BRCA1 и BRCA2 восстанавливают двухцепочечные разрывы в ДНК путем гомологичной рекомбинации — процесса, при котором поврежденная хромосома использует свою «сестру-близнеца» в качестве шаблона для репарации. Когда эти гены перестают правильно работать из-за мутаций, ДНК не может нормально восстанавливаться, и в ней накапливается еще больше повреждений.

Что способствует развитию мутаций, которые приводят к раку?
Мутации, связанные с онкозаболеваниями, бывают двух основных видов. Наследственные мутации происходят в половых клетках, и затем они будут присутствовать во всех клетках тела ребенка. Соматические мутации присутствуют только в клетках, в которых они изначально возникли, и в их потомках — например, только в злокачественной опухоли.
Обычно, чтобы нормальная клетка превратилась в злокачественную, в ней должен возникнуть целый набор мутаций. В каждом конкретном случае невозможно точно сказать, что именно послужило причиной. Скорее всего, единой причины и нет. На организм человека постоянно действует множество факторов, и многие из них могут способствовать поломкам в генах.
Вот список некоторых распространенных факторов риска, способствующих развитию рака:
Некоторые инфекции, например, ВПЧ
Неблагоприятная экологическая ситуация, воздействие вредных веществ на работе
Пол — многие онкологические заболевания чаще встречаются у мужчин или женщин
Семейный анамнез: рак у близких родственников
Большое количество красного и обработанного мяса (говядина, свинина, баранина, фастфуд, сосиски и колбасы, бекон и пр.)
Распространенные мутации при раке
Мутации в гене EGFR — белка-рецептора эпидермального фактора роста, который находится на поверхности клеток и активирует их размножение
T790M — один из вариантов мутации в гене EGFR
Мутации в гене ROS1 — белка, который встроен в клеточную мембрану и передает сигналы, играющие роль в росте и дифференцировке клеток
Мутации в гене BRAF. Белок, который он кодирует, участвует в регуляции делений клеток путем активации специфического сигнального пути.
Слияние генов с участием NTRK — когда из двух генов получается “неправильный”, гибридный. Гены NTRK кодируют белки Trk, которые выполняют разные функции, в том числе защищают клетки от апоптоза.
Мутации в гене ALK — белка, встроенного в клеточную мембрану, который передает сигналы, связанные с ростом, миграцией клеток, образованием новых кровеносных сосудов
Мутации в генах BRCA — белков, которые помогают восстанавливать ДНК, когда в обеих ее цепочках происходят разрывы
Мутации в генах RAS — белков, которые передают сигналы внутри клеток и регулируют клеточные деления. Семейство RAS включает три гена: KRAS, NRAS и HRAS.
Мутации в PIK3CA — гене, который кодирует белок PI3K, участвующий в регуляции важных процессов в клетках
Мутации в HRR — группе генов, продукты которых участвуют в репарации ДНК при двухцепочечных разрывах
Мутации в TP53 — гене, кодирующем белок p53, «страж генома», который останавливает размножение клеток с поврежденной ДНК и «приказывает» им совершить «самоубийство».
Результатом некоторых мутаций может стать микросателлитная нестабильность — состояние, при котором нарушается восстановление ДНК, и она приобретает повышенную склонность к мутациям.
Почему важно изучать мутации при онкологических заболеваниях?
Для врачей-онкологов важно знать, какие мутации произошли в раковых клетках у конкретного пациента. Это помогает решать важные задачи:
- судить о степени агрессивности рака, выстраивать прогноз;
- определять тип, подтип некоторых злокачественных опухолей;
- подбирать наиболее эффективные противоопухолевые препараты;
- назначать персонализированную терапию при запущенном раке, когда не помогают стандартные схемы лечения из протоколов.
Выявление мутаций, связанных с раком, у здоровых людей помогает оценивать риск развития онкологического заболевания, проводить профилактику и решать, кому назначать дополнительные скрининговые исследования.
А ученым знания о мутациях в опухолевых клетках помогают создавать новые лекарства.


Как определяют мутации при раке?
В федеральной сети клиник экспертной онкологии «Евроонко» доступны все современные исследования для выявления мутаций при раке:
Что такое эпигенетические изменения, и какую роль они играют в онкологии?
Не меньшую (а может быть, даже и более важную) роль, чем мутации, в развитии рака играют эпигенетические изменения. Этим термином называют такие модификации, которые не меняют последовательность генетического кода, но влияют на активность генов.
Чаще всего встречаются две разновидности эпигенетических изменений (но есть и другие):
- Метилирование ДНК — присоединение к ее определенным участкам метильных групп. Чаще всего они заставляют «молчать» определенные гены. В норме у человека метилирован 1% всего генома. В некоторых раковых клетках этот показатель ниже. За счет этого в них могут «включаться» онкогены.
- Модификации гистонов. ДНК организована таким образом, что напоминает бусы — эта структура называется нуклеосомой. В качестве бусинок выступают особые белки — гистоны. Они обмотаны нитями ДНК и влияют на активность генов. Даже небольшие изменения в гистонах могут сильно повлиять на регуляцию работы генов, заставить некоторые из них «замолчать» или, напротив, активировать.

Эпигенетика — очень интересная наука. Возможно, со временем она поможет ученым создать еще больше эффективных препаратов для лечения рака.

Почему у многих курильщиков не развивается рак легких? 20 апреля 2022

С возрастом у людей накапливается много мутаций, способных привес. 27 декабря 2021
Как родинка превращается в меланому? 08 декабря 2021
Лечение пациентов проводится в соответствии со стандартами и рекомендациями наиболее авторитетных онкологических сообществ. «Евроонко» является партнёром Фонда борьбы с раком. ВНИМАНИЮ ПАЦИЕНТОВ: Рекомендации по лечению даются только после консультации у специалиста. Ваши персональные данные обрабатываются на сайте в целях его корректного функционирования. Если вы не согласны с обработкой ваших персональных данных, просим вас покинуть сайт. Оставаясь на сайте, вы даёте согласие на обработку ваших персональных данных.
Сведения и материалы, размещенные на сайте , подготовлены исключительно в информационных целях и не являются медицинской консультацией или заключением. Авторы информационных материалов сайта не могут гарантировать применимость такой информации для целей третьих лиц и не несут ответственности за решения третьих лиц и связанные с ними возможные прямые или косвенные потери и/или ущерб, возникшие в результате использования информации или какой-либо ее части, содержащейся на сайте.
Читайте также:
