Неиммунологические пути активации комплемента. Образование гранулем при аллергическом альвеолите
Добавил пользователь Алексей Ф. Обновлено: 21.01.2026
Э кзогенный аллергический альвеолит (ЭАА) входит в группу заболеваний, именуемую “альвеолиты” и включающую также токсический альвеолит и идиопатический фиброзирующий альвеолит. Особенностью перечисленных заболеваний является диффузное поражение легочной ткани, причины возникновения и особенности течения которого различаются в зависимости от вида болезни. ЭАА является наиболее частой формой альвеолита.
Определение
ЭАА - это заболевание, вызванное вдыханием органической пыли с различными антигенами и характеризующееся диффузным поражением альвеолярной и интерстициальной ткани легкого. В литературе встречаются и другие названия этой патологии: “гиперчувствительный пневмонит”, “ингаляционные пневмопатии”, “диффузная интерстициальная пневмония”, “интерстициальный гранулематозный пневмонит” и др. Термин “ экзогенный аллергический альвеолит” был предложен J. Pepys в 1967 г.
В настоящее время известно большое число аллергенов, способных вызывать ЭАА. В их число включают растительный материал, содержащий сапрофитные грибы, в частности термофильные актиномицеты, аспергиллы и пенициллы; птичий белок, который вдыхается вместе с птичьим пометом; белки животных и рыб, а также антигены насекомых. В зависимости от вида антигена и содержащего его вещества экзогенные аллергические альвеолиты описывались под различными названиями: “легкое фермера” - заболевание, возникающее при работе с влажным сеном или зерном, содержащим термофильные актиномицеты; “багассоз” - поражение легких у лиц, работающих с сахарным тростником; “легкое голубеводов” и “легкое любителей волнистых попугаев” - альвеолиты, возникающие в результате ингаляции пыли, содержащей птичий помет и перо; “легкое грибников” - заболевание у лиц, выращивающих грибы, связанное с термофильными актиномицетатами; “легкое сыроваров” - альвеолит, вызываемый антигеном из группы пенициллинов; “легкое работающих с рыбной мукой” - поражение легких белком рыб; альвеолит, вызываемый вдыханием препаратов гипофиза, у больных несахарным диабетом и т. д. Как следует из этого перечня, ЭАА в значительной степени являются профессиональными болезнями и, следовательно, чаще встречаются у взрослых. У детей они также наблюдаются, хотя реже. Заболевания в детском возрасте вызваны теми же этиологическими факторами, что и у взрослых, так как контакт с рядом перечисленных аллергенов у детей вполне реален. Прежде всего это относится к аллергенам, вызывающим “легкое голубеводов” и “легкое любителей волнистых попугаев”, не исключен также контакт с аллергенами, содержащимися во влажном сене и зерне.
Ингаляция аллергенов, содержащихся в перечисленных органических веществах, вызывает образование специфических преципитинов IgG. Доказано, что при “легком фермера” наибольшую роль играют термофильные актиномицеты - Micropolyspora faeni и Actypomyces vulgaris. При “легком голубеводов” и “легком любителей волнистых попугаев” специфическим антигеном является сывороточный Оg-глобулин. В острой стадии ЭАА у большинства больных в сыворотке крови удается обнаружить специфические преципитины при использовании антигенов, приготовленных из соответствующих материалов. В хронической стадии болезни преципитины нередко не обнаруживаются. У части здоровых людей, имеющих контакт с соответствующим антигеном, также можно обнаружить преципитирующие антитела. Считается, что в реализации патологического процесса важная роль принадлежит иммунным комплексам, образующимся при взаимодействии антигена с преципитирующими антителами. Повреждение тканей происходит в результате действия активированного комплемента или вследствие выделения лизосомальных ферментов при разрушении лейкоцитов, фагоцитировавших иммунные комплексы. Если антигенный стимул не был чрезмерным и экспозиция не повторяется, то происходит фагоцитоз иммунных комплексов с последующей полной их элиминацией. В случаях же повторяющегося контакта с антигеном активированные альвеолярные макрофаги стимулируют рост клеток фибробластического ряда. Секреция фибробластами коллагена ведет к развитию интерстициального легочного фиброза. Однако не все лица, контактирующие с аллергенами, заболевают ЭАА. Так, по данным V. Schlegel (1987), болезнь возникает лишь у 1 - 5% людей, вдыхающих антигены. Это наводит на мысль, что в развитии заболевания имеют значение не только экзогенные, но и эндогенные факторы.
В острой фазе ЭАА обнаруживаются два типа морфологических изменений в легких: воспалительный инфильтрат в стенках альвеол, состоящий из лимфоцитов и плазматических клеток, и гранулемы как в альвеолярных перегородках, так и в стенках бронхиол. Эпителиально-клеточные гранулемы весьма схожи с таковыми при саркоидозе, но их меньше и они не так резко ограничены (К. Бергман, 1984). В хронической стадии болезни обнаруживаются фиброзные изменения в стенках альвеол и бронхов, которые в далеко зашедших случаях приводят к нарушению архитекторники паренхимы легких, формированию “сотового легкого” и бронхиолоэктазов.
ЭАА у детей может возникнуть в широком возрастном диапазоне. Под нашим наблюдением были дети в возрасте от 1 года 8 мес до 16 лет. Наибольшее число заболевших (47%) приходилось на школьный возраст. У детей до 3 лет ЭАА возник в 37% случаев, у детей дошкольного возраста - в 12% случаев. Клинические симптомы и течение ЭАА зависят от характера аллергена, массивности и продолжительности антигенного воздействия и индивидуальных особеннностей макроорганизма (Р. В. Путов, М. М. Илькович, 1986; А. Г. Хоменко и соавт., 1987). Большинство авторов различают три варианта течения заболевания: острое, подострое (субхроническое) и хроническое.
Острые симптомы возникают через несколько часов после массивного контакта с органическим материалом, содержащим антигены, например после чистки голубятни. Чаще же болезнь начинается на фоне более или менее длительного контакта с аллергеном. Большинство наблюдавшихся нами детей с ЭАА были сельскими жителями и имели постоянный контакт с сеном, домашними птицами и животными. Лишь у 1/7 части больных был домашний контакт с волнистыми попугайчиками.
Мы наблюдали случаи заболевания, связанные с переездом на жительство в район элеватора, проживанием в доме, в котором производили шерстяные ковры, а также в сыром помещении с плесенью на полу и стенах. В начале болезни появляются общие нарушения, как при гриппе (повышение температуры тела, озноб, головная боль, боли в конечностях). Поражение легких проявляется сухим кашлем, одышкой, появлением мелко- и среднепузырчатых влажных хрипов. В отличие от бронхиальной астмы у больных нет свистящего дыхания и рассеяных сухих хрипов, но у детей с атопией начало альвеолита сопровождается иногда одышкой астматического типа.
В острой фазе заболевания в составе крови отмечается незначительный лейкоцитоз с нейтрофилезом. Эозинофилия нехарактерна.
При прекращении контакта с аллергеном заболевание заканчивается полным выздоровлением через несколько дней или недель. При повторном контакте с аллергенами могут возникать рецидивы, более длительные и тяжелые, чем первичное заболевание. При постоянном контакте болезнь может развиваться подостро, оставаться нераспознанной и переходить в хроническую стадию.
В хронической стадии болезни ведущими симптомами становятся одышка и кашель с отделением слизистой мокроты. В легких выслушивается умеренное количество крепитирующих хрипов, хотя этот симптом непостоянен. Постепенно у части больных появляется деформация (уплотнение) грудной клетки, утолщаются концевые фаланги пальцев, при физической нагрузке возникает цианоз. Помимо этого, более чем у половины больных наблюдаются общая слабость, повышенная утомляемость, ограничение двигательной активности, снижение аппетита и уменьшение массы тела. Состав крови вне периода обострения обычно нормальный, так же как и биохимический анализ крови. Исследование иммуноглобулинов показывает у части больных в острой фазе и при обострении хронического течения ЭАА повышение уровня отдельных классов иммуноглобулинов, существенных изменений показателей клеточного иммунитета не выявляется. Зато у всех обследованных детей с ЭАА обнаружено повышение уровня циркулирующих иммунных комплексов.
Бронхографическое исследование, проведенное у части больных в хронической стадии ЭАА, не выявило патологических изменений. При бронхоскопии диффузный катаральный эндобронхит обнаружен у половины обследованных пациентов, у остальных слизистая оболочка бронхов была без изменений.
Бактериологическое исследование мокроты выявило в посеве H. influenzae менее чем у половины обследованных больных, у остальных определялись единичные колонии грибков рода Candida и сапрофитная флора.
При ЭКГ-исследовании у 84% больных определены преходящие изменения в виде синусовой тахикардии и метаболических изменений в миокарде гипоксического характера. У 16% больных с хроническим течением ЭАА выявлены электрокардиографические признаки перегрузки правых отделов сердца (отклонение электрической оси сердца вправо, увеличение амплитуды и заострение зубца Р, отрицательный зубец Т и смещение сегмента ST вниз в грудных отведениях). У этих же пациентов при эхокардиографии обнаружены гипертрофия миокарда и дилатация правого желудочка, а также умеренное снижение сократительной способности миокарда, что могло являться признаком формирующегося легочного сердца. У остальных детей этой группы на эхокардиограмме отклонений от нормы не отмечено.
Рентгенологические изменения в острой фазе аллергического альвеолита определяются в виде мелких (милиарных) очаговых теней, расположенных преимущественно в средних легочных полях. Нередко обнаруживается понижение прозрачности легочной ткани - симптом матового стекла. Оба этих симптома связаны с наличием экссудативных, пролиферативных и гранулематозных изменений в альвеолярной ткани и легочном интерстиции, хотя они выявляются не всегда. В этих случаях на рентгенограммах легких отмечается нечеткость (смазанность) легочного рисунка с обеих сторон, более выраженная в прикорневых и базальных отделах, на фоне которой определяются двусторонние мелкие очаговые тени с убывающей интенсивностью по направлению к верхушкам. Такую рентгенологическую картину мы наблюдали у 16% больных с острым и у 5% с подострым (рецидивирующим) течением ЭАА. Рентгенологические находки в хронической стадии ЭАА разнообразны и зависят от длительности и тяжести болезни, а также связанных с этим характером и выраженностью морфологических измеенний в легких. У половины детей, впервые поступивших к нам в клинику уже в хронической стадии заболевания, рентгенологически определены признаки диффузного пневмофиброза. Отмечено уменьшение объема легких, высокое стояние куполов диафрагмы, при рентгеноскопии - уменьшение подвижности грудной клетки и диафрагмы. Легочный рисунок был смазан, понижена прозрачность легочной ткани, более выраженная в средних и нижних зонах легких, по периферии легких определялись участки вздутия. У 10% детей рентгенологически выявлена сетчатая деформация легочного рисунка. Расширение внутригрудной части трахеи и главных бронхов отмечено в 16% случаев. У 20% больных рентгенологически определено выбухание дуги легочной артерии. В отдельных случаях при обострениях хронического течения ЭАА рентгенологически в легких с обеих сторон обнаружены множественные инфильтративные облаковидные тени, которые обычно не коррелируют с тяжестью состояния больного и могут даже быть основным симптомом обострения процесса. Как правило, эти изменения исчезают под влиянием лечения, однако в дальнейшем могут рецидивировать. Нарушение функции дыхания является важной составной частью патофизиологических изменений при ЭАА. В клинической картине болезни всегда присутствуют проявления острой и хронической дыхательной недостаточности в виде одышки и цианоза, усиливающихся или появляющихся при физической нагрузке.
При хроническом течении ЭАА превалируют расстройства вентиляции по рестриктивному типу, что проявляется снижением жизненной емкости легких, общей емкости легких, растяжимости легких и повышением удельной бронхиальной проводимости (по данным бодиплетизмографии). Наряду с этим у пациентов с острым и подострым течением ЭАА нередко выявляются обструктивные нарушения в виде гиперинфляции легких и снижения проходимости мелких бронхов. Одним из наиболее постоянных и диагностически ценных признаков является уменьшение диффузионной способности легких, возникающее как вследствие изменения дмффузионных свойств альвеолярно-капиллярной мембраны, так и в результате нарушения равномерности вентиляционно-перфузионных отношений. У больных с острым течением ЭАА возможны полное излечение и нормализация функциональных параметров. Исследование газового состава крови выявляет в момент обострения заболевания гипоксемию и гипокапнию. В период ремиссии изменений может не быть.
Прогноз острой фазы ЭАА благоприятный. При переходе болезни в хроническую стадию прогноз становится серьезным. Заболевание может прогрессировать даже после прекращения контакта с аллергенами. У взрослых больных описаны развитие легочного сердца и смерть от правожелудочковой недостаточности. У детей прогноз хронической стадии ЭАА более благоприятен, хотя также серьезен.
Как показали собственные наблюдения, большое значение в улучшении прогноза хронических форм ЭАА помимо прерывания контакта с причинно-значимыми аллергенами имеет как можно более ранняя диагностика и адекватная терапия. Так, среди пациентов с ЭАА (все формы), у которых мы имели возможность проследить развитие болезни в течение 7 мес - 7 лет (в среднем 2,8 года), выздоровление от ЭАА отмечено в 15% случаев. Улучшения состояния, выражавшегося главным образом в уменьшении степени дыхательной недостаточности, нам удалось добиться у 42% больных с подострой и хронической формами заболевания. Случаев прогрессирования процесса и летальных исходов отмечено не было.
Диагностика
Диагноз альвеолита, особенно хронического течения, может быть установлен лишь в результате полного клинико-инструментального обследования больного. При подозрении на ЭАА необходимо провести тщательный сбор анамнеза с целью выявления контакта с возможным причинным аллергеном.
Острое начало болезни, сопровождающееся одышкой, кашлем и хрипами в легких, заставляет проводить дифференциальную диагностику с бронхиальной астмой, а лихорадка и общие нарушения - с пневмонией.
Дифференциальная диагностика ЭАА и пневмонии базируется на различии в физикальных и рентгенологических изменениях, которые при пневмонии, как правило, односторонние, инфильтративные, очаговые и ограниченные, а при альвеолите диффузные, двусторонние.
У отдельных больных ЭАА нужно дифференцировать острую фазу с милиарным туберкулезом в связи с некоторым сходством рентгенологических изменений. В этих случаях помогают тщательно собранный анамнез (контакт с туберкулезными больными), результаты туберкулиновых проб, поиски туберкулезного возбудителя, а также других проявлений туберкулеза и тщательный анализ рентгенологических данных. Милиарные высыпания при туберкулезе располагаются, как правило, равномерно по всем легочным полям, их намного больше и они отчетливее, чем при ЭАА.
Определенные трудности возникают при дифференциальной диагностике ЭАА и бронхиолита, при котором имеются одышка и диффузные изменения в легких. Диагностика должна базироваться на различиях в характере одышки (при бронхиолите - преимущественно экспираторная, при альвеолите - смешанная); физикальной и рентгенологической картине заболеваний.
Диагностировать хроническую стадию ЭАА очень трудно, особенно если не удается установить связь заболевания с аллергенами, а острые эпизоды были зафиксированы под другими диагнозами. В этих случаях большим подспорьем становится всестороннее изучение функции дыхания. Выявление рестриктивных нарушений вентиляции, снижение диффузионной способности легких и хронической гипоксемии ограничивает круг заболеваний и выдвигает ЭАА на первый план.
Из специальных методов диагностики наиболее важный - выявление специфических преципитирующих антител в сыворотке крови больного. Для этих целей применяется метод двойной диффузии в агаре по Оухтерлони или его сочетание со встречным иммунным электрофорезом. Диагностическое значение этого метода ограничено тем, что специфические антитела могут быть выявлены не у всех больных, они довольно быстро исчезают после прекращения контакта и могут быть обнаружены у здоровых лиц, контактирующих с антигеном, а методические погрешности могут приводить к ложноположительным результатам. Ненадежными оказались метод специфической стимуляции Т-лимфоцитов и кожные пробы из-за часто возникающих неспецифических реакций.
Лечение ЭАА заключается прежде всего и главным образом в прекращении контакта больного с аллергеном. Всем больным после установления диагноза ЭАА назначали кортикостероидную терапию (преднизолон в начальной суточной дозе 1 мг 1 кг массы тела). При острой фазе заболевания эту дозу пациенты принимали в течение 10 - 14 дней, при хронической - в течение 2 - 4 нед. Показаниями для снижения дозы кортикостероидов мы считали уменьшение одышки и(или) кашля, количества хрипов в легких, положительную рентгенологическую и функциональную динамику, улучшение самочувствия. Снижение дозы преднизолона проводилось со скоростью 5 мг в неделю. Поддерживающую дозу (5 мг в сутки) больные с острой формой ЭАА получали в среднем в течение 3 мес.
При хроническом течении заболевания поддерживающую дозу преднизолона назначали на более длительный срок (6 - 8 мес). Двое больных с тяжелым хроническим течением ЭАА еще год продолжали принимать кортикостероиды альтернирующим курсом (по 5 мг преднизолона через день, а затем через 2 дня). Побочные проявления кортикостероидной терапии в виде синдрома Иценко - Кушинга мы наблюдали у 21% больных. По мере снижения дозы преднизолона проявления гиперкортицизма исчезали. Учитывая, что при хроническом течении ЭАА, когда уже сформирован диффузный легочный фиброз, эффективность кортикостероидной терапии значительно снижается, мы в последние годы стали назначать таким больным купренил (D-пеницилламин). Препарат разрушает циркулирующие иммунные комплексы, способствует скоплению растворимого коллагена и тормозит образование нерастворимого коллагена, тем самым замедляя развитие соединительной ткани в легких. В нашей группе пациентов сочетанную терапию D-пекицилламином и преднизолоном получали 26,3% детей. Препарат давали 1 раз в день в дозе 125 - 250 мг в среднем в течение 6 мес. За время лечения D-пеницилламином проводили регулярный контроль общих анализов крови и мочи, а также уровня сывороточного железа. Побочных и токсических реакций на прием D-пеницилламина не отмечено.
Активно применяли физические методы лечения: массаж грудной клетки и лечебную физкультуру. В случае присоединения острых респираторных заболеваний и обострения бронхолегочного процесса назначали антибактериальную терапию. По показаниям применяли бронхоспазмолитические, отхаркивающие и другие симптоматические средства, при необходимости проводили лечение сопутствующих заболеваний. Больным с проявлениями сердечной недостаточности назначали кардиотропную терапию.
Последние публикации (1995 - 1996 гг.), касающиеся больных ЭАА (как взрослых, так и детей), свидетельствуют об эффективности плазмафереза и лимфоцитафереза в комплексной терапии заболевания.
При выраженной дыхательной недостаточности обязательным компонентом лечения была оксигенотерапия. Кроме того, всем родителям объясняли исключительную важность полного прекращения контакта больного ЭАА ребенка с вызывающим заболевание фактором.
Псевдоаллергия ( Ложная аллергия , Парааллергия )
Псевдоаллергия - это повышенная реактивность на определенные вещества, поступающие в организм, с развитием клинических признаков, характерных для истинной аллергии. При этом иммунологические реакции, возникающие при аллергии, отсутствуют, а воспалительный процесс развивается вследствие нарушения обмена гистамина, неадекватной активации комплемента и других механизмов. Для развития псевдоаллергии требуется довольно большое количество вещества, вызывающего непереносимость (пищевого продукта, добавки или лекарства). Диагностика псевдоаллергии основана на исключении истинной аллергии. Лечение предусматривает отказ от проблемных продуктов, использование антигистаминных средств.
МКБ-10
Общие сведения
Псевдоаллергия (ложная аллергия) - развитие патологического процесса, идентичного аллергической реакции по клиническим проявлениям, но с отсутствием иммунологической стадии (вещество, вызвавшее реакцию, не является антигеном, не происходит выработки иммуноглобулинов). Псевдоаллергическая реакция начинается сразу с выброса клетками медиаторов воспаления. Чаще всего псевдоаллергия возникает на пищевые продукты, пищевые добавки и лекарственные средства, поступающие в организм. По данным статистики, именно псевдоаллергические реакции являются наиболее распространенными, встречаясь в течение жизни почти у 70% населения (истинная аллергия наблюдается значительно реже - у 1-10% взрослых и детей).
Причины
Существует три основных фактора, способствующих развитию псевдоаллергических реакций. Это нарушение обмена гистамина, неадекватная активация комплемента и нарушение метаболизма жирных кислот. Чаще всего псевдоаллергия возникает при нарушении обмена гистамина вследствие повышенной гистаминолиберации, сниженной гистаминопексии, дисбактериоза и избыточного употребления гистаминосодержащих продуктов.
Интенсивное высвобождение гистамина происходит в результате воздействия на тучные клетки и базофилы веществ-либераторов: яиц и морепродуктов, шоколада, клубники, орехов, консервированных продуктов и т. д. Кроме того, гистамин может высвобождаться из клеток при воздействии различных физических факторов: высокой и низкой температуры, вибрации, ультрафиолетового излучения; химическом воздействии кислот и щелочей, медикаментов.
Псевдоаллергия нередко развивается при хронических заболеваниях ЖКТ, сопровождающихся нарушением кислотности желудочного сока и повреждением слизистой оболочки желудка и кишечника, что приводит к более легкому проникновению либераторов к тучным клеткам, имеющимся в пищеварительном тракте и интенсивному выбросу гистамина и других медиаторов воспаления.
Псевдоаллергия может возникать при нарушении процесса инактивации гистамина (сниженной гистаминопексии) вследствие заболеваний кишечника и печени, при дисбактериозе, различных интоксикациях, длительном приеме некоторых медикаментов.
Псевдоаллергические реакции довольно часто развиваются при употреблении пищевых продуктов, содержащих повышенное количество гистамина, тирамина. К таким продуктам относятся различные виды сыра, красное вино, полуфабрикаты, подвергнутые ферментированию и консервированию: мясные и рыбные консервы, колбасы и ветчина, сосиски, маринованные помидоры и огурцы, сельдь, а также шоколад, шпинат, какао бобы, пивные дрожжи и др.
Еще один причинный фактор, вызывающий развитие псевдоаллергии - различные пищевые добавки, являющиеся красителями (тартазин и нитрит натрия), консервантами (бензойная кислота, глутамат натрия, салицилаты), ароматизаторами, загустителями и т. п. Псевдоаллергия может возникать и при попадании в организм продуктов, загрязненных пестицидами, нитратами и нитритами, тяжелыми металлами, токсинами микроорганизмов.
Значительно реже псевдоаллергия развивается вследствие неадекватной активации комплемента при некоторых иммунодефицитных состояниях, в частности при наследственном ангионевротическом отеке. Иногда появление псевдоаллергии может быть обусловлено употреблением некоторых нестероидных противовоспалительных средств, нарушающих обмен арахидоновой кислоты.
Симптомы псевдоаллергии
Клинические признаки ложной аллергии сходны с симптомами, встречающимися при аллергических заболеваниях. При этом патологический процесс приводит к локальному или системному повышению проницаемости периферических сосудов, отеку, воспалению, спазму мышц внутренних органов, повреждению клеток крови.
Клинические проявления псевдоаллергии зависят от преимущественного поражения определенного органа и системы организма. Чаще всего это высыпания на кожных покровах по типу крапивницы, локальный отек кожи в области лица и шеи (отек Квинке). Нередко наблюдается нарушение функции желудочно-кишечного тракта с появлением болей в животе, тошноты и рвоты, метеоризма, диареи, признаки поражения бронхолегочной (одышка, удушье, кашель) и сердечно-сосудистой системы (нарушения сердечного ритма, отеки на ногах, обморочные состояния из-за снижения артериального давления).
Появляющиеся симптомы псевдоаллергии имеют свои особенности в зависимости от причинного фактора, вызвавшего развитие патологического процесса. Так, резкое высвобождение гистамина клетками приводит к выраженному повышению его концентрации в крови и появлению вегетативно-сосудистых проявлений в виде гиперемии кожи, чувства жара во всем теле, головных болей по типу мигренозных, головокружения, затруднения дыхания. При этом часто отмечаются признаки неблагополучия со стороны ЖКТ (тошнота, сниженный аппетит, урчание в животе, поносы). Нарушения обмена арахидоновой кислоты при псевдоаллергии проявляются симптомами, наблюдаемыми при бронхиальной астме (чувство нехватки воздуха, кашель, приступы удушья).
При псевдоаллергии могут наблюдаться анафилактоидные реакции, сходные с анафилактическим шоком, но отличающиеся от него отсутствием выраженных нарушений системы кровообращения, поражением преимущественно одного органа или системы, благоприятным исходом заболевания.
Диагностика
Диагностика псевдоаллергии основана на тщательном анализе анамнестических сведений, выявлении симптоматики, встречающейся преимущественно при псевдоаллергических реакциях и проведении лабораторных исследований, позволяющих исключить истинную аллергию.
Отличительные клинические признаки псевдоаллергии: развитие у детей старше года и у взрослых, возникновение реакции на либератор при первом контакте и отсутствие постоянных обострений при повторных контактах с ним, наличие четкой зависимости проявлений псевдоаллергии от количества поступающего продукта, отсутствие перекрестной чувствительности, локальность, ограниченность патологического процесса и его клинических проявлений одним органом (системой).
При проведении лабораторных исследований при псевдоаллергии обычно отсутствует эозинофилия в анализе крови, уровень общего иммуноглобулина E в пределах нормы, а результаты определения специфических иммуноглобулинов в крови и кожные аллергопробы отрицательные.
В специализированных клиниках для выявления псевдоаллергии и проведения дифференциальной диагностики с истинными аллергическими реакциями могут применяться такие методы, как проведение теста с введением в 12-перстную кишку гистамина (если имеется непереносимость пищевых продуктов), определение флюоресценции лимфоцитов (при крапивнице), индометациновый тест (при аспириновой бронхиальной астме), элиминационно-провокационные тесты и пр.
Лечение псевдоаллергии
В первую очередь необходимо прекратить (по возможности) поступление в организм веществ-либераторов, которые вызывают появление патологической псевдоаллергической реакции у данного пациента (прекратить прием аспирина и других нестероидных противовоспалительных средств при аспириновой астме, пищевого красителя тартазина - при пищевой непереносимости и т. д.).
Если развитие псевдоаллергии связано с повышенным высвобождением гистамина клетками, ограничивают прием продуктов, стимулирующих этот процесс и содержащих гистамин в повышенных количествах, а также рекомендуют прием перорально кромолин-натрия в достаточно больших дозах. При наличии заболеваний ЖКТ (гастродуоденита с повышенной секреторной функцией, язвенной болезни 12-перстной кишки) рекомендуется диетическое питание с использованием овсяной каши, рисового отвара, а также прием лекарственных препаратов, снижающих секрецию и обладающих обволакивающим действием на слизистую желудка и кишечника. При наличии дисбактериоза проводят его коррекцию и снижают количество углеводов в пищевом рационе.
При псевдоаллергии с клиническими проявлениями в виде крапивницы (при нарушении инактивации гистамина), назначают введение раствора гистамина в постепенно возрастающей дозе. При псевдоаллергическом наследственном отеке Квинке вводят С1-ингибитор или свежую (свежезамороженную) плазму, а также препараты тестостерона.
Профилактика
Профилактика псевдоаллергии основана на исключении факторов, которые вызывают ее развитие: отказе от приема потенциальных пищевых продуктов-либераторов, некоторых лекарственных препаратов и рентгеноконтрастных веществ, соблюдении элиминационной диеты, своевременном лечении сопутствующих заболеваний ЖКТ.
1. Аллергические заболевания: учеб. пособие/ Мельников В.Л., Митрофанова Н.Н., Мельников Л.В. - 2015.
2. Псевдоаллергия и истинная аллергия: в чем сходство и различия?/ Зайков С.В.// Здоровье Украины. - 2018 - №16.
3. Клиническая аллергология. Руководство для практических врачей/ Под ред. проф Р.М. Хаитова. - 2002.
Экзогенный аллергический альвеолит: симптомы и лечение
Экзогенный аллергический альвеолит — диффузное воспаление легочной ткани, приводящее к развитию пневмосклероза, дыхательной недостаточности и легочного сердца.
Экзогенный аллергический альвеолит, или гиперчувствительный интерстициальный пневмонит, развивается при повторном аэрогенном поступлении в сенсибилизированный организм антигенов (аллергенов) микробного, животного, растительного происхождения или различных низкомолекулярных химических соединений.
Вначале происходит сенсибилизация организма в виде активации Тн2 и появления IgG-антител к причинно-значимому антигену. Реакцию могут вызывать вещества, способные попасть в альвеолы. При попадании причинно-значимого антигена в сенсибилизированный организм реакция протекает быстро (через 4-8 ч) подобно феномену Артюса с образованием иммунных комплексов. Процессы отложения иммунных комплексов и образования хемоаттрактантов, анафилатоксинов (С5а, СЗа) в результате активации комплемента ведут к острому повреждению сосудов и альвеол с привлечением нейтрофилов и макрофагов.
На 2-е сутки после контакта с антигеном развивается ГЗТ с вовлечением CD4+ (Тн1), активированных макросов и CD8+ цитотоксических Т-лимфоцитов. В дальнейшем образуются эпителиоидно-макрофагальные гранулемы, активируются фибробласты, развивается интерстициальный фиброз.
Некоторые виды экзогенного аллергического альвеолита и источники причинно-значимых аллергенов
Вид экзогенного аллергического альвеолита
Источник аллергенов и аллергены
Альвеолиты, вызываемые медикаментами
Медикаменты: пенициллины и другие антибиотики, сульфаниламиды, нитрофураны, соли золота
Альвеолиты, вызываемые низко молекулярными соединениями
Дитиоизоцианаты, соли тяжелых металлов
Пшеница, мука (аллергены зернового долгоносика, грибов)
Болезнь молольщиков кофе
Болезнь моющихся в сауне
Влажная древесина (аллергены грибов)
Болезнь легких, связанная с при менением увлажнителей и кондиционеров
Вода и воздух, содержащие аллергены грибов и бактерий, в т. ч. аллергены актиномицетов
Заплесневелый сыр (аллергены пеницилловых грибов)
Хлопок (аллергены плесневых грибов)
Кора клена (аллергены плесневых грибов)
Легкое птицевода (любителей птиц)
Перья и помет голубей, волнистых попугайчиков (аллергены птиц и грибов)
Легкое рабочего, обрабатывающего солод
Прелый ячмень, солодовая пыль (аллергены аспергилловых грибов - А. fumigatusl А. clavatus)
Прелое сено (аллергены термофильных актиномицетов и грибов)
Патогенез
В патогенезе рассматриваемых заболеваний имеет основное значение иммунокомплексный механизм повреждения тканей. Аллерген, который попал в организм, приводит к сенсибилизации (привыканию). В этом процессе формируются антитела к нему. Чаще всего преципитирующие, которые в основном относятся к иммуноглобулину G.
Антитела с аллергеном формируют иммунные комплексы. Отложения последних можно наблюдать с помощью специальных методов на стенках альвеол и мельчайших бронхиол, из-за чего не может не возникнуть воспалительный процесс. В патологическом описанном процессе имеет значение повышенная проницаемость сосудистой стенки, причиной которой является включение IgE-опосредованных аллергических реакций. Вазоактивные амины выделяются из базофильных гранулоцитов или тучных клеток в организме. Имеет значение и тромбоцитактивирующий фактор, который учавствует в выделении из тромбоцитов серотонина и гистамина, которые являются вазоактивными аминами.
Сосуды становятся более проницаемыми (через них могут попадать различные частички более легко) из-за вазоактивных аминов и тромбоцитактивирующего фактора. Усиливается хемотаксис нейтрофильных и эозинофильных гранулоцитов, что вызывает и усиливает воспалительные процессы.
Также в патогенезе может отмечаться замедленная аллергическая реакция, при которой в легких формируются так называемые гранулемы. Появится она или нет — зависит от запустившего патогенез аллергена. Зачастую причина заключается в спорах грибков или частицах их. Также к образованию гранулем приводит наличие иммунных нерастворимых комплексов.
Развитие гранулемы условно делят на стадии, которые кончаются формированием рубца, что говорит о таком диагнозе как фиброз легких. В части случаев заболевания на клетках ткани легкого фиксируются аллергены, что меняет их антигенные свойства. По этой причине запускается цитотоксический механизм повреждения тканей.
В патогенезе экзогенного аллергического альвеолита могут иметь значение псевдоаллергические механизмы. Классический или же альтернативный путь характеризует активацию комплемента аллергенами, которые происходят из некоторых грибков. Также активация может быть вследствие попадания в организм экстрактов, в том числе, из пыли, источником которой является заплесневелое сено.
Симптомы
- острая
- подострая
- хроническая
Острое течение заболевания развивается через 4-1 2 ч после вдыхания аллергена. У больного появляются кашель, прозрачная мокрота, хрипы, одышка, субфебрильная температура, боли в мышцах и суставах.
Хроническая фаза заболевания сопровождается прогрессирующей одышкой при физических нагрузках, пневмосклерозом, усилением дыхательной и сердечной недостаточности.
Для диагностики данного заболевания (точнее, ряда заболеваний экзогенного происхождения) важен детальный сбор анамнеза. Нужно выяснить, в каких условиях проживает и работает пациент, в какой среде находился длительное время и т.д. Также врач собирает жалобы пациента и обнаруживает характерные симптомы. Всех больных отправляют на проведение рентгенографии.
Подтверждение диагноза экзогенного аллергического альвеолита проводится с помощью серологических методов, а также при проведении аллергических диагностических проб. С помощью этих методов обнаруживают хронизированные или подострые формы болезни (особенно важное значение — в тех случаях, когда при сборе анамнеза врач не обнаружил возможный аллерген).
Дифференциальная диагностика
При постановке диагноза нужно учитывать, что схожую симптоматику и развитие могут иметь ряд других патологий:
Рентгенография позволяет дифференциировать ЭАА с инфекционной пневмонией. В последнем случаев выявляют долевое, сегментарное или же дольковое затемнение. При саркоидозе патологический процесс затрагивает, помимо легких, и другие органы. В моче повышенное количество кальция, а бронхолегочные лимфоузлы по размерам больше нормы.
Если у человека диссеминированный туберкулез легких, скорее всего, он ранее болел туберкулезом, или находился какое-то время рядом с больным этой болезнью человеком. Туберкулиновые пробы проводятся для дифдиагностики, они показывают положительный результат. Также можно взять мокроту на анализ для обнаружения в ней возбудителя болезни.
Идиопатический фиброзирующий альвеолит отличается от рассматриваемой болезни пневмофиброзом, развивающимся быстрыми темпами, и дыхательной недостаточностью, которая постепенно усугубляется.
Для идиопатического фиброзирующего альвеолита характерно быстрое прогрессирование пневмофиброза с развитием дыхательной недостаточности.
Лабораторная диагностика
От больных получают бронхоальвеолярный смыв с помощью бронхоальвеолярного лаважа во время фибробронхоскопии. В лаважной жидкости выявляют иммунные комплексы и циркулирующие антитела к причинно-значимому антигену. Титр IgО -, IgА-, ІgЕ-антител при заболевании повышен. Изучают цитограмму лаважной жидкости с количественным учетом альвеолярных макрофагов, нейтрофилов, эозинофилов и базофилов. Полицитоз в острую фазу превышает норму в 5-7 раз.
При гистологическом изучении биоптатов легких выявляется экссудативная фаза воспаления в виде обильной макрофагально-лимфоцитарной инфильтрации, васкулита и выпадения фибрина в альвеолы, в которых скапливаются лимфоциты. Возможно формирование смешанных гранулем.
Лечение
Больному необходимо прервать контакт с причинно-значимым аллергеном. Назначают кортикостероиды (преднизолон) и десенсибилизирующие лекарственные средства. Возможно проведение плазмафереза.
Экзогенный аллергический альвеолит
К экзогенным аллергическим альвеолитам относят заболевания бронхов и легких, при которых вдыхание органической пыли вызывает реакции повышенной чувствительности с преимущественным поражением альвеол и бронхиол. Особенно широко заболевание распространено среди лиц, чей труд связан с сельским хозяйством. В дождливый сезон аллергическим альвеолитом заболевают до 8 % фермеров в Англии и около 4 % в США [Davies R. - В кн.: Fishman А., 1980 ].
Что провоцирует / Причины экзогенного аллергического альвеолита:
Этиологические факторы экзогенного аллергического альвеолита могут быть распределены на несколько групп: 1) термофильные актиномицеты; 2) плесень (Aspergillus, Pemellium, Al- ternaria); 3) пыль растительного и животного происхождения (древесная и шерстяная); 4) белковые антигены (птичий помет и перья, домашняя пыль и др.); 5) пищевые антигены (сыр, грибы, солод, мука и др.); 6) медикаменты (пенициллин, нит- рофураны, соли золота и др.). Исходя из характера ингалируе- мых частиц, приводящих к развитию экзогенного аллергического альвеолита, описано несколько заболеваний: «легкое фермера», «легкое любителя птиц», «болезнь голубеводов», «легкое работающих с солодом», «легкое грибников», «легкое мойщика сыра», «легкое мельника», «болезнь работников деревообрабатывающих предприятий», «болезнь сортировщиков шерсти» и др. Описаны аллергические альвеолиты у лиц, работающих с кондиционирующими и увлажняющими воздух установками, вдыхающих с лечебной целью препараты, полученные из задней доли гипофиза свиней и крупного рогатого скота. Вероятно, способствовать развитию экзогенного аллергического альвеолита может наследственная предрасположенность к этому заболеванию.
Патогенез (что происходит?) во время экзогенного аллергического альвеолита:
Патогенез экзогенного аллергического альвеолита пока изучен недостаточно. Имеются указания на то, что в сыборотке крови у 80 % больных с «легким фермера» были найдены преци- питирующие антитела к антигенам гниющего сена. Патогенная роль антител у больных «легким фермера» в настоящее время оспаривается, так как у большого процента практически здоровых фермеров, имеющих контакт с гнилым сеном, тоже обнаружены преципитирующие антитела.
В ряде исследований было продемонстрировано наличие у больных экзогенным аллергическим альвеолитом реакций гиперчувствительности I и IV типов. Оказалось, что антигены органических пылей могут стимулировать альтернативный путь активизации комплемента. В эксперименте было установлено участие в патогенезе экзогенного аллергического альвеолита реакций, вызванных активированными альвеолярными макрофагами.
Патологоанатомические изменения зависят от стадии заболевания и характеризуются изменениями различной степени выраженности от острой альвеолярно-интерстициальной реакции до диффузного легочного фиброза [Crafton J., Duglas A., 1974J. При остром течении экзогенного аллергического альвеолита гистологически, как правило, отмечаются диффузное воспаление интерстиция, формирование гранулем, реже - облитерирующий бронхиолит, острое воспаление с инфильтрацией полинуклеарами, васкулиты, геморрагии. При иммунофлюоресцентном исследовании фиксированные в легких Сз-фракция комплемента и иммуноглобулины обнаруживаются редко.
Симптомы экзогенного аллергического альвеолита:
Клиническая картина экзогенного аллергического альвеолита зависит от характера течения заболевания: острого, подострого или хронического. Большое значение для диагностики имеет указание на контакты с гниющим сеном или другими источниками органической пыли. При остром течении больные жалуются на появление через 6-8 ч после контакта с антигеном одышки, озноба, лихорадки и кашля с выделением скудной, иногда окрашенной кровью мокроты. У некоторых больных появляется цианоз. Над всей поверхностью легких выслушиваются крепитирующие хрипы. При клиническом исследовании крови может быть обнаружен умеренный лейкоцитоз,. СОЭ незначительно повышена. Изменения легких при рентгенологическом исследовании выражены незначительно. Могут иметься некоторое усилениелегочного рисунка и слабо выраженные мелкоочаговыедиссеминированные тенив легких. При прекращении контакта с аллергизирующими агентами клинические и рентгенологические признаки болезни могут спонтанно исчезать через 3-4 нед, но повторный контакт приводит к подострому течению заболевания, при котором клинические и рентгенологические изменения исчезают значительно медленнее.
При хроническом течении заболевания в клинической картине преобладают признаки дыхательной и сердечной (преимущественно правожелудочковой) недостаточности, одышка и кашель становятся постоянными, а рентгенологически этот процесс сопровождается появлением более выраженного пневмосклероза и прогрессированием диссеминированных очаговых изменений в легких. Иногда появляется рентгенологическая картина, описываемая как «сотовое легкое».
При давности заболевания более 10 лет у 60-70 % больных определяется хронический бронхит, а у 25%-эмфизема легких. Спирографически наиболее часто (в 45% случаев) определяется сочетание обструктивных и рестриктивных нарушений внешнего дыхания, только рестриктивные изменения отмечались у 30 % и чисто обструктивные - у 3% больных. Кроме того, у больных с экзогенным аллергическим альвеолитом были выявлены нарушение проходимости как крупных, так и мелких бронхов, изменение распределения воздуха в легких, снижение диффузной способности легких и повышение давления в легочной артерии.
Диагностика экзогенного аллергического альвеолита:
Для диагностики экзогенного аллергического альвеолита может быть использовано определение преципитирующих антител к антигену, контакт с которым рассматривается как наиболее вероятная причина возникновения заболевания. Высокие титры преципитирующих антител к исследуемому антигену могут свидетельствовать о его этиологической значимости только при наличии клинических, рентгенологических и функциональных, проявлений заболевания, так как у 30-40 % практически здоровых лиц, имеющих контакт с исследуемым антигеном, обнаруживаются преципитирующие антитела в диагностических титрах [ШсИегБоп Н. В. - В кн.: Р15Ьтап А., 1980]. Для уточнения диагноза у отдельных больных проводят провокационную пробу, во время которой больного помещают в ту обстановку, в которой он заболел, и оценивают наступающие при этом изменения состояния больного. Потребность в такой пробе наиболее очевидна в тех случаях, когда в качестве причины альвеолита заподозрена микрофлора, находящаяся в кондиционирующих и увлажняющих воздух установках. Однако эту пробу нужно проводить только в отдельных случаях и с большой осторожностью, так как она может привести к ухудшению состояния больного.
Дифференциальный диагноз нужно проводить с диссеминированными поражениями легких (альвеолярным и метастатическим раком, милиарным туберкулезом, саркоидозом и другими фиброзирующими альвеолитами, аспергиллезом и др.).
Раковое поражение легких отличается от экзогенного аллергического альвеолита отсутствием связи заболевания с воздействием экзогенного аллергена, неуклонным прогрессиро- ванием и большей тяжестью течения заболевания, особенностями рентгенологических признаков поражения легких, отсутствием в сыворотке крови преципитирующих антител к какому-либо аллергену.
Милиарный туберкулез легких отличается от экзогенного аллергического альвеолита отсутствием связи с внешними антигенами, более выраженной тяжестью и длительностью течения заболевания, особенностью рентгенологических проявлений, положительными серологическими и кожными реакциями с туберкулезным антигеном, отсутствием в сыворотке крови повышенных титров преципитирующих антител к какому-либо эк- зоаллергену, который может привести к аллергическому альвеолиту.
Саркоидоз отличается от экзогенного аллергического аль- веолнта, помимо клинико-лабораторных и рентгенологических данных, увеличением прикорневых лимфатических узлов, изменениями суставов, глаз и других органов.
Отличительными особенностями фиброзирующих альвеолитов при системных поражениях соединительной ткани являются васкулит и многоорганность поражения. Бронхопульмональный аспергиллез отличается от экзогенного аллергического альвеолита выраженной эозинофилией и преобладанием обструктивных изменений бронхов с бронхоспазмом над рестриктивными изменениями.
В случаях, когда дифференциальный диагноз особенно труден, например при хроническом течении аллергического альвеолита, производят биопсию легочной ткани с гистологическим исследованием биоптата.
Лечение экзогенного аллергического альвеолита:
Лечение экзогенного аллергического альвеолита начинается с устранения из окружающей больного среды аллергенов, вызвавших заболевание, и прекращения контакта больного с этими аллергенами. При остром, тяжелом и прогрессирующем течении заболевания назначают глюкокортикосте- роиды по 1-1,5 мг преднизолона на 1 кг массы больного в сутки. Кортикостероидные препараты применяют несколько недель с постепенным уменьшением дозы до полной отмены. Длительность лечения кортикостероидными препаратами сугубо индивидуальна и зависит от клинического эффекта и того, как больной переносит эти препараты. При легком течении заболевания какой-либо медикаментозной терапии не требуется и симптомы болезни исчезают после прекращения контакта с аллергеном.
Прогноз аллергического альвеолита зависит от своевременного, возможно более полного и раннего устранения из окружающей больного среды этиологических факторов, вызывающих альвеолит, и активного лечения этого заболевания. При повторном рецидивировании альвеолита и появлении осложнений со стороны легких и сердца прогноз становится неблагоприятным.
Профилактика экзогенного аллергического альвеолита:
Профилактика. Первичная профилактика альвеолита включает высушивание сена, использование открытых силосных ям и хорошее проветривание производственных помещений. Необходимость соблюдения гигиенических норм касается производственных и прочих помещений, в которых содержатся животные и птицы. Требуется тщательный уход за кондиционерами и увлажнителями воздуха.
Вторичная профилактика экзогенного аллергического альвеолита заключается в прекращении контакта с аллергенами лиц, прошедших лечение по поводу аллергического альвеолита. В тех случаях, когда болезнь связана с условиями работы, необходима смена профессии.
К каким докторам следует обращаться если у Вас Экзогенный аллергический альвеолит:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о экзогенного аллергического альвеолита, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
Система комплемента: молекулярные основы и клиническое значение

Система комплемента — комплекс белков, постоянно присутствующих в крови, которые выполняют ряд важнейших функций. На данный момент комплекс насчитывает более трех десятков белковых молекул, среди которых основные белки — С1, С2, …, С9, а также ряд белков-регуляторов. Комплемент принято относить к факторам врожденного иммунитета, выполняющим защитную функцию, однако при определенных обстоятельствах сбой работы системы комплемента может стать звеном патогенеза некоторых заболеваний.
Вначале разберем механизмы работы системы комплемента, после чего рассмотрим их клиническое значение.
Активация системы комплемента
Существует три пути активации данной системы: классический, альтернативный и лектиновый. Все они приводят к ключевому событию: формированию С3-конвертазы.
В классическом варианте комплемент активируется через IgG и IgM, которые формируют иммунные комплексы с антигенами. Комплекс С1 (состоящий из q, r и s субъединиц) связывается с Fc-фрагментом иммуноглобулина. Происходит активация C1, комплекс приобретает протеолитическую активность и активирует C4 и C2. Последние формируют ключевой ферментативный комплекс — С3-конвертазу.
При альтернативном пути активация комплемента происходит без участия антител. Инициируют его поверхностные молекулы микробов и их внеклеточные структуры — например, углеводороды, полисахариды и т. д. С3 в клетках постоянно (даже когда нет активации системы комплемента) претерпевает диссоциацию на С3а и С3b, но в очень малых количествах.
Когда в клетке появляется инициирующий фактор (предположим, это бактерия), С3b связывается с ее поверхностными молекулами. К этому комплексу присоединяются другие молекулы-регуляторы: фактор В, фактор D, пропердин. Так появляется еще одна форма С3-конвертазы.
Лектиновый путь активируется через лектин, связывающий маннозу (фактор врожденного иммунитета — MBL) или группу лектинов Ficolin, которые связывают молекулы на поверхности патогенов — дрожжей, бактерий, паразитов и вирусов. MBL и Ficolin постоянно циркулируют в крови в виде MBL-ассоциированного комплекса (MASP). Когда MASP связывается с вышеназванными молекулами, комплекс претерпевает изменения конформации и активирует уже знакомый путь C4 и C2, что приводит к формированию С3-конвертазы, как и в классическом случае.
Итак, вне зависимости от пути активации различия оканчиваются на формировании ключевого фермента — С3-конвертазы. Последняя расщепляет С3 на два фрагмента: С3а и С3b. Отметим, что С3b выполняет функцию опсонина, С3а — анафилотоксин, способный воздействовать на тучные клетки с высвобождением гистамина.
Однако С3b также способен присоединиться к С3-конвертазе и модифицировать ее, превратив в С5-конвертазу. Этот фермент проделывает то же самое с С5, образуя С5а и С5b. По аналогии, С5а — анафилотоксин, С5b — опсонин.
И снова С5b присоединяется к С5-конвертазе, вовлекая в каскад С6-С9 с формированием т. н. мембраноатакующего комплекса (MAC) [1].
.
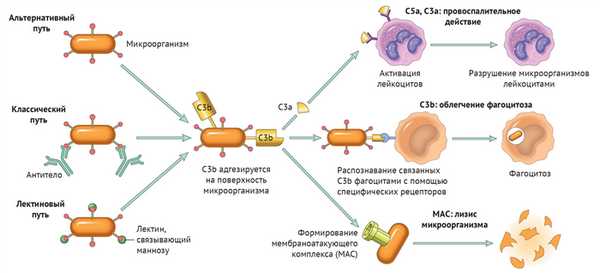
Любой из трех путей активации системы комплемента приводит к формированию С3-конвертазы, которая расщепляет С3-компонент на С3а и С3b. Последний участвует в опсонизации патогенов и облегчает таким образом фагоцитоз, а также инициирует каскад формирования МАС. С3а вместе с С5а (и в меньшей степени С4а) — побочные продукты реакций, которые обладают провоспалительным действием («Robbins Basic Pathology», 10nd ed — 2018, p 76).
Таким образом, систему комплемента можно разделить на три функциональные группы: анафилотоксины, опсонины и мембраноатакующий комплекс — МАС.
.

Анафилотоксины
К ним относятся С3а, С4а и С5а. В целом, их роль сводится к провоспалительному действию, что выражается в повышении проницаемости сосудов микроциркуляторного русла (МЦР), вазоконстрикции. В нейтрофилах, эозинофилах и макрофагах анафилотоксины инициируют респираторный взрыв, в базофилах и тучных клетках — высвобождение гистамина. Кроме того, анафилотоксины регулируют синтез эозинофильного катионного белка, адгезию и хемотаксис эозинофилов [2].
В здоровом организме роль анафилотоксинов по большому счету этим и ограничивается. Однако в случае реакций гиперчувствительности данные молекулы могут стать ключевым звеном патогенеза. Одним из наиболее ярких примеров является бронхиальная астма.
Эпителий и гладкомышечные клетки дыхательных путей содержат рецепторы к анафилотоксинам — C3aR и C5aR. При аллергических реакциях происходит активация системы комплемента, который в свою очередь активирует иммунокомпетентные клетки (ИКК), среди которых — нейтрофилы, эозинофилы, макрофаги, дендритные клетки. Последние под влиянием стимула (например, аллергена) способны в свою очередь вновь активировать комплемент — так замыкается порочный круг.
Помимо поддержания системного воспаления, анафилотоксины ответственны и за ремоделирование дыхательных путей. Под их влиянием происходит гиперплазия мерцательного эпителия и гладкомышечных клеток, неоваскуляризация и фиброзирование паренхимы [3,4].
Также анафилотоксины играют важную роль в патогенезе синдрома системного воспалительного ответа (SIRS). При сепсисе, когда микробы в больших количествах попадают в кровоток, происходит системная активация цитокинов, хемокинов и, конечно, системы комплемента. Повышение концентрации анафилотоксинов при сепсисе, к слову, считается неблагоприятным прогностическим фактором [5].
В случае с сепсисом и SIRS анафилотоксины становятся звеном патогенеза. Наибольшая роль в данной ситуации принадлежит С5а. Предположительно, избыточный синтез этого белка приводит к дисфункции нейтрофилов, апоптозу лимфоидных клеток, способствует развитию кардиомиопатий, ДВС-синдрома и полиорганной недостаточности.
В связи с этим постепенно разрабатываются препараты, ингибирующие синтез С5а. На биологических моделях было показано, что блокада данного фактора действительно улучшает прогноз при сепсисе и SIRS [6].
МАС
Данный комплекс может формироваться на поверхности грамотрицательных бактерий и напрямую участвовать в их уничтожении (более всего действие МАС направлено против Neisseria). Описаны также случаи образования МАС на поверхности грамположительных бактерий, паразитов и мембране собственных клеток. Состоит он из последних 5 белков комплемента: С5 — С9.
Специфического рецептора, инициирующего образование комплекса, нет. Белки комплемента адгезируются на наружной поверхности клеточной стенки бактерии, после чего комплекс приобретает ферментативную активность и перфорирует мембрану. Нарушается концентрация ионов и воды — клетка погибает [7].
Недавние исследования показывают, что у МАС имеется и провоспалительное — «сублитическое» — действие. При образовании комплекса на поверхности нейтрофилов или макрофагов происходит локальная утечка провоспалительных медиаторов, а в случае атаки мезангиальных клеток и микроглии — высвобождение цитокинов. Также МАС вызывает образование инфламмасомы путем активации Nod-подобного рецептора [8].
Не допустить образование МАС на собственных клетках помогает рецептор CD59. Генетический дефект CD59 приводит к появлению пароксизмальной ночной гемоглобинурии [7]. А поскольку МАС способен поддерживать системное воспаление, он также вовлекается в патогенез различных воспалительных заболеваний (см. ниже).
Возрастная макулярная дегенерация
Возрастная макулярная дегенерация (ВМД) — основная причина слепоты у пациентов старше 50 лет в цивилизованных странах. В макуле (как и во всей сетчатке) происходят дистрофически-дегенеративные процессы, вследствие чего нарушается способность фокусировать свет в определенной точке, в результате исчезает ясность и четкость зрения. Существует две формы ВМД: влажная (быстро прогрессирующая, экссудативная) и сухая (атрофическая форма). Иногда выделяют рубцовую форму, которая скорее является завершающей стадией заболевания.
Одним из ключевых звеньев этиопатогенеза ВМД является дефект фактора комплемента H — одного из основных регуляторов системы комплемента. Функция его заключается в ингибировании С3-конвертазы (если точнее — является кофактором для протеазы, которая осуществляет катализ С3-конвертазы). Существует несколько форм гена фактора Н, один из наиболее известных — Y402H, который существенно повышает риск развития ВМД. Есть и другие, более редкие варианты [9].
В случае влажной формы ВМД происходит неоваскуляризация сетчатки — аномальное разрастание сосудов под действием VEGF (фактор роста эндотелия сосудов). В опытах было показано, что высвобождение VEGF и неоваскуляризация невозможны без действия MAC [10].
Также в обоих вариантах ВМД важная роль приписывается локальному хроническому воспалению под воздействием системы комплемента. Установлена взаимосвязь между активацией комплемента (особенно по альтернативному пути) и риском развития ВМД [10].
Разумеется, эти данные невозможно было проигнорировать, вследствие чего начали разрабатывать ингибиторы факторов системы комплемента для предотвращения ВМД. На данный момент существуют и моноклональные антитела (анти-фактор D, Экулизумаб), и рекомбинантный фактор Н, и антагонисты различных белков системы комплемента, но пока ни один из них не рекомендован для лечения ВМД [10].
Болезнь Альцгеймера
Воспалительный процесс в нервной ткани сегодня рассматривается как основное патогенетическое звено в развитии БА и других нейродегенеративных заболеваний. Также существуют данные, что прием противовоспалительных препаратов (НПВС) существенно снижает риск развития БА [11].
Однако помимо воспалительных цитокинов, важная роль в развитии локального воспаления принадлежит и системе комплемента. В ликворе пациентов с болезнью Альцгеймера обнаруживается повышенная концентрация С3 в сравнении со здоровыми пациентами. Также активность системы комплемента у пациентов с БА существенно выше [12].
Наследственный ангионевротический отек
НАО — редкое и потенциально фатальное заболевание, этиологическим фактором которого является генетический дефект (НАО 1 типа) или дисфункция (НАО 2 типа) ингибитора С1-компонента комплемента (iС1). В норме iС1 — регулятор, который блокирует весь путь активации системы комплемента. При его дефиците происходит гиперактивация начальных компонентов комплемента, следствием чего является повышение проницаемости сосудов, что приводит к различным отекам.
Проявляется НАО в основном в возрасте после 20 лет отеками конечностей, реже — шеи и лица, которые длятся 1-3, максимум — 7 дней, после чего самостоятельно проходят. Сначала пациент может их даже не замечать, однако со временем частота и выраженность отеков нарастают, может происходить отек слизистой ЖКТ, что проявляется болью, тошнотой, иногда — клиникой острого живота. Наиболее опасен отек гортани, который может сопровождаться асфиксией.
Но ситуация с лечением не так уж и плоха. Ингибитор С1 можно вводить внутривенно для профилактики приступов, для купирования — подкожно [13,14].
Пароксизмальная ночная гемоглобинурия
ПНГ — редкое заболевание, в основе которого лежит клональная экспансия гемопоэтических клеток с мутацией PIGA. Результатом данной мутации является недостаточность ГФИ-заякоренных белков, а именно — CD55 и CD59 (гликозилфосфатидилинозитол или ГФИ-якорь — гликопептид, присоединяющийся к белкам в процессе посттрансляционных модификаций).
Проявляется заболевание гемолитической анемией, костномозговой недостаточностью, тромбофилией.
В норме CD55 ингибирует С9-компонент и предотвращает формирование МАС, а CD59 — ингибирует образование С3-конвертазы и предотвращает протеолиз С3-компонента.
Патогенез начинается с внутрисосудистого гемолиза, который происходит ввиду дефицита CD55. На поверхности эритроцитов с мутацией формируется С3-конвертаза, которая запускает дальнейший синтез МАС. Образование последнего ничего не сдерживает из-за дефекта CD59. МАС перфорирует мембрану эритроцита, и клетка погибает.
Все клинические проявления — гемоглобинурия, анемия (апластическая), тромбоз/эмболия, гастроинтестинальные и неврологические симптомы, так или иначе, являются следствием данного механизма [15,16].
В качестве лечения используется трансплантация гемопоэтических клеток, гемотрансфузии, симптоматическая и поддерживающая терапия. Также достаточно перспективным является использование ингибиторов системы комплемента, например, Экулизумаба (Солириса), который, по данным некоторых публикаций, устраняет все значимые симптомы заболевания [15].
Однако по данным Кохрейна, доказательную базу Экулизумаба нельзя назвать достаточной [17].
Атипичный гемолитико-уремический синдром
Для АГУС характерными симптомами являются гемолитическая анемия, тромбоцитопения и почечная недостаточность с уремией. Этиологией данного заболевания могут быть различные генетические дефекты регуляторов системы комплемента.
Зачастую это мутация CFH, отвечающего за экспрессию уже знакомого читателю фактора Н. Таких мутаций существует более 80, они могут быть наследственными или спорадическими. Также встречаются мутации генов, ответственных за фактор В, С3-компонент комплемента, тромбомодулин и др. [18].
В лечении АГУС также может быть использован экулизумаб [19], однако и здесь ощущается нехватка доказательной базы. В основном же терапия АГУС осуществляется с помощью гемотрансфузий/плазмообмена, диализа, почечной трансплантации — и снова ни одна из названных процедур не способна избавить пациента от болезни [18]. Таким образом, наиболее перспективна разработка ингибиторов системы комплемента и проведение РКИ с их участием.
Помимо перечисленных заболеваний, система комплемента принимает непосредственное участие в патогенезе аутоиммунных кожных заболеваний [20], воспалительных заболеваний почек [21], разнообразных аллергических и аутоиммунных заболеваний.
Разработка ингибиторов комплемента уже сегодня является перспективным направлением, а некоторые препараты данной группы (экулизумаб) уже могут применяться в ряде случаев.
Читайте также:
- Рефракционные нарушения у детей
- Базальный тонус сосудов. Растяжимость сосудов. Трансмуральное давление. Мобилизация крови из вен.
- Рекомендации по анализу рентгенограммы плечевого сустава в косой ПЗ проекции (метод Грэши)
- Физиология образования пептической язвы. Методы лечения пептической язвы
- Бронхит курильщика: причины, симптомы и лечение
