Нервная система при нарушении обмена гликопротеинов (маннозидозе, фукозидозе, галактосиалидозе)
Добавил пользователь Алексей Ф. Обновлено: 02.02.2026
О мукополисахаридозах (МПС), редких наследственных заболеваниях обмена веществ из группы лизосомных болезней накопления, в последние годы говорят часто. Еще недавно схожесть симптоматики МПС с другими заболеваниями и недостаточная лабораторная диагностика часто приводили к ошибочным диагнозам и неадекватному лечению. Вместе с тем ранняя диагностика мукополисахаридозов и правильная терапия во многом определяют прогноз заболевания и перспективы пациента.
Основа патогенеза МПС — накопление в органах и тканях патологического субстрата, а именно гликозаминогликанов (ГАГ), или мукополисахаридов, которые являются базовым компонентом соединительной ткани. Избыточное накопление ГАГ приводит к дисфункции клеток, органов и тканей и вызывает разнообразные клинические проявления. МПС относится к мультисистемным заболеваниям, поэтому дифференциальная диагностика данной нозологии актуальна для врачей любых специальностей, особенно педиатрического профиля.

Опытом правильной диагностики МПС (на примере синдрома Хантера как наиболее распространенного типа мукополисахаридоза) поделилась старший научный сотрудник лаборатории редких наследственных болезней у детей Центра редких болезней ФГАУ «Национальный медицинский исследовательский центр здоровья детей» Минздрава России, кандидат мед. наук Татьяна Подклетнова.
Объективная лабораторная диагностика
Основа диагностики — клинические проявления заболевания. Все типы МПС имеют общие внешние клинические признаки, которые могут и должны вызвать у врача на амбулаторном приеме настороженность в отношении МПС: гаргоилизм, костные изменения, органомегалия и т. д.
Лабораторная диагностика включает три этапа.
1. Количественная и качественная оценка экскреции ГАГ в моче. Неспецифический тест, который с высокой степенью вероятности позволяет заподозрить у пациента МПС, не дает, однако, четкой информации о типе заболевания.
При легких формах заболевания избыточное количество ГАГ в моче может не определяться, следовательно, тест будет ложно-отрицательным. На основании только этого лабораторного анализа ставить окончательный диагноз нельзя!
2. Энзимодиагностика. Измерение активности фермента в лейкоцитах крови. При МПС любого типа снижается уровень определенного фермента в лейкоцитах или плазме крови. В частности, при МПС 2-го типа снижается уровень идуронат-2-сульфатазы в плазме (норма: 250-620 nM/mg/h); МПС 2-го типа: 0-20 nM/mg/h); при МПС 1-го типа — α-L-идуронидазы в периферической крови (норма: 61-176 nM/mg/h; МПС 1-го типа: 0-18 nM/mg/h) и т. д. Однако существует ряд заболеваний, при которых уровень ферментов в крови также может снижаться, например, множественная сульфатазная недостаточность. Необходим третий этап.
3. Молекулярно-генетическая диагностика. Наличие мутаций в том или ином гене дает окончательный ответ и возможность установить объективный диагноз. Так, МПС 1-го типа обусловлен мутацией в гене IDUA, МПС 2-го типа — мутацией в гене IDS и т. д.
Существуют и другие методы диагностики, которые обязательно должны быть предложены семьям, планирующим рождение ребенка, но у которых уже есть случаи МПС среди близких родственников. Речь о пренатальной и предимплантационной диагностике.
Пренатальная диагностика проводится между 10-й и 12-й неделями уже наступившей беременности. Выполняется определение ферментной активности в ворсинах хориона, проводится молекулярно-генетическая диагностика плода. Надежность метода достигает 99 %. У родителей есть возможность при выявлении патологии прервать беременность на малом сроке. Или же принять осознанное решение о рождении ребенка с генетическим заболеванием. В этом случае ранняя пренатальная диагностика дает возможность начать адекватное лечение на самом раннем этапе, что, естественно, влечет за собой совершенно иные, более благоприятные прогнозы относительно качества и продолжительности жизни ребенка.
Предимплантационная диагностика проводится перед искусственным оплодотворением и позволяет избежать рождения ребенка с данной генетической патологией.
Шаг 1. Дифдиагностика с другими видами мукополисахаридозов
В современной классификации существуют 7 основных типов мукополисахаридозов. Наиболее часто (помимо МПС 2-го типа) встречаются МПС 1-го, 3-го, 4-го, 6-го типов.
Особенности МПС 1-го типа (синдром Гурлера, синдром Гурлера — Шейе, синдром Шейе):
- гипертрофия десен, редкие мелкие зубы, макроглоссия;
- частые респираторные инфекции, отиты, бронхиты;
- тугоухость;
- помутнение роговицы, пигментная дегенерация сетчатки, глаукома;
- низкий рост, кифосколиоз, деформация грудной клетки, врожденный вывих бедра, контрактуры крупных и мелких суставов;
- синдром запястного канала;
- цервикальный стеноз;
- шумное носовое дыхание, гипертрофия аденоидов и миндалин, синдром обструктивного апноэ сна;
- недостаточность митрального и аортального клапанов, кардиомиопатия;
- задержка психомоторного развития, регресс навыков;
- экскреция гепарансульфата и дерматансульфата с мочой.
МПС 1-го типа имеет аутосомно-рецессивный тип наследования, т. е. заболевание одинаково свойственно лицам мужского и женского пола, в то время как МПС 2-го типа — мужское заболевание, девочки болеют крайне редко. Помутнение роговицы при МПС 2-го типа практически не встречается либо очень «нежное», визуально не видное. При МПС-1 помутнение роговицы видно визуально. Костные деформации и проявления при МПС-1 превалируют, ярче выражены, быстрее прогрессируют.
Особенности МПС 3-го типа (синдром Санфилиппо):
- болеют лица мужского и женского пола;
- ведущим является поражение ЦНС: интеллектуальный дефицит, нарушения поведения и сна, двигательные нарушения, эпилепсия;
- высокий рост, кифосколиоз, деформация грудной клетки, контрактуры крупных и мелких суставов менее выраженные;
- частые респираторные инфекции, отиты, бронхиты;
- тугоухость;
- шумное дыхание, гипертрофия аденоидов и миндалин, синдром обструктивного апноэ сна;
- недостаточность митрального и аортального клапанов, кардиомиопатия;
- экскреция гепарансульфата с мочой.
Наиболее яркое отличие МПС 3-го типа — более выраженная неврологическая симптоматика по сравнению с другими типами МПС, для которых характерен интеллектуальный дефицит.
Например, при МПС-1 и МПС-2 иногда бывает и так, что ребенок изначально развивается в соответствии с возрастом, лишь затем появляются симптомы задержки и происходит регресс. В случае МПС-3 ребенок с раннего детства имеет прогрессирующую задержку развития, нарушения поведения, к которым позже присоединяются другие неврологические проявления: двигательные нарушения, судороги. Что касается соматических проявлений, то и здесь есть отличия: дети с МПС 3-го типа имеют достаточно высокий рост (другим типам свойственна низкорослость); при этом типе мукополисахаридоза не бывает цервикального стеноза и синдрома запястного канала.
Особенности МПС 4-го типа (синдром Моркио):
- изменения черт лица по типу гаргоилизма отсутствуют;
- частые респираторные инфекции, отиты, бронхиты;
- сохранный интеллект;
- тугоухость;
- помутнение роговицы, пигментная дегенерация сетчатки;
- низкий рост, кифосколиоз, килевидная деформация грудной клетки, грубые деформации крупных и мелких суставов при отсутствии контрактур;
- цервикальный стеноз;
- шумное дыхание, гипертрофия аденоидов и миндалин, синдром обструктивного апноэ сна;
- недостаточность митрального и аортального клапанов, кардиомиопатия;
- экскреция кератансульфата с мочой.
Примечательно, что детям с МПС 4-го типа не присущ гаргоилизм. Кроме того, особенностью этого типа МПС являются специфические костные деформации: килевидная деформация грудной клетки, грубая деформация позвоночника, вальгусная деформация конечностей. МПС-4 отличает и абсолютно сохранный интеллект пациента (в отличие от МПС-1 или МПС-2, при которых есть пациенты как с высоким уровнем интеллекта, так и с достаточной грубой задержкой интеллектуального развития).
При ранней постановке диагноза и правильном ведении болезни пациенты с синдромом Моркио могут быть успешно адаптированы в обществе.
Особенности МПС 6-го типа(синдром Марото — Лами):
- гипертрофия десен, редкие, мелкие зубы, макроглоссия;
- частые респираторные инфекции, отиты, бронхиты;
- сохранный интеллект;
- тугоухость;
- помутнение роговицы, пигментная дегенерация сетчатки;
- низкий рост, кифосколиоз, деформация грудной клетки, врожденный вывих бедра, контрактуры крупных и мелких суставов;
- синдром запястного канала;
- цервикальный стеноз;
- шумное дыхание, гипертрофия аденоидов и миндалин, синдром обструктивного апноэ сна;
- недостаточность митрального и аортального клапанов, кардиомиопатия;
- экскреция дерматансульфата с мочой.
Этот тип МПС имеет всю симптоматику, характерную для других типов мукополисахаридоза. Из-за видимого помутнения роговицы, грубых костных деформаций, выраженных контрактур суставов МПС 6-го типа похож на тяжелые формы МПС-1 и МПС-4.
Важно отметить, что при данном типе МПС, как и при МПС-4, пациенты имеют сохранный интеллект и при ранней диагностике заболевания, своевременном начале ферментозаместительной терапии могут быть социализированы в обществе.
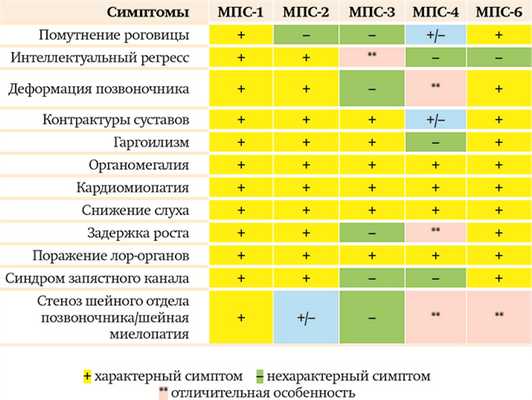
Таблица может помочь врачу на амбулаторном приеме предположить МПС, чтобы потом подтвердить/ опровергнуть диагноз лабораторными исследованиями
Шаг 2. Исключение других болезней накопления
Ряд болезней накопления имеет схожие с МПС внешние клинические признаки. Например, симптоматика альфа-маннозидоза включает:
- грубые черты лица;
- изменения скелета по типу множественного дизостоза;
- поясничный лордоз;
- диффузную мышечную гипотонию;
- шумное носовое дыхание;
- умеренную гепатоспленомегалию;
- нейросенсорную тугоухость;
- пупочную, паховую грыжи;
- умственную отсталость различной степени;
- частые респираторные инфекции, бронхиты, отиты.
Но для альфа-маннозидоза ведущим клиническим признаком является высокая степень нейросенсорной тугоухости, наличие признаков периферической полинейропатии (для МПС-1, МПС-2, МПС-6 характерен только синдром запястного канала), гуморальные и клеточные иммунодефициты. У пациентов с МПС, несмотря на то, что они склонны к частым респираторным инфекциям, иммунодефициты отсутствуют. Но главное отличие в результатах лабораторных исследований. При альфа-маннозидозе отмечается снижение активности альфа-маннозидазы в лейкоцитах. Накопление маннозосодержащих олигосахаридов. ГАГ в моче отсутствует. По результатам ДНК-диагностики заболевание обусловлено мутациями в гене MAN2B1.
Муколипидоз 2-го и 3-го типа также имеет симптомы, которые «роднят» его с разными типами МПС. Муколипидоз 2-го типа имеет более тяжелое течение и клинические проявления практически с первых месяцев жизни, быстрое прогрессирование. Муколипидоз 3-го типа мягче, отличается более поздним проявлением симптоматики и чуть меньшей скоростью прогрессирования. При этом вне зависимости от типа муколипидозу свойственны общие с мукополисахаридозом симптомы:
- грубый гаргоилизм;
- низкорослость;
- помутнение роговицы;
- тугоподвижность суставов;
- интеллектуальный дефицит;
- паховые и пупочные грыжи;
- органомегалия и др.
Отличить одно заболевание от другого помогает лабораторная диагностика. При муколипидозе 2-го типа отмечается повышение уровня лизосомных ферментов (N-ацетилгексозаминидазы) в плазме и низкий уровень в лейкоцитах крови. При муколипидозе 3-го типа — резкое снижение активности N-ацетилглюкозамин-1-фосфотрансферазы в лейкоцитах и культуре кожных фибробластов (ККФ). В отличие от МПС муколипидоз обусловлен мутациями в гене GNPTAB.
Фукозидоз — очень редкая патология, которая имеет общие с МПС симптомы: огрубление черт лица, низкорослость, органомегалию, грыжи, нейросенсорную тугоухость, контрактуры крупных и мелких суставов, помутнение роговицы и т. д.
Как и другие болезни накопления, фукозидоз может протекать с разной скоростью прогрессирования. При тяжелой форме болезни клинические проявления возникают уже на первом году жизни, быстро прогрессируют, приводя к тяжелой инвалидизации и раннему летальному исходу. При мягком течении клинические симптомы появляются в конце первого десятилетия, медленнее прогрессируют.
Главной отличительной особенностью фукозидоза являются специфические кожные проявления — ангиокератома, ангидроз. Наличие ангиокератомы вкупе с характерной для МПС симптоматикой дает основания предполагать фукозидоз. Окончательное слово за лабораторной диагностикой. При фукозидозе отмечается резкое снижение активности α-L-фукозидазы и ККФ, накопление гликолипидов и гликопротеинов в клетках. Молекулярно-генетическая диагностика указывает на мутации в гене FUCA1.
GM1-ганглиозидоз , в отличие от предыдущего заболевания, широко распространен среди болезней накопления. Несмотря на некоторые схожие с МПС симптомы (гаргоилизм, низкорослость, гиперплазия десен, костные деформации, органомегалия, тугоподвижность суставов и т. д.), GM1-ганглиозидоз имеет яркие отличительные особенности. В частности, ему свойственны макулодистрофия по типу «вишневой косточки», поражение почек, быстро прогрессирующее поражение ЦНС, эпилепсия, грубая задержка психомоторного развития, ангиокератома. По результатам лабораторной диагностики отмечается резкое снижение активности β-галактозидазы в лейкоцитах и ККФ. Заболевание обусловлено мутациями в гене GLB1. Болезнь практически всегда имеет тяжелое течение и неблагоприятный исход в первые годы жизни.
Множественная сульфатазная недостаточность — заболевание, которое легко спутать с МПС 2-го типа, если не выполнить объективную лабораторную диагностику. Клиническая симптоматика заболевания почти идентична симптоматике МПС-2, но результаты лабораторных исследований показывают принципиальные отличия. Так, при множественной сульфатазной недостаточности в крови снижен уровень не только идуронат-2-сульфатазы, но и других ферментов, в частности арилсульфатаз А, В, С. ДНК-диагностика показывает мутации в гене SUMF1.
Шаг 3. Исключение иных наследственных заболеваний или синдромальных состояний, схожих с болезнями накопления, в том числе МПС
Микроделеция Xq28, включающая ген IDS. Заболевание обусловлено делецией в хромосомной области, которая затрагивает ген IDS. Мутации этого гена лежат в основе МПС 2-го типа, поэтому неудивительно, что клинические признаки микроделеции Xq28 практически совпадают с симптомами МПС-2, включая высокий уровень ГАГ в моче. Примечательно, что ферментозаместительная терапия, назначаемая обычно при МПС-2, в этом случае также может давать положительную динамику. Но формально это все-таки не МПС-2, поскольку заболевание вызвано делецией, затрагивающей ген IDS, а не мутацией в нем.
Синдром Беквита — Видемана. Достаточно распространенный синдром, имеющий схожую с МПС симптоматику: интеллектуальный дефицит, органомегалию, грыжи. В то же время молекулярно-генетическое исследование показывает совершенно отличную от МПС картину: это синдромальное состояние, обусловленное изменениями в регионе 11р15, включающем гены факторов роста и гены-супрессоры опухолевого роста.
Х-сцепленная демиелинизирующая лейкодистрофия со спондилоэпифизарной дисплазией. Для этого заболевания характерны клинические признаки, схожие с симптоматикой болезней накопления: гаргоилизм, изменения скелета по типу множественного дизостоза (сколиоз, воронкообразная деформация грудной клетки), интеллектуальный дефицит, вальгусная деформация нижних конечностей, рецидивирующие отиты, тугоухость и другие. При этом уровень ГАГ в моче в пределах нормы, отсутствует дефицит лизосомных ферментов. Молекулярно-генетическое исследование указывает на специфическую мутацию в гене AIFM1, что и позволяет установить верный диагноз.
Шаг 4. Дифдиагностика с заболеваниями, имеющими схожую с МПС клиническую симптоматику
И, наконец, необходимо исключить заболевания, под которые маскируются МПС: ювенильный ревматоидный артрит; детский церебральный паралич; гипертензионно-гидроцефальный синдром; периферическая нейропатия; гепатит неясного генеза; гепатолиенальный синдром; врожденный порок сердца; хронический отит, аденоидит, тонзиллит; хронический обструктивный бронхит; муковисцидоз; бронхиальная астма; гипотиреоз; иммунодефицитное состояние; помутнение роговицы.
Надо отметить, что часть этих диагнозов в контексте МПС лишь симптомы, например, помутнение роговицы, порок сердца, аденоидит или отит. Гепатит неясного генеза — симптом органомегалии, увеличения печени; муковисцидоз, хронический обструктивный бронхит — проявления поражения нижних дыхательных путей у пациентов с МПС.
Поэтому за постановкой любого диагноза должен стоять тщательный сбор анамнеза, включая неонатальный и семейный, а также объективная лабораторная диагностика. В случае с МПС этот принцип исключительно важен. Вот лишь пару примеров. Раньше детям с МПС часто выставляли детский церебральный паралич как окончательный диагноз. И это на фоне отсутствия отягощенного неонатального анамнеза, хронической гипоксии, повышения мышечного тонуса, позотонических и патологических рефлексов, характерных для ДЦП.
К диагнозам, которые прежде часто «подменяли» истинный, относится и гипотиреоз. Отчасти заболевание действительно напоминает МПС (крупный язык, задержка психоречевого развития, увеличенная щитовидная железа по данным УЗИ могут навести на мысль о болезни накопления). Однако у пациентов с МПС увеличение щитовидной железы обусловлено отложением ГАГ в тканях органа, которое при этом не дает никакого гормонального дисбаланса.
Гликогенозы ( Болезнь накопления гликогена , Гликогеновая болезнь )
Гликогенозы - наследственные болезни, в основе которых лежит генетический дефект производства ферментов, принимающих участие в метаболизме углеводов. Характерный общий признак - чрезмерное отложение гликогена в миоцитах, гепатоцитах и других клетках организма. Гликогенозы проявляются симптомами гипогликемии, гепатомегалии, мышечной слабости, печеночной, сердечной, дыхательной и почечной недостаточности. Диагностика включает биохимический анализ крови, морфологическое исследование биопсийного материала мышц и печени, определение активности ферментов, молекулярно-генетические тесты. Лечение основано на лечебном питании, медикаментозной коррекции метаболических расстройств, в ряде случаев требуются операции.
МКБ-10

Общие сведения

Причины гликогенозов
Единственным фактором, провоцирующим развитие гликогеновых болезней, является генетический дефект, в результате которого возникает недостаточность определенного фермента, участвующего в обмене глюкозы. Все гликогенозы за исключением IX типа наследуются по аутосомно-рецессивному принципу. Это означает, что мутационный ген расположен на хромосоме, не сцепленной с полом, проявление заболевания возможно только при наследовании мутаций от каждого из родителей - при наличии двух рецессивных измененных генов в аллели. Если дефектным является один ген из пары, то другой - доминантный, нормальный - обеспечивает организм достаточным количеством фермента. Человек при этом становится носителем гликогеноза, но не болеет. В парах, где оба партнера - носители, вероятность рождения больного ребенка составляет 25%. При гликогенозе типа IX патологический ген локализован в половой X-хромосоме. Гемизиготные мужчины имеют пару XY, всегда больны гликогенозом, передают дефект всем своим дочерям. Вероятность передачи мутации от женщины-носительницы детям обоих полов составляет 50%.
Патогенез
Патогенетическая основа всех гликогенозов - невозможность процесса синтеза и распада гликогена, его накопление в тканях. Гликоген является единственным резервным полисахаридом организма, своеобразным энергетическим «депо» - после приема пищи излишек глюкозы превращается в гликоген печени и мышц, затем постепенно расщепляется обратно до глюкозы. Благодаря этому механизму поддерживается стабильный уровень сахара в плазме крови, клетки и ткани организма непрерывно обеспечиваются энергией. При агликогенозе (0 тип) - отсутствует фермент гликогенсинтетаза, ответственная за производство гликогена. Пациенты страдают от тяжелой гипогликемии.
При гликогеновых болезнях типов 1-11 возникает генетически обусловленная недостаточность какого-либо фермента, катализирующего цепочку глюкоза-гликоген-глюкоза. 1 тип характеризуется дефектом глюкозо-6-фосфатазы и глюкозо-6-фосфаттранслоказы, 2 тип - альфа-1,4-глюкозидазы, 3 тип - амило-1,6-глюкозидазы, 4 тип - D-1,4-глюкано-α-глюкозилтрансферазы, 5 тип - гликогенфосфорилазы миоцитов, 6 тип - крахмалфосфорилазы гепатоцитов, 7 тип - фосфоглюкомутазы, 8 тип - фосфофруктомутазы, 9 тип - киназы фосфорилазы гепатоцитов. Из-за сниженной активности или полного отсутствия фермента гликоген накапливается в мышцах, печени, редко - в других тканях. Изменяется структура и функциональность органов, развиваются различные формы органной недостаточности.
Классификация
С учетом ферментативного дефекта и особенностей клинических проявлений выделяют 12 вариантов гликогенозов, от 0 до XI. Кроме того, описаны случаи комбинированных типов, когда определяется дефицит двух ферментов, а также случаи неидентифицируемых типов, при которых выделить ферментный дефект не удается. Согласно ведущему патогенетическому механизму гликогеновые болезни подразделяются на три больших группы:
- Печеночные. Включают гликогенозы всех типов, кроме II, V и VII. Гликоген откладывается преимущественно в гепатоцитах. Характерна гепатомегалия, гипогликемия через 2 часа после поступления углеводов. При I типе заболевания также поражаются почки, при III и IV типах развиваются миопатии.
- Мышечные. В данную группу входят болезни типов VII и V. Изменена ферментативная активность в мышечной ткани, нарушено энергообеспечение мышц. Типичные симптомы - миалгии, судороги.
- Смешанные. Гликогеноз II типа отличается тем, что в патологический процесс вовлекаются все гликогенсодержащие ткани. Гликоген скапливается в лизосомах и цитоплазме клеток. Страдают многие органы, возрастает риск смерти по причине сердечной или дыхательной недостаточности.
Симптомы гликогенозов
Агликогеноз развивается в периоде новорожденности либо раннего детства. Низкое содержание гликогена в печени проявляется резко выраженной гипогликемией натощак. Наблюдается заторможенность, глубокий сон, потеря сознания, бледность кожи, тошнота, рвота, судороги ночью и в утренние часы. Внешне пациенты низкорослые, имеют пониженную плотность костной ткани, повышенный риск переломов. При болезни Гирке (I тип) симптомы дебютируют в первые 4 месяца жизни. Характерен плохой аппетит, приступы рвоты, недостаток веса, увеличение печени, диспропорциональность строения тела - круглое лицо, большой живот, тонкие конечности.
Клинические признаки болезни Помпе (II тип) определяются в течение нескольких недель после рождения. Дети вялые, малоподвижные, с ослабленным сосательным рефлексом, сниженным аппетитом. Гепатомегалия изменяет пропорции тела - живот увеличивается, руки и ноги остаются тонкими. Поражается сердце, легкие, нервная система. Высок риск сердечной и легочной недостаточности. У пациентов с болезнью Форбса (III тип) симптомы слабой и умеренной выраженности. На первый план выходит гипогликемия постабсорбционного периода, гепатомегалия, накопление подкожного жира в области туловища. Ведущие симптомы болезни Андерсена (IV тип)- мышечная слабость, плохая переносимость физической нагрузки, судороги.
Болезнь Томсона представлена гепатомегалией, нистагмом, атаксией, прогрессирующими неврологическими нарушениями с мышечной гипертонией, децеребрацией. Типичные проявления болезни Мак-Ардля (V тип) - боли, спазматические сокращения, чрезмерная утомляемость и слабость мышц даже после незначительной нагрузки. Иногда тонические судороги переходят в генерализованные, что сопровождается общей скованностью. Проявления болезни Герса (VI тип) менее выраженные, пациенты способны переносить легкие и умеренные физические нагрузки, не испытывая дискомфорта. Дополнительно обнаруживаются признаки поражения печени - угнетение аппетита, рвота, тошнота, боли в правом боку.
Течение болезни Таруи (VII тип) включает непереносимость физической нагрузки, сопровождающуюся тошнотой и рвотой, болезненными спазмами мышц. Поступление глюкозы не повышает способность совершать физические действия. После употребления пищи симптомы обостряются. Наиболее мягкое течение свойственно болезни Хага (IX тип). У больных детей увеличивается печень, задерживается моторное развитие и рост, формируется мышечная гипотония. С возрастом симптомы самостоятельно редуцируются. Гликогеноз X типа крайне редок, характеризуется гепатомегалией, при длительном течении снижается переносимость физических нагрузок. Гликогеноз XI типа сопровождается значительным увеличением печени, задержкой роста и физического развития, рахитом. У подростков нередко наблюдается сокращение объема печени, ускорение роста.
Осложнения
При разновидностях гликогенозов, сопровождающихся гипогликемией, существует риск развития гипогликемической комы. Как правило, выраженное снижение уровня глюкозы в крови происходит при пропуске приемов пищи, особенно после ночного сна (пропуск завтрака). Пациенты испытывают головокружение и судороги, теряют сознание. Тяжелые формы мышечных гликогенозов при продолжительном течении и отсутствии терапии приводят к дистрофии скелетных мышц, сердечной недостаточности. Осложнением некоторых печеночных гликогенозов является цирроз печени.
Диагностика
При подозрении на гликогеноз ребенку рекомендуется консультация врача-генетика, педиатра, гастроэнтеролога, гепатолога. В первую очередь специалист собирает анамнез, проводит клинический опрос и осмотр. Поскольку заболевание передается аутосомно-рецессивным способом, семейные случаи выявляют редко. Распространены жалобы на слабость, апатичность ребенка, бледность и желтушность кожи, отказ от еды или повышенный аппетит, трудности пробуждения утром, тремор, судороги. При осмотре врач отмечает увеличение размера печени, выпирание живота, задержку роста, мышечную гипотрофию, специфическое отложение подкожной жировой клетчатки, ксантомы. Лабораторные и инструментальные методы позволяют подтвердить диагноз гликогеноза, исключить врожденный сифилис, токсоплазмоз, цитомегалию, патологии печени, болезнь Гоше, миотонию, прогрессирующую мышечную дистрофию, амиотрофии. К обязательным методам исследований относят:
- Биохимическое исследование крови. По результатам анализа обнаруживается гипогликемия с уровнем глюкозы натощак 0,6-3 ммоль/л, лактатацидоз с концентрацией молочной кислоты 3-10 ммоль/л (кроме гликогеноза 4 типа). Дополнительно выявляется увеличение показателей триглицеридов, общего холестерина, ЛПНП, ЛПОНП, мочевой кислоты, печеночных ферментов.
- Исследование биоптата печени, мышц. При изучении ткани печени наиболее распространенными характеристиками являются повышенное количество гликогена и его глыбчатое распределение в цитоплазме гепатоцитов, иногда - в вакуолизированных ядрах. Определяется выраженная белковая и/или крупно- и мелкокапельная жировая дистрофия гепатоцитов, их некроз, ограниченные очаги фиброза в местах гибели клеток. Возможны признаки цирроза. При мышечных типах болезней исследуется мышечный биоптат, в котором просматриваются субсарколеммальные накопления структурно нормального гликогена.
- Исследование ферментов. Активность ферментов изучается в культуре кожных фибробластов, биоптате мышечной и печеночной ткани, лейкоцитах. При гликогенозах с хроническим медленно прогрессирующим течением снижение функциональности фермента легкое или умеренное. При тяжелом течении фермент отсутствует либо его активность минимальна.
- УЗИ брюшной полости. Отмечается выраженное увеличение печени, особенно левой ее доли. Характерна гиперэхогенность и структурная диффузная неоднородность паренхимы (множественные мелкие гиперэхогенные эхосигналы, распределенные равномерно). В дистальных отделах паренхимы прохождение ультразвука ослаблено. Возможно обнаружение структурно разнообразных печеночных аденом, увеличение размеров почек, селезенки и поджелудочной железы.
Комплекс диагностических исследований подбирается индивидуально в зависимости от возраста пациента и предполагаемого типа гликогеновой болезни. Может потребоваться молекулярно-генетическая диагностика (секвенирование генов с целью выявления мутации), электромиография, ЭХО-КГ, ОАК, коагулограмма.
Лечение гликогенозов
Специфические методы терапии не разработаны. Патогенетическое лечение проводится консервативно, направлено на устранение гипогликемии, метаболического ацидоза, кетоза, гиперлипидемии, коррекцию дисфункции гепатобилиарного комплекса и желудочно-кишечного тракта. При развитии осложнений (серьезном поражении внутренних органов) выполняются хирургические операции. Медицинская помощь пациентам включает следующие направления:
- Диетотерапию. Для минимизации метаболических нарушений составляется индивидуальный план питания. Больным рекомендуется снизить количество жиров, сахарозы, фруктозы и галактозы для уменьшения гиперлипидемии и ацидоза. При первом типе гликогеноза назначается диета с увеличенным потреблением углеводов. В частности, показано употребление сырого кукурузного крахмала с медленной усвояемостью, позволяющей предупредить гипогликемию. При типах 3, 4 и 9 вводится рацион с преобладанием животного белка и дробным питанием.
- Лекарственную коррекцию симптомов. В рамках комплексного лечения применяется кокарбоксилаза для увеличения производства ацетилкофермента А, кортикостероидов и глюкагона для стимуляции глюконеогенеза. Дефицит карнитина компенсируется левокарнитином. При вторичных тубулопатиях, печеночных и билиарных дисфункциях используются желчегонные препараты, гепатопротекторы, липотропные вещества. При признаках ацидоза показаны щелочные растворы внутривенно. При почечной дисфункции, протеинурии - ингибиторы АПФ. При гиперурикемии - урикодепрессоры. При нейтропении - гранулоцитарный колониестимулирующий фактор.
- Хирургическое лечение. Пациентам с тяжелыми фатальными поражениями печени может потребоваться ортотопическая трансплантация органа. Показанием к операции является цирроз с осложнениями, часто развивающийся при третьем и четвертом типе патологии. В отдельных случаях хирургическое вмешательство целесообразно при аденомах печени с высоким риском трансформации в злокачественную опухоль. Трансплантация почек иногда выполняется больным с хронической почечной недостаточностью.
Прогноз и профилактика
Эффективность терапии, вероятность осложнений и летального исхода зависят от типа патологии. Одни гликогенозы незначительно ухудшают качество жизни больных, компенсируются по мере взросления, другие - не поддаются лечению и неизбежно завершаются смертью. Для снижения риска рождения ребенка с гликогенозом супружеским парам из группы риска - имеющим семейный отягощенный анамнез, детей с подтвержденным диагнозом - требуется медико-генетическое консультирование, пренатальная диагностика.
Альфа-маннозидоз
Альфа-маннозидоз - это редкая патология из группы лизосомных болезней накопления, которая вызвана дефектом фермента альфа-маннозидазы. Заболевание возникает при мутации гена MAN2B1, наследуется по аутосомно-рецессивному типу. Основные симптомы: аномалии развития костей, иммунодефицит, умственная отсталость и тугоухость. Диагностика альфа-маннозидоза требует проведения биохимических и генетических исследований, МРТ головного мозга, консультации ЛОР-врача и невролога. Лечение включает заместительную ферментотерапию, симптоматические медикаменты, комплексную реабилитацию.



Альфа-маннозидоз относится к орфанным заболеваниям. Предполагаемая его частота составляет 1 случай на 500 тыс. населения. В медицинской литературе представлены детальные описания около 100 пациентов с характерной клинической картиной патологии. Существенных расовых и половых отличий среди заболевших не обнаружено. Основная проблема альфа-маннозидоза - поздняя диагностика заболевания. Из-за этого пациенты не могут вовремя получить современную заместительную терапию.

Причины
Патология возникает при мутации генетической последовательности MAN2B1, которая кодирует энзим альфа-маннозидазу. Дефектный ген располагается на коротком плече 19-й хромосомы в локусе 19p13.13. На сегодня известно более 150 вариантов мутаций, из которых клиническое значение имеют около 40 типов. Болезнь имеет аутосомно-рецессивный путь наследования, поэтому риск передачи мутантного гена ребенку составляет 25%.
Пока ученым не удалось установить четкую корреляцию между генотипическими и фенотипическими вариантами патологии. При этом не исключается существование «благоприятных» мутаций, при которых сохраняется остаточная ферментная активность и наблюдается субклиническое течение. Факторами риска тяжелого течения заболевания служат внутриутробные инфекции, осложнения перинатального периода, критические состояния в периоде новорожденности.
Лизосомальная альфа-маннозидаза вырабатывается здоровыми клетками и расщепляет маннозидные связи в олигосахаридах. При резком снижении или отсутствии этого вещества в организме начинаются накапливаться углеводы, содержащие маннозу. Патологические олигосахариды присутствуют во всех тканях и органах, что обуславливает клинический полиморфизм симптоматики.
Биохимические нарушения при альфа-маннозидозе сопряжены с патологиями иммунных реакций. Наблюдается угнетение хемотаксиса лейкоцитов и фагоцитарной активности. Олигоманнозиды, которые содержат в структуре молекулы 5-6 остатков маннозы, связываются с рецепторами интерлейкина-2, нарушают иммунный ответ и способствуют развитию иммунодефицитных состояний.

Первоначально альфа-маннозидоз подразделяли на два типа: первый ‒ связанный с органной патологией и ранней смертью, и второй ‒ характеризующийся более легким течением и преимущественным поражением нервной системы. После накопления информации о клиническом течении болезни в практической генетике появилась новая классификация, согласно которой выделяют 3 формы:
- Легкая. Манифестация симптомов происходит у пациентов старше 10 лет. Клинические проявления медленно прогрессируют, поэтому больные сохраняют частичную способность к самообслуживанию и средний уровень интеллекта. Это наиболее благоприятный вариант альфа-маннозидоза, однако он встречается редко.
- Среднетяжелая. Клиническая симптоматика развивается в дошкольном возрасте, когда и устанавливается диагноз. Неврологические и соматические нарушения быстро прогрессируют, со временем пациенты теряют способность к бытовому обслуживанию и социализации. Это самая распространенная форма болезни.
- Тяжелая. Симптомы развиваются еще во внутриутробном периоде или манифестируют сразу после рождения ребенка. Тяжелый вариант заболевания характеризуется множественными поражениями ЦНС, которые сопряжены с летальным исходом в младенческом возрасте.
Симптомы альфа-маннозидоза
Дети имеют характерный фенотип, который напоминает клинические проявления синдрома Гурлера. Наблюдаются малые аномалии развития лицевого скелета: крупный выступающий лоб, западение переносицы, широкий нос с вывернутыми ноздрями. Голова имеет большие размеры относительно туловища, причем такое соотношение сохраняется по мере взросления ребенка. Характерна короткая толстая шея, сколиоз, деформация грудины.
Дети страдают от множественных неврологических нарушений. С раннего возраста определяется задержка речевого и психомоторного развития, которая со временем перерастает в умственную отсталость. Даже при легком течении болезни уровень интеллекта по шкале IQ не превышает 60-80 единиц. У пациентов старше 10 лет зачастую встречается атаксия, 25% больных страдают психическими расстройствами.
Важным признаком является нейросенсорная тугоухость, которая чаще возникает у детей раннего и дошкольного возраста. При присоединении среднего отита и скоплении воспалительного экссудата формируется смешанная форма тугоухости. Соматические проявления болезни представлены умеренной гепатоспленомегалией, вентральными грыжами, кислотным рефлюксом.
Прогрессирующая психосоциальная деградация лишает пациентов возможности вести полноценную жизнь. Характерна ранняя инвалидизация больных, поэтому они требуют пожизненного квалифицированного ухода. Большую проблему представляют нарушения иммунной функции, которые приводят к затяжным инфекциям дыхательных путей, кожи, мочеполовой системы. Полиорганная недостаточность на фоне иммунодефицита - частая причина смерти пациентов с альфа-маннозидозом.
Обследование детей с подозрением на альфа-маннозидоз проводится под руководством педиатра и генетика. На первом этапе выполняют сбор анамнеза заболевания и жизни, тщательный физикальный осмотр, анализ особенностей фенотипа пациента. На втором этапе назначаются инструментальные и лабораторные методы, которые нужны для верификации диагноза, оценки соматического и неврологического статуса. Составляющие диагностической программы:
- Биохимические исследования. Предварительный диагноз основывается на обнаружении повышенного уровня маннозосодержащих олигосахаридов в сыворотке крови или в образце мочи.
- Анализ сухих пятен крови. Высокоинформативное исследование используется для определения активности альфа-маннозидазы. Ее снижение является неоспоримым критерием для постановки диагноза.
- Генетическая диагностика. Для 100% подтверждения альфа-маннозидоза определяют нуклеотидную замену в генетической последовательности MAN2B1. Результаты анализа важны для медико-генетического консультирования родителей и других родственников больного ребенка.
- Инструментальная визуализация. При изучении МРТ-снимков головного мозга определяется поражение белого вещества, прогрессирующая атрофия мозжечка. Патологии опорно-двигательного аппарата требуют проведения рентгенографии скелета.
- Консультации специалистов. Снижение слуха требует консультации детского отоларинголога с выполнением аудиометрии, рентгенографии пирамиды височной кости. Посещение невролога и психиатра необходимо для выяснения степени когнитивных нарушений.
- Пренатальная диагностика. Если в семье есть больной ребенок или родители являются носителями мутации, рекомендуется скрининг патологии при следующей беременности. С этой целью назначается анализ ферментной активности и генетическое исследование. Материал для диагностики получают при биопсии хориона, амниоцентезе.
Дифференциальная диагностика
Постановка диагноза альфа-маннозидоза затруднена из-за неспецифичности симптоматики, дороговизны и недоступности ряда инновационных тест-систем. Врачу необходимо дифференцировать патологию с болезнями накопления:
- углеводов (мукополисахаридоз, гликогеноз);
- липидов (болезнь Ниманна-Пика, Гоше, гистиоцитоз Х);
- продуктов минерального обмена (гемохроматоз, гепатоцеребральная дистрофия).

Лечение альфа-маннозидоза
Консервативная терапия
Ранее возможности лечения были резко ограничены. В последние годы в клиническую практику внедряется препарат альфа-маннозидазы, который используется для заместительной ферментной терапии. По химической структуре он идентичен природному энзиму. Рекомбинантная альфа-маннозидаза поступает в клетки организма, восполняет дефицит фермента и уменьшает запасы олигосахаридов.
Препарат показан для лечения легких и среднетяжелых форм заболевания. Он назначается детям и взрослым с подтвержденным диагнозом, вводится внутривенно по индивидуальной схеме. Отдаленные результаты лечения обнадеживают: у пациентов улучшается мелкая моторика, нормализуются биохимические и иммунологические показатели крови. Однако при тяжелых вариантах патологии ферментотерапия не применяется.
Другие варианты лечения носят симптоматический характер. Учитывая высокую частоту инфекционных заболеваний, пациентам назначают антибиотикотерапию, препараты антимикотиков для профилактики грибковых инфекций. Важное место в комплексном лечении больных имеет установка слуховых аппаратов, занятия с логопедом и коррекционным педагогом, применение ортезов и инвалидных колясок. Такие меры повышают мобильность и самостоятельность пациентов.
Экспериментальное лечение
Инновационным направлением терапии является применение гемопоэтических стволовых клеток. Лечебная тактика основана на их способности дифференцироваться в различные клеточные линии, которые будут вырабатывать нормальный фермент. Пока известно только 4 случая применения трансплантации стволовых клеток при альфа-маннозидозе, поэтому методика требует дальнейшего изучения.
Продолжительность жизни при альфа-маннозидозе значительно сокращается. При легких формах заболевания пациенты живут до 50 лет, при среднетяжелых могут умирать в молодом возрасте. Тяжелый клинический вариант нередко завершается внутриутробной гибелью или смертью в первые месяцы жизни ребенка. Для профилактики патологии семейным парам из группы риска показано генетическое консультирование при планировании беременности.
1. Альфа-маннозидоз у детей: анализ собственных наблюдений, возможности лечения/ А.Н. Семячкина, Е.А. Николаева, Е.Ю. Воскобоева// Российский вестник перинатологии и педиатрии. - 2020. - №4.
3. Alpha-Mannosidosis: Therapeutic Strategies/ Ceccarini MR, Codini M, Conte C, et al// Int J Mol Sci. - 2018. - №19.
Дифференциальная диагностика мукополисахаридозов
Валентина Мохор, «МВ». 25.01.2022 Фото носит иллюстративный характер. Из открытых источников.
Читайте также:
