Нервная система при нарушениях митохондриального окисления жирных кислот
Добавил пользователь Владимир З. Обновлено: 28.01.2026
Обзор
Снимок конфокальной микроскопии эмбриональных фибробластов мыши, обработанных индуктором ферроптоза RSL3 (100 nM, 6h)
Авторы
Редакторы
Статья на конкурс «Био/Мол/Текст»: Задумывались ли вы когда-нибудь о том, что клетки общаются между собой? Ведь клеточный мир настолько многообразен и велик, что в нем без языка не обойтись! Всем известные гормоны — только один из диалектов такого «языка»! В этой статье мы расскажем о том, как липиды помогают клеткам «общаться». Почему такой, казалось бы, простой химический процесс, как окисление липидов, может приводить к гибели клетки? Как клетки понимают, когда пора заканчивать фазу воспаления и переходить к восстановлению? Что такое ферроптоз. Вы все еще читаете аннотацию? Давайте скорее окунемся в удивительный мир редокс-липидомики и взглянем на липиды по-новому!
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Давно известно, что без липидов человеческий организм не может существовать. Эта обширная группа природных органических соединений, включающая жиры и жироподобные вещества, необходима для построения клеточных мембран и регуляции обмена веществ. Изучением липидов занимается липидомика, а появление раздела «редокс-липидомика» (окислительно-восстановительная липидомика, часть липидомики, занимающаяся характеристикой окисленных липидов) позволило по-новому взглянуть на роль продуктов окисления липидов и оценить их влияние на ключевые процессы, происходящие в клетках.
О липидах в составе клеточных мембран читайте в статье «Липидный фундамент жизни» [1]. — Ред.
В дополнение к природному липидому (совокупности всех липидов организма), существуют виды липидов, полученные в результате ферментативных и неферментативных модификаций (эпилипидом), что делает общую картину еще более сложной, поскольку их функции все еще в значительной степени неизвестны. Окисленные липиды представляют собой фракцию эпилипидома, которая привлекла большое внимание ученых из-за их роли в возникновении и развитии многих заболеваний человека. Однако основной проблемой редокс-липидомики остается отсутствие оптимальных вычислительных инструментов для надежной, точной и специфической идентификации уже открытых и еще неизвестных модифицированных липидов. В настоящее время жидкостная хроматография и масс-спектрометрия являются основными методами, позволяющими определить количество липидов в клетке, оценить их участие в ряде физиологических механизмов и даже изучить структуру продуктов окисления этих веществ [2].
Знакомство с липидами
Молекулы липидов чрезвычайно разнообразны, их насчитывают более миллиона вариантов [3]! Впечатляющее количество, по сравнению с 70 000 выявленных белков и 30 000 генов! Для удобства химики разделили все липиды на две большие группы:
- омыляемые, которые легко гидролизуются в воде под действием щелочей;
- неомыляемые, которые не гидролизуются в щелочной среде.
К первой группе относятся простые липиды, состоящие исключительно из спирта и жирных кислот (воски, триацилглицеролы, эфиры холестерола), и сложные липиды, в состав которых входят и другие компоненты (фосфолипиды, гликолипиды, сфинголипиды). К неомыляемым липидам относится большая группа стероидов, включающая холестерин и его производные: стероидные гормоны, витамины, желчные кислоты.
Большая роль маленьких молекул
Липиды, содержащие полиненасыщенные жирные кислоты (ПНЖК — кислоты, содержащие две и более двойных связей), являются важными сигнальными молекулами, регулирующими многие метаболические процессы и клеточные реакции, включая воспаление. Для выполнения этих функций они подвергаются реакциям окисления, то есть присоединяют кислородсодержащие группы.
Окисление липидов происходит с помощью двух основных механизмов. Первый способ — неферментативное перекисное окисление. При этом липиды взаимодействуют с активными формами кислорода (АФК), в результате чего происходит накопление гидроперекисей липидов (LOOH) (рис. 1). В норме процессы перекисного окисления необходимы для поддержания структуры клеточных мембран, функционирования ионных каналов, рецепторов и ферментных систем. Их роль велика и в синтезе липидных медиаторов — биорегуляторов (простагландинов, тромбоксанов, лейкотриенов и др.). Однако неконтролируемое свободнорадикальное окисление липидов может приводить к изменению проницаемости мембраны, нарушению ее целостности, а это прямая угроза гибели клетки [3]!
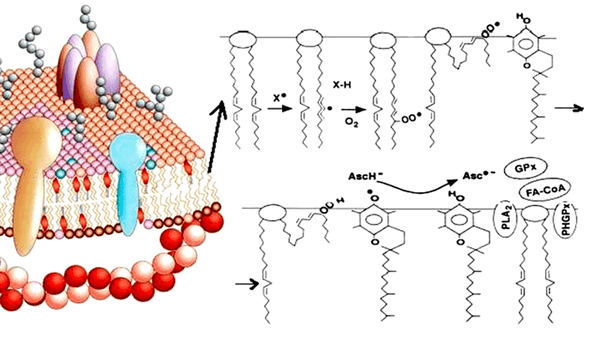
Рисунок 1. Зарождение цепной реакции перекисного окисления липидов. Фосфолипиды клеточных мембран, взаимодействуя со свободными радикалами, превращаются в гидроперекиси липидов, что может влиять на функции мембраны клетки.
Второй путь окисления — ферментативные изменения, отличающиеся высокой селективностью и специфичностью. Ферментативное окисление происходит под действием металлопротеинов: липоксигеназы, циклооксигеназы, цитохрома Р450, пероксидазы. Продукты реакций окисления ПНЖК, выступая в качестве сигнальных молекул, координируют метаболизм и другие физиологические процессы, иными словами, управляют судьбой клетки [4]! Такие вещества носят название эйкозаноидов. Они принимают участие во многих важнейших процессах: росте мышечной ткани, реакциях иммунитета на токсины и патогены, выступают в роли нейромедиаторов и даже гормонов!
К сожалению, человеческий организм не научился синтезировать все необходимые ПНЖК. Возникает вопрос: можно ли их получить извне? Разумеется! Пищевыми источниками полиненасыщенных жирных кислот являются растительные масла, рыбий жир и препараты омега-3-жирных кислот. Таким образом, казалось бы невкусный рыбий жир — просто лакомство для наших клеток!
Из липидов — в дирижеры клеточных реакций
Исследования редокс-липидомики, проведенные при помощи масс-спектрометрии в сочетании с обращенно-фазовой хроматографией, выявили удивительный факт: липиды контролируют активность иммунной системы [4]! При попадании в организм чужеродных агентов, желающих нанести вред и повредить ткани, развивается воспаление, цель которого — устранить патоген. Иммунные клетки, встав на защиту организма, в зоне повреждения вырабатывают «провоспалительные» производные ПНЖК (лейкотриены, липоксины, гипоксины и т.д.), которые усиливают воспаление и таким образом избавляют организм от патогена (рис. 2).
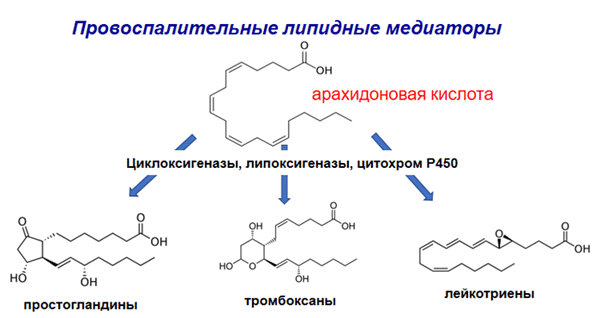
Рисунок 2. Провоспалительные производные арахидоновой кислоты: простагландины, тромбоксаны и лейкотриены
рисунок авторов статьи
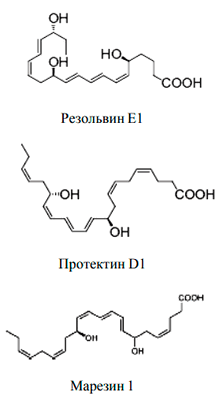
Рисунок 3. Противовоспалительные медиаторы: резолвины, протектины, марезины
Но воспаление — патологический процесс, и при удалении повреждающего фактора важно вовремя остановиться и прекратить воспалительный ответ. Здесь на помощь приходят противовоспалительные липидные медиаторы — резолвины, протектины, марезины (рис.3). Они останавливают образование «провоспалительных» медиаторов и обеспечивают защиту клеток от повреждающих факторов.
Кроме того, собственные поврежденные клетки, не способные восстановиться, для перехода воспаления в завершающую фазу и сохранения постоянства внутренней среды должны подвергнуться уничтожению, чему также способствуют липидные медиаторы. Как это возможно? Оказалось, что липидные молекулы фосфатидилсерина (фосфолипида клеточной мембраны) выставляются на мембрану поврежденных клеток и «помечают» их. Фосфатидилсерин на поверхности клеток является сигналом для их поглощения макрофагами и клетками микроглии [5]. В исследованиях также была продемонстрирована значимость этого медиатора: наличие даже одной молекулы фосфатидилсерина уже достаточно для активации фагоцитоза!
Две стороны одной медали
Оказалось, что роль липидов велика не только в уничтожении старых или поврежденных клеток, но и их компонентов, или органелл. Например, для удаления митохондрий, безвозвратно утративших свои функции, на поверхности ее внешней мембраны появляется кардиолипин — фосфолипид, который в норме присутствует только на внутренней мембране органелл. Именно он и служит сигналом митофагии, или уничтожения митохондрий [5]. Удаление исключительно ненужных организму структур без повреждения нормальных клеток требует точной передачи сигналов и имеет решающее значение для поддержания постоянства внутренней среды.
Однако данный процесс может стать опасным для организма. Чрезмерная митофагия описана при многих острых и хронических заболеваниях центральной нервной системы. Так, при болезни Паркинсона она может привести к гибели нейронов [6]. Контроль качества митохондрий с целью избежания излишнего уничтожения имеет центральное значение для функционирования и благополучия нейронов. Это открывает новые возможности для исследований в области лечения нейродегенеративных заболеваний!
Как липиды «помогают» клетке погибнуть?
Что же делать со старыми клетками, честно отслужившими свой срок? Безусловно, оставлять их на своем месте нельзя, иначе новым здоровым клеткам будет некуда деться. Остается один вариант — аккуратно разобрать и удалить из организма те из них, которые не способны более функционировать. Данный процесс носит названия апоптоза. Валериан Каган и его соавторы доказали, что для осуществления этого процесса необходимо окислить ПНЖК кардиолипина [7]. При необратимых изменениях в клетке знакомый нам кардиолипин образует комплекс с белком дыхательной цепи — цитохромом c — и превращает его в фермент пероксидазу. Пероксидаза тотчас окисляет ПНЖК кардиолипина, и он перемещается на внешнюю мембрану митохондрий, увеличивая ее проницаемость (рис.4). Это приводит к высвобождению других проапоптотических факторов клетки, действие которых приводит к клеточной гибели.
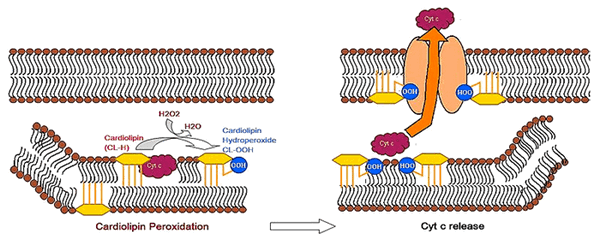
Рисунок 4. Окисление кардиолипина как фактор апоптоза. На рисунке представлена клеточная мембрана, состоящая из бислоя липидов, один из которых — кардиолипин (показан желтым цветом). При взаимодействии с белком цитохромом c (cyt c) кардиолипин превращает его в пероксидазу, которая, в свою очередь, окисляет ПНЖК кардиолипина (на рисунке — cardiolipin hydroperoxide, CL-OOH). Гидроперекись кардиолипина выходит на внешнюю мембрану митохондрии, изменяя ее проницаемость, что приводит к апоптозу.
Новый взгляд на клеточную смерть
Одним из важнейших достижений редокс-липидомики является открытие уникального варианта неапоптотической программируемой гибели клетки — ферроптоза [8]. По сравнению с другими формами этот путь клеточной гибели неповторим. В чем же его особенность? Оказалось, что, в отличие от апоптоза, при котором происходит аккуратная разборка клетки, ферроптоз приводит к клеточному коллапсу, в котором железо и АФК принимают активное участие. Давайте разберемся, как это происходит!
Ферроптоз назван так неспроста. Железо (Fe от лат. ferrum) — основной элемент, необходимый для осуществления ключевого звена данного пути гибели клетки: перекисного окисления липидов (рис. 5) [9], [10]. Перекисное окисление может происходить под действием свободного двухвалентного железа (через реакцию Фентона), а также посредством фермента липоксигеназы, содержащей железо.
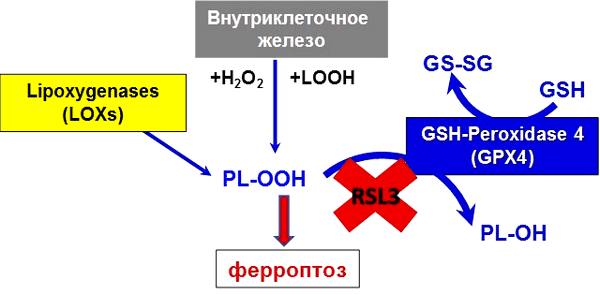
Рисунок 5. Ионы железа в организме находятся под строгим метаболическим контролем. Нарушение баланса ионов железа в клетке и возникновение окислительного стресса приводит к цепной реакции окисления липидов и формированию избытка гидроперекисей. Накопление гидроперекисей липидов приводит к развитию ферроптоза. Гидроперекиси фосфолипидов (PL-OOH) образуются внутри клетки с участием различных форм низкомолекулярного внутриклеточного железа и железосодержащих ферментов. Активная GPX4 восстанавливает гидроперекиси липидов до спиртов. В случае ингибирования фермента, например, специфическим ингибитором RSL3, PL-OOH накапливаются в клетках, усиливая развитие окислительного стресса.
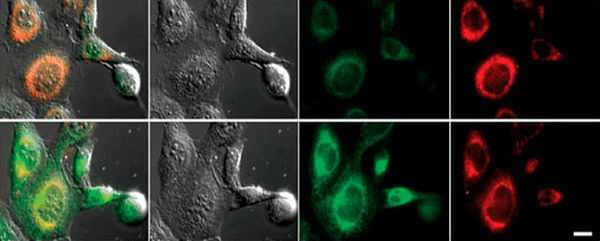
Конкретные механизмы редокс-модификации липидов, задействованные в выполнении программы ферроптоза, на сегодняшний день остаются тайной. Но, окрасив клетку различными флуоресцентными красителями, можно увидеть, насколько удивительные очертания они приобретают при ферроптозе (рис. 6) [11]!
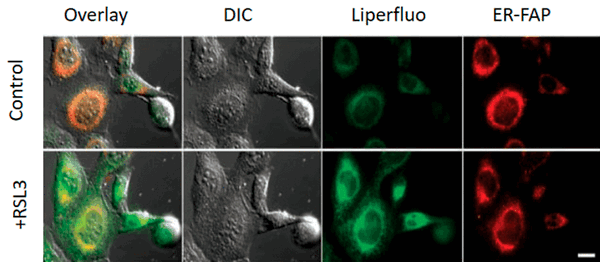
Рисунок 6. Снимок конфокальной микроскопии эмбриональных фибробластов мыши, обработанных индуктором ферроптоза RSL3 (100 nM, 6h). Control — необработанные клетки. Liperfluo — флуоресцентный зонд, который после взаимодействия с гидроперекисями липидов способен флуоресцировать, если он встроен в плазматическую мембрану клеток. ER-FAP (ER-targeted fluorogen-activating protein) — флуоресцентный белок, чья флуоресценция активируется при связывании метки с эндоплазматическим ретикулумом.
В клетках организма существуют механизмы, препятствующие неконтролируемому перекисному окислению. Одним из ключевых ферментов здесь является глутатионпероксидаза 4 (GPX4), которая восстанавливает гидроперекиси липидов до спиртов за счет окисления глутатиона (GSH). Далее окисленная молекула глутатиона (GS-SG) восстанавливается с помощью фермента глутатион-редуктазы. В случае инактивации клеточного глутатиона и GSH-зависимой антиоксидантной защиты происходит накопление токсичных липидных АФК и запуск ферроптоза [12].
Две крайности одной и той же сущности. Как ферроптоз реализуется в целом организме и можно ли обернуть его в свою пользу?
Проведенные исследования показывают, что ферроптоз осуществляется во многих типах тканей человека. Так, при отравлении парацетамолом в организме накапливается N-ацетил-p-бензохинонимин, при этом наблюдается истощение глутатиона, в результате чего происходит массивная гибель клетки по механизму ферроптоза [13].
Имеющиеся данные указывают на то, что ферроптоз может выступать одним из ключевых механизмов развития некоторых нейродегенеративных заболеваний, а также является одной из возможных причин гибели клеток в условиях глутаматной эксайтотоксичности [14].
Ионы железа могут играть ключевую роль в гибели эпителиальных клеток почечных канальцев в условиях острой почечной недостаточности [13]. Данный механизм обусловлен нарушением гломерулярной фильтрации и накоплением ионов железа как внутриклеточно, так и в полости канальца, что приводит к реализации клеточной смерти.
Ферроптоз, как механизм регулируемой клеточной смерти, имеет и терапевтическую ценность. Существует ряд потенциальных молекул, ингибирующих Xc - — транспортную систему (эрастин, RSL3), которые, воздействуя на культуру опухолевых клеток, вызывают их гибель по механизму ферроптоза [12], [13]. Как доказать, что это происходит благодаря ферроптозу, а не случайному совпадению? При добавлении к клеткам веществ, связывающих железо, оно становится «неподвижным» и не может участвовать в химических процессах. В этом случае процессы ферроптоза значительно замедляются. Однако не все так просто и радужно! Эти молекулы не обладают высокой специфичностью, и при более высоких дозах клеточная гибель может происходить по механизму апоптоза!
Вывод
Благодаря редокс-липидомике стало известно, что кислородсодержащие липиды играют огромную роль в сохранении постоянства внутренней среды, запуская апоптоз, ферроптоз и контролируя воспаление. Однако стоит принять во внимание, что, несмотря на очевидное значение в регуляции множества биологических функций, содержание окисленных липидов в организме крайне мало (0,03-3,0 моль% от всего липидома организма) [4]. Кроме того, трудности анализа окисленных липидов заключаются в их химической нестабильности, термолабильности и неоднородности окисленных продуктов. Не зря их сравнивают с иголкой в стоге сена!
Митохондриальная миопатия
Митохондриальные миопатии — это группа заболеваний мышц, которые возникают в результате нарушения функции тканевого дыхания при патологиях митохондрий. Болезни проявляются нарастающей мышечной слабостью, атрофией мускулатуры, прогрессирующими двигательными расстройствами, которые могут сопровождаться судорогами, поражениями сердца, ухудшением слуха и зрения. Диагностика предполагает лабораторные (исследование мышечных биоптатов, генетическое тестирование, биохимические анализы), инструментальные методы (ЭМГ, церебральное МР-сканирование). Лечение включает симптоматические препараты, физиотерапию, ЛФК.
МКБ-10
Общие сведения
Термин «митохондриальная миопатия» объединяет в себе несколько патологий со сходным патогенезом. Наиболее часто дети страдают синдромами MELAS, MERRF, синдромом Кернса-Сайра с хронической прогрессирующей наружной офтальмоплегией. Изучение молекулярно-генетических особенностей этих болезней началось в 1980-х гг. Распространенность патологий у детей составляет около 11,5 случая на 100 тыс. населения. Из-за мультисистемности поражения, клинического полиморфизма, вариабельности течения этот вид миопатии представляет серьезные трудности в диагностике.
Причины
Миопатии обусловлены наследственными либо спорадическими мутациями в митохондриальной ДНК или в ядерных генах, контролирующих работу митохондрий. Известно более 300 вариантов генных дефектов — однонуклеотидных замен, делеций, вызывающих нарушения функционирования митохондрий. Митохондриальные миопатии имеют ряд генетических аспектов, выделяющих их среди всех наследственных заболеваний. Принципиальные различия:
- Материнское наследование. Эмбрион получает всю цитоплазму с содержащимися в ней органеллами от матери, поэтому только она может передать ребенку мутантную мтДНК. В то же время, при мутациях ядерной ДНК наследование происходит по аутосомно-рецессивному, аутосомно-доминантному или Х-сцепленному типу.
- Гетероплазмия. При митохондриальной миопатии в клетках мышечной ткани одновременно присутствует мутантный и нормальный генетический материал в разном процентном соотношении, чем объясняется вариабельность клинических проявлений у членов одной семьи при наследственной форме болезни.
- Митотическая сегрегация. При делении клеток, содержащих мутантные митохондриальные гены, мтДНК распределяется между дочерними клетками случайным образом, неравномерно.
Патогенез
Митохондрия — универсальная органелла, присутствующая во всех клетках, кроме эритроцитов. Она имеет дыхательную цепь, которая включает 5 ферментных комплексов из нескольких десятков субъединиц каждый. Ферменты обеспечивают окислительное фосфорилирование для синтеза АТФ — аденозинтрифосфата, выступающего основным источником энергии в организме.
При митохондриальных заболеваниях может быть 4 варианта патогенетических механизмов развития. Как правило, при поражениях мышц наблюдаются дефекты электронного транспорта и окислительного фосфорилирования, что сопровождается нарушениями образования энергетических молекул. Другие варианты расстройств включают нарушения обмена пирувата, дефекты метаболизма жирных кислот, дисфункцию цикла Кребса.
При миопатиях отмечаются полисистемные расстройства. Мышечная и нервная ткань, больше других зависимые от энергопроизводства, страдают в первую очередь. Поражение проявляется нарушениями обмена веществ в мышцах, дегенеративными процессами, атрофией миофибрилл и их замещением соединительной тканью. Со временем патологический процесс распространяется на сердечную мышцу, эндокринную систему, почки и печень, что определяет различные «маски» миопатии.
Симптомы митохондриальной миопатии
Патологии манифестируют у детей раннего возраста, иногда они присутствуют с рождения. Общим признаком является миопатический синдром, который включает прогрессирующую мышечную слабость, снижение тонуса скелетной мускулатуры, непереносимость физических нагрузок. Типично отставание в моторном развитии: дети поздно начинают сидеть, ползать, ходить, у них сохраняется неуклюжесть движений, проблемы с поддержанием равновесия.
Клинические особенности определяются типом заболевания. При синдроме MERRF мышечная слабость сопровождается разнообразными судорожными приступами (атоническими, тонико-клоническими, миоклоническими), расстройствами координации вследствие мозжечковой атаксии. Для синдрома MELAS характерны повторные инсульты, умственная отсталость, нейросенсорная тугоухость.
У детей распространен синдром Кернса-Сайра, при котором клинические признаки дополняются расстройствами глотания, нарушениями работы проводящей системы сердца, снижением слуха. Хроническая прогрессирующая наружная офтальмопатия может возникать как компонент болезни Кернса-Сайра, так и развиваться изолированно, что чаще бывает в старшем возрасте.
Осложнения
Отличительными особенностями миопатического синдрома являются необратимость, неуклонное прогрессирование. Сначала мышечная слабость появляется в проксимальных отделах конечностей, затем поражает все тело ребенка: в процесс вовлекается гладкая мускулатура органов дыхания и пищеварения, что чревато дыхательной недостаточностью, аспирационными пневмониями, тотальным параличом. Такие пациенты теряют способность к самообслуживанию, требуют круглосуточного ухода.
Миопатии осложняются деформациями позвоночника, искривлениями нижних конечностей на фоне слабости мышечного корсета. Вследствие атрофии зрительных нервов у больных с синдромом MERRF возникает слепота. Опасным последствием многих вариантов митохондриальной патологии являются инсульты, эпилептический статус, мозговой отек, которые становятся основными причинами летального исхода.
Диагностика
Первичное обследование детей с подозрением на митохондриальную миопатию проводится у невролога, для уточнения диагноза показана консультация генетика. При осмотре учитывается неврологический статус ребенка, показатели мышечной силы и тонуса, уровень развития когнитивных навыков. Постановка диагноза требует комплексного обследования, включающего следующие методы:
- Электромиография. Исследование демонстрирует уменьшение амплитуды и длительности регистрируемых потенциалов двигательных единиц (ПДЕ), что указывает на разнокалиберность мышечных волокон с их мозаичной атрофией, гипертрофию небольшой части миофибрилл.
- Исследование биоптатов мышц. Патогномоничным признаком митохондриальной миопатии является феномен «рваных красных волокон», который определяется при специальной окраске биоптатов трихромом по Гомори.
- МРТ головного мозга. Нейровизуализация назначается при подозрении на центральный характер мышечных нарушений, для исключения сопутствующих нейродегенеративных поражений ЦНС, которые нередко встречаются при митохондриальных болезнях.
- Цитоморфоденситометрия. Анализ необходим для оценки активности митохондрий в лимфоцитах ребенка, показывает снижение числа органелл при увеличении их объема, уменьшение оптической плотности гранул, нарушения ферментативной активности.
- Генетический анализ. Учитывая разнообразие митохондриальных миопатий, для подтверждения диагноза обязательно выполняется секвенирование митохондриальной ДНК. При исследовании проверяется наличие мутаций, которые чаще всего провоцируют заболевание у детей.
- Биохимические исследования. Заподозрить мышечные поражения, связанные с нарушенным окислительным фосфорилированием, удается по увеличению показателей лактата и пирувата в крови, цереброспинальной жидкости.
Лечение митохондриальных миопатий
В клинической неврологии отсутствуют эффективные методы терапии патологии у детей. Суть медицинской помощи сводится к уменьшению моторного дефицита, своевременной коррекции осложнений, стимуляции обменных процессов в митохондриях. Наибольшую результативность демонстрируют следующие группы медикаментов:
- Аминокислоты. L-аргинин рекомендован неврологами в острой фазе для улучшения кровоснабжения мозга при осложнении миопатии инсультом, в резидуальном периоде болезни для предупреждения повторных приступов ишемии нервной ткани.
- Энерготропные препараты. Чтобы улучшить энергообеспечение тканей ребенка, эффективны препараты с левокарнитином, янтарной кислотой, коэнзимом Q10, широко используется комплекс витаминов группы В, аскорбиновая кислота, альфа-токоферол.
- Антиконвульсанты. При сочетании миопатии с эпилептическими пароксизмами показаны противосудорожные препараты группы сульфат-замещенных моносахаридов, бензодиазепинов, ограничено применяются барбитураты. Вальпроаты для лечения детей с митохондриальными нарушениями не назначаются.
Важным компонентом лечения у детей является нейродиетология, которая предполагает исключение веществ, оказывающих негативное влияние на обменные процессы (терапия «обхождения блока»). Рекомендована кетогенная диета, другие виды высокожировых диет. По показаниям проводится лечебное энтеральное или парентеральное питание, в тяжелых случаях устанавливается гастростома.
Для коррекции моторных нарушений применяется расширенный комплекс физиотерапии: ультразвуковая терапия, электромиостимуляция, электрофорез с ингибиторами ацетилхолинэстеразы. Хороший эффект демонстрирует лечебный массаж, индивидуально подобранный комплекс ЛФК. Чтобы избежать перегрузки ослабленных мышц, широко используются занятия в бассейне. Также требуется ортопедическая коррекция, подбор специальной обуви ребёнку .
Прогноз и профилактика
Поскольку митохондриальные миопатии пока являются неизлечимыми болезнями, прогноз неблагоприятный. Улучшить качество жизни пациентов удается с помощью комплексной реабилитации, однако при развернутой клинической картине смерть нередко наступает в детском или молодом возрасте. Для профилактики семейным парам с отягощенной наследственностью необходимо медико-генетическое консультирование при планировании беременности.
1. Митохондриальные болезни: миопатии, энцефаломиопатии и энцефаломиелополиневропатии/ В.М. Казаков, А.А. Скоромец, Д.И. Руденко, Т.Р. Стучевская// Неврологический журнал. — 2018. — №6.
3. Влияние дисфункции митохондрий на клинические проявления наследственных миопатий/ Д.А. Харламов, В.С. Сухоруков// Российский вестник перинатологии и педиатрии. — 2013. — №4.
4. Митохондриальные миопатии в сочетании с кардиомиопатией. Новые подходы к лечению/ О.С. Страхова, Ю.М. Белозеров, С.В. Перминов, В.В. Давыдкин// Альманах клинической медицины. — 2001. — №4.
Психические расстройства при дисфункции митохондрий
Митохондриальная дисфункция может быть результатом наследственных или спонтанных (связанных с возрастом или малигнизацией) мутаций митохондриальной ДНК или менделевских мутаций в ядерной ДНК, кодирующей митохондриальные белки. Точечные мутации «горячих точек» или делеции митохондриальной ДНК приводят к четко определенным клиническим синдромам, таким как MELAS (митохондриальная энцефаломиопатия с лактоацидозом и эпизодами обострений ) , MERFF (миоклоническая эпилепсия с "рваными красными волокнами" ) или CPEO (хроническая прогрессирующая наружная офтальмоплегия). Другие мутации вызывают более неспецифические клинические проявления, начиная от изолированной миопатии или энцефаломиопатии и заканчивая мультисистемным заболеванием. Чаще всего поражаются органы с самым высоким потреблением энергии, такие как мозг, скелетные и сердечные мышцы, а также почки; однако симптомы в любом органе или ткани могут проявляться в любом возрасте.
Существует значительная фенотипическая изменчивость, даже среди родственников, из-за изменяющегося генотипа, скорости гетероплазмии (отношение митохондрий к мутанту в норме в клетках) и "порогового эффекта" (доля пораженного митохондриала, необходимая для проявления симптомов) в различных тканях. У большинства пациентов на начальном этапе заболевания наблюдаются симптомы с хронически повышенным уровнем лактата. Однако во время повышенного потребления энергии, такого как инфекция, лихорадка, тяжелые физические нагрузки, голодание и перепады температуры, у пациентов повышается уровень лактата и возникает метаболический ацидоз, что приводит к усилению выраженности (или появлению) симптомов, часто в сочетании с изменением психического статуса. По мере течения болезни наблюдается ремиттирующий паттерн с постепенным ухудшением и частичными ремиссиями. Клинический опыт показывает, что семейный анамнез в этих случаях положителен для нескольксоматических, неврологических и психических расстройств и, часто, расстройств, связанных с употреблением психоактивных веществ, создавая у врача впечатление «проклятой» семьи.
Эпидемиология
Исходя из имеющихся данных, общая распространенность митохондриальных дисфункций оценивается в 13,1 на 100 000 , что делает первичные нарушения митохондрий наиболее распространенными нарушениями обмена веществ
Как правило, участие трех или более систем органов без диагноза должно вызывать подозрения на митохондриальное заболевание. Позитивный семейный анамнез (особенно если он указывает на характер наследования), наличие лактоацидоза и изменения белого вещества на МРТ - еще один красный флаг для врача.
Диагностику лучше всего проводить в специализированных центрах и обычно она включает в себя: выявление повышенного соотношения лактата/ пирувата, уровня аланина в сыворотке и соотношения ацил / свободного карнитина в сыворотке, а также повышенных концентраций в сыворотки и мочи органических кислот. В зависимости от фенотипа может быть указано множество дополнительных тестов (ЭМГ, ЭКГ, ЭЭГ пр.). Золотым стандартом диагностики в большинстве случаев является генетическое исследование кожи или мышечная биопсия (постмитотическая ткань), которая обычно проводится в специализированных лабораториях.
Психические расстройства
Ранние исследования подтвердили связь между различными психическими расстройствами и митохондриальной дисфункцией. Было проведено несколько систематических исследований, в ходе которых была обнаружена высокая распространенность сопутствующих психических расстройств, особенно аффективных, которые присутствовали в 42% и даже в 71% случаев (54% основных депрессивных расстройств, 17% биполярных расстройств). Коморбидный психиатрический диагноз означал большее количество госпитализаций , больше соматических заболеваний и более низкое качество жизни. Когнитивный дефицит здесь был также распространен.
У детей наблюдаются задержки в развитии, трудности в обучении (работа «рывками», а затем «зонирование») и, иногда, проблемы со слухом. Было высказано предположение, что дисфункция ЦНС является результатом нарушения гомеостаза кальция , изменения синтеза и высвобождения нейротрансмиттеров , а также изменения рецепторной передачи сигналов и синаптической пластичности.
Замечено, что пациенты могут обращаться за помощью психиатра в то время, когда соматические признаки болезни не проявляются. Психиатры, здесь следовательно, играют ключевую роль в обеспечении того, чтобы пациент шел по правильной траектории диагностического обследования. Тщательное и детальное изучение истории болезни, соответствующие направления, продольное наблюдение и постоянное междисциплинарное сотрудничество - все это важно для адекватного ведения этих случаев.
Лечение
В настоящее время не существует «лекарства» от этих расстройств. Реальные цели лечения состоят в том, чтобы облегчить симптомы и замедлить прогрессирование заболевания.
Большинство пациентов получают пользу от эмпирического «митохондриального коктейля», который представляет собой комбинацию витаминов и добавок, направленных на замедление прогрессирования заболевания и сохранение митохондриальной функции. Компонентами «коктейля» являются креатин (увеличивает выработку АТФ), L-карнитин (переносит молекулы, способствующие метаболизму липидов в АТФ), коэнзим Q 10 (часть цепи переноса энергии), а также витамины В, С и Е, фолиевая кислота и бета-каротины , которые смягчают эффект усиления окислительного стресса.
Согласно проведенному метаанализу, только креатин, как было показано, приносит значительную пользу пациентам; тем не менее, авторы пришли к выводу, что хорошо контролируемые испытания являются «существенными строительными блоками в продолжающемся поиске» для лучшего лечения. Новые препараты в настоящее время тестируются на возможность обхода цепи переноса электронов, изменения динамики митохондрий или изменения скорости гетероплазмии. Цитоплазматический митохондриальный перенос рассматривается как терапевтический подход к митохондриальным заболеваниям, связанным с ДНК. Этот метод , названный «оплодотворением трех родителей in vitro», представляет собой процесс, который включает передачу цитоплазмы третьего донора и здоровых митохондрий. Предимплантационная генетическая диагностика может предоставить носителям митохондриальных мутаций ДНК возможность зачать здоровое потомство в будущем.
Учитывая, что этиопатогенез психопатологических симптомов, вторичных по отношени. к митохондриальным расстройствам, несколько отличается от первичных психических расстройств, неудивительно, что психопатологические симптомы здесь проявляются атипично. Кроме того, они могут быть устойчивы или даже усилиться под влиянием обычного психофармакологического лечения. Антипсихотики и антидепрессанты - селективные ингибиторы обратного захвата серотонина, миртазапин, тразодон - ингибируют некоторые комплексы митохондриальных ферментов. Противоэпилептические средства подавляют общую функцию митохондрий. Было выдвинуто предположение, что митохондриальная токсичность может способствовать побочным эффектам психотропных препаратов у гораздо более широкого круга пациентов. Пациенты с митохондриальными нарушениями показывают повышенную восприимчивость к побочным эффектам. Антихолинергические соединения могут ухудшать когнитивные нарушения и вызвать аритмию. Атипичные антипсихотические препараты могут усилить метаболический синдром у этих пациентов, многие из которых уже подвержены риску диабета. Опыт показывает, что психопатологические симптомы можно ослабить с помощью одного митохондриального коктейля, что следует учитывать, прежде чем переходить к психофармакологической терапии. К сожалению, пациенты часто заканчивают психотропной полипрагмазией с сомнительным или бесполезным эффектом.
Профилактика обострений
Общие профилактические меры, такие как минимизация воздействия алкоголя, табака и химических психоактивных веществ, предотвращение высокой температуры и недосыпания, своевременное лечение инфекции, лихорадки и обезвоживания, важны для предотвращения рецидивов в медицине вообще и в психиатрии, в частности, у пациентов с митохондриальными заболеваниями. В общем, особые соображения необходимо соблюдать для анестезии, хирургии и иммунизации этих пациентов.
. Модификация диеты также важна. Анаплеротическая диета, состоящая из 4-6 комплексных углеводно-белковых приемов пищи в день, оказалась полезной. Следует избегать поста , включая продолжительный голодание в течение ночи (пациентов учат перекусывать перед сном). Самоконтроль имеет важное значение для своевременного устранения рецидивов.
Жирные кислоты и окислительный стресс при психических расстройствах
Жирные кислоты являются важной составной частью клеточных мембран. Мембраны способны синтезировать их с помощью ацетил-СоА, но не способны синтезировать незаменимые жирные кислоты (линолевая кислота и альфа-линолевая кислота), которые являются предшественниками соответственно арихидоновой кислоты (омега-6 длинноцепочечных полиненасыщенных жирных кислот кислота) и докозагексаеновой кислоты (омега-3 длинноцепочечной полиненасыщенной жирной кислоты). Клеточная мембрана с высоким содержанием ненасыщенных жирных кислот играет защитную, противовоспалительную роль и косвенно антиоксидантную роль, способствуя физиологическим защитным процессам против свободных радикалов.
Оксидативный стресс является условием, которое изменяет нормальный внутриклеточный баланс между окислительными веществами, образующимися при аэробном метаболизме и процессами антиоксидантной системы, которые выполняют функцию нейтрализации, вводя в действие ряд защитных механизмов как ферментативной, так и неферментативной природы. Ферментативные системы включают супероксиддисмутазу (SOD), каталазу (CAT) и глутатионпероксидазу (GSH-Px). В неферментативных системах наиболее важными молекулами являются глутатион, альфа-токоферол (витамин Е), аскорбиновая кислота (витамин С), флавоноиды, фенольные соединения , а также цинк (Zn), медь (Cu) и селен (Se).
Многочисленные физиологические и патологические процессы, такие как старение, чрезмерное потребление калорий, инфекции, воспалительные заболевания, экологические токсины, фармакологическое лечение, эмоциональный или психологический стресс, ионизирующее излучение, сигаретный дым и алкоголь, увеличивают концентрацию окисляющих веществ в организме, называемую реакционно способными видами кислорода ( ROS) или, чаще всего, свободные радикалы. Это химические вещества являются высокореактивными из-за наличия свободных неспаренных электронов. Увеличение свободных радикалов ставит под угрозу чувствительные гомеостатические механизмы, которые включают в себя нейротрансмиттеры, гормоны, окисляющие вещества и множество других медиаторов.
Благодаря своей структуре, которая богата двойными связями, полиненасыщенные жирные кислоты оказывают влияние на клеточную мембрану, уязвимую для повреждения от свободных радикалов, вызывая перекисное окисление. Ущерб, вызванный перекислением липидов, делает клетку неустойчивой и, следовательно, нарушает текучесть, проницаемость, трансдукцию сигнала и вызывает рецепторные, митохондриальные ( ДНК) и ядерные изменения.
Окислительный стресс от свободных радикалов является одним из факторов, который способствует увеличению скорости клеточного цикла и последующей преждевременной гибели клеток, приводящей ко многим дегенеративным заболеваниям в центральной нервной системе, а также к психическим расстройствам. Периферийные системы проходят процесс атерогенеза и могут способствовать патологии сердечно-сосудистой системе.
Существует связь между повышенным оксидативным стрессом и большинством психических расстройств. Эти данные важны для признания того, что целостность и функциональность биомолекул тесно коррелирует с интеграцией с жирными кислотами и антиоксидантами, будь то с точки зрения питания или с терапевтической точки зрения.
Длинная углеводородная цепь полиненасыщенных жирных кислот в мембранных фосфолипидах имеет изломы в месте цис- двойных связей, которые в результате созданных стерических эффектов обеспечивают замечательную реакционную способность молекулы. Из-за текучести липидного компонента биомолекулы демонстрируют заметную степень подвижности, что помогает объяснить их функциональные свойства.
Полиненасыщенные жирын кислоты с нейроновой мембраной фосфатипиды особенно чувствительны к пероксидации, опосредованной оксирадикалами, то есть с помощью ROS. Они представляют собой высокореактивные виды из-за наличия неспаренных электронов внешней оболочки и генерируются как через аэробные метаболические физиологические процессы, так и через патологические процессы, которые могут быть ишемическими, воспалительными или вызваными эмоциональным или психологическим стрессом или загрязнением окружающей среды, курением, а также плохими привычки питания.
В перекисном окислении липидов мембран , повреждение липидов происходит в три этапа . Первый этап - инициирование, включает в себя атаку реактивного кислородного метаболита, способного абстрагировать атом водорода от метиленовой группы в липиде. Наличие двойной связи, прилегающей к метиленовой группе, ослабляет связь между атомами водорода и атома углерода, так что его можно легко удалить из молекулы. После захвата водорода, оставшийся радикал жирной кислоты , R • сохраняет один электрон и стабилизируется за счет перегруппировки молекулярной структуры с образованием сопряженного диена.
Во время "стадии распространения". ROO • способен абстрагировать другой атом водорода от соседней жирной кислоты, которая подвергается той же перестройке реакции и взаимодействию с кислородом. ROO •становится липидным гидропероксидом, который в присутствии переходных ионов может далее разлагаться до альдегида или образовывать циклический эндопероксид, изопростаны и углеводороды.
"Стадия распространения" позволяет продолжить реакцию. Одно инициирование может приводить к цепной реакции, приводящей к перекислению всего ненасыщенного липида в мембране. Особые антиоксиданты, такие как витамин Е, могут остановить этот процесс и, следовательно, определяются как антиоксиданты, разрушающие цепь.
Жирные кислоты без двойных связей или только с одной двойной связью могут подвергаться окислению, но не цепному процессу липидного перекисного окисления; например, олеиновая кислота с 18 атомами углерода и одна двойная связь (C18: 1) не подвергаются этому процессу перекисного окисления липидов. Последний этап, прекращение цепи, происходит после взаимодействия одной ROO •с другим радикалом или антиоксидантом.
Таким образом , механизм действия оксидативного стресса в некоторых случаях может быть связан с усилением ( увеличением ) перекисного окисления липидов мембран. Например, недавно было обнаружено, что при шизофрении происходит увеличение уровней этана, который является прямым маркером перекисного окисления липидов n -3.
Нервная система при нарушениях митохондриального окисления жирных кислот
Наследуемые дефекты бета-оксидации жирных кислот включают в себя группу по меньшей мере 12 заболеваний, характеризующиеся дефицитом отдельных ферментов или транспортеров. Большинство из этих заболеваний имеют различающиеся возраст начала и клинической тяжести. Симптоматика чаще всего является эпизодической и проявляется на фоне вирусных инфекций, физиологического стресса или пролонгированной физической нагрузки. В зависимости от характера генетического дефекта пациенты развивают гипокетонемическую гипогликемию, кардиомиопатию, рабдомиолиз, нарушение функции печени или внезапную смерть. Диагноз основывается на оценке специфических биохимических маркеров (ацетилкарнитиновый профиль периферической крови). Превентивные мероприятия эффективно предупреждают тяжёлые клинические проявления, включая внезапную смерть.
1. Казанцева Л.З., Николаева Е.А. Клинические проявления, диагностика и возможности лечения важнейших генетически детерминированных заболеваний, вязанных с патологией обмена органических кислот у детей // Лечащий врач. - 1999. - № 1. - C. 43-47.
2. Brown N.F., Mullur R.S., Subramanian I., Esser V., Bennett M.J., Saudubray J.M., Feigenbaum A.S., Kobari J.A., Macleod P.M., Mcgarry J.D., Cohen J.C. Molecular characterization of L-CPT I deficiency in six patients: insights into function of the native enzyme // Journal of lipid research. - 2001. - Vol. 42, № 7. - P. 1134-1142.
4. Gessner B.D., Gillingham M.B., Johnson M.A., Richards C.S., Lambert W.E., Sesser D., Rien L.C., Hermerath C.A., Skeels M.R., Birch S., Harding C.O., Wood T., Koeller D.M. Prevalence and distribution of the c.1436C-->T sequence variant of carnitine palmitoyltransferase 1A among Alaska Native infants // The Journal of pediatrics. - 2011. - Vol. 158, № 1. - P. 124-129.
5. Greenberg C.R., Dilling L.A., Thompson G.R., Seargeant L.E., Haworth J.C., Phillips S., Chan A., Vallance H.D., Waters P.J., Sinclair G., Lillquist Y., Wanders R.J., Olpin S.E. The paradox of the carnitine palmitoyltransferase type Ia P479L variant in Canadian Aboriginal populations // Molecular genetics and metabolism. - 2009. - Vol. 96, № 4. - P. 201-207.
6. Gregersen N., Andresen B.S., Corydon M.J., Corydon T.J., Olsen R.K., Bolund L., Bross P. Mutation analysis in mitochondrial fatty acid oxidation defects: Exemplified by acyl-CoA dehydrogenase deficiencies, with special focus on genotype-phenotype relationship // Human mutation. - 2001. - Vol. 18, № 3. - P. 169-189.
7. Kompare M., Rizzo W.B. Mitochondrial fatty-acid oxidation disorders // Seminars in pediatric neurology. - 2008. - Vol. 15, № 3. - P. 140-149.
8. Lang T.F. Adult presentations of medium-chain acyl-CoA dehydrogenase deficiency (MCADD) // Journal of inherited metabolic disease. - 2009. - Vol. 32, № 6. - P. 675-683.
9. Newborn screening: toward a uniform screening panel and system--executive summary. // Pediatrics. - 2006. - Vol. 117, № 5 Pt 2. - P. S296-307.
10. Sanderson S., Green A., Preece M.A., Burton H. The incidence of inherited metabolic disorders in the West Midlands, UK // Archives of disease in childhood. - 2006. - Vol. 91, № 11. - P. 896-899.
11. Schatz U.A., Ensenauer R. The clinical manifestation of MCAD deficiency: challenges towards adulthood in the screened population // Journal of inherited metabolic disease. - 2010. - Vol. 33, № 5. - P. 513-520.
12. Spiekerkoetter U. Mitochondrial fatty acid oxidation disorders: clinical presentation of long-chain fatty acid oxidation defects before and after newborn screening // Journal of inherited metabolic disease. - 2010. - Vol. 33, № 5. - P. 527-532.
Наследуемый дефицит карнитин пальмитоилтрансферазы входит в группу митохондриальных болезней с нарушением бета-окисления жирных кислот. Врождённые дефекты оксидации жирных кислот, особенно интенсивно изучающиеся в последние 10-15 лет, насчитывают, по меньшей мере, 12 заболеваний, согласно количеству ферментов, участвующих в процессе окисления. Указанные метаболические дефекты могут иметь серьезные клинические последствия в виде гипогликемических судорог, повреждения мышц, метаболи ческого ацидоза и поражения печени. Считается, что такие клинические состояния, как рабдомиолиз после физической нагрузки, неясная печеночная энцефалопатия и гипокетонемическая гипогликемия с судорожным синдромом в раннем младенческом возрасте, в большинстве случаев ассоциированы с врожденными дефектами митохондриального окисления жирных кислот. Кроме того, известно, что часть случаев синдрома внезапной смерти младенческого возраста асс оциирована с наличием мутаций, характерных для митохондриальных болезней.
Значительный прогресс в изучении указанных заболеваний был достигнут в последнее десятилетие, что связано с акти вным внедрением неонатального скрини нга с использованием тандемной масс -спектр ометрии и генетического тестирования.
Эпидемиология. В целом, каждая из митохондриальных болезней с нарушением бета-окисления жирных кислот встречается редко, однако вся группа занимает значительную долю среди наследуемых дефектов метаболизма. Например , результаты крупномасштабного исследования, проведенного в Великобритании в 1998-2003 гг., показали следующую распространенность и структуру наследуемых дефектов метаболизма [10]:
● Митохондриальные болезни (в том числе, болезни нарушения бета-окисления жирных кислот) - 20.3 на 100 000;
● Лизосомальные болезни накопления - 19.3 на 100 000;
● Нарушения обмена аминокислот (исключая фенилкетонурию) - 18.7 на 100 000;
● Органические ацидемии - 12.6 на 100 000;
● Фенилкетонурия - 8.1 на 100 000;
● Пероксисомные болезни - 7.4 на 100 000;
● Болезни накопления гликогена - 6.8 на 100 000;
● Болезни нарушения цикла мочевины - 4.5 на 100 000.
Митохондриальное бета-окисление жирных кислот обеспечивает углеродными субстратами процесс глюконеогенеза и энергетические потребности в фазу голодания организма. В печени процесс бета-окисления генерирует ацетил-КоА (коэнзим А), что поддерживает глюконеогенез и кетогенез (образование бета-гидроксибутирата и ацетоацетата). В мышцах бета-окисление к ритически необходимо для вовлечения ацетил-КоА в цикл Кребса и обеспечение энергетических потребностей, но в мышечной ткани кетоновые тела почти не образуются. Ткани головного мозга крайне нуждаются в бета-окислении для энергопродукции, одновременно утилизируя для этих же целей кетоны, синтезированные в печени . Если при голодании печень не синтезирует кетоновые тела в нужном количестве, головной мозг испытывает мета болический шок, клинически проявляющийся нарушением сознания и судорог ами.
Жирные кислоты (ЖК) с различной длиной углеродной цепи (коротко-, средне- и длинноцепочеч ные) являются компонентами триглицеридов и фосфолипидов. Ос новным источником жирных кислот во время голодания являются триглицериды жировой ткани, которые расщепляются под влиянием липаз (ингибируются инсулином), далее жирные кислоты поступают в печень и активируются путем присоединения ацетил-КоА и формирования комплекса ацетил-КоА-ЖК (процесс этерификации, специфический для каждой жирной кислоты). Комплекс ацетил-КоА-ЖК формируется в цитоплазме гепатоцитов, но для проникновения в митохондрии длинноцепочечных ЖК необходим отдельный метаболический путь с участием карнитина и специфических ферментов.
Метаболический путь с участием карнитин пальмитоилтрансферазы (CPT). Во время фазы насыщения организма фермент ацетил-КоА карбоксилаза активен и конвертирует ацетил-КоА (коэнзим А) в малонил-КоА, которы й ингибирует активность CPT 1 типа. Во время фазы голодани я глюкагон деактивирует ацетил-КоА карбоксилазу путём фосфорилирования. Концентрация малонил-КоА падает, что активирует CPT1, которая, находясь на внешней стороне мембран митохондрий, заменяет молекулы КоА на карнитин в цитоплазматически х длинноцепочечных жирных кислотах (ДЖК). Комплекс карнитин-ДЖК перемещается на внутреннюю часть мембран митохондрий, где посредством CPT 2 типа происходит обратная замена карнитина на ацетил-КоА и комплекс ацетил-КоА-ДЖК поступает во внутренние компартаменты митохондрий для участия в процессе бета-оксидации жирных кислот. Процесс переноса длинноцепочечных ЖК через мембрану митохондрий с участием карнитина и соответствующих ферментов носит условное название «карнитиновый шаттл» (рис. 1).
В отличие от длинноцепочечных жирных кислот (C16-18), коротко- и среднецепочечные жирные кислоты не нуждаются в «карнитиновом шаттле» и способны прямо проникать через митохондриальную мембрану. Эта их способность используется в терапевтических целях путем диетического замещения при состояниях, которые связаны с тем или иным нарушением «карнитинового шаттла» (системный дефицит карнитина, дефицит CPT 1 и 2 типов и т.д.).
Дефицит ацетил-КоА дегидрогеназы среднецепочечных жирных кислот (medium-chain acyl-CoA dehydrogenase, MCAD дефицит) считается самым частым и изученным дефектом оксидации ЖК (частота составляет 1:4000-1:10000 новорождённых в северной Европе). Эксперты поставили этот метаболический дефект на первое место в очень широком списке претендентов для создания программы неонатального скрининга метаболических болезней в Европе [9]. Клинические проявления включают в себя гипокетонемическую гипогликемию на фоне катаболического стресса (голодание, инфекция, рвота, диарея, лихорадка), могут быть судороги и кома. У выживших после комы пациентов отмечается умеренный психоневрологический дефицит, гепатомегалия. Медиана возраста первых проявлений - 1,5 года (варьиру ет от новорожденных до подросткового возраста). Считается, что с возрастом метаболические кризы становятся реже и исчезают у многих выживших пациентов после 5 лет . Однако при отсутствии диетической ко ррекции, повторяющиеся гипогликемические кризы могут приводить к задержке психомоторного развития и трудностями в обучении. В то же время, недавно опубликованные данные неонатального скрининга показывают, что многие случаи протекают асимптомно, хотя у носителей дефекта смертность превышает популяционную в 5 раз.
Дефекты бета-окисления длинноцепочечных жирных кислот можно разделить на 4 группы, имеющие различающиеся клинические проявления и подходы к терапии:
1. Дефект карнитинового траспортера, ведущий к дефициту карнитина - дефицит OCTN2 (organic cation carnitine transporter 2).
2. Дефекты вышеописанного «карнитинового шаттла» - дефициты CPT1 и CPT2 (carnitine palmitoyl-CoA transferase 1 and 2), дефицит CACT (carnitine acylcarnitine translocase).
3. Дефекты непосредственно процесса бета-оксидации - дефицит VLCAD (very-long-chain acyl-CoA dehydrogenase), дефицит LCHAD (long-chain 3-hydroxyacyl-CoA dehydrogenase), дефицит mTFP (mitochondrial trifunctional protein), дефицит LKAT (long-chain 3-ketoacyl-CoA thiolase), дефицит ACAD9 (acyl-CoA dehydrogenase 9).
4. Множественный дефицит ацетил-КоА дегидрогеназ - MAD (multiple acyl-CoA dehydrogenase) дефицит.Митохондриальные болезни с нарушением бета-окисления жирных кислот в большинстве случаев имеют аутосомно-рецессивный характер наследования, клинические проявления чаще всего интермиттирующие и выявляются в периоды повышенной энергетической потребности. Кризы могут быть связаны с голоданием, стрессом (например, инфекцией) и интенсивной физической нагрузкой. Для большинства указанных метаболических дефектов описаны одна или несколько каузальных мутаций, формирующие различающиеся по степени выраженности клинических проявлений фенотипы.
N. Gregersen с соавт. [6] предложили выделять три клинических фенотипа наследуемого дефицита окисления длинноцепочечных жирных кислот:
1. Ранняя, часто неонатальная, манифестация с тяжелым течением. Фенотип
характеризуется наличием кардиомиопатии (может быть с перикардитом), печеночной энцефалопатии (близкой по клинико-лабораторным проявлениям к синдрому Рея) или тяжелой гипокетонемической гипогликемии (могут быть судороги и кома). Также возможно и различное сочетание указанных синдромов. Общая летальность без лечения составляет 40-80 %, смерть может наступить в первые дни жизни, хотя внутриутробные проявления чаще всего отсутствуют. Кардиомиопатия полностью обратима при восполнении энергодефицита диетическим добавлением среднецепочечных жирных кислот. Гипогликемия также мож ет быть предупреждена более частыми кормлениями и контролем избыточного катаболизма (добавление в пищу легкоу свояемых углеводов, например, термически не обработанного кукурузного крахмала во время инфекций и других интеркуррентных заболеваний; в более старшем возрасте - избегание голодания, употребления алкоголя (особенно «на голодный желудок»), резкого диет-опосредованного похудания, профессиональных занятий спортом и особых протоколов ведения беременности [11]).
2. Манифестация в первые годы жизни с относительно нетяжелым течением. В основном проявляется гипокетонемической гипогликемий при стрессовых условиях (голодание, инфекции) и гепатомегалией вследствие гепатостеатоза. Клинические проявления весьма похожи на MCAD дефицит (см. выше). При соответствующем лечении прогноз благоприятный с полной реверсией стеатоза. Терапия такая же, как и при первом фенотипе.
3. Поздняя манифестация (подростки, взрослые) с преобладанием мышечных симптомов. Характеризуется эпизодами мышечной слабости, болей в мышцах и рабдомиолиза после физической нагрузки. Характерна острая или персистирующая гиперферментемия (увеличение концентраций креатинфософкиназы, аминотрансфераз). Анамнез иногда указывает на наличие признаков 1 или 2 фенотипов в раннем детстве. Соответствующие протективные меры (легкоусвояемые углеводы перед предполагаемой нагрузкой, запрет на занятия профессиональным спортом) позволяют избежать потенциально фатального рабдомиолиза.
Ассоциация клинических проявлений с метаболическим дефектом при врожденных нарушениях митохондриального окисления жирных кислот показана в таблице.
Проведенный в последние годы неонатальный скрининг показал, что многие дети с наличием метаболического дефекта окисления длинноцепочечных жирных кислот (VLCAD - оказался самым частым выявляемым дефектом из этой группы, а также CPT1 и CPT2) остаются бессимптомными на протяжении длительного периода наблюдения [12]. Некоторые VLCAD позитивные пациенты со временем развивают симптомы миопатии. Считается, что в основе благоприятного клинического течения митохондриальных болезней может лежать относительно высокая резуидальная активность затронутого дефектом фермента [12].
Ассоциация клинических проявлений с метаболическим дефектом при врожденных нарушениях митохондриального окисления жирных кислот)
Гипокетонемическая гипогликемия после голодания/катаболического стресса
PCD = primary carnitine deficiency, CACT. CPT1, CPT2, LCHAD, MCAD, SCAD, MTP, VLCAD, ACAD9
Читайте также:
