Нервная система при врожденных дефектах метаболизма ГАМК
Добавил пользователь Дмитрий К. Обновлено: 21.01.2026
Прежде всего необходимо подчеркнуть, что незрелый мозг новорожденных не является просто уменьшенной копией или версией мозга взрослых [3]. Незрелый мозг во время развития и созревания постоянно претерпевает множество структурных и функциональных изменений, начиная с рождения новых клеток, их миграции, роста, установления и переустанавления многочисленных клеточных контактов, кончая смертью определенных клеток. Этот период, как уже было описано выше, характеризуется также повышенной возбудимостью и склонностью к эпилептогенезу.
К настоящему времени существует множество экспериментальных моделей эпилептогенеза как in vivo, так in vitro. Модели на животных могут быть использованы для решения многих задач, таких как исследования патофизиологических механизмов эпилепсии, испытание и разработка новых средств лечения, изучение последствий повторяющихся эпилептических разрядов и др. Однако в настоящее время адекватных in vivo моделей, позволяющих изучать механизмы вторичного эпилептогенеза в незрелом мозге, почти нет. Подавляющее большинство моделей для исследования эпилептогенеза разработаны на взрослых животных и не пригодны для изучения детской эпилепсии и, тем более, для исследования механизмов вторичного эпилептогенеза у детей по многим причинам [63]. У новорожденных и у детей раннего возраста основными причинами генерации эпилептиформных разрядов являются гипоксическая-ишемическая энцефалопатия, температурная лихорадка и различные травмы головного мозга во время родов [18]. Хорошо известно, что такие нарушения у детей намного чаще, чем у взрослых сопровождаются развитием эпилептического статуса, называемого как стойкое эпилептическое состояние с повторяющимися или непрерывными приступами, которые продолжаются более 30 мин, или между которыми больной не может полностью достичь своего нормального психического и неврологического состояния [64]. Предполагается, что генерация повторных иктальных эпилептиформных разрядов и возникновение эпилептического статуса у новорожденных и детей раннего возраста являются одним из основных факторов риска эпилептогенеза в процессе развития [65]. Поэтому в настоящее время для запуска и исследования детского эпилептогенеза наиболее часто используются модели, в которых у постнатальных животных вызывают эпилептиформные разряды или эпилептический статус при помощи различных химических конвульсантов, таких как пилокарпин, каинатная кислота и др.; ишемического инсульта мозга, искусственного повышения температуры тела (фебрильные судороги) или повторной высокочастотной электрической стимуляции определенных структур мозга - модель «киндлинга» [63, 64, 66, 67]. Однако все эти модели недостаточно адаптированы для исследования механизмов и необходимых условий вторичного эпилептогенеза в незрелом мозге, главным образом, из-за невозможности разделить фоновое патогенное воздействие конвульсанта от эпилептогенного эффекта повторяющихся эпилептиформных разрядов per se на формирование эпилептического фокуса. Например, локальная инъекция химических конвульсантов на определенные структуры мозга из-за диффузии или аксонального транспорта не будет действовать локально.
In vitro модель вторичного эпилептогенеза
Для исследования механизмов и необходимых условий вторичного эпилептогенеза в незрелом мозге нами была разработана новая модель, которая позволяет искусственно вызвать генерацию локальных повторных эпилептиформных разрядов и исследовать их эпилептогенный эффект на интактной ткани. Был разработан новый препарат, который состоит из двух взаимосвязанных комиссуральными волокнами интактных гиппокампов новорожденных (7-9-дневных) крыс или мышей [41, 68], что приблизительно соответствует 1-му году жизни человека (рис. 3) [26, 69]. Рисунок 3. Генерация и межгиппокампальное проведение иктальных эпилептиформных разрядов. а - гиппокампальный препарат; б - схема трехотсектной камеры с препаратом гиппокампа; в - схема эксперимента: два гиппокампа и соединяющие их комиссуральные волокна имеют три независимых перфузионных входа (стрелки слева) и один общий выход (стрелка справа). На один гиппокамп в течение 1 мин повторно (каждые 15-20 мин) апплицировался каинат (+КА); г - одновременная экстраклеточная регистрация иктальных эпилептиформных разрядов, вызванных аппликацией каината в ипсилатеральном (ипси-) и контралатеральном (контра-) гиппокампах. Ниже при большей развертке показаны различные фазы иктального разряда. Специально разработанная камера позволяет размещать левый и правый гиппокампы и соединяющие их комиссуральные волокна в три отдельных отсека и перфузировать их раздельно [42]. Эта модель дет возможность вызывать эпилептиформные разряды в одном гиппокампе (имитирующий «первичный эпилептогенный очаг») локальной аппликацией на него конвульсивного агента, например каината. При использовании этого препарата нами отмечено, что кратковременная (в течение 1 мин) аппликация каината на один гиппокамп (ипсилатеральный) вызывает генерацию в этом гиппокампе длительного (1-2 мин) эпилептиформного тонико-клонического иктального разряда, который с небольшой задержкой проводится на другой (контралатеральный) гиппокамп. После 10-15 аппликаций каината (с интервалом 15-20 мин) на один гиппокамп, в котором каждая аппликация каината сопровождалась генерацией иктальных разрядов, проводящимися на контралатеральный (контра-) гиппокамп, оба гиппокампа начинают генерировать спонтанные и синхронные эпилептиформные иктальные и интериктальные разряды. Блокада комиссуральной проводимости аппликацией тетродотоксина или перерезкой обнаружила, что контралатеральный гиппокапм (в ~75% случаях) способен самостоятельно генерировать спонтанные эпилептиформные тонико-клонические иктальные разряды (рис. 4). Рисунок 4. Спонтанная и вызванная эпилептиформная активность в зеркальном эпилептическом фокусе (ЗЭФ). а - экстраклеточная регистрация спонтанных и вызванных эпилептиформных разрядов в интактном контралатеральном гиппокампе; б - в срезах контралатерального гиппокампа через 24 ч после формирования ЗЭФ; в - петч-кламп регистрация спонтанной и вызванной эпилептиформной активности в пирамидной СА3 клетке контралатерального гиппокампа в режиме фиксации тока. На этой модели нами впервые было экспериментально показано, что повторные эпилептические разряды per se способны трансформировать интактную ткань незрелого мозга в эпилептический очаг, который в данном случае называется «зеркальным эпилептическим фокусом» (ЗЭФ), поскольку он возник в гомологичной структуре мозга.
Используя эту модель ЗЭФ, нам удалось установить некоторые условия и фундаментальные механизмы индукции и экспрессии вторичного эпилептического очага. Во-первых, одним из необходимых условий индукции ЗЭФ является активация НМДА-рецепторов. Блокада НМДА-опосредованных синаптических токов аппликацией антагониста НМДА-рецепторов на контралатеральный гиппокамп не препятствовала генерации и распространению эпилептиформных разрядов, иницированных каинатом в ипсилатеральном гиппокампе, но предотвратила формирование ЗЭФ [42]. Парадоксально, но аналогичный результат был получен и в экспериментах с избирательным блокированием ГАМК-рецепторов [70], что указывает на важную роль ГАМКергической синаптической передачи во вторичном эпилептогенезе. Во-вторых, дальнейший анализ электрических регистраций в контрольных экспериментах и в экспериментах с антагонистами НМДА- и ГАМК-рецепторов показал, что одним из важнейших условий формирования ЗЭФ является наличие высокочастотных осцилляций (ВЧО), 60-120 Гц во время повторных распространяющихся иктальных разрядов. В контрольных экспериментах повторные иктальные разряды с осцилляциями с частотной полосой не выше 10-20 Гц не сопровождались формированием ЗЭФ, так же как и в экспериментах с антагонистами НМДА- и ГАМК-рецепторов, в которых контралатеральный гиппокамп в отличие от ипсилатерального генерировал иктальные разряды без высокочастотных осцилляций. Поэтому, наличие или отсутствие ВЧО могут быть использованы как биомаркеры эпилептогенности иктальных разрядов в незрелом мозге [70]. В-третьих, экспрессия эпилептического фокуса сопровождалась значительными изменениями в функционировании ГАМКергической системы. Нами обнаружено, что в нейронах ЗЭФ ГАМК обладает повышенным возбуждающим действием из-за перманентно повышенной [Cl - ] I и положительного сдвига потенциала реверсии ГАМК-опосредованных постсинаптических токов [42, 49, 70]. Возбуждающее действие ГАМК было обнаружено также и в срезах мозга, полученных в ходе хирургического удаления эпилептического очага, у пациентов с фармакорезистентной эпилепсией [71]. Поэтому понимание молекулярных и клеточных механизмов и роли ГАМКергической системы в формировании вторичного эпилептического фокуса имеет огромное значении как в лечении эпилепсии, так и в предотвращении эпилептогенеза, т.е возникновения эпилепсии.
Поскольку в наших экспериментах ключевым элементом в формировании эпилептического фокуса является возбуждающее действие ГАМК, которое обусловлено хронически повышенной концентрацией [Cl-]i, в первую очередь возникает вопрос о механизмах, лежащих в основе изменений хлорного гомеостаза.
Как уже было сказано, в ЦНС хлорный гомеостаз поддерживается главным образом двумя противоположно направленными хлорными ко-транспортерами: NKCC1 - хлорный импортер и КСС2 - хлорный экспортер. Считается, что в незрелом мозге наиболее активен NKCC1, тогда как максимальная активность КСС2 достигается только в зрелых нейронах. Поэтому мы в первую очередь исследовали роль NKCC1 в генерации, распространении эпилептиформных разрядов и формировании вторичного эпилептического очага [49]. Нами впервые показано, что фармакологическая или генетическая блокада (Knock out) NKCC1 не предотвращала ни генерацию и распространение эпилептиформных разрядов, ни формирование ЗЭФ. Однако специфический антагонист NKCC1, буметанид, полностью блокировал спонтанную и вызванную эпилептиформную активность в ЗЭФ. Используя метод измерения ионных токов (пэтч-кламп): регистрацию одиночных НМДА- и ГАМК-активируемых ионных каналов, показано, что буметанид уменьшает возбуждающее действие ГАМК за счет частичного снижения [Cl - ] i и отрицательного сдвига потенциала реверсии ГАМК-опосредованных постсинаптических токов [49, 72]. Таким образом, буметанид, несмотря на то что не способен предотвратить вторичный эпилептогенез, является эффективным антиконвульсантом. В настоящее время буметанид проходит клинические испытания в качестве противоэпилептического препарата у детей.
Далее, используя различные электрофизиологические и иммунохимические методы, мы продемонстрировали, что повышенная [Cl - ] i и возбуждающее действие ГАМК в ЗЭФ является результатом интернализации и даун-регуляции КСС2 [72]. В контрольной ткани фармакологическая блокада КСС2 при помощи специфического антагониста увеличивала внутринейрональную концентрацию хлора и вызывала генерацию эпилептиформной активности. Кроме того, в экспериментах на 20-дневных эмбрионах мышей с генетической блокадой КСС2 мы впервые зарегистрировали спонтанные эпилептиформные разряды, что также косвенно указывает на важную роль КСС2 в механизмах эпилептогенеза в незрелом мозге [73].
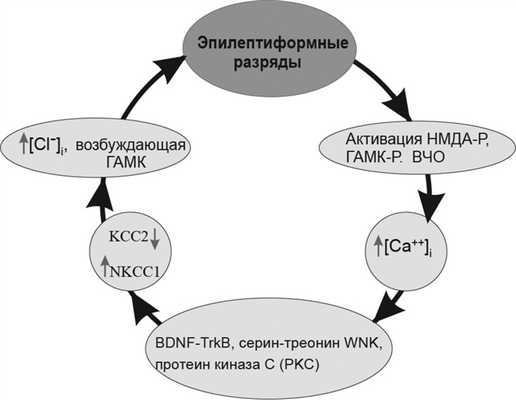
На основе собственных и литературных данных нами построена гипотеза об основных условиях и механизмах вторичного эпилептогенеза (рис. 5). Рисунок 5. Гипотетический порочный круг вторичного эпилептогенеза в незрелом мозге. Ключевыми элементами данного гипотетического «порочного круга» являются: 1) периодически повторяющиеся эпилептиформные иктальные разряды, содержащие высокочастотные (ВЧО, >60 Гц) осцилляции; 2) активация НМДА- и ГАМК-рецепторов (НМДА-Р и ГАМК-Р), которые участвуют в генерации высокочастотных осцилляций (ВЧО, >60 Гц) [42, 70]; 3) вход ионов Ca ++ через НМДА-рецепторы и потенциалзависимые кальциевые каналы [74]; 4) повышение внутриклеточной концентрации Ca ++ , вызывающей активацию множества различных внутриклеточных каскадов, включающих BDNF-TrkB [75, 76], серин-треонин протеинкиназа WNK [77, 78], протеинкиназа С [79, 80], что может привести к модификациям эффективности работы хлорных котранспортеров, результирующих в повышенной [Cl - ] i из-за из-за негативной (down) регуляции КСС2 [72] и позитивной (up) регуляции NKCC1 [14].
Проблемы лечения заболеваний нервной системы у детей раннего возраста
Перинатальная патология нервной системы у детей раннего возраста является одной из наиболее актуальных проблем в педиатрии, так как нередко приводит к дезадаптации ребенка в социальной среде, а в тяжелых случаях - к инвалидизации. В связи с этим большое значение приобретают поиски новых эффективных методов лечения поражений ЦНС у детей раннего возраста, о чем мы попросили рассказать Галину Станиславовну Голосную, доктора медицинских наук, профессора кафедры неврологии, нейрохирургии и клинической генетики педиатрического факультета ГБОУ ВПО «Российский национальный исследовательский медицинский университет имени Н.И. Пирогова» Минздравсоцразвития РФ.
Галина Станиславовна, расскажите, пожалуйста, каковы варианты последствий перинатального поражения нервной системы (ППНС) у детей раннего возраста?
Варианты последствий перинатального поражения нервной системы отражены в классификации, представленной ниже (табл.). Наиболее актуальными для практических врачей являются именно гипоксические поражения головного мозга, которые занимают первое место в структуре ППНС и являются основными причинами перинатальной смертности, составляя от 20 до 50% в ее структуре, а также факторами возникновения необратимых дефектов ткани головного мозга. У 5-15% недоношенных детей, перенесших гипоксическое поражение ЦНС, впоследствии формируются выраженные спастические параличи, эпилепсия, поражение органов слуха и зрения, а у 25-50% детей диагностируется расстройство когнитивных функций и нарушения поведения. Развивающийся мозг новорожденного чрезвычайно чувствителен к воздействию гипоксии, которая не только вызывает очаговые повреждения мозговой ткани, но и задерживает развитие сосудистой системы, а также нарушает клеточную дифференциацию. Толерантность к воздействию повреждающих факторов у каждого ребенка различна. Поэтому при относительно равных условиях у детей развиваются не равнозначные последствия ППНС. Как таковой инсульт новорожденных вследствие гипоксических изменений отличается от инсульта у взрослых не только локализацией, но и обширностью дистрофических изменений и задержкой миелинизации нервной системы.
Таблица
Классификация перинатальных поражений нервной системы у новорожденных
(Н.Н. Володин, А.С. Петрухин, 1999)
| I. Гипоксические поражения ЦНС A. Церебральная ишемия (Р.91.0) 1. Церебральная ишемия I степени (легкая) 2. Церебральная ишемия II степени (средней тяжести) 3. Церебральная ишемия III степени (тяжелая) Б. Внутричерепные кровоизлияния гипоксического генеза (Р.52) 1. Внутрижелудочковое кровоизлияние I степени (субэпендимальное) 2. Внутрижелудочковое кровоизлияние II степени (субэпендимальное + интравентрикулярное) 3. Внутрижелудочковое кровоизлияние III степени (субэпендимальное + интравентрикулярное + перивентрикулярное) B. Сочетанные ишемические и геморрагические поражения ЦНС (не травматические) II. Травматические повреждения нервной системы A. Внутричерепная родовая травма (Р.10) 1. Эпидуральное кровоизлияние 2. Субдуральное кровоизлияние (супра-, субтенториальное) 3. Внутрижелудочковое кровоизлияние 4. Паренхиматозное кровоизлияние (геморрагический инфаркт) 5. Субарахноидальное кровоизлияние Б. Родовая травма спинного мозга (Р.11.5) 1. Кровоизлияние в спинной мозг (растяжение, разрыв, надрыв) с травмой или без травмы спинного мозга B. Родовая травма периферической нервной системы (Р.14) 1. Травматическое повреждение плечевого сплетения а) проксимальный тип Эрба - Дюшена (С5-С6) б) дистальный тип Дежерин-Клюмпке (С7-Т1) в) тотальный паралич (С5-Т1) | 2. Повреждение диафрагмального нерва (С3-С5) 3. Травматическое повреждение лицевого нерва 4. Травматическое повреждение других периферических нервов III. Дисметаболические и токсико-метаболические нарушения функций ЦНС А. Преходящие нарушения обмена веществ (Р.70-Р.71) 1. Ядерная желтуха (билирубиновая энцефалопатия) 2. Гипогликемия 3. Гипокальциемия 4. Гипермагнезиемия 5. Гипомагнезиемия 6. Гипонатриемия 7. Гипернатриемия Б. Токсико-метаболические нарушения функций ЦНС (Р.04) 1. Состояния, обусловленные приемом во время беременности алкоголя, табакокурение, употребление наркотиков и медикаментов, вызывающих зависимость 2. Состояния, обусловленные действием на ЦНС токсинов (вирусных, бактериальных) 3. Состояния, обусловленные действием на ЦНС лекарственных препаратов (или их сочетание), введенных плоду и новорожденному IV. Поражение ЦНС при инфекционных заболеваниях перинатального периода А. Поражение ЦНС при внутриутробных инфекциях (Р.35-Р.37) 1. Энцефалит, менингит, менингоэнцефалит 2. Цитомегаловирус, герпес, токсоплазмоз, врожденная краснуха, ЕСНО-вирусы, сифилис и другие Б. Поражение ЦНС при неонатальном сепсисе (Р.36; Р.37.2; Р.37.5) 1. Менингит, менингоэнцефалит, вентрикулит, энцефалит 2. Стрептококк, стафилококк, колибактерии, клебсиелла, синегнойная палочка, листериоз, грибок |
Уже доказано, что смерть клеток при гипоксии происходит не только по типу некротического поражения, но и с развитием апоптоза клеток, который, в свою очередь, угнетается и индуцируется факторами специфической и неспецифической защиты.
В настоящее время получено значительное количество новой информации о патогенезе гипоксического перинатального поражения ЦНС, его молекулярных и биологических основах. На биологических моделях установлена многоуровневая система химической регуляции, обеспечивающая жизнеспособность и защиту нейронов от неблагоприятных влияний, а также программируемую гибель клеток в случае повреждения мозга с участием многочисленных нейротрофических и ростовых факторов. В связи с этим большой интерес представляет изучение этих факторов и репаративных механизмов, определяющих течение, исходы гипоксии мозга у новорожденных, а также возможности реабилитации в неонатальном периоде.
Какова комплексная терапия данных заболеваний? Какие современные группы препаратов можно использовать в реабилитации детей с ППНС, особенно с первых дней жизни?
Основные принципы комплексной терапии следующие:
- Профилактика и ранняя терапия внутриутробной гипоксии новорожденного.
- Скорейшее восстановление нормальной проходимости дыхательных путей и адекватная вентиляция легких.
- Ликвидация возможной гиповолемии.
- Поддержание адекватной перфузии мозга за счет предупреждения как кратковременных изменений давления, так и полицитемии, гиперволемии.
- Охранительный режим: профилактика охлаждения, перегревания.
- Введение дексаметазона (0,5 мг/кг).
- При судорогах введение фенобарбитала (10-20 мг/кг), затем - 3-4 мг/кг/сут.
- Введение фуросемида (1-2 мг/кг) 2 раза в сутки детям после 2 суток жизни. При не восстановившемся диурезе введение мочегонных препаратов неэффективно.
- Гемостатическая терапия.
- Лечение отека мозга.
- Ноотропные препараты, улучшающие трофические процессы: пантогам (40 мг/кг/ сут), инстенон (10-15 мг/кг/сут), кортексин (10 мг/сут), актовегин (1 мл/сут, внутривенно, капельно).
- Церебролизин, витамины группы В назначают новорожденным после 2-й недели жизни. Церебролизин противопоказан новорожденным с судорогами в анамнезе.
В реабилитации детей с первых дней жизни, имеющих ППНС, используют в основном препараты, улучшающие микроциркуляцию и состояние сосудистой системы: актовегин, кавинтон, траумель S (чаще используется при гемморагическом типе нарушений), ноотропные препараты, циннаризин, витамины группы А, Е. При развитии ликвородинамических нарушений и необходимости их медикаментозной коррекции - диакарб, триампур. Необходимо отметить, что важна индивидуальная оценка неврологических нарушений и темпов развития каждого ребенка.
Каково патогенетическое обоснование применения в комплексной терапии неврологических заболеваний у детей ноотропных препаратов, в том числе препаратов гопантеновой кислоты? Какова фармакодинамика Пантогама?
Современные представления о механизмах нейронального повреждения при длительном или значительном действии таких повреждающих факторов, как гипоксия и ишемия, знание нейропатофизиологических процессов при гипоксическом поражении мозга дает возможность применения в комплексной терапии реабилитационных программ у детей первого года жизни нейропротективных препаратов. В последние годы в лечении различных заболеваний ЦНС у детей все большее значение приобретают препараты, воздействующие на обмен центральных медиаторов, особенно лекарственные средства, влияющие на метаболизм тормозного нейромедиатора - гаммааминомасляной кислоты (ГАМК).
Одним из таких препаратов является Пантогам, разработанный в 70-е годы XX века НПО «Витамины» и с 1995 года выпускаемый российской компанией «ПИК-ФАРМА». Пантогам по химической структуре представляет собой кальциевую соль D(+)-пантоил гаммааминомасляной кислоты и относится к ноотропным препаратам смешанного типа с широким клиническим применением. Пантогам обладает целым рядом свойств, которые определяют его особое место среди других лекарственных средств. Пантогам является естественным метаболитом ГАМК в нервной ткани, в отличие от других ГАМК-призводных ноотропных препаратов. Благодаря присутствию в молекуле Пантогама пантоильного радикала, препарат проникает через гематоэнцефалический барьер и оказывает выраженное воздействие на функциональную активность ЦНС. Пантогам в организме практически не метаболизируется и в течение 48 часов выводится в количестве 95-98%.
Фармакологические эффекты Пантогама обусловлены прямым влиянием на ГАМК-рецепторно-канальный комплекс. Препарат оказывает также активирующее влияние на образование ацетилхолина. Пантогам способствует нормализации метаболизма ГАМК при различных видах патологии, улучшает утилизацию глюкозы и кровоснабжение мозга, повышает устойчивость мозга к гипоксии, воздействию токсических веществ, стимулирует анаболические процессы в нейронах. Пантогам применяется при лечении неврологических и психических заболеваний как изолированно, так и в комбинации с другими препаратами, при этом хорошо переносится детьми. Сочетание мягкого психостимулирующего и умеренно седативного эффектов Пантогама (в отличие от других ноотропных средств) позволяет активировать когнитивные функции у детей, снижает волнение и тревожность, нормализует сон, способствуя полноценному отдыху ребенка. У детей раннего возраста применение препарата Пантогам оптимально при самых первых признаках задержки темпа моторного или психоэмоционального развития, а также в комплексном лечении более выраженных нарушений развития. С года до 3 лет - в комплексной терапии задержек развития нарушения темпа предречевого и речевого развития.
В действии Пантогама сочетаются противосудорожный, дезинтоксикационный и нейровегетотропный эффекты. Препарат может применяться у детей, страдающих эпилепсией и другими судорожными состояниями. Пантогам наряду с нейрометаболическим обладает нейропротекторным и нейротрофическим действием, улучшает когнитивные функции, повышает психическую активность и объем познавательной деятельности.
Наличие двух лекарственных форм Пантогама - таблеток и 10%-ного сиропа, не содержащего сахар, - особенно удобно для применения у детей первого года жизни, дошкольников и детей младшего школьного возраста.
Каковы результаты клинических исследований эффективности использования препарата Пантогам в лечении ППНС у детей?
В основном в отечественной литературе хорошо известны исследования по применению препарата Пантогам при коррекции когнитивных расстройств, синдроме дефицита внимания, астеноневротическом синдроме, нарушении речевого развития. В практике педиатров и неврологов препарат Пантогам широко применяется у детей на первом году жизни при легком и среднетяжелом варианте нарушений психомоторного развития. В настоящее время проведены исследования по эффективности применения препарата Пантогам (сироп) при нарушении психомоторного развития легкой и средней степени у детей второго полугодия жизни (результаты собственных наблюдений (рис.).
Рисунок
Динамика изменений в двигательной, сенсорной и эмоциональной сферах (оценка по О.В. Баженовой) у детей первого года жизни при лечении препаратом Пантогам (сироп)
Гамма - аминомаслянная кислота и психические расстройства ( по данным нейровизуализации)
Дисбаланс между возбуждением и торможением при передаче сигналов нейронами головного мозга рассматривался, как один из молекулярных механизмов, ответственных за психические расстройства. В этом контексте мультимодальные исследования, связывающие непрерывный технический прогресс в нейровизуализации с методами измерения концентраций нейротрамситтера, могут представлять собой поворотный момент для подобных доказательств in vivo. Возможность связать психопатологию, генетику, нейроанатомию и функционально-биохимическую активность мозга может привести исследования в психиатрии психиатрические к пониманию этиологии и патогенеза психических расстройств.
Методы нейровизуализации третьего поколения
Исследования нейровизуализации третьего поколения были обогащены достижениями в области магнитно-резонансной спектроскопии (MRS), измеряющей концентрацию важных нейротрансмиттеров, таких как ингибирующая аминокислота ГАМК ( гамма - аминомаслянная кислота , GABA ).
Ограничения магнитно - резонансной спектроскопии
Магнитно-резонансная спектроскопия является методом выбора для неинвазивного измерения концентрации ГАМК in vivo в отдельных областях мозга. Однако, прямая интерпретация результатов MRS ограничена внутренними особенностями этой методики. В частности, получение сигнала ГАМК ограничено большими (например, 3 × 3 × 3 см 3 ) одиночными вокселями, так как мульти-воксельная спектроскопия обычно измеряет метаболиты с более длительной релаксацией Т2, такие как N-ацетиласпартат , холин и креатин (Cr). Это приводит к широкой гетерогенности между исследованиями в исследуемой анатомической области. Более того, MRS может определять только общую концентрацию нейрохимических и не может различать отдельные функциональные пулы, что затрудняет выводы о доступности нейротрансмиттеров.
В этом контексте мультимодальные подходы, объединяющие MRS с другими взаимодополняющими методами, могут привести к всесторонней интерпретации нейрохимических основ патологий головного мозга. В качестве примера можно привести мультимодальную МRS и функциональную магнитно-резонансную томографию (fМRT), которые помогают изобразить нейрохимические и функциональные патологические механизмы, ответственные за сложные психические расстройства.
Нейрофизиологические исследования
Нейрофизиологические исследования , такие, как электроэнцефалография (ЭЭГ) или магнитоэнцефалография (МЭГ), измеряющая колебательную активность в нейрональных ансамблях головного мозга, могут иметь основополагающее значение для интерпретации результатов по концентрации ГАМК, поскольку гамма - аминомаслянная кислота , как было показано, положительно коррелирует со специфическими для стимула нейронными колебаниями.
Гамма - аминомаслянная кислота и психические расстройства
Гамма - аминомаслянная кислота является основным ингибирующим нейромедиатором в центральной нервной системе млекопитающих. Теории о его дисфункции при шизофрении предполагают, что изменения в нервной цепи с участием ГАМК играют роль в механизмах этого психического расстройства и связанных с ним когнитивных нарушений. Также установлена роль дисфункции ГАМК в различных психических расстройствах, таких как биполярное расстройство (BD) или большое депрессивное расстройство (MDD).
При шизофрении (SZ) унимодальные исследования дали смешанные результаты, так как в литературе сообщалось о повышенных, пониженных или неизмененных уровнях ГАМК в зависимости от региона, фазы заболевания и лечения. И наоборот, мультимодальные результаты показали снижение уровня глутамата, но не ГАМК, у больных шизофренией.
Действительно, в то время как большинство авторов оценивали влияние диагноза на концентрацию ГАМК, другие рассматривали влияние возраста, антипсихотиков и роль ГАМК в разных фазах заболевания. Однако, наиболее часто сообщаемый результат исследований заключается в том, что концентрация ГАМК снижается у пациентов с шизофренией по сравнению со здоровыми людьми. В частности, ГАМК была снижена в медиальной лобной коре (MFC) и затылочной коре (OC) , причем, результат был модулирован по возрасту в MFC и не зависел от типа лекарства или его дозировки. Наблюдаемое снижение уровня ГАМК в MFC у старых больных шизофренией по сравнению с сопоставимым по возрасту контролем позволяет предположить, что концентрация ГАМК снижается с увеличением возраста у пациентов. Независимость изменений в OC от дозировки лекарств была далее распространена на базальные ганглии, что предполагает, гипотезу о снижение ГАМК в этих областях , которое обусловлено расстройством, наблюдаемым также у пациентов с первым эпизодом , а не эффектом лечения. Снижение уровня ГАМК в префронтальных зонах у больных шизофренией было описано только при выполнении МRS при очень высоком (7 Т) магнитном поле. Стоит отметить, что пациенты, принимающие только типичные антипсихотические средства, имели более высокую концентрацию ГАМК, чем те, которые принимали только атипичные антипсихотические препараты.
По- видимому, концентрацию ГАМК в отдельности нельзя считать биомаркером шизофрении, в то время как потенциальное нарушение баланса между возбуждением и торможением, которое можно измерить с помощью соотношения глутамат / ГАМК, требует более глубокого изучения. К сожалению, GABA пока нельзя считать биомаркером биполярного аффективного расстройства ( BD). Первичный дефицит глутаматергического метаболизма может вызывать аберрантные паттерны активации нейронов в областях, специфически релевантных для экспрессии ангедонического поведения при большом депрессивном расстройстве, особенно, в состоянии рецидива депрессии. Кроме того , сниженные уровни гамма - аминомаслянной кислоты были выявлены при расстройствах аутистического спектра.
Биохимические исследования , показали снижение гиппокампальной передачи сигналов глутамата при шизофрении и отсутствие дефицита в синтезе гамма - аминомаслянной кислоты. Тем не менее, мультимодальное исследование, сочетающее функциональную магнитно-резонансную томографию и MRS, выявило, что активность поясной извилины коры связана с глутаматом, N- уровней ацетиласпартата и ангедонии у пациентов с депрессией. Наиболее часто увеличение глутаматергических метаболитов было обнаружено в передней части поясной извилины ( АСС) при синдроме дефицита внимания и гиперактивностии ( СДВГ).
Не было обнаружено различий в уровнях гамма - аминомаслянной кислоты при паническом расстройстве, синдроме посттравматического стрессового расстройства и синдроме дефицита внимания и гиперактивности по сравнению со здоровыми людьми.
Пиридоксин-зависимая эпилепсия - вариант наследственной патологии, связанной с дефектом метаболизма.
При врождённых дефектах метаболизма большинство эпилепсий течёт как эпилептическая энцефалопатия. Одним из вариантов наследственной патологии, ассоциированной с дефектом метаболизма, является пиридоксин-зависимая эпилепсия.

Частым симптомом врождённых дефектов метаболизма в неонатальном и младенческом возрасте является эпилепсия. Она может быть и первым, и ведущим симптомом заболевания. При врождённых дефектах метаболизма большинство эпилепсий течёт как эпилептическая энцефалопатия.
Преимущественно ранняя миоклоническая энцефалопатия и миоклонии ассоциированы с врождёнными дефектами метаболизма, но эпилепсия может также проявляться инфантильными спазмами, с-мом Отахара, резистентными к лекарственной терапии неонатальными судорогами и фенотипом прогрессирующей миоклонус-эпилепсии. Одним из вариантов наследственной патологии, ассоциированной с дефектом метаболизма, является пиридоксин-зависимая эпилепсия.
Этиология её возникновения на биохимическом уровне до конца не установлена. Возможно, присутствуют мутации в структурном гене для декарбоксилазы глютаминовой кислоты (ДГК), картированном на 2q. Заболевание передаётся по аутосомно-рецессивному типу, распространённость составляет 1: 20 000 новорожденных.
Для Клинической картины характерно начало приступов в первые часы после рождения или первый год жизни, затем болезнь течёт как эпилептическая энцефалопатия. Течение заболевания острое. Иногда отмечаются судороги плода, а при родах выявляют окрашенные меконием густые воды, гипоксию плода или асфиксию при рождении. В классическом варианте это возбуждённый новорожденный с нарушением сна, аномальными движениями глаз, повторными фокальными моторными, а также генерализованными тоническими и миоклоническими приступами и инфантильными спазмами. В дальнейшем неврологические нарушения у пациентов включают гипервозбудимость, беспокойство, бессонницу, «стартл» - рефлексы на звуковые и тактильные раздражители, пронзительный высокий крик, мышечную гипотонию или гипертонию, отсутствие безусловных рефлексов, нарушение вскармливания и рвоту, вздутие живота, геморрагии в лёгких, требующих применения ИВЛ.
Для ЭЭГ характерны вспышки локальных или мультифокальных пик-волн, генерализованных пик-волн, участки высоковольтных медленных волн и гипсаритмию.
В диагностике применяется проба с пиридоксином, длящаяся несколько дней. При повторных и коротких приступах пиридоксин назначается перорально до 30 мг на 1 кг веса в сутки, эффект отмечается в сроки от 3-го до 7-го дня.
При тяжёлых приступах в виде статуса пиридоксин вводится внутривенно в суточной дозе от 20 до 100 мг на 1 кг веса. Эффект наступает в течение нескольких минут.
Для подтверждения диагноза проводится молекулярная диагностика с определением мутаций в гене ALDH7A1, кодирующим белок антиквитин.
Лечение Как правило, судороги плохо купируются антиконвульсантами, но прекращаются в течение нескольких минут при назначении пиридоксина парентерально, после чего в течение нескольких часов может отмечаться летаргия, отсутствие реакции на окружающее, тяжёлая гипотония с дальнейшим существенным улучшением клинического состояния. При прекращении терапии пиридоксином судороги возобновляются через несколько дней.
Суточная доза пиридоксина от 50 до 200 мг ( в 1 или 2 приема) предотвращает возникновение повторных приступов. Дозу по мере роста ребёнка можно не увеличивать, а постепенно снижать до 15-20 мг на 1 кг веса. Увеличение дозы оправдано во время инфекций. Части пациентов наряду с пиридоксином показано и совместное назначение противосудорожной терапии.
Генетика метаболизма фолатов
Поскольку метаболизм фолатов является важным звеном базовых биологических процессов, то его нарушения, в том числе генетически обусловленные, рассматриваются как фактор высокого риска развития патологических состояний: сердечно-сосудистых заболеваний (ССЗ), онкологических заболеваний, нарушений репродуктивных функций и патологий развития плода. Своевременное выявление генетической мутации, нарушающей выработку ферментов фолатного цикла, дает возможность эффективно контролировать и корректировать уровень фолиевой кислоты у пациентов, что благотворно сказывается на их здоровье.

Группа соединений фолатов играет ведущую роль в широком спектре жизненно важных процесов:
- Стимулирует эритропоэз
- Участвует в синтезе аминокислот, нуклеиновых кислот, пуринов, пиримидинов, витаминов
- Участвует в обмене холина, гистидина
- Является важным сопутствующим фактором в метилировании ДНК и РНК
- Способствует регенерации мышечной ткани
- Влияет на развитие быстрорастущих тканей (кожа, оболочки ЖКТ, костный мозг)
- Способствует нормальному созреванию и функционированию плаценты
- Оказывает эстрогеноподобное действие
- Выполняет защитную функцию при беременности по отношению к действию на плод тератогенных и повреждающих факторов
Фолатный цикл - каскадный процесс превращения фолиевой кислоты в доступное для усваивания организмом производное - 5-метилтетрагидрофолат. Процесс контролируется ферментом метилентетрагидрофолатредуктазой (MTHFR). Обмен фолатов является источником одноуглеродных фрагментов (метильной группы -СН3) для жизненно важных клеточных процессов: биосинтеза пуриновых нуклеотидов и превращения уридинионофосфата в тимидилат; митилирования ДНК и РНК.
С фолатным циклом сопряжён цикл образования метионина из гомоцистеина, который проходит при участии витамина В12 и двух ферментов: метионин-синтазы (MTR) и метионин-синтаза-редуктазы (MTRR).
Нарушения метаболизма фолатов влияют на стабильность ДНК двумя основными способами:
- Подавление синтеза тимидилата, в результате чего формируется несбалансированный нуклеотидный пул
- Низкий уровень S-аденозилметионина, что приводит к недостаточному метилированию ДНК и вызывает нарушение регуляции генной экспрессии
Поскольку метаболизм фолатов является важным звеном базовых биологических процессов, то его нарушения, в том числе генетически обусловленные, рассматриваются как фактор высокого риска развития патологических состояний: сердечно-сосудистых заболеваний (ССЗ), онкологических заболеваний, нарушений репродуктивных функций и патологий развития плода.
С точки зрения вклада в развитие ССЗ рассматриваются два процесса, связанные с фолатным циклом: накопление гомоцистеина и нарушение процессов метилирования ДНК.
Основным повреждающим эффектом повышения уровня гомоцистеина является активация атеротромбоза за счёт многочисленных механизмов. Установлено, что у больных с повышенным уровнем гомоцистеина риск смерти от всех сердечно-сосудистых причин был выше в 1,7 раза, от инфаркта миокарда - в 3,4 раза, от инсульта - в 4,3 раза, чем у больных с нормальным уровнем гомоцистеина. Кроме того, гомоцистеин является частичным агонистом рецепторов глицина. При таких состояниях, как инфаркт и травма мозга, когда концентрация глицина возрастает, даже незначительные концентрации гомоцистеина начинают оказывать выраженное нейротоксическое воздействие. Эффективность метаболизма гомоцистеина напрямую зависит от достаточности фолатов в организме и полноценного функционирования фермента MTHFR.
Роль генетически обусловленных нарушений метаболизма фолатов была доказана для пациентов с инфарктом миокарда и ишемическим инсультом: наличие полиморфизма MTHFR C667T было ассоциировано с тромботическими событиями. Тем не менее следует отметить, что само по себе носительство условно «неблагоприятных» аллельных вариантов генов ферментов фолатного цикла повышает риск ССЗ в случае отсутствия коррекции уровня фолатов в организме. Исследования показали, что носительство полиморфных аллелей MTHFR C667T не влияло на прогноз больных с нормальным уровнем фолиевой кислоты, в то время как при низком фолатном статусе риск основных коронарных событий был повышен на 32% у гетерозиготных носителей и на 44% у гомозиготных носителей аллели 667TT, а также была отмечена тенденция к повышению сердечно-сосудистых осложнений у носителей потенциально благоприятного «дикого» генотипа, имевших сопутствующий дефицит фолиевой кислоты.
Регулярный приём фолиевой кислоты (под контролем врача) значительно снижает содержание в крови гомоцистеина и сокращает ежегодную смертность от ССЗ.
Особую актуальность генетические дефекты фолатного цикла имеют с точки зрения развития репродуктивных проблем и пороков развития плода. Ассоциация генетических полиморфизмов ферментов фолатного цикла доказана при осложнениях беременности: фетоплацентарной недостаточности, преэклампсии, преждевременной отслойке нормально расположенной плаценты, замершей беременности, внутриутробной гибели плода, развитии гестоза. Была установлена связь с высокой частотой аномальных гинекологических и акушерских кровотечений. Примечательно, что дефекты генов ферментов фолатного цикла ассоциированы и с бесплодием у мужчин, необструктивной азооспермией и олигозооспермией.
Важно знать, что при наследственных дефектах генов ферментов фолатного цикла избыток синтетической фолиевой кислоты может ещё больше нарушить равновесие и привести к таким же последствиям для плода, как и дефицит этого витамина.
Показания к генетическому анализу:
- Повышенный уровень гомоцистеина в крови
- Невынашивание беременности, гибель плода
- Плановая подготовка к беременности
- Семейная предрасположенность к онкологическим заболеваниям
- Назначение химиотерапии
- Назначение оральных контрацептивов и гормональной заместительной терапии
- Наличие ИБС, артериальной гипертонии, атеросклероза или атеротромбоза
- Антифосфолипидный синдром, тромбоэмболия
- Рождение ребёнка с изолированными пороками нервной трубки, сердца или урогенитального тракта
При проведении генетического исследования метаболизма фолатов определяют следующие полиморфизмы:
Читайте также:
