Несостоятельность кишечного анастомоза. Что делать при несостоятельности анастомоза?
Добавил пользователь Владимир З. Обновлено: 21.01.2026
В работе изложены современные принципы хирургического лечения больных и пострадавших с несостоятельностью швов при заболеваниях и травмах органов желудочно-кишечного тракта. Разработанные в клинике методы оперативного лечения несостоятельности швов желудочно-кишечного тракта при осложненной язвенной болезни, повреждениях двенадцатиперстной и тонкой кишки позволяют улучшить непосредственные и отдаленные результаты оперативных вмешательств, снизить послеоперационную летальность.
Surgical treatment of patients and affected with unsoundness suture at the diseases and injuries of the gastrointestinal tract
The paper presents the modern principles of surgical treatment of patients and affected with suture failure in diseases and injuries of the gastrointestinal tract. Developed at the clinic methods of surgical treatment of insolvency joints of the gastrointestinal tract in complicated peptic ulcer, duodenal lesions and small intestine can improve the immediate and long-term results of surgical interventions, to reduce postoperative mortality.
Задача исследования: улучшение результатов хирургического лечения больных и пострадавших с заболеваниями и травмами органов ЖКТ путем усовершенствования существующих и разработки новых методов профилактики и лечения пациентов с несостоятельностью швов.
Материалы и методы: за период 1992-2011 гг. в хирургическом отделении РКБ МЗ РТ находились на лечении 208 больных и пострадавших с несостоятельностью швов при заболеваниях и травмах органов ЖКТ (табл. 1).
Пациенты с несостоятельностью швов ЖКТ основной группы и группы сравнения
Несостоятельность швов ЖКТ
Основная группа
Группа сравнения
Основную группу составили 90 больных и пострадавших с несостоятельностью швов ЖКТ, оперированные в клинике с 2002 по 2011 г. В основной группе помимо традиционных методов оперативного лечения, 35 пациентам (38,9%) были выполнены хирургические пособия по разработанным в клинике методикам. Из них 12 пациентам (13,3%) произведены оперативные вмешательства по поводу осложненной язвенной болезни и 23 пациентам (25,6%) по поводу несостоятельности швов межкишечного анастомоза. Мужчин было 62 (68,9%), женщин — 28 (31,1%), возраст больных от 18 до 80 лет. 88 пациентам (97,7%) релапаротомия произведена по экстренным показаниям.
В группу сравнения включены 118 больных и пострадавших, оперированные в клинике с аналогичными осложнениями за период с 1992 по 2001 г. 116 пациентам (98,3), повторные оперативные вмешательства, проведены по экстренным показаниям. Мужчин было 77 (65,3%), женщин — 41 (31,1%), возраст больных от 16 до 86 лет.
Заболевания и травмы, при которых наблюдалась несостоятельность швов ЖКТ, в основной группе и группе сравнения представлены в таблицах 2, 3.
Несостоятельность швов ЖКТ у больных и пострадавших в основной группе
Заболевания и травмы органов ЖКТ
Несостоятельность швов
Несостоятельность швов ЖКТ у больных и пострадавших в группе сравнения
Подавляющее большинство больных с несостоятельностью швов ЖКТ в основной группе составили пациенты с осложненной язвенной болезнью желудка и двенадцатиперстной кишки (12 п.к.) — 53 (58,9%). У больных с несостоятельностью швов ушитого прободного отверстия основной причиной развития осложнения в 21 (84,0%) наблюдении были ошибки, допущенные при выборе метода первичной операции. Так, у 14 больных при релапаротомии было установлено наличие пилородуоденального стеноза, у 7 перфорация каллезной и пенетрирующей язвы, что изначально предполагало выполнение резекции желудка. Кроме того, 7 больным не проводилась адекватная предоперационная подготовка, при наличии у них гипопротеинемии, водно-электролитных нарушений, сопутствующих заболеваний.
При несостоятельности швов ушитого прободного отверстия больших каллезных, стенозирующих и пенетрирующих язвах выполнили резекцию желудка у 16 больных. Повторное ушивание прободного отверстия в сочетании с двухсторонней поддиафрагмальной стволовой ваготомией и гастроэнтеростомией у больных с каллезными и пенетрирующими язвами, произвели в 5 случаях, в виду наличия распространенного перитонита, высокого риска выполнения радикальной операции. Ушивание прободного отверстия, при релапаротомии без иссечения язвы и дренирующих операций, выполнили у 4 больных.
Таким образом, при перфорации стенозирующих, пенетрирующих, кровоточащих язв желудка, 12 п.к. методом выбора являются первичная резекция желудка или ушивание перфоративного отверстия с двухсторонней поддиафрагмальной стволовой ваготомией, гастроэнтеростомией. Ушивание перфоративного отверстия, иссечение прободной язвы с последующей пилоропластикой и ваготомией показаны при перфорации простых язв желудка и 12 п.к.
При несостоятельности швов культи 12 п.к. тактика лечения определялась ее формой. У больных с инфильтративной формой несостоятельности швов культи 12 п.к. проводили консервативную терапию, заключающуюся в декомпрессии культи 12 п.к. через зонд, установленный при эндоскопии, антибактериальной терапии, коррекции водно-электролитного баланса, введении белковых препаратов, ингибиторов протеаз. При первично-свищевой форме несостоятельности дуоденальной культи, проводили энтеральное питание, осуществляли защиту кожных покровов в области свища, многослойным нанесением медицинского клея, цинковой мази или пасты, облучение инфракрасным лазерным излучением. Дуоденальное содержимое, поступавшее из дренажей брюшной полости, после процеживания возвращали по назоинтестинальному зонду.
Перитонеальная форма несостоятельности швов культи 12 п.к. является абсолютным показанием к экстренному оперативному вмешательству. Целью операции является устранение поступления дуоденального содержимого, декомпрессия 12 п.к., санация и дренирование брюшной полости, отграничение свободной брюшной полости от возможного попадания кишечного содержимого.
Важным моментом при ушивании дефекта культи 12 п.к. являлась дополнительная мобилизация кишки с пересечением связки Клермона, фиксирующей нижнегоризонтальную часть 12 п.к., что позволяло устранить натяжение по линии сшиваемых тканей, при сохранении адекватного кровоснабжения. Обязательным является проведение назоинтестинального зонда в отводящую петлю с целью нутритивной поддержки. В случаях наличия больших дефектов в культе 12 п.к. и невозможности укрытия ее просвета, у 5 больных выполнили дуоденоеюностомию на длинной петле с межкишечным соустьем (патент № 2184493, 2002 г.).
При перитонеальной форме несостоятельности швов желудочно-кишечного анастомоза, возможно ушивание дефекта с укреплением линии швов прядью сальника, а так же с использованием раневого покрытия «ТахоКомб». У 2 пациентов с перитонеальной формой несостоятельности гастродуоденоанастомоза, со значительными размерами дефекта и невозможностью обеспечить его герметичность, производили перевод Б-I в Ру, формируя при этом, после гастроэнтеростомии, дуоденоеюноанастомоз «конец в бок» по разработанной в нашей клинике методике (патент № 2325853, 2008 г.). Обязательным является проведение в ходе операции назоинтестинального зонда в отводящую петлю с целью энтерального питания.
В программе профилактики несостоятельности швов ЖКТ у больных и пострадавших с заболеваниями и травмами 12 п.к. и тонкой кишки решающее значение имеют выбор оптимального варианта первичного хирургического вмешательства, своевременная диагностика осложнения. При травме 12 п.к., с целью профилактики несостоятельности швов, во время оперативного вмешательства необходимо проводить мобилизацию 12 п.к. по Кохеру - Клермону, ушивать раны в поперечном направлении атравматическим шовным материалом. При повреждениях более 1/3 окружности кишки, необходимо наложение дуоденоеюноанастомоза с брауновским соустьем или выключение 12 п.к. из пассажа.
Вопросы профилактики несостоятельности швов ЖКТ при острой кишечной непроходимости, острых язвах тонкой кишки осложненных перфорацией, тромбозе мезентериальных сосудов, грыжесечениях по поводу ущемленных грыж брюшной стенки сложны и сводятся в основном к дренированию брюшной полости и закрытой интубации кишки, после ушивания ее дефекта или резекции пораженной части органа. При острой спаечной кишечной непроходимости, грыжесечении при ущемленных послеоперационных вентральных грыжах, важным моментом операции является этап вхождения в брюшную полость, при котором возможно повреждение кишки, с последующим вероятным развитием несостоятельности швов. Чтобы избежать повреждения кишки, необходимо осуществлять лапаротомию крайне осторожно, входить в брюшную полость в той части, где нет сращений, при этом использовать технику дифференциации тканей, методом их инфильтрации физиологическим раствором или новокаином, проводя, таким образом, гидравлическую препаровку. Рассечение спаек должно производиться тщательно, последовательно, все десерозированные участки ушивать с использованием атравматического шовного материала.
Перфорации или повреждения тонкой кишки необходимо ушивать двухрядным швом атравматическим шовным материалом, предварительно иссекая размозженные края ран. При близко расположенных перфорациях, разрывах кишки, повреждениях ее более 2/3 окружности, полном поперечном разрыве и отрыве кишки от брыжейки более 5 см показаны резекция тонкой кишки с анастомозом «бок в бок», назоинтестинальная интубация двухпросветным зондом. При «проблемном» кровоснабжении кишки, важным моментом в профилактике несостоятельности швов межкишечного анастомоза является установление границ ее жизнеспособности и определение необходимого объема резекции кишки.
С целью профилактики несостоятельности швов при заболеваниях органов брюшной полости, при распространенном перитоните, тяжелом состоянии больных, водно-электролитных нарушениях, резекцию кишки необходимо завершать выведением стомы, кроме ситуаций, когда возможны большие потери кишечного содержимого по стоме в послеоперационном периоде при обширных резекциях. При неуверенности в надежности состоятельности межкишечного соустья, возможно выполнение еюностомии по Майдлю. Преимущества еюностомии по Майдлю заключаются в проведении раннего энтерального питания, а также возврате кишечного содержимого по стоме.
Оперативные вмешательства по поводу острой кишечной непроходимости необходимо завершать назоинтестинальной интубацией двухпросветным зондом, с последующим проведением многократной энтеросорбции в раннем послеоперационном периоде. При ранней послеоперационной спаечной кишечной непроходимости, преимущества имеет проведение зонда через гастростому, когда в отличие от назоинтестинальной интубации, зонд может находиться в желудочно-кишечном тракте до двух недель и более.
На основании результатов проведенных нами экспериментальных исследований, разработан и внедрен в клиническую практику новый метод профилактики несостоятельности швов энтероэнтероанастомоза (патент № 2445022, 2012, «Способ профилактики несостоятельности швов энтероэнтероанастомоза»). Суть метода состоит в экстраперитонизации межкишечного анастомоза. После проведенной ре- или лапаротомии, ревизии и санации брюшной полости, резекции некротизированной части кишки формируется межкишечный анастомоз «бок в бок» или производится ушивание дефекта в ранее сформированном межкишечном анастомозе. В последующем рассекаются все слои брюшной стенки в месте, куда наиболее свободно можно подвести и разместить межкишечный анастомоз. В брюшной стенке формируется полость, стенками которой являются париетальная брюшина, мышцы, подкожная жировая клетчатка. В сформированную таким образом полость помещается межкишечный анастомоз, с герметизацией и фиксацией его к париетальной брюшине и формированием «шпор» приводящей и отводящей петель кишки. Кожная рана ушивается редкими швами с обязательным дренированием подкожной клетчатки. В случае развития несостоятельности швов межкишечного анастомоза формируется наружный кишечный свищ, в последующем чаще закрывающийся самостоятельно. Этим приемом достигается главная цель по недопустимости развития распространенного перитонита и необходимости проведения повторной операции. Все это в конечном итоге приводит к улучшению непосредственных и отдаленных результатов оперативных вмешательств при заболеваниях и травмах тонкой кишки.
Важным моментом в профилактике и лечении несостоятельности швов при травмах тонкой кишки является дренирование боковых отделов брюшной полости, малого таза. Кроме того при повреждениях 12 п.к. широко дренируем забрюшинное пространство трубками и перчаточными дренажами через люмботомический доступ.
При травме ободочной кишки следует произвести ее резекцию с выведением приводящей кишки в виде одноствольной колостомы. При небольших ранах кишки, тяжелом состоянии пострадавшего, распространенном перитоните, поврежденный участок толстой кишки может быть выведен в виде двуствольной колостомы, возможно также его ушивание с ретроградной интубацией толстой кишки.
У больных с несостоятельностью швов ушитого прободного отверстия при перфоративной язве 12 п.к. в 13 наблюдениях произведена резекция 2/3 желудка по Брауну. У 3 больных, в связи с наличием большой каллезной язвы залуковичного отдела 12 п.к., невозможностью формирования прямого гастродуоденоанастомоза, ушивания культи 12 п.к. была выполнена резекция желудка по разработанной нами методике, основное отличие которой заключается в наложении дуоденоеюноанастомоза. В 5 наблюдениях повторное ушивание перфоративного отверстия сочеталось с двухсторонней поддиафрагмальной стволовой ваготомией, гастроэнтеростомией по Вельфлеру - Брауну. У 4 больных вновь произведено ушивание перфоративного отверстия и его укрытие раневым покрытием «ТахоКомб», продленная декомпрессия желудка и 12 п.к. У всех больных операция включала тщательную санацию и адекватное дренирование брюшной полости. Ранние послеоперационные осложнения наблюдались у 5 пациентов. В 2 случаях развилось внутрибрюшное кровотечение, в связи с чем пациентам произведена релапаротомия. У 1 пациента развилось желудочное кровотечение из острых язв желудка на 3-и сутки после операции. Проведение эндоскопического гемостаза и противоязвенной терапии способствовало остановке кровотечения и заживлению язв. У 1 пациента развилась ранняя послеоперационная спаечная кишечная непроходимость, была выполнена релапаротомия, висцеролиз с назоинтестинальной интубацией. У 1 пациента произошла подкожная эвентерация. Летальный исход наступил у 7 пациентов (28,0%).
При несостоятельности швов гастродуоденоанастомоза в основной группе у больных произвели разобщение анастомоза, с последующим переводом его в Ру, в связи с большим дефектом в соустье. 4 пациентам была выполнена реконструктивная операция по разработанной нами методике, суть которой заключается в формировании гастроэнтероанастомоза на длинной петле по Ру с дуоденоеюноанастомозом «конец в бок». Летальный исход наступила у 3 пациентов (42,9%),
В 4 случаях несостоятельности швов гастроэнтероанастомоза проводили ушивание дефекта с укреплением линии швов прядью сальника (2 пациента), а также с использованием раневого покрытия «ТахоКомб». Умер 1 больной, летальность — 25%.
В основной группе 23 пациентам была выполнена экстраперитонизация межкишечного анастомоза, в 3 случаях (13,0%) произошла несостоятельность швов анастомоза с образованием кишечного свища, который закрылся через 3 недели после проведения консервативной терапии. Летальных исходов было 2 (8,6%), оба пациента погибли от прогрессирующей полиорганной недостаточности и выраженной сопутствующей патологии.
Летальность в основной группе составила 27,8%, в группе сравнения — 35,6%.
1. Внедрение разработанных нами новых методов оперативного лечения больных и пострадавших с несостоятельностью швов при осложненной язвенной болезни, травмах 12 п.к., тонкой кишки позволило улучшить результаты оперативных вмешательств, снизить послеоперационную летальность на 7,8%.
2. При несостоятельности швов ушитого прободного отверстия у больных с большими каллезными, стенозирующими и пенетрирующими язвами показана резекция желудка. При невозможности формирования культи 12 п.к. следует выполнять резекцию желудка по разработанным нами методикам.
3. При невозможности ушивания дефекта культи 12 п.к. или гастродуоденоанастомоза у пациентов с перитонеальной формой несостоятельности швов показаны реконструктивные операции с формированием дуоденоеюноанастомоза по разработанным нами методикам.
4. При экстраперитонизации энтероэнтероанастомоза вероятность развития несостоятельности швов межкишечного анастомоза значительно снижается за счет надежной его герметизации в брюшной стенке. В случае развития несостоятельности швов межкишечного анастомоза формируется кишечный свищ, в последующем чаще закрывающийся самостоятельно. Данный способ операции способствует профилактики распространенного перитонита и необходимости проведения повторного вмешательства.
Д.М. Красильников, Я.Ю. Николаев, М.М. Миннуллин
Казанский государственный медицинский университет
Красильников Дмитрий Михайлович — доктор медицинских наук, профессор, заведующий кафедрой хирургических болезней № 1
Несостоятельность кишечного анастомоза. Что делать при несостоятельности анастомоза?
По данным отечественных и зарубежных авторов при формировании колоректального анастомоза все еще часто наблюдается несостоятельность швов, что обусловливает высокую послеоперационную летальность (45-92,8%, Каримов Ш.И. с соавт., 1998; Исаев г.Б., 2002; Wang A., 2000). Для лечения подобных осложнений одним из способов является выведение петли кишки, несущей анастомоз, на брюшную стенку. Это вмешательство при низких колоректальных анастомозах невыполнимо. В таких случаях многие авторы применяют лапаростомии различных модификаций. Используемые лапаростомы не лишены существенных недостатков, так как не устраняют возможность эвентерации, опасности нагноения раны брюшной стенки, не обеспечивают эффективный отток содержимого из брюшной полости, не предупреждают формирование межкишечных абсцессов и деформации колоректального анастомоза. Все это подчеркивает актуальность модернизации лапаростомий.
Нами разработан способ дренирования при несостоятельности швов низких колоректальных анастомозов, а также в других случаях, когда вывести наружу петлю кишки, несущую анастомоз, не представляется возможным.
Разработанный способ комбинированного дренирования брюшной полости и раны брюшной стенки обеспечивает эффективное и непрерывное удаление гноя и кишечного содержимого из брюшной полости. Обеспечивает визуальный, а при необходимости и эндоскопический контроль за прилежащими зонами брюшной полости и процессом заживления раны стенки кишки в области анастомоза. частично изолирует брюшную полость от патологического очага. Создает условия для наименее травматичного ушивания дефекта анастомоза с сохранением его формы и просвета, исключает повторную операцию в области анастомоза при восстановлении непрерывности желудочнокишечного тракта. Максимально защищает лапаротомную рану от нагноения.
В послеоперационном периоде через все дренажи осуществляют постоянную аспирацию. Во время перевязок меняют тампоны в конусе и несколько раз окончатым зажимом или пинцетом удаляют оформленные фрагменты кала, которые не могли выделиться через дренажи. После того как рана в области анастомоза полностью очистилась от гноя, дефект в кишке ушивается однорядным монофиламентным узловым швом. При этом удается избежать деформации анастомоза и в целом сохранить форму и просвет кишки. Конус удаляется, и рана в этой области ушивается редкими швами до 2-х просветного дренажа, который первоначально подводился к анастомозу. Его удаляют в последнюю очередь. Рана заживает по типу первичного натяжения. Разгрузочную колостому закрывают местно по общепринятой методике. При этом исследование колоректального анастомоза не производится, а хорошую проходимость его подтверждают контрольной ирригографией и колоноскопией.
У всех 40 больных удалось в короткие сроки (10-14 дней) ликвидировать местный или диффузный перитонит, избежать развития разлитого перитонита и предотвратить нагноение операционной раны, и также зашить рану на кишке в области несостоятельности швов через лапаростомический конус без релапаротомии. Кроме того создана возможность визуально наблюдать за течением воспалительного процесса в животе и регенерацией раны стенки кишки. Время пребывания больных в стационаре сократилось в среднем на 2 недели. летальный исход наблюдался только у одного больного, у которого поздно диагностирована несостоятельность швов анастомоза и развился разлитой перитонит.
Использование предложенного метода не требует немедленного ушивания раны в области несостоятельности швов и выполнения таких операций, как обработка параколостомических абсцессов при их возникновении. хирургическую обработку раны брюшной стенки в области несостоятельности выполняют через лапаростомический конус. улучшается дренирование брюшной полости и раны брюшной стенки за счет постоянного вакуумирования через все дренажи, что предотвращает распространение перитонита и предупреждает нагноение раны брюшной стенки в области лапаростомы. Таким образом в результате применения разработанного способа визуального контроля и отграничения области несостоятельности толстокишечного анастомоза с помощью конуса снижена количество осложнений и летальности.
За последние десятилетия, несмотря на усовершенствование техники соединения тканей, применение многочисленных методов прогнозирования, профилактики и ранней диагностики, в решении проблемы несостоятельности швов кишечных анастомозов (НШКА) радикальных изменений не наблюдается. Проблема приобретает особую актуальность при экстренной и неотложной резекции кишки на фоне острой кишечной непроходимости (ОКН), распространенного перитонита (РП), раковой и гнойной интоксикации, сочетанной травмы органов брюшной полости, у больных пожилого и старческого возраста.
Не менее сложно определить причины возникновения данного осложнения, среди которых имеют особое значение технические погрешности при формировании анастомоза [8], нарушение кровоснабжения сшиваемых тканей [9], вовлечение в воспалительный процесс стенки кишки, прилегающей к анастомозу, снижение ее защитно-барьерной функции для флоры, вегетирующей в просвете кишечника [10], анемия [13], повышение внутрикишечного давления [3, 14], наличие злокачественного новообразования и его распространенность [11, 17], проведение предоперационной лучевой терапии [11, 18].
Для профилактики данного осложнения используют различные методы и средства, такие как укрепление кишечных швов фибрин-коллагеновой субстанцией ТахоКомб [16], применение аутофибринового клея [5], биоклея ЛАБ [7], укрепление зоны анастомоза демукозированным сегментом подвздошной кишки [15], парамезентериальное введение иммуномодулятора [12], введение препарата энтеросана [6], интубационная декомпрессия, санация и гастроэнтеросорбция с полифепаном [4], перманентная внутрибрыжеечная блокада и лимфотропная терапия [1], лазермагнитотерапия зоны анастомоза [2], санация области анастомоза [10].
Цель работы - профилактика НШКА у больных после экстренной и неотложной резекции кишки при ОКН и РП различной этиологии.
Материал и методы
Проанализированы результаты лечения 576 больных, оперированных в экстренном и неотложном порядке в период с 1990 по 2008 г. Из 576 больных 332 составили основную группу (ОГ) и 244 - группу сравнения (ГС).
Из 332 больных ОГ 143 (43,07%) произведена резекция различных сегментов тонкой и толстой кишки по поводу осложненных форм раковой опухоли, 189 (56,93%) - по поводу ОКН различной этиологии, РП, открытых и закрытых повреждений кишечника, тромбоза и тромбоэмболии мезентеральных сосудов.
Из 143 больных, оперированных в экстренном и неотложном порядке по поводу осложненных раковых опухолей, 112 (78,32%) проведены радикальные, 31 (21,68%) - паллиативные вмешательства. При радикальных операциях у 73 (65,18%) больных вмешательство завершилось наложением первичных анастомозов, у 39 (34,82%) - формирование энтеро- и колостомы.
Из 189 больных, оперированных в экстренном и неотложном порядке по поводу ОКН различной этиологии и РП, у 43 (22,75%) диагностирована ущемленная грыжа различной локализации, у 6 (3,18%) - тонко-тонкокишечная (1) и тонко-толстокишечная (5) инвагинация; у 49 (25,93%) - заворот кишки, у 6 (3,18%) - тромбоз и тромбоэмболия мезентеральных сосудов, у 34 (17,99%) - спаечная ОКН, у 15 (7,94%) - перфорация кишки различной этиологии, у 8 (4,23%) - колото-резаные раны, у 10 (5,29%) - огнестрельные ранения, у 17 (8,99%) - закрытые повреждения, у 1 (0,53%) - стеноз анастомоза. Из них у 162 (85,71%) операция завершилась наложением первичных анастомозов, у 27 (14,29%) - формированием энтеро- и колостомы. У 6 больных с первичными анастомозами в левой половине толстой кишки была сформирована разгрузочная цекостома.
Больным ОГ первичных анастомозов было наложено 235 (70,78%): тонко-тонкокишечных - 110 (46,81%), тонко-толстокишечных - 33 (14,04%), толсто-толстокишечных - 92 (39,15%). Проксимальные тонкокишечные анастомозы наложены 24 (10,2%) больным, дистальные тонкокишечные - 65 (27,7%), терминальные тонкокишечные анастомозы - 21 (8,9%), илеоцекоанастомозы - 5 (2,1%), илеоасцендоанастомозы - 6 (2,6%), илеотрансверзоанастомозы - 22 (9,4%), поперечно-поперечноободочные - 3 (1,3%), поперечно-нисходящеободочные - 8 (3,4%), поперечно-сигмовидноободочные - 10 (4,3%), поперечно-прямокишечные - 23 (9,8%), нисходящеободочно-прямокишечные - 48 (20,4%) больным.
Из 244 больных ГС 118 (48,36%) произведены операции по поводу осложненных раковых опухолей тонкой и толстой кишки, 126 (51,64%) - по поводу ОКН различной этиологии, РП, открытых и закрытых повреждений кишечника, тромбоза и тромбоэмболии мезентеральных сосудов.
Из 118 больных, оперированных по поводу осложненных раковых опухолей, 71 (60,17%) произведены радикальные и 47 (39,83%) - паллиативные вмешательства. Радикальная операция у 21 (29,58%) больного завершилась наложением 24 первичных анастомозов, у 1 из них с анастомозом на левой половине толстой кишки дополнительно сформирована вспомогательная цекостома. У 50 (70,42%) больных были сформированы энтеро- и колостомы. Из 47 паллиативных операций в 6 (12,77%) были наложены обходные тонко-толстокишечные анастомозы, в 41 (87,23%) - энтеро- и колостомы.
Из 126 больных, оперированных в экстренном и неотложном порядке по поводу ОКН различной этиологии и РП, у 34 (26,98%) диагностирована ущемленная грыжа различной локализации, у 28 (22,22%) - заворот кишки, у 4 (3,18%) - тромбоз и тромбоэмболия мезентеральных сосудов, у 33 (26,19%) - спаечная ОКН, у 6 (4,76%) - перфорация кишечника различной этиологии, у 5 (3,97%) - колото-резаные раны, у 7 (5,56%) - огнестрельные ранения и у 9 (7,14%) - закрытые повреждения. Из 126 у 80 (63,49%) больных операция завершилась наложением первичного анастомоза, у 46 (36,51%) - формированием энтеро- и колостомы. У 3 больных с первичным анастомозом в левой половине ободочной кишки была сформирована дополнительная разгрузочная цекостома.
Больным ГС произведена резекция тонкой кишки с наложением первичных тонко-тонкокишечных анастомозов в 59 (56,7%) наблюдениях, резекция терминальной части тонкой кишки и правосторонняя гемиколэктомия с наложением илеоколоанастомоза - в 15 (14,4%), резекция толстой кишки с наложением коло-колоанастомоза - в 30 (28,9%). Проксимальные тонкокишечные анастомозы наложены 10 (9,6%) больным, дистальные - 42 (40,4%), терминальные - 7 (6,7%), илеоцекоанастомозы - 1 (0,96%), илеоасцендоанастомозы - 2 (1,9%), илеотрансверзоанастомозы - 12 (11,5%), поперечно-поперечноободочные - 3 (2,9%), поперечно-нисходящеободочные - 2 (1,9%), поперечно-прямокишечные - 14 (13,5%), нисходяще-прямокишечные - 11 (10,6%) больным. В 6 наблюдениях, в которых произведена паллиативная операция, были сформированы обходные илеотрансверзоанастомозы.
Таким образом, у 244 больных ГС было сформировано 110 (45,08%) первичных анастомозов и 141 (57,38%) - энтеро- и колостома. Из 110 первичных анастомозов 80 были наложены больным с неопухолевыми заболеваниями, 30 анастомозов наложены 27 больным со злокачественными опухолями. Среди последних 27 больных 21 произведены радикальные операции (наложено 24 первичных анастомоза, причем в 3 наблюдениях одномоментно сформированы тонко-тонкокишечные и толсто-толстокишечные анастомозы с резекцией тонкой и толстой кишки по поводу инвазии раковой опухоли толстой кишки в тонкую) и 6 больным наложены обходные илеотрансверзоанастомозы.
Из 141 кишечной стомы 49 были сформированы больным с неопухолевыми заболеваниями, причем 3 из них с первичными анастомозами в левой половине ободочной кишки была наложена вспомогательная цекостома. 92 наружных свища были сформированы у больных с осложненной формой рака тонкой и толстой кишки. У 51 больного кишечные стомы были сформированы после радикальных операций и у 41 - после паллиативных.
При соединении концов кишки нами в основном были использованы анастомозы по типу бок в бок. Из 235 анастомозов 175 (74,47%) были наложены по типу бок в бок, 60 (25,53%) - по типу конец в конец. У больных ГС из 110 анастомозов 37 (33,64%) были наложены по типу бок в бок, 68 (61,82%) - по типу конец в конец и 5 (4,55%) - по типу конец в бок.
Для прогнозирования НШКА и определения жизнеспособности резецируемых сегментов кишечника нами были использованы трансиллюминационная ангиотензиометрия и пульсомоторография по М.З. Сигалу и З.М. Сигалу. Для профилактики данного осложнения проводили назоинтестинальную и трансанальную интубацию тонкой и толстой кишки с интра- и послеоперационной декомпрессией, санацию, гастроэнтеросорбцию с полифепаном, перманентную внутрибрыжеечную блокаду и лимфотропную терапию и лазермагнитное облучение области швов анастомоза как во время операции, так и в послеоперационном периоде чрескожно с помощью приборов Орион и двухканального Мустанг-2000.
Результаты и обсуждение

В ОГ НШКА наблюдалась у 8 (3,40%) из 235 больных, в ГС - у 17 (15,46%) из 110 (см. таблицу), что связано с внедрением комплексных мероприятий по прогнозированию и профилактике ранних послеоперационных осложнений у больных, которым выполнена неотложная резекция кишечника.
Методы трансиллюминационной ангиотензиометрии и пульсомоторографии позволили с высокой точностью определить состояние интрамуральной гемодинамики анастомозируемых приводящего и отводящего концов кишки и перистальтической активности кишечника. Первичные анастомозы были наложены больным с максимальным интрамуральным артериальным давлением не ниже 8 кПа (60 мм рт.ст.) с пульсовым кровотоком и амплитудой пульсовой волны более 3 мм.
Для профилактики ранних послеоперационных осложнений больным ОГ проводили комплексные мероприятия. С целью интраоперационной и послеоперационной декомпрессии, санации и гастроэнтеросорбции выполняли назоинтестинальную и трансанальную интубацию желудочно-кишечного тракта. Для назоинтестинальной интубации были использованы зонды: желудочно-кишечный одноканальный и двухканальный силиконовый №25 с наружным диаметром 8,2 мм, длиной 2,5 м, для трансанальной интубации - №33 с наружным диаметром 11,2 мм, длиной 1,4 м. Для гастроэнтеросорбции использовали полифепан. Он положительно влияет на перистальтику кишечника, оказывает адсорбирующее, детоксикационное, антиоксидантное действие, повышает фагоцитарную активность ретикулоэндотелиальной системы, снижает протромбиновый индекс, повышает концентрацию IgA, ускоряет репаративные процессы, стимулирует регенерацию. Препарат не травмирует слизистую желудочно-кишечного тракта, что дает возможность его длительного применения. Сеансы гастроэнтеросорбции проводили 3-4 раза в день. В емкость помещали 300 мл изотонического раствора натрия хлорида, добавляли 20-30 г полифепана (из расчета 0,5-1 г на 1 кг массы тела больного в сутки) и перемешивали жидкость. С помощью шприца Жане вводили раствор с полифепаном фракционно в назоинтестинальный зонд 3-4 раза в день по 200-300 мл с последующим пассивным, а при необходимости активным выведением через 20-30 мин. Больным с тяжелым эндотоксикозом дополнительно проводили сеансы толстокишечного сорбционного диализа.
В послеоперационном периоде выполняли перманентную внутрибрыжеечную блокаду и лимфотропную терапию через катетер, введенный и фиксированный в корне брыжейки тонкой кишки, лекарственным составом, включающим местный анестетик новокаин 0,5% (по 7 мл/кг в сутки), антикоагулянт гепарин (по 150 ЕД/кг в сутки), антихолинэстеразный препарат прозерин (по 0,03 мг/кг в сутки) и антибиотик цефтриаксон (по 15 мг/кг в сутки). Это позволяет блокировать патологическую симпатическую и болевую импульсацию в стенке кишечника, ликвидировать спазм баугиниевой заслонки, быстрее восстановить перистальтику кишечника, что приводит к раннему уменьшению внутрикишечного давления, улучшает крово- и лимфообращение в области швов анастомоза, способствует его заживлению и тем самым предотвращает НШКА.
Для профилактики НШКА проводили также лазермагнитное облучение области швов анастомоза во время операции и в послеоперационном периоде, что способствует улучшению микроциркуляции, ликвидации отека в тканевом шовном валике и первичному заживлению кишечных анастомозов.
Таким образом, экстренная и неотложная резекция кишки должна проводиться с обязательным определением состояния интрамуральной гемодинамики анастомозируемых сегментов объективными методами исследования.
Для профилактики несостоятельности швов у больных с первичными анастомозами на фоне острой кишечной непроходимости и распространенного перитонита целесообразно проведение перманентной внутрибрыжеечной блокады, лимфотропной терапии и местной лазермагнитотерапии.
Проведение назоинтестинальной и трансанальной интубационной декомпрессии, санация и гастроэнтеросорбция полифепаном положительно влияют на процесс заживления анастомозов на фоне перитонита.
Внедрение разработанного комплекса мероприятий по профилактике несостоятельности швов кишечных анастомозов после экстренной и неотложной резекции кишки позволило уменьшить частоту осложнения на 12,06% у больных основной группы по сравнению с контрольной.
Институт хирургии им. А.В. Вишневского Министерства здравоохранения и социального развития РФ
Институт хирургии им. А.В. Вишневского Минздрава России, Москва
ФГБУ «Национальный медицинский исследовательский центр хирургии им. А.В. Вишневского» Минздрава России, Москва, Россия
Институт хирургии им. А.В. Вишневского Минздрава РФ, Москва
Эндоскопическое лечение несостоятельности пищеводных анастомозов с использованием вакуумно-аспирационной системы
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2019;(10): 13‑20
Частота несостоятельности анастомозов верхних отделов желудочно-кишечного тракта составляет от 3 до 25%. С развитием эндоскопических технологий стал доступен новый метод лечения — эндоскопическая вакуумно-аспирационная терапия. Материал и методы. В период с 2015 по 2018 г. на базе хирургического эндоскопического отделения НМИЦ хирургии им. А.В. Вишневского пролечены 10 пациентов с использованием вакуумно-аспирационной системы при несостоятельности анастомозов верхних отделов желудочно-кишечного тракта. Результаты. У 9 пациентов после полного закрытия дефекта система удалена через 2—4 сеанса (в среднем на 11-е сутки). У 1 пациента после 5 сеансов в области несостоятельности образовалась отграниченная полость, заполненная грануляциями, вакуумно-аспирационная система удалена. Выводы. Эндоскопическая вакуумно-аспирационная терапия — инновационный, миниинвазивный, экономически выгодный и успешный способ лечения дефектов анастомозов и их осложнений, который должен быть внедрен в клиническую практику в многопрофильных стационарах.
В структуре заболеваемости злокачественными новообразованиями в России рак желудка и пищевода занимает ведущие позиции [1]. Сегодня наиболее эффективным методом лечения этих заболеваний является хирургический. Однако, несмотря на все возможности современной хирургии, сложность и травматичность проводимых операций влекут за собой ряд осложнений. Одним из самых тяжелых осложнений таких операций является несостоятельность швов эзофагогастроанастомоза и эзофагоеюноанастомоза, что может стать причиной эмпиемы плевры, медиастинита, пищеводно-трахеального свища, сепсиса и летального исхода. По данным последних исследований [2], частота несостоятельности пищеводного соустья составляет от 3 до 25%, а летальность в данной группе пациентов достигает 60%.
Основными задачами лечения несостоятельности шов анастомоза являются закрытие свищевого отверстия, санация полости затека, обеспечение нутритивной поддержки, а также профилактика и лечение гнойных осложнений. В прошедшие годы с развитием эндоскопических технологий для лечения несостоятельности анастомозов применяли различные методики, такие как клипирование, фибриновый клей, ушивание отверстия с использованием эндоскопических устройств, стентирование самораскрывающимися металлическими и пластиковыми стентами [3, 4]. Методом выбора в течение долгого времени служило стентирование с хорошим клиническим результатом до 80% [5]. Однако процедура стентирования имеет ряд осложнений, таких как миграция стента, врастание в окружающие ткани с образованием стриктуры после его удаления [6—8].
С 2006 г. стал доступным новый метод лечения данного осложнения — эндоскопическая вакуумно-аспирационная терапия (ВАТ) [9]. В хирургической практике вакуумная терапия используется с 1950 г. [10] для лечения раневых инфекций. Принцип ВАТ основан на продолжительном локальном воздействии отрицательного давления на рану, что уменьшает локальный отек, способствует усилению местного кровообращения, снижает уровень микробной обсемененности раны, уменьшает раневую полость и приводит тем самым к ускорению заживления раны [11].
Внутрипросветная вакуумная терапия с использованием губки впервые применена для лечения несостоятельности колоректальных анастомозов [12, 13]. В дальнейшем методика получила свое развитие в лечении несостоятельности анастомозов верхних отделов желудочно-кишечного тракта [14, 15] и стала активно применяться отдельными авторами как альтернативный метод лечения [16, 17].
Материал и методы
В 2015—2018 гг. на базе хирургического эндоскопического отделения НМИЦ хирургии им. А.В. Вишневского пролечены 10 пациентов с использованием вакуумно-аспирационной системы (ВАС) при несостоятельности анастомозов верхних отделов желудочно-кишечного тракта. Средний возраст пациентов составил 55,7 года (48—70 лет). По поводу злокачественных новообразований пищевода или желудка оперированы 9 пациентов, из них у 2 выполнена расширенная гастрэктомия с еюногастропластикой, у 4 — субтотальная эзофагэктомия с пластикой изоперистальтической желудочной трубкой, у 1 — проксимальная резекция желудка и нижней трети пищевода с еюногастропластикой, у 2 — резекция пищевода с пластикой желудочной трубкой. Еще у 1 пациента с многочисленными оперативными вмешательствами в анамнезе по поводу рецидивной грыжи пищеводного отверстия диафрагмы выполнены ререзекция желудка с резекцией эзофагогастроанастомоза и еюногастропластика (реконструкция по типу операции Merendino—Dillard).
Несостоятельность эзофагогастро-, эзофагоэнтероанастомоза у данных пациентов диагностирована на 6±2-е сутки после проведенных операций. Всем пациентам предприняли попытку консервативной терапии (с целью самостоятельного закрытия дефекта), однако ввиду ее неэффективности на 14±5-е сутки начали лечение с использованием ВАС.
Методика и техника
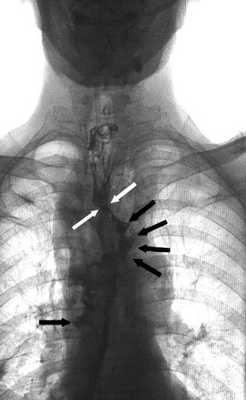
Все манипуляции проводили после тщательного обследования пациента с целью уточнения расположения, размера дефекта анастомоза, а также выявления затеков в средостение, плевральную или брюшную полости. Несостоятельность анастомоза диагностировали при рентгенологическом исследовании верхних отделов желудочно-кишечного тракта с использованием водорастворимого контрастного препарата (рис. 1). Рис. 1. Рентгенограмма верхних отделов желудочно-кишечного тракта с водорастворимым контрастом у пациента после трансхиатальной эзофагэктомии с пластикой пищевода изоперистальтической желудочной трубкой. Желтыми стрелками указана зона несостоятельности анастомоза, красными — область затека контрастного препарата.
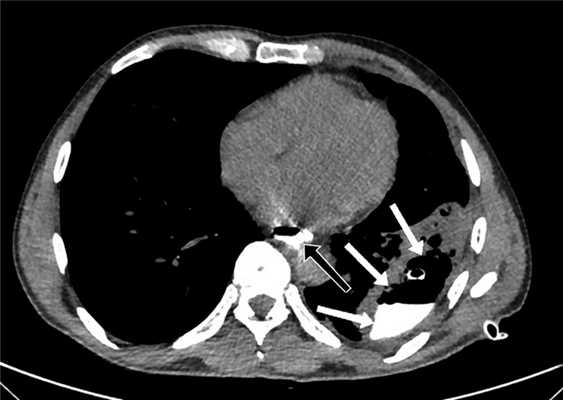
Для определения размера и локализации затеков в средостении, плевральных или брюшной полостях и динамики их уменьшения пациентам выполнена КТ с пероральным контрастированием (рис. 2). Рис. 2. Компьютерная томограмма пациента после низведения желудка, проксимальной резекции желудка с резекцией эзофагогастроанастомоза и еюногастропластики. Желтой стрелкой указана зона несостоятельности анастомоза, красными — область затека контрастного препарата.
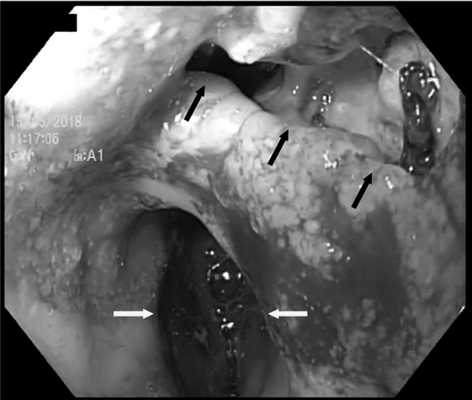
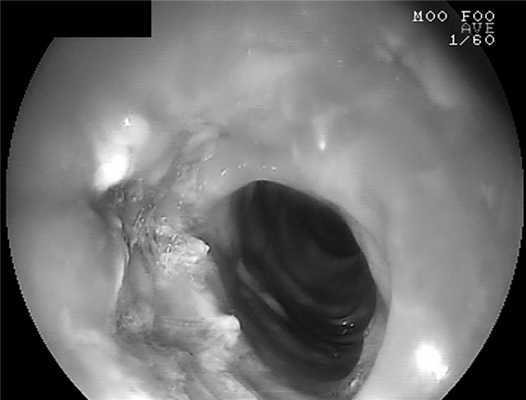
Помимо этого, для предварительной оценки зоны несостоятельности анастомоза, ее размеров и расположения всем пациентам выполнена ЭГДС (рис. 3). Рис. 3. Эндоскопическая картина у пациента после трансхиатальной эзофагэктомии с пластикой пищевода изоперистальтической желудочной трубкой. Желтыми стрелками указан просвет желудочной трубки, черными — зона несостоятельности анастомоза.
Эндоскопическую установку ВАС проводили под общей анестезией с интубацией трахеи в положении пациента лежа на спине. При первичном осмотре определяли уровень пищеводного анастомоза (в см) от резцов и размеры дефекта соустья. При наличии затека по возможности проводили эндоскопическую ревизию полости с оценкой ее размеров.

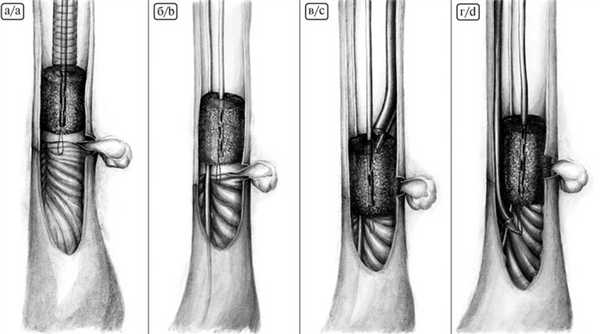
При создании эндоскопической ВАС использовали губчатую систему с открытыми сообщающимися ячейками для лечения осложненных и хронических раневых инфекций размером 10×7,5 см и толщиной 3,3 см (рис. 4, А). Рис. 4. Пошаговое моделирование вакуумно-аспирационной системы. А — губчатая система с открытыми сообщающимися ячейками размером 10×7,5 см и толщиной 3,3 см; Б — моделирование губки в форме цилиндра; В — назогастральный зонд, на котором моделировали систему; Г — фиксация губки на дистальном конце зонда; Д — фиксация губки проксимально; Е — окончательный вид системы. Такие размеры губки позволяли сделать 2 ВАС с использованием стандартного зонда для аспирации содержимого желудка.
Губку моделировали в форме цилиндра диаметром, не превышающим диаметр пищевода, и длиной, перекрывающей минимум на 2 см дистальную и проксимальную границы зоны несостоятельности (см. рис. 4, Б). В губку проводили «желудочный» зонд и фиксировали его 2 швами — на дистальном конце зонда и проксимально (см. рис. 4, В, Д). Здесь же из лигатур формировали 2 петли для позиционирования губки. На рис. 4. Е представлен окончательный вид ВАС.

Для установки ВАС применяли собственную разработанную методику. С этой целью использовали overtube с внутренним полым стилетом, через который можно провести эндоскоп (рис. 5, А—В). Рис. 5. Overtube с внутренним полым стилетом — А и Б; В — внешний вид эндоскопа с надетым на него overtube.
Это приспособление (overtube) под эндоскопическим контролем устанавливали в просвет пищевода до зоны несостоятельности анастомоза. В дальнейшем по нему с помощью внутреннего стилета проводили ВАС (рис. 6, А; Рис. 6. Эндоскопическая картина установки и позиционирования вакуумно-аспирационной системы. А — система проведена в просвет пищевода; Б — вдоль системы проведен зонд для питания; В, Г — эндоскопически ассистированное позиционирование системы. рис. 7, А). Рис. 7. Схема установки и позиционирования вакуумно-аспирационной системы. А — система проведена через overtube в просвет пищевода к зоне анастомоза; Б — overtube извлечен, вдоль системы проведен зонд для питания на противоположной стороне от зоны несостоятельности; В, Г — эндоскопически ассистированное позиционирование системы.
После этого overtube извлекали из просвета пищевода и следующим этапом мимо ВАС через инструментальный канал в просвет тонкой кишки устанавливали зонд для питания, позиционируемый вдоль ВАС с противоположной стороны от зоны несостоятельности (см. рис. 6, Б; 7, Б). Окончательным этапом выполняли эндоскопически ассистированное позиционирование ВАС в область несостоятельности анастомоза таким образом, чтобы зона дефекта располагалась непосредственно посередине губки (рис. 8). Рис. 8. Эндоскопическая картина соотношения вакуумно-аспирационной системы (желтые стрелки) и зоны несостоятельности анастомоза (красные стрелки).
Это достигалось путем захватывания ранее сформированных лигатурных петель на проксимальном и дистальном концах губки с помощью эндоскопической цапки, проведенной через инструментальный канал (см. рис. 6, В, Г; 7, В, Г).
После установки и позиционирования губки проксимальный конец ВАС и несущий ее зонд выводили через нос и подключали к активной аспирации с разрежением 100—110 мм рт.ст.
После установки ВАС пациентов переводили в палаты общего профиля на самостоятельном дыхании. Лечение дополняли антибактериальной и инфузионной терапией, а также энтеральным зондовым питанием.
На 3—5-е сутки удаляли аспирационную систему и эндоскопически контролировали динамику размеров дефекта. При визуальном отсутствии несостоятельности (рис. 9) Рис. 9. Эндоскопическая картина у пациента после резекции желудка, нижней трети пищевода, интерпозиции сегмента тощей кишки по типу еюногастропластики, несостоятельности эзофагоеюноанастомоза и 3 сеансов лечения с помощью вакуумно-аспирационной системы. Полное закрытие дефекта в зоне пищеводного соустья. ВАС удаляли и выполняли контрольное рентгенологическое исследование с водорастворимым контрастом. При сохранении дефекта ВАС устанавливали повторно.
Результаты
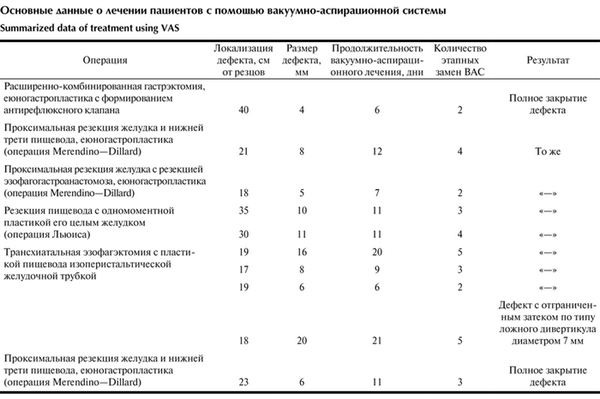
В таблице Основные данные о лечении пациентов с помощью вакуумно-аспирационной системы суммированы основные данные о лечении пациентов с помощью ВАС. Средняя продолжительность первичной манипуляции составила 78 мин. Замену ВАС проводили каждые 3—5 дней, длилась она в среднем около 50 мин.
У 9 пациентов систему удалили после 2—5 сеансов (в среднем на 11-е сутки) с полным закрытием дефекта. У 1 пациента после 5 сеансов в области несостоятельности образовалась отграниченная полость, заполненная грануляциями, ВАС удалена. Эффект лечения у всех пациентов подтвержден рентгеноскопией с пероральным приемом контрастного препарата с визуализацией зоны эзофагоанастомоза. Несостоятельность швов пищеводного соустья ликвидирована у всех больных.
Таким образом, эндоскопическая ВАТ — новый, минимально инвазивный способ лечения несостоятельности пищеводных анастомозов различной локализации. Более того, данная методика может успешно применяться как в гастроинтестинальной, так и в колоректальной, а также в бариатрической хирургии. ВАТ также является экономически выгодной манипуляцией по сравнению не только с повторной операцией, но и с другими минимально инвазивными методами лечения несостоятельности анастомоза.
В целом эндоскопическую ВАТ можно рассматривать как инновационный и перспективный метод выбора в лечении несостоятельности различных анастомозов верхних отделов желудочно-кишечного тракта. Важно отметить, что ВАТ требует большого опыта и навыка команды эндоскопических хирургов, а также анестезиологов-реаниматологов для обеспечения анестезиологического пособия и оказания интенсивной терапии в периоперационном периоде.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflict of interest.
Сведения об авторах
Несостоятельность колоректального анастомоза: факторы риска, профилактика, диагностика, лечебная тактика
Цель обзора. Анализ и систематизация литературных данных по проблеме несостоятельности колоректаль ного анастомоза после резекции прямой кишки.
Основные положения. В последнее десятилетие в современной колоректальной хирургии прослеживается тенденция увеличения количества сфинктеросохраняющих операций. Широкое использование сшивающих аппаратов соответствующего диаметра позволяет формировать ультранизкие анастомозы (на уровне тазового дна). Одним из грозных осложнений после резекции прямой кишки является несостоятельность швов колоректального анастомоза, частота которой достигает 21 %. Летальность при несостоятельности швов колоректального анастомоза может достигать 40 %. В литературе обсуждается множество факторов риска, как предоперационных, так и интраоперационных, влияющих на заживляемость межкишечного соустья. Практически во всех исследованиях высота расположения опухоли и анастомоза от ануса, проведенная предоперационная лучевая терапия, мужской пол являются независимыми факторами риска развития несостоятельности швов колоректального анастомоза. По другим факторам однозначного мнения специалистов нет. Своевременное использование профилактических мер и алгоритма ранней диагностики НА позволяет уменьшить количество и тяжесть послеоперационных осложнений.
Заключение. Индивидуальный учет факторов риска, их адекватная оценка и степень влияния на возможные осложнения являются определяющими в выборе объема оперативного вмешательства, что, несомненно, улучшит непосредственные и отдаленные результаты хирургического лечения рака прямой кишки.
Ключевые слова
Об авторах
ФГБОУ ВО «Ростовский государственный медицинский университет» Министерства здравоохранения Российской Федерации
Россия
доктор медицинских наук, профессор, заведующий кафедрой хирургических болезней ФПК и ППС
ФГБОУ ВО «Ростовский государственный медицинский университет» Министерства здравоохранения Российской Федерации
Россия
кандидат медицинских наук, ассистент кафедры хирургических болезней № 2
ФГБОУ ВО «Ростовский государственный медицинский университет» Министерства здравоохранения Российской Федерации
Россия
доктор медицинских наук, профессор, заведующий кафедрой хирургических болезней № 2
ФГБОУ ВО «Ростовский государственный медицинский университет» Министерства здравоохранения Российской Федерации
Россия
доктор медицинских наук, доцент кафедры хирургических болезней № 2, заведующий хирургическим отделением
ФГБОУ ВО «Ростовский государственный медицинский университет» Министерства здравоохранения Российской Федерации
Россия
ассистент кафедры оперативной хирургии и топографической анатомии, ФГБОУ ВО «Ростовский государственный медицинский университет» Министерства здравоохранения Российской Федерации. Контактная информация:
МБУЗ «Городская больница № 6», Городской лечебно-диагностический колопроктологический центр, хирургическое отделение, Министерства здравоохранения Российской Федерации
Россия
врач-хирург, врачколопроктолог
Список литературы
1. Ермаков Д.Ф. Факторы риска несостоятельности аппаратного анастомоза после передней резекции прямой кишки: дис. … канд. мед. наук. М., 2012.
2. Черданцев Д.В., Поздняков А.А., Шпак В.В., Рябков Ю.В., Попов А.Е. Несостоятельность колоректального анастомоза. Современное состояние проблемы (обзор литературы). Колопроктология. 2015;4(54):57-64.
3. Шатрова Н.А. Прогнозирование, профилактика и лечение несостоятельности толстокишечных анастомозов: дис. … канд. мед. наук. Пермь, 2012.
4. Mine M., Yamamoto T. Desing of a mechanical anastomosis machine for esophagus, stomach and intestines. In: The 37th Annual meeting of Japanese Society of Medical Istrumentation. 1962:377 (in Japan.).
5. Vakalopoulos K.A., Daams F., Wu Z., Timmermans L., Jeekel J.J., Kleinrensink G.J., van der Ham A., Lange J.F. Tissue adhesives in gastrointestinal anastomosis: a systematic review. J Surg Res. 2013;180(2):290-300.
6. Горский В.А., Агапов М.А., Климов А.Е., Андреев С.С. Проблема состоятельности кишечного шва. Практическая медицина. 2014;5(81):33-37.
7. Попов Д.Е. Факторы риска несостоятельности колоректальных анастомозов у больных раком прямой кишки. Колопроктология. 2014;2(48):48-56.
9. Park J.S., Choi G.S., Kim S.H. et al. Multicenter analysis of risk factors for anastomotic leakage after laparoscopic rectal cancer excision: the Korean laparoscopic colorectal surgery study group. Ann Surg. 2013;257:665-71.
10. Половинкин В.В. Тотальная мезоректумэктомия — фактор повышения эффективности лечения среднеампулярного и нижнеампулярного рака прямой кишки: дис. . д-ра мед. наук. Краснодар, 2015.
11. Жебровский В.В. Осложнения в хирургии живота. М.: МИА, 2006. 446 с.
12. Царьков П.В., Кравченко А.Ю., Тулина И.А., Цугуля П.Б. Всегда ли формирование аппаратного анастомоза при передней резекции гарантирует восстановление непрерывности кишечника? Рос журн гастроэнт гепатол колопроктол. 2012;22(4):73-80.
13. Hirst N.A., Tiernan J.P., Millner P.A. et al. Systematic review of methods to predict and detect anastomotic leakage in colorectal surgery. Colorectal Disease. 2014;16(2):95-109.
14. Leung J.M., Dzankic S. Relative importance of preoperative health status versus intraoperative factors in predicting postoperative adverse outcomes in geriatric surgical patients. J. Am. Geriatr. Soc. 2001;49:1080-5.
15. Котельникова Л.П., Шатрова Н.А., Белякова Я.В. Отдаленные результаты резекций левой половины ободочной и прямой кишок. Современные проблемы науки и образования. 2012;2:78.
18. Moran B.J. Predicting the risk and diminishing the consequences of anastomotic leakage after anterior resection for rectal cancer. Acta Chir. Iugosl. 2010;57(3):47-50.
19. Vermeer T.A., Orsini R.G., Daams F., Nieuwenhuijzen G.A., Rutten H.J. Anastomotic leakage and presacral abscess formation after locally advanced rectal cancer surgery: Incidence, risk factors and treatment. Eur J Surg Oncol. 2014;40(11):1502-9.
20. Половинкин В.В., Волков А.В., Халафян А.А. Продолжительность операции и интраоперационная кровопотеря при тотальной мезоректумэктомии. Сибирское медицинское обозрение. 2013;2(80):54-59.
21. Wang L., Gu J. Risk factors for symptomatic anastomotic leakage after low anterior resection for rectal cancer with 30 Gy/10f/2w preoperative radiotherapy. World J Surg. 2010; 34(5):1080-5.
22. Линев К.А., Высоцкий А.А. Тактика хирургического лечения несостоятельности швов анастомоза толстой кишки. Вестник неотложной и восстановительной медицины. 2013;14(4):474-7.
23. Lagoutte N., Facy O., Ravoire A. et al. C-reactive protein and procalcitonin for the early detection of anastomotic leakage after elective colorectal surgery: pilot study in 100 patients. J Visc Surg. 2012;149(5):345-9.
24. Гостищев В.К., Дибиров М.Д., Хачатрян Н.Н., Евсеев М.А., Омелькосский В.В. Новые возможности профилактики послеоперационных осложнений в абдоминальной хирургии. Хирургия. 2011;10:56-60.
25. Giaccaglia V., Salvi P.F., Cunsolo G.V. et al. Procalcitonin, as an early biomarker of colorectal anastomotic leak, facilitates enhanced recovery after surgery. J Crit Care. 2014:29(4);528-32.
26. Pedersen T., Roikjær O., Jess P. Increased levels of C-reactive protein and leukocyte count are poor predictors of anastomotic leakage following laparoscopic colorectal resection. Dan Med J. 2012;59(12):A4552.
27. Ахметзянов Ф.Ш., Шайхутдинов Н.Т., Валиев Н.А., Шемеунова З.Н., Егоров В.И. Аспирационное дренирование в профилактике послеоперационных гнойно-септических осложнений при брюшно-анальной резекции прямой кишки. Казанский медицинский журнал. 2015;96(6):935-9.
28. den Dulk M., Marijnen C.A., Collette L., Putter H., Påhlman L., Folkesson J., Bosset J.F., Rödel C., Bujko K., van de Velde C.J. Multicentre analysis of oncological and survival outcomes following anastomotic leakage after rectal cancer surgery. Br J Surg. 2009;96(9):1066-75.
29. Грошилин В.С., Султанмурадов М.И., Харагезов А.Д., Хоронько Р.Ю. Патент РФ на изобретение № 2523822. Способ послеоперационной профилактики несостоятельности толсто-толстокишечного анастомоза. 2014 г.
30. Guenaga K.F., Matos D., Castro A.A. et al. Mechanical bowel preparation for elective colorectal surgery. Cochrane Database Syst. Rev. 2003;(2):CD001544.
31. Зитта Д.В., Субботин В.М., Терехина Н.А. Влияние механической предоперационной подготовки кишечника на течение раннего послеоперационного периода. Колопроктология. 2010;3(33):14-9.
32. Guenaga K.F., Matos D., Wille-Jørgensen P. Mechanical bowel preparation for elective colorectal surgery. Cochrane Database Syst. Rev. 2011:7;(9):CD001544. DOI: 10.1002/14651858.CD001544.pub4
34. Jafari M.D., Wexner S.D., Martz J.E. et al. Perfusion assessment in laparoscopic Left-Sided/Anterior resection (PILLAR II): A Multi-Institutioanal Stady. J. Am. Coll Surg. 2015;220(1):82-92.
35. Gouya H., Oudjit A., Leconte M. et al. CT antegrade colonography to assess proctectomy and temporary diverting ileostomy complications before early ileostomy takedown in patients with low rectal endometriosis. AJR Am. J. Roentgenol. 2012;198:98-105.
36. Rondelli F., Bugiantella W., Vedovati M.C. et al. To drain or not to drain extraperitoneal colorectal anastomosis? A systematic review and metaanalysis. Colorectal Dis. 2014;16:35-42.
Читайте также:
- Вестибуло-глазодвигательные тесты
- Предопухолевые изменения под действием стронция. Появление атипичных клеток под действием стронция
- Депо эритроцитов
- Вас интересует мужчина Козерог? Гороскоп совместимости с мужчиной Козерогом
- Влияние носа на сердечно-сосудистую систему. Нос и мозговое кровообращение
