Образование и выход трансмембранных белков клетки
Добавил пользователь Дмитрий К. Обновлено: 21.01.2026
По биохимической классификации мембранные белки делятся наинтегральные и периферические.
- Интегральные мембранные белки прочно встроены в мембрану и могут быть извлечены из липидного окружения только с помощью детергентовили неполярных растворителей. По отношению к липидному бислою интегральные белки могут быть трансмембранными политопическими или интегральными монотопическими.
- Периферические мембранные белки являются монотопическими белками. Они либо связаны слабыми связями с липидной мембраной, либо ассоциируют с интегральными белками за счёт гидрофобных, электростатических или других нековалентных сил. Таким образом, в отличие от интегральных белков они диссоциируют от мембраны при обработке соответствующим водным раствором (например, с низким или высоким pH, с высокой концентрацией соли или под действием хаотропного агента). Эта диссоциация не требует разрушения мембраны.
Мембранные белки могут быть встроены в мембрану за счёт жирнокислотных или пренильных остатков либогликозилфосфатидилинозитола, присоединённых к белку в процессе их посттрансляционной модификации.
Еще один важный момент - способы прикрепления белков к мембране:
1. Связывание с белками, погруженными в бислой. В качестве примеров можно привести F1-часть Н + - АТРазы, которая связывается с Fo-частью, погруженной в мембрану; можно упомянуть также некоторые белки цитоскелета.
2. Связывание с поверхностью бислоя. Это взаимодействие имеет в первую очередь электростатическую природу (например, основный белок миелина) или гидрофобную (например, поверхностно-активные пептиды и, возможно, фосфолипазы). На поверхности некоторых мембранных белков имеются гидрофобные домены, образующиеся благодаря особенностям вторичной или третичной структуры. Указанные поверхностные взаимодействия могут использоваться как дополнение к другим взаимодействиям, например к трансмембранному заякориванию.
3. Связывание с помощью гидрофобного "якоря"; эта структура обычно выявляется как последовательность неполярных аминокислотных остатков (например, у цитохрома 65). Некоторые мембранные белки используют в качестве якоря ковалентно связанные с ними жирные кислоты или фосфолипиды.
4. Трансмембранные белки. Одни из них пересекают мембрану только один раз (например, гликофорин), другие - несколько раз (например, лактозопермеаза; бактериородопсин).
Мембранные липиды
Мембранные липиды - это амфипатические молекулы, самопроизвольно формирующие бислои. Липиды нерастворимы в воде, однако легко растворяются в органических растворителях. В большинстве животных клеток они составляют около 5О% массы плазматической мембраны. В участке липидного бислоя размером 1 х 1 мкм находится приблизительно 5 х 1ОО тыс. молекул липидов. Следовательно плазматическая мембрана небольшой животной клетки содержит примерно 1О липидных молекул. В клеточной мембране присутствуют липиды трех главных типов:
1) фосфолипиды (наиболее распространенный тип);сложные липиды , содержащие глицерин , жирные кислоты , фосфорную кислоту и азотистое соединение .
Типичная молекула фосфолипида имеет полярную голову и два гидрофобных углеводородных хвоста. Длина хвостов варьирует от 14 до 24 атомов углерода в цепи. Один из хвостов содержит, как правило, одну или более цис-двойных связей ( ненасыщенный углеводород ), тогда как у другого ( насыщенный углеводород ) двойных связей нет. Каждая двойная связь вызывает появление изгиба в хвосте. Подобные различия в длине хвостов и насыщенности углеводородных цепей важны, поскольку они влияют на текучесть мембраны .
Амфипатические молекулы , находящиеся в водном окружении, обычно агрегируют, при этом гидрофобные хвосты оказываются спрятанными, а гидрофильные головы остаются в контакте с молекулами воды. Агрегация такого типа осуществляется двумя способами: либо путем образования сферических мицелл с хвостами обращеными внутрь, либо путем формирования бимолекулярных пленок, или бислоев, в которых гидрофобные хвосты располагаются между двумя слоями гидрофильных голов.
Два основных фосфолипида, которые присутствуют в плазме - это фосфатидилхолин ( лецитин ) и сфингомиелин . Синтез фосфолипидов происходит почти во всех тканях, но главным источником фосфолипидов плазмы служит печень . Тонкий кишечник также поставляет в плазму фосфолипиды, а именно лецитин, в составе хиломикрон . Большая часть фосфолипидов, которые попадают в тонкий кишечник (в том числе и в виде комплексов с желчными кислотами ), подвергается предварительному гидролизу панкреатической липазой . Этим обьясняется, почему полиненасыщенный лецитин, добавленный в пищу, влияет на содержание линолеата в фосфолипидах плазмы не больше, чем триглицериды кукурузного масла в эквивалентных количествах.
Фосфолипиды являются неотьемлемым компонентом всех клеточных мембран . Между плазмой и эритроцитами постоянно происходит обмен фосфатидилхолином и сфингомиелином. Оба эти фосфолипида присутствуют в плазме в качестве составных компонентов липопротеинов , где они играют ключевую роль, поддерживая в растворимом состоянии неполярные липиды , такие как триглицериды и эфиры холестерина . Это свойство отражает амфипатический характер молекул фосфолипидов - неполярные цепи жирных кислот способны взаимодействовать с липидным окружением, а полярные головы - с водным окружением ( Jackson R.L. ea, 1974 ).
2) Холестерол. Холестерин - это стерин, содержащий стероидное ядро из четырех колец и гидроксильную группу.
Это соединение обнаруживается в организме как в виде свободного стерина, так и в форме сложного эфира с одной из длинноцепочечных жирных кислот. Свободный холестерин - компонент всех клеточных мембран и та основная форма, в которой холестерин присутствует в большинстве тканей. Исключение представляют кора надпочечников , плазма и атероматозные бляшки , где преобладают эфиры холестерина . Кроме того, значительная часть холестерина в кишечной лимфе и в печени тоже этерифицирована.
Холестерин содержится в составе липопротеин ов либо в свободной форме, либо в виде эфиров с длинноцепочечными жирными кислотами . Он синтезируется во многих тканях из ацетил-CoA и выводится из организма желчь ю в виде свободного холестерола или солей желчных кислот . Холестерол является предшественником других стероид ов, а именно кортикостероидов , половых гормонов , желчных кислот и витамина D . Он является соединением, типичным для метаболизма животных, и содержится значительных количествах в продуктах животного происхождения: яичном желтке, мясе, печени и мозге.
Плазматические мембраны эукариот содержат довольно большое количество холестерола - приблизительно одну молекулу на каждую молекулу фосфолипида . Помимо регулирования текучести холестерол увеличивает механическую прочность бислоя. Молекулы холестерола ориентируются в бислое таким образом, чтобы их гидроксильные группы примыкали к полярным головам фосфолипидных молекул
Гликолипиды - это липидные молекулы, принадлежащие к классу олигосахаридсодержащих липидов, которые обнаруживаются только в наружной половине бислоя, а их сахарные группы ориентированы к поверхности клетки.
Гликолипиды это сфинголипиды , у которых к NH группе сфингазина присоединен остаток ЖК, а к кислороду сфингазина присоединены следующие группы: олигосахаридные цепи, Gal, Glc, GalNAc ( нейраминовая кислота ) - ганглиозиды. Gal или Glc - цереброзиды. сульфосахара Glc-SO3H, Gal-SO3H - сульфолипиды.
Гликолипиды обнаруживаются на поверхности всех плазматических мембран , однако их функция неизвестна. Гликолипиды составляют 5% липидных молекул наружного монослоя и сильно различаются у разных видов и даже в разных тканях одного вида. В животных клетках они синтезируются из сфингозина - длинного аминоспирта - и называются гликосфинголипидами.
Структура их в целом аналогична структуре фосфолипидов , образованных из глицерола . Все гликолипидные молекулы различаются по числу сахарных остатков в их полярных головах. Один из простейших гликолипидов - галактоцереброзид
Трансмембранный белок - Transmembrane protein

A трансмембранный белок (TP) представляет собой тип интегрального мембранного белка, который охватывает всю клеточную мембрану. Многие трансмембранные белки действуют как шлюзы, позволяющие транспортировать определенные вещества через мембрану. Они часто претерпевают значительные конформационные изменения, чтобы перемещать вещество через мембрану. Они обычно очень гидрофобны и агрегируются и осаждаются в воде. Для экстракции им требуются детергенты или неполярные растворители, хотя некоторые из них (бета-бочки ) также могут быть экстрагированы с использованием денатурирующих агентов.
пептидная последовательность, который охватывает мембрану, или трансмембранный сегмент, в значительной степени гидрофобен и может быть визуализирован с использованием графика гидропатии. В зависимости от количества трансмембранных сегментов трансмембранные белки можно разделить на однопролетные (или битопические ) или многопролетные (политопические). Некоторые другие интегральные мембранные белки называются монотопными, что означает, что они также постоянно прикреплены к мембране, но не проходят через нее.
Содержание
- 1 Типы
- 1.1 Классификация по структуре
- 1.2 Классификация по топологии
- 3.1 Стабильность α-спиральных трансмембранных белков
- 3.2 Сворачивание α-спиральных трансмембранных белков
- 3.3 Стабильность и фолдинг Трансмембранные белки с β-цилиндрами
- 4.1 Транспортеры, управляемые поглощением света
- 4.2 Транспортеры, управляемые окислением и восстановлением
- 4.3 Транспортеры, управляемые электрохимическим потенциалом
- 4.4 Транспортеры, управляемые гидролизом PP-связей
- 4,5 Портеры (унипортеры, симпортеры, антипортеры)
- 4,6 Альфа-спиральные каналы, включая ионные каналы
- 4,7 Ферменты
- 4,8 Белки с альфа-спиральными трансмембранными якорями
- 4,9 β-бочки, состоящие из одной полипептидной цепи
- 4,10 β-бочки, состоящие из нескольких полипептидных цепей
Классификация по структуре
Существует два основных типа трансмембранных белков: альфа-спиральный и бета -бочки. Альфа-спиральные белки присутствуют во внутренних мембранах бактериальных клеток или плазматической мембране эукариот, а иногда и в внешних мембранах. Это основная категория трансмембранных белков. У людей 27% всех белков составляют альфа-спиральные мембранные белки. Бета-цилиндрические белки пока обнаружены только в наружных мембранах грамотрицательных бактерий, клеточных стенках грамположительных бактерий, наружных мембранах митохондрий и хлоропластов, или могут секретироваться как порообразующие токсины. Все трансмембранные белки с бета-стволами имеют простейшую топологию вверх-вниз, что может отражать их общее эволюционное происхождение и сходный механизм сворачивания.
Помимо белковых доменов существуют необычные трансмембранные элементы, образованные пептидами. Типичным примером является грамицидин A, пептид, который образует димерную трансмембранную β-спираль. Этот пептид секретируется грамположительными бактериями в качестве антибиотика. О трансмембранной спирали полипролина-II не сообщалось в природных белках. Тем не менее, эта структура экспериментально наблюдалась в специально разработанных искусственных пептидах.
Классификация по топологии
Эта классификация относится к положению N- и C-концов белка на разных сторонах липидного бислоя. Типы I, II, III и IV - это однопроходные молекулы. Трансмембранные белки типа I прикреплены к липидной мембране с помощью якорной последовательности стоп-переноса, и их N-концевые домены нацелены на эндоплазматический ретикулум (ER) просвет во время синтеза (и внеклеточное пространство, если зрелые формы расположены на клеточных мембранах ). Типы II и III заякорены с помощью сигнально-якорной последовательности, при этом тип II нацелен на просвет ER с его C-концевым доменом, в то время как тип III имеет свои N-концевые домены, нацеленные на просвет ER. Тип IV подразделяется на IV-A, с их N-концевыми доменами, нацеленными на цитозоль, и IV-B, с N-концевым доменом, нацеленным на просвет. Последствия для деления на четыре типа особенно проявляются во время транслокации и трансляции, связанной с ER, когда белок должен пройти через мембрану ER в направлении, зависящем от типа.
![]()
Трансмембранные белки групп I и II имеют противоположные конечные топологии. Белки группы I имеют N-конец на дальней стороне и C-конец на цитозольной стороне. Белки группы II имеют С-конец на дальней стороне и N-конец в цитозоле. Однако окончательная топология - не единственный критерий для определения групп трансмембранных белков, а скорее расположение топогенных детерминант и механизм сборки рассматривается в классификации
3D-структура
Мембрана структуры белка могут быть определены с помощью рентгеновской кристаллографии, электронной микроскопии или ЯМР-спектроскопии. Наиболее распространенными третичными структурами этих белков являются трансмембранные спиральный пучок и бета-ствол. Часть мембранных белков, которые прикреплены к липидному бислою (см. кольцевая липидная оболочка ), в основном состоят из гидрофобных аминокислот.
Мембранные белки, которые имеют гидрофобные поверхности, относительно гибки и являются выражается на относительно низком уровне. Это создает трудности в получении достаточного количества белка и последующем выращивании кристаллов. Следовательно, несмотря на значительную функциональную важность мембранных белков, определение структур атомного разрешения для этих белков сложнее, чем глобулярных белков. По состоянию на январь 2013 г. менее 0,1% определенных белковых структур составляли мембранные белки, несмотря на то, что они составляли 20-30% от общего протеома. Из-за этой сложности и важности этого класса белков были разработаны методы предсказания структуры белков на основе графиков гидропатии, положительное внутреннее правило и другие методы.
Термодинамическая стабильность и сворачивание
Стабильность α-спиральных трансмембранных белков
Трансмембранные α-спиральные белки необычайно стабильны, судя по исследованиям термической денатурации, поскольку они не разворачиваются полностью внутри мембран (полное развертывание также потребует разрушения много α-спиральных Н-связей в неполярных средах). С другой стороны, эти белки легко неправильно сворачиваются из-за ненативной агрегации в мембранах, перехода в состояния расплавленной глобулы, образования ненативных дисульфидных связей или развертывания периферических области и нерегулярные петли, которые локально менее стабильны.
переносчики, управляемые электрохимическим потенциалом
- протон или натрий транс определение местоположения F-типа и V-типа АТФаз
транспортеров, управляемых гидролизом PP-связи
- P-тип кальциевая АТФаза (пять различных конформаций)
- регуляторы кальциевой АТФазы фосфоламбан и сарколипин
- Общий секреторный путь (сек) транслокон (препротеин-транслоказа SecY)
Портеры (унипортеры, симпортеры, антипортеры)
- белки-переносчики
- суперсемейство основных фасилитаторов (переносчик глицерин-3-фосфата, лактоза пермеаза и переносчик нескольких лекарственных препаратов EmrD) (переносчик множества лекарственных препаратов отток AcrB, см. множественная лекарственная устойчивость )
- Дикарбоксилат / аминокислота: симпортер катионов (симпортер протон-глутамата)
- Моновалентный катион / протон антипортер (натрий / протонный антипортер 1 NhaA) натриевый симпортер
- переносчики аммиака
- переносчик лекарств / метаболитов (небольшой переносчик множественной лекарственной устойчивости EmrE - структуры рет расценены как ошибочные)
Альфа-спиральные каналы, включая ионные каналы
- подобные, включая калиевые каналы KcsA и KvAP, и канал для ионов калия с внутренним выпрямителем Кирбак из нейромедиатора 63>рецепторы (рецептор ацетилхолина )
- Вспомогательные белки внешней мембраны (переносчик полисахаридов) - α-спиральные трансмембранные белки внешней бактериальной мембраны
Ферменты
Белки с альфа-спиральными трансмембранными якорями
- домен трансмембранной димеризации]
- Цитохром c нитритредуктазы комплекс
- стерилсульфатсульфогидролаза
- Станнин A димер
- Иновирус (нитчатый фаг ) главный белок оболочки -ассоциированный белок A и B .
- мембранная протеаза, специфичная для гомолога стоматина
β-бочки, состоящие из одной полипептидной цепи
- бета-бочки из восьми бета-нитей и с «числом сдвига» десять (n = 8, S = 10). Они включают:
- канонический (β-катенин—зависимый) путь, который, в конечном счете, контролирует программы генной экспрессии, связанные с определением судьбы клетки и морфогенезом [9];
- неканонические (β-катенин—независимые) пути [10], которые регулируют полярность клетки, стимулируя реорганизацию цитоскелета [11], [12] и метаболизм кальция [13].
- (OmpA) (OmpX) (OmpW) (PagP) (NspA)
Примечание: n и S - это, соответственно, количество бета-цепей и «число сдвига» бета-ствола
Важнейшие стрелочники клеток организма: белки Wnt

Обзор
Дилемма стрелочника
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Говорят «стрелочник во всем виноват», а ведь он только выполняет переданную команду: скажут ему «переводи стрелку», он и направит поезд по другому пути, а не скажут — так он и не переведет. Таким же образом действуют и сигнальные молекулы нашего организма, в том числе в сигнальном пути Wnt. Задача этих биомолекул — передать «приказы» клеток-«начальников» клеткам-«подчиненным».

Конкурс «био/мол/текст»-2012
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2012 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific.
Введение от редакции
Wnt-путь — один из важнейших молекулярных сигнальных путей, который регулирует эмбриональное развитие и дифференцировку клеток. Весь путь назван по имени одного из лигандов, который активирует путь в клетках — Wnt. Это сокращение произошло от слияния названий двух генов — Wg + Int. Прототип гена был открыт у дрозофилы, где мутация в гене Wg (wingless) подавляла развитие крыльев. Гомологичный ген у позвоночных — Int — связан с развитием раковых опухолей.
На сегодняшний день известно, что Wnt-путь регулирует развитие многих органов во время эмбриогенеза и отвечает за билатеральную симметрию организма. Его функции — все то, что формирует из массы эмбриональных клеток сформированный организм. У взрослых особей нарушения Wnt-пути ведут к повышенному риску раковых заболеваний. Также недавние работы показали важную роль компонентов Wnt в пролиферации и дифференциации стволовых клеток.
Гликопротеины Wnt — это семейство секретируемых клетками сигнальных молекул, которые участвуют в координации поведения клеток в организме. Эти белки, открытые еще в начале 1980-х в качестве маркеров многих видов раковых заболеваний, оказались ключевыми регуляторами эмбрионального развития, процессов регенерации, роста костей, дифференцировки стволовых клеток и массы других процессов, связанных с морфогенезом и определением клеточной судьбы.
Структура Wnt белков
Структура белков семейства Wnt напоминает кисть руки (рис. 1; [1]). Роль большого пальца играет аминоконцевой домен, состоящий из пучка α-спиралей, стабилизированных пятью дисульфидными мостиками. «Указательный палец» — карбоксиконцевой домен, включающий два β-тяжа, поддерживаемых шестью дисульфидными мостиками. «Ладонь» обладает высокой гибкостью, обеспечивая конформационную подвижность белка. Кроме этого, к «большому пальцу» ковалентно присоединяется пальмитолеиновая жирная кислота, необходимая для взаимодействия с транспортными белками. Присоединение остатка жирной кислоты называется ацилированием, и зависит оно от другой модификации участка «ладони» — гликозилирования. Без него становится невозможным взаимодействие с транспортными белками и, следовательно, секреция.
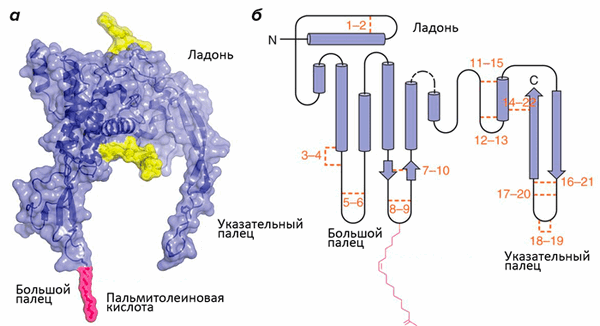
Рисунок 1. Структура Wnt. а — Объемная модель Wnt8. Желтым цветом обозначены гликозилированные участки. б — Вторичная структура Wnt. Оранжевым цветом обозначены и пронумерованы 22 остатка цистеина, которые образуют парные дисульфидные мостики. Розовым цветом обозначена ковалентно присоединенная ацильная группа: жирная кислота.
Секреция Wnt
Предполагается, что присоединение необходимого для секреции Wnt остатка жирной кислоты осуществляет ацилтранферраза эндоплазматического ретикулума Поркупин (PORCN), так как делеция этого гена нарушает секрецию Wnt (рис. 2; [4]). После ацилирования Wnt распознается белками аппарата Гольджи — трансмембранным рецептором GPR177 (широко известным как Wntless (Wls)), «белками-грузчиками» p24, которые переносят Wnt от эндоплазматического ретикулума на поверхность клетки (рис. 3; [5]) и транспортным белком Swim, который поддерживает растворимость и сигнальную активность компллекса Wnt/Wls [6].
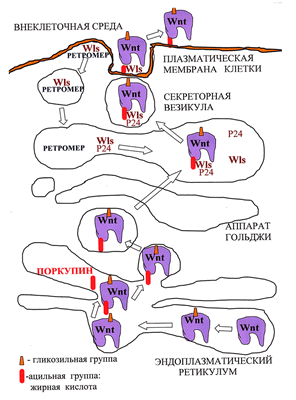
Рисунок 2. Биогенез и секреция Wnt. Молекулы Wnt в процессе созревания в эндоплазматическом ретикулуме подвергаются гликозилированию, а затем ацилированию. Затем в сопровождении белка Wntless из аппарата Гольджи они попадают в секреторные везикулы, внутри которых пересекают плазматическую мембрану, после чего секретируются. Wntless извлекается из отработанных секреторных везикул и переносится обратно в аппарат Гольджи с помощью комплекса Retromer.
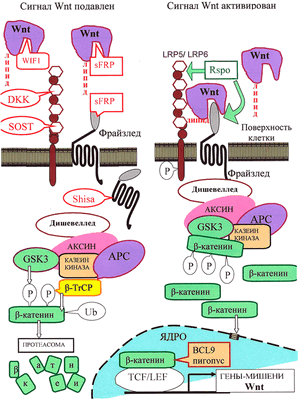
Рисунок 3. Канонический путь Wnt-сигнализации. «Рабочим телом» канонического пути является β-катенин: в неактивном состоянии его мало, а в активном — много, и он активирует транскрипцию в ядре.
Неактивное состояние: в отсутствии взаимодействия между Wnt и рецептором LRP5/6 количество цитоплазматического β-катенина малó за счет «деградационного комплекса», состоящего из белков APC, казеинкиназы и гликоген-синтезы-киназы GSK3, расположенных на «платформе» белка Аксин. С помощью этого комплекса цитоплазматический β-катенин фосфорилируется, а затем подвергается убиквитилированию белком β-TrCP, что приводит к его деградации с помощью протеасомы.
Активированное состояние: Wnt-сигнал начинается с образования комплекса Wnt с LRP5/6 и рецептором Фрайззлед (Frizzled), что приводит к активации белка Dishevelled. Это ингибирует «деградационный комплекс» и «выключает» убиквитилирование β-катенина. В результате накапливающийся в цитоплазме свободный β-катенин [16] проникает в ядро и активирует транскрипцию с помощью транскрипционных факторов TCF/LEF и ряда других.
Регуляция пути Wnt: с секретируемыми молекулами Wnt непосредственно связываются их антагонисты: Wnt-ингибирующий фактор (WIF) и Фрайззлед-узнающий белок 1 (sFRP). Кроме того, для предотвращения образования комплекса Фрайззлед—Wnt—LRP, c белками LRP5/LRP6 могут связаться DKK и склеростин. Белки Shisa, захватив рецептор Фрайззлед, мешают ему выйти на поверхность клетки. Если Wnt образует комплекс с LRP5/6 и Фрайззлед, сигнализация активируется. Белок R-spondin 2 (RSPO), стабилизируя рецепторы Фрайззлед и LRP5/6, повышает сигнализацию по пути Wnt. В эндоплазматическом ретикулуме для созревания LRP5/6 необходим сопровождающий белок MESD.
Мембранные рецепторы Wnt
Для того чтобы воздействовать на клетку-мишень, Wnt должен связаться с клеточными рецепторами. В качестве таких рецепторов на поверхности клетки выступают трансмембранный белок Фрайзлед Frizzled (Fz) и липопротеиды низкой плотности LRP5/LRP6. Связаться с ними молекуле Wnt активно мешают различные антагонисты, которым противостоят агонисты (рис. 3). Помимо этих рецепторов Wnt может связываться с рецепторными тирозинкиназами Ror и Ryk . Ror, связавшись с Wnt5a, фосфорилирует белок Дишевеллед и таким образом контролирует морфогенез тканей, тогда как Ryk, фосфорилируя мембранный белок Vangl2, контролирует полярность клетки.
Кстати, Frizzled и уже упомянутый рецептор GPR177 относятся к семейству рецепторов GPCR, за исследование которых в 2012 году была вручена Нобелевская премия по химии [7]. Рецепторные тирозинкиназы также представляют важный класс сигнальных рецепторов мембраны клетки (см., например, [8]). — Ред.
Механизмы воздействия Wnt на клетку
По традиции механизмы воздействия Wnt на клетку подразделяют на:
В основе канонического пути Wnt-сигнализации лежит стабилизация цитоплазматического белка β-катенина (рис. 3). В отсутствие сигнала β-катенин не активен и быстро деградирует. Когда клетки активируются Wnt, скорость деградации β-катенина снижается. Избежавший деградации β-катенин накапливается в цитоплазме и входит в ядро.
В ядре β-катенин, захватив ядерные белки BCL9 и пигопус (Pygopus), взаимодействует с белками TCF/LEF, превращая их в мощные активаторы транскрипции. TCF/LEF являются многофукциональными белками, которые, обладая способностью избирательно связываться с определенными последовательностями ДНК и с определенными белками-активаторами, «принимают решение», какие из генов будут активированы сигналом Wnt [14]. Обнаружено, что связь между β-катенином и TCF4, необходимая для такой активации, может быть нарушена ресвератролом. Это позволяет предположить, что ресвератрол, являющийся флавоноидом кожицы черного винограда и получаемого из него вина, может быть использован в качестве безвредного лекарства для подавления сигнала Wnt при раковых заболеваниях [15].
Влияние Wnt-сигнализации на клеточный цикл и пролиферацию клеток
Появляется все больше доказательств сложной взаимосвязи канонического пути Wnt-сигнализации и клеточного цикла. Компоненты сигнального каскада Wnt действуют непосредственно на формирование митотического веретена. Так, например, у излюбленного модельного организма молекулярных биологов — червячка C. elegans — сигнализация Wnt вызывает асимметрию митотического веретена, приводящую к асимметричному распределению β-катенина [17]. Более того, сигнализация Wnt сильно активируется в митозе, свидетельствуя о том, что «митотическая Wnt-сигнализация» играет важную роль в организации программы клеточного деления и таким образом способствует клеточной пролиферации [18].
Стволовые клетки в основном характеризуются двумя свойствами: способностью к самообновлению и дифференцировке в различные типы клеток . Эти процессы регулируются различными факторами роста, в том числе белками Wnt [19]. Накопленные данные показывают, что сигнальный путь Wnt/β-катенина играет ключевую роль в поддержании плюрипотентности, а также в процессах перепрограммирования соматических клеток. В то же время сигнализация Wnt/β-катенин играет важную роль и в процессе дифференцировки.
Дифференцировка и де-дифференцировка стволовых клеток — также предмет Нобелевской премии 2012 года (по физиологии и медицине): «Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки» [20]. См. также [21], [22]. — Ред.
Обнаружено, что добавление белка Wnt или же, наоборот, ингибитора Wnt (малой молекулы IWP2) снижает неоднородность популяции клеток. При этом образуются либо клетки со стабильно высоким уровнем синтеза Wnt, либо клетки с низким уровнем синтеза Wnt. При дифференцировке эмбриональные клетки с высоким уровнем синтеза Wnt преимущественно образуют энтодермальные и сердечные клетки, а с низким — в первую очередь нейроэктодермальные клетки [23]. Знание того, что сигнализация Wnt на ранних стадиях дифференцировки повышает, а на поздних стадиях наоборот угнетает развитие сердца, позволило путем правильной стратегии использования малых молекул и механизмов сигнализации Wnt получить in vitro из индуцированных плюрипотентных стволовых клеток человека кардиомиоциты с недостижимой до сих пор эффективностью — до 98% [24]!
Перспективы
Вот уже 30 лет как ежегодно появляется огромное количество статей, так или иначе затрагивающих тему сигнализации Wnt. Такое пристальное внимание к этой теме вполне заслуженно, потому что «вездесущая» молекула Wnt регулярно преподносит сюрпризы. Так, например, выяснилось, что β-катенин, избежавший деградации благодаря активации Wnt-сигнала, активирует синтез ферментативной субъединицы теломеразы (TERT) в стволовых и раковых клетках. В этом ему помогает один из транскрипционных факторов плюрипотенции — Klf4, направляющий его на промотор гена Tert [25]. Как известно, теломераза — фермент, поддерживающий длину теломеров в противовес их укорочению, приводящему к старению клетки [26]. Поэтому открытие роли Wnt в стабилизации теломер может помочь как борьбе с раковыми заболеваниями, так и борьбе со старением.
Трансмембранные (интегральные) белки
Некоторые из трансмембранных белков пронизывают мембрану один раз (гликофорин), другие имеют несколько участков (доменов), последовательно пересекающих бислой.
Трансмембранные домены, пронизывающие бислой, имеют конформацию α-спирали. Полярные остатки аминокислот обращены внутрь глобулы, а неполярные контактируют с мембранными липидами. Такие белки называют «вывернутыми» по сравнению с растворимыми в воде белками, в которых большинство гидрофобных остатков аминокислот спрятано внутрь, а гидрофильные располагаются на поверхности .
Радикалы заряженных аминокислот в составе этих доменов лишены заряда и протонированы (-СООН) или депротонированы (-NH2).
Гликозилированные белки
Поверхностные белки или домены интегральных белков, расположенные на наружной поверхности всех мембран, почти всегда гликозилированы. Олигосахаридные остатки могут быть присоединены через амидную группу аспарагина или гидроксильные группы серина и треонина.
Олигосахаридные остатки защищают белок от протеолиза, участвуют в узнавании лигандов или адгезии.
Латеральная диффузия белков
Некоторые мембранные белки перемещаются вдоль бислоя (латеральная диффузия)или поворачиваются вокруг оси, перпендикулярно его поверхности.
Например, фермент фосфолипаза А2 , связываясь с цитоплазматической поверхностью мембраны, может латерально перемещаться по поверхности бислоя и гидролизовать несколько тысяч фосфолипидов в минуту до тех пор пока не отделится от мембраны.
Латеральная диффузия интегральных белков в мембране ограничена, это связано с их большими размерами, взаимодействием с другими мембранными белками, элементами цитоскелета или внеклеточного матрикса.
Белки мембран не совершают перемещений с одной стороны мембраны на другую (флип-флоп» перескоки), подобно фосфолипидам.
Медицинская биохимия, принципы измерительных технологий в биохимии, патохимия, диагностика, биохимия злокачественного роста. Часть 2.

Чарльз Дарвин представил нам отличную теорию о зарождении и развитии жизни на Земле. Правда, в ней еще очень много вопросов и спорных моментов. Но на данном этапе лучшего у нас пока нет. Самая большая проблема с теорией мистера Дарвина в том, что мы можем догадываться и строить предположения как и почему все произошло, но мы не можем проверить или опровергнуть эту теорию. Предлагаю использовать теорию эволюции как паттерн, чтобы представить, как развивалась нервная система и какие процессы привели к появлению сознания. Мы обсудим возможные перспективы такого подхода позже.
Разнообразные типы клеток объединяются в ансамбли и паттерны, так что специализированные компоненты интегрируются в физиологию всего органа
Закроем глаза и будем представлять.
У нас есть целый океан одиночных клеток, которые переносятся потоками или плавают в лужах. Днем солнце нагревает их, а ночью они остывают. Мы можем представить, что в какой-то момент клетки научились сокращаться и этим приобрели способность к передвижению, что в совокупности с умением распознавать температуру дало им возможность перемещаться, а со временем, сокращая только одну сторону начало получаться перемещаться в более комфортном направлении.

Но некоторые все равно перемещались в неудачном направлении и погибали, и их мертвые тела, разлагаясь, создавали химический маркер для таких мест, и другие особи научились со временем различать такие маркеры. Так же со временем возможность сенсоров по распознаванию маркеров росла, и мы можем видеть, что со временем они научились распознавать не только тепло/холод, но и опасные места, где ощущаются маркеры разложения, и места где есть еда. Предлагаю называть такую систему внешними маркерами.
Система внешних маркеров, по сути, очень проста, когда на внешнем сенсоре есть определенный раздражитель, то сокращается определенная часть тела, чтобы обеспечить движение к или от раздражителя. Можно представить это как двигатель с выключателем, где роль переключателя играет внешний раздражитель. Для примера, муравей переносит упавший лист за черенок, потому что на черенке присутствует специальный химический маркер, сделанный самой природой, муравей натыкаясь на него, запускает алгоритм перетаскивания листика.

Наблюдая за насекомыми, мы можем видеть, что следующим шагом развития стала система внешних маркеров на заказ. В какой-то момент времени, мы можем предположить что внешние сенсоры научились различать не только химию разложения, но также и химические маркеры живых особей, и природа не упустила возможности создать органы способные производить различные выделения для пометок окружающей среды. Это тоже очень простая система. Например, при наличии определенного стимула в качестве переключателя животное может услышать шум и испугаться. Оно оставляет след в виде мочи или кала как маркер для других, что это опасное место.Это очень похоже на примитивную систему коммуникации. Мы можем предположить, что изначально это произошло в тот момент, когда особи научились различать свой след и возвращаться по нему назад в зону комфорта, или другие особи могли следовать за первой. Может по ночам им было более комфортно находиться вместе. Систему с внешними маркерами на заказ мы можем видеть почти у всех живых существ. Правда, у людей это чаще заметно например в таком бытовом мероприятии как покупки. Когда женская особь оставила химические маркеры на куске бумаги, а мужская особь видит совпадающие маркеры на полке, берет и кладет в корзину, вычеркивает в списке. :)

Но с ростом размера тел, эволюция столкнулась с парой проблем. Так как количество клеток в одной особи росло, то росло и количество сенсоров которое приходилось обрабатывать. И на этом пути эволюция собрала максимальное количество цепей обработки сигналов в одном месте. К тому же все информационно тяжелые сенсоры, зрение, слух, обоняние разместились не очень далеко.
Другой проблемой стало то, что появилась необходимость переключать весь набор клеток в различные режимы работы одновременно. Например, режимы сна, спокойствия, паники, агрессии. Реализовать это при помощи подведения командных нервов к каждой клетке не представляется возможным. И в данном случае эволюция не стала изобретать ничего нового, а просто использовала старый трюк с маркерами. Только теперь это стали маркеры внутри организма. То есть появились механизмы, начавшие вырабатывать определенные маркеры, которые разносятся кровью по организму. Клетки, раздражаясь на маркер, изменяют свой режим работы. Назовем это сигнальной системой. Самый простой и известный всем пример работы сигнальной системы, это приступ паники. Когда при наличии определенных раздражителей система начинает вырабатывать адреналин.

И вот тут мы подходим к самому интересному. На каком-то неизвестном этапе, случилось так, что некоторые особи утратили возможность распознавать внешние маркеры. У китообразных, сирен, большинства рукокрылых и узконосых приматов, включая человека, вомероназальный орган рудиментарен или полностью утрачен. На самом деле, мы, конечно, не можем знать, что случилось, было ли наращивание маркеров в сигнальной системе первичным и система внешних маркеров стала не нужна. Или сначала по какой-то причине система внешних маркеров стала недоступна и тогда началось наращивание маркеров во внутренней сигнальной системе. В случае с человеком, на данный момент известно более 100 внутренних маркеров. Так же известно, что гормоны человека могут воздействовать на животных. Но гормоны животных либо не имеют воздействия на человека, либо их реакция очень ослаблена. То есть мы можем предположить, что сигнальная система человека гораздо более развита, чем у животных. И возможно это именно та грань, которая нас различает.
Но вернемся к теме возникновения сознания.
На данном этапе наших теоретических исследований, мы пришли к тому, что у нас есть система выключателей, которые при раздражении производят какую-то работу. При этом все эти выключатели собраны физически в одном месте и крайние из них имеют в качестве подключения сенсоры или нервы.
Еще у нас имеется сигнальная система, которая управляется теми же самыми выключателями. Но при этом сами выключатели умеют реагировать на маркеры сигнальной системы. То есть мы можем это себе представить как замкнутый круг. Выключатели управляют сигнальной системой, сигнальная система воздействует на выключатели.

Обобщив сказанное, мы можем сказать что сознание представляет из себя бесконечный замкнутый цикл из двух систем, воздействующих друг на друга, триггеров и гормональной, в попытках найти равновесие. При этом внешние раздражители вносят свои поправки и нарушают равновесие. Эмоции в данном случае есть не более чем побочный эффект работы этих систем.
Для подтверждения данной модели, нам понадобится обнаружить нейроны которые взаимодействуют со всем спектром гормонов, что представляется мало возможным на данном уровне развития техники. Подобные нейроны исчисляются несколькими тысячами на каждый гормон, в общей массе почти сотни миллиардов нейронов.
В следующей части мы рассмотрим детальнее как из набора триггеров и сигнальной сети организовать то что мы называем сознанием. В качестве примера будем использовать реализованную компьютерную модель на ранней стадии обучения
Читайте также:

