Образование клапанов аорты. Разделение артериального ствола плода
Добавил пользователь Алексей Ф. Обновлено: 21.01.2026
Суть нарушений при этом, довольно часто встречающемся пороке, состоит в следующем. Клапан аорты, регулирующий поток крови из левого желудочка в ее восходящий отдел, состоит из трех тонких полулунных створок, которые при каждом сокращении левого желудочка прижимаются к стенке аорты, открывая путь свободному потоку крови, а при каждом расслаблении - смыкаются, перегораживая этот путь.
В течение одного сердечного цикла они, таким образом, производят два действия: открывают и закрывают «шлюз». Можно только представить себе, каким идеальным должно быть состояние самих створок — их эластичность, подвижность, плотность - чтобы обеспечить такую многолетнюю, полноценную и непрерывную работу. Ведь достаточно их неполного соприкосновения, чтобы создать препятствие потоку или обратный ток крови в сторону желудочка.
Стеноз (применительно к клапанам или сосудам) означает сужение
При врожденном пороке сужение может быть за счет неправильного развития створок, их срастания между собой (точнее - их «неразделения» на три), отсутствия одной из створок (когда их две вместо трех, но они, все же, полностью закрывают клапанное отверстие) и, наконец, за счет узости самого кольца, к которому эти створки крепятся. Чаще наблюдается сочетание этих структурных изменений, выраженных в большей или меньшей степени.
Препятствие кровотоку создает разницу давления между левым желудочком и аортой, и степень этой разницы зависит от величины отверстия и состояния развития самих створок. В любом случае, на левый желудочек падает нагрузка большая, чем при нормальном кровообращении: при резком сужении желудочек может не справляться с ней вообще, а при небольшом - относительно легко все переносить, постепенно утолщая свою стенку и увеличиваясь в размере.
Приблизительно в 10% случаев этого порока створки клапана настолько обезображены, что вместо них имеется мембрана с отверстием в 1-2 мм с небольшими бороздками. Интересно, что у плода, находящегося в матке, такое грубейшее нарушение нормального развития сердца почти никак себя не проявляет. Это понятно, так как основная часть крови плода идет в обход аортального клапана через легочный ствол и открытый артериальный проток в аорту. Однако, диагностировать его с помощью эхокардиографии можно, начиная с 6-7 месяцев беременности , что очень важно, так как при таких стенозах ребенок сразу после рождения оказывается в критическом состоянии. События будут развиваться драматически быстро, и, если экстренно ему не помочь, то он погибнет в течение первых недель. Это произойдет, прежде всего, из-за того, что левый желудочек постоянно будет работать с нагрузкой, превышающей его возможности, и он очень быстро может «сдаться». Более того, нарушается процесс кровоснабжения стенки самого левого желудочка, его питания. Необходима срочная операция.
Казалось бы - чего проще? Взять, «раскрыть» клапан — и все. Быстро и легко, особенно при всех современных возможностях.
К сожалению, это не так. Вернее, не всегда так. В «идеальных» случаях, действительно несложно рассечь сращенные створки и расширить клапанное отверстие. Это делается в рентгенохирургическом кабинете. Процедура - короткая и достаточно безопасная. Но, если створки плохо развиты, а клапанное кольцо — узкое, то эффекта можно и не достичь, а кроме того, само вмешательство может оказаться слишком травматичным. Поэтому, даже сегодня лечение детей с критическим стенозом аорты связано с очень высокой степенью риска. Разрыв неразвитых створок никоим образом не восстанавливает их, а только устраняет сужение, спасая ребенка от скорой гибели. Даже при удачном непосредственном исходе на этом этапе, в дальнейшем ему предстоит операция на клапане аорты для полного восстановления его нормальной функции.
Интересно, что в последние годы разрабатывается методика устранения стеноза аорты у плода, до его появления на свет, дающая возможность сердцу нормально работать последние месяцы внутриутробной жизни и быть лучше подготовленным к нагрузкам, которые его ожидают после первого самостоятельного вдоха. Пока это первые шаги, но вполне возможно, что близок день, когда критический стеноз аортального клапана станет вполне излечимым пороком сердца.
К счастью, в большинстве случаев клапанное кольцо сужено умеренно, две или только одна створка клапана сращена со своими соседками, но не полностью, и в целом, аппарат функционирует неплохо. Неплохо — но не идеально. Нагрузка на левый желудочек есть, и степень его зависит от величины препятствия. Что при этом происходит с желудочком? Стенка его утолщается, масса увеличивается, полость его камеры уменьшается и питание стенки артериальной кровью ухудшается из-за того, что утолщение намного опережает развитие сосудистой сети в толще мышцы сердца. Кроме того, при первой операции, если клапан был представлен плохо разделенной мембраной, результат был достигнут только расширением узкого отверстия. Сами створки остались обезображенными. Они не закрывают отверстие до конца, т.к. не смыкаются в фазу диастолы. В результате часть крови, выброшенной в аорту, идет обратно в левый желудочек, увеличивая и без того чрезмерную нагрузку. Это недостаточность клапана, которая в комбинации с его стенозом значительно ухудшает клиническую картину, и ускорит необходимость полной коррегирующей операции.
Стеноз аортального клапана у детей старшего возраста — совсем другая, и гораздо менее драматичная история. Признаков недостаточности сердца долгое время может не быть совсем, а диагноз ставят на основании типичного шума на клапане и по данным эхокардиографии. Не быстрое, но неуклонное увеличение сердца в размерах, нарушения ритма, и иногда — жалобы на боли за грудиной, могут быть признаком того, что вмешательство необходимо . Вместе с тем, течение заболевания позволяет следить за ним в динамике и выбрать время и метод коррекции порока.
В наилучшем случае все дело в самих створках и простым их разделением все и ограничится. В других - они настолько изменены, что придется заменить весь клапан искусственным протезом. В третьих - самых тяжелых - само кольцо аортального клапана может быть настолько узким, что невозможно вшить в него протез, даже самого малого диаметр. Тогда применяют разнообразные методы расширения этого кольца. Это уже большие и травматичные вмешательства со значительным риском, и отличный результат уже не столь закономерен.
Мы не будем вдаваться в технические подробности. Особенности операции у вашего ребенка, как и степень риска, и последствия вам должны подробно объяснить. Скажем только, что длительная (имеется в виду 10-20 лет) жизнь со стенозом аортального клапана опасна, т.к. может привести к серьезным осложнениям вплоть до внезапной смерти у, казалось бы, в остальном вполне здорового подростка. В любом случае, дамоклов меч необходимой операции висит до тех пор, пока она не будет сделана, а этот факт — тоже неблагоприятен для нормального психологического состояния и ребенка, и вас самих.
Результаты операций, в том числе и отдаленные, достаточно хорошие, если они делаются на благополучном (во всем остальном) фоне.
Интересно, что при совсем нередком варианте нормально работающего аортального клапана, когда вместо трех его створок имеются две (и обнаруживаются они случайно у «бессимптомного» человека), процессы «старения» створок, связанные с возрастом, идут гораздо быстрее, чем при трехстворчатом строении. Разрушение самих створок, отложение в них кальция можно наблюдать в 40-50 лет, когда появляются первые клинические симптомы: одышка, увеличение сердца, боли за грудиной, ощутимые нарушения ритма. Понятно, что это уже совсем другой сценарий, нежели описанный выше, но он вызван тем же стенозом клапана аорты. И, если двустворчатый клапан - это, несомненно, врожденное, то и его последствия можно отнести к врожденным порокам сердца, в каком бы возрасте они не были впервые выявлены.
Показания к замене клапана при появлении симптомов абсолютны, потому что следующим симптомом может быть внезапная остановка сердца и смерть. Операция протезирования аортального клапана сегодня не должна сопровождаться практически никаким риском, а конструкции самих клапанов настолько совершенны и долговечны, что позволяют вести нормальный образ жизни многие годы.
Общий артериальный ствол
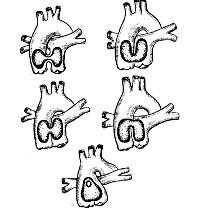
Название этого редкого порока сердца определяет его сущность. От сердца вместо двух магистральных сосудов — аорты и легочной артерии — отходит один большой сосуд, несущий кровь в большой круг кровообращения, в легкие и в венечные сосуды. Этот сосуд — — не разделился, как ему положено, на 4-5 неделе внутриутробной жизни плода, на аорту и легочную артерию, а «сидя» верхом над двумя желудочками, несет смешанную кровь в оба круга кровообращения (желудочки сообщаются между собой через огромный дефект межжелудочковой перегородки). Легочные артерии к обоим легким могут отходить от ствола одним общим сосудом (и потом разделяться на ветви) или раздельно, когда и правая, и левая отходят непосредственно от ствола.
Понятно, что при этом пороке глубоко нарушена вся система кровообращения. В желудочках смешиваются потоки венозной и артериальной крови. Эта недонасыщенная кислородом смесь поступает в большой круг и в легкие под одинаковым давлением, и сердце работает с огромной нагрузкой. Проявления порока становятся очевидными уже в первые дни после рождения: одышка, быстрая утомляемость, потливость, синюшность, учащенный пульс, увеличенная печень — словом, все признаки тяжелой сердечной недостаточности. Эти явления могут уменьшиться в первые месяцы жизни, но в дальнейшем они будут только нарастать. Кроме того, ответ сосудов легких на усиленный кровоток приводит к их изменениям, которые очень скоро станут необратимыми. По статистическим данным, 65% детей с общим артериальным стволом погибают в течение первых 6 месяцев жизни, а 75% не доживают до первого дня рождения. Больных, даже достигших всего лишь двух-трехлетнего возраста, оперировать, как правило, уже поздно, хотя они и могут дожить до 10-15 лет.
Хирургическое лечение вполне возможно, а его результаты достаточно хорошие. Важнейшим условием успеха будет своевременное поступление ребенка в специализированный кардиологический центр и выполнение операции в первые месяцы жизни . Промедление в этих случаях подобно смерти.
Если по каким-то причинам выполнение радикальной операции невозможно, то существует и оправдал себя паллиативный вариант: наложение манжеты на обе легочные артерии, отходящие от общего ствола. Эта операция (см. главу о дефектах межжелудочковой перегородки) защитит легочные сосуды от усиленного кровотока, но ее надо делать очень рано — в первые месяцы жизни.
Радикальная коррекция общего артериального ствола — большое вмешательство, выполняемое, естественно, в условиях искусственного кровообращения. От общего ствола отсекаются артерии, идущие к легким, превращая, таким образом, ствол только в восходящую аорту. Потом рассекается полость правого желудочка, и дефект перегородки закрывают заплатой. Теперь восстановлен нормальный путь для левожелудочковой крови. Затем правый желудочек соединяют с легочными артериями с помощью кондуита. Кондуит представляет собой синтетическую трубку того или иного диаметра и длины, в середине которой вшит биологический или (реже) механический протез самого клапана. О различных конструкциях искусственных клапанов и их недостатках и преимуществах мы говорили выше (см. главу об аномалии Эбштейна). Скажем лишь, что по мере роста весь вшитый кондуит может прорастать собственной тканью и разрушаться, а клапан — постепенно зарастать и плохо справляться со своей первоначальной функцией. Кроме того, размер кондуита, который можно вшить полугодовалому ребенку, явно недостаточен, чтобы нормально работать многие годы: ведь синтетические трубки и искусственные клапаны не растут. И, каким бы большим кондуит не был, через несколько лет он станет относительно узким. В таком случае, со временем встанет вопрос о замене кондуита, т.е. о повторной операции, но это может случиться через много лет нормальной жизни ребенка. Однако необходимость постоянного и регулярного кардиологического контроля должна быть для вас очевидной.
Возможно, что к моменту, когда вы будете это читать, уже создадут протезы, покрытые изнутри собственными клетками, взятыми заранее из тканей ребенка. Пока это только экспериментальные работы и потребуется время, чтобы они стали клинической реальностью. Но при сегодняшних головокружительных темпах развития науки такое вполне возможно уже в скором будущем.
Общий артериальный ствол - врожденная сердечно-сосудистая аномалия, характеризующаяся сращением легочной артерии и аорты в единый сосуд, обеспечивающий коронарное, легочное и системное кровообращение. Наличие общего артериального ствола проявляется цианозом, тахипноэ, тахикардией, гипотрофией; в некоторых случаях - критической сердечной недостаточностью с первых дней жизни. Общий артериальный ствол диагностируется с помощью рентгенологического исследования, фонокардиографии, электрокардиографии, эхокардиографии, зондирования полостей сердца, вентрикулографии, аортографии. При общем артериальном стволе показана ранняя хирургическая коррекция порока.
МКБ-10
Общие сведения
Общий артериальный ствол - (общий аортопульмональный ствол, истинный артериальный ствол) - врожденный порок сердца, при котором от сердца отходит единственный магистральный сосуд, несущий смешанную кровь в большой и малый круг кровообращения. В кардиологии общий артериальный ствол диагностируется в 2-3% случаев от числа всех ВПС. Общему артериальному стволу всегда сопутствует дефект межжелудочковой перегородки; кроме этого могут встречаться аномалии сердца и сосудов: перерыв или атрезия дуги аорты, коарктация аотрты, атрезия митрального клапана, открытый атриовентрикулярный канал, аномальный дренаж легочных вен, единственный желудочек и др. Среди экстракардиальных аномалий встречаются пороки развития желудочно-кишечного, урогенитального тракта, скелета.
Причины общего артериального ствола
Общий артериальный ствол возникает вследствие нарушения формирования магистральных сосудов на ранней стадии эмбриогенеза (5-6 неделе развития плода) и отсутствия разделения примитивного ствола на главные магистральные сосуды - аорту и легочную артерию.
При общем артериальном стволе нередко задерживается развитие перегородок сердца, в связи с чем сердце может иметь трехкамерное или двухкамерное строение. Клапан общего артериального ствола может быть одно-, двух-, трех- или четырехстворчатым; часто отмечается его стеноз или недостаточность. Обширный дефект межжелудочковой перегородки является неотъемлемым признаком общего артериального ствола.
Классификация общего артериального ствола
Учитывая место отхождения легочных артерий, различают 4 типа общего артериального ствола:
- Ствол легочной артерии отходит от общего артериального ствола, делится на правую и левую легочные артерии;
- Правая и левая легочные артерии отходят от задней стенки общего артериального ствола;
- Правая и левая легочные артерии отходят от боковых стенок общего артериального ствола;
- Легочные артерии отсутствуют, ввиду чего кровоснабжение легких обеспечивается бронхиальными артериями, отходящими от аорты. На сегодняшний день в кардиологии данный тип рассматривается как тяжелая форма тетрады Фалло.
Общий артериальный ствол может располагаться в равной степени над обоими желудочками (42%), в большей степени над правым желудочком (42%), преимущественно над левым желудочком (16%).
Особенности гемодинамики при общем артериальном стволе
Гемодинамические нарушения при общем артериальном стволе появляются сразу после рождения ребенка. Равное давление в полостях сердца, легочной артерии и аорте способствует переполнению кровью легочных сосудов, быстрому прогрессированию сердечной недостаточности и ранней гибели пациентов. У выживших детей рано возникает выраженная легочная гипертензия.
В случае сужения легочной артерии отсутствует перегрузка малого круга кровообращения и создается градиент давления «аорта-ствол легочной артерии». В данной ситуации развивается сердечная недостаточность по лево- и правожелудочковому типу.
С учетом анатомической формы общего артериального ствола могут наблюдаться 3 варианта нарушения гемодинамики:
- увеличение легочного кровотока и повышение давления в сосудах легких. Характеризуется легочной гипертензией и сердечной недостаточностью, резистентными к проводимому лечению.
- норма или незначительное увеличение легочного кровотока, нерезко выраженный сброс крови. Проявляется цианозом при нагрузке; сердечная недостаточность отсутствует.
- снижение легочного кровотока вследствие стеноза устья легочной артерии. Присутствует постоянный цианоз, обусловленный нарушением оксигенации крови.
Симптомы общего артериального ствола
При отсутствии сужения устья легочной артерии состояние новорожденных с первых минут жизни расценивается как критическое. До 75% детей с общим артериальным стволом погибает в первый год жизни, из них 65% - в течение первого полугодия. Причиной смерти служит сердечная недостаточность и переполнение кровью сосудов легких.
В остальных случаях клиника общего артериального ствола характеризуется одышкой в покое, синюшностью, потливостью, быстрой утомляемостью, тахикардией, гепатомегалией - всеми признаками тяжелой недостаточности кровообращения. У детей рано развивается кардиомегалия и формируется сердечный горб, имеется деформация фаланг пальцев по типу «барабанных палочек» и «часовых стекол». Пациенты с общим артериальным стволом при отсутствии хирургического лечения порока иногда могут дожить до 15-30 лет.
Диагностика общего артериального ствола
Аускультативная картина и данные фонокардиографии при общем артериальном стволе неспецифичны: регистрируется систолический (иногда также диастолический) шум, громкий II тон. Электрокардиография не имеет самостоятельного диагностического значения; обычно на ней выявляется перегрузка обоих желудочков и отклонение ЭОС вправо.
Рентгенография органов грудной клетки более информативна и обнаруживает шарообразную форму сердца, увеличение и гипертрофию желудочков, расширение тени магистральных сосудов и ветвей легочной артерии. Основные анатомические признаки общего артериального ствола (ДМЖП, отхождение от сердца единого магистрального сосуда) выявляются с помощью эхокардиографии.
Во время зондирования полостей сердца зонд легко проводится в общий артериальный ствол; в желудочках, легочной артерии и аорте регистрируется равное систолическое давление (при сужении легочной артерии - градиент давления). При вентрикулографии и аортографии (трункографии) визуализируется заполнение контрастом общего артериального ствола.
Дифференциальная диагностика общего артериального ствола должна проводиться с дефектом аортолегочной перегородки, тетрадой Фалло, транспозицией магистральных сосудов, атрезией легочной артерии, комплексом Эйзенменгера.
Лечение общего артериального ствола
Консервативные мероприятия при общем артериальном стволе малоэффективны и направлены, главным образом, на создание температурного комфорта, ограничение активности, снижение ОЦК, коррекцию сердечной недостаточности.
У детей первых месяцев жизни, находящихся в критическом состоянии, прибегают к выполнению паллиативной операции - сужению легочной артерии. Радикальная коррекция порока предусматривает отделение легочных артерий от общего артериального ствола, имплантацию кондуита между правым желудочком и легочной артерией и пластику дефекта межжелудочковой перегородки. Части больным требуется проведение пластики или протезирования клапана общего артериального ствола ввиду его недостаточности.
Успешность оперативного лечения общего артериального ствола зависит от степени легочной гипертензии, наличия других врожденных пороков и аномалий венечных артерий. Интраоперационная летальность составляет 10-30% и увеличивается пропорционально возрасту оперируемых.
Прогноз общего артериального ствола
При антенатальном выявлении общего артериального ствола у плода женщине рекомендуется искусственное прерывание беременности. Без кардиохирургической помощи лишь менее 10% пациентов доживают до 20-30 лет. Долгосрочный прогноз после операции зависит от состоятельности анастомоза между легочной артерией и правым желудочком, функционирования клапана ствола. В перспективе может потребоваться замена клапана или реимплантация кондуита.
Пациенты с общим артериальным стволом в течение всей жизни нуждаются в наблюдении кардиолога и кардиохирурга, профилактике инфекционного эндокардита перед хирургическими и стоматологическими процедурами ввиду опасности развития бактериемии.
Перерыв дуги аорты ( Атипичная коарктация аорты , Атрезия дуги аорты )

Причины
Предрасполагающие факторы атипичной коарктации общие с любой генетической патологией. Группу риска составляют дети женщин, рожающих после 35 лет, ведущих нездоровый образ жизни либо состоящих в близкородственных браках, а также люди, рожденные в семьях, у которых в анамнезе выявляется два и более выкидыша или уже есть больной ребенок. Во время беременности к тератогенным последствиям могут привести перенесенные инфекционные заболевания матери — оспа, эпидемический паротит, грипп, корь.
Патогенез
При атрезии аорты любого типа значительно ухудшается кровообращение органов и тканей, особенно нижней части тела. Первые дни и недели жизни ситуация для пациента более благоприятная, поскольку часть дефицита крови компенсируется за счет функционирующего боталлова протока. По мере его физиологического зарастания появляются признаки гемодинамической недостаточности нижней половины тела, особенно органов брюшной полости, таза. Это приводит к почечной и печеночной недостаточности, эндогенному накоплению продуктов метаболизма, ацидозу, иногда с критическим смещением pH.
На фоне порока снижается сопротивление малого круга, что потенцирует патологическое перераспределение крови. Значительная часть минутного объема кровообращения попадает в систему легочной артерии, вследствие чего там развивается гипертензия, нарастают симптомы право- и левожелудочковой недостаточности. Постоянное высокое давление в сосудах легких вызывает гипертрофию, а затем массивную дилатацию левого предсердия, которое может сдавить бронхи и еще больше ухудшить работу дыхательной системы.
Классификация
Номенклатура данного дефекта дуги аорты главным образом стоится на анатомических характеристиках и месте формирования перерыва. Все типы могут сочетаться с сужением выходного отдела левого желудочка сердца, гипоплазией аортального клапана и дефектом межжелудочковой перегородки или быть изолированными пороками магистрального сосуда. В современной классификации патология делится на три вида:
● Тип А. Характеризуется отсутствием просвета аорты на уровне ее перешейка. На этот вид приходится порядка 44% случаев заболевания.
● Тип В. Перерыв в точке между общей левой сонной и подключичной артериями наблюдается у 52% пациентов. Делится на четыре подтипа:
○ Тип В1. Включает левый открытый артериальный проток, аберрантную правую подключичную артерию.
○ Тип В2. Артериальный проток имеет двусторонний характер. От аорты изолирована правая подключичная артерия.
○ Тип В3. Левый артериальный проток открыт, от аорты отходит правая легочная артерия.
○ Тип В4. Двусторонний артериальный проток, правосторонняя дуга аорты. Левая подключичная артерия изолирована от сосуда.
● Тип С. Самый редкий вариант дефекта — всего 4% от известных случаев. Перерыв происходит между безымянной и левой общей сонной артериями.
Симптомы
Клинические проявления различаются у больных разных возрастных категорий. У новорожденных на первый план выходят бледность кожи, затрудненное дыхание, рассеянные влажные хрипы в легких, нарушения диуреза вплоть до анурии, ацидоз. Характерным симптомом является цианоз нижней половины туловища после внутривенного введения простагландина Е1. Этот феномен — следствие раскрытия артериального протока, сопровождающегося сбросом крови из легочной артерии в нисходящую часть аорты. При неблагоприятном течении патологии у ребенка могут нарастать явления отека легких.
У детей старшего возраста симптоматика нередко отсутствует. Тот факт, что они смогли выжить с таким серьезным наследственным пороком, практически всегда говорит о том, что у пациентов развилась мощная коллатеральная сеть, способная компенсировать отсутствие соединения между сегментами аорты. Иногда больные жалуются на слабость, боли в ногах при физических нагрузках, головные боли, кровотечения на фоне развившейся артериальной гипертензии.
Осложнения
Перерыв дуги аорты относится к тяжелым порокам развития с высокой летальностью. В течение первых семи дней умирает около 40% новорожденных, к полугоду выживаемость снижается до 27% и держится на этом уровне до 15 лет. Особенно чреват осложнениями период зарастания артериального протока - на фоне скудной перфузии тканей может развиться метаболический синдром, сопровождающийся повреждением центральной нервной системы, сердечной мышцы, других органов. В случае выживания это может привести к отставанию умственного и физического развития, тяжелым сопутствующим заболеваниям.
Диагностика
Обнаружение данной патологии обычно осуществляется еще на этапе беременности при плановом посещении женщиной кабинета УЗИ и последующей консультации акушера-гинеколога. В ином случае диагноз ставится после родов неонатологами, детскими кардиологами. Большое значение отводится физикальным методам исследования. В частности, при пальпации определяется слабый пульс на ногах, аускультативно выслушивается усиление II тона над основанием сердца, систолический шум во втором межреберье, что говорит о нарушенной гемодинамике. Из инструментальных методов применяются:
- Электрокардиография. Базовый способ диагностики сердечно-сосудистых патологий, способный при атрезии дуги аорты выявить признаки гипертрофии правого желудочка, блокаду правой ножки пучка Гиса. При существенном нарушении гемодинамики появляется картина увеличения левого желудочка, нарушения проведения импульса в этой части органа. Стоит учитывать, что в 20% случаев на ЭКГ патология не обнаруживается.
- УЗИ сердца. Основной метод исследования при данном эмбриональном пороке. Перерыв дуги может быть заподозрен по существенному несоответствию диаметров восходящей аорты и легочного ствола. Также можно определить характер брахицефальных сосудов, их пропускную способность. В отличие от физиологического направления дуги кзади, при аномалии сосуда курс каротидных артерий направлен кверху.
- Магнитно-резонансная томография. Позволяет получить трехмерное изображение сосудистого пучка, установить характер отхождения сонных артерий, подтвердить отсутствие пути от нисходящей к восходящей части аорты. Существенным недостатком метода является невозможность дифференциальной диагностики между перерывом и тяжелой гипоплазией дуги.
- Рентгенография. Неспецифический метод, дающий возможность косвенно заподозрить перерыв аорты. Как следствие легочной гипертензии и следующего за ней гипертрофического, дилатационного перерождения миокарда на снимке можно увидеть кардиомегалию, усиление легочного рисунка, легочно-венозный застой, начинающийся отек легких. При синдроме Ди Джорджи верхнее средостение может быть слегка суженным из-за отсутствия вилочковой железы.
- Лабораторнаядиагностика. С помощью газового состава крови по уровню pH, рСО2, концентрации буферных систем можно определить наличие декомпенсированного метаболического ацидоза. В биохимическом анализе выявляются маркеры ишемического повреждения печени (высокие уровни АЛТ, АСТ, ЛДГ), почек (креатинина).
Лечение перерыва дуги аорты
Консервативная терапия
Патология является абсолютным показанием к хирургическому вмешательству. У новорожденных, которые на первых днях жизни могут плохо переносить операции, возможно непродолжительное лечение простагландином Е1. Данное вещество оказывает влияние на сосуды, снижая периферическое сопротивление и улучшая перфузию крови, уменьшает риск образования тромбов, способствует поддержанию проходимости открытого артериального протока, препятствует его зарастанию.
Хирургическое лечение
Согласно исследованиям, общая хирургическая летальность при оперативной коррекции атрезии составляет приблизительно 30%. Кроме того, лечение дефекта аорты остается проблемой современной медицины по той причине, что большинство пациентов изначально находятся в тяжелом состоянии с выраженной сердечной недостаточностью, анурией. Использование новых методик, совершенствование старых, внедрение в предоперационный период инфузий простагландина Е1 позволяет надеяться на скорое улучшение ситуации. Само вмешательство выполняется по одному из двух вариантов:
- Двухэтапный метод. Основные моменты этого способа на первом этапе — восстановление целостности дуги аорты с помощью имплантации собственных тканей либо сосудистого протеза с одномоментной перевязкой боталлова протока, временного сужения легочной артерии. Во вторую очередь закрывают дефект межжелудочковой перегородки (при его наличии). Как эндогенный материал могут быть использованы части сонной или подключичной артерии. Аутотрансплантат не провоцирует тромбообразование и активацию иммунитета, что упрощает течение послеоперационного периода и снижает вероятность повторных вмешательств.
- Одноэтапный метод. Представляет собой прямое анастомозирование нисходящей и восходящей частей аорты в условиях стернотомии, применения аппарата искусственного кровообращения и гипотермии. Данный способ технически более сложен, но предпочтителен при сочетании перерыва с множественными дополнительными пороками сердца, сосудов, так как дает хирургам максимальное количество времени для их устранения. Операция также применяется при сочетании атипичной коарктации с общим артериальным стволом, транспозицией магистральных сосудов.
Прогноз и профилактика
Естественное течение заболевания неблагоприятное. При хирургическом лечении в раннем возрасте, после проведения инфузионной терапии простагландинами прогноз в целом благоприятный. В отдаленном периоде велика вероятность повторных операций. Специфическая профилактика отсутствует. Супружеским парам с отягощенной наследственностью перед беременностью рекомендуется посещение центра планирования семьи, консультация генетика. Во время вынашивания ребенка и подготовки к гестации женщина должна придерживаться принципов здорового образа жизни, ограничить, а лучше исключить действие табака и алкоголя, предупреждать и своевременно лечить тератогенные внутриутробные инфекционные патологии.
1. Реконструктивная хирургия перерыва дуги аорты у взрослых/ Козлов Б.Н., Панфилов Д.С., Саушкин В.В.// Хирургия. Журнал им. Н.И. Пирогова - 2016 - №5.
2. Перерыв дуги аорты: диагностика порока методом мультидетекторной компьютерной томографии/ Ялынская Т.А.// Кардиоваскулярная радиология - 2012 - №4.
3. Описание этапной коррекции перерыва дуги аорты типа А в сочетании с гипоплазией левых отделов сердца/ Калашников С.В., Степаничева О.А., Беришвили Д.О.// Детские болезни сердца и сосудов - 2016 - №4.
Дефект аортолегочной перегородки
Дефект аортолегочной перегородки (аортолегочное окно, аортопульмональный септальный дефект, аортолегочный свищ или фенестрация) обусловлен наличием отверстия, посредством которого аорта и ствол легочной артерии сообщаются между собой. Дефект аортолегочной перегородки - редкая аномалия, составляющая в кардиологии 0,2−0,3% случаев всех врожденных пороков сердца.
Причины дефекта аортолегочной перегородки
Аотролегочное окно является следствием нарушения эмбриогенеза, в результате которого не формируется полноценная аортолегочная перегородка. Разделение эмбрионального артериального ствола на аорту и легочный ствол происходит между 6-7 неделями внутриутробного развития плода. Нарушение этого процесса приводит к возникновению дефекта аортолегочной перегородки.
Причины развития дефекта аортолегочной перегородки аналогичны таковым при формировании других врожденных пороков сердца. Факторами, нарушающими формирование сердца плода на ранних этапах внутриутробного развития, могут выступать инфекции беременной (краснуха, ветряная оспа, герпес, грипп, сифилис и др.), прием алкоголя и токсичных лекарственных препаратов, соматические заболевания матери (сахарный диабет), патологическое течение беременности (угроза самопроизвольного прерывания, сильные токсикозы), наследственность, ионизирующее излучение и пр.
Особенности гемодинамики при дефекте аортолегочной перегородки
При дефекте аортолегочной перегородки кровь под большим давлением поступает из восходящей аорты в легочную артерию. Выраженный артериовенозный (лево-правый) сброс рано приводит к развитию легочной гипертензии, которая присутствует у большинства больных с дефектом аортолегочной перегородки. Когда сопротивление в малом и большом круге кровообращения выравнивается, возникает перекрестный, а затем и веноартериальный (право-левый) сброс крови, что сопровождается развитием цианоза.
Классификация дефекта аортолегочной перегородки
С учетом критериев локализации, формы отверстия и его отношения к легочным артериям различают следующие анатомические типы дефекта аортолегочной перегородки (В. И. Бураковский и соавт., НЦССХ им. А. Н. Бакулева):
I тип - дефект имеет форму протока с хорошо выраженными полюсами; расположен в середине аортолегочной перегородки в удалении от синусов Вальсальвы. Левая и правая легочные артерии отходят дистальнее аортолегочного дефекта.
II тип - дефект имеет форму окна; расположен в проксимальной (нижней) части аортолегочной перегородки над синусами Вальсальвы. Аортолегочная перегородка частично сформирвоана в своей дистальной части; ветви легочной артерии отходят нормально, дистальнее дефекта.
III тип - дефект имеет форму окна; расположен в дистальной (верхней) части аортолегочной перегородки в удалении от синусов Вальсальвы. Аортолегочная перегородка частично сформирвоана в своей проксимальной части. Ветви легочной артерии отходят в зоне вершины дефекта.
IV тип - дефект имеет форму окна; расположен в дистальной (верхней) части аортолегочной перегородки, на уровне отхождения правой ветви легочного ствола. При данном типе дефекта аортолегочной перегородки аорта сообщается как с правой легочной артерией, так и с общим легочным стволом.
V тип - полное отсутствие аортолегочной перегородки, однако клапаны аорты и легочной артерии сформированы и разобщены. Легочные артерии отходят от общего магистрального сосуда, берущего начало от основания сердца.
Симптомы дефекта аортолегочной перегородки
У детей первых месяцев жизни ранним симптомом дефекта аортолегочной перегородки служит одышка по типу тахипноэ. Характерно отставание в физическом развитии, быстрая утомляемость, частые ОРВИ, повторные пневмонии.
На стадии преимущественного артериовенозного сброса кожные покровы физиологической окраски или несколько бледные. Небольшой цианоз может появляться при крике, плаче, явлениях сердечной и дыхательной недостаточности. При развитии перекрестного и веноартериального сброса крови цианоз кожи и видимых слизистых становится выраженным и постоянным. У 70% пациентов с дефектом аортолегочной перегородки обнаруживается деформация грудной клетки по типу «сердечного горба», формирование которого связано с увеличением правого желудочка, работающего в режиме гиперфункции.
При дефекте аортолегочной перегородки небольшого диаметра и у детей длительное время сохраняется удовлетворительное состояние. При больших дефектах рано развивается легочная гипертензия. Продолжительность жизни больных с дефектом аортолегочной перегородки зависит от размеров отверстия и составляет от нескольких месяцев до 30-40 лет (в среднем - 14 лет).
Диагностика дефекта аортолегочной перегородки
При осмотре пациентов с дефектом аортолегочной перегородки отмечается отставание в массе и росте, выпячивание грудной клетки в виде сердечного горба. Перкуторно выявляется расширение границ сердечной тупости в обе стороны; при аускультации выслушивается систолический шум с диастолическим компонентом, изменение сердечных тонов; пальпаторно определяется систолическое дрожание во II-III межреберье.
С помощью фонокардиографии зафиксируется аускультативная картина, изложенная выше. Электрокардиография выявляет признаки перегрузки правых отделов сердца, гипертрофию обоих желудочков, отклонение ЭОС вправо. Рентгенологическая картина при дефекте аортолегочной перегородки типична: увеличение тени сердца, расширение тени аорты и легочной артерии, усиление легочного рисунка в ранний период заболевания и его обеднение при развитии легочной гипертензии. С помощью эхокардиографии обнаруживается дефект в аортолегочной перегородке, устанавливается расположение окна, его размеры, исключаются сопутствующие пороки сердца.
Путем зондирования полостей сердца определяется выраженность легочной гипертензии, величина сброса крови, исследуется степень насыщения крови кислородом в легочной артерии. Диагностическим признаком дефекта аортолегочной перегородки является возможность проведения катетера из легочной артерии через отверстие в начальные отделы восходящей аорты. При выполнении аортографии видно попадание контрастного вещества из восходящей аорты в ствол легочной артерии. Дифференциальная диагностика при дефекте аортолегочной перегородки проводится с ДМЖП, общим артериальным стволом, открытым артериальным протоком.
Лечение дефекта аортолегочной перегородки
Поскольку спонтанное закрытие дефекта аортолегочной перегородки невозможно, единственным способом лечения врожденного порока сердца является кардиохирургическая операция. При большом дефекте аортолегочной перегородки операция выполняется в ранние сроки - до 1 года.
Закрытие аортолегочного окна производится путем ушивания или пластики дефекта с помощью заплаты доступами через просвет аорты или легочной артерии, либо с обеих сторон. Операция выполняется в условиях ИК, гипотермии и фармакохолодовой кардиоплегии.
При дефекте аортолегочной перегородки I типа производится перевязка протока. Невозможность выполнения радикальной операции при легочной гипертензии диктует необходимость выполнения двухэтапного вмешательства: 1 - сужение легочного ствола или легочной артерии; 2 - снятие суживающей манжетки и радикальная операция.
Интраоперационная летальность составляет 3%; послеоперационная достигает 15-20%.
Прогноз при дефекте аортолегочной перегородки
Большие размеры дефекта аортолегочной перегородки обусловливают злокачественное течение порока: 25-30% пациентов погибают в течение первого полугода жизни. Причинами смерти пациентов с дефектом аортолегочной перегородки обычно служат сердечная недостаточность, разрыв аневризмы легочной артерии в полость перикарда, тампонада сердца (гемоперикард), тромбоэмболии, бактериальный эндокардит.
У выживших больных отсутствие хирургического лечения приводит к развитию необратимых изменений в легких, делающих невозможным хирургическое лечение в более поздние сроки. В литературе встречаются единичные указания на больных с дефектом аортолегочной перегородки, доживших до 35−40 лет.
Читайте также:
