Оценка двигательной единицы. Патология двигательной единицы мышц
Добавил пользователь Валентин П. Обновлено: 21.01.2026
ФГБОУ ВО «Читинская государственная медицинская академия» Минздрава России, Чита, Россия
Медицинский центр "Интермед-Меркурий", Москва, Россия, 101000
Характеристика потенциала действия двигательных единиц латеральной крыловидной мышцы и биопотенциалов жевательных мышц при проведении сплинт-терапии по поводу болевой дисфункции височно-нижечелюстного сустава
Цель исследования — изучение потенциала двигательных единиц (ПДЕ) латеральных крыловидных мышц и биопотенциалов жевательных мышц в динамике сплинт-терапии у пациентов с дисфункцией височно-нижнечелюстного сустава (ВНЧС). В исследование включили 50 пациентов в возрасте 18—30 лет с диагнозом «синдром болевой дисфункции ВНЧС» (клиническая группа). Контрольную группу составили 25 здоровых волонтеров. Длительность сплинт-терапии составляла 6 мес. Электромиография была проведена до, через 1, 3, 6 и 12 мес от начала терапии. При дисфункции ВНЧС уже в состоянии покоя регистрируется повышенная функциональная активность всех жевательных мышц. Длительность и амплитуда ПДЕ латеральной крыловидной мышцы при функциональной нагрузке меньше на относительно здоровой стороне ВНЧС. Показатели биоэлектрической активности собственно-жевательной и височной мышц при максимальном волевом сжатии в привычной окклюзии отмечались ниже на стороне боли ВНЧС. Высокая степень корреляции наблюдалась между показателями латеральной крыловидной мышцы на относительно здоровой стороне ВНЧС и собственно-жевательной мышцы на стороне боли ВНЧС. На фоне восстановления равномерной биоэлектрической активности собственно-жевательных мышц через 12 мес от начала лечения отмечалась симметричность значений длительности и амплитуды ПДЕ латеральных крыловидных мышц и были достигнуты уровни контроля.
Дискоординированная работа латеральных крыловидных мышц (ЛКМ), собственно-жевательных мышц (СЖМ) и височных мышц (ВМ) при дисфункции височно-нижнечелюстного сустава (ВНЧС) генерирует переднюю дислокацию суставного диска, растяжение и разрывы внутрисуставных связок, развитие вторичного остеоартроза [1, 2]. Это обусловливает необходимость более детальной оценки состояния жевательного аппарата как важнейшего звена в развитии внутренних нарушений в ВНЧС. Глобальная электромиография (ЭМГ) позволяет зарегистрировать суммарную биоэлектрическую активность (БЭА) мышцы [3]. Однако в отношении исследования ЛКМ возможности глобальной ЭМГ ограничены [4]. В литературе имеются сведения об оценке БЭА ЛКМ с помощью устройства, содержащего поверхностные электроды [5]. Однако данная методика не позволяет выделить потенциал двигательных единиц (ПДЕ) мышцы. Анализ амплитуды, длительности и количества фаз ПДЕ дает возможность определить изменения структурных единиц мышцы локально, а также стадию денервационно-реиннервационного процесса в ней [6]. Эта функция может быть выполнима только с помощью локальной ЭМГ. Использование локальной ЭМГ позволит исследовать интимные механизмы ЛКМ, наиболее тонко и в ранние сроки реагирующей на функциональные нарушения в ВНЧС.
Цель исследования — изучить потенциал действия двигательных единиц латеральных крыловидных мышц и биопотенциалов жевательных мышц в динамике сплинт-терапии у пациентов с дисфункцией ВНЧС.
Материал и методы
Для достижения поставленной цели обследовали лиц с различными клиническими проявлениями функциональных нарушений ВНЧС, обратившихся в специализированный центр на базе клиники Читинской государственной медицинской академии за период 2016—2018 гг.
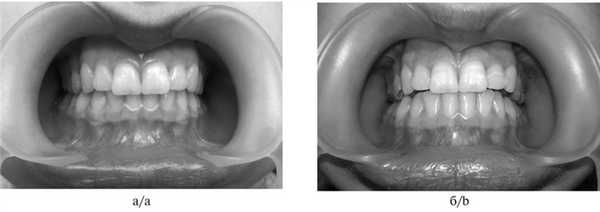
Углубленное обследование проведено 50 пациентам в возрасте 18—30 лет с диагнозом «синдром болевой дисфункции ВНЧС» (клиническая группа): проведено аппаратное лечение (сплинт-терапия) длительностью 6 мес (рис. 1). Рис. 1. Соотношение зубных рядов до наложения (а) и после наложения (б) сплинта.
Все электромиографические исследования были проведены до и на этапах лечения — через 1, 3, 6 мес, а также через 12 мес от начала терапии. Контрольную группу составили 25 здоровых волонтеров.
Для изучения ПДЕ ЛКМ использовали электромиограф Viking Quest («Nicolet Biomedical», США; рис. 2). Рис. 2. Электромиографический четырехканальный комплекс Viking Quest.
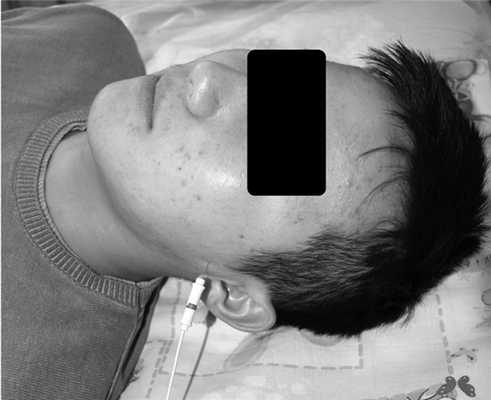
При оценке состояния ЛКМ использовали методику Н.А. Хватовой (1986). Концентрические игольчатые электроды вводили на расстоянии 16 мм от середины основания козелка уха (рис. 3). Рис. 3. Установленный игольчатый электрод для электромиографии латеральной крыловидной мышцы.
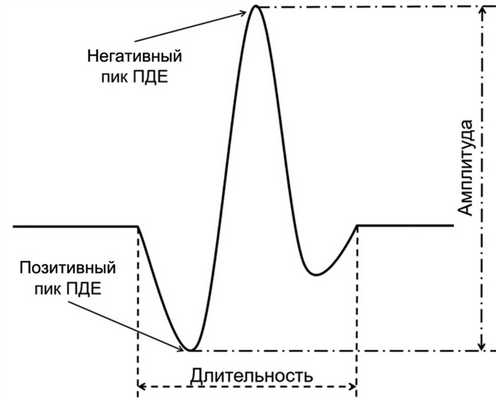
Обследование ЛКМ проводили в состоянии покоя и при заданной нагрузке (максимальное выдвижение нижней челюсти вперед) в течение 10 с. Интерпретацию результатов осуществляли по длительности и амплитуде ПДЕ (рис. 4). Рис. 4. Длительность и амплитуда потенциала двигательной единицы.
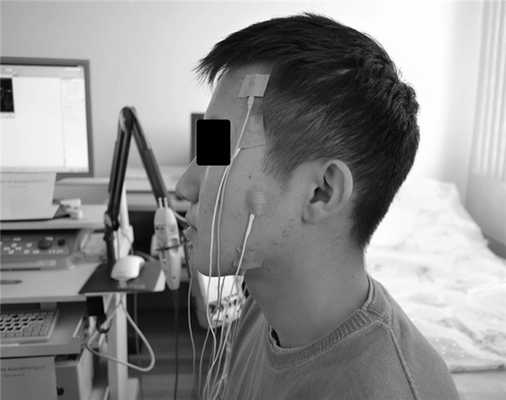
Для комплексной оценки ответной реакции мышечного аппарата на сплинт-терапию исследовали также СЖМ и ВМ по традиционной методике (рис. 5). Рис. 5. Электромиографическое исследование собственно-жевательной и височной мышц.
В объективные характеристики протокола ЭМГ были включены спонтанная активность мышцы в состоянии покоя, средняя длительность (в миллисекундах) и амплитуда (в микровольтах) ПДЕ при заданной нагрузке ЛКМ, средняя амплитуда БЭА (в микровольтах) СЖМ и ВМ при MVC.
Статистическую обработку полученных данных проводили в программе Statistica 10.0. По результатам визуального и количественного анализа по критерию Шапиро—Уилка на соответствие нормальному распределению некоторые показатели амплитуды потенциалов латеральной крыловидной (через 12 мес наблюдения на относительно здоровой стороне ВНЧС), собственно-жевательной (до лечения на стороне боли ВНЧС) и височной (до лечения на относительно здоровой стороне ВНЧС) мышц получили уровень значимости p
Результаты и обсуждение
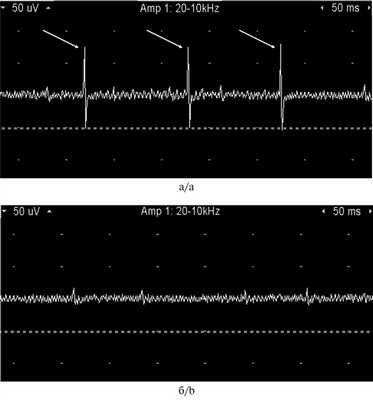
Анализ результатов исследований показал, что при дисфункции ВНЧС регистрируются функциональные нарушения во всех жевательных мышцах, даже в состоянии относительного физиологического покоя. По данным локальной ЭМГ ЛКМ, эти нарушения проявляются спонтанной активностью с отклонениями от изолинии в виде «залпов» максимальной высотой 134 мкВ (рис. 6, a). Рис. 6. «Залпы» спонтанной активности у пациентов (клиническая группа; а) и здоровых лиц (контрольная группа; б) латеральной крыловидной мышцы в состоянии относительного физиологического покоя. У здоровых лиц спонтанная активность ЛКМ не выявлялась, что отражалось изолинией на электромиограмме (рис. 6, б).
При проведении глобальной ЭМГ в покое у пациентов максимальная БЭА СЖМ составила 87 мкВ, ВМ — 72 мкВ. У здоровых лиц этот показатель СЖМ не превышал 27 мкВ, ВМ — 24 мкВ.
При исследовании ЛКМ с функциональной нагрузкой до лечения длительность и амплитуда ПДЕ снижались с разной степенью интенсивности на стороне боли ВНЧС и на здоровой стороне ВНЧС. На стороне боли ВНЧС длительность ПДЕ сократилась на 5,6%, а на противоположной стороне на 35,7%. Средняя амплитуда ПДЕ со стороны боли ВНЧС снижалась в 1,6 раза, а на здоровой стороне ВНЧС — в 2,8 раза. По нашему мнению, субнормальный уровень длительности и амплитуды свидетельствует об уменьшении количества мышечных волокон в двигательной единице и снижении их сократительной способности. Очевидно, это является следствием неравномерной нагрузки на мышцы с доминированием силы на здоровой стороне ВНЧС. Данное явление можно объяснить постоянным напряжением ЛКМ на здоровой стороне ВНЧС из-за рефлекторного сдвига нижней челюсти в сторону боли ВНЧС.
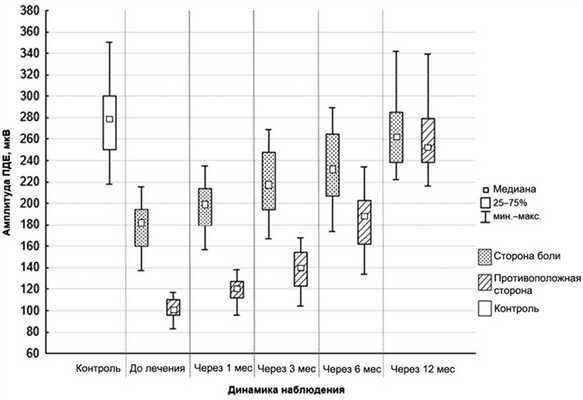
Оценка показателей амплитуды ПДЕ в динамике свидетельствует, что через 1 мес от начала терапии на стороне боли ВНЧС разница между исследуемой величиной и контролем составляла 32,0%. Через 3 мес амплитуда ПДЕ на стороне боли ВНЧС продолжила увеличиваться, и различие с контролем составляло 27,3%. Через 6 мес анализ показал отсутствие достоверных различий с уровнем контроля до 16,3%. К концу 12-месячного наблюдения уровень амплитуды ПДЕ на стороне боли ВНЧС практически достиг уровня контроля. При этом амплитуда ПДЕ на относительно здоровой стороне ВНЧС характеризовалась слабым приростом в динамике. Тенденция к уровню контроля была зафиксирована только к 6-месячному периоду, и разница составляла 39,0%. К концу 12 мес амплитуды ПДЕ на обеих сторонах становились равными и соответствовали таковым у здоровых лиц (рис. 7). Рис. 7. Амплитуда ПДЕ латеральной крыловидной мышцы при функциональной нагрузке.
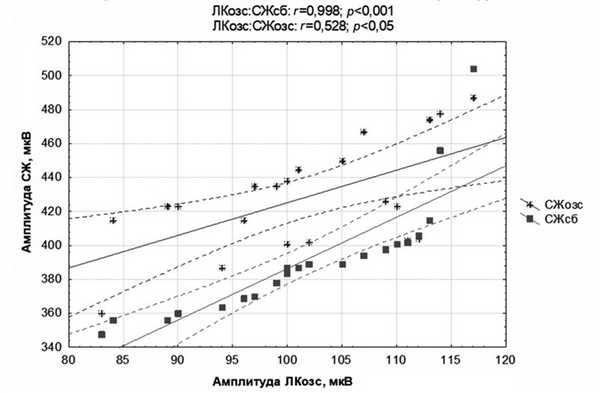
Результаты корреляционного анализа свидетельствуют о положительной зависимости между амплитудой ЛКМ и СЖМ. Причем высокая степень корреляции наблюдается между показателями ЛКМ на относительно здоровой стороне ВНЧС и СЖМ на стороне боли ВНЧС (r=0,998; p<0,001). В то же время между значениями ЛКМ и СЖМ на относительно здоровой стороне ВНЧС умеренная теснота связи (r=0,528; p
Данное наблюдение свидетельствует, очевидно, о том, что перегрузка СЖМ на стороне боли ВНЧС в большей степени способствует повышенной нагрузке ЛКМ на относительно здоровой стороне ВНЧС. Это можно объяснить сдвигом нижней челюсти под воздействием сил СЖМ на стороне боли ВНЧС, который в свою очередь приводит к повышенному напряжению ЛКМ на относительно здоровой стороне ВНЧС.
Выводы
1. При дисфункции височно-нижнечелюстного сустава в состоянии относительного физиологического покоя регистрируется повышенная функциональная активность всех жевательных мышц. Спонтанная активность латеральной крыловидной мышцы проявляется отклонениями от изолинии в виде «залпов» максимальной высотой 134 мкВ. Максимальная биоэлектрическая активность собственно-жевательной и височной мышц составила 87 и 72 мкВ соответственно.
2. У пациентов с дисфункцией височно-нижнечелюстного сустава регистрируется асимметрия значений длительности и амплитуды потенциала двигательных единиц. При функциональной нагрузке длительность и амплитуда потенциала двигательных единиц латеральной крыловидной мышцы снижаются (на 30 и 50% соответственно) на относительно здоровой стороне по сравнению со стороной боли. Биоэлектрическая активность собственно-жевательной мышцы и височной мышцы при максимальном волевом сжатии в привычной окклюзии снижается на 20% на стороне боли по сравнению с относительно здоровой стороной.
3. Высокая степень корреляции обнаружена между показателями латеральной крыловидной мышцы на относительно здоровой стороне височно-нижнечелюстного сустава и собственно-жевательной мышцы на стороне боли височно-нижнечелюстного сустава (r=0,998; p<0,001).
4. Симметричность значений длительности и амплитуды потенциала двигательных единиц латеральных крыловидных мышц и достижение ими уровня контроля регистрируются только после восстановления равномерной биоэлектрической активности собственно-жевательных мышц.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Сведения об авторах
КАК ЦИТИРОВАТЬ:
Оценка двигательной единицы. Патология двигательной единицы мышц
Кафедра нервных болезней, традиционной медицины Красноярского государственного медицинского университета им. проф. В.Ф. Войно-Ясенецкого, Красноярск
ГБОУ ВПО «Красноярский государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого», Красноярск, Россия
Методы оценки двигательных функций верхней конечности
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. 2016;116(7): 101‑107
Цель исследования. Анализ наиболее часто употребляемых шкал для оценки функции верхней конечности, их преимуществ и недостатков, возможности использования в разные периоды перенесенного инсульта. Материал и методы. Приведены анализ результатов отечественных и зарубежных, а также данные собственных исследований, посвященных проблеме оценки нарушений двигательных функций в паретичной руке вследствие перенесенного инсульта. Рассматриваются различные аспекты оценки двигательной активности руки, возможностей повседневного функционирования в условиях центрального пареза.
Цереброваскулярная патология, особенно острые нарушения мозгового кровообращения - одна из сложнейших проблем медицины. В 2009 г. заболеваемость инсультом составила 3,52 случая на 1000 населения и 3,27 - в 2010 г., смертность - 1,19 и 0,96 на 1000 населения соответственно [1]. Двигательные нарушения, наблюдающиеся у 80% перенесших инсульт больных, являются одной из важных причин стойкой утраты трудоспособности, их устранение - одна из целей преемственной нейрореабилитации. Как правило, восстановление функций верхней конечности значительно растянуто во времени и нередко является основной причиной нетрудоспособности [2].
Постинсультный парез верхней конечности представляет собой несколько вариантов паттернов двигательных расстройств. Особенно страдают при центральном парезе мышечные группы, связанные с отведением плеча (средняя порция дельтовидной мышцы, надостная мышца); обеспечивающие разгибание в локтевом суставе (трехглавая мышца плеча), супинацию предплечья (двуглавая мышца плеча, супинатор плеча); разгибатели кисти (длинный лучевой, короткий лучевой и локтевой разгибатель запястья) и II-V пальцев (разгибатели пальцев, II-V пальцев).
Одновременно отмечается нарастание спастичности в других мышечных группах, обеспечивающих приведение плеча (подлопаточная, большая грудная, большая круглая, широчайшая мышцы спины); сгибание в локтевом суставе (двуглавая мышца плеча, плечевая мышца, круглый пронатор, плечелучевая); пронаторы предплечья (круглый и квадратный пронаторы); сгибатели кисти (лучевой и локтевой сгибатели запястья) и II-V пальцев (поверхностный и глубокий сгибатели пальцев, червеобразные мышцы кисти, ладонные межкостные мышцы).
Эти изменения в сочетании с нейродистрофическими, болевыми и чувствительными нарушениями, возможными экстрапирамидными проявлениями дистонии в верхней конечности приводят к формированию патологических синдромов - «замороженное плечо», приведенное, ротированное внутрь плечо (англ.: adducted, internally rotated shoulder), согнутый локоть (англ.: flexed elbow), согнутое запястье (англ.: flexed wrist), пронированное предплечье (англ.: pronated forearm), сжатый кулак (англ.: clenched fist).
Перечисленные расстройства в значительной степени ограничивают возможности пользования паретичной кистью. После повторных неудачных попыток действия паретичной рукой пациент может перестать их предпринимать, при этом формируется синдром приученного неиспользования руки (англ.: learned nonuse), а связанные с верхней конечностью повседневные виды активности выполняются только здоровой рукой [3]. Будучи исключенной из движения, паретичная рука не имеет перспектив двигательного восстановления, поскольку феномен неупотребления приводит к торможению зон мозга, ответственных за работу верхней конечности.
Определение степени выраженности двигательных нарушений, особенно тонких движений, является важной задачей восстановительного лечения, влияющей на составление реабилитационной стратегии. Кроме оценки двигательных возможностей руки, необходим анализ выраженности спастичности, изменений повседневного функционирования, чувствительных расстройств, феномена неиспользования, апраксии. Оценка только физических признаков и симптомов (объем движений и мышечная сила) не дают полной информации о нарушении функции верхней конечности и степени ее использования пациентом [4].
Стандартизованный подход к тестированию необходим для уменьшения расхождения результатов оценки между врачами, а также при проведении повторных исследований. Не существует общего мнения об идеальной шкале, описывающей все аспекты двигательных нарушений верхней конечности и подходящей для регулярной оценки восстановления после перенесенного инсульта.
Цель исследования - анализ наиболее часто употребляемых шкал для оценки функции верхней конечности, их преимуществ и недостатков, возможности применения в разные периоды перенесенного инсульта.
В отечественной неврологической и реабилитационной практике длительное время использовалась Шкала НИИ неврологии АМН СССР, которая является достаточно простым инструментом для определения степени двигательного дефицита [5]. К ее преимуществам относятся интегративный характер оценки, наличие подраздела оценки поверхностной и глубокой чувствительности, мышечного тонуса, мышечной силы. В то же время тестирование двигательной функции ограничивается оценкой мышечной силы по 6-балльной шкале и объема активных движений в суставе в процентах от нормы. При этом отсутствует возможность оценки функционирования верхней конечности, определение степени ее использования, ряд параметров оценивается только качественно (субъективно). Недостатком указанной шкалы является и отсутствие в доступной литературе указаний на уровень ее валидности. К сожалению, эта шкала не получила международного признания.
Существует ряд шкал, позволяющих оценить объем движений различных отделов верхней конечности, подходящих для детального исследования двигательной активности отдельных сегментов - шкала Фагл-Мейера оценки верхней конечности (Fugl-Meyer Assesment Upper Extremity - FMA-UE), двигательный функциональный тест Вольфа (Wolf Motor Function Test - WMFT), шкала оценки движений (Motor Assessment Scale - MAS), тест изучения деятельности руки (Action Research Arm Test - ARAT).
FMA-UE
По мнению большинства экспертов, шкала FMA-UE является хорошо продуманным, объективным и эффективным методом клинического обследования больных с инсультом 8. Она считается одним из наиболее точных инструментов оценки нарушений двигательных функций после инсульта и используется в качестве объективного показателя их ухудшения и последующего восстановления 12. Шкала FMA-UE является наиболее широко используемым инструментом клинической оценки постинсультных двигательных нарушений верхней конечности и может применяться для оценки эффективности реабилитации, объективизации восстановления движений верхних конечностей [7].
Шкала включает разделы, отражающие стадии восстановления движений, начиная с начальной - когда возможны только глобальные движения, например в виде синергического сгибания в плечевом и локтевом суставах одновременно с подъемом и отведением согнутой в локте руки. Выделяются шесть последовательных стадий восстановления движений: переход от одной стадии к другой начинается, когда восстановление движений предыдущего этапа достигает не менее 60% [13]. Начисление в каждом пункте производится от 0 до 2 баллов, где 0 - невозможность выполнить движение. Общие значения могут составлять от 0 (отсутствие произвольных движений) до 66 (полный диапазон активных движений). Возможно начало тестирования из любого пункта субшкалы, который соответствует данному уровню нарушений пациента. В среднем заполнение шкалы занимает около 10 мин, однако у пациентов с речевыми нарушениями это время увеличивается. Шкала FMA-UE может использоваться для установления цели, плана и мониторинга прогресса лечения пациента. Референтные значения составляют от 0 до 20 баллов - тяжелые двигательные нарушения, от 21 до 50 - умеренные и от 51 до 66 - легкие [11].
Недостатком шкалы FMA-UE является эффект «пола и потолка» (относится к ситуации, когда у больного имеется незначительная степень двигательного функционирования, которую не выявляет шкала, или, наоборот, он получает максимальную оценку, но все же испытывает некоторые трудности при выполнении комплексных движений) [14, 18]. Положительными моментами являются отсутствие необходимости специального обучения, достаточные простота и мобильность, эталонность данного теста.
По рекомендациям Американской ассоциации физиотерапевтов шкала FMA-UE может быть использована для объективной оценки движения пациентов в остром и восстановительном периодах инсульта, а также на стадии амбулаторной реабилитации (уровень рекомендации 4 - настоятельно рекомендуется, имеет отличные измерительные свойства и пригодна для клинического применения).
Среди тестов для оценки потенциала верхней конечности после инсульта WMFT считается одним из наиболее простых и надежных инструментов для изучения произвольных движений верхней конечности [12, 15]. Он рекомендован для обследования пациентов с легкими и умеренными двигательными нарушениями [15], широко используется для измерения объема движений верхней конечности [16]. Первоначально тест состоял из 21 пункта, но в дальнейшем для повышения удобства и функциональности был сокращен до 17. Впоследствии предпринимались попытки модернизации до 6 пунктов [15, 17-22]. Хотя модернизированный WMFT оказался несколько менее чувствительным, принципиальной разницы между двумя версиями найдено не было [23]. WMFT тестирует широкий спектр задач возрастающей сложности - от проксимальных к дистальным сегментам конечности [24] и состоит из 3 частей, оценивающих 1) время и скорость выполнения заданий; 2) функциональные возможности и качество движения во время их выполнения; 3) мышечную силу [25]. Задания теста должны выполняться как можно быстрее, время обследования ограничено 120 с 26.
WMFT рекомендуется к использованию в остром, раннем и позднем восстановительном периодах инсульта и на амбулаторном этапе реабилитации с уровнем 3 Американской ассоциации физиотерапевтов (рекомендуется, имеет хорошие оценочные свойства, клиническую полезность). Необходимые аксессуары: картонная коробка около 25 см в высоту (для взрослого человека среднего роста) и коробка 20,3 и 15,2 см (для людей ниже среднего роста); карандаш, цветные скрепки, три стандартные шашки, карты, динамометр, замок с ключом, полотенце, корзина с ручкой, секундомер.
Шкала разработана для оценки двигательных функций у больных, перенесших инсульт [29], широко используется в клинических исследованиях. Из-за некоторых неудобств в 1988 г. она была модифицирована, удален пункт «тонус» из-за низкой надежности. Каждый пункт оценивается по семибалльной шкале от 0 до 6, где за 6 баллов приняты оптимальные двигательные характеристики. Общее время тестирования составляет около 15 мин [30]. Необходимое оборудование: секундомер, две пластиковые чашки, восемь бусинок, колпачок от ручки, резиновый мяч около 14 см в диаметре, расческа, десертная ложка с водой, ручка, лист бумаги для рисования линий и объект цилиндрической формы (например, банка).
К недостаткам шкалы можно отнести необходимость большого количества дополнительного оборудования, которое снижает ее мобильность. Преимуществом является относительно широкое применение, использование не только в повседневной клинической практике, но и в исследовательских целях. Нет данных StrokEDGE о возможности использования в разные периоды инсульта, однако, учитывая высокую корреляцию между общими значениями при тестировании по FMA-UE и MAS (r=0,88) [31], можно предположить, что использование данной шкалы в остром, раннем и позднем восстановительных периодах инсульта возможно на уровне «рекомендовано», как и у шкалы FMA-UE.
Тест предложен в 1981 г. как модификация более раннего метода - Функционального теста верхней конечности (UEFT) для оценки восстановления верхней конечности при центральном параличе [17]. ARAT представляет собой стандартизованную порядковую шкалу, основанную на предположении о том, что сложные движения верхней конечности, используемые в повседневной жизни, можно разложить на четыре составляющие: хватка, сжатие, щипок и менее дифференцированные движения - разгибание и сгибание в локтевом и плечевом суставах. Тест оценивает возможности подъема предметов различного размера на высоту около 37 см, перемещения предмета цилиндрической формы на расстояние 37,5 см при помощи щипкового захвата, поднимание объектов различного размера, которые удерживаются I и III пальцами, и выполнение трех глобальных движений верхней конечности. Каждая конечность оценивается отдельно. Выполнение заданий ARAT оценивается по 4-балльной шкале от 0 до 3 баллов: движение оценивается в 3 балла, если задача выполнена нормально; в 2 балла - выполнена, но чрезмерно долго, с большим трудом или плохо скоординированными движениями; в 1 балл - выполнена частично, и 0 - не выполнена вообще. Суммарное значение в 57 баллов является максимальным для каждой верхней конечности. ARAT имеет высокую надежность и достоверность, время проведения теста составляет от 8 до 10 мин. Главное преимущество теста заключается в возможности оценить широкий спектр функций верхних конечностей после инсульта. Основные ограничения заключаются в отсутствии оценки ловкости (манипуляционные задачи) и необходимости стандартизированного оборудования для завершения оценки [32], стоимость которого около 600 долларов США. Полный комплект ARAT состоит из специального столика, четырех деревянных блоков, мяча для крикета, длинных и коротких трубочек из нержавеющей стали, длинных и коротких штырей с резьбовым стержнем, резьбовых стержней для труб, шайбы, двух бокалов, шарикоподшипников 6 мм в диаметре, мраморного бруска 1,5 см диаметром, секундомера. Тест рекомендован для применения в остром, раннем и позднем восстановительных периодах инсульта и на стадии амбулаторной реабилитации, при уровне рекомендаций 3 («рекомендуется»). Таким образом, ARAT является гибким и действительным показателем функциональных ограничений верхних конечностей для использования в практической реабилитации и научных исследованиях [21].
Все перечисленные шкалы оценки имеют высокую валидность, широко используются в научных исследованиях. Они позволяют точно оценить степень функциональных нарушений руки, имеют разделы, посвященные чувствительным расстройствам и изменениям тонуса (MAS), и, по нашему мнению, должны быть введены в практику реабилитационных отделений. В настоящее время в России указанные шкалы оценки двигательных нарушений используются редко, в том числе вследствие недостаточной информированности врачей, а также в связи с отсутствием русcифицированных вариантов.
Существуют также шкалы измерения двигательных нарушений, имеющие узконаправленный характер оцениваемых параметров: тест «девять колышков и девять отверстий» (Nine Hole Peg Test - NНPT) и тест коробки и блоков (Box и Block Test - BBT) - для измерения уровня расстройств мелкой моторики у пациентов с легким парезом руки. Этот вид оценки подразумевает измерение одного или нескольких параметров движения, например скорости, ловкости и точности.
Тест недорогой, очень практичный и полезный для определения состояния тонкой моторики. Может использоваться во всех случаях, когда есть нарушение тонких движений, в том числе при расстройствах координации, слабости пальцев, расстройствах чувствительности, апраксии кисти. Необходимое оборудование для проведения теста: секундомер, квадратная доска с девятью лунками (10 мм в диаметре, 15 мм в глубину), расположенными на расстоянии 15 мм друг от друга в три ряда по три отверстия и девять колышков (9 мм в диаметре и 32 мм длиной). Преимуществами теста являются его простота, мобильность, небольшая стоимость, быстрота проведения. Тест считается достаточно надежным, его валидность была доказана в ряде исследований, существуют референтные значения для различных возрастных и гендерных групп. К условным недостаткам можно отнести необходимость использования специального оборудования и «эффект пола» - больные с грубым нарушением функции кисти тест выполнить не могут.
NHPT проводится следующим образом: пациент сидит за столом, его просят поставить колышки в отверстия по одному и в любом порядке, а затем также по одному вынуть обратно. Время отсчитывается с момента, когда тестируемый касается первого колышка до того, когда последний колышек будет положен обратно в контейнер. При другом варианте оценки тест может быть остановлен через 50 с с подсчетом количества вставленных колышков. NHPT имел умеренную степень чувствительности в отражении изменений функции верхней конечности в течение первых 6 мес после инсульта [17]. Отмечено, что полученные при выполнении теста результаты имеют незначительную корреляцию с состоянием повседневного функционирования.
По данным StrokEDGE, NHPT не рекомендован к применению в остром периоде инсульта (уровень рекомендации 1 - не рекомендуется, имеет плохие оценочные свойства и низкую клиническую полезность), но может применяться в раннем и позднем восстановительном периодах (уровень рекомендации 3).
Тест позволяет оценить глобальную моторику рук путем подсчета числа блоков, которые можно транспортировать отдельно из одного отсека коробки в другой в течение 1 мин, и учета количества перемещенных блоков. Более высокие значения свидетельствуют о лучшей ловкости рук. Надежность, обоснованность и оперативность выполнения BBT подтверждены у пациентов с инсультом, в том числе при повторном тестировании 33. BBT продемонстрировал сильную связь выявленных двигательных нарушений с уровнем повседневного функционирования. Доказана возможность использования данного метода оценки движений в остром, раннем и позднем восстановительном периодах инсульта и на амбулаторном этапе реабилитации (StrokEDGE) [36].
Шкалы оценки скорости и ловкости движений целесообразно использовать у пациентов с легким дефектом верхней конечности (когда другие методы оценки - FMA, MAS - являются недостаточно чувствительными) или имеющих не столько двигательный, сколько координаторный, диспраксический или сенсорный дефект, приводящий к нарушению моторики кисти.
Электронейромиография
По всем вопросам, связанным с проведением электрофизиологического исследования вы можете задать врачу перед проведением исследования. Ниже приведен обзор электрофизиологических методов.
Электрофизиологическое исследование (электронейромиография) прежде всего необходимо для определения уровня поражения периферического нерйромоторного аппарата - вовлечение периферического нерва, мотонейронов спинного мозга, нервно-мышечного синапса или патологии мышечного волокна. Применительно к полинейропатии метод позволяет дифференцировать вовлечение миелиновой оболочки - демиелинизирующая нейропатия или аксона - аксональная нейропатия, а также подтверждения генерализованного или мультифокального вовлечения периферических нервов в патологический процесс. Группа методик позволяет дифференцировать вовлечение в патологический процесс моторного корешка.
Метод связан с неприятными субъективными ощущениями при стимуляции электрическим током, однако в большинстве своем переносится испытуемым хорошо, имеет абсолютное противопоказание - наличие гнойно-воспалительных изменений в месте стимуляции и наложения электродов, не противопоказан при сопутствующей сердечно-сосудистой патологии, установленном кардиостимуляторе.
Комплекс электрофизиологических методик включает стимуляционные методики (исследование скорости распространения возбуждения (СРВ) по моторному и сенсорному волокну, исследование F-волны (тестирование СРВ на наиболее проксимальном участке нерва), выявление блока проведения (БП) возбуждения, в редких случаях оценка Н-рефлекса), а также методика игольчатой миографии - оценка параметров потенциалов двигательных единиц, спонтанной и инсерционной активности мышечного волокна. Для оценки состояния нервно-мышечного синапса применяется стандартный декремент-тест и джиттер. Методика игольчатой миографии связана с введением в мышцу концентрического игольчатого электрода, сопровождается неприятными ощущениями в связи с введением иглы в мышцу, при этом стимуляции электрическим током не происходит. Риск осложнений при такой процедуре сопоставим с риском стандартной венепункции.
Стимуляционная ЭМГ. При проведении стимуляционной ЭМГ моторных волокон отводящие электроды располагаются над соответствующей мышцей (принцип "belly-tendon"). Проводится стимуляцию соответствующего нерва на разных уровнях, суммарную электрическую активность исследуемой мышцы фиксируется и отображается электромиографом на вольтажно-временной шкале в виде М-волны. Расстояние между двумя точками стимуляции и разница латентности М-волн, позволяет определить скорость распространения возбуждения (СРВ) между двумя точками стимуляции. Интервал от момента стимула до времени появления первого моторного ответа носит название терминальная (дистальная) латентность. Этот параметр не равнозначен СРВ на дистальном участке нерва, так как не учитывает время синаптической задержки. Вызванный моторный ответ начинается с фазы нарастания, реполяризации и гиперполяризации (рисунок 1), отражающие асинхронное возбуждение мышечных волокон при супрамаксимальной стимуляции нерва разной степени удаления от регистрирующих накожных электродов.
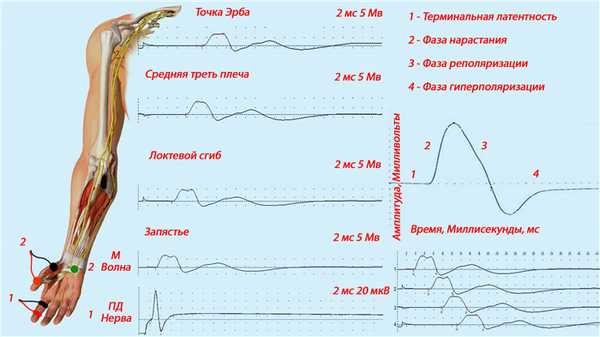
Рисунок 1. Иллюстрация вызванного моторного и сенсорного ответа при стимуляции срединного нерва в разных точках. Форма кривой моторного и сенсорного ответа при стимуляции срединного нерва в разных точках руки.
При стимуляции периферического нерва помимо ортодромного распространения возбуждения присутствует также антидромное к нейронам переднего рога через вставочные нейроны. Активация мотонейронов приводит к появление позднего ответа (F-волна). Этот ответ позволяет получить ориентировочную информацию о СРВ на проксимальных участках нервов, недоступных для прямой стимуляции (рисунок 2). Электрофизиологическим эквивалентом сухожильного рефлекса на растяжение является H-рефлекс, который возможно зарегистрировать при повторной стимуляции общего большеберцового нерва с интервалом в 20 секунд и регистрации позднего ответа с камбаловидной мышцы.
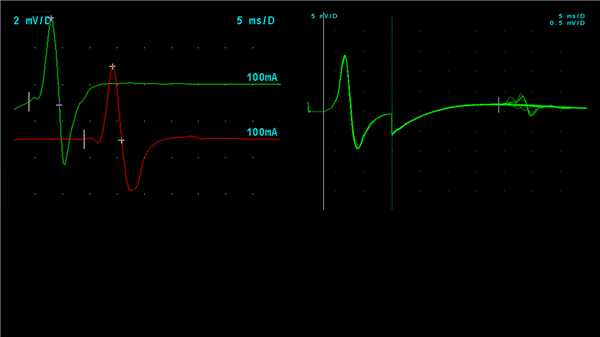
Рисунок 2. Стимуляционная ЭМГ большеберцового нерва + F-волна. А. Вызванный моторный ответ при стимуляции большеберцового нерва с уровня лодыжки и подколенной ямки. Отведение от m. Abductor Hullucis. B. F-волна при стимуляции большеберцового нерва (суперпозиция)
Игольчатая ЭМГ. Для оценки состояния электрической активности мышцы проводится введение концентрического игольчатого электрода непосредственно в мышцу. Поскольку электрод тестирует лишь небольшую зону мышцы, то для увеличения объективности оценки электрод перемещают в несколько её точек (рисунок 3). Методика имеет одно абсолютное противопоказание - наличие гнойно-воспалительных изменений в месте исследования. С осторожностью (под контролем МНО) проводят у пациентов на фоне антикоагулянтной терапии, по возможности, исключая из исследования параспинальные мышцы. Риск осложнений методики при остальных состояниях, включая применение кардиостимулятора, сопоставим со стандартной пункцией вены.
Методика игольчатой миографии включает в себя три этапа. На первом этапе проводится оценка спонтанной и инсерционной (insertional) активности мышечных волокон при полном расслаблении мышцы.
Рисунок 3(B). Схематическое представление расположение концентрического игольчатого электрода по отношению к мышечному волокну.
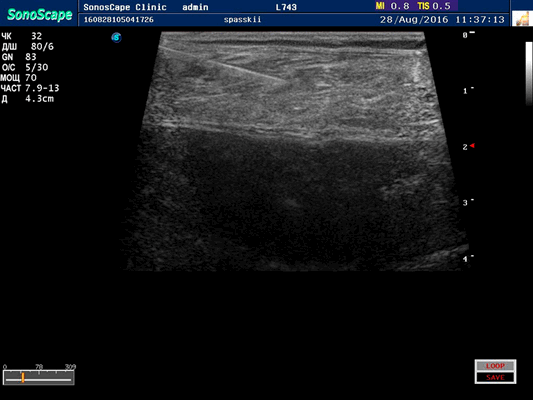
Игольчатый электрод в мышце при УЗ-исследовании.
1. Пучки мышечных волокон
2. Терминали аксона
3. Игольчатый электрод
6. Область регистрации концентрического электрода
Инсерционная активность («потенциал вкола иглы») возникает в течение 0,5-1 мс в виде короткого электрического всплеска при механическом раздражении мышечных волокон игольчатым электродом. Может быть увеличена, уменьшена или включать волновые феномены - потенциал концевой пластинки (шум концевой пластинки) - электрический потенциал мембраны мышечных волокон вследствие ирритации возбуждения от терминалей аксона при их механическом раздражении от игольчатого электрода и разряды высокой частоты. В эксперименте на крысах показано усиление амплитуды шума концевой пластины в сочетании с регистрацией потенциалов фибрилляций и положительных острых волн в миофасциальной тригерной точке мышцы. Эти находки послужили основанием рассматривать дисфункцию концевой пластинки как основную причину формирования миофасциальной тригерной точки.
В нормальных условиях вне зоны концевой пластинки в спокойном состоянии мышца не имеет электрической активности. Следовательно, любая активность расслабленной мышцы будет рассматриваться как патологическая. По электрофизиологическим характеристикам выделяют несколько видов спонтанной активности - потенциалы фибрилляций (ПФ), положительные острые волны (ПОВ), потенциалы фасцикуляций (ПФц), комплексные разряды высокой частоты (КРВС), миотонические разряды, нейромиотонические разряды, миокимии и крампи. Все данные феномены являются не специфичными и могут развиваться как при нейрогенных, так и при мышечных процессах.
Потенциал фибрилляций (ПФ) имеют двухфазную или трехфазную форму с начальным положительным или отрицательным отклонением, продолжительностью от 1 до 5 мс. Возникают в мышечных волокнах, которые утратили свою иннервацию при нейрогенных состояниях или вследствие их расщепления и удаления от зоны замыкательной пластинки при мышечной патологии.
Положительная острая волна (ПОВ) имеют двухфазную форму с начальной острой положительной фазой, за которой следует продолжительная отрицательная фаза, длительностью от 10 до 30 мс. Причины развития аналогичные ПФ.
Спонтанная деполяризация мембраны мышечного волокна с последующим распространением возбуждения на соседние мышечные волокна приводит к развитию комплексного разряда высокой частоты (КРВЧ). Впоследствии переменное количество соседних мышечных волокон может быть последовательно деполяризовано, пока «цепь» не завершится, в результате первоначальное мышечное волокно снова разряжается. Каждый спайк в этом разряде принадлежит отдельному мышечному волокну, которые, в свою очередь, могут являться частями разных двигательных единиц, но располагаться близко друг к другу. Данный электрофизиологический феномен имеет регулярную картину с резким началом и прекращением и частоту от 3 до 40 Гц с характерным звуковым эффектом (звук мотора катера).
Миотонические разряды - это потенциал действия мембраны отдельных мышечных волокон, с экспоненциальным изменением частоты (от 40 - 100 Гц) и амплитуды с характерным звуковым феноменом (звук «пикирующего бомбардировщика»). Несмотря на то, что медленные миотонические феномены имеют сходство с ПФ, отличительной особенностью является быстрая скорость изменения частоты и амплитуды. Эти феномены характерны для миотонической дистрофии, миотонии и парамиотоний, также могут быть при других мышечных заболеваниях без миотоний (гиперкалийемический паралич, полимиозит и др), редко при аксональных нейропатиях, но при этом никогда не являются преобладающей формой спонтанной активности.
Потенциалы фасцикуляций (ПФц) - это спонтанные разряды одиночных двигательных единиц, которые генерируются в любом месте нижнего мотонейрона. Электрофизиологические характеристики идентичны регистрации потенциала одиночной двигательной единицы с нерегулярной частотой регистрации. Обычно возникают при нейрогенных заболеваниях (болезни мотонейрона, аксональные нейропатии).
Миокимические разряды - группа спонтанно возникающей повторяющейся очереди ПДЕ с частотой от 40 - 60 Гц с последующим кратковременным периодом электрического молчания (0,1-10 сек) с повторением той же последовательности. Имеют регулярный полу ритмичный рисунок и звук (напоминающий «марширующих солдат). Чаще всего встречаются при лучевом повреждении нерва, хронических компрессионных нейропатиях.
Нейромиотонические разряды - это всплески ПДЕ, возникающие в моторных аксонах, запускаемых на высоких частотах (от 100 до 300 Гц). Они повторяются либо непрерывно или в виде повторяющихся импульсов убывающей амплитуды. На него не влияет произвольная активность. Обычно возникает при дефекте потенциал зависимых калиевых каналов, наблюдаются обычно при заболеваниях повышенной возбудимости нервов (синдром Исакса, синдром Морвана).
Крампи-потенциалы - непроизвольные повторяющиеся рекрутирование ПДЕ с высокой частотой на большой площади мышцы. Обычно быстро нарастает с добавлением новых потенциалов с внезапным быстрым прекращением. Могут наблюдаться у здоровых людей при чрезмерной активации мышцы, а также при любом хроническом нейрогенном расстройстве, электролитных нарушениях, повышенной возбудимости периферических нервов.
Произвольная мышечная активность опосредована функцией нижнего мотонейрона и иннервируемых ими мышечных волокон. Данный комплекс составляет понятие потенциала двигательной единицы (ПДЕ). При произвольном движении мышцы ПДЕ регистрируются полуритмическим паттерном с частотой, зависимой от произвольной активации мышцы. Концентрический игольчатый электрод может зарегистрировать только ПДЕ, расположенные вблизи к его регистрирующей поверхности (в основном в пределах 0,5 мм). Рекрутирование ПДЕ - это инициирование возбуждения дополнительных двигательных единиц по мере увеличения частоты условной первой (активной) ПДЕ. Суммарный электрический потенциал всех доступных двигательных единиц, регистрируемых концентрическим электродом в единицу времени в исследуемой точке мышцы и отображаемой на вольтажно-временной шкале носит название интерференционной кривой.
Способ выделения и анализа произвольно набранных повторяющихся ПДЕ с оценкой их амплитуды, длительности и числа фаз носит название количественной ЭМГ. Из-за большого числа и разнообразия параметров ПДЕ этот метод требует многократных измерений и статистическое описание результатов, полученных из разных участков мышц. С развитием цифровых технологий стало возможным компьютерное алгоритмическое сопоставление шаблонов, называемое разложением количественной ЭМГ (QEMG), что значительно повысило достоверность и воспроизводимость параметров электрической активности мышц. Каждая ПДЕ характеризуется временем нарастания фронта (время быстрого положительного или отрицательного отклонения изолинии), длительностью (время от первого отклонения от изолинии до окончательного возврата к ней) амплитудой (максимальная амплитуда размаха основного потенциала), числом фаз (число раз, когда потенциал пересекает изолинию плюс один) и стабильностью (любое изменение конфигурации ПДЕ при отсутствия движения электрода).
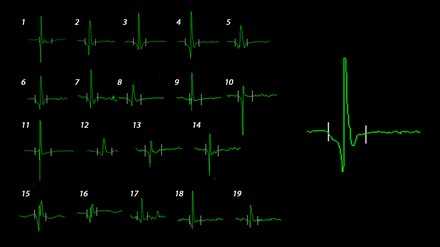
Рисунок 4. Рисунок Анализируемые параметры ПДЕ, вариабельность ПДЕ в мышце здорового человека. Произвольно набранные 19 ПДЕ из разных точек передней большеберцовой мышце здорового человека, анализируемые параметры - амплитуда, длительность и фаза (справа).
При нервно-мышечной патологии параметры ПДЕ изменяются, что в сочетании с регистрацией спонтанной активности, позволяет исследователю определить уровень поражения. Утрата мышечных волокон при большом спектре мышечной патологии приведет к уменьшению длительности ПДЕ, увеличение числа фаз, а также, в отдельных случаях, уменьшению амплитуды. В то же время компенсаторная гипертрофия мышечного волокна может приводить к отдельным высокоамплитудным потенциалам. Спонтанная активность в этих случаях возникают на поврежденной или нестабильной мембране мышечного волокна при его расщеплении или распаде. Утрата значительного числа аксонов приводит к уменьшению числа активных двигательных единиц, уменьшению частоты интерференционной кривой, с последующей компенсаторной реиннервацией мышечных волокон, лишенных нервного контроля за счет коллатерального спраутинга. Это приводит к увеличению амплитуды и длительности, впоследствии к полифазии и утрате стабильности двигательных единиц. Мышечное волокно, утратившее связь с аксоном, генерирует электрический сигнал на поверхности мембраны, регистрируемый как спонтанная активность. При этом электрофизиологические характеристики спонтанной активности при первично-мышечном и денервационном процессах не различаются между собой. Вопросы механизма изменения параметров ПДЕ при разных типах поражения выходят за рамки данной монографии и подробно изложены в трудах Buchthal F и Stålberg E.
Таким образом, нейрофизиологические методы оценки являются необходимыми в оценке пациентов с разными уровнями поражения периферического нейро-моторного аппарата. Метод требует от исследователя контроля различных технических факторов, владения навыками сбора данных и понимания изменений сигналов, которые могут быть обусловлены широким спектром причин. В нашем центре проводится весь спектр электрофизиологических методик на высоком уровне, мы готовы предложить индивидуальный подход к Вашей проблеме и обеспечить соблюдение всех общепринятых стандартов.
Двигательные единицы (ДЕ)
Дано понятие двигательной единицы (ДЕ) и описана ее структура. Приведена классификация ДЕ и соответствие ДЕ и типов мышечных волокон. Описан принцип размера и правило Хеннемана. Приведены данные об активации ДЕ при выполнении силовых упражнений в зависимости от величины отягощения.
Определение
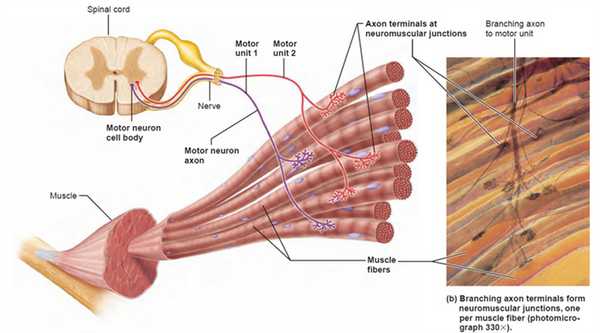
Термин «двигательная единица» был предложен Е. Г. Лидделом и Ч.С. Шеррингтоном для обозначения группы мышечных волокон, иннервируемых терминалями (веточками) одного аксона.
В настоящее время под двигательной единицей (ДЕ) понимается элементарная функциональная единица мышцы, включающая в себя мотонейрон и иннервируемые им мышечные волокна.
Структура ДЕ
Войдя в мышцу, аксон мотонейрона разветвляется на множество веточек, каждая из которых иннервирует отдельное мышечное волокно. Таким образом, один мотонейрон иннервирует достаточно большое количество мышечных волокон (от нескольких единиц до нескольких тысяч), в то время как каждое мышечное волокно иннервируется только одним двигательным нейроном.
Установлено, что мышечные волокна, принадлежащие к одной ДЕ, рассредоточены по всей мышце, то есть принадлежат к разным мышечным пучкам. Такое рассредоточенное (дисперсное) распределение мышечных волокон каждой ДЕ обеспечивает равномерное сокращение мышцы, когда в работу «включается» лишь некоторая часть ДЕ. Следует отметить, что в одну ДЕ составляют мышечные волокна, обладающие одинаковыми свойствами. Посредством активации различных ДЕ центральная нервная система управляет активностью всей мышцы.
Размер ДЕ (иннервационное отношение, коэффициент иннервации)
Размер ДЕ — это количество мышечных волокон, которые иннервируются одним мотонейроном. Чтобы определить этот показатель определяют количество мышечных волокон в скелетной мышце и количество мотонейронов, которые инннервируют эти мышечные волокна (табл.1). Иногда в литературе размер ДЕ называют иннервационным отношением или коэффициентом иннервации.
Всякий раз, когда активируется мотонейрон, он посылает потенциалы действия ко всем мышечным волокнам, которые он иннервирует. Поэтому, чем ниже коэффициент иннервации, тем совершеннее контроль со стороны нервной системы за мышечными волокнами. По коэффициенту иннервации (размеру ДЕ) можно судить о количестве веточек, необходимых аксону мотонейрона, чтобы иннервировать все входящие в ДЕ мышечные волокна.
Табл. 1 — Количество мышечных волокон, количество ДЕ (мотонейронов) и размер ДЕ в различных скелетных мышцах человека
| Мышца | Количество мышечных волокон | Количество ДЕ | Размер ДЕ |
| Передняя большеберцовая | 250090 | 445 | 562 |
| Медиальная головка икроножной мышцы | 1120365 | 1934 | 579 |
| Наружная прямая мышца глаза | 26730 | 2970 | 9 |
| Плечелучевая | 136530 | 333 | 410 |
С возрастом количество ДЕ, приходящихся на одну мышцу уменьшается. Это связано с тем, что уменьшается количество мотонейронов, которые иннервируют отдельную мышцу. Вследствие этого количество мышечных волокон по мере старения организма человека также уменьшается.
Классификации ДЕ
Существуют различные классификации ДЕ. Исходя из значимости для организма, Р. Берк с соавт. (R.E. Burke, 1973) предложил разделять ДЕ по сочетанию двух признаков - скорости сокращения и устойчивости к утомлению. По этой классификации ДЕ делятся на три типа: S (slow) - медленные, устойчивые к утомлению; FR (fast resistant) - быстрые, устойчивые к утомлению, FF (fast fatigable) - быстрые, быстроутомляемые. Этим ДЕ соответствуют различные типы мышечных волокон (табл. 1).
Таблица 1 — Соответствие типов ДЕ и мышечных волокон
| Тип ДЕ | S | FR | FF |
| Тип мышечного волокна | I тип | IIA тип | IIB тип |
Строение и функции мотонейрона соответствуют морфологическим характеристикам мышечных волокон, которые он иннервирует. Так, мотонейрон ДЕ S типа имеет небольшое клеточное тело и иннервирует от 10 до 180 мышечных волокон, а мотонейрон ДЕ FF типа имеет большое клеточное тело и иннервирует от 300 до 800 мышечных волокон (Дж.Х. Уилмор, Д.Л. Костилл, 1997) (рис.1).
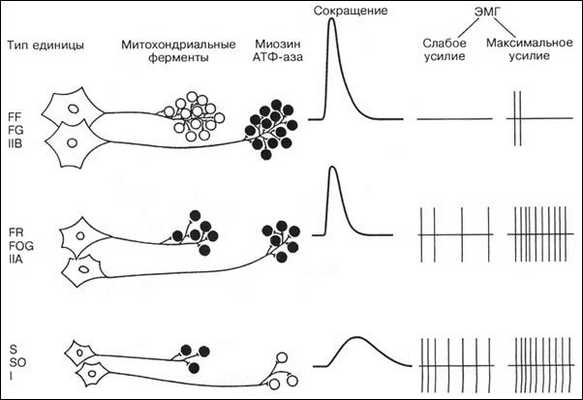
Рис. 1. Гистохимические и физиологические свойства трех основных типов ДЕ и мышечных волокон (R.E. Burke, 1973)
В табл. 2 представлено количество мышечных волокон и количество ДЕ в различных мышцах человека
Принцип размера или правило Хеннемана
ДЕ S типа имеют низкий порог активации, поэтому при развитии силы мышцы они включаются в работу первыми. После этого активируются ДЕ FR типа. ДЕ FF типа обладают высоким порогом активации, поэтому при развитии усилия в мышце они активируются последними.
Благодаря тому, что мышечные волокна, принадлежащие различным ДЕ, рассредоточены по всей мышце, а не находятся в одном пучке, развитие силы мышцы характеризуется плавностью. Однако из-за того, что между соседними мышечными волокнами существуют соединительнотканные связи, при сокращении одних мышечных волокон, например, входящих в состав ДЕ S типа, и расслабленном состоянии других (например, входящих в состав ДЕ FF типа) должны возникать силы трения, обусловливающие высокую вязкость мышцы. Г.В. Васюков (1967) показал, что при небольших напряжениях мышцы (30% от максимума) ее вязкость максимальна. При дальнейшем напряжении мышцы, когда одновременно возбуждено много мышечных волокон, вязкость мышцы скачкообразно уменьшается.
Активация ДЕ в зависимости от различной величины внешней нагрузки
В настоящее время установлено, что в зависимости от величины внешнего отягощения активируются разные ДЕ. Эти данные представлены в табл. 3
Читайте также:
- Коронарный синдром без подъема интервала ST. Стенокардия покоя. Стенокардия напряжения.
- Трехмерная эхокардиография и тканевое допплеровское исследование при дилатационной кардиомиопатии (ДКМП)
- Доброкачественные опухоли костей и костные кисты
- Депрессия и продолжительность жизни
- Герпетиформный дерматит у ребенка
