Пангипопитуитаризм - причины, симптомы, диагностика и лечение
Добавил пользователь Alex Обновлено: 09.01.2026
Пангипопитуитаризм — недостаточность аденогипофиза, которая сопровождается уменьшением концентрации гипофизарных циркулирующих гормонов, что приводит к формированию гипокортицизма, гипогонадизма и гипотиреоза различной степени, с риском развития комы. В патогенезе пангипопитуитаризма (гипоталамо-гипофизарная недостаточность) лежит разрушение передней доли гипофиза (аденогипофиз), заключающееся в сниженной производительности тропных гормонов, что приводит к деструкции периферических эндокринных желез (щитовидная, паращитовидная, надпочечники).
Регулируют деятельность вышеперечисленных желез гормоны, вырабатываемые гипофизом:
- АКТГ — адренокортикотропный гормон;
- СТГ — соматотропный гормон, гормон роста;
- ТТГ — тиреотропный гормон;
- ФСГ/ЛГ — гонадотропный гормон;
- Пролактин.
Причины пангипопитуитаризма
Нарушение гормональной секреции при пангипопитуитаризме может быть спровоцировано деструктивными процессами передней доли гипофиза и гипоталамуса. В анамнезе патология имеет врожденный или приобретенный характер.
Провоцировать развитие болезни могут:
- дефекты кровотока в гипоталамо-гипофизарной области. Аномальная циркуляция крови возникает при инфаркте ткани гипофиза, ишемическом некрозе, сосудистом тромбозе, апоплексии гипофиза, расширении внутренней сонной артерии или повреждении ее стенок. Чаще всего нарушение кровообращения (синдром Симмондса-Шиена) наблюдается у женщин в послеродовой период, осложненный сепсисом, обильной кровопотерей, тромбоэмболией;
- массивные кровопотери различного генеза (желудочно-кишечные, носовые и т.п.);
- окологипофизарные новообразования (менингиома, краниофарингиома, метастазы злокачественных опухолей и др.);
- опухоли гипофиза, провоцирующие деструкцию секреции тропных гормонов;
- хирургическая операция в гипоталамо-гипофизарной области;
- облучение гипофиза;
- воспалительный или опухолевый инфильтрат, возникающий при гистиоцитозе, лимфоцитарном гипофизите, саркоидозе, гемохроматозе;
- синдром «пустого» турецкого седла;
- тяжелая черепно-мозговая травма.
Врожденный или наследственный пангипопитуитаризм наблюдается при:
- наследственно-недостаточном уровне соматотропного гормона или других тропных гормонов, который вызван мутацией генов Pit-1 и Ргор;
- голопрозэнцефалии, септооптической дисплазии, аплазии, гипоплазии или при подобной патологии развития гипоталамо-гипофизарной системы;
- идиопатическом дефиците тропных гормонов гипофиза.
В редких случаях спровоцировать гипоталамо-гипофизарную недостаточность могут некоторые инфекционные болезни: грипп, сифилис, туберкулез, малярия, энцефалит, а также токсикоз на поздних сроках беременности. Осложнения в виде пангипопитуитаризма могут вызвать гемохроматоз, саркоидоз и болезнь Хенда—Шюллера—Крисчена.
Симптомы пангипопитуитаризма
Клинические признаки напрямую связаны с первопричиной заболевания, вызвавшего дефицит или полное отсутствие соответствующих гормонов гипофиза. Кроме симптомов полиэндокринной недостаточности, клиническая картина характеризуется нейровегетативными нарушениями. Проявления обычно имеют латентную форму и могут быть не замечены пациентом. Иногда болезнь характеризуется яркими симптомами, выраженными в острой форме.
Симптомы дефицита гипофизарных гормонов:
- При дефиците гормона роста (СТГ) у пациентов наблюдается состояние хронической усталости, неприятие физических нагрузок, депрессивные расстройства, ожирение, атеросклероз. Недостаточность СТГ у детей обуславливает задержку роста и полового развития, умственное отставание. Крайняя степень дефицита СТГ — гипофизарный нанизм (карликовость), определяющаяся малым ростом, слабым развитием половой системы, аномальным зрением, гипотонией;
- Полный или парциальный дефицит гонадотропинов (ЛГ/ФСГ) у женщин сопровождается ановуляцией (нарушение овуляционного цикла), аменорей (отсутствие менструации длительный период) и диспареунией (болезненный половой акт). У мужчин наблюдаются импотенция, дисфункция яичек, атрофия семенных пузырьков и предстательной железы, малоподвижность сперматозоидов (олигоазооспермия). Дефицит гонадотропинов, независимо от половой принадлежности, со временем приводит к исчезновению вторичных половых признаков, снижению либидо, бесплодию, развитию остеопороза. Гипогонадизм зачастую диагностируется уже тогда, когда пациент уже обширный комплекс симптомов;
- Признаки недостаточности адренокортикотропного гормона (АКТГ) аналогичны симптомам первичного гипокортицизма: астения, депрессии, артериальная гипотенция, похудение, субфебрильная температура, гипоклемия. Клиническая картина может усугубляться вторичным гипокортицизмом, тяжелыми расстройствами органов пищеварения, гипотонией, гипогликемией, снижением сопротивляемости организма к случайным инфекционным заболеваниям и невралгическими нарушениями. Острая недостаточность адренокортикотропного гормона может послужить источником сосудистого коллапса;
- Дефицит секреции тиреотропных гормонов (ТТГ) проявляется снижением артериального давления, брадикардией, вялостью, атонией (снижение тонуса мышц) кишечника. Также могут наблюдаться сухость кожи, судороги икроножных мышц и непереносимость холода. В общем клиническая картина дефицита ТТГ аналогична первичному гипотериозу;
- Полная или парциальная недостаточность пролактина характеризуется агалкией, то есть отсутствием у женщины секреции молока после родов.
Пангипопитуитаризм при синдроме Шиена, как правило, имеет вялое течение. В процессе болезни наблюдается истощение всего организма, происходит равномерное атрофирование мышц и уменьшение в объеме внутренних органов. Обращает на себя внимание желтизна, сухость, истончение и шелушение кожного покрова. Болезнь Симмондса отличается резкой потерей веса, происходит атрофия подкожной клетчатки и мышц, снижение температуры тела и артериального давления.
Для заболевания Шиена-Симмондса характерен так называемый синдром «7А»:
- адинамия — упадок сил, вплоть до полной потери двигательной активности;
- аменорея — отсутствие менструаций;
- апатия — полное равнодушие ко всему окружающему;
- агалактия — отсутствие у роженицы молока в грудных железах;
- депигментация ареол — потеря пигмента в сосковой области;
- потеря аксиллярного оволосения — уменьшение роста волос в подмышечной и лобковой зоннах;
- «алебастровая» бледность и гипотрофия кожи — неестественная бледность, дряблость, сухость.
Для всех форм пангипопитуитаризма на поздних стадиях заболевания характерны потеря физической активности вплоть до полной обездвиженности, общая слабость, гипотермия. При тяжелой стадии болезни могут возникать ортостатический коллапс, коматозное состояние, которые без неотложной терапии приводит к гибели больного. Физиологические патологии сопровождаются нарушением психического здоровья, проявляются в общей эмоциональной угнетенности, глубокой депрессии, инволюционном старческом психозе.
Диагностика пангипопитуитаризма
В большинстве случаев распознавание болезни не вызывает затруднений, так как имеет достаточно характерную симптоматику. Специалисты важное значение придают исходным данным анамнеза: облучение или перенесенные операции гипофиза, черепно-мозговые травмы, массивные кровотечения во время родов или потеря крови другого характера, инфекционные заболевания, наследственные факторы. В обязательном порядке назначаются лабораторные и инструментальные анализы. Первые направлены на определение секреции гормонов железами-мишенями, вторые — на структурные изменения в организме.
У больных пангипопитуитаризмом биохимический анализ крови может обнаружить гипохромную или монохромную анемию, иногда снижение лейкоцитов (лейкопения) на фоне завышенного уровня лимфоцитов и эозинофилов. Концентрация холестерина в крови увеличена, а количество сахара — понижено.
Важную роль имеют анализы крови и мочи, определяющие степень плотности гормонов, вырабатываемых передней долей гипофиза (пролактин, АКТГ, ФСГ и т. д.) и периферическими эндокринными железами (эстрадиол, тестостерон и другие).
Для определения резерва аденогипофизных гормонов проводят стимуляционное тестирование с введением пептидных гормонов гипоталамуса, дозированным приемом метирапона, также проводят гипоклемическую инсулиновую пробу.
Для диагностики пангипопитуитаризма используют ряд инструментальных методов:
- МРТ, КТ, ПЭТ головного мозга — выявление структурных патологий в гипоталамо-гипофизной области;
- Церебральная ангиография — диагностика аневризма и сосудистых аномалий;
- Рентгенография трубчатых костей, позвоночника — определение остеопороза.
Дифференцировать гипоталамо-гипофизарную недостаточность с другими заболеваниями порой весьма затруднительно. Целый ряд болезней имеет аналогичную симптоматику. Так, туберкулез, злокачественные опухоли, энтероколиты, тропическая диарея, дистрофическая миотония, психогенная анорексия приводят к потере веса. Однако похудение при этих заболеваниях развивается со временем и является сопутствующим, а не доминирующим фактором, как при пангипопитуитаризме.
Лечение пангипопитуитаризма
Прогноз и профилактика пангипопитуитаризма
Сценарий течения и излечения болезни определяется этиологией заболевания и терапевтическими или хирургическими мероприятиями, проводимыми в период болезни.
Пациент, страдающий пангипопитуитаризмом, должен проходить обязательное обследование на предмет оценки гормонального фона. С началом лечения анализы проводятся через три, шесть и двенадцать месяцев. Затем больной находится под постоянным наблюдением, ежегодно проходя освидетельствование.
В случаях ухудшения зрения, специалист предписывает МРТ, КТ гипофиза и турецкого седла. Контроль этих зон осуществляется на протяжении десяти лет, с повтором каждые два года.
Профилактические меры пангипопитуитаризма включают в себя срочное устранение массивных кровотечений, недопущение черепно-мозговых травм, предупреждение инфекционных заболеваний, травмирующих гипофиз.
Гипопитуитаризм
Гипопитуитаризм — это патологическое состояние, которое обусловлено снижением выработки нескольких или всех гормонов гипофиза. Сидром возникает при прямом поражении гипофиза некрозом, опухолью или воспалительным процессом, кроме того, он может стать следствием нарушений гипоталамо-гипофизарной регуляции. Гипопитуитаризм проявляется симптомами гипокортицизма, гипогонадизма, гипотиреоза, расстройствами обмена веществ. Диагностика заболевания включает анализы на гипофизарные гормоны, методы нейровизуализации, исследование периферических желез внутренней секреции. Основу лечения составляет заместительная терапия гормональными препаратами.
МКБ-10

Общие сведения
Гипопитуитаризм представляет собой разнообразный по этиопатогенезу и клиническим признакам синдром, который встречается у пациентов разного профиля, протекает под «маской» других заболеваний. Истинная частота гипопитуитаризма не установлена, информация о распространенности существует только для отдельных форм. Гипопитуитаризм относится к одному из наиболее сложных в диагностике состояний, его выявление и правильное лечение требует от эндокринолога высокой профессиональной подготовки.

Причины гипопитуитаризма
Этиологическая структура гипопитуитаризма разнообразна, поскольку она отражает не только конкретные органические процессы в гипофизе, но и разнообразные соматические заболевания, провоцирующее его развитие. В клинической эндокринологии все возможные причины появления гипопитуитаризма объединяются в следующие группы:
- Некроз гипофиза. Отмирание ткани гипофиза происходит вследствие ишемии органа при воспалении височных артерий, атеросклерозе, серповидноклеточной анемии. Гипопитуитаризм изредка встречается у беременных женщин при тяжелой эклампсии, при массивных кровотечениях после родов (синдроме Шихана).
- Опухоли гипофиза. К первичным новообразованиям центрального эндокринного органа относят хромофобную аденому, краниофарингиому. Также наблюдаются параселлярные опухоли: менингиома, глиома зрительного нерва.
- Сосудистые заболевания. Причиной гипопитуитаризма может быть внутричерепная аневризма сонной артерии, тромбоз кавернозного синуса, кровоизлияние в гипофиз.
- Нейроинфекции. Вовлечение гипофиза в воспалительный процесс наблюдается при бактериальных патологиях: туберкулезе, менингококковом менингите, сифилисе. Дефицитное состояние может диагностироваться при системных микозах.
- Метаболические нарушения. Нередко гипопитуитаризм становится результатом системных нарушений здоровья и накопления токсинов, что возможно при почечной и печеночной недостаточности.
- Ятрогенные факторы. Дефицит гормонов часто выявляется у больных, которые прошли курс облучения носоглотки или турецкого седла, при случайном хирургическом разрушении органа.
Все вышеперечисленные факторы являются причинами первичной формы гипопитуитаризма. Вторичная недостаточность в основном отмечается при поражении гипоталамуса вследствие воспалительных, травматических или токсических воздействий. Также возможно появление опухолей гипоталамуса: первичных нейроэндокринных новообразований, метастатических лимфом. В редких случаях вторичный гипопитуитаризм развивается на фоне вынужденного голодания, нервной анорексии.
Патогенез
Гипофиз — центральная железа внутренней секреции, которая состоит из передней доли (аденогипофиза), занимающей 70-80% массы органа, задней доли (нейрогипофиза), промежуточной доли, которая по происхождению принадлежит к аденогипофизу. В аденогипофизе вырабатываются регуляторные гормоны: тиреотропный (ТТГ), адренокортикотропный (АКТГ) фолликулостимулирующий (ФСГ), лютеинизирующий (ЛГ), соматотропный (СТГ) и лютеотропный.
Гипопитуитаризм имеет множество механизмов развития, которые обусловлены конкретной причиной болезни. Возможно как прямое разрушение клеток либо инфекционно-токсическое их повреждение, так и опосредованное влияние патологий гипоталамуса на активность аденогипофиза. При снижении выработки регуляторных гормонов нарушается работа соответствующих периферических желез, что проявляется характерными симптомами.
Классификация
Учитывая механизм развития, гипопитуитаризм подразделяется на первичный с прямым поражением секретирующих клеток, и вторичный, когда недостаточный синтез гормонов связан с отсутствием стимулирующих влияний от высших нейроэндокринных центров. В практической эндокринологии повсеместно используется разделение гипопитуитаризма на клинические формы по степени нарушения секреции гормонов:
- Тотальный гипопитуитаризм— наиболее тяжелый вариант патологии, когда снижается или полностью прекращается выработка всех гипофизарных гормонов. Сюда относят гипофизарную кахексию (болезнь Симонса), послеродовой гипопитуитаризм (синдром Шихана), гипоталамо-гипофизарную недостаточность.
- Парциальный гипопитуитаризм — частичное поражение гипофиза, при котором нарушается синтез одного или нескольких гормонов. Парциальная форма имеет следующие подвиды:
- гипофизарный гипогонадизм — недоразвитие наружных половых признаков и нарушение репродуктивной функции, возникающее из-за дефицита ЛГ и ФСГ;
- гипофизарная карликовость (нанизм) — низкорослость вследствие недостаточного синтеза соматотропина в детском возрасте;
- гипофизарный гипокортицизм — гипофункция коры надпочечников, которая вызвана отсутствием стимулирующего влияния АКТГ;
- адипозогенитальная дистрофия — прогрессирующее ожирение и недоразвитие половых органов;
- гипофизарный гипотиреоз — снижение выработки тиреоидных гормонов на фоне нарушений синтеза ТТГ в передней доле гипофиза.
Симптомы гипопитуитаризма
Учитывая разнообразие клинических форм заболевания, невозможно выделить типичные симптомы гипопитуитаризма. Проявления болезни будут зависеть от выраженности нарушения работы гипофиза, причины поражения эндокринного органа, наличия у больного сопутствующих патологий. При гипопитуитарных синдромах в большинстве случаев сочетаются три группы признаков: полигормональная недостаточность, нейросоматические нарушения, психические расстройства.
Тотальный гипопитуитаризм
При гипофизарной кахексии на первый план выходит резкое снижение веса и атрофия мышц и отсутствием аппетита. Состояние чаще возникает у женщин 30-40 лет. Больные жалуются на постоянную сонливость, упадок сил, у них уменьшается половое влечение. Подобную клиническую картину имеет синдром Шихана, однако его патогномоничным признаком является развитие симптоматики у женщин в послеродовом периоде.
Больные с гипоталамо-гипофизарной недостаточностью имеют симптомы гипокортицизма, гипотиреоза, гипогонадизма. Вследствие дефицита антидиуретического гормона клиническая картина дополняется признаками несахарного диабета. Объем выделяемой мочи достигает 10-15 л в сутки, на фоне чего беспокоит постоянная мучительная жажда.
Парциальный гипопитуитаризм
При недостатке СТГ у детей возникает карликовость при правильных пропорциях тела. У взрослых дефицит соматотропина влияет на основной обмен: угнетает метаболические реакции, повышает уровень холестерина в крови, способствует расщеплению белков мышечной ткани. В результате снижения плотности костей нередки переломы. Кожа выглядит сухой, уменьшается потоотделение. Человек испытывает постоянную усталость, апатию, снижение работоспособности.
Дефицит гонадотропных гормонов (ФСГ, ЛГ) у женщин репродуктивного возраста вызывает нарушения цикла вплоть до отсутствия менструаций, снижение либидо, сухость влагалища. Нередко возникают расстройства мочеиспускания, дискомфорт во время полового акта. Мужчины испытывают эректильную дисфункцию, снижение полового влечения, неспособность к семяизвержению. Зачастую уменьшается волосяной покров в гормонозависимых зонах (подмышечные впадины, промежность).
Для гипотиреоза типично появление сонливости, вялости, снижения умственной и физической работоспособности. Кожа становится бледной, сухой, прохладной на ощупь. Поражение ЖКТ характеризуется запорами. На фоне отеков и нарушения метаболизма пациенты набирают вес даже при соблюдении стандартной калорийности рациона. При гипокортицизме, наоборот, наблюдается снижение массы тела в сочетании с расстройствами ЖКТ.
Осложнения
Основным негативным последствием гипопитуитаризма является гипофизарный криз, который является крайне тяжелой степенью гормональной недостаточности. Его началу способствует перенесенный острый стресс, физическая травма, отсутствие или резкое прекращение заместительной гормональной терапии. Нередко кризы наступают при осложнении гипопитуитаризма инфекционно-воспалительными процессами.
Патология развивается постепенно в течение нескольких дней, но при кровоизлиянии в гипофиз симптомы появляются в считанные часы. Гипофизарный криз проявляется адинамией, снижением температуры тела, угнетением сухожильных и брюшных рефлексов. У пациентов снижается артериальное давление, замедляется пульс, нарушаются все обменные процессы. Без своевременной помощью состояние приводит к полиорганной недостаточности, коме, смерти пациента.
Диагностика
Первичное обследование больного происходит в кабинете врача-эндокринолога. Учитывая многоликость гипопитуитарного синдрома, требуется провести полное физикальное обследование, выяснить все жалобы и детально собрать анамнез заболевания, чтобы заподозрить гипопитуитаризм. Подтвердить наличие гипопитуитаризма помогают следующие диагностические методы:
- Нейровизуализация. Чтобы обнаружить органические поражения гипоталамо-гипофизарной зоны, проводится рентгенография турецкого седла, МРТ или КТ головного мозга. При необходимости обследование дополняется церебральной ангиографией, электроэнцефалографией.
- УЗИ эндокринных органов. Для оценки состояния органов-мишеней, работа которых определяется уровнем тропных гормонов, информативной является ультразвуковая диагностика. Для детализации данных возможно выполнение КТ щитовидной железы, надпочечников, органов малого таза.
- Биохимические анализы. Оценка общего состояния здоровья производится на основе протеинограммы, липидограммы, острофазовых показателей. Важное значение имеют уровни основных электролитов крови. При подозрении на несахарный диабет назначается анализ мочи.
- Гормональные исследования. Базовым методом диагностики является измерение уровней гормонов в крови. Как правило, для уточнения причины и формы гипопитуитаризма делаются пробы с введением ГнРГ, клофелина, тиролиберина.
- Консультации профильных специалистов. Чтобы уточнить первопричину гипопитуитаризма, больным рекомендуется пройти комплексное обследование у невролога, кардиолога, офтальмолога, инфекциониста, других врачей.
Лечение гипопитуитаризма
Плановая терапия
При гипопитуитаризме показано дифференцированное лечение, которое проводится, учитывая этиологический фактор заболевания, степень тяжести, клиническую симптоматику, наличия осложнений. Большинство гипопитуитарных синдромов успешно купируются с помощью медикаментозной терапии, для которой разработана следующая терапевтическая схема:
- Заместительные гормональные препараты. Для коррекции работы эндокринной системы эффективны аналоги кортикотропного, тиреотропного, соматотропного гормонов. Женщинам для устранения гипогонадизма рекомендованы комбинированные оральные контрацептивы, а мужчинам подбираются лекарства с андрогенным эффектом.
- Глюкокортикостероиды. Медикаменты применяются при некрозе гипофиза для предупреждения церебральных осложнений такого состояния, купирования отека мозга. Также лекарства используются при активном иммунном воспалении, повреждающем органы гипоталамо-гипофизарной системы.
- Противомикробные препараты. Лекарства необходимы при доказанной инфекционной этиологии гипопитуитаризма, чтобы быстро устранить провоцирующих фактор, ликвидировать воспаление в головном мозге.
- Цитостатики. Средства для химиотерапии назначаются при первичных злокачественных новообразованиях гипофиза либо при метастатических опухолях. Цитостатики комбинируют с другими методами лечения в нейроонкологии.
Неотложная помощь
Купирование гипофизарного криза проводится в отделении реанимации. Лечение начинается с введения высоких доз кортикостероидов, при стойкой артериальной гипотензии дополнительно вводится раствор ДОКСА. Спустя 12-24 часа терапию дополняют тиреоидными препаратами. Чтобы улучшить водно-солевой обмен, нормализовать показатели гликемии, вводятся инфузионные растворы: физиологический раствор, раствор глюкозы, гипертонические растворы с натрием.
Для улучшения метаболизма показано введение коферментных препаратов тиамина, активной формы витамина В6, цитохрома С, аденозинмонофосфата. Чтобы устранить является сердечной недостаточности, необходимо использовать кардиотропные лекарства из группы бета-адреномиметиков, аналептиков, сердечных гликозидов. Респираторная поддержка включает ингаляции увлажненного кислорода, искусственную вентиляцию легких.
Хирургическое лечение
При аденомах гипофиза, опухолях кармана Ратке и других новообразованиях области турецкого седла рассматривается вопрос о возможности нейрохирургического удаления патологической ткани. Для комплексного лечения опухолевых процессов оперативное вмешательство нередко дополняется лучевой терапией. В первые дни после геморрагического инсульта тоже возможно проведение операции, если консервативное лечение не дает ожидаемого эффекта.
Прогноз и профилактика
Прогноз оценивается с учетом причины, тяжести состояния, в значительной мере зависит от своевременности диагностики проблемы, соблюдения пациентом врачебных рекомендаций. При постоянном приеме заместительной терапии удается сохранить высокое качество жизни и нормализовать функции периферических эндокринных желез. Сомнительный прогноз для пациентов с тотальным гипопитуитаризмом, который нередко завершается комой. Меры профилактики не разработаны.
4. Гипопитуитаризм: причины и эпидемиология/ А.В. Древаль// Алгоритмы диагностики и лечения гипофизарной недостаточности. — 2014. — №5-6.
Апоплексия гипофиза ( Питуитарная апоплексия )
Апоплексия гипофиза - это острое состояние, которое возникает вследствие резкого увеличения размеров опухоли гипофиза из-за ее разрыва, кровоизлияния или некроза. Заболевание сопровождается сильными головными болями, нарушением зрения, тошнотой, рвотой. Поражение гипофиза вызывает гипопитуитризм. Сдавление сосудов головного мозга приводит к развитию локальной ишемии. Диагностика основывается на проведении томографии головного мозга, определении уровня тропных гормонов. Лечение зависит от остроты и распространённости патологического процесса. При обширных поражениях проводят гормональную терапию и оперативное вмешательство с целью декомпрессии структур головного мозга.



Апоплексия гипофиза - неотложное состояние в нейрохирургии, характеризующееся кровоизлиянием в полость турецкого седла и сдавлением структур параселлярной области. Заболевание встречается редко, однако всегда несет угрозу для жизни пациента. Развивается апоплексия в основном у больных с активно растущими опухолями гипофиза и новообразованиями больших или гигантских размеров. По данным исследований РНХИ им. проф. А.Л. Поленова, частота возникновения данного патологического состояния при опухолях аденогипофиза составляет около 3%. Чаще встречаются кровоизлияния в новообразование, реже - ишемические инфаркты, некрозы.

Причины
Острое состояние возникает у больных с кортикотропными и соматотропными аденомами, глиомами, метастазами в ткань гипофиза. К апоплексии могут привести следующие факторы:
- Длительная антикоагулянтная терапия. Применение высоких доз кроверазжижающих препаратов при повышении АД может спровоцировать возникновение кровотечения из сосуда головного мозга.
- Опухоли гипофиза. Стремительный рост новообразований вызывает сдавливание близлежащих мозговых структур, нарушение трофики гипофиза.
- Лучевая терапия. Радиотерапия опухолей головного мозга вызывает нарушение целостности и питания сосудистой сети вплоть до образования трофических язв, кровотечений.
- Черепно-мозговые травмы. Ушибы, сотрясения головного мозга, переломы костей черепа приводят к механическому повреждению мозговых структур или новообразования.
- Проведение исследований гипофиза. Инвазивные методы оценки гипофизарной функции могут повлечь за собой нарушение целостности тканей новообразования и стать причиной кровотечения.
- Идиопатическое кровоизлияние. Известны случаи спонтанной апоплексии без предшествующих физических или химических воздействий.
Патогенез апоплексии связан с образованием и активным ростом опухоли гипофиза. Данное состояние сопровождается увеличением сосудистой сети, усилением локальной микроциркуляции. Физическое или химическое воздействие на опухоль провоцирует нарушение целостность капилляров и истечение крови в подпаутинное пространство. Активный рост новообразования вызывает сдавление мозгового вещества, черепных нервов, сосудов, питающих головной мозг. Это объясняет стремительное развитие неврологической симптоматики при апоплексии гипофиза. Сдавление нервов приводит к нарушению функции других систем (зрительной, дыхательной, сердечно-сосудистой). Чаще всего возникает поражение аденогипофиза, нейрогипофиз остается сохранным и функционирует нормально.

Симптомы апоплексии гипофиза
Клиника заболевания зависит от размеров новообразования, вида поражающего фактора, может варьировать от малозначимых симптомов до нарушения сознания и комы. Около 25% апоплексий гипофиза протекают без клинических проявлений. Массивное кровотечение в паренхиму мозга характеризуется стремительным нарастанием неврологической симптоматики. Возникает интенсивная головная боль в лобной или параорбитальной зоне, тошнота, рвота. При отсутствии лечения развивается отек головного мозга, помутнение сознания вплоть до комы.
При быстром росте опухоли и дислокации мозговых структур снижается острота зрения вплоть до слепоты, возникает птоз, дефекты полей зрения. Сдавление внутренней сонной артерии приводит к возникновению ишемического инсульта, компрессия средней мозговой артерии - к нарушению работы обонятельных трактов, развитию аносмии.
Поражение гипофиза вызывает различные эндокринные нарушения. При небольших размерах опухоли, незначительном кровоизлиянии уровень тропных гормонов остается нормальным. Обширное кровотечение сопровождается дисфункцией передней доли гипофиза и развитием гипопитуитаризма. Данное состояние вызывает снижение секреции адренокортикотропного (АКТГ), соматотропного (СТГ), тиреотропного (ТТГ), фоликулостимулирующего (ФСГ), лютеинизирующего (ЛГ) гормонов, пролактина. У 5-10 % пациентов с апоплексией гипофиза развивается несахарный диабет, сопровождающийся полиурией, полидипсией.
Обширные геморрагии, проникновение крови в спинномозговую жидкость вызывают развитие менингеальных симптомов, нарушение двигательной функции, развитие ступора, сопора, комы. При паренхиматозном кровоизлиянии в срединные структуры головного мозга возникают эпилептические припадки, потеря сознания, параличи. Поражение сердечно-сосудистого и дыхательного центра продолговатого мозга вызывает внезапную смерть. Генерализованное повреждение аденогипофиза приводит к дефициту всех тропных гормонов (пангипопитуитаризму) и гипофункции периферических эндокринных желёз. Наблюдаются резкое снижение веса, выраженная астенизация, признаки гипотиреоза и гипокортицизма, психоневрологические нарушения, гипофизарная кома.
Вариабельность симптоматики и данных лабораторных анализов делают диагностику апоплексии гипофиза затруднительной. Обязательным является консультация эндокринолога, нейрохирурга, офтальмолога, невролога. При подозрении на апоплексию проводятся следующие обследования:
- Лучевая диагностика.КТ головного мозга с контрастированием является основным методом диагностики, позволяющим определить участки геморрагии, некротические ткани, объемные образования любого размера. Магнитно-резонансная томография мозга или рентгенография черепа в боковой проекции выполняются при отсутствии возможности проведения КТ. Рентгенография позволяет обнаружить объемное образование в области гипофизарной ямки. МРТ выявляет некротизированные участки, опухоли небольшого размера.
- Анализ гормонального фона. Производят забор крови для определения уровня кортизола, пролактина, гормонов щитовидной железы, гонадотропных и соматотропного гормонов.
- Мониторинг общего состояния организма. Осуществляют с помощью ОАК, ОАМ, анализа ликвора, биохимического анализа крови с обязательным исследованием уровня мочевины, креатинина и электролитов (Na, К) в динамике.
Дифференциальная диагностика
Дифференциальная диагностика апоплексии гипофиза проводится с разрывом аневризмы сосудов мозга, иными внутричерепными новообразованиями, окклюзией сонной артерии. В этом случае дополнительно выполняется ангиография внутричерепных сосудов. При нарушении сознания заболевание дифференцируют с другими острыми состояниями: вирусным и бактериальным менингитом, менингоэнцефалитом, обширным инсультом. Для диагностики осуществляют забор спинномозговой жидкости для определения белка, крови, лейкоцитов, глюкозы.

Лечение апоплексии гипофиза
Тактика лечения зависит от тяжести патологического процесса, клиники заболевания. При эндокринной недостаточности проводят заместительную гормональную терапию до стабилизации состояния. При нарастании симптомов внутричерепной гипертензии, резком снижении зрения, угрозе развития отека головного мозга, потере сознания проводят хирургическую декомпрессию головного мозга.
Операцию выполняют в экстренном порядке транссфеноидальным или транскраниальным доступами. Во время вмешательства осуществляют забор материала на гистологическое исследование, ослабляют давление на жизненно важные структуры мозга, производят полное удаление опухоли, некротических масс и геморрагических сгустков. По окончании операции с целью профилактики внутричерепной гипертензии и отека мозга устанавливают вентрикулярный дренаж. В послеоперационном периоде проводят восстановление кислотно-щелочного, электролитного равновесия, корректируют эндокринные нарушения с помощью глюкокортикоидов, тироксина, половых гормонов. При необходимости продолжают проведение искусственной вентиляции легких.
Прогноз в отношении апоплексии зависит от вида и объема поражения мозговых структур. При локальном кровоизлиянии с сохранением нормальной функции мозга, оказании экстренной специализированной помощи прогноз благоприятный. В большинстве случаев удается стабилизировать состояние, вернуть нормальный уровень гормонов, электролитов. Массивное кровоизлияние, быстрый рост опухоли со сдавлением структур головного мозга возникает редко, приводя к стремительному нарушению сознания, коме и смерти. Профилактика возникновения апоплексии гипофиза состоит в диспансерном наблюдении невролога и эндокринолога, ежегодном проведении компьютерной томографии новообразований головного мозга.
2. Нарушения церебральной гемодинамики у больных с аденомой гипофиза, осложненной питуитарной апоплексией/ К.Э. Махкамов, М.М. Азизов, Н.Г. Дадамьянц// Вестник экстренной медицины. - 2013.
3. Результаты хирургических вмешательств у больных с аденомами гипофиза, осложненными питуитарной апоплексией/ К.Э. Махкамов, М.М. Азизов// Вестник экстренной медицины. - 2010.
Гипофизарный нанизм (карликовость) - симптомы и лечение
Что такое гипофизарный нанизм (карликовость)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Скворцовой Ольги Викторовны, детского эндокринолога со стажем в 9 лет.
Над статьей доктора Скворцовой Ольги Викторовны работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина
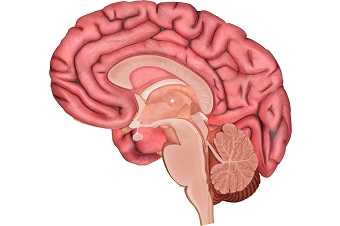
Определение болезни. Причины заболевания
Гипофизарный нанизм, или гипопитуитаризм — это заболевание, при котором частично или полностью прекращается выработка гормона роста — соматотропина (соматотропного гормона) [1] . Оно сопровождается нарушением роста скелета, из-за чего мужчины не вырастают выше 130 см, а женщины — выше 120 см. В связи с этим характерным проявлением болезнь также называют карликовостью.
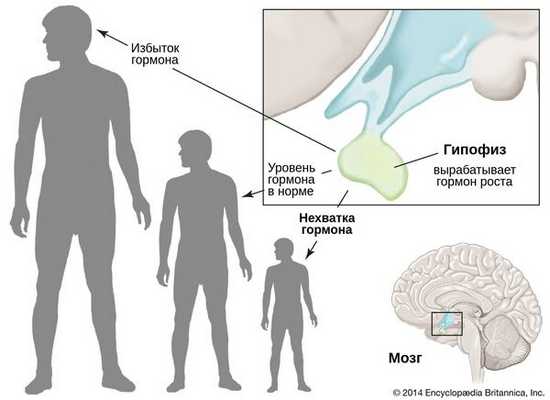
Наиболее частые причины гипофизарного нанизма:
- Наследственность — мутации в гене соматотропного гормона (GH1) или его рецепторах. Частота встречаемости врождённого гипопитуитаризма колеблется от 1:4000 до 1:10000 [5] .
- Дефекты развития гипоталамо-гипофизарной системы — области головного мозга, где вырабатывается соматотропный гормон:
- гипоплазия (недоразвитие) гипофиза;
- полное отсутствие гипофиза. При этом дефицит гормона роста сочетается с нехваткой других гормонов, которые вырабатываются в гипофизе. Такое состояние называется пангипопитуитаризмом. Оно проявляется надпочечниковой недостаточностью, ухудшением работы щитовидной железы (гипотиреозом), несахарным диабетом, гипогонадотропным гипогонадизмом (отсутствием полового развития и дефицитом гормона роста).
- Опухоли гипофиза:
- краниофарингиома — доброкачественная опухоль гипофизарной области, одна из самых распространённых в детском возрасте;
- гамартома — редкий вид доброкачественной опухоли;
- герминома — редкий вид опухоли, чаще всего бывает злокачественной — и др.
- Травмы головного мозга с повреждением гипофиза, возникшие до того, как человек достиг социально приемлемого роста — 155-170 см (например, родовая травма).
- Инфекционные заболевания — менингиты, энцефалиты и др.
- Облучение головы и шеи.
- Токсические последствия химиотерапии.
Теоретически, спровоцировать развитие гипофизарного нанизма может любое заболевание, которое будет затрагивать работу гипофиза.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы гипофизарного нанизма
Гипофизарный нанизм проявляется по-разному. Симптоматика зависит от причин дефицита гормона роста.
Основной симптом — отставание в темпах линейного роста [2] . Такие дети вырастают менее чем на 4 см в год. Нарушение динамики роста будет заметно уже в первые месяцы жизни ребёнка. Если повреждение гипоталамуса или гипофиза возникло в более позднем возрасте, то отставание в росте будет отмечаться позднее. Также для детей с гипофизарным нанизмом характерно отставание костного (биологического) возраста от паспортного (фактического) более чем на 2-3 года.
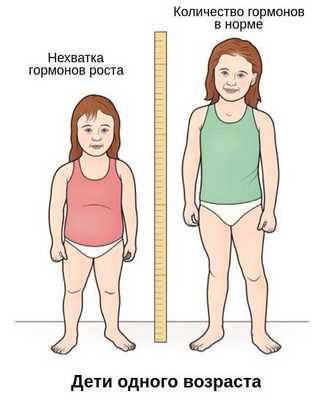
При нехватке гормонов роста телосложение остаётся пропорциональным. Это важный диагностический критерий: он позволяет исключить разные формы скелетных дисплазий [9] .
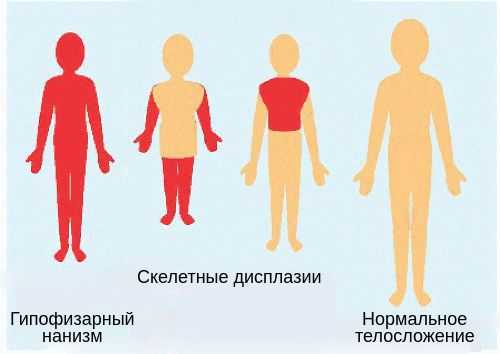
Симптомами врождённого гипофизарного нанизма у новорождённых являются:
- гипогликемия — низкий уровень глюкозы в крови натощак. Это физиологическое состояние может встречаться и у здоровых детей из-за незрелости поджелудочной железы. Дети с нанизмом сталкиваются с ним гораздо чаще, особенно на первом году жизни, поскольку гормон роста участвует в регуляции углеводного обмена;
- позднее закрытие большого родничка;
- задержка костного созревания;
- истончение кожи — может быть связано со снижением функции щитовидной железы;
- медленный рост ногтей и волос;
- высокий голос.
Часто у детей с гипопитуитаризмом встречается множественный кариес зубов. Это объясняется задержкой окостенения скелета и снижением обменных процессов в костной ткани.
Психоинтеллектуальное развитие у детей с гипофизарным нанизмом, как правило, не страдает, но возможны некоторые психологические проблемы: повышенная потребность в родительской опеке, снижение самооценки, трудности в общении со сверстниками.
Патогенез гипофизарного нанизма
В зависимости от причин дефицита соматотропного гормона есть несколько вариантов механизмов развития заболевания. При этом в основе патогенеза всегда будет лежать нарушение выработки гормона роста. В дальнейшем его нехватка станет причиной нарушения работы органов и систем, на которые он оказывает влияние: костной, мышечной и соединительной ткани, жирового углеводного обмена. В некоторых случаях первоначально будут развиваться гипоталамические нарушения, а недостаточность соматотропного гормона станет вторичным проявлением.
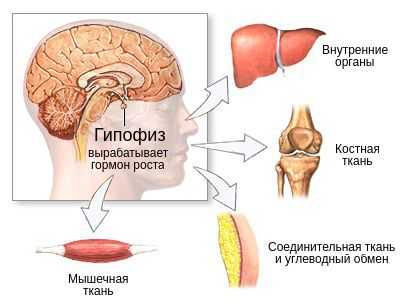
Молекулярной основой изолированного дефицита гормона роста является мутация определённого гена, которая не даёт организму синтезировать гормон. От видов генетических мутаций зависит, будет ли дефицит соматотропного гормона изолированным, или же он будет сочетаться с нехваткой других гормонов гипофиза, которые лежат в основе других патологий:
- дефицит тиреотропного гормона — вторичный гипотиреоз;
- дефицит пролактина — гипопролактинемия;
- дефицит гонадотропинов — аменорея и недоразвитие половых органов у женщин, снижение потенции и либидо у мужчин;
- дефицит АКТГ — вторичная недостаточность надпочечников;
- дефицит вазопрессина — несахарный диабет;
- дефицит кортизола — гипокортицизм.
У некоторых пациентов с мутацией конкретных генов выявляется гиперплазия передней доли гипофиза (аденогипофиза). В процессе жизни может произойти её атрофия вплоть до формирования синдрома "пустого турецкого седла" — недостаточности области головного мозга, где расположен гипофиз. Данный синдром приводит к внедрению мягкой мозговой оболочки в полость турецкого седла, сдавлению и уменьшению гипофиза, что нарушает или полностью прекращает его работу.
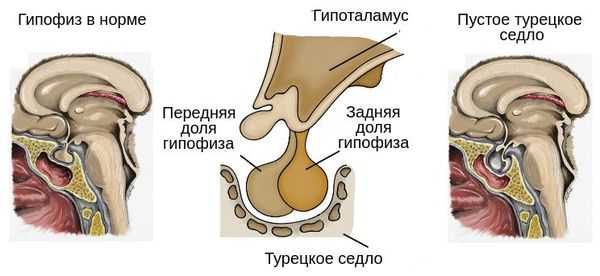
В подобных случаях дефицит гормона роста и других гормонов гипофиза будет возникать постепенно [3] .
Классификация и стадии развития гипофизарного нанизма
Единой, общепринятой классификации гипофизарного нанизма не существует. Наиболее удобной для практикующих врачей является классификация, основанная на причинах заболевания. Она выделяет две большие группы: врождённый и приобретённый гипопитуитаризм [4] .
Врождённый гипофизарный нанизм делится на три подгруппы:
- Наследственный:
- изолированный дефицит гормона роста: мутации гена самого гормона (GH1) или мутации гена рецептора к соматотропину (GHRHR);
- множественный дефицит гормонов передней доли гипофиза: мутации гена PIT-1 или гена PROP1.
- Идиопатический (незафисимый) дефицит СТГ-релизинг гормонов, которые стимулируют выработку гормонов передней доли гипофиза.
- Дефекты развития гипоталамо-гипофизарной системы:
- патология срединной трубки;
- нарушение развития гипофиза: врождённая аплазия (отсутствие гипофиза), гипоплазия (недоразвитие), эктопия (неправильное расположение).
Приобретённый гипофизарный нанизм включает в себя девять причин развития болезни:
- Опухоли гипоталамуса и гипофиза: краниофарингиома, гамартома, нейрофиброма, герминома, аденома гипофиза.
- Опухоли других отделов мозга: глиома зрительного перекреста.
- Травмы: черепно-мозговая, хирургическое повреждение ножки гипофиза.
- Инфекционные заболевания: вирусный, бактериальный энцефалит и менингит, неспецифический гипофизит (воспаление гипофиза).
- Супраселлярные арахноидальные кисты — полые опухоли, заполненные жидкостью (ликвором), которые распространяются в полость черепа.
- Сосудистые нарушения: аневризмы сосудов гипофиза, инфаркт гипофиза.
- Облучение головы и шеи по поводу лейкемии, медуллобластомы, ретинобластомы; общее облучение всего тела (при пересадке костного мозга).
- Токсические последствия химиотерапии.
- Инфильтративные болезни: саркоидоз, гистиоцитоз.
Осложнения гипофизарного нанизма
Осложнения заболевания связаны с утратой воздействия гормона роста на органы и системы. Они развиваются вследствие несвоевременной диагностики.
У новорождённого с дефицитом соматотропина относительную опасность может представлять гипогликемическое состояние, поскольку этот гормон играет важную роль в регуляции углеводного обмена. Клинически гипогликемия проявляется бледностью, потливостью, повышенным аппетитом, беспокойством ребёнка, иногда наблюдается судорожный синдром [5] .

Так как сомтатотропин усиливает синтез белка и тормозит его распад, у детей с дефицитом этого гормона может снизиться уровень общего белка в организме и его фракций. Это сказывается на общем физическом развитии: снижается иммунитет, повышается риск присоединения других гормональных сопутствующих нарушений.
Значительная часть эффектов гормона роста передаётся через ИПФР-I (инсулиноподобный фактор роста-I). Он вырабатывается в печени под действием соматотропина и стимулирует рост внутренних органов. Вследствие дефицита соматотропного гормона рост и своевременное развитие органов может частично нарушиться. Это приводит к нарушению работы печени, почек, сердечно-сосудистой системы. Такое осложнение встречается нечасто.
При дефиците гормона роста совместно с другими гормонами гипофиза (пангипопитуитаризме) будет развиваться недостаточность других эндокринных желёз — щитовидной железы, надпочечников, репродуктивной системы. Несвоевременная диагностика этих нарушений после рождения опасна для жизни, а также может стать причиной необратимым нарушений психического или интеллектуального развития.
Диагностика гипофизарного нанизма
Диагностика заболевания начинается с оценки линейного роста ребёнка и скорости прибавки в росте. Для этого врачи сравнивают фактические параметры ребёнка с предполагаемым ростом и среднестатистической скоростью роста. Подставив все данные в специальную формулу, они вычисляют коэффициент стандартного отклонения. Если у ребёнка отставание в росте больше двух сигмальных отклонений, плохая скорость прибавки роста, то проводится дальнейшее обследование.
Затем врачи определяют костный возраст. Сделать это можно с помощью рентгена или УЗИ запястья. В норме костный возраст может отставать или опережать паспортный на два года.
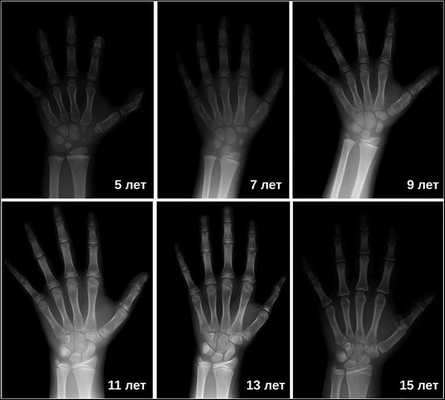
Также важно провести оценку гормонального профиля:
- уровень тиреотропного гормона (ТТГ) и свободного тироксина (Т4) — проверка работы щитовидной железы;
- уровень кортизола и АКТГ (кортикотропина) — исключение нарушений работы надпочечников [10] ;
- уровень лютеинизирующего гормона (ЛГ) и фоллитропина (ФСГ) — исключение гипогонадотропного гипогонадизма в возрасте, когда должно начаться половое созревание;
- инсулиноподобный фактор роста-I (ИПФР-I) — оценка уровня гормона роста.
Прямая оценка уровня соматотропина, как правило, не проводится. Гормон роста в течение суток выделяется в разном количестве, поэтому узнать его истинный уровень невозможно.
При необходимости проводится МРТ головного мозга и гипофиза с контрастированием [6] . Она позволяет исключить или подтвердить наличие объёмных образований области гипофиза и головного мозга.
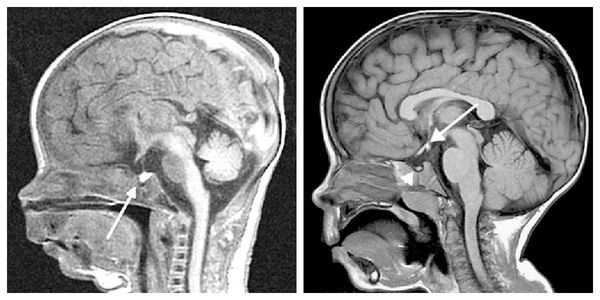
Для дифференциальной диагностики задержки роста, не связанной с гормоном роста, исключают дефицит железа, дефицит витамина D, общего белка и другие дефицитные состояния, т. к. их наличие может отрицательно влиять на скорость линейного роста. Рентгенография черепа в данном случае не информативна.
Для исключения определённых генетических синдромов может потребоваться консультация генетика.
При подозрении на истинный дефицит гормона роста проводятся пробы на стимуляцию соматотропина. Эти провокационные тесты стимулируют выброс гормона роста при введении определённых препаратов. Они проводятся только после исключения других возможных причин низкорослости. На основании этих проб, при отсутствии должного выброса гормона роста, будет установлен диагноз "гипопитуитаризм".
Лечение гипофизарного нанизма
Лечение проводится рекомбинантным гормоном роста, который получают методом генной инженерии. Он назначается после исключения активных злокачественных новообразований и тяжёлых сопутствующих заболеваний (как физических, так и психических). Эти состояния являются противопоказанием к использованию данного препарата.
Если имеются другие дефициты гормонов гипофиза, то перед лечением их также нужно компенсировать. Иначе должного эффекта от применения гормона роста не будет.
Цели лечения:
- ускорить темп роста и нормализовать рост;
- стимулировать начало периода полового созревания с нормальным ростом;
- достичь генетически прогнозируемого роста ребёнка или опередить его;
- улучшить качество жизни;
- повысить минеральную плотность костей;
- снизить факторы риска сердечно-сосудистых заболеваний.
Противопоказания к назначению рекомбинантным гормоном роста:
- закрытые зоны роста, за счёт которых происходит линейный рост (при их закрытии человек перестаёт расти);
- активные злокачественные новообразования;
- прогрессирующий рост внутричерепных опухолей;
- аллергия на препарат.
Прекращают терапию гормоном роста при:
- закрытии зон роста;
- плохой скорости прибавки роста — менее 2 см в год;
- достижении социально приемлемого роста.
Крайне редко возможны побочные эффекты и осложнения при терапии гормоном роста:
- доброкачественная внутричерепная гипертензия — повышение внутричерепного давления;
- боли в суставах — обычно наблюдаются при значительном ускорении линейного роста;
- возможно усугубление заболеваний, связанных с недифференцированными дисплазиями соединительной ткани (сколиозов);
- отёки — связано с функцией гормона роста задерживать жидкости в организме;
- пубертатная гинекомастия — увеличение грудных желёз за счёт разрастания железистой ткани у мальчиков [7] .
Прогноз. Профилактика
Прогноз заболевания при своевременной диагностике и проведении должного лечения, как правило, благоприятный. Дети достигают своего генетически прогнозируемого роста и иногда даже опережают его.
Если дефицит гормона роста сочетается с дефицитом других гормонов гипофиза, то для достижения желаемого эффекта, профилактики ухудшения состояний и более лёгкой социальной адаптации ребёнка необходимо лечение других дефицитов.
Также очень важен чёткий и своевременный контроль во время лечения гормоном роста: оценка динамики линейного роста, гормонального статуса и костного возраста. Особое внимание необходимо уделять режиму лечения и своевременной коррекции дозы препарата с учётом прибавки в росте и весе. При применении соматотропного гормона доза препарата будет увеличиваться. При несвоевременной прибавке дозы динамика роста может ухудшится [8] .
Мониторинг детей, находящихся на лечении, проводится раз в полгода, при других сопутствующих дефицитах гормонов гипофиза — по показаниям.
Вопрос профилактики данного заболевания сложен, т. к. речь идёт о генетических нарушениях. В первую очередь важен ответственный подход будущих родителей к рождению ребёнка:
- своевременное обследование и лечение заболеваний;
- восполнение дефицитов при планировании беременности;
- отказ от вредных привычек.
Для профилактики дефицита гормона роста, который возникает вследствие другого заболевания (инфекции, опухоли, травмы), следует проводить профилактики первоисточника.
Читайте также:
- Ганглионеврит
- Анамнез у больного с пороком сердца. Одышка при пороке сердца
- Биопсия сторожевого лимфатического узла при раке молочной железы
- Липидный обмен при нейроциркуляторной дистонии. Клиника перехода вегето-сосудистой дистонии в ИБС
- Укладка при рентгенограмме лицевого отдела черепа, придаточных пазух и костей носа в боковой проекции
