Перикард и перикардиальный выпот на рентгенограмме. Однофотонная эмиссионная компьютерная томография (ОФЭКТ) сердца
Добавил пользователь Владимир З. Обновлено: 15.01.2026
Однофотонная эмиссионная компьютерная томография миокарда является радионуклидным методом исследования, предназначенным для оценки кровоснабжения миокарда на уровне микроциркуляции. Метод основан на оценке распределения в сердечной мышце внутривенно введенного РФП, который включается в неповрежденные кардиомиоциты пропорционально коронарному кровотоку. Области миокарда с нормальным кровоснабжением создают картину равномерного распределения РФП, а участки миокарда с относительным или абсолютным снижением кровотока вследствие ишемии или рубцового повреждения имеют снижение включения РФП за счет дефектов перфузии.
Распределение РФП в миокарде зависит как от самой перфузии, так и от целостности сарколеммы и сохранности клеточного метаболизма (жизнеспособности). Благодаря сходству распределения в миокарде калия и используемых РФП, имеется возможность комбинированной оценки раннего и отсроченного включения РФП. Ранний паттерн распределения пропорционален потоку крови, в то время как последний паттерн распределения указывает на ткань с неповрежденным внутри-экстраклеточным градиентом, что позволяет дифференцировать жизнеспособный и нежизнеспособный (рубец, некроз) миокард.
Среди РФП, меченных99mTc, наибольшее распространение получил МИБИ, известный в зарубежной литературе, как Сестамиби, который подобно калию, поступает в кардиомиоциты посредством K-Na-АТФ-насоса. Жизнеспособность миокарда определяется по увеличению накопления изотопа как на отсроченных изображениях, так и при повторном его введении. Для участков жизнеспособного миокарда характерны, так называемые, полустабильные дефекты перфузии. Они характеризуются возвращением изображения миокарда к норме на поздних отсроченных сцинтиграммах и после реинъекции РФП в покое. Если область гипоперфузии сохраняется, то эта зона, соответствует нежизнеспособным участкам миокарда. В ряде работ показана высокая информативность в оценке наличия жизнеспособного миокарда перфузионной сцинтиграфии в сочетании с фармакологической пробой с добутамином.
Наиболее часто для верификации жизнеспособного миокарда применяется введение синтетического бета-1-адреностимулятора добутамина, который в малых дозах (5-10 мкг/кг/мин) способен повышать сократимость жизнеспособного миокарда без существенного повышения частоты сердечных сокращений. Однофотонная эмиссионная компьютерная томография миокарда выполненная с добутаминовым тестом оценивает степень жизнеспособности миокарда, чувствительность метода сцинтиграфии (от 89% до 100%).
На рисунке 1-3 представлены сцинтиграфические исследования миокарда больного 58 лет находившегося на стационарном лечении в РНПЦ «Кардиология» с диагнозом ХСН, атеросклероз сосудов сердца. Была выполнена ОФЭКТ миокарда по однодневному протоколу с нагрузочным фармакологическим тестом с добутамином, затем через 3 часа ОФЭКТ миокарда в покое (рис.1-2). При анализе полученной информации полученной после введения добутаминаопределяется, неравномерное накопление РФП по миокарду левого желудочка с различной степенью процентного соотношения в сегментах сердечной мышцы. Перфузия медиально-базального отдела задней, латеральной стенки и межжелудочковой перегородки миокарда левого желудочка имеет признаки выраженной ишемии 20 % миокарда всего левого желудочка с выраженным нарушением перфузии, соответственно в бассейнах Rightcoronaryarteries 49 % с выраженным нарушением перфузии и 10% зоны аперфузии.LeftCircumflex 46,5% и LeftanteriorDescending 0.1%
Рис.1 ОФЭКТ миокарда больного 58 лет с фармакологической пробой с добутамином

При повторном исследовании через 3 часа в покое наблюдается увеличение процентного показателя зон гипоперфузии в миокарде левого желудочка. 34.5 % миокарда всего левого желудочка с выраженным нарушением перфузии, соответственно в бассейнах Rightcoronaryarteries 81,7 % с выраженным нарушением перфузии и 10% зоны аперфузии.LeftCircumflex 51% и LeftanteriorDescending 10,9%.
Рис. 2 ОФЭКТ миокарда больного 58 лет с ХСН в покое.

В последствии выполнена операция АКШ, через 6 месяцев выполнена ОФЭКТ миокарда (Рис.3) в покое нет заметно выраженного повышения процентного показателя зон гипоперфузии в миокарде левого желудочка. Общий составил 22.7 % миокарда от всего левого желудочка с выраженным нарушением перфузии, соответственно в бассейнах Rightcoronaryarteries 58,1 % с выраженным нарушением перфузии и 10% зоны аперфузии.LeftCircumflex 26,6% и LeftanteriorDescending 3,4%.
Рис. 3 ОФЭКТ миокарда больного 58 лет после АКШ
Примененная нами проба в диагностических целях с фармакологическим препаратом добутамином (дипиридамолом) при ОФЭКТ позволяет выявлять участки жизнеспособного миокарда.
РАДИОНУКЛИДНАЯ ДИАГНОСТИКА В ИССЛЕДОВАНИИ ФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ МИОКАРДА
Благодаря развитию новых высокоинформативных компьютерных технологий на сегодняшний день в кардиологии широко используются современные неинвазивные радионуклидные методы исследования. Развитию и совершенствованию радионуклидных методов исследования сердечно-сосудистой системы способствовала как разработка радиофармацевтических препаратов (РФП), обладающих специфической тропностью к здоровому или ишемизированному миокарду, так и устройств, представляющих информацию о прохождении индикатора не только в графической, но и в визуальной форме. Основным прибором в радионуклидной диагностике является созданная в 1963 году H. Anger гамма - камера.
Прогрессирующее развитие ядерной кардиологии обусловлено созданием гамма-томографов с высокой скоростью счета, привлечением компьютерной техники для сбора и обработки информации. В кардиологии радионуклидные методы исследования направлены на изучение:
- состояния внутрисердечной гемодинамики, аорты, крупных сосудов с оценкой характера тока крови в них;
- перфузии миокарда с оценкой ее локальных нарушений;
- сократительной функции миокарда;
- определения регионарной метаболической активности миокарда.
Из радионуклидных методов для оценки функционального состояния миокарда в настоящее время в мировой практике наиболее широко применяются радионуклидная томовентрикулография (РТВГ), перфузионная однофотонная эмиссионная компьютерная томография миокарда (ОФЭКТ) и позитронно-эмиссионная томография (ПЭТ).
Однофотонная эмиссионная компьютерная томография миокарда (ОФЭКТ).
Особое место среди методов ядерной медицины занимает перфузионная однофотонная эмиссионная компьютерная томография миокарда (ОФЭКТ), позволяющая получать уникальную информацию о кровоснабжении миокарда на уровне микроциркуляции и применяется в мировой практике уже на протяжении более 20 лет.
ОФЭКТ миокарда - радионуклидный метод исследования, основанный на оценке распределения в миокарде внутривенно введенного РФП, которое происходит пропорционально коронарному кровотоку. ОФЭКТ миокарда предназначен для выявления областей относительного или абсолютного снижения кровотока, возникающего вследствие ишемии или рубцового повреждения миокарда. Для визуализации перфузии миокарда применяют РФП, которые экстрагируются и удерживаются миокардом в течение различных временных интервалов.
В настоящее время используют следующие РФП: таллия хлорид (201Tl), 99мTc-MIBI (2,4,метоксиизобутилизонитрил, «Технетрил» российского производства, “Cardiolite” США) и 99мTc-TF (тетрофосмин), 99мTc-ТЕБО («тебораксим»).
Применение 201Tl основано на его биологическом сходстве с калием, после внутривенного введения он быстро покидает кровеносное русло и поступает в клетки в количествах, пропорциональных исходной величине кровотока. Около 4% введенной дозы на некоторое время проникает в миокард, и благодаря этому сердце хорошо видно на фоне низкой фоновой активности легких. 99мTc-MIBI интенсивно концентрируется в симпатических нервных рецепторах и так как миокард хорошо иннервируется симпатическими волокнами, снижение включения в них 99мTc-MIBI - является показателем дисфункции миокарда.
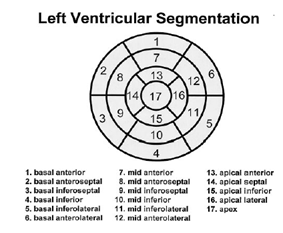
Локальные нарушения перфузии миокарда при проведении однофотонной эмиссионной компьютерной томографии оцениваются по проценту накопления РФП в сегментах миокарда или по 4-х бальной шкале 13-20-ти сегментарной модели ЛЖ: при этом ЛЖ делится на 13 - 20 сегментов по четырем стенкам: передняя, боковая, нижняя и перегородка, и 3 областям: верхушка, средняя треть и основание (рис.1.).
Рис. 1. Перфузионная 17-ти сегментарная карта.
При анализе нарушений локальной сократимости 0 баллов оценивается как нормальная аккумуляция РФП, 1 балл - немного сниженная аккумуляция РФП с захватом более 75% от максимального включения в миокард, 2 балла - от 50 до 75% включения изотопа, 3 балла - значительно выраженные дефекты перфузии менее 50%, 4 балла - от 0 до 25% включения изотопа (рубцовые зоны).
Перфузионнуюсцинтиграфию миокарда выполняют в покое и в сочетании с различными нагрузочными пробами, проведение которых необходимо для выявления бассейна артерии, которая не в состоянии обеспечить адекватное увеличение коронарного кровотока в ответ на увеличение работы сердца.
Показания к применению перфузионной ОФЭКТ миокарда.
Поскольку распределение РФП в миокарде происходит пропорционально коронарному кровотоку и включение его в неповрежденные кардиомиоциты, является отражением нормального кровотока миокарда и при этом будет равномерное изображение распределения РФП в ЛЖ. Отражением ограничения кровотока и ишемического или рубцового повреждения сердечной мышцы будет снижение распределения РФП в той или иной области миокарда, дефект перфузии.
Таким образом, перфузионнаясцинтиграфия миокарда позволяет определить наличие, локализацию, распространенность и тяжесть рубцового или ишемического повреждения миокарда, функциональную значимость анатомического поражения коронарных артерий, выявленного при ангиографии, оценить жизнеспособность миокарда.
С помощью перфузионной сцинтиграфии миокарда возможны:
- диагностика атеросклеротического поражения коронарных артерий (наличие, локализацию, распространенность);
- оценка степени стеноза коронарных артерии и его влияния на регионарную перфузию миокарда;
- оценка жизнеспособности миокарда (ишемические или рубцовые изменения, предсказание об улучшении функции после реваскуляризации);
- оценка (прогноз) степени риска у пациентов: после инфаркта миокарда, для предоперационной оценки степени риска перед большими хирургическими вмешательствами у больных с высоким риском развития коронарных осложнений;
- контроль и оценка эффективности лечения после: коронарной реваскуляризации; медикаментозной терапии сердечной недостаточности или стенокардии, проведения мероприятий по изменению образа жизни.
Нагрузочные пробы, наиболее часто применяемые в сочетании сперфузионной ОФЭКТ миокарда.
Применение нагрузочных проб значительно повышает чувствительность, специфичность и точность диагностики ИБС. В качестве нагрузочных проб применяют пробу с физической нагрузкой, а также фармакологические пробы. У больных со сниженным коронарным кровотоком вследствие нарушения реактивности сосудов или стенозирующего повреждения определяется область сниженной концентрации РФП в зоне сниженной перфузии. Если зона сниженной концентрации РФП появляется или увеличивается при введении его во время физической нагрузки или после введения положительных инохронотропных адренергических препаратов (по сравнению с покоем), то вероятной причиной является ишемия. Если зона сниженной концентрации РФП не меняется ни при нагрузке, ни в покое, наиболее вероятной причиной этого следует считать рубцовое повреждение миокарда.
Перфузионнаясцинтиграфия миокарда в сочетании с пробой с физической нагрузкой (ПФН).
ПФН обычно выполняют на велоэргометре либо на бегущей дорожке (тредмил). Больным с предполагаемой высокой толерантностью к физической нагрузке заранее подбирают начальную ее мощность с тем, чтобы общее время проведения физической нагрузки не превышало 12-15 мин. Во время проведения исследования регистрируют ЭКГ и АД. При достижении критериев прекращения пробы внутривенно вводят РФП, после чего больной продолжает выполнять физическую нагрузку еще в течении 2 мин. для достижения ишемического равновесного состояния, так называемого ischemicsteadystate. При возникновении приступа стенокардии, не купируемого в покое, по возможности вводят РФП до приема нитроглицерина и других антиангинальных препаратов для исключения маскирующего ишемию эффекта. При выполнении ПФН в отсутствии появления достоверных критериев положительной пробы, важным является достижение ЧСС не менее 120-135 уд/мин.
Перфузионнаясцинтиграфия миокардав сочетании с фармакологическими пробами.
При проведении фармакологических проб применяют следующие препараты:
а) препараты, вызывающие вазодилатацию и приводящие к коронарной гиперемии (дипиридамол и аденозин);
б) положительные ино-хронотропные адренергические препараты (добутамин и арбутамин) с целью увеличения потребности миокарда в кислороде.Сосудорасширяющий эффект дипиридамола при проведении фармакологической пробы связан с повышением содержания внеклеточного аденозина и простациклина, в результате чего уменьшаются тонус мелких миокардиальных артерий и артериол и коронарное сосудистое сопротивление, пик которого наступает через 2-5 мин. после внутривенного введения дипиридамола.
Дипиридамол вводят внутривенно медленно в дозе 0,56 мг/кг в течение 4 мин. в положении больного лежа на спине. РФП вводят внутривенно до достижения критериев прекращения пробы. При отсутствии показаний к немедленному купированию эффекта дипиридамола, эуфилин вводится не ранее чем, через 5 мин после введения РФП. Следует учитывать, что побочные эффекты могут возникать в течение 30 мин. после введения дипиридамола.
Пробы с дипиридамолом или аденозином не следует проводить больным с указаниями в анамнезе на бронхоспазм, заболевания легких (бронхиальная астма и легочная гипертензия), интубацию по поводу тяжелой легочной патологии, выраженную гипотонию (систолическое АД менее 90 ммртст), тяжелый клапанный порок сердца и повышенную чувствительность к аденозину и дипиридамолу, а также не следует проводить больным постоянно принимающих метилксантины по поводу бронхообструктивногосндрома, больным с ативентрикулярной блокадой II-III степени или синдромом слабости синусового узла, с ОИМ давностью не более 2-х сут, нестабильной стенокардией с последним приступом, возникшим не более чем за 48 часов до начала исследования.
При использовании препаратов, увеличивающих потребность миокарда в кислороде в качестве нагрузочного теста в клинической практике отдают предпочтение добутамину, синтетическому катехоламину с выраженным действием на β1-рецепторы и слабым влиянием на α- и β2-адренорецепторы. При применении малых доз добутамина (до 10 мг/кг/мин) отмечается отчетливое положительное инотропное действие, обусловленное стимуляцией ?1- и ?-рецепторов. При применении высоких доз (20-40 мг/кг/мин) прогрессивно увеличивается ЧСС за счет стимуляции β1- адренорецепторов. При этом системное АД повышается незначительно за счет увеличения сердечного выброса, а периферическое сопротивление уменьшается. В областях миокарда, снабжаемых кровью артерий с критическим стенозом, вследствие неадекватного притока крови в условиях повышенной потребности миокарда в кислороде, возникает регионарная ишемия, выявляемая при сцинтиграфии. При этом с целью оценки жизнеспособности миокарда добутамин применяют в малых дозах (до 20 мг/кг/мин), а ишемии миокарда - в больших дозах (до 40 мг/кг/мин).
Пробы с инохронотропными препаратами не следует проводить больным с желудочковыми тахиаритмиями, в ранний период ИМ, нестабильной стенокардией, обструктивной гипертрофической кардиомиопатией.
Перфузионнаясцинтиграфия миокардав сочетании с черезпищеводной электрической стимуляцией предсердий (ЧПЭС).
ЧПЭС является безопасной альтернативой ПФН. ЧПЭС проводят в положении больного лежа на спине до достижения ЧСС 160 уд/мин или до появления критериев прекращения стимуляции, после чего в/в вводят РФП. При отсутствии клинической и ЭКГ - критериев ишемии миокарда продолжительность ЧПЭС на последней ступени составляет около 2 мин. После прекращения стимуляции ЧСС практически немедленно возвращается к исходной и признаки ишемии миокарда уменьшаются или исчезают быстро. Поэтому при проведении ЧПЭС в сочетании с перфузионной ОФЭКТ миокарда стимуляцию после введения РФП продолжают не менее 3 мин.
К ограничению пробы относят побочные эффекты виде жжения или болезненной пульсации в подложечной области, или в нижней трети грудины, противопоказана больным с заболеваниями пищевода.
Меры предосторожности при проведении перфузионнойсцинтиграфия миокарда в сочетании с фармакологическими пробами.
Нагрузочные пробы выполняют в радионуклидных отделениях, оснащенных набором инструментом и препаратов для проведения реанимационных мероприятий, исследования должны; проводится в присутствии врача, прошедшее специальное обучение реанимационным мероприятиям. Необходимо постоянное наблюдение за показателями гемодинамики (АД и ЧСС), регистрация ЭКГ в 12 отведениях.
Применение ОФЭКТ миокарда
Чувствительность метода ОЭКТ с 99мTc-MIBI и 201Tl для диагностики ИБС с использованием нагрузочных проб составляет более 90%. Этот метод может быть использован не только для диагностики ишемии миокарда, но и для определения функциональной значимости стеноза коронарных артерий или коллатерального кровотока, обнаруженных при ангиографии. Другое важное применение данного исследования - это оценка прогноза больных с острым инфарктом миокарда, поскольку этот метод позволяет выявить не только степень нарушения перфузии, но и распространенность рубцевания в связи с предыдущими инфарктами миокарда. Особенно информативна ОЭКТ с 99мTc-MIBI и 201Tl при ведении больных, получающих сердечные гликозиды, с блокадой ножек пучка Гиса, т.е. в тех случаях стандартной пробе с нагрузкой не удается провести анализ сегмента ST.
Доказана возможность ОФЭКТ с 99мTc-МИБИ прогнозировать отдаленные исходы заболевания у больных, перенесших острый инфаркт миокарда, так называемую стратификацию риска возникновения коронарного синдрома.
Использование ОФЭКТ с 99мTc-МИБИ с добутаминовым тестом в диагностике постинфарктной аневризмы ЛЖ выявляет не только наличие аневризмы, но и жизнеспособного миокарда в «переходной» ишемизированной зоне.
Доказана информативность сцинтиграфии миокарда с 99мTc-MIBI или 201Tl и эхокардиографии, выполненных в сочетании с введением низких доз допамина, для выявления жизнеспособного миокарда в областях постинфарктного кардиосклероза и прогнозирования восстановления их сократимости после реваскуляризации. Чувствительность выявления жизнеспособности миокарда в областях акинезии методами эхокардиографии и ОФЭКТ с 99мTc-MIBI, выполненных в покое и в сочетании с допаминовой пробой составляет 85% и 92% соответственно. Следовательно, перфузионная ОФЭКТ является не только высокоинформативным методом определения степени и распространенности нарушения кровообращения в миокарде, но и позволяет определять жизнеспособность диссинергичного (гибернирующего) миокарда.
Перикардиальный выпот
Перикардиальный выпот - накопление жидкости в полости перикарда. В большинстве случаев это происходит при перикардите. Однако иногда перикардиальный выпот возможен в отсутствие перикардита, например при микседеме (гипотиреозе) или разрыве сердца. Основное клиническое значение перикардиального выпота - опасность тампонады сердца, когда жидкость «душит» сердце, что может приводить к снижению артериального давления и даже остановке сердца.
В зависимости от характера выпота в перикарде различают: гидроперикард, гемоперикард, хелоперикард.
Острый или хронический выпот в полость перикарда образуется при чрезмерной выработке или уменьшении оттока перикардиальной жидкости, что приводит к ее накоплению в полости перикарда. Причина клинически очевидна только приблизительно в 25% случаев, еще в 25% случаев ее удается установить в ходе дополнительного обследования, но в оставшихся 50% она так и остается неизвестной.
Возможные причины:
- Застойная сердечная недостаточность при других патологических состояниях, таких как ревматизм легочное сердце или кардиомиопатия.
- Состояние после операций на сердце или после инфаркта миокарда.
- Заболевания соединительной ткани (склеродермия, системная красная волчанка, ревматоидный артрит).
- Новообразования: доброкачественные (миксома предсердий); первичные злокачественные (мезотелиома); вторичные злокачественные (например, рак легких или молочной железы).
- Хронические заболевания почек (уремия или гемодиализ) или другие причины гипоальбуминемии.
- Инфекции: острые (энтеровирус, аденовирус, вирус гриппа, Streptococcus pneumonia, Coxiell aburnetti (вызывает Q-лихорадку) или хронические (туберкулез, грибковые инфекции, паразитарные инфекции).
- Лекарственные препараты (прокаинамид, гидралазин) или состояние после лучевого воздействия.
- Тяжелый гипотиреоз с микседемой.
Рентгенография.
Рентгенолог может заподозрить наличие жидкости в перикарде на основании увеличения размеров “сердечной” тени. Однако поскольку увеличение тени сердца может произойти также вследствие его дилатации, одного установления увеличения “сердечной” тени недостаточно для решения вопроса о накоплении жидкости в перикарде. Сложность заключается в том, что рентгенологически за тенью наполненного жидкостью перикардиального мешка не различима тень самого сердца.
Ранним рентгенологическим признаком накопления экссудата в сердечной сорочке является не столько увеличение размеров, сколько изменение силуэта “сердечной” тени.
Треугольная форма тени возникает при длительно существующих хронических перикардиальных выпотах в связи с потерей эластичности наружным листком перикарда. Шаровидная форма тени говорит в пользу более свежего и увеличивающегося в объеме выпота. Характерный признак экссудативного перикардита - ослабление пульсации контура тени. Пульсация аорты остается четкой. При рецидивирующем течении процесса с образованием спаек рентгенологически может выявляться зубчатость сердечных контуров.
Эхокардиография.
Является методом выбора.
Визуализируется скопление жидкости между висцеральным и париетальным перикардом.
Более 1 см расстояние между висцеральной и париетальной плеврой считается массивным плевральным выпотом.
В начале жидкость скапливается сзади.
ОФЭКТ-КТ исследование в онкологии
ОФЭКТ-КТ - это эффективный метод диагностики злокачественных опухолевых заболеваний молочных желез, легких, органов брюшной полости и малого таза, а также их метастазов в лимфатических узлах и костях. О возможностях, области применения и достоинствах этого метода рассказывает Павел Иванович Крживицкий, кандидат медицинских наук, заведующий отделением радионуклидной диагностики НМИЦ онкологии им. Н.Н. Петрова.
Радионуклидная диагностика - раздел ядерной медицины, основанный на выявлении болезней с помощью радиоактивных меток или радиофармпрепаратов. Метод основан на принципе меченых атомов, согласно которому, радиоактивные вещества принимают такое же участие в процессах жизни клетки, как и не радиоактивные. Поэтому изучая распределение радиоактивной метки в организме больного с помощью специальных детектирующих аппаратов, например таких как ОФЭКТ-КТ и ПЭТ-КТ , врач получает возможность увидеть самые начальные проявления опухоли
Как проходит исследование? Пациенту внутривенно вводят радиоактивный препарат, и врач через определенное время с помощью современного оборудования (ОФЭКТ-КТ или ПЭТ-КТ) видит его пространственное распределение в клетках, тканях или органах у обследуемого человека. С помощью современных компьютерных систем формируется изображение, которое анализируют обычно не менее 2 специалистов.

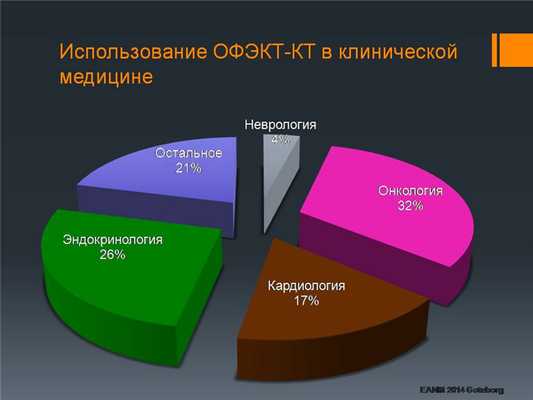
По данным Европейского общества ядерной медицины, треть всех ОФЭКТ-КТ исследований производится в онкологии.
С помощью ОФЭКТ-КТ исследования мы можем определить аномально протекающие биохимические процессы в опухолевых клетках, когда анатомические и морфологические изменения еще не видны и не могут быть выявлены с помощью методов классической лучевой диагностики, таких, как рентгенография или КТ. С помощью методов радионуклидной диагностики сегодня мы можем диагностировать опухоли размерами менее 1 сантиметра.
Главная задача радионуклидных исследований в онкологии - оценка распространенности опухолевого процесса и оценка эффективности лечения.
Основные методы лучевой и радионуклидной диагностики разделяют на две категории
- Рентгенография
- Компьютерная томография (КТ)
- Магнитно-резонансная томография (МРТ)
- Сцинтиграфия
- Однофотонная эмиссионная компьютерная томография (ОФЭКТ)
- Позитронно-эмиссионная томография (ПЭТ)
Гибридные методы сочетают в себе анатомические и функциональные. К ним относится ОФЭКТ-КТ и ПЭТ-КТ. В отделении радионуклидной диагностики НМИЦ онкологии им. Н.Н. Петрова установлен гибридный аппарат «SiemensSymbiaT16». Этот прибор сочетает в себе двухдетекторную гамма-камеру и 16-срезовый компьютерный томограф. В целом информативность ОФЭКТ-КТ выше, чем КТ + ОФЭКТ отдельно. Исследования достаточно безопасны для пациентов.

За одно обследование получается максимум диагностической информации. Например, при раке молочной железы на ОФЭКТ-КТ томографе Siemens за одно исследование мы можем оценить состояние молочной железы, регионарных лимфатических узлов, органов грудной и брюшной полостей. В результате, пациент может начать специфическое противоопухолевое лечение максимально быстро.
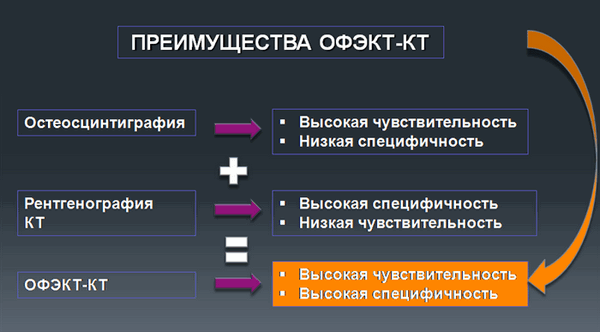
Преимущества ОФЭКТ-КТ
- Позволяет получить трехмерное функциональное изображение
- Высокое качество изображения
- Возможность точной анатомической локализации выявленный патофизиологических процессов
- Возможность одновременной совместной оценки выявленных функциональных и структурных нарушений
Диагностика метастатического поражения скелета
Наибольшее распространение этот метод получил в исследовании костей. ОФЭКТ-КТ исследование объединяет преимущества остеосцинтиграфии - высокую чувствительность и рентгенографии - высокую специфичность.
В результате ОФЭКТ-КТдиагностики могут быть выявлены новые уточняющие данные и даже может измениться диагноз. По опыту отделения радионуклидной диагностики НМИЦ онкологии им. Н.Н. Петрова: после рутинной остеосцинтиграфии в 40% случаев изменялся диагноз.
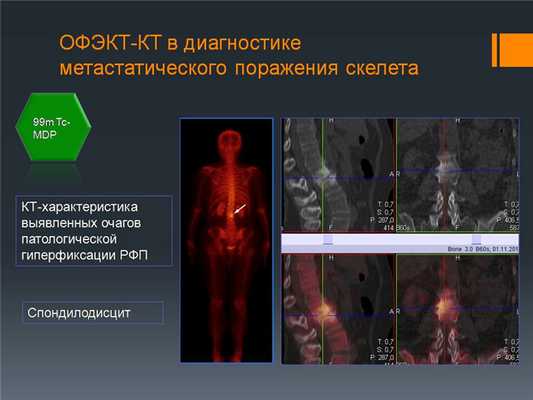
Пример уточняющей диагностики: При КТ-исследовании выявлен очаг, подозрительный на метастазы в 3 поясничном позвонке. После выполнения ОФЭКТ-КТ видно, что это спондилодисцит позвоночника, не онкологическое заболевание.
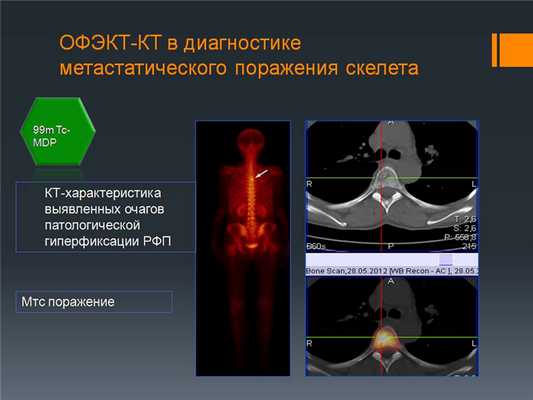
Пример уточняющей диагностики: Выявлен очаг гиперфиксации подозрительный на мтс. На снимке ОФЭКТ-КТ подтверждается, что это метастазы.
Диагностика метастатического поражения регионарных лимфоузлов у больных РМЖ
Статус регионарных лимфатических узлов влияет не только на прогноз, но и на выбор лечебной тактики, на объем лучевой терапии. При поражении лимфоузлов лучевая терапия может проводиться в над- и подключичной области. А при отсутствии метастазов облучается только грудная стенка и даже возможно полное отсутствие лучевой терапии.
Биопсия сигнальных лимфоузлов у больных РМЖ
Современное лечение РМЖ немыслимо без методов радионуклидной диаг ностики. Известно, что состояние сигнального лимфоузла определяет состояние всех остальных лимфоузлов. При помощи ОФЭКТ-КТ можно анатомически точно определить сигнальный лимфоузел. Во-первых, это помощь для хирурга: точная локализация позволяет ему быстрее обнаружить нужный лимфоузел. Во-вторых, результат исследования облегчает навигацию при последующей лучевой терапии.
ОФЭКТ-КТ также успешно применяется в диагностике нейроэндокринных новообразований, в диагностике метастазов при раке предстательной железы.

Авторская публикация:
Крживицкий Павел Иванович
врач-рентгенолог, врач-радиолог, кандидат медицинских наук.
Заведующий отделением радионуклидной диагностики, cтарший научный сотрудник отдела ядерной медицины и радиационной онкологии
Что вам необходимо сделать
Если вы хотите узнать побольше о бесплатных возможностях ФБГУ НМИЦ онкологии им. Н.Н. Петрова Минздрава России, получить очную или заочную консультацию по диагностике и лечению, записаться на приём, ознакомьтесь с информацией на официальном сайте.
Если вы хотите общаться с нами через социальные сети, обратите внимание на аккаунты в ВКонтакте и Одноклассники.
Экссудативный перикардит ( Выпотной перикардит )
Экссудативный перикардит - это воспаление серозного перикарда, сопровождающееся накоплением выпота в перикардиальном пространстве. Признаками экссудативного перикардита могут быть тяжесть и боль в груди, одышка, дисфагия, кашель и осиплость голоса, отечность лица, набухание шейных вен, симптомы сердечной недостаточности и тампонады сердца. Установить диагноз помогают результаты рентгенографии, ЭхоКГ и ЭКГ, мультиспиральной КТ, пункции перикарда. Лечение включает прием НПВС, кортикостероидов, терапию основного заболевания (антибиотики, цитостатики, противотуберкулезные препараты и т.д.), по показаниям - пункцию перикарда, перикардэктомию.
МКБ-10

Общие сведения
Экссудативный (выпотной) перикардит протекает как осложнение или клиническое проявление различных заболеваний сердца, легких и других внутренних органов. Формирование экссудативного перикардита в большинстве случаев включает стадию сухого перикардита, реже экссудат накапливается в перикардиальной щели с самого начала. Образование экссудата обусловлено повышением проницаемости сосудов серозной оболочки сердца при воспалительном процессе в перикарде.
Причины
Экссудативный перикардит редко наблюдается как самостоятельная патология, обычно он является частным проявлением полисерозита или следствием другого заболевания, приводящего к повреждению перикарда. По происхождению выделяют инфекционные (специфические и неспецифические), неинфекционные (иммуногенные, токсические, механические) и идиопатические экссудативные перикардиты.
Инфекционные перикардиты
Неспецифические инфекционные перикардиты чаще вызываются:
- кокковыми формами бактерий (стафилококком, стрептококком, пневмококком)
- вирусами (гриппа, ECHO, Коксаки).
Специфические перикардиты могут быть этиологически связаны с возбудителями:
- туберкулеза;
- брюшного тифа;
- бруцеллеза;
- туляремии;
- грибковых инфекций (при кандидозе, гистоплазмозе);
- паразитарных заболеваний (при амебиазе, эхинококкозе);
- риккетсиозов.
Туберкулезный экссудативный перикардит часто возникает при лимфогенном проникновении микобактерий из средостенных и трахеобронхиальных лимфоузлов в перикард. Гнойный экссудативный перикардит может развиться после операций на сердце, при инфекционном эндокардите, на фоне иммуносупрессивной терапии, при прорыве абсцесса легкого.
Неинфекционные перикардиты
Во многих случаях этиологию неинфекционного экссудативного перикардита установить не удается. Среди диагностированных причин по распространенности лидируют:
- злокачественные опухоли перикарда (мезотелиома);
- инвазии и метастазы при раке легкого, раке молочной железы, лейкозах, лимфоме;
- диффузные заболевания соединительной ткани (ревматизм, системная красная волчанка);
- аллергические процессы (сывороточная болезнь);
- уремия в терминальной стадии ХПН;
- облучение средостения;
- ранние сроки инфаркта миокарда (эпистенокардический перикардит);
- гипотиреоз;
- нарушении холестеринового обмена (ксантоматозный перикардит).
Патогенез
Гемодинамическое значение выпота при экссудативном перикардите зависит от объема, скорости поступления жидкости и адаптивного потенциала наружного листка перикарда. При медленном поступлении экссудата за счет растяжения и увеличения объема перикарда внутриперикардиальное давление и внутрисердечная гемодинамика длительное время заметно не изменяются. При экссудативном перикардите может накапливаться до 1-2 л жидкости, приводящей к сдавлению прилегающих к сердцу органов и нервных путей.
При быстром накоплении выпота и невозможности перикарда увеличить свой объем отмечается существенный подъем давления в перикардиальной полости и развитие тампонады сердца. Выпот при экссудативном перикардите со временем может подвергаться организации с замещением грануляционной тканью, приводящим к утолщению перикарда с сохранением перикардиального пространства или его облитерацией.
Классификация
По клиническому течению экссудативный перикардит может быть острый или хронический; сопровождающийся развитием тампонады сердца или без таковой. По составу воспалительной жидкости различают:
- Серозный перикардит. Экссудат образуется на ранних стадиях воспаления и состоит преимущественно из воды и альбуминов
- Серозно-фиброзный. Имеет значительное число нитей фибрина
- Геморрагический. Связан с тяжелым повреждением сосудов и включает большое количество эритроцитов
- Гнойный. Содержит много лейкоцитов и фрагменты некротизированных тканей.
- Гнилостный. Ихорозный экссудат возникает при попадании в воспалительный выпот анаэробной микрофлоры.
Симптомы экссудативного перикардита
Проявления экссудативного перикардита зависят от скорости накопления жидкости, степени сдавления сердца и выраженности воспалительного процесса в перикарде. Вначале основными жалобами являются тяжесть и ноющие боли в грудной клетке. По мере накопления жидкости в полости перикарда, в связи с механическим сдавлением рядом расположенных органов, возникает одышка, дисфагия, лающий кашель, осиплость голоса.
Характерна отечность лица и шеи, набухание шейных вен на вдохе, постепенное развитие симптомов сердечной недостаточности. Шум трения перикарда не характерен, но может выслушиваться при умеренном выпоте в определенном положении тела больного. Имеют место общие проявления, связанные с причиной развития экссудативного перикардита: при инфекционном генезе - озноб, лихорадка, интоксикация; при хроническом туберкулезном процессе добавляется потливость, отсутствие аппетита, похудание, гепатомегалия.
При гнойном экссудативном перикардите возможны инфекционные очаги в близлежащих органах, септический процесс. Эпистенокардический экссудативный перикардит возникает в течение 4-хсуток суток после инфаркта миокарда и проявляется одышкой, ортопноэ, набуханием шейных вен. Ревматический перикардит обычно развивается на фоне тяжелого панкардита; уремический - сопровождается клинической картиной ХПН.
В случае опухолевого генеза перикардит сопровождается обильным выпотом, болью в груди, предсердными аритмиями, развитием тампонады сердца. При большом объеме выпота больные вынужденно принимают сидячее положение, что облегчает их состояние.
Диагностика
У больных с экссудативным перикардитом отмечается небольшое выбухание передней грудной стенки и легкая отечность в прекадиальной области, ослабление или исчезновение верхушечного толчка, расширение границ относительной и абсолютной сердечной тупости, притупление перкуторного тона под углом левой лопатки. О развитии тампонады сердца свидетельствует увеличение ЦВД, падение АД, тахикардия с преходящей аритмией, парадоксальный пульс.
Установить диагноз экссудативного перикардита и дифференцировать его от других заболеваний сердца (острого инфаркта миокарда, острого миокардита) помогают:
- Рентгенография грудной клетки. На рентгенограмме при значительном объеме жидкости наблюдается увеличение тени и сглаживание сердечного контура, изменение формы сердца (треугольная - при длительно существующем хроническом экссудате), ослабление пульсации сердца. Мультиспиральная КТ подтверждает наличие патологического выпота и утолщение перикардиальных листков.
- Эхокрдиография. Наиболее точный и специфичный метод диагностики экссудативного перикардита даже с небольшим объемом выпота - ЭхоКГ, визуализирующая наличие эхонегативного (свободного) пространства между листками перикарда, диастолическую сепарацию париетальной пластинки и эпикарда, утолщение перикарда. В тяжелых случаях отмечается нарушение ритмичных движений сердца, при тампонаде - диастолический коллапс правых отделов сердца.
- Электрокардиография. ЭКГ в случае экссудативного перикардита выявляет снижение амплитуды всех зубцов.
- Пункция перикарда. Для уточнения причины экссудации и верификации диагноза экссудативного перикардита выполняют пункцию перикарда и исследование характера перикардиальной жидкости (общеклиническое, бактериологическое, цитологическое, анализ на AHAT и LE-клетки). Возможно проведение биопсии перикарда с морфологическим исследованием полученной ткани.

Лечение экссудативного перикардита
Лечение экссудативного перикардита проводят в стационаре, тактика ведения больных определяется объемом и этиологией патологии, выраженностью гемодинамических нарушений. При остром процессе в перикарде необходим мониторинг показателей АД, ЧСС, ЦВД.
- Фармакотерапия. Для снятия болевого синдрома, лихорадки и более скорого рассасывания выпота при экссудативном перикардите назначают НПВС (ибупрофен, индометацин), глюкокортикостероиды (преднизолон). Проводят активное лечение основного заболевания с применением антибактериальных, противотуберкулезных, цитостатических препаратов, проведением гемодиализа и т. д.
- Пункция перикарда. Показана для эвакуации большого скопления жидкости, не рассасывающейся в течение 2-3 недель; при тампонаде сердца и гнойном перикардите. Если после повторных пункций и дренирования перикардиальный выпот продолжает быстро накапливаться, выполняют перикардэктомию, торакоскопическую фенестрацию.
Прогноз и профилактика
Основным осложнением острого экссудативного перикардита является тампонада сердца; в 30% случаев при распространении воспаления на миокард предсердий может возникать пароксизмальная мерцательная аритмия или суправентрикулярная тахикардия. Возможен переход экссудативного перикардита в хронический и констриктивный. В случае развития тампонады сердца существует высокий риск летального исхода. Прогноз экссудативного перикардита зависит от причины поражения перикарда и своевременности лечения; при отсутствии тампонады сердца он относительно благоприятный.
Профилактика экссудативного перикардита заключается в предупреждении и ранней этиопатогенетической терапии тех заболеваний, которые могут приводить к его развитию. В этой связи вопрос профилактики экссудативного перикардита является актуальным не только для кардиологии, но и ревматологии, пульмонологии и фтизиатрии, онкологии, аллергологии.
Констриктивный перикардит
Констриктивный перикардит - фиброзное утолщение листков перикарда и облитерация перикардиальной полости, приводящие к сдавлению сердца и нарушению диастолического наполнения желудочков. Констриктивный перикардит проявляется слабостью, одышкой при физических нагрузках, одутловатостью и цианозом лица, набуханием шейных вен, гепатомегалией, асцитом, отеками. Диагноз констриктивного перикардита подтверждается данными лабораторного исследования, ЭКГ, ЭхоКГ, рентгенографии, КТ и МРТ сердца, зондирования полостей сердца. При констриктивном перикардите показано хирургическое лечение - перикардэктомия.
Констриктивный перикардит относится к числу адгезивных перикардитов и является наиболее тяжелой формой перикардиальной патологии. Распространенность констриктивного перикардита не превышает 1 % от всех заболеваний сердечно-сосудистой системы. У мужчин констриктивный перикардит встречается в 3-5 раз чаще, обычно заболевание развивается в возрасте 20 - 50 лет. Синонимами констриктивного перикардита в кардиологии служат понятия «сдавливающий перикардит», «панцирное сердце».
Причины констриктивного перикардита
Констриктивный перикардит может быть вызван недавно перенесенным острым или хроническим экссудативным перикардитом различного генеза. Самым распространенным этиологическим фактором констриктивного перикардита (в 30% случаев) является туберкулез, реже бактериальная, вирусная и грибковая инфекции.
Возникновение констриктивного перикардита может быть связано с ранениями, травмами грудной клетки, облучением средостения, новообразованиями (лимфогрануломатозом, раком молочной железы). Констриктивный перикардит может развиться спустя несколько недель или месяцев после кардиохирургического вмешательства. В ярде случаев констриктивный перикардит выступает как осложнение диффузных заболеваний соединительной ткани (ревматоидного артрита, системной красной волчанки) и терминальной почечной недостаточности (у больных на хроническом гемодиализе).
В настоящее время растет число случаев идиопатического констриктивного перикардита, причина которого остается неизвестной.
Патогенез констриктивного перикардита
Образование грубой рубцовой ткани при констриктивном перикардите приводит к уплотнению и уменьшению размеров перикарда, сдавливающего сердце и мешающего нормальному расширению и наполнению желудочков во время диастолы. Отложение кальция в перикарде встречается при длительном течении констриктивного перикардита и может быть сплошным («панцирное сердце») и ограниченным, в виде фиброзно-известковой полосы по атриовентрикулярной борозде, вокруг полых или легочных вен.
При констриктивном перикардите склеротическому поражению подвергается также сердечная мышца и окружающие органы: плевра, диафрагма, субдиафрагмальная брюшина, печеночная и селезеночная капсулы, стволы венечных артерий с развитием диффузного миофиброза и коронарной недостаточности. Утолщенный обызвествленный перикард при констриктивном перикардите может прирастать диафрагме, плевре и тканям средостения, сдавливать верхнюю и нижнюю полые вены, портальную вену.
Ограничение наполнение правого желудочка во время диастолы и венозного возврата в правое предсердие способствует повышению давления в системных венах и развитию правожелудочковой недостаточности. Частичное наполнение левого желудочка при констриктивном перикардите приводит к снижению ударного объема, сердечного выброса и артериального давления. Вследствие снижения рабочей нагрузки на мышечные волокна наблюдается атрофия миокарда и уменьшение массы сердца.
Симптомы констриктивного перикардита
В большинстве случаев констриктивный перикардит имеет постепенно прогрессирующее течение, включающее 4 периода: скрытый, начальный, выраженных клинических проявлений и дистрофический. Во время скрытого периода констриктивного перикардита (продолжительностью от нескольких месяцев до нескольких лет) отмечаются остаточные явления перенесенного острого или первично хронического перикардита, формирование в перикардиальной полости легких спаек, не оказывающих негативного влияния на работу сердца и общую гемодинамику.
Фиброзное сдавление сердца с постепенным нарушением гемодинамики в начальном периоде констриктивного перикардита характеризуется появлением общей слабости, стабильной непереносимости физических нагрузок; развитием утомляемости и одышки при ходьбе и физическом напряжении. Наблюдаются одутловатость и цианоз кожных покровов лица, шеи, ушных раковин, набухание шейных вен, повышение центрального венозного давления (ЦВД), тахикардия, пульс малого наполнения и приглушенные тоны сердца. Начальный период заболевания сопровождается гепатомегалией, тяжестью в правом подреберье, вздутием живота, потерей аппетита, диспепсией, похуданием.
В период выраженных клинических проявлений констриктивного перикардита отмечается сильная слабость, резкий и стойкий подъем ЦВД (более 250-300 мм вод. ст.), усиление отечности и цианоза лица и шеи («консульская голова»), развитие значительного асцита. При констриктивном перикардите ортопноэ обычно отсутствует, его развитие возможно при сопутствующем гидротораксе или высоком стоянии диафрагмы вследствие асцита.
В дистрофической стадии у больных констриктивным перикардитом отмечается крайнее ухудшение общего состояния с резким истощением, дегенеративными изменениями в органах и тяжелыми функциональными нарушениями печени, выраженным астеническим синдромом, отеками нижних и верхних конечностей, лица и тела. Развиваются атрофия скелетных мышц, контрактуры крупных суставов и трофические язвы, у большинства больных наблюдается нарушение сердечного ритма.
Возможными осложнениями констриктивного перикардита являются мерцательная аритмия (у 70% больных), миокардиальная недостаточность, кардиальный цирроз печени, нефротический синдром, экссудативная энтеропатия, при длительном течении заболевания - «панцирное сердце».
Диагностика констриктивного перикардита
Диагностике констриктивного перикардита помогает изучение анамнеза, проведение физикального осмотра, лабораторного исследования, ЭКГ, ЭхоКГ, рентгенографии, КТ и МРТ сердца, биопсии миокарда, зондирования полостей сердца.
Физикальное обследование больного констриктивным перикардитом выявляет гепатомегалию, выраженный асцит, периферические отеки, одутловатое лицо с цианотичным оттенком (синдром верхней полой вены), резкое набухание шейных вен, усиливающееся на вдохе (признак Куссмауля). Характерно высокое ЦВД, стойкая тахикардия, снижение пульсового давления, малый мягкий (иногда парадоксальный) пульс, отсутствие верхушечного толчка, добавочный перикард-тон.
Изменения при констриктивном перикардите, выявляемые во время ЭКГ, подтверждают вовлечение миокарда в воспалительный и рубцовый процессы, развитие атрофии сердечной мышцы и гипертрофии предсердий. Результаты ЭхоКГ, полученные у больных констриктивным перикардитом, демонстрируют утолщение перикарда, наличие перикардиальных сращений, отсутствие увеличения размеров сердца, парадоксальное движение межжелудочковой перегородки.
Рентгенография сердца позволяет определить уменьшение размера сердца, обеднение рисунка корней легких, наличие отложения в перикарде очагов кальция, расширение верхней полой вены, экстракардиальные сращения, плевральный выпот. Биохимическое исследование крови у значительной части больных констриктивным перикардитом обнаруживает признаки функциональных нарушений печени: гипоальбуминемию, протеинурию, повышение уровня билирубина и мочевины, увеличение бромсульфолеиновой пробы.
С целью уточнения диагноза констриктивного перикардита выполняют МСКТ и МРТ, вентрикулографию, зондирование полостей сердца. В наиболее сложных случаях прибегают к диагностической торакотомии для непосредственного осмотра перикарда.
Дифференциальная диагностика
Дифференциальный диагноз констриктивного перикардита проводят с:
- заболеваниями миокарда (тяжелым миокардитом, дилатационной и рестриктивной кардиомиопатией, ИБС, эссенциальной артериальной гипертензией),
- поражениями сердца при амилоидозе, гемохроматозе, саркоидозе и системной склеродермии;
- хроническим легочным сердцем;
- недостаточностью трикуспидального клапана, митральным стенозом; миксомой правого предсердия;
- циррозом и раком печени,
- тромбозом воротной или печеночной вены.
Лечение констриктивного перикардита
При констриктивном перикардите консервативная терапия неэффективна, единственный радикальный метод лечения - перикардэктомия, заключающаяся в как можно более полном удалении околосердечной сумки и освобождении сердца и сосудов от сдавления. Перед проведением операции показаны низкосолевая диета и прием диуретиков. Полное хирургическое иссечение обызвествленного и припаянного к сердцу перикарда связано с риском перфорации стенок сердца, травмы коронарных артерий и полых вен, опасностью кровотечения. Летальность при перикардэктомии составляет 5%.
При констриктивном перикардите туберкулезного генеза противотуберкулезные препараты показаны до и после перикардэктомии. После операции проводится медикаментозная и физическая реабилитация больных для ликвидации застойных процессов и улучшения функционального состояния миокарда.
Улучшение самочувствия после перикардэктомии может наступить сразу или спустя некоторое время, необходимое для стойкого восстановления нормальной сердечной деятельности. Перикардэктомия недостаточно эффективна при развитии необратимых изменений в миокарде и печени.
Прогноз констриктивного перикардита
При неоперированном констриктивном перикардите или отсутствии эффекта от перикардэктомии отдаленный прогноз в целом неблагоприятный. Хирургическое лечение констриктивного перикардита может обеспечить 10-15 летнюю выживаемость: при отсутствии декомпенсации - с возможностью заниматься физическим трудом, при наличии остаточных явлений сердечной недостаточности - с получением группы инвалидности.
Читайте также:
- Курс лечения климакса эстрогенами. Эффективность эстрогенов при климактерическом синдроме
- Иммунитет. Виды иммунитета. Виды иммунной реактивности организма.
- Слуховая кора. Переработка сенсорной информации в слуховой коре.
- Антигенная структура гонореи. Антигены гонококков. Генетические характеристики гонококков. Плазмиды гонококков.
- Гипероксалурическая хроническая обструктивная болезнь легких.
