Перспективы развития глубокой стимуляции мозга
Добавил пользователь Валентин П. Обновлено: 22.01.2026
Как работают уже существующие способы терапии с помощью имплантов для мозга и чем они могут уступать Neuralink.
29 августа Маск показал вторую версию своего проекта нейроинтерфейса Neuralink — чип Link, размером с монету. Его успешно имплантировали свиньям для считывания мозговой активности.
Link подключается к мозгу с помощью тонких гибких нитей с электродами. Он обрабатывает информацию чипом-имплантом, а управлять им можно через мобильное приложение.
Маск заявляет, что в первую очередь Neuralink поможет лечить болезнь Альцгеймера, паралич, деменцию и другие заболевания, а в будущем позволит телепатически общаться, управлять устройствами и играть в игры.
Во время презентации Маск сравнил проект с другими современными разработками, которые используют имплантацию в мозг для лечения болезней — Utah Array и глубокой стимуляцией мозга.
BrainGate — это система инвазивных мозговых имплантатов, предназначенная для помощи людям, которые потеряли, например, контроль над конечностями.
Она состоит из внешнего декодирующего устройства, подключенного к протезам или другим приборам, и системы датчиков, имплантируемой в мозг. Датчики представляют собой матрицу микроэлектродных жёстких игл, выполненных по технологии Utah Array, которую разработали в 1990-х годах.
Utah Array считается отраслевым стандартом, который используют более 500 лабораторий в своих проектах.
Матрица микроэлектродных игл позволяет создавать каналы передачи информации от мозга к компьютеру размером до 256 электродов и распознавать сигналы нейронов в областях мозга. Особое внимание BrainGate уделяет области мозга, отвечающей за моторные функции.
Информация с датчиков преобразует мозговую активность в электросигналы, которые передаются на декодер и перерабатываются в команды для внешнего прибора, например, протеза руки или bluetooth-передатчика, эмулирующего компьютерную мышь.
Через BrainGate человек может управлять объектами с помощью мозговых команд.
Разработкой BrainGate занимались исследователи факультета нейробиологии Брауновского Университета совместно с Cyberkinetics — дочерней биотех-компанией университета, которая производила медицинское оборудование.
Первые эксперименты по имплантации микроэлектродной матрицы в мозг человека ученые провели в 2002 году. А после одобрения FDA в 2004 году начали проводить клинические испытания системы на четырёх парализованных пациентах.
Несмотря на успех, ученые не смогли построить жизнеспособную бизнес-модель, отмечает нейроинженер Михаил Лебедев. Инвестиции Cyberkinetics начали сокращаться, производителю пришлось переключаться на более коммерчески успешные проекты, а в 2008 году полностью отказаться от BrainGate.
BrainGate был продан компании BlackRock Microsystems, которая производит датчики и оборудование для сбора данных. Ей же принадлежит и производство матрицы Utah Array.
BlackRock продолжила разработки BrainGate: в 2009 году началась вторая фаза клинических испытаний BrainGate2, которая продолжается до сих пор.
Периодически BrainGate публикует результаты тестов, например, в 2012 году двое парализованных смогли управлять роботизированными руками. Одна из испытуемых, Кэчи Хатчинсон, впервые за 15 лет смогла пить без посторонней помощи.
В публикации 2018 года BrainGate рассказала о трёх участниках клинических испытаний, которые смогли пользоваться планшетом силой мысли: читать почту, писать в мессенджерах, слушать музыку и обмениваться видео.
Они успешно пользовались интернетом, проверяли погоду и покупали в онлайне. Один из участников эксперимента сыграл отрывок из «Оды радости» Бетховена на цифровом пианино.
В исследованиях участвуют ученые из Университета Брауна, Массачусетская больница, Гарвардская медицинская школа, немецкий аэрокосмический центр и другие организации. Финансирование исследований BrainGate проходит из федеральных и благотворительных источников, указано на сайте организации.
Одна из особенностей технологии Utah Array — микроэлектродные иглы, из которых состоит имплантат. Они слишком жёсткие. Это ограничивает число доступных для подключения нейронов, а также мешает долгосрочной работе, так как мозг может отторгать внешние раздражители.
В феврале 2020 года Маск в Twitter сравнил Utah Array со «средневековым орудием пыток», признав, что хоть исследователи уже используют технологию на людях, нетрудно сделать её лучше.
На презентации Neuralink в августе предприниматель вновь сравнил свой проект с Utah Array и назвал несколько проблем старой технологии:
- В массиве может быть не более 100 каналов (электронов).
- Иглы имплантируются в мозг массово — иногда вручную с помощью пневмомолотка, так как электроды механически не входят в нервную ткань.
- Из головы торчат большие коробки и провода, что может вызвать риск получить инфекцию.
- Для использования больному нужен медицинский специалист.
Neuralink решает эти проблемы, заявляет Маск. Например, вместо игл стартап использует тонкие полимерные нити с электродами, которые по одиночке подключаются к мозгу с помощью специального «швейного» робота. Это позволяет упростить и обезопасить установку импланта.
Также Neuralink разработал специальный чип, который занимается обработкой данных, полученных от мозга, — он помещается под кожу и полностью скрывается после имплантации в отличие от существующих разработок на базе Utah Array.
Neuralink совершает технологические прорывы в разработке нейроинтерфейса, хотя не предлагает ничего кардинально нового в научном плане, считает нейробиолог Михаил Лебедев.
В разговоре с «Медузой» в 2019 году он заявил, что хоть сверхновых идей в научном плане Neuralink не несёт, у компании есть деньги и технологии, которые вполне могут помочь совершить научный прорыв.
Deep Brain Stimulation — это метод хирургического лечения болезни Паркинсона, ОКР, эпилепсии, синдрома Туретта и других двигательных расстройств.
В мозг больного имплантируются электроды, которые посылают высокочастотные электрические импульсы в определенные участки мозга, а также генератор импульсов и провод, который проходит от головы под кожей за ухом к ключице или животу.
DBS напрямую регулирует деятельность мозга. Его принцип и механизм работы до сих пор до конца неясен и обсуждается врачами, но метод действительно помогает пациентам смягчить симптомы или уменьшить побочные эффекты от лекарств. К 2018 году глубокой стимуляцией мозга воспользовались более 150 тысяч человек.
Процедура одобрена FDA в 1997 году и постепенно расширяется для новых болезней: например, в 2003 году DBS одобрили для лечения дистонии, в 2009 году — для ОКР, а в 2018 году — для эпилепсии.
DBS — рискованная операция, которая может нести осложнения: кровотечение, занесение инфекции. А также нейропсихиатрические побочные эффекты: апатию, галлюцинации, депрессию и другие расстройства. Однако большинство из них могут быть временными.
Могут возникнуть проблемы и во время хирургического вмешательства — так как мозг человека движется внутри черепа, часть электродов могут сместиться и вызвать необратимые последствия, включая изменение личности.
Маск отмечает, что DBS несет огромную пользу больным, но у процедуры есть свои недостатки:
- Всего к мозгу подключаются лишь 8-16 электродов. Чем их больше, тем больше обрабатывается информации между мозгом и компьютером, что даёт больше возможностей для развития технологии.
- Терапия направлена только на лечение прямым воздействием, она не позволяет читать и записывать информацию мозговой активности.
- Она не всегда срабатывает и напрямую влияет на работу мозга.
Deeplink же может помочь ученым не только стимулировать мозг, но и задействовать обратную связь и записывать его реакцию, отмечает нейробиолог Михаил Лебедев.
Например, включать стимулятор только по мере необходимости, вместо «тупого» стимулирования, которое сейчас используется для болезни Паркинсона.
Сейчас Neuralink не подходит для глубокой стимуляции, так как работает только с корой мозга, но перейти к этому можно достаточно быстро, заключает учёный.
В этом вся суть Маска.
Вопрос в идеях, их финансировании и воплощении.
Маск сделал революцию в космической отрасли. Сначала США, а потом и другие страны пересмотрели свой взгляд на частную космонавтику, туда были инвестированы миллиарды, созданы сотни компаний: в США, Европе, Китае.
Частная космонавтика привлекла к себе частный капитал, в ней стали пытаться воплощать ранее казавшимися безумные идеи
Та же ситуация с электротранспортом — казалось, что это безумие сопоставимое с частными ракетами, но Маск почти единолично изменил правила игры, — теперь почти все главные автопроизводители (кроме Тойоты, лол) связывают свое будущее с электромобилями, Тесла строит чуть ли не каждый год завод по выпуску сотен тысяч машин. Миллиарды инвестируются в системы автопилота и новые технологии хранения энергии.
Если Маск проделает такой же фокус и со стимуляторами мозга, то он окажется у истоков еще одной революции, кроме энергетики, транспорта, космонавтики, он еще и коренным образом изменит медицину!
О каком перевороте в космонавтике, да еще и частной, идет речь? В космос как нечего было запускать, так и сейчас задач не появилось. Маск хайпожорил на Луне и Марсе, но, видать, триллионы баксов под это дело с неба к нему в карман падать не спешат)) Придумал внятный "утилизатор" пусков - низкоорбитальный инет - ок. Кто и зачем хотя бы Старлинку будет создавать конкуренцию?
А туристическую космонавтику как до него неспеша пилили без кукареканья, так и пилят
По Нейролинку спец сказал то же самое, что и я раньше. Придумали, как засунуть в мозг кучу датчиков, но понятия не имеют, что с получаемой с них инфой делать. Это "управление рукой" из видео - примитив. А грезят чтением и записью мыслей 🤦🏻♂️ Марс - и тот ближе))
Согласен, это главная проблема и лишь Маск, хотя бы гипотетически, но предложил ее решение.
Космическая отрасль это довольно убогенький бизнес т.к. там, собственно, сложно быть busy.
Поэтому Маск и начал с first principles, со снижение стоимости доставки груза, а также демонстрации принципиальной возможности работы частной космической компании.
Успешность реализации проекта Фэлкон 9 уже позволила начать до этого немыслимый проект вроде Старлинка, а реализация Старшипа откроет для человечества совершенно новые горизонты.
Нейралинк это имплантант в мозг, это медицина, и в эту отрасль нужны инвестиции, ей нужен пиар, ей нужен свой Маск. В этом суть, а не в футуристическом киберпанке.
Суть Маска в революциях. Разговоры о Марсе это лишь "оправдание" для создания очень дешёвой многоразовой сверхтяжелой ракеты.
Сказки об полном автопилоте для электрокаров это лишь часть плана по инвестированию в технологии хранения энергии. Хороших батарей нет как сейчас, так и не было15 лет назад, когда он только начинал с Тесла. Но благодаря Маску, возможно, они появятся, а без них ни о какой массовости EV речь идти не может.
Та же ситуация и с Нейролинк, Маск предлагает инвестировать в это, попробовать, разумеется никто понятия не имеет, как работает мозг, но без сверхусилий, к которым призывает Маск, мы не сдвинимся с мёртвой точки.
Он мыслимый, весь вопрос - при каких параметрах (стоимость запуска, обслуживания, абонентской платы, числа клиентов) будет окупаемость и прибыль. К счастью, в современных США этими скучными цифрами можно не забивать себе голову, когда компания выпускает акции на биржу))
многоразовой сверхтяжелой ракеты
Для какой нагрузки это чудо нужно?
Сказки об полном автопилоте для электрокаров
Автопилоты успешно создаются другими компаниями без сказок. Вообще, Тесла на этом поприще давно и плотно посасывает, с завидным постоянством въезжая в фуры)) Без лидара автопилотирование заканчивается кладбищем, к сожалению
без сверхусилий, к которым призывает Маск, мы не сдвинимся с мёртвой точки
В статье указан уже разрешённый к использованию на человеке имплантат. Двигал бы с мёртвой точки его научную базу. Сейчас всё упирается не в технико-билологические ограничения этого имплантата, а в непонимание: что с получаемой инфой делать. И, тем более, как проводить "запись" со стимуляторов в мозг
Я говорю о том, что он технически был неосуществим без Фэлкон 9.
На какой ракете можно было за 11 пусков запустить 650 спутников меньше чем за год?
Для какой нагрузки это чудо нужно?
Будет запускать пачками sample return missions к разным телам Солнечной Системы, а потом продавать образцы на Земле на аукционах.
Автопилоты успешно создаются другими компаниями без сказок
Тесла и не создавалась для автопилота, просто так совпало, что одновременно технологии созрели.
Сейчас всё упирается не в технико-билологические ограничения этого имплантата, а в непонимание: что с получаемой инфой делать
Сейчас все упирается во все. Зачем это нужно, как и т.д. также как и скосмонавтикой и электрокарами.
Едва ли они что смогут там нормальное сделать, но вот поковыряться мозг - самое то. Там же проблема в количестве электродов, у нейралинка их уже 1000, попробуют сделать 10 000, 100 000, вдруг че и выйдет
Применение глубокой стимуляции головного мозга в лечении болезни Паркинсона
Данный обзор литературы направлен на исследование тенденций в использовании наиболее эффективной и распространенной формы нейромодуляции, а именно глубокой стимуляции мозга, с конкретным применением к болезни Паркинсона.
Ключевые слова: болезнь Паркинсона, глубокая стимуляция головного мозга.
Болезнь Паркинсона — хроническое нейродегенеративное заболевание, вызванное прогрессирующим разрушением и гибелью нейронов, вырабатывающих нейромедиатор дофамин, и вызывающее моторные нарушения: мышечную ригидность, гипокинезию, тремор покоя, постуральную неустойчивость. Так же характерны немоторные проявления: боль, парестезии, сенсорные аномалии, вегетативная дисфункция, нарушения поведения и сна [1].
На протяжении многих лет основным лечением болезни Паркинсона является терапия леводопой [2], чья эффективность несомненна, однако приводит к леводопа-индуцированным дискинезиям [3]. Появление осложнений, связанных с леводопой, и резистентных к ней симптомов вызывает потребность в разработке лучших методов лечения, в частности в исследовании различных форм нейромодуляции. В 1987 году при проведении стереотаксической таламотомии было замечено, что высокочастотная стимуляция способна остановить экстрапирамидный тремор [4]. Впоследствии в 1994 году впервые была применена глубокая стимуляция мозга в качестве лечения болезни Паркинсона [5]. Клинические испытания показывают, что глубокая стимуляция мозга может превосходить медикаментозную терапию и значительно улучшать двигательные функции и качество жизни пациента [6].
Терапевтический эффект глубокой стимуляция мозга достигается за счет высокочастотных (обычно более 100 Гц) электрических импульсов, которые поступают через электроды, имплантированные в субкортикальные области мозга [7]. В настоящее время считается, что применение электрических импульсов оказывает ингибирующее воздействие на тела нейронов, близко расположенных к электрическому полю, а также возбуждающее действие на аксоны. Глубокая стимуляция мозга вызывает нейрохимические изменения: стимулирует астроциты и индуцирует распространение волн кальция, что приводит к высвобождению аденозина и глутамата [8]. При болезни Паркинсона электрофизиологическим признаком является повышенная бета-активность базальных ганглиев (8-35 Гц), которая подавляется допамином и глубокой стимуляцией мозга высокой частоты [9].
Успех терапии глубокой стимуляции мозга во многом зависит от тщательного отбора пациентов, в ходе которого используют международные критерии:
- Идиопатическая болезнь Паркинсона (согласно критериям болезни Паркинсона Британского банка мозга: брадикинезия, мышечная ригидности, тремор покоя, медленно прогрессирующее течение, эффект от приема леводопы, отсутствие мозжечковой и пирамидной симптоматики) длительностью более 5 лет.
- Инвалидизация, несмотря на оптимальное фармакологическое лечение, включая побочные эффекты от длительного применения леводопы.
- Высокая чувствительность к леводопе (компенсация симптоматики в период “включения”: оцениваются симптомы болезни Паркинсона утром в состоянии “выключения” до приема леводопы и в состоянии “включения” после приема форсированной дозы леводопы).
- Стадия по шкале Хен-Яра должна быть не выше III в состоянии “включения”.
- Возраст до 70 лет (в связи с риском хирургических осложнений и необратимым ухудшением когнитивных функций после операции).
- Отсутствие когнитивных нарушений.
Критерии, исключающие хирургическое лечение:
- Психические нарушения (острый психоз, деменция, расстройства поведения).
- Органические поражения базальных ганглиев.
- Синдром паркинсонизма (пациенты с вторичным паркинсонизмом плохо реагируют на ГСМ).
- Тяжелые соматические заболевания [10], [11].
Суть глубокой стимуляции мозга состоит в имплантации электродов в зоны мишени, расположенные в подкорковых образованиях головного мозга. Затем электроды соединяются с имплантируемым под кожу стимулятором, обычно под ключицей, который генерирует электрические импульсы и стимулирует ядро. Параметры стимуляции — амплитуда, частота и ширина импульса — задаются врачом [12].
И как только пациент будет признан хорошим кандидатом для глубокой стимуляции мозга, необходимо выбрать точку мишень. Мишени при болезни Паркинсона:
1) субталамическое ядро,
2) внутренняя часть бледного шара,
3) промежуточное ядро таламуса.
Стимуляция промежуточного ядра таламуса может быть применена у пациентов с дрожательной формой болезни Паркинсона, поскольку облегчает только тремор. Отсутствие эффективности при других моторных симптомах и риск транзиторной дизартрии ограничивает его использование и в качестве зон стимуляции больший интерес представляет стимуляция бледного шара и субталамического ядра, которая позволяет улучшить весь спектр моторной дисфункции при болезни Паркинсона [13], [14].
Когда основной целью является уменьшение дофаминергических препаратов предпочтительно использовать субталамическое ядро. В случае, когда снижение количества медикаментов не ожидается, и целью является сокращение дискинезий, используется внутренняя часть бледного шара. Если имеется вероятность снижения когнитивных функций пациента, рекомендуется также рассмотреть возможность использования в качестве цели бледный шар, учитывая и другие цели процедуры [15].
Обнаружить целевую область можно с помощью МРТ (большая вероятность погрешности, учитывая небольшие размеры точек мишеней) или записи электрических потенциалов — интраоперационная нейрофизиологическая диагностика, которая может быть использована, в том числе и для регистрации поведенческих реакций пациента [16].
Процедура имплантации хорошо переносится, но, как и все операции, не лишена осложнений, которые выделяют в две группы: связанные с хирургическим вмешательством и связанные с оборудованием. К первой группе относятся: внутричерепные кровоизлияния, судороги, интраоперационная брадикардия, тромбоз глубоких вен, эмболия легочной артерии, аспирационная пневмония. Во вторую группу осложнений входят эрозии и инфекции [17], [18], [19].
В заключении можно сказать, что за прошедшие десятилетия леводопа стала «золотым» стандартом лечения болезни Паркинсона. Однако у большинства пациентов развиваются моторные флуктуации или дискинезии примерно через 5 лет после начала терапии. Глубокая стимуляция мозга улучшает качество жизни и уменьшает двигательные осложнения. Успех применения зависит от тщательного отбора пациентов, и точного размещения электродов. Несмотря на то, что эффекты от стимуляции субталамического ядра и внутренней части бледного шара близки, выбор точки мишени должен быть индивидуализирован и адаптирован к ситуации пациента.
- Jankovic J. Parkinson’s disease: clinical features and diagnosis. J Neurol Neurosurg Psychiatry. 2008;79(4):368-76.
- Fahn S. Levodopa in the treatment of Parkinson's disease. J Neural Transm Suppl. 2006;71:1-15.
- Pandey S, Srivanitchapoom P. Levodopa-induced dyskinesia: clinical features, pathophysiology, and medical management. Ann Indian Acad Neurol. 2017;20(3):190-8.
- Bergman H, Wichmann T, DeLong MR. Reversal of experimental parkinsonism by lesions of the subthalamic nucleus. Science. 1990;249(4975):1436-8.
- Benabid AL, Pollak P, Gross C, Hoffmann D, Benazzouz A, Gao DM, et al. Acute and long-term effects of subthalamic nucleus stimulation in Parkinson’s disease. Stereotact Funct Neurosurg. 1994;62(1-4):76-84.
- Deuschl G, Schade-Brittinger C, Krack P, Volkmann J, Schafer H, Botzel K, et al. A randomized trial of deep-brain stimulation for Parkinson’s disease. N Engl J Med. 2006;355(9):896-908.
- Lozano CS, Tam J, Lozano AM. The changing landscape of surgery for Parkinson’s disease. Mov Disord Off J Mov Disord Soc. 2017;30.
- Vedam-Mai V, van Battum EY, Kamphuis W, Feenstra MG, Denys D, Reynolds BA, et al. Deep brain stimulation and the role of astrocytes. Mol Psychiatry. 2012;17(2):124-31.
- Ray NJ, Jenkinson N, Wang S, Holland P, Brittain JS, Joint C, et al. Local field potential beta activity in the subthalamic nucleus of patients with Parkinson’s disease is associated with improvements in bradykinesia after dopamine and deep brain stimulation. Exp Neurol. 2008;213(1):108-13.
- Williams A, Gill S, Varma T, Jenkinson C, Quinn N, Mitchell R, et al. Deep brain stimulation plus best medical therapy versus best medical therapy alone for advanced Parkinson’s disease (PD SURG trial): a randomised, open-label trial. Lancet Neurol. 2010;9(6):581-91.
- Munhoz, R., Picillo, M., Fox, S., Bruno, V., Panisset, M., Honey, C., & Fasano, A. (2016). Eligibility Criteria for Deep Brain Stimulation in Parkinson’s Disease, Tremor, and Dystonia. Canadian Journal of Neurological Sciences / Journal Canadien Des Sciences Neurologiques, 43(4), 462-471.
- Baylis, F. “I Am Who I Am”: On the Perceived Threats to Personal Identity from Deep Brain Stimulation. Neuroethics (2013) 6: 513.
- Pedrosa DJ, Timmermann L: Review: management of Parkinson’s disease. Neuropsychiatr Dis Treat 2013, 9: 321-340.
- Chao, Y., Gang, L., Na, Z. L., Ming, W. Y., Zhong, W. S., & Mian, W. S. (2007). Surgical Management of Parkinson’s Disease: Update and Review. Interventional Neuroradiology, 13(4), 359-368.
- Anand Rughani, MD Jason M Schwalb, MD Christos Sidiropoulos, MD Julie Pilitsis, MD, PhD Adolfo Ramirez-Zamora, MD, et all. Congress of Neurological Surgeons Systematic Review and Evidence-Based Guideline on Subthalamic Nucleus and Globus Pallidus Internus Deep Brain Stimulation for the Treatment of Patients With Parkinson's Disease: Executive Summary. Neurosurgery, Volume 82, Issue 6, 1 June 2018, Pages 753-756.
- Kobayashi K., Katayama Y. Intraoperative Microelectrode Recording. In: Itakura T. (eds) Deep Brain Stimulation for Neurological Disorders. Springer (2015).
- Deep-brain stimulation of the subthalamic nucleus or the pars interna of the globus pallidus in Parkinson’s disease. The New England Journal of Medicine. 2001; 345(13):956-63.
- Sillay KA, Larson PS, Starr PA. Deep brain stimulator hardware-related infections: incidence and management in a large series. Neurosurgery. 2008;62(2):360-6.
- Chan DTM, Zhu XL, Yeung JHM, Mok VCT, Wong E, Lau C, et al. Complications of deep brain stimulation: a collective review. Asian J Surg. 2009;32(4):258-63.
Основные термины (генерируются автоматически): глубокая стимуляция мозга, бледный шар, субталамическое ядро, внутренняя часть, III, болезнь, мышечная ригидность, промежуточное ядро таламуса, тремор покоя, тщательный отбор пациентов.
Перспективы развития глубокой стимуляции мозга


- НИО хирургии аорты, коронарных и периферических артерий
- НИО новых хирургических технологий
- НИО хирургической аритмологии
- НИО эндоваскулярной хирургии
- НИО сосудистой и гибридной хирургии
- НИО онкологии и радиотерапии
- НИО ангионеврологии и нейрохирургии
- НИО анестезиологии и реаниматологии
- НИО лучевой и инструментальной диагностики
- Состав совета по защите докторских и кандидатских диссертаций
- Требования к соискателям
- Соискатели
- Апелляции
- ГОСТ по оформлению диссертации и автореферата
- Контакты совета
- Генеральный директор Центра
- Руководство Центра
- Миссия
- История
- Мероприятия
- Фотопроекты
- Истории пациентов
- Нормативные документы
- Структура отдела
- Организационно-методическая работа с регионами
- Развитие телемедицинских технологий
- Кадровая политика и повышение квалификации
- Публичный отчет
- Устав и регистрационные документы
- Лицензии
- Публичный отчет
- Сведения о медицинских работниках
- План развития Центра
- Политика обработки персональных данных
- Охрана труда
- Политика в области охраны труда
- Противодействие коррупции
- Учетная политика
Второе рождение: глубинная стимуляция головного мозга позволяет вернуть к жизни тяжелобольных пациентов
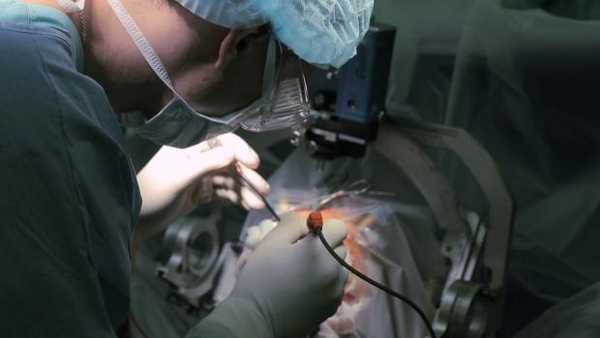
Центр Мешалкин достиг высоких успехов в функциональной нейрохирургии, целью которой является нормализация нарушенных функций центральной нервной системы с использованием имплантируемых устройств
Одним из применяемых в функциональной нейрохирургии методов является глубинная стимуляция головного мозга (англ. Deep Brain Stimulation, DBS). Данная методика подразумевает малоинвазивное нейрохирургическое вмешательство, при котором в головной мозг имплантируют специальные электроды, через которые в определенную область поступают электроимпульсы. Вмешательство позволяет нормализовать функциональные нарушения, обеспечив повышение качества жизни больных. Одним из пациентов нейрохирургического отделения Центра Мешалкина, которому успешно выполнено данное лечение, стал 21-летний Гошгар А.
Редкое хроническое заболевание центральной нервной системы - генерализованная дистония, проявляющаяся изменениями мышечного тонуса туловища, конечностей и лица, а также непроизвольными сокращениями мышц головы, шеи, верхних и нижних конечностей, обнаружено у молодого человека в 8 лет. Родители стали замечать дрожание рук у мальчика. Патология значительно снижала качество жизни ребенка: он не мог держать ручку на уроке, стал испытывать трудности при ходьбе, самообслуживании, заболевание сказалось на когнитивных функциях. Насильственные движения, не поддающиеся контролю, не беспокоили Гошгара лишь во сне. На протяжении нескольких лет больному не могли поставить диагноз, рекомендуемые врачами физиотерапия, витамины и медикаменты не давали результата.
По словам врача-невролога, генерализованная дистония не поддается фармакологической терапии. Единственным оптимальным методом лечения является нейростимуляция глубинных структур головного мозга. С целью нормализации нарушенной функции центральной нервной системы в 2017 году специалисты Центра Мешалкина выполнили процедуру DBS. В ходе вмешательства в подкорковые ядра головного мозга пациента имплантировали электроды, проводящие электрические импульсы, подавляющие симптомы заболевания. Импульсы генерирует заранее запрограммированное устройство - нейростимулятор, состоящий из батареи и чипа (микрокомпьютера), который имплантируется пациенту в подключичную область.
Нейростимуляция способствовала восстановлению двигательных функций и позволила улучшить социальную адаптацию Гошгара. По словам родителей, изменения стали заметны сразу после операции, для молодого человека это стало вторым рождением. Сегодня качество жизни Гошгара сопоставимо со здоровым человеком. Он самостоятельно передвигается и выполняет все необходимые манипуляции, не испытывает проблем с социальной адаптацией.
Глубинную стимуляцию головного мозга в Центра Мешалкина применяют с 2015 года. Показаниями к данному виду лечения являются болезнь Паркинсона, дистония, фармакорезистентная эпилепсия, эссенциальный тремор, синдром Туретта, обсессивно-компульсивное расстройство и др.
Глубинная стимуляция в нейрохирургии

Методика глубинной стимуляции головного мозга применяется для лечения пациентов с различными заболеваниями центральной нервной системы, которые не поддаются консервативной терапии, а открытые вмешательства сопряжены с высоким риском осложнений. В обзоре оценивается эффективность глубинной стимуляции различных участков головного мозга при некоторых фармакорезистентных формах заболеваний.
Ключевые слова
Полный текст
ВВЕДЕНИЕ
Основоположником методики стимуляции головного мозга является швейцарский физиолог Вальтер Рудольф Гесс (Walter Rudolf Hess; 1881-1973) . Еще в 20-х годах прошлого столетия раздражая электрическим током различные участки головного мозга через установленные металлические электроды, он вызывал у кошек чувство страха, голода и ярости. Работы В. Гесса легли в основу дальнейших исследований, которые проводил Хосе Мануэль Родригес Дельгадо (Jose Manuel Rodriguez Delgado; 1915-2011) — пионер методики стимуляции головного мозга человека. Х. Дельгадо впервые разработал технологию имплантации электродов. Во время одного из его экспериментов при стимуляции моторной области головного мозга рука у больного непроизвольно сжалась в кулак, на что пациент признался: «Мне кажется, доктор, что ваше электричество сильнее моих желаний» [1]. Другой больной в ответ на стимуляцию поворачивал голову из стороны в сторону и утверждал, что делает это сам: «Я просто ищу свои тапочки». Самый показательный эксперимент автор провел в 1963 г.: установив электрод в хвостатое ядро мозга быка, ученый смог остановить нападавшее на него животное (рис.) [1].
Рис. Эксперимент Х. Дельгадо, проведенный в 1963 г. [1]
Примечание. Иллюстрация опыта, где нападающий бык останавливается (а) и поворачивает в противоположную сторону (б).
Х. Дельгадо занимался проблемой лечения эпилепсии, болезни Паркинсона, психических расстройств; изобрел устройства, напоминающие нимб и шлем, через которые электромагнитные импульсы раздражали различные участки головного мозга.
Впервые методику глубинной стимуляции головного мозга в клиническую практику внедрил A. Benabid. В 1987 г. после стимуляции пациенту с болезнью Паркинсона промежуточного ядра таламуса (Vim) автор получил обнадеживающие результаты.
Точный механизм действия глубинной стимуляции до настоящего времени неизвестен, однако существует мнение, что стимуляция нейронов электрическим током вызывает выброс аденозинтрифосфата, который активирует аденозиновые А1-рецепторы, что в свою очередь через цепь реакций приводит к угнетению возбуждения и проведения в нервной ткани [2].
В настоящее время глубинная стимуляция является одним из эффективных методов лечения фармакорезистентных форм заболеваний, таких как эпилепсия, паркинсонизм, эссенциальный тремор, дистония, детский церебральный паралич, синдром Туретта (табл.).
Таблица. Заболевания и анатомические структуры, подвергающиеся глубинной стимуляции
Заболевания
Анатомические структуры
Центральное срединное ядро таламуса, базальные ганглии (скорлупа, хвостатое ядро), субталамическое ядро, черная субстанция, гиппокамп, миндалевидное тело, червь мозжечка 15
Субталамическое ядро, бледный шар, педункулопонтийное ядро 22
Вентральное промежуточное ядро таламуса, субталамическое ядро, zona incerta, prelemniscal radiation 36
Внутренняя часть бледного шара, вентральное промежуточное и вентральное заднее ядро таламуса, субталамическое ядро 40
Детский церебральный паралич
Вентролатеральное ядро таламуса, медиальная часть бледного шара, верхние ножки мозжечка 47
Медиальные таламические ядра, бледный шар 51
Ежегодно в Российской Федерации необходимое количество подобных операций достигает 56 000 [54]. К преимуществу данной методики следует отнести малую инвазивность, возможность подбора настроек для каждого пациента, что снижает количество побочных эффектов и улучшает прогнозы заболевания, а также высокую зону покрытия (т.е. модулируя один участок, можно изменять активность других).
ГЛУБИННАЯ СТИМУЛЯЦИЯ ГОЛОВНОГО МОЗГА КАК МЕТОД ЛЕЧЕНИЯ ФАРМАКОРЕЗИСТЕНТНЫХ ФОРМ ЗАБОЛЕВАНИЙ
Фармакорезистентная форма эпилепсии
В Российской Федерации ежегодно около 1400 больных нуждаются в проведении хирургического лечения фармакорезистентной формы эпилепсии [54]. Глубинная стимуляция является одним из методов коррекции активности эпилептогенной зоны. Она применяется для лечения как темпоральной, так и экстратемпоральной формы фармакорезистентной эпилепсии, при которых открытое хирургическое вмешательство сопряжено с высокими рисками осложнений.
В настоящее время для лечения эпилепсии используется глубинная стимуляция центрального срединного ядра таламуса, базальных ганглиев, субталамического ядра, черной субстанции, гиппокампа, миндалевидного тела и мозжечка. Однако доказанную эффективность имеет только двусторонняя стимуляция передних ядер таламуса. Переднее ядро таламуса является частью круга Пейпеца, в который также входят гипоталамус, поясная извилина, гиппокамп и мамиллярные ядра гипоталамуса [55]. Образовавшийся нервный импульс в нейронах коры головного мозга или в амигдалогиппокампальном комплексе поступает в мамиллярные ядра гипоталамуса, откуда через сосцевидно-таламический тракт в передние таламические ядра. Из ядер таламуса нервный импульс распространяется на столбы свода, поясную извилину, базальные ганглии, по таламостриарным волокнам — в хвостатое ядро, по таламокорковым путям — в моторную область коры головного мозга. Существует множество различных цепей распространения патологического нервного импульса, однако он всегда поступает в таламус, поэтому данная анатомическая структура является мишенью при лечении эпилепсии.
В 1972 г. J. Kusske провел эксперимент, в котором впервые показал, что повреждение передней ядерной группы таламуса сопровождается сокращением частоты и продолжительности эпилептических приступов [3]. M. Mirski с соавт. выявили, что разрушение, стимуляция или инъекция ГАМКергических агонистов в переднее ядро таламуса, а также разрушение сосцевидно-таламического тракта обладают противосудорожным эффектом [4, 5].
Первое клиническое наблюдение стимуляции переднего ядра таламуса описали I. Cooper и соавт. [6]. При лечении 6 пациентов с фармакорезистентной формой эпилепсии было выявлено снижение частоты судорог более чем на 50% у 5 больных, а у 1 пациента бессудорожный период длился около двух лет. В других исследованиях указывается, что при глубинной стимуляции переднего ядра таламуса происходит снижение частоты приступов на 46-76% [7, 8].
В 2010 г. проведено крупное многоцентровое исследование SANTE (Stimulation of the Anterior Nucleus of Thalamus for Epilepsy study), показавшее обнадеживающие результаты при двусторонней стимуляции переднего ядра таламуса. Было обследовано 110 пациентов: у 54% произошло улучшение в виде сокращения количества приступов на 56%; у 13% приступы полностью отсутствовали на протяжении 6 мес, еще у 13 частота приступов снизилась на 90% и более [9]. К примеру, стимуляция блуждающего нерва сопровождается уменьшением количества приступов более чем на 50% у 30% больных [10].
Центральное срединное ядро таламуса является самым крупным ядром таламуса, имеет связи с корой полушарий головного мозга, базальными ганглиями (хвостатым ядром, скорлупой). Так, согласно данным A. Velasco и соавт. и A. Valentín и соавт., частота приступов снижается на 73-92% [11, 12].
A. Biraben и соавт. показали, что развитие эпилепсии происходит в результате уменьшения количества дофамина в базальных ганглиях, а именно в скорлупе и хвостатом ядре [13]. Глубинная стимуляция хвостатого ядра приводит к снижению частоты приступов на 50% и более у 92% пациентов [14]. Стимуляция амигдалогиппокампального комплекса была впервые предложена M. Velasco и соавт. Другие авторы также отметили, что установка электродов в данную область сопровождается урежением частоты приступов на 50% и более у 50-90% больных [15, 16]. A. Cukiert и соавт. сообщили результаты наблюдения 9 пациентов с фармакорезистентной эпилепсией, которым проводили стимуляцию гиппокампа с помощью установленного в него электрода. У 97% больных было выявлено снижение частоты приступов на 80% [17].
Стимуляция мозжечка в качестве терапии пациентов с фармакорезистентной формой эпилепсии впервые была предложена в 1973 г. I. Cooper и соавт. Снижение частоты приступов выявляется у 33% больных [6].
Болезнь Паркинсона
Болезнь Паркинсона является вторым по распространенности нейродегенеративным заболеванием после болезни Альцгеймера и второй причиной инвалидизации после инсульта головного мозга. Этиологическим фактором для развития заболевания является снижение концентрации дофамина в черной субстанции и полосатом теле. В Российской Федерации хирургическое лечение при болезни Паркинсона требуется приблизительно в 2800 случаях в год [54]. Эффективность лечения болезни Паркинсона зависит от точности постановки диагноза, которая варьирует в пределах 73,8-82,7% [56].
Впервые стимуляцию субталамического ядра произвел P. Pollak в 1993 г. при лечении пациента с фармакорезистентной формой болезни Паркинсона. В последующем для этой цели стали использовать установку электродов в бледный шар. Так, согласно V. Odekerken и соавт., глубинная стимуляция как субталамического ядра, так и бледного шара в равной степени является эффективным методом лечения фармакорезистентной формы болезни Паркинсона [19]. Однако глубинная стимуляция бледного шара сопряжена с меньшими побочными эффектами [20].
По данным Р. Pahwa и соавт., у всех принявших участие в исследовании пациентов (n=19), которым проводили глубинную стимуляцию субталамических ядер, отметили снижение выраженности двигательных расстройств на 85-100%. Авторы определили, что двусторонняя стимуляция сопровождалась лучшими результатами лечения, чем односторонняя [21]. Согласно представленным результатам С. Акшулакова и соавт., из 48 пациентов с болезнью Паркинсона, которым проводили глубинную стимуляцию субталамического ядра или бледного шара, улучшение двигательных функций на 80% отметили все исследуемые. Постуральная неустойчивость, нарушения походки и автономные симптомы регрессировали в меньшей степени, однако всем пациентам уменьшена доза допаминергических препаратов на 30% и больше, что привело к полному регрессу лекарственных дискинезий. У 7 пациентов прием препаратов был полностью прекращен [22].
По мнению G. Abbate-Daga и соавт., глубинная стимуляция субталамического ядра уменьшает не только двигательные расстройства, но и выраженность психических нарушений, которые наблюдаются у 50% пациентов (психозы, депрессия, галлюцинации) [23]. Есть мнение, что глубинная стимуляция у пациентов с болезнью Паркинсона может провоцировать развитие когнитивных нарушений 24. Однако, A. Romann и соавт. в своем исследовании опровергли вышеуказанные наблюдения [27].
В 2005 г. для лечения больных с фармакорезистентной формой болезни Паркинсона Р. Mazzone с соавт., а затем P. Plaha с соавт. предложили стимуляцию педункулопонтийного ядра. Выраженность моторных нарушений снижалась в значительной мере [28, 29]. Однако до настоящего времени эффективность стимуляции данного анатомического образования активно обсуждается.
Эссенциальный тремор
Эссенциальный тремор — полиэтиологическое заболевание, характеризующееся развитием дрожательных гиперкинезов. Одним из патогенетических звеньев развития заболевания является нарушение возбуждения в таламусе и нижних оливах, что приводит к дезинтеграции нервного импульса в церебеллоталамокортикальной петле. Наряду с этим происходит повышение содержания глутамата и снижение уровня гамма-аминомасляной кислоты, глицерина и серина в ликворе, повышение активности норадренергической системы и увеличение содержания в крови циклического аденозинмонофосфата. До 50% пациентов являются резистентными к консервативной терапии эссенциального тремора, наибольшую доказательную базу имеет глубинная стимуляция вентрального промежуточного ядра таламуса, однако постоянно проводятся исследования, в которых проверяется роль ядер таламуса (zona incerta, prelemniscal radiation) [30, 31].
Так, известно, что глубинная стимуляция вентрального промежуточного ядра таламуса снижает выраженность тремора по шкале Fahn-Tolosa-Marin на 85% [32]. В ряде других исследований при глубинной стимуляции вентрального промежуточного ядра таламуса выраженность тремора рук может уменьшаться на 50-91%, а головы и голоса — на 15-100% [33, 34]. В. Тюрников и соавт. представили опыт эффективного лечения пациента с медикаментозно-резистентной формой эссенциального тремора. Авторы провели хроническую стимуляцию вентрального промежуточного ядра таламуса со стороны тремора, на фоне которой симптоматика полностью регрессировала [35].
D. Huss и соавт. оценили эффективность различных методов терапии больных с фармакорезистентной формой эссенциального тремора, а именно одно- или двусторонней глубинной стимуляции вентрального промежуточного ядра или односторонней таламотомии. Авторы выявили, что анализируемые методы лечения в равной степени улучшают прогноз заболевания, однако два первых продемонстрировали относительную безо-пасность и были сопряжены с меньшим числом побочных эффектов [36]. T. Chen с соавт. оценили эффективность глубинной стимуляции у пациентов, которых погружали в наркоз, и тех, кто был в сознании во время проведения операции. Про-анализировав показатели 89 участников, исследователь не выявил разницы в исходах заболевания у бодрствующих и спящих больных: снижение выраженности тремора составило 48,6 и 45,5% соответственно [37].
Дистония
Дистония — группа синдромов, характеризуемых постуральными непроизвольными двигательными расстройствами, при которых задействованы как мышцы-агонисты, так и мышцы-антагонисты. Существует первичная и вторичная форма дистонии, характерным отличием является наличие структурных изменений в головном мозге при вторичной форме. По этой причине наиболее часто производится глубинная стимуляция первичных форм. Распространенность первичных форм дистонии варьирует от 11 до 300 на 100 000 населения, а точность постановки диагноза — от 60 до 70% [54]. Патогенез дистонии до конца не ясен. Возможной причиной является нарушение синтеза и переработки нейромедиаторов (серотонина, норадреналина, глутамина и гамма-аминомасляной кислоты), что ведет к изменению взаимо-связи между базальными ганглиями, таламусом и корой головного мозга. Наличие гена DYT также сопровождается развитием дистонии. Доказанную эффективность имеет глубинная стимуляция внутренней части бледного шара, хотя существуют работы, в которых показана эффективность стимуляции вентрального промежуточного и вентрального заднего ядра таламуса, а также субталамического ядра.
Так, B. Sun и соавт. отметили, что стимуляция субталамического ядра по сравнению со стимуляцией бледного шара является наиболее эффективной: улучшение наступает сразу, параметры стимуляции ниже, длительнее срок службы батареи [38]. L. Cif и соавт. обследовали и пролечили 53 пациента с дистонией. Авторы выявили снижение выраженности симптомов и улучшение исходов заболевания на 71-74% при двусторонней глубинной стимуляции внутренней части бледного шара [39]. Согласно M. Vidailhet и соавт., у 22 пациентов, которым выполнили стимуляцию внутренней части бледного шара, улучшение моторных функций по шкале Burke-Fahn-Marsden Dystonia Rating Scale-motor (BFMDRS) произошло на 54%, а уровень инвалидизации по шкале BFMDRS уменьшился на 44% [40]. В проведенном многоцентровом исследовании 40 больных с первичной сегментарной и генерализованной дистонией было выявлено улучшение моторных функций в первые три месяца после глубинной стимуляции бледного шара по шкале BFMDR на 39% [41].
Ограничением для глубинной стимуляции является возраст детей 7 лет, однако в литературе описывается случай успешного лечения дистонии у пятилетнего ребенка, страдающего эпилепсией. После двусторонней стимуляции внутренней части бледного шара выраженность моторных нарушений снизилась на 81%, что благоприятно сказалось на качестве жизни [42]. R. Yadav и соавт. опубликовали результаты лечения дистонии с помощью глубинной стимуляции медиальной части бледного шара. Авторы отметили снижение выраженности дистонии в туловище и конечностях на 50%, а в шее — более чем на 90% [43]. Существующее мнение, согласно которому у пациентов после глубинной стимуляции происходит нарушение психики, было опровергнуто исследованиемS. Meoni и соавт. [44].
Детский церебральный паралич — совокупность неврологических синдромов, возникающих в результате повреждения головного мозга плода или новорожденного. Детский церебральный паралич является вторичной формой дистонии, при которой происходит снижение тормозного влияния коры головного мозга на стволовые центры и вестибулярные ядра. Согласно результатам некоторых исследований, наибольшее количество повреждений у больных детским церебральным параличом выявляется со стороны чечевицеобразного ядра; у 69% пациентов — в скорлупе, у 68% — в субталамических ядрах, у 62% — в таламусе, у 20% — в бледном шаре, у 13% — в хвостатом ядре.
Наиболее часто используется стимуляция вентролатерального ядра таламуса, медиальной части бледного шара и верхних ножек мозжечка. Глубинная стимуляция применяется для коррекции двигательных и речевых нарушений, уменьшения выраженности координаторных нарушений при различных формах детского церебрального паралича: положительный эффект от данных операций достигает 50% [45]. Доказано, что глубинная стимуляция медиальной части бледного шара улучшает двигательные функции, уменьшает выраженность контрактур и спазма [46]. L. Romito и соавт. представили результаты лечения 15 пациентов с детским церебральным параличом, которым проводили двустороннюю стимуляцию медиальной части бледного шара. Авторы выявили снижение выраженности двигательных нарушений на 49,5%, а степени инвалидизации — на 30% [47]. Аналогичные данные получил J. Keen с соавт. [48]. Однако ранее M. Vidailhet с соавт. не отметили способности глубинной стимуляции влиять на исходы заболевания у пациентов с детским церебральным параличом [49]. J. Kim и соавт. представили исследование, в котором провели сравнительную оценку глубинной стимуляции внутренней части бледного шара с/без деструкции вентролатерального ядра таламуса. В ходе исследования авторы не выявили значимых отличий [50].
Болезнь Туретта
Заболевание, характеризуемое моторными и во-кальными тиками, а у некоторых больных — копролалией. В США насчитывается около 2 млн больных с подобным заболеванием. Лечение фармакорезистентной формы болезни Туретта заключается в глубинной стимуляции медиальных таламических ядер и бледного шара. Так, по мнению V. Visser-Vandewalle и соавт., глубинная стимуляция медиальных таламических ядер сопровождается снижением частоты тиков на 66% [51]. M. Welter и соавт. обосновывают лучшую эффективность глубинной стимуляции внутренней части бледного шара снижением частоты тиков на 78% в сравнении с 45% при стимуляции медиальных ядер таламуса [52]. Аналогичные результаты получены J. Zhang с соавт.: ученые отметили снижение частоты тиков на 51,2% при стимуляции внутренней части бледного шара [53]. Несмотря на множество исследований, концепция лечения больных с фармакорезистентной формой болезни Туретта до настоящего времени не определена.
ЗАКЛЮЧЕНИЕ
Глубокая стимуляция мозга ( DBS)
Глубокая стимуляция мозга в психиатрии применяется для лечения обсессивно - компульсивного расстройства , сопровождающегося стойкими навязчивыми состояниями и ритуалами, кроме того, этот метод лечения может использоваться в процессе терапии дистоний.
При глубокой стимуляции мозга пациентам обычно вводят электроды в оба полушария мозга , а место их имплантации определяется по результатам нейровизуализации ( магнитно - резонансной томографии и спектроскопии) , кроме того, современные методы нейрофизиологических исследований позволяют построить и изучить достаточно детальную карту электрической активности мозга.
Операция проводится в два этапа , на первом этапе чаще под местным обезболиванием после наложения специальной стереотаксической скобы последовательно электроды вводятся в мозг пациента в заранее выбранные структуры мозга по заранее заданному компьютером пути и оставляются не присоединенными. Концы электродов находятся под кожей, разрез зашивается. Под общим наркозом в области грудной клетки подкожно вшивается электростимулятор, к которому подсоединяются электроды. Послеоперационный период обычно продолжается 2-3 дня. Затем, спустя неделю, больного вновь госпитализируют вновь для подключения вживленных электродов к импульсному генератору. После 2 недель нейростимулятор включают и настраивают на протяжении нескольких недель. В течение этого времени подбираются необходимые для подавления симптомов психического илим неврологического расстройства режимы стимуляции. После глубокой стимуляции мозга снижается количество психоторопных средств и уменьшается их доза, возможна, и полная отмена психофармакологических средств. К показаниям DBS относятся: идиопатическая форма болезни Паркинсона , существоующая , по краней мере, на протяжении не менее 5 лет, возраст пациента не должен быть старше 70-75 лет, имеет месо положительная реакция на препарат L - допа ( феномен "включения - выключения"), у пациента также должны отсутствовать серьезные заболевания сердечно - сосудистой системы и онкологическая патология. Кроме того, не рекомендуется DBS при выраженных когнитивных нарушениях , в частности, памяти.
Сразу после оперативного вмешательства больной может ощущать усталость и чувствовать боль, которая легко снимается лекарствами. Позже может появиться болезненность и раздражение в месте введения электродов, которое со временем проходит. Проведение первого этапа потребует трехдневного пребывания в медицинском учреждении, для выполнения второй части DBS необходимы одни сутки.
Впервые DBS была предложена в 1987 году , когда нейрохируги применили имплантацию нейростимулятора ( "пейсмакер мозга") для лечения нейропсихиатрических заболеваний. Несмотря на сравнительно длительную историю применения DBS , соновные положения этой процедуры и механизмы терапевтического эффекта остаются неясными. DBS непосредственно изменяет активность мозга в контроллируемом режиме , однако, ее эффект часто бывает обратимым и отчасти зависит от техники самогооперативного вмешательства.
Читайте также:
