Пограничные лучи Букки для рентгенотерапии рака века глаза. Эффективность
Добавил пользователь Валентин П. Обновлено: 21.01.2026
предоставляем актуальную медицинскую информацию от ведущих специалистов, помогая врачам в ежедневной работе
The role of radiotherapy in combined treatment
The role of radiotherapy in combined treatment
of eye diseases
A.M. Korytova,V.N. Alexeev,
N.V. Ilyin, Yu.N. Vinogradova
Review demonstrates an important role of various types of radiotherapy (distant photon, electronic, brachytherapy) in the treatment of malignant, benign tumor of the eye and also non-neoplastic diseases of the same localization (orbital pseudotumor, endocrine ophthalmopathies, terminal aching glaucoma).
With the increase of frequency of eye tumors in the last years, tactic and methodic questions of radiotherapy of malignant tumors of different eye structures according to their histologic belonging are widely covered.
Литература
1. Алексеев В.Н., Егоров Е.А., Мартынова Е.Б. О распределении уровней внутриглазного давления в нормальной популяции // Клин. офтальмология.-2001.-Т.2/2.-с.38-40.
2. Алексеев В.Н., Мартынова Е.Б., Усачев В.В. // Всероссийский съезд офтальмологов, 7-й: Тезисы докладов. - М.-2000. - Т.1. - с.96-97.
3. Белкина Б.М., Дурнов Л.А., Голдобенко Г.В. возможности органосохранного лечения ретинобластомы у детей. // Вопр. онкологии.-1992.-T.38/9.-с.1097-1103.
4. Бессмертный А.М., Червяков А.Ю., Лобыкина Л.В. // Всероссийский съезд офтальмологов, 7-й: Тезисы докладов. - М. - 2000. - Т.1.-с.105.
5. Балмуханова А.В. Облучение перед операцией при злокачественной меланоме сосудистого тракта. // Достижения и перспективы офтальмоонкологии (сб. научных трудов научно-практич. конф.).-М.-2001.-с.86-88.
6. Бровкина А.Ф. Актуальные вопросы офтальмоонкологии. // Вестник офтальмол.-1997.-№1.-с.5-7.
7. Бровкина А.Ф. Болезни орбиты. // М.-Медицина.-1993.-240с.
8. Бровкина А.Ф., Вальский В.В., Зарубей Г.Д. Метастатическое поражение печени у больных с увеальной меланомой. // Вестник офтальмологии.-1998.-T.114/1.-стр.21-23.
9. Бровкина А.Ф., Зарубей Г.Д., Фишкин Ю.Г. Обоснованность использования брахитерапии при увеальных меланомах юкстапапиллярной локализации. // Вестник офтальмологии. - 1991. - T. 107/6. - с.41-43.
10. Вайнштейн Е.С., Бровкина А.Ф., Бурдянская Е.И., Зарубей Г.Д. Опухоли защитного аппарата глаза, глазного яблока и глазницы. // Клиническая рентгенорадиология.-1985.-т.5.-с.134-162.
11. Вайнштейн Е.С., Бровкина А.Ф., Фридман Ф.Е. и др. Диагностика и лечение меланом глаза и его придатков.// Метод. рекомендации.-М.-1975.
12. Вальский В.В. Крупнофракционная брахитерапия злокачественных опухолей конъюнктивы. // Достижения и перспективы офтальмоонкологии (сб. научных трудов научно-практич. конф.).-М.-2001.-с.98-100.
13. Вальский В.В., Гришина Е.Е. Сравнение результатов дистанционной рентгенотерапии и брахитерапии лимфопролиферативных заболеваний конъюнктивы. // Достижения и перспективы офтальмоонкологии (сб. научных трудов научно-практич. конф.).-М.-2001.-с.100-101.
14. Волков В.В. Варианты лечебной тактики при опухолях наружных отделов глаза. // Вестник офтальмологии. - 1991. -T. 107/4. - стр. 34-39.
15. Егоров Е.А., Бабушкин А.Э. Клапанная трабекулотомия с аутосклеральным имплантатом в хирургии глаукомы. // Вестн. офтальмол.-1988.-№1.-с.7-9.
16. Зарубей Г. Д., Будкина Г.П., Бровкина А. Ф., Дмитровская И.П., Хватова А. В. // Методы контактной бета-терапии новообразований глаза. - Тез. докладов II Всесоюз. научно-технич. симпоз. проблем развития терапевтич. pадиац. техники. - М. - 1975. - с.166-168.
17. Индейкин Е.Н. Острый приступ первичной глаукомы и его лечение. // Автореф. дис. д-ра мед. наук.-Л.-1971.-35с.
18. Индейкина Г.В. Ретробульбарные инъекции аминазина при купировании острых приступов терминальной глаукомы. // Офтальмол. журнал.-1987.-№2.-с.122-123.
19. Краснов М.М., Акопян В.С., Ильина Т.С. и др. Лазерное лечение первичной глаукомы. // Вестн. офтальмол.-1982.-№5.-с.18-22.
20. Краснов М.М., Каспаров А.А., Мусаев П.И. О результатах интрасклеральной капсулопластики в лечении глаукомы. // Вестн. офтальмол.-1984.-№4.-с.12-13.
21. Левко М.А. Глубокая склерэктомия с ангулодилатацией в лечении глаукомы. // Автореф. дис. канд. мед. наук.-С-Петербург. - 2000. - 23с.
22. Либман Е.С., Шахова Е.В. Состояние слепоты и динамика слепоты и инвалидности вследствии патологии органа зрения в России // Всероссийский съезд офтальмологов, 7-й: Тезисы докладов.-М.-2000.-с.209-215.
23. Линник Л.Ф., Магарамов Д.А., Семикова Т.С., Яровой А.А. Методика комбинированного лечения меланомы хориоидеи брахитерапией и лазерной термотерапией. // Достижения и перспективы офтальмоонкологии (сб. научных трудов научно-практич. конф.). -М.-2001.-с.122-124.
24. Лобанов Г.В., Голдобенко Г.В. Лучевая терапия двусторонней ретинобластомы. // Офтальмол. журнал.-1998. - №1. - стр. 15-17.
25. Нестеров А.П. Глаукома.-М.-Медицина.-1995.-255с.
26. Нестеров А.П., Егоров Е.А., Батманов Ю.Е., Колесникова Л.Н. Некоторые особенности хирургии глаукомы. // Вестн. офтальмол. - 1986.-№3.-с.6-8.
27. Нестеров А.П., Колесникова Л.Н. Фистулизирующая иридоциклоретракция. // Вестн. офтальмол.-1984.-№1.-с.10-12.
28. Офтальмоонкология: Руков-во для врачей под ред. А.Ф. Бровкиной. - М. - Медицина.- 2002.-424с.
29. Пантелеева О.Г. Метастатические опухоли орбиты. // Достижения и перспективы офтальмоонкологии (сб. научных трудов научно-практич. конф.).-М.-2001.-с.79-80.
30. Полякова С.И., Терентьева Л.С., Вит В.В. Особенности диагностики, клиники и лечения лимфом орбиты. // Офтальмол. журнал. - 1997.-№3.-с.173-178.
31. Рябцева А.А. Комбинированная глаукома. Автореферат дис. д-ра мед. наук.-М.-1996.
32. Саакян С.В. Отдаленные результаты лечения детей с ретинобластомой при помощи неоадьювантной химиотерапии. // Достижения и перспективы офтальмоонкологии (сб. научных трудов научно-практич. конф.).-М.-2001.-с.140-143.
33. Ушакова Т.Л., Белкина Б.М., Поляков В.Г., Дурнов Л.А. Подходы к лечению местнораспространенной ретинобластомы у детей. // Достижения и перспективы офтальмоонкологии (сб. научных трудов научно-практич. конф.).-М.-2001.-с.156-158.
34. Федоров С.Н., Иоффе Д.И., Ронкина Т.И. Антиглаукоматозная операция - глубокая склерэктомия. // Вестн. офтальмол. -1 982. - №4.-с.6-10.
35. Федоров С.Н., Козлов В.И., Тимошкина Н.Т. и др. Непроникающая глубокая склерэктомия при открытоугольной глаукоме // Офтальмохирургия.-1989.-№3.-с.52-55.
36. Фрадкин М.Я., Бунин А.Я., Чернявский Г.Я.-Уч. зап. МНИИ глазных болезней им. Гельмгольца.-М.-1961.-вып.6.-с.259-260.
37. Шеина А.И. Лучевая терапия эндокринной офтальмопатии // Достижения и перспективы офтальмоонкологии (сб. научных трудов научно-практич. конф.).-М.-2001.-с.189-191.
38. Anteby I., Ramu N., Gradstein L. et al. Ocular and orbital complications following the treatment of retinoblastoma. // Eur. J. Ophthalmol.-1998.-8/2.-p.106-111.
39. Arthur D.W., Zwicker R.D., Garmon P.W. et al. Electron photon matched field technique for treatment of orbital disease. // Ynt. J. Radiat. oncol. biol. phys.-1997.-37/2.-p.496-474.
40. Ascaso F.J., Cascante J.M., Castillo J.M. et.al. Simultaneous bilateral primary choroidal melanoma. // Eur. J. Ophthalmol. - 1996. - 6/1. - p.87-89.
41. Augsburger J.J., Goel S.D. Visual function following enucleation or episcretal plague radiotherapy for posterior uveal melanoma. // Arch.Ophthalmol.-1994.-112/6.-p.786-789.
42. Caccialanza M., Piccinno R., Gnecchi L. et.al. Radiotherapy of carcinomas of the eyelids. // Skin Cancer.-1998.-13/2.-p.67-72.
43. Cains J. Trabeculoectomy // Amer. J. Ophthalmol. -1968. - V.66. - p. 673-679.
44. Castro J.R., Char D.H., Petti P.L. et.al. 15 years experience with helium ion radiotherapy for uveal melanoma. // Int. J. Radiat. Oncol. Biol. Phys.-1997.-39/5.-p.989-996.
45. Char D.H., Kroll S.M., Quivey J.M., Castro J. Long term’visual outcome of radiated uveal melanomas in eyes eligible for randomisation to enucleation versus brachytherapy. // Br. J. Ophthalmol. - 1996. - 80/2. - p.117-124.
46. Coleman D.J., Silverman R.H., Ursea R. et. al. Ultrasonically induced hyperthermia for adjunctive treatment of intraocular malignant melanoma. // Retina.-1997.-p.109-117.
47. Covington E.E., Lobes L. and Sudorsanam A. Radiathion therapy for exophthalmos: report of seven cases. // Radiology. - 1977. - 122. - p.797-799.
48. Daftari I.K., Char D.H., Verhey L.J. et.al. Anterior segment sparing to reduce charged particle radiotherapy complications in uveal melanoma. // Int. J. Radiat. Oncol. Biol. Phys. - 1997. - 39/5. - p.997-1010.
49. Debois J.M., Haustrate F.M. Breast cancer and the eye. // Oncologie.-1996.-19/5.-p.385-393.
50. Donaldson S.S., Bagshaw M.A., Kriss J.D. Supervoltage orbital radiotherapy for Grave’s ophthalmopathy. // J. Clin. Endocrinol. Metab.-1973.-37.-p.276-285.
51. Esik O., Iheda H., Muhai K., Kaneko A. A retrospective analysis of different modalities for treatment of primary orbital non-Hodgkin’s lymphomas. // Radiother. Oncol.-1996.-38/1.-p.13-18/
52. Fay A.M., Leib M.L., Fountain K.S. Multiple myeloma involving the orbit. // Ophthalmic Plast. Keconstr. Surg.-1998.-14/1.-p.67-71.
53. Finger P.T., Mieler W.F. Microwave thermoradiotherapy for uveal melanoma: Results of a 10-year study. // Ophthalmology. - 1997. - 104/11. - p.1794-1803.
54. Finger P.T. Radiation therapy for choroidal melanoma. // Surv. Ophthalmol.-1997.-42/3.-p.215-232.
55. Fontanesi J., Pratt C.B., Hustu H.O., Coffey D. Use of irradiation for therapy of retinoblastoma in children more than 1 year old: the st. Jude children’s research hospital experience and review of literature. // Medical and Pediatric Oncology.- 1995.-24(5).-p.321-326.
56. Foss A.J.E., Whelehan I., Hungerford J.L. et al. Predictive factors for the development of rubeosis following proton beam radiotherapy for uveal melanoma. // Br. J. Ophtalmol.-1997.-81/9.-p.748-754.
57. Gallie B.L., Budning A., Re Boer G. et al. Chemotherapy with focal therapy can cure intraocular retinoblastoma without radiotherapy. // Arch. Ophthalmol.-1996.-114/11.-p.1321-1328.
58. Giinalp I., Batioglu F. Effect of Pre-Enucleation irradiation on the survival of patients with uveal melanoma. // Ophthalmologica. - 1998. - 212.-p.231-235.
59. Granberg-Danielsen B. Die Behandlung des glaucoms mit Megaphen. // Ophthalmologica.-1955.-130.-p.403-405.
60. Greenwald M.J., Strauss L.C. Treatment of intraocular retinoblastoma with carboplatin and etoposide chemotherapy. // Ophthalmology.-1996.-103/12.-p.1989-1997.
61. Gunalp I., Gunduz K., Ozkan M. Causes of enucleation: a clinicopathological study. // Eur.J.Ophthalmol.-1997.-7/3.-p.223-228.
62. Gunduz K., Shields J.A., Shields C.L., Eagles R.C.Jr. Cutaneous melanoma metastatic to the vitreous cavity. // Ophthalmology.-1998.-105/4.-p.600-605.
63. Kennerdell J., Maroon J.,Melton M., Warren F. The management of optic nerve sheath meningioms // Amer. J. Ophthal. - 1988. - Vol. 106/4.-p.450-457.
64. Kingston J.E., Hungerford J.L., Madreperla S.A., Plowman P.N. Results of combined chemotherapy and radiotherapy for advanced intraocular retinoblastoma.// Arch. Ophthalmol. - 1996. - 114/11. - p.1339-1343.
65. Kreissing I., Rose D., Simader E. Longterm follow-up of iodina-125 brachytherapy for choroidal melanomas. Part II: Functional results (Germ).-Jod-125-brachytherapie des malignen aderhaut - melanoms. Teil II: funktionelle langzeitergebnisse. // Klin.Monatsbl. Augenheilkd. - 1996.-209/1.-p.7-12.
66. Lagreze W.-D.A., Wesendahl T.A., Kommerell G. Enophthalmos due to metastatic breast adenocarcinoma (Germ). // Klin. Monatsbl. Augenheilkd.-1997.-211/1.-p.68-69.
67. Lam D.S., Li C.K., Cheng L.L. et al. Primary orbital Ewing’s sarcoma: report of a case and review of the literature (see comments). // Eye.-13(Pf 1).-1999.-p.38-42.
68. Lee A.G., Woo S.Y., Miller N.R. et al. Improvement in visual function in an eye with a presumed optic nerve sheath meningioma after treatment with trec-dimensional conformal radiation therapy. // J. Neuro-Ophthalmol.-1996.-16/4.-p.247-251.
69. Logani S., Cho A.S., Ali B.H. et.al. Single-dose compared with fractionated-dose radiation of the OM431 choroidal melanoma cell line. // An.J.Ophthalmol.-1995.-120/4.-p.506-510.
70. Madreperla S.A., Hungerford J.L., Doughty D. et al. Treatment of retinoblastoma vitreous base seding.// Ophthalmology. - 1998. - 105/1. - p.120-124.
71. Mannor G.E., Rose G.E., Plowman P.N. et al. Multidiaciplinary management of refractory orbital rhabdomyosarcoma. // Ophthalmology. - 1997.-104/7.-p.1198-1201.
72. Margo C.E., Mulla Z.D. Malignant tumors of the orbit: Analysis of the Florida cancer registry.// Ophthalmology. - 1998. - 105/1. -p.185-190.
73. Martin K.R., Broadway D.C. Cyclodiode laser therapy for painful, blind glaucomatous eyes. // Br.J.Ophthalmol. - 2001. - 85(4). - p.474-476.
74. Meyer A., D’Hermies F., Korobelnik J.F. et.al. Ring reccurens of ciliary body melanoma after proton-beam therapy - Recidive annulaire d»un melanoma ciliare apres photontherapie. // J.Fr.Ophtalmol. - 1997. - 20/9.-p.697-700.
75. Missoten L., Dirven W., Van der Schueren A. et al. Results of treatment of choroidal malignant melanoma with high-dose-rate strontium-90 brachytherapy. // Graefe’s Arch.Clin.Exp. Ophthalmol. - 1998. - 236/3.-p.164-173.
76. Mombaerts I., Schlingemann R.O., Goldschmeding R., Koornnef L. Are systemic corticosteroids useful in the management of orbital preudotumors? // Ophthalmology.-1996.-103/3.-p.521-528.
77. Murphree A.L., Villablanca J.G., Deegan III W.F. et al. Chemotherapy plus local treatment in the management of intraocular retinoblastoma. // Arch. Ophthalmol.-1996.-114/11.-p.1348-1356.
78. Murray T.G., Roth D.B., O’Brien J.M. et al. Local carboplatin and radiation therapy in the treatment of murine transgenic retinoblastoma.// Arch. Ophthalmol.-1996.-114/11.-p.1385-1389.
79. Norregaard J.C., Gerner N., Jensen O.A., Prause J.U. Malignant melanoma of the conjunctiva: Occurrence and survival following surgery and radiotherapy in a Danish population. // Graefe’s Arch. Clin. Exp. Ophthalmol.-1996.-234/9.-p.569-572.
80. Notis C.M., Abramson D.H., Sagerman R.H., Ellsworth R.M. Orbital rhabdomyosarcoma: Treatment or overtreatment. // Ophthalmic Genet. - 1995.-16/4.-p.159-162.
81. Quivey J.V., Augsburger J., Snelling L., Brady L.W. 125I plaque therapy for uveal melanoma: Analysis of the impact of time and dose factors on local control. // Cancer.-1996.-77/11.-p.2356-2362.
82. Rudoler S.B., Shields C.L., Corn B.W. et.al. Functional vision is improved in the majority of patients treated with external-beam radiotherapy for choroidal metastases: A multivariate analysis of 188 patients. // J.Clin.Oncol.-1997.-15/3.-p.1244-1251.
83. Sanna M. Sull’azione dellu clorpromazina (4560 RP) per via retrobulbaire in oftalmologia. // Ann di Oftalm.-1957.-83.-p.545-554.
84. Schlienger P., Brunin F., Desjardins L. et al. External radiotherapy for carcinoma of the eyelid. // Int. J. Radiat. Oncol. Biol. Phys. - 1996. - 34/2.-p.277-287.
85. Schlienger P., Desjardins L. External electron irradiation in 2 cases of capillary hemangioma of the optic disk. // Bulletin du Cancer. Radiotherapie.-1995.-82/2.-p.306-310.
86. Seregard S., Lundell G., Lax I. et.al. Tumour cell proliferation after failed ruthenium plaque radiotherapy for posterior uveal melanoma. // Asta Ophthalmol.Scand.-1997.-75/2.-p.148-154.
87. Seregard S. Posterior uweal melanoma. The swedish perspective. // Acta Ophthalmol. Scand.-1996.-74/4.-p.315-329.
88. Shields C.L. Plaque radiotherapy for the management of uveal metastasis. // Curr.Opin.Ophthalmol.-1998.-9/3.-p.31-37.
89. Shields C.L., De Potter P., Himelstein B.P. et al. Chemoreduction in the initial management of intraocular retinoblastoma. // Arch. Ophthalmol. - 1996.-114/11.-p.1330-1338
90. Shields C.L., Shields J.A., Needle M. et al. Combined chemoreduction and adjuvant treatment for intraocular retinoblastoma.// Ophthalmology. -1997.-104/12.-p.2101-2111.
91. Signh A.D., Garway-Heath D., Love S., Plowman P.N. et al. Relationship of regression pattern to recurrence in retinoblastoma.// Br. J. Ophthalmol.-1993.-V.77/1.-p.12-16.
92. Sigurdsson H., Thorisdottir S., Bjornsson J.K. Enucleation and evisceration in Iceland 1964-1992. Study in a defined population. // Acta Ophthalmol Scand.-1998.-76/1.-p.103-107.
93. Summanen P., Immonen I., Kivela T. et.al. Radiation related complications after ruthenium plaque radiotherapy of uveal melanoma. // Br.J.Ophthalm.-1996.-80/8.-p.732-739.
94. Takahashi T., Mitsuhashi N., Nagashima H. et al. Clinical experience of radiation therapy for Graves’ophthalmopathy. // Radiat. Med.med. Jmaging. Radiat. Oncol.-1996.-14/6.-p.343-347.
95. Tellado M., Specht C.S., McLean I.W. et al. Primary orbital melanomas. // Ophthalmology.-1996.-103/6.-p.929-932.
96. Welde G., Sjosrand J. A clinical study of radiation cataract formation in adult life following (-irradiation of the lens in early childhood. // Br. J. Ophthalmol.-1997.-81/4.-p.261-266.
97. Wilson W.B., Prochoda M. Radiotherapy for thyroid orbitopathy. Effects on extraocular muscle bolance. // Arch. Ophthalmol. - 1995. - 113/11. -p.1420-1425.
98. Wong E.Y., Chew P.T., Chee C.K., Wong J.S. Diode laser contact transscleral cyclophotocoagulation for refractory glaucoma in Asian patients. // Am.J.Ophthalmol.-1997.-124/6.-p.797-804.
99. Yen M.T., Tse D.T., Wu X., Wolfson A.H. Radiation therapy for local control of of eyelid carcinoma: report of two cases and review of the literature. // Opthalmic Plastic and Reconstructive Surgery. - 2000. - 16/3.-p.211-215.
100. Zografos L., Baercher L., Chamot L. et.al. Cobalt-60 treatment of choraidal hemangiomas. // Am.J.Ophthalmol. - 1996. - 121/2. - p.190-199.
101. Zografos L., Egger E., Bercher L. et.al. Proton beam irradiation of choroidal hemangiomas. // Am.J.Ophthalmol. - 1998. - 126/2. - p.261-268.
Пограничные лучи Букки для рентгенотерапии рака века глаза. Эффективность
СРАВНИТЕЛЬНАЯ ЭФФЕКТИВНОСТЬ РЕЖИМОВ ФРАКЦИОНИРОВАНИЯ БЛИЗКОФОКУСНОЙ РЕНТГЕНОТЕРАПИИ БАЗАЛЬНОКЛЕТОЧНОГО РАКА КОЖИ ЛИЦА
Джабаров Фархад Расимович 1 , Толмачев Владимир Генрихович 2 , Агеева Наталия Алексеевна 3
1 Ростовский государственный медицинский университет, доктор медицинских наук, ассистент кафедры лучевой диагностики ФПК и ППС
2 Ростовский государственный медицинский университет, ассистент кафедры лучевой диагностики ФПК и ППС
3 Ростовский государственный медицинский университет, кандидат философских наук, доцент кафедры истории и философии
Аннотация
В статье проанализированы 80 историй болезни пациентов, получивших короткофокусную рентгенотерапию по поводу базальноклеточного рака кожи лица в условиях отделения радиологии ГБУ «Онкодиспансер» РО с 2013 по 2016 годы. Результаты, полученные в ходе исследования, свидетельствуют о том, что разработанный режим мультифракционирования дозы излучения при короткодистанционной рентгенотерапии может быть рекомендован для лечения базальноклеточного рака кожи лица. Режим мультифракционирования является более выгодным с косметических позиций.
COMPARATIVE EFFICIENCY OF FRACTIONATING REGIMES IN CLOSE-FOCUS ROENTGENOTHERAPY OF FACIAL BASAL CELL CARCINOMA
Dzhabarov Farkhad Rasimovich 1 , Tolmachev Vladimir Genrikhovich 2 , Ageeva Nataliya Alekseevna 3
1 Rostov State Medical University, Doctor of Medicine, assistant of Radiodiagnosis Chair, Professional Training and Retraining Faculty,
2 Rostov State Medical University, assistant of Radiodiagnosis Chair, Professional Training and Retraining Faculty,
3 Rostov State Medical University, candidate of philosophical science, associate professor of History and Philosophy Department
Abstract
In the article there is an analysis of 80 medical histories of the patients who got close-focus roentgenotherapy on account of facial basal cell carcinoma in the conditions of a radiology department of the State-funded Establishment “Oncologic Dispensary” of the Rostov Region from 2013 till 2016. The results of the investigation witness to the fact that a worked out regime of multifractionating of a radiation dose in close-focus roentgenotherapy can be recommended for treatment of a facial basal cell carcinoma. The multifractionating regime is a more preferable one from the point of view of cosmetology.
В структуре заболеваемости злокачественными новообразованиями отмечается неуклонный рост количества случаев рака кожи. Так, рак кожи в 2001 г. занял 3-е место после рака легкого и желудка у мужчин и рака молочной железы у женщин [1]. Наиболее часто диагностируемым эпителиальным новообразованием кожи является базальноклеточный рак. Частота встречаемости, по данным различных авторов, составляет от 45% до 96,8 % [2, 3].
Излюбленной локализацией базальноклеточного рака являет кожа лица, от 63,4% - 97% [2, 4, 15, 16]. Кожа лица имеет ряд анатомических особенностей - это мало выраженная жировая клетчатка и близкое расположение костной и хрящевой ткани, что осложняет проведение лучевого лечения и зачастую приводит к выраженным косметическим дефектам. Ведущим методом лечения базальноклеточного рака кожи лица остается близкофокусная рентгенотерапия, которая позволяет добиться излечения в 90% - 95% случаев [7, 8, 9, 10]. Однако в ряде случаев, из-за анатомических особенностей, подведение канцероцидных доз сопровождается выраженными лучевыми повреждениями и, как следствие, косметическими дефектами. Зачастую попытки снизить суммарную очаговую дозу, во избежание лучевых реакций, приводит к недооблучению опухоли и развитию рецидива.
Одним из основных подходов к повышению эффективности лучевого лечения является расширение радиотерапевтического интервала [3]. Наиболее доступным способом модификации этого интервала является использование нестандартных схем фракционирования дозы во времени. В последнее время широко обсуждаются перспективы применения режима мультифракционирования дозы излучения, что способствует улучшению результатов лечения [11, 12]. Учитывая вышесказанное, подбор оптимального режима фракционирования рентгентерапии должен с одной стороны обеспечить подведение адекватных суммарных доз, с другой стороны - минимизировать лучевые повреждения.
В нашем исследовании были проанализированы 80 историй болезни пациентов, получивших короткофокусную рентгенотерапию по поводу базальноклеточного рака кожи лица в условиях отделения радиологии ГБУ «Онкодиспансер» РО с 2013 по 2016 годы. Пациенты были поделены на две сопоставимые по полу, возрасту группы. У всех диагностирован базальноклеточный рак кожи лица. В I группу отнесены 33 больных, получившие КФРТ в режиме мультифракционирования дозы РОД = 2,5 Гр дважды в день 5 раз в неделю, до СОД = 60-70 иГр. II контрольную группу составили 47 пациентов, получивших КФРТ с использованием традиционного фракционирования РОД = 4,0 - 5,0 Гр до СОД = 60-70 иГр. Фактор ВДФ для обеих групп составил 79 - 85 Ед. У всех 80 больных обеих групп был прослежен и оценен клинический эффект проводимой терапии. Во всех случаях достигнута полная регрессия опухоли.
Критерием оценки эффективности исследуемого режима был выбран анализ течения лучевой реакции после проводимой короткодистанционной рентгенотерапии рака кожи. Степень выраженности лучевой реакции может проявляться следующими формами: стойкой эритемой и зудом, экссудацией, кровоточивостью из эрозированной поверхности кожи, отеком тканей облучаемой области. В зависимости от степени выраженности, общепринятой является классификация лучевых реакций с определением степени повреждения ткани. Причем длительность лучевой реакции определяется временем ее начала и сроками формирования лучевого рубца.
Пациентам обеих групп были розданы опросники, в которых они, основываясь на собственных ощущениях, отмечали сроки возникновения лучевой реакции и степень ее выраженности. Кроме этого, при ежедневном осмотре облучаемой области перед проведением сеанса лучевой терапии степень выраженности реакции фиксировалась лечащим врачом в дневнике истории болезни.
Всего были опрощены и проанализированы анкеты 21 пациента из I группы, и 35 анкет пациентов из II группы (табл. 1).
Табл. 1.Длительность проявления лучевых реакций различной степени выраженности у пациентов исследуемых групп.
Recurrent basal cell carcinoma of lids skin (peculiarities of clinical course, treatment)
(peculiarities of clinical course, treatment)
I.E. Panova , S.A. Vasil’ev, L.E. Semenova, A.V. Pilat, E.S. Pavlenko , S.N. Dudnil , D.A. Vazhenina
Ural State Academy of additional education
Chelyabinsk regional oncological prophylactic center
Ophthalmooncological center, Chelyabinsk
Purpose: to study the peculiarities of clinical course recurrent basal cell carcinoma of lids skin.
Materials and methods: we examined 429 patients with recurrent basal cell carcinoma of lids skin.
Results: Recurrent cases were found in 19,7% of patients. In 89% of patients the recurrence occur in first 5 years, in 24,5% - predominance of multiple affection. Predominance of ulcer and nodular clinical forms, localization on the lower lid with its marginal edge involvement and spread type of tumor process were detected.
Conclusion:
Surgical treatment of recurrent basal cell carcinoma of lids skin with reconstructive stage and laser photodestruction help lowering the recurrence frequency.
Базально-клеточный рак (БКР) - наиболее рапространенная злокачественная опухоль кожи, возникающей в эпидермисе или волосяных фолликулах, характеризуется многообразием клинических проявлений и гистоморфологических форм, местнодеструирующим ростом, возможностью обширного характера поражения и исключительно редким метастазированием [3,8,10,12,14]. Частота периокулярной локализации в структуре БКР кожи достигает 11% [3].
Актуальность проблемы БКР кожи век определяется ростом заболеваемости, высоким удельным весом (до 75%) в структуре всех злокачественных опухолей органа зрения [1,3,6,10,13]. Несмотря на довольно благоприятное течение, многообразие методов лечения (хирургический, лучевой, лазерный, криовоздействие, комбинированный) данного заболевания, частота возникновения рецидивов варьирует от 2,2 до 30% [1,3,4,7,9,11,15,16].
Целью настоящего исследования явилось изучение причин рецидивов рака с учетом особенностей клинического течения, уточнение места хирургического лечения с одномоментным реконструктивно-восстановительным этапом и лазерной фотодеструкции.
Методы исследования. В офтальмоонкологическом центре Челябинского областного онкологического диспансера за период 1999-2005 гг. под нашим наблюдением находилось 429 больных с БКР кожи век. Рецидивирующее течение БКР кожи век имело место в 72 случаях (19,7%), из них женщин - 49 (68%), мужчин - 23 (32%); средний возраст больных составил 66,9 ±7,5лет. Особенности клинического течения рецидивного рака кожи век изучены в сравнении с контрольной группой (100 первичных больных БКР кожи век), безрецидивная ремиссия у которых после лечения составила 5 лет.
Комплексное офтальмологическое обследование дополнялось определением локализации образования, его размеров, распространенности. По показаниям проводили компьютерную томографию, ультразвуковое исследование регионарных лимфатических узлов, термографию лица и шеи. Верификацию диагноза осуществляли на основе цитологического и патоморфологического исследований биоптатов.
Иссечение опухоли с одномоментным реконструктивно-восстановительным этапом по поводу рецидивов БКР кожи век выполнено 60 (83,3%) пациентам с использованием местной, реже - общей (43%) анестезии. Оценку характеристики дефектов тканей, возникающих при хирургическом лечении, осуществляли на основе классификации, предложенной С.А. Васильевым [5]. Лазерная фотодеструкция рецидива БКР кожи век произведена 12 больным (16,7%) с использованием диодного лазера АЛОД-1 «Алком».
Результаты и их обсуждение. Изучение взаимосвязи развития рецидивов БКР кожи век с методами лечения показало, что они возникают преимущественно после короткодистанционной рентгенотерапии (46,2%), криодеструкции (33,8%), реже - после хирургического лечения (20%). Это можно объяснить превалированием лучевых и криохирургических методов лечения у данной категории больных, которые проводились до создания специализированного офтальмоонкологического центра в Челябинской области.
Анализ сроков появления рецидивов БКР кожи век свидетельствует о том, что они появляются у 89% больных в первые 5 лет. А их ежегодная частота, по нашим данным, составляет 10,8 - 29,2%. Однократный рецидив наблюдали у 82% пациентов, повторные - у 28%. Согласно полученным данным у больных с рецидивирующим течением БКР достоверно чаще (24,5%) по сравнению с группой контроля (9,0%) наблюдается множественный характер поражения.
Удельный вес рецидивов в структуре больных с БКР кожи век представлен на рис.1.
Анализ представленных данных отражает увеличение (12,3% до 26,10%) данного показателя в 1999-2003 гг. и снижение (6,9%) в 2004 г., что обусловлено как увеличением потока больных в специализированный центр, так и сроками возникновения рецидивов заболевания.
Сравнение распределения пациентов по стадиям (по системе TNM) опухолевого процесса показало, что рецидивы заболевания достоверно чаще развивались у больных с T2N0M0 (36,9%) и T3-4N0M0 (24,6%) стадиями. В контрольной группе эти показатели составили 23 и 11% соответственно.
При изучении анатомотопографической локализации рецидивов БКР кожи век установлено, что в сравнении с контрольной группой они достоверно чаще наблюдались при локализации опухоли на коже нижнего века с вовлечением интермаргинального пространства (27,7 и 15% соответственно), при распространенном характере поражения с захватом двух и более анатомических зон (24,6 и 12% соответственно).
Данные о частоте клинических форм и патоморфологических вариантов БКР кожи век [6] в исследуемых группах представлены в таблице 1.
Из таблицы 1 следует, что рецидивы БКР кожи век достоверно чаще развивались у больных с язвенной формой (57%) и при агрессивно-растущем (46,7%) и смешанном (26,6%) типах роста.
Динамический характер наблюдений позволил выявить клинические особенности рецидивов БКР кожи век, для течения которых наиболее характерно оказалось наличие язвенной и узловой форм роста. Рецидивы язвенной формы БКР кожи век возникали преимущественно у больных с опухолью T2-4N0M0 стадией, характеризовались инфильтративным ростом, наличием дефекта размерами от 5 до 20 мм, рубцово-измененной кожи по периферии образования, у трети больных - распространенного характера поражения с вовлечением слезного мясца, внутренней спайки век, конъюнктивы, склеры глаза, мягких тканей орбиты, кожи спинки носа и скуловой области.
Узловая форма рецидивов БКР возникала более чем у половины больных в стадии T1-2N0M0; клинически характеризовалась в большей степени ростом по периферии, чем в высоту, слабой подвижностью образования, обусловленной постлучевыми изменениями кожи. Наиболее часто (61,5%) узловую форму рецидива базально-клеточного рака в периокулярной области мы наблюдали на нижнем веке.
Хирургическое лечение рецидивов БКР кожи век выполнено 60 (83,3%) пациентам. Для оптимизации реконструктивно-восстановительного этапа мы изучили характеристику дефектов тканей, возникающих при иссечении опухоли. Установлено, что при хирургическом лечении рецидивов БКР кожи век превалировали полнослойные дефекты (72,0%), срединной (53,%%) и медиальной (34,9%) локализации, средних и больших размеров (74%).
С учетом локализации и характеристики тканевых дефектов использовались различные виды пластик.
При небольших дефектах кожи пластику выполняли с применением кожного аутотрансплантата с противоположного верхнего века ипсилатерального глаза либо скользящими горизонтальными (вертикальными) кожными лоскутами.
Дефекты век средних размеров возникали при иссечении рецидивов, развивающихся преимущественно после короткодистанционной рентгенотерапии. В этой группе больных чаще наблюдались полнослойные дефекты срединной локализации. Это обусловливало необходимость реконструкции тарзо-конъюнктивальной пластинки: скользящим лоскутом, с верхнего века «на ножке» в сочетании с различными модификациями кожных лоскутов - ротационными лоскутами с щеки, лба, спинки носа, кожным аутотрансплантатом (рис.2).
Большие, субтотальные и тотальные дефекты век и периокулярных тканей были полнослойными, локализовались в области нижнего века; внутреннего, наружного углов глаза; спинки носа; области щеки, виска. Для пластики таких дефектов использовали тарзо-коньюнктивальный вертикальный лоскут на ножке с верхнего века в сочетании с кожными ротационными лоскутами с височной области, лба, V -Y лоскутом со щеки (рис.3).
В трех случаях при рецидиве разрушающего варианта язвенной формы БКР кожи век распространенный характер поражения обусловил целесообразность выполнения экзентерации орбиты c пластикой обширного дефекта височной мышцей на питающей ножке и свободным TRAM лоскутом.
Лазерную фотодеструкцию опухоли (рис.4) проводили при рецидивах узловой формы БКР кожи век начальной стадии, возникших после криодеструкции и локализовавшихся на нижнем веке с вовлечением интермаргинального пространства и на внутреннем углу глаза. В послеоперационном периоде на 1-2 день в зоне фотодеструкции формировалась корочка, спустя 5-10 дней наблюдались явления нежного рубцевания. Средние сроки пребывания на больничном листе у данной группы составили 6±2,4 дня.
Резюмируя изложенное, позволим себе заключить, что рецидивы БКР кожи век чаще возникали у больных, получивших короткодистанционную рентгенотерапию или криодеструкцию при размерах опухоли Т2-Т3. После хирургического лечения с одномоментной пластикой рецидивы БКР кожи век имели место в 2,8 % случаев.
Литература:
1. Абунамус С.М. Рецидивирующее течение базально - клеточного рака кожи век: клинико - морфологические особенности, лечение // Диссертация на соискание степени канд. мед. наук. Челябинск, 2004. С. 87-95.
2. Апатенко А.К. Эпителиальные опухоли и пороки развития кожи. - М.: Медицина, 1973. С. 237.
3. Бровкина А.Ф. Офтальмоонкология: Руководство для врачей. - М.: Медицина, 2002. - 424с.:ил. С. 193-197.
4. Буйко А.С., Сафроненкова И.А., Питерова О.В. Эпителиальные злокачественные опухоли кожи век стадии Т3 - 4: комбинированное лечение или скальпель? // Офтальмологический журнал, 2002. №1. С. 30-34.
5. Васильев А.С. Пластическая хирургия в онкологии // Челябинск, 2002. С. 49-51.
6. Гистологическая классификация опухолей кожи // Международная гистологическая классификация опухолей № 12. - Женева: ВОЗ, 1980. С. 94.
7. Ежова М.Н. Современные методы терапии различных форм базально-клеточного рака кожи // Рос. журн. кож. и венер. болезней. 1998. №2. С. 8 - 12.
8. Злокачественные новообразования в России в 1998 году (заболеваемость и смертность) // Под ред. В.И. Чиссова, В.В. Старинского. - М., 1999. С.268.
9. Ключарева С.В. Новообразования кожи в офтальмологической практике и современные методы их хирургического лечения лазерной установкой на парах меди «Яхрома-Мед» // Клин. Офтальмология, 2005. Т. 6, №1. С. 23-28.
10. Усова Р.А. Базально - клеточный рак кожи век: эпидемиология, клинико - морфологическая характеристика // Диссертация на соискание степени канд. мед. наук. Челябинск, 2002. С. 75.
11. Andres M., Sporl E., Krantz H., Matthaus W., Seiler T. Cry therapy of malignant eyelid tumors// Ophthalmologe. 1992. №6 - P. 787-792
12. Leoro F., Caro R.de, Caro G. de, Ninfo V. Eyelid basal cell carcinoma with intracranial extension // Ophthal. Plast. Reconstr. Surg. 1998. - Vol.14, №1. - P.50-56.
13. Goldberg L.H. Basal cell carcinoma // Lancet, 1996. - Vol. 347, Issue 9002. P. 663-667.
14. Margo C. Basal cell carcinoma of the eyelid and periocular skin / C.Margo, K. Waltz // Ophthalmology, 1993. - Vol. 38, №2. P.169-192.
15. Pass H.I. Photodynamic therapy in oncology: mechanisms and clinical // Ibid, 1993. Vol.85, №6. P. 443-456.
16. Randle H.W. Basal cell carcinoma. Identification and treatment of the high-risk patient // Derm. Surg., 1996. - Vol. 22, №3. P. 255-261.
Лечение кожи лучами Букки

Лучи Букки широко применялись для лечения целого ряда болезней и дефектов кожи в середине ХХ века. Позже метод постепенно утратил популярность, но и сегодня такие процедуры можно встретить во многих косметологических и дерматологических клиниках. Чем может помочь Букки-терапия и когда она действительно необходима, разбирался MedAboutMe.
Уменьшение зуда, выравнивание кожи и другие эффекты Букки-терапии
Лучи Букки (пограничные лучи) - это один из видов рентгеновского облучения, направленные и короткие лучи. Их особенность в том, что они не могут проникать в кожу дальше поверхностных слоев - именно в них задерживается 90% всего излучения. Это дает возможность активно воздействовать на эпидермис и при этом не наносить вред другим тканям, сосудам и внутренним органам.
Такое рентгеновское излучение является местной терапией, а это значит, что действует только в зоне влияния лучей. Лечение кожи этим методом активизирует метаболические процессы и улучшает кровообращение. С помощью Букки-терапии удается добиться следующих результатов:
- Снимается воспаление и шелушение.
- Уходит зуд.
- Поврежденная кожа быстрее восстанавливается.
- Разравниваются различные дефекты (рубцы, шрамы и прочее).
- Исчезает покраснение.
- Уменьшается или полностью исчезает боль.
Количество сеансов облучения врач подбирает индивидуально, в зависимости от того как протекает заболевание кожи. Чаще всего назначается две процедуры с интервалом в 45 дней. Но в тяжелых случаях курс может составлять до 10 таких сеансов.
Лечение кожи при келоидных рубцах
Сегодня лучи Букки чаще всего применяются для устранения келоидных рубцов, вызванных разрастанием соединительной ткани. Причем процедуры могут быть назначены еще на этапе профилактики, если врач видит, что травмированная кожа плохо заживает и деформируется. Рентген-терапия способна замедлить формирование рубца и со временем полностью его убрать. Кроме этого, направленное облучение используется в пластической хирургии - с его помощью уменьшается количество осложнений после проведенных корректирующих операций. Например, сеансы Букки-терапии могут быть рекомендованы после пластики век и круговой подтяжки лица.
Дерматологи отмечают, что Букки-терапия очень эффективна, если применяется на протяжении первого года после травмы кожи - по статистике, с помощью направленного излучения выравниваются 9 из 10 свежих рубцов. Даже серьезные дефекты становятся менее заметными, например, келоидный рубец может перейти в гладкий.
Лечение кожи со старыми келоидными рубцами с помощью лучей Букки, по мнению специалистов, будет менее эффективным. Особенно тяжело коррекции поддаются участки после лазерной коррекции. В таких случаях рентгеновское облучение тоже может применяться, но только в комплексной терапии. Например, сеансы могут проводиться после хирургического удаления рубца или криодеструкции, в качестве профилактики.
Лучи Букки при других заболеваниях кожи
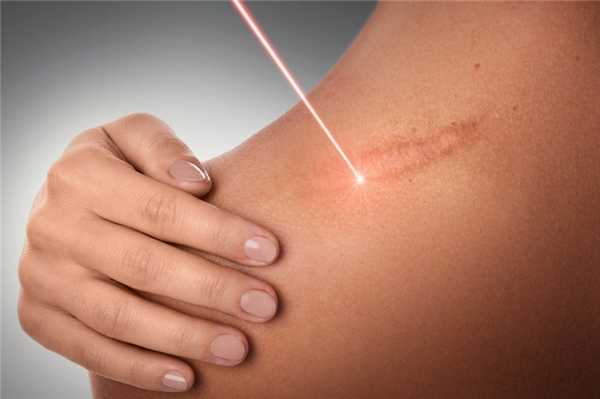
Поскольку лучи Букки способны активизировать обменные процессы, их также используют для лечения некоторых заболеваний кожи. Большой популярностью они пользуются у больных псориазом, поскольку уже после первого сеанса удается уменьшить выраженность симптомов - снять зуд и шелушение. В этих же целях терапия применяется и для лечения кожи при других хронических неинфекционных болезнях, среди которых:
- Нейродермит.
- Экземы (себорейная экзема и поражение волосистой части головы).
- Красный плоский лишай.
- Фолликулярный вегетирующий дискератоз.
Другие заболевания кожи, при которых врач может назначить Букки-терапию:
- Угревая сыпь.
- Микозы - грибковые поражения кожи. В этом случае излучение используется исключительно как дополнительная терапия.
- Герпетическая сыпь.
- Гидраденит - гнойное воспаление потовых желез.
- Хейлит - воспаление красной каймы губ.
- Гемангиома - доброкачественная опухоль.
- Плоские бородавки.
Противопоказания терапии и возможные осложнения на коже
Если сеанс Букки-терапии проведен правильно, кожа не повреждается облучением. Но все же после процедуры могут возникнуть покраснение или пигментация, которые должны пройти максимум за 14 дней. Если этого не происходит, нужно обязательно обратиться к врачу и, возможно, прекратить курс Букки-облучения. Изменение цвета кожи - частое осложнение, которые возникает у пациентов после рентгеновского лечения. Также могут появляться сосудистые сеточки или звездочки, шелушащиеся участки и прочее. В тяжелых случаях после сеанса появляются ранки, которые потенциально могут переродиться в язвы и даже плоскоклеточный рак.
Именно такие осложнения и привели к тому, что сегодня лучи Букки используются, скорее, как дополнительная процедура, и назначаются в том случае, если другие методы не помогли облегчить заболевание кожи. Однако многие дерматологи настаивают, что побочные эффекты вызваны не вредом самих лучей, а неправильным выбором параметров облучения, поскольку для каждого пациента назначается индивидуальный курс Букки-терапии.
И все же такое лечение кожи однозначно противопоказано пациентам со следующими проблемами:
- Почечная недостаточность и другие болезни почек.
Различные нарушения кровообращения.
Уход за кожей после проведения процедуры

После процедуры рентгеновского облучения кожа нуждается в дополнительном уходе. При келоидных рубцах для ускорения регенерации назначаются жирные кремы, которые нужно будет использовать до следующей процедуры - то есть на протяжении полутора месяцев. Чаще всего на первом этапе назначаются заживляющие средства, такие как:
- Спасатель.
- Эплан.
- Солкосерил.
- Бепантен.
- Ируксол.
- Банеоцин.
Приблизительно через две недели препарат можно заменить обычным питательным кремом для рук, лица или тела. Лучше всего выбрать средство, которое уже использовалось и не вызывает аллергии.
Хронические заболевания кожи (псориаз, нейродермит, экзема) потребуют дополнительного ухода после процедуры Букки-терапии. Необходимые средства в этом случае назначаются исключительно лечащим врачом с учетом динамики болезни, выраженности симптомов, размера очагов повреждения и прочего.
Лучевая терапия: риски реальные и мнимые

Врачи лечат рак при помощи лучевой терапии уже более 120 лет. И если на первых порах ни ученые, ни врачи, ни, конечно же, пациенты не осознавали всю степень опасности метода, позволяющего уничтожать до этого неизлечимые раковые опухоли, то сегодня метод лучевой терапии используется намного более обдуманно и гуманно, позволяя сохранять здоровье врачам и успешно лечить пациентов.
Но в сознании немалого числа людей ядерная бомба, разрушившая Хиросиму, Чернобыльская трагедия и облучение раковых пациентов находятся где-то рядом. Объединяет их одно слово: «радиоактивность». Понятно, что радиоактивное излучение необходимо, чтобы убить раковые клетки, но как тогда сам облученный человек остается в живых и не опасен ли он для окружающих, рассказывает MedAboutMe.
Онкологические болезни и лучевая терапия

Сегодня онкологические пациенты в большинстве случаев получают комбинированную терапию:
- хирургическая операция по удалению раковых опухолей и пораженных ими тканей;
- лекарственная, то есть химиотерапия — удар по опухоли сильнодействующими лекарствами, что приводит к развитию тяжелых побочных эффектов (легкой «химии» в онкологии не бывает);
- лучевая терапия.
Лучевая терапия использует ионизирующее излучение, которое отличается от других видов излучений тем, что может проникать глубоко в ткани и запускать процессы изменений в клетках живого организма. Главная задача лучевой терапии — нанести максимальные повреждения раковой опухоли и минимизировать воздействие на здоровые клетки и ткани, которые находятся вокруг нее.

При лечении рака выпадение волос обычно развивается как побочный эффект от химиотерапии — медикаментозного лечения. Вводимые в тело человека сильнодействующие лекарства работают системно, поэтому выпадают волосы на голове, в области бровей и на других частях тела. При лучевой терапии выпадение волос происходит только при непосредственном воздействии ионизирующего излучения на данный участок — например, при лечении опухолей головы. На других участках тела волосы не выпадают.
Источники излучения снаружи и внутри тела пациента

Облучать пациента можно двумя путями:
1. При помощи внешнего источника излучения (так называемое дистанционное облучение)
При этом источник находится на некотором расстоянии от злокачественной опухоли, вне тела человека. К этой группе методов сегодня относятся нейтронная и протонная разновидности терапии, дистанционная гамма-терапия, лучевая терапия быстрыми электронами, некоторые виды рентгенотерапии (близкофокусная, например), и др.
2. При помощи источника ионизирующего излучения, введенного в тело больного (внутреннее облучение). В этом случае выделяют две основных подгруппы методов:
При этом максимально близко к опухоли или прямо в нее вводятся радиоактивные вещества (радионуклиды) — радий-226, иридий-192, цезий-137, йод-125, кобальт-60. Радионуклиды могут быть введены внутрь органа, ткани, сосуда, просвета (бронхи или пищевод) и т. д. Их вводят вручную или автоматизированным путем, дистанционно. Само вещество, испускающее ионизирующее излучение, разрушающее опухоль, находится на графитовой или серебряной матрице и заключено в титановую капсулу. Количество и разновидность радионуклида подбираются таким образом, чтобы через определенное время (1-2 месяца) излучение полностью прекратилось, или капсула изымается из тела по окончании курса лечения.
В отличие от брахитерапии, в этом случае в тело пациента вводятся радиофармацевтические препараты — так называются радионуклиды, тропные к четко определенным тканям. То есть, при введении их в тело человека они довольно быстро собираются в конкретной ткани или в органе и абсолютно «равнодушны» ко всему остальному организму. Так, для лечения опухолей щитовидной железы используют йод-131, а для лечения метастазов в костях — стронций-89 или самарий-153 и др. Пограничным методом лечения, в основу которого лег принцип тропности, стал метод радиоиммунной терапии: при этом к радионуклидам «прицепляют» моноклональные антитела, которые приводят источники излучения прямиком в опухоль, где и происходит процесс терапии.
Радиоактивность и больные раком

Итак, если источник излучения находится снаружи, то сам пациент не становится радиоактивным в процессе лечения. Его организм, а точнее, злокачественная опухоль в его теле (и окружающие ее клетки) подвергается воздействию разрушающего ионизирующего излучения. Но радионуклиды в тело не попадают.
Это значит, что при дистанционной лучевой терапии онкологических болезней он не представляет никакой опасности для окружающих его людей и может беспрепятственно общаться со своими близкими сразу после процедур.
Наши ткани имеют разное происхождение и состоят из клеток разных типов, которые могут отличаться друг от друга по чувствительность к лучевой терапии. Злокачественные опухоли кожи (но не меланома) и слизистой полости матки, например, намного более остро реагируют на лучевую терапию по сравнению с опухолями, развившимися из клеток мышц. И даже внутри одной опухоли ее наружные слои будут более чувствительны к излучению, чем внутренние.
Следует добавить, что курс дистанционной лучевой терапии может назначаться на довольно длительное время. Это необходимо для того, чтобы здоровые клетки тела успевали восстановиться после воздействия на них ионизирующим излучением. Промежутки между процедурами рассчитываются таким образом, чтобы больным, опухолевым клеткам не хватало времени и ресурсов на восстановление.
Совсем иначе выглядит ситуация, когда в тело человека вводятся источники радиоактивного излучения. При этом на протяжении определенного времени пациент становится сам по себе таковым источником. Но очень слабым. Излучение не распространяется за пределы 1-2 см от источника. Поэтому на протяжении 1-2 месяцев пациенту при проведении брахитерапии, например, не следует сажать на коленки детей, а также близко общаться с беременными женщинами. Остальные посетители больного допускаются к нему на полчаса в день.
Если капсула с радиоактивным источником не извлекается, она может определяться детекторами в аэропортах, поэтому таким пациентам выдают специальный документ, в котором подтверждается наличие радиоактивной капсулы в их теле. Подчеркнем еще раз, что для других людей она опасности уже не представляет.
Если при брахитерапии радиоактивный источник заключен в капсулу и находится в конкретном участке тела человека, то при проведении системной лучевой терапии вещества сконцентрированы в определенной ткани, но ничем не ограничены. Поэтому они могут выводиться с мочой и другими биологическими жидкостями. И эти жидкости будут радиоактивны.
Обычно проблемы опасности пациента для других людей не возникает, потому что на протяжении нескольких дней, пока уровень радиоактивности не снизится до безопасного, он находится в больнице и лежит в отдельной палате, где отходы жизнедеятельности больного попадают не в канализацию, а в специальные емкости.
Читайте также:
