Полинейропатия критических состояний. Диагностика, лечение
Добавил пользователь Валентин П. Обновлено: 01.02.2026
Диабетическая нейропатия - повреждение нервов, обусловленное диабетом, клинически очевидное или субклиническое, при отсутствии другой возможной этиологии (WHO) [1]. Наиболее изученной и распространенной формой диабетической нейропатии является дистальная симметричная полинейропатия. ДСПН - наличие симптомов дисфункции дистальных отделов периферических нервов у пациентов с сахарным диабетом после исключения других причин [2].
Код(ы) МКБ-10:
| МКБ-10 | |
| Код | Название |
| G63.2* | Диабетическая полинейропатия (E10-E14+ с общим четвертым знаком.4) |
Дата разработки/пересмотра протокола: 2017 год.
Сокращения, используемые в протоколе:
| GPP | Good Point Practice (Надлежащая клиническая практика) |
| WHO | World Health Organization (Всемирная организация здравоохранения) |
| ВАШ | визуальная аналоговая шкала |
| ДАН | диабетическая автономная нейропатия |
| ДМН | диабетическая мононейропатия |
| ДН | диабетическая полинейропатия |
| ДПН | диабетическая полинейропатия |
| ДСПН | диабетическая сенсомоторная полинейропатия |
| МКБ 10 | международная классификация болезней 10-го пересмотра |
| НС | нервная система |
| РКИ | рандомизированные клинические исследования |
| СД I | сахарный диабет I типа |
| СД 2 | сахарный диабет II типа |
| ЭНМГ | Электронейромиография |
Пользователи протокола: неврологи, эндокринологи, врачи общей практики.
Категория пациентов: взрослые.
Шкала уровня доказательности:
Таблица 1 - Шкала уровней доказательности
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+). Результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов. |
| GРP | Надлежащая клиническая практика. |

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
Согласно классификации Американской ассоциации диабета от 2016 [2]:
Диффузные нейропатии
Диабетическая сенсомоторная полинейропатия:
· преимущественно мелких волокон;
· преимущественно крупных волокон;
· смешанные (мелких и крупных волокон) - наиболее частые.
Автономная нейропатия
Кардиоваскулярная
· брадикардия;
· тахикардия в покое;
· ортостатическая гипотензия;
· внезапная смерть (злокачественная аритмия).
Гастроинтестинальная:
· диабетический гастропарез (гастропатия);
· диабетическая энтеропатия (диарея);
· толстокишечная гипомоторика (запоры).
Урогенитальная:
· диабетическая цистопатия (нейрогенный мочевой пузырь);
· эректильная дисфункция;
· женская половая дисфункция.
Судомоторная дисфункция:
· дистальный гипогидроз/ангидроз;
· «вкусовая» потливость (связанная с приемом пищи);
· отсутствие предвестников гипогликемии;
· аномальная функция зрачка.
Мононейропатия (атипичные формы):
· изолированные нейропатии черепно-мозговых или периферических нервов;
· множественные мононейропатии.
Радикулопатия/полирадикулопатия (атипичные формы):
· радикулоплексусная нейропатия (пояснично-крестцовая полирадикулопатия, проксимальная моторная амиотрофия);
· грудная радикулопатия.
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ
Диагностические критерии 4
Жалобы:
· онемение кончиков пальцев ног, стоп;
· парэстезии;
· жжение в пальцах ног, подошвах, икрах;
· боли в пальцах ног, подошвах, икрах;
· слабость в нижних конечностях;
· крампи;
· симметричная дистальная локализация неврологических симптомов.
Анамнез:
· наличие СД1 или СД2;
· появление и постепенное нарастание выраженности вышеперечисленных жалоб, коррелирующих с тяжестью и длительностью СД;
· характерно усиление симптоматики в ночное время;
· перенесенные длительно незаживающие язвенные дефекты в стопах;
· перенесенные порезы и др. травматические повреждения в стопах, не сопровождающиеся болевыми ощущениями
Физикальное обследование:
Общий неврологический осмотр:
· исследование тактильной чувствительности на конечностях с помощью стандартного микрофиламента (10 г) (80);
· исследование болевой чувствительности на конечностях с помощью неврологической иглы, одноразовой зубочистки/зубчатого колеса (Pin-wheel);
· исследование температурной чувствительности на конечностях с помощью термического наконечника (Tip-term), поочередного прикосновения пробирок с водой различной температуры (20°С и 40°С);
· исследование вибрационной чувствительности с помощью градуированного камертона 128 Гц или биотензиометра;
· исследование мышечно-суставного чувства;
· исследование коленных и ахилловых рефлексов;
· исследование силы мышц;
· исследование статики и походки с открытыми и закрытыми глазами;
· исследование координационных проб (пальце-носовой и пяточно-коленной) с открытыми и закрытыми глазами.
Все исследования чувствительности проводятся симметрично с обеих сторон по направлению от дистального отдела проксимально.
Клинически значимы следующие признаки:
· снижение/отсутствие болевой, температурной чувствительности в дистальных отделах нижних конечностей;
· аллодиния (синдром, при котором человек чувствует боль от факторов, которые обычно боли не вызывают, например, механическая/тактильная аллодиния, когдаболь возникает от прикосновений) в дистальных отделах нижних конечностей;
· гиперэстезия(повышенная чувствительность к раздражителям) в дистальных отделах нижних конечностей;
· снижение/отсутствие вибрационной чувствительности и мышечно-суставного чувства в дистальных отделах нижних конечностей;
· снижение/выпадение ахилловых и коленных рефлексов;
· снижение силы мышц в дистальных отделах конечностей;
· нарушение координации при закрытых глазах (сенситивная атаксия).
Лабораторные исследования: смотрите клинический протокол СД1 и СД2 у взрослых.
Инструментальные исследования:
Стимуляционная ЭНМГ нижних конечностей с оценкой скорости проведения по моторным и сенсорным волокнам, не менее 2-х нервов с каждой стороны (снижена у больных сахарным диабетом до 35-40 м/сек при норме 50-65м/сек, наиболее выражена в дистальных отделах нижних конечностей) (УД-B) [3].
Проведение данного исследования является самым объективным для динамического наблюдения, оценки эффективности проводимой терапии [2,11-13].
Дуплексное сканирование сосудов нижних конечностей (при подозрении на диабетическую ангиопатию) покажет толщину артериальной стенки, стеноз просвета артерий нижних конечностей, наличие атеросклеротических бляшек, степень кальцификации, снижение эластичности артериальной стенки [1].
Рентгенография стопы в 2-х проекциях (при подозрении на нейроостеоартропатию Шарко)выявляет деформацию, деструкцию костей, суставов; в более поздних стадиях - фрагментации суставов с ремоделированием кости, возникающим компенсаторно с целью восстановить устойчивость костей и суставов, при этом кости фиксируются в новом положении [1].
Показания для консультации специалистов:
· консультация ангиохирурга - с целью исключения/диагностирования диабетической ангиопатии, синдрома диабетической стопы;
· консультация хирурга-ортопеда - с целью исключения/диагностирования нейроостеоартропатии Шарко;
· консультация хирурга - при язвенном дефекте стопы с/без инфицированием/-я;
· консультация эндокринолога - при нестабильной гликемии, усугубляющей течение ДСПН;
· консультация кардиолога;
Согласно консенсусу, принятому в Сан-Антонио (1988, 1992 гг.), для диагноза ДСПН необходимы как минимум наличие одного симптома и одного изменения, выявленного при электродиагностических исследованиях [21,22].
Проведение скрининга на ДСПН
Таблица 2 - Категории пациентов для проведения скрининга на ДСПН [2]
| Категории пациентов для проведения скрининга | Уровень доказательности |
| все пациенты с впервые выявленным СД2 | В |
| пациенты с СД1 через 5 лет после постановки диагноза | В |
| пациенты на «Д» учёте без ранее диагностированной ДСПН | В |
| пациенты с нарушенной толерантностью к углеводам | В |
Диагностический алгоритм:
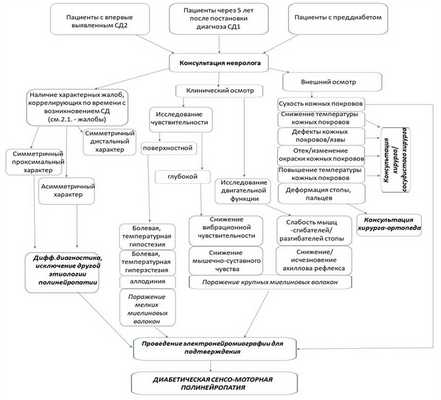
Рисунок 1. Алгоритм диагностики ДСПН [14,15]
Дифференциальный диагноз
Дифференциальный диагноз и обоснование дополнительных исследований
ДСПН является диагнозом-исключением. Наличие сахарного диабета и признаков полинейропатии не означает автоматически наличие диабетической полинейропатии. Для постановки окончательного диагноза требуется тщательная дифференциальная диагностика [2].
Таблица 3 - Дифференциальная диагностика ДСПН [2,14,15]
| Диагноз | Обоснование для дифференциальной диагностики | Обследование | Критерии исключения диагноза |
| Алкогольная ПН | Признаки полинейропатии, не укладывающиеся в рамки ДПНП* | Биохимический анализ крови. УЗИ ОБП. | Анамнестические данные. Наличие алкогольной дистрофии печени, других проявлений со стороны НС: алкогольная энцефалопатия, алкогольная миелопатия, алкогольная полирадикулонейропатия |
| ПН при аутоиммунных заболеваниях | Признаки полинейропатии, не укладывающиеся в рамки ДПНП* | Иммунологические исследования крови. | Аутоиммунные заболевания в анамнезе. Клинико-лабораторные признаки данных заболеваний. |
| ПН при дефиците витамина В12 | Признаки полинейропатии, не укладывающиеся в рамки ДПНП* | Определение уровня В12 в крови. | Низкая концентрация витамина В12 в сыворотке. Возможно сочетание с макроцитарной мегалобластной анемией. |
| ПН при других метаболических нарушениях (гипотиреоз, гипертиреоз, ожирение) | Признаки полинейропатии, не укладывающиеся в рамки ДПНП* | Анализ крови на гормоны щитовидной железы. УЗИ щитовидной железы | Анамнестические данные. Клинико-лабораторно-инструментальные признаки данных заболеваний. |
| Паранеопластические синдромы | Признаки полинейропатии, не укладывающиеся в рамки ДПНП* | В соответствии с КП онкологических заболеваний. | Анамнестические данные. Результаты инструментальных исследований, указывающие на наличие онкопроцесса. |
| Воспалительные демиелинизирующие ПН (поствакцинальные, после перенесенной острой инфекции) | Признаки полинейропатии, не укладывающиеся в рамки ДПНП* | ЭНМГ. Анализ ликвора. Биопсия n.suralis | Анамнестические данные. Специфические данные на ЭНМГ. Обнаружение белка в ликворе. Специфические изменения биопсии n.suralis |
| Наследственные ПН | Признаки полинейропатии, не укладывающиеся в рамки ДПНП* | Исследования в лабораториях молекулярно-генетического профиля. ЭНМГ | Анамнестические данные. Семейный анамнез. Клинико-лабораторные признаки того или иного наследственного заболевания. |
| ПН при экзогенных интоксикациях (свинец, мышьяк, фосфор и др.) | Признаки полинейропатии, не укладывающиеся в рамки ДПНП* | Анализы крови и мочи на наличие токсических веществ. | Анамнестические данные. Клинико-лабораторные признаки той или иной интоксикации. |
| ПН при эндогенных интоксикациях (хроническая печеночная недостаточность, хроническая почечная недостаточность) | Признаки полинейропатии, не укладывающиеся в рамки ДПНП* | Биохимические анализы крови и мочи. УЗИ и\или МРТ ОБП и почек | Анамнестические данные. Клинико-лабораторно-инструментальные признаки хронической печеночной недостаточности или хронической почечной недостаточности. |
| ПН при инфекциях (сифилис, лепра, ВИЧ, бруцеллез, герпес, дифтерия и др.) | Признаки полинейропатии, не укладывающиеся в рамки ДПНП* | Анализ крови (ИФА, ПЦР и др.) на наличие определенных инфекций. | Анамнестические данные. Клинико-лабораторные признаки той или иной инфекции |
*несимметричная/преимущественно моторная/локализованная в верхних конечностях/остро развившаяся полинейропатия
Полинейропатия - симптомы и лечение
Что такое полинейропатия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Богдановой Евгении Павловны, нейрофизиолога со стажем в 10 лет.
Над статьей доктора Богдановой Евгении Павловны работали литературный редактор Вера Васина , научный редактор Наталья Пахтусова и шеф-редактор Маргарита Тихонова

Определение болезни. Причины заболевания
Полинейропатия (Polyneuropathy) — это группа заболеваний периферической нервной системы, при которых повреждаются периферические нервные волокна, входящие в состав различных нервов. Полинейропатия может быть вызвана множеством причин, но проявляется общими симптомами: слабостью в руках и ногах, онемением, покалыванием и жжением в кистях и стопах.

Полиневропатия и полинейропатия — это разные варианты написания одного и того же термина.
Как часто встречается полинейропатия
Полинейропатией страдает около 2,4 % населения, заболевание чаще встречается среди пожилых людей [6] .
Причины полинейропатии
Выделяют первичные и вторичные полинейропатии. Первичные полинейропатии — это наследственные формы, которые могут сочетаться с поражением других органов и отделов нервной системы. К наследственным полинейропатиям относятся транстиретиновая семейная амилоидная полинейропатия, болезнь Фабри, порфирийная полинейропатия, болезнь Рефсума.
Вторичные полинейропатии встречаются гораздо чаще. В зависимости от причинного фактора их можно разделить на несколько видов:
- Инфекционные и инфекционно-аллергические (с известным и неизвестным возбудителем, аллергические). В эту группу входит синдром Гийена — Барре.
- Токсические: медикаментозные, при хронических бытовых и производственных интоксикациях (ртутью, свинцом, литием), при токсикоинфекциях (ботулизм, дифтерия, столбняк), алкогольные. Медикаментозные полинейропатии могут развиться при приёме Амиодарона, Колхицина, Хлоракина, Хлорамфеникола, Дапсона, Дисульфирама, Этамбутола, Этионамида, Глутетимида, статинов, Изониазида, Гидралазина, Фенитоина, Никотинамида, препаратов золота. Чаще всего полинейропатия развивается при длительном применении больших доз этих лекарств. Также к ней может привести приём нуклеозидов — препаратов для лечения ВИЧ-инфекции. Полинейропатия может возникать на фоне химиотерапии — примерно через месяц после начала применения Цисплатина, если доза превышает 400 мг/м 2 ; при терапии Винкристином и Винбластином — нередко в первые два месяца лечения, если суммарная доза препаратов превышает 30-50 мг [8] . В редких случаях полинейропатию вызывает Интерферон-альфа, используемый при гепатите С и опухолях.
- При воздействии физических факторов: холода, вибрации, радиации, хронических компрессиях (из-за утолщения оболочек вокруг нерва при системных болезнях соединительной ткани) и т. д.
- Сосудистые: при системных заболеваниях соединительной ткани, специфических и неспецифических васкулитах, атеросклерозе.
- Метаболические: при болезнях обмена веществ, дефиците витаминов (алиментарные), эндокринных заболеваниях (например, при сахарном диабете), болезнях печени и почек. Полинейропатия может быть первым проявлением сахарного диабета, чаще всего 2-го типа.
- Паранеопластические (при злокачественных новообразованиях).
Около 20-30 % аксональных полинейропатий, т. е. возникших из-за повреждения длинных отростков нервов, являются идиопатическими: их причину не удаётся выявить, несмотря на полную диагностику [7] . Иногда поиск причины полинейропатии может затянуться на месяцы. Это связано с многообразием провоцирующих факторов и трудностями при сборе анамнеза: пациенты не всегда честно рассказывают о вредных привычках и часто не знают, чем болели родственники.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы полинейропатии
Клиническая картина полинейропатий типична и проявляется следующими симптомами:
- Двигательные нарушения. При заболевании развиваются периферические парезы — снижается мышечная сила и тонус, атрофируются мышцы, угнетаются или исчезают рефлексы. Постепенно слабеют и уменьшаются в размерах мышцы рук и ног, чаще в стопах, голенях и кистях. Пациенты быстро устают при ходьбе, подъёме по лестнице и занятиях спортом, не могут встать на носки и пятки, взять и удержать тяжёлые предметы, чувствуют неловкость в руках, отмечают шаткость при ходьбе.
- Чувствительные нарушения. Страдают глубокие (суставно-мышечное чувство, вибрационная чувствительность) и поверхностные виды чувствительности (чаще — болевая чувствительность). Чувствительные нарушения проявляются следующими симптомами:
- Снижается или исчезает чувствительность к боли и температуре, преимущественно в стопах, голенях и кистях. Немеют руки и ноги, пациенты не различают горячую и холодную воду, могут поранить ногу, наступить на что-то острое и не заметить этого, так как не чувствуют боли.
- Нейропатическая боль — пациенты описывают болевые ощущения по-разному: колющие, кинжальные, жгучие, ноющие, как от удара электрическим током. Боль может сочетаться с нарушением болевой и температурной чувствительности, аллодинией (боль возникает из-за прикосновения к коже) и гипералгезией (слабый раздражитель вызывает сильную боль). Нейропатическая боль часто начинается со стоп, но пациент, как правило, не может указать точно, где болит, и лишь примерно показывает область боли. Боль может быть постоянной или периодической, возникать самопроизвольно или в ответ на прикосновение.
- Из-за нарушения глубоких видов чувствительности развивается сенситивная атаксия: пациент неустойчив, вынужден при ходьбе всегда смотреть под ноги, так как не чувствует поверхность под ногами. К глубоким видам чувствительности относится ощущение вибрации и суставно-мышечное чувство — понимание положения своего тела в пространстве. При ходьбе по твёрдой поверхности у больного возникает ощущение мягкого ковра под ногами. Особенно сложно передвигаться в темноте, когда невозможно смотреть под ноги. В таких случаях пациенты часто падают.
- Трофические нарушения. Истончается кожа и изменяется её окраска, утолщаются ногтевые пластины. Эти изменения связаны с тем, что периферические нервы не только обеспечивают движения мышц, но и питают мышцы и кожу.
При поражении периферических отделов вегетативной нервной системы нарушается работа внутренних органов. Эти нарушения сопровождаются следующими симптомами:
- ортостатическая гипотензия — давление снижается при перемене положения тела, например когда человек сидел или лежал, а потом резко встал ; в покое;
- ригидный пульс, т. е. исчезновение его физиологической нерегулярности;
- пониженное потоотделение;
- нарушение тонуса мочевого пузыря и недержание мочи;
- запоры и диарея; [3][6] .
Патогенез полинейропатии
Периферической называют ту часть нервной системы, которая не входит в центральную нервную систему, т. е. нервы за пределами головного и спинного мозга.

Периферическую нервную систему образуют длинные отростки нервных клеток, тела которых залегают в спинном мозге, стволе головного мозга, спинномозговых и вегетативных узлах. Эти длинные отростки называют аксонами. Аксоны получают питание из тела нервных клеток [11] .
Выделяют два типа нервных волокон: тонкие ( безмиелиновые ) и толстые ( миелиновые ). Миелин окружает аксон прерывистой электроизолирующей оболочкой, благодаря чему возбуждение передаётся быстрее. Этому способствуют перехваты Ранвье — периодические участки, не покрытые миелином.

Полинейропатии делят на два основных класса:
- аксонопатии, или аксональные полинейропатии, — повреждён непосредственно сам аксон;
- миелинопатии, или демиелинизирующие полинейропатии, — поражена миелиновая оболочка аксона.
Зачастую при поражении миелиновой оболочки позже повреждается и сам аксон, а при первичном повреждении аксона со временем разрушается и миелиновая оболочка.
Классификация и стадии развития полинейропатии
Формы полинейропатии в зависимости от причины:
- инфекционные и инфекционно-аллергические;
- токсические;
- от воздействия физических факторов;
- метаболические;
- паранеопластические.
По течению полинейропатии могут быть:
- острыми — развиваются от нескольких дней до четырёх недель;
- подострыми — симптомы усиливаются в течение 4-8 недель;
- хроническими — развиваются в течение нескольких месяцев или лет.
По патоморфологическим признакам выделяют аксонопатии и миелинопатии.
По преобладанию симптомов выделяют:
- сенсомоторные полинейропатии (в равной степени присутствуют чувствительные и двигательные нарушения);
- преимущественно моторные;
- преимущественно сенсорные;
- преимущественно вегетативно-трофические (с нарушением работы внутренних органов).
В чистом виде они встречаются редко, чаще развивается сочетанное поражение двух или трёх видов нервных волокон [6] .
Осложнения полинейропатии
К ослож нениям полинейропатии можно отнести атрофию мышц и утрату движений в конечностях, тревожные и депрессивные расстройства из-за боли при сенсорных полинейропатиях.
Также на фоне полинейропатии могут возникать ожоги, повреждения кожи из-за нарушения чувствительности и частые падения, которые приводят к травмам [15] .
Диагностика полинейропатии
Сбор анамнеза
При диагностике полинейропатии важно выяснить, на что жалуется пациент, какой образ жизни он ведёт и какими болезнями страдают его близкие родственники.
На приёме доктор спрашивает:
- о наличии хронических и онкологических болезней, а также уточняет, проводилась ли химиотерапия;
- о вредных привычках и профессиональных факторах, например работе с тяжёлыми металлами и фосфорорганическими соединениями;
- о схожих симптомах у родственников, например слабости и онемении в ногах и руках, — эти нарушения могут указывать на наследственную полинейропатию.
Нужно обязательно рассказать доктору о вредных привычках, в том числе о злоупотреблении алкоголем, а также о том, что предшествовало развитию полинейропатии, например инфекция, боль в животе, голодание и т. д.
Неврологический осмотр
Доктор осматривает кожу, ощупывает мышцы, измеряет окружность рук и ног, оценивает сухожильные, надкостничные рефлексы и чувствительность.
Сухожильные рефлексы проверяют с помощью лёгкого удара неврологическим молоточком по сухожилию мышцы:
- при ударе по ахиллову сухожилию стопа сгибается в области подошвы;
- при ударе по сухожилию четырёхглавой мышцы бедра разгибается голень (проверка коленного рефлекса);
- при ударе по шиловидному отростку лучевой кости рука сгибается в локте и поворачивается кисть (проверка надкостничного рефлекса).
Если рефлексы выпадают, описанные движения не происходят.
Чтобы оценить походку, силу мышц рук и ног, доктор просит пациента встать на носки и пятки, сесть на корточки и встать, лёжа потянуть стопы на себя и от себя, согнуть и разогнуть ноги в коленях, сжать кулаки, согнуть и разогнуть руки в локтях и т. д.
Нарушение разных видов чувствительности определяют различными методами:
- для оценки температурной чувствительности к коже прикасаются пробирками с тёплой и холодной водой;
- болевую чувствительность проверяют с помощью лёгкого покалывания заострённой деревянной палочкой;
- вибрационную чувствительность исследуют с помощью камертона;
- при оценке суставно-мышечного чувства пациент закрывает глаза, доктор шевелит пальцами его рук и ног, пациент описывает свои ощущения.
Определить интенсивность боли можно с помощью специальных шкал, например DN4 и визуальной аналоговой шкалы (ВАШ). Принцип ВАШ состоит в том, что пациенту предлагают оценить силу боли по 10-балльной шкале, где 0 — это отсутствие боли, а 10 — самая сильная боль, какую он испытывал в жизни. С помощью этой шкалы можно оценить эффективность лечения, сравнив интенсивность боли до него и после.
Лабораторная диагностика
Лабораторная диагностика позволяет установить причину полинейропатии.
К основным лабораторным методам относятся:
- Общий анализ крови, определение концентрации витамина В12, анализ крови и мочи на содержание тяжёлых металлов, проба Уотсона — Шварца (специфическое исследование мочи при подозрении на порфирию).
- Биохимический анализ крови (глюкоза, гликированный гемоглобин, показатели работы печени, почек).
- Исследование антител к ганглиозидам — информативный метод при моторной мультифокальной и хронической воспалительной демиелинизирующей полинейропатии, синдроме Гийена — Барре и других аутоиммунных невропатиях. Однако повышенный титр антител к GM1-ганглиозидам выявляют у 5 % здоровых людей, зачастую у пожилых пациентов [6] .
- Антитела к ассоциированному с миелином гликопротеину (анти-MAG антитела) — определяются при парапротеинемической полинейропатии и ряде других аутоиммунных полинейропатий.
- Исследование спинномозговой жидкости — проводится при подозрении на демиелинизирующие полинейропатии. Повышенное содержание белка в ликворе может указывать на синдром Гийена — Барре, хроническую воспалительную демиелинизирующую полинейропатию. Реже небольшое повышение встречается при диабетической полинейропатии. Избыток клеток в ликворе может указывать на полинейропатию при ВИЧ-инфекции и болезни Лайма[8] .
- Молекулярно-генетический анализ — назначают при подозрении на наследственные мотосенсорные полинейропатии [6] . При анализе берут кровь из вены и отправляют в лабораторию.
Инструментальная диагностика
- Стимуляционная электронейромиография (ЭНМГ) — основной метод диагностики полинейропатии, при котором определяется скорость проведения импульса по двигательным и чувствительным нервам. Позволяет подтвердить полинейропатию, определить её тип (аксонопатия или миелинопатия).
- Игольчатая электромиография с оценкой состояния мышц рук и ног — проводится, если результаты стимуляционной ЭНМГ сомнительны: например, пограничные между нормой и патологией, или требуется дифференциальная диагностика между полинейропатией и поражением мышц (миопатией) [1][2][6] .
- Ультразвуковое исследование нервов (УЗИ) — позволяет определить, на каком именно участке повреждены нервы.
- Биопсия нервов — при полинейропатии проводится редко, целесообразна при подозрении на васкулит и амилоидную полинейропатию. Чаще всего для биопсии выбирают икроножный нерв [6] .

Лечение полинейропатии
Чтобы вылечить полинейропатию, нужно выявить и устранить причину болезни, а также подавить механизмы её развития.
Методы лечения полинейропатии зависят от основного заболевания:
- при сахарном диабете — подбирают диету и терапию, которая снижает уровень глюкозы;
- при дефиците витаминов — дают рекомендации по питанию и назначают витамины;
- при аутоиммунных воспалительных полинейропатиях — применяют плазмаферез и внутривенно вводят иммуноглобулин [14] .
Чтобы уменьшить нейропатическую боль, применяют:
- медикаментозное лечение — антидепрессанты и антиконвульсанты (препараты для лечения эпилепсии);
- немедикаментозное лечение — психотерапия, методы с биологической обратной связью.
Нестероидные противовоспалительные препараты (НПВС) при нейропатической боли неэффективны [6] [8] .
В терапии диабетической полинейропатии широко применяют препараты тиоктовой кислоты — антиоксиданта, защищающего клетки от повреждения [13] .
Помимо медикаментозного лечения, проводится физическая реабилитация: лечебная физкультура, массаж, методы с биологической обратной связью, физиотерапия (электромиостимуляция) и т. п.
Эффективного лечения наследственных полинейропатий пока не существует [6] . При болезни Рефсума основной метод лечения — это диетотерапия, также может применяться плазмаферез . Пациенту нужно ограничить поступление фитановой кислоты, есть меньше зелёных овощей, говядины, рыбы (тунца, пикши и трески).
Прогноз. Профилактика
Прогноз зависит от течения основного заболевания и своевременного и правильного лечения. Также влияет тип полинейропатии: при миелинопатиях прогноз благоприятнее, чем при аксонопатиях [8] .
Наследственные полинейропатии, как правило, неуклонно прогрессируют, но благодаря их медленному развитию пациенты адаптируются и обслуживают себя самостоятельно до поздних стадий болезни.
Прогноз токсических полинейропатий относительно благоприятный при прекращении интоксикации, например если пациент откажется от алкоголя.
При диабетической полинейропатии с адекватной терапией прогноз тоже относительно благоприятный. Без лечения заболевание прогрессирует, а невропатическая боль снижает качество жизни: пациенты не могут нормально спать и работать [6] [8] .
Профилактика полинейропатии
Профилактика заключается в своевременной диагностике и лечении соматических заболеваний, нарушений обмена веществ, а также отказе от алкоголя. Пациентам с хроническими заболеваниями необходимо регулярно посещать лечащего врача и выполнять его рекомендации. При подозрении на полинейропатию доктор направит больного на электронейромиографию [5] [7] .
Людям, занятым на вредном производстве, необходимо регулярно посещать профпатолога. Обычно такие консультации входят в ежегодный профилактический медицинский осмотр.
Пациентам, чьи родственники страдают наследственными формами полинейропатии, желательно обратиться к медицинскому генетику, чтобы определить свой риск развития болезни.
Полинейропатия критических состояний. Диагностика, лечение
В обзоре представлены данные иностранной и отечественной литературы последних 28 лет, посвященные диагностике, клиническим проявлениям, критериям постановки диагноза, течению и лечению полинейропатии и миопатии критических состояниях (ПМКС) у взрослых и детей. Развитие ПМКС приводит к увеличению сроков нахождения пациентов на ИВЛ, длительной реабилитации, формированию тяжелых последствий, снижению качества жизни, повышению смертности. Основными патологическими механизмами развития ПМКС являются: нарушение электровозбудимости тканей, микроциркуляции, гипергликемия, активация протеолиза, митохондриальная дисфункция, оксидантный стресс, продукция провоспалительных цитокинов. Ранняя диагностика, включая клинические критерии (приобретенной в отделении интенсивной терапии мышечной слабости, полинейропатии, миопатии), электронейромиографию, данные биопсии позволяет корректировать тактику терапии пациентов для предупреждения или минимизации проявлений ПМКС. Исследования ПМКС у детей при инфекционной патологии представлены в единичных публикациях и нуждаются в дальнейшем изучении.

1. Алашев А. М. Синдром нервно-мышечных нарушений при критическом состоянии в нейрореаниматологии: Автореф. дис. канд. мед. наук. Екатеринбург, 2006. 18 с.
2. Команцев В. Н.,Скрипченко Н. В., СавинаМ. В. Возможности нейрофизиологических методов в оценке локализации поражения нервной системы при нейроинфекциях у детей // Журнал инфектологии. 2010. Т. 2. №2. С.40-44.
3. Саввина И. А., Скрипченко Н. В., Команцев В. Н. и соавт. Острая полинейромиопатия у детей с тяжелым сепсисом и полиорганной недостаточностью // II Беломорский симпозиум «Актуальные вопросы анестезиологии и реаниматологии и высокотехнологическая помощь медицины критических состояний. Архангельск, 2009. С. 79-80.
5. Banwell B. L., et al. Muscle weakness in critically ill children // Neurology. 2003. Vol. 61. P. 1779-1782.
6. Bednarik J., Vondracek P. L., Dusek L. Risk factors for critical illness polyneuromyopathy // J Neurol. 2005. №252. P. 343-351.
7. Bolton C. F., Laverty D. A., Brown J. D. Critically ill polyneuropathy: electrophysiological studies and differentiation from Guillain-Barre syndrome // J Neurol Neurosurg Psychiatry. 1986. №49. P. 563-573.
8. Bolton C. F. Neuromuscular manifestations of critical illness // Muscle Nerve. 2005. №32. P. 140-163.
9. Bolton C. F., Gilbert J. J., Hahn A. F. Polyneuropathy in critically ill patients // J Neurol Neurosurg Psychiatry. 1984. №47. P. 1223-1231.
12. Hermans G., Wilmer A., Meersseman W. Impact of intensive insulin therapy on neuromuscular complications and ventilator dependency in the medical intensive care unit // Am J Respir Crit Care Med. 2007. T.175. №5. P. 480-9.
13. Khan J., Harrison T. B., Rich M. M. Mechanisms of Neuromuscular Dysfunction in Critical Illness // Crit Care Clin. 2008. Т.24. №1. P.1-11.
14. Klaude M., Fredriksson K., Tjäder I. Proteasome proteolytic activity inskeletal muscle is increased in patients with sepsis // ClinSci(Lond). 2007. №112. Р. 499-506.
15. Latronico N., Shehu I., Seghelini E. Neuromuscular sequelae of critical illness // Curr Opin Crit Care. 2005. №11. Р.381-390.
16. MacIntyreN. R. Respiratory mechanicsinthe patient who is weaning from the ventilator // Respir Care.2005. Vol.50. №2. P.275-86; discussion 284-6.
17. Rich M., Bird S. J., Raps E. C. Direct muscle stimulation in acute quadriplegic myopathy // Muscle Nerve. 1997. №20. Р. 665-673.
18. Rich M., Pinter M. J. Sodium channel inactivation in ananimal model of acute quadriplegic myopathy // Ann Neurol. 2001. №50. Р. 26-33.
19. Showalter C., Engel A. G. Acute quadriplegic myopathy: analysis of myosin isoforms and evidence for calpain-mediated proteolysis // Muscle Nerve. 1997. №20. Р. 316-322.
20. Spitzer A. R., Giancarlo T., Maher L. Neuromuscular causes of prolonged ventilator dependency // Muscle Nerve. 1992. №15. Р. 682-686.
21. Stevens R. D. et al.A framework for diagnosing and classifying intensive care unit-acquired weakness // Crit Care Med.2009. Vol. 37. №10. Suppl. P.S299-308.
22. Stevens R. D., Dowdy D. W., Michaels R. K. Neuromuscular dysfunction acquired in critical illness: a systematic review // Intensive Care Med. 2007. Т.33. №11. Р.1876-91.
23. Svistunenko D., Davies N., Brealey D. Mitochondrial dysfunction in patients with severe sepsis: an EPR interrogation of individual respiratory chain components // Biochim. Biophys. Acta. 2006. № 1757. Р.262-272.
24. Tabarki B., Coffiniéres A., Van Den Bergh P. Critical illness neuromuscular disease: clinical, electrophysiological, and prognostic aspects // Arch Dis Child. 2002. №86. Р. 103-107.
27. Witt N. J., Zochodne D.W., Bolton C.F. Peripheral nerve function in sepsis and multiple organ failure // Chest. 1991. № 99. Р.176-184.
28. Zochodne D. W., Bolton C.F., Thompson R.T. Myopathy in critical illness // Muscle Nerve. 1986. № 9. Р.652.
29. Zochodne D.W., Bolton C.F., Wells G.A. et al. Critical illness polyneuropathy. A complication of sepsis and multiple organ failure // Brain. 1987. Vol.110 (Pt 4). P.819-41.
Введение. Поражение нервно-мышечной системы при развитии критического состояния проявляется общей мышечной слабостью и гипотрофией мышц и обозначается как приобретенная в отделении интенсивной терапии (ОИТ) мышечная слабость (ПОРИТМС, intensive care unit-acquired weakness, ICUAW), которая может быть обусловлена поражением периферических нервов, мышц, нарушением нервно-мышечной проводимости при отсутствии иной причины, кроме самого критического состояния). После описания С. Болтоном [9] поражения периферической нервной системы (ПНС) при критических состояниях как полинейропатии критического состояния (ПКС), ее клинические, морфологические и нейрофизиологические проявления достаточно изучены у взрослых. Кроме того, при критических состояниях кроме ПНС было выявлено сочетанное либо изолированное поражение и мышц, которое стали именовать как миопатию критического состояния (МКС) [28]. В отечественной литературе публикации по ПМКС единичны и представлены только в последние годы [1]. В настоящее время при наличии достаточных обзоров и публикаций клинических наблюдений по ПНКС и МКС (ПМКС) взрослых пациентов аналогичные исследования у детей, включая инфекционную патологию, носят эпизодический характер [3, 26]. Предпринятый обзор позволяет представить полную картину состояния проблемы ПМКС, послужит основанием для разработки обоснованных направлений дальнейшего изучения этой актуальной проблемы.
Определение, эпидемиология и этиология. Полинейропатия критических состояний - это острая аксональная сенсорно-моторная полинейропатия с мышечной слабостью в конечностях, возникающая у пациентов, длительно находящихся в отделениях интенсивной терапии в критическом состоянии (более 7 дней) с искусственной вентиляцией легких (ИВЛ), при развивающейся полиорганной недостаточности, сепсисе и чаще проявляющаяся с возникновением проблем при отключении от ИВЛ при отсутствии сердечно-сосудистой и легочной патологии [10, 15]. В 30 % случаев ПКС сочетается с миопатией критических состояний. Миопатия критических состояний - острая миопатия с выраженностью клинических проявлений от незначительных функциональных нарушений до грубой миопатии и по структурным показателям - от нормальной гистологической картины до поражения мышц с атрофией и некрозом [10, 15].
Впервые полинейропатия критических состояний была описана С. Bolton и коллегами еще в 1984 году, хотя единичные случаи ПКС упоминались уже в конце 19 века. Позже нейрофизиологические и морфологические исследования показали, что при критическом состоянии первично могут поражаться мышцы в виде нарушения цитоархитектоники и развития некроза мышечных волокон - «миопатия критического состояния» [28]. В дальнейшем клинические и нейрофизиологические исследования показали, что развитие полинейропатии может сочетаться с первично-мышечным поражением и дает основание говорить о «полинейромиопатии критических состояний» [6]. Изолированные полинейропатии критических состояний и изолированные миопатии критических состояний развиваются в 70 % поражения нервно-мышечной системы (в соотношении 1:1), а сочетание полинейропатии и миопатии в 30 % случаях [22]. Частота встречаемости ПМКС, по данным зарубежной литературы, в зависимости от нозологии, ведущей к развитию критического состояния (КС), составляет: 7 % у пациентов после пересадки органов, 33 % у пациентов, находящихся в астматическом статусе, 60 % у пациентов с острым респираторным дистресс-синдромом, 50-70 % у пациентов с сепсисом или синдромом системного воспалительного ответа [27], 100 % у пациентов с полиорганной недостаточностью [22].
В значительной степени на развитие ПМКС влияет длительность пребывания на ИВЛ и составляет: 25-33 % (по клиническим данным) и у 58 % (по электронейромиографическим (ЭНМГ) данным) у пациентов, находящихся на ИВЛ 4-7 дней [25], 68 % у пациентов, находящихся на ИВЛ более 7 суток, 100 % у пациентов, находящихся на ИВЛ более 4 недель. К факторам риска развития ПМКС относят: пожилой возраст, женский пол, лечение кортикостероидами и аминогликозидами, гипоксию и гипотензию, гипертермию, гипергликемию, гипоальбуминемию, парентеральное питание. Частота встречаемости полинейропатии критического состояния у детей меньше, чем у взрослых, вследствие значительно меньшей частоты развития синдрома системного воспалительного ответа (ССВО) в педиатрических, нежели во взрослых отделениях интенсивной терапии, и составляет 1,7 % [5]. ПНКС описана в одном исследовании у 5 и в другом - у 20 детей в возрасте от 2 до 17 лет, включая ребенка с менингококковой инфекцией [24, 26].
Клинические проявления. Поражение ПНС в КС имеет типичные клинические признаки. Поражение ПНС ограничивается нервами конечностей, краниальные нервы, как правило, остаются интактными. Расстройства чувствительной сферы клиническими приемами не определяются в условиях КС пациентов, но хорошо диагностируются нейрофизиологически. Со стороны двигательной сферы отмечается снижение мышечного тонуса, отсутствие рефлекторной двигательной активности в ответ на болевые стимулы при сохранности, в ряде случаев, мимических проявлений. При длительном нахождении на ИВЛ (более 10 дней) отмечаются гипотрофии мышц, с преобладанием в дистальных отделах конечностей. Распространенность поражения нервов, включая диафрагмальный нерв, приводит к развитию дыхательной недостаточности, вследствие пареза дыхательной мускулатуры, и является преградой для снятия в дальнейшем больных с ИВЛ. Критерием затрудненности снятия больного с ИВЛ считается невозможность больного поддерживать самостоятельное дыхание в течение 24-48 часов [16]. Пациенты детского возраста с генерализованными бактериальными инфекциями, осложнившимися сепсисом с синдромом полиорганной недостаточности, имеют схожие со взрослыми пациентами полинейропатии критических состояний, клинически проявляющиеся слабостью мышц конечностей и также электрофизиологическими признаками полинейропатии [3]. Присоединение к ПНКС поражения мышц (миопатии) значительно ухудшает состояние пациентов и формирует тип поражения, который обозначается как полинейропатия-миопатия КС. В клинической картине к поражениям дистальных отделов конечностей вследствие ПНКС присоединятся парезы проксимальной группы мышц вследствие первично-мышечного страдания. Однако поражение проксимальной группы мышц конечностей возможно и при ПКС.
Течение и прогноз. При успешном лечении первичного заболевания, полиорганной недостаточности, сепсиса прогноз при ПМКС хороший. Однако при тяжелых ПМКС восстановление занимает недели в умеренных случаях и месяцы, а иногда и годы [1]. В течении ПМКС выделяют три стадии: развития, стабилизации и регресса. В начале заболевания выраженность ПМКС прогрессирует, но к 4-8 суткам отмечается переход в стадию стабилизации. Внутрибольничный показатель летальности у пациентов с ПНКС выше, чем без ПНКС (84 % против 56.5 %, p=0.01) [10]. Летальность в ОИТ в 3,5 раза выше для пациентов с ПМКС против пациентов вне ОИТ. Прогноз восстановления пациентов с МКС более благоприятный, чем с ПКС. Исследование при ПМКС показало, что пациенты с МКС восстанавливались в течение 6 месяцев, тогда как с ПКС восстанавливались намного дольше, либо оставались инвалидами, а также имели показатель смертности выше, чем при МКС [11]. Полное восстановление утраченных функций в среднем наблюдается у 30,2 % пациентов. У 25 % пациентов длительно, либо пожизненно наблюдались выраженные функциональные нарушения в виде тетрапареза, параплегии, выраженной слабости дыхательной мускулатуры (вплоть до ИВЛ), мышечной атрофии, болезненной гиперестезии. Средняя летальность пациентов составляет 29,7 % (диапазон 0-70 %). По данным S. Williams с соавторами, прогноз восстановления у детей после ПМКС такой же, как и у взрослых - длительное восстановление от нескольких недель и до месяцев. Глубокая слабость повышает летальность у детей от сепсиса и ССВО, а также является причиной значительной долгосрочной инвалидности [24].
Патогенез. В настоящее время каскад патофизиологических процессов развития ПКС и МКС является весьма сложным и не ясным. В начале критического состояния медиаторы системного воспаления вызывают каскад патологических реакций, что приводит к развитию ПМКС несколькими параллельными путями. К основным патологическим механизмам развития ПМКС относят: нарушение электровозбудимости тканей, микроциркуляции, гипергликемия, активация протеолиза, митохондриальная дисфункция, оксидантный стресс, продукция провоспалительных цитокинов. C. Bolton и его коллеги предложили гипотезу о микроциркуляторных нарушениях в эндоневрии, которые являются определяющими в развитии полинейропатии. При ПКС это может быть опосредовано повышенной экспрессией Е-селектина в эндотелии сосудов периферических нервов, индуцированной провоспалительными цитокинами. Более того, цитокины, синтезирующиеся при сепсисе, обладают гистамин подобными свойствами, которые могут повышать проницаемость капилляров [8]. Гипергликемия также может привести к нарушению микроциркуляции в эндоневрии периферических нервов. Теория снижения активности факторов роста нерва предполагает дефицит аксонального транспорта с последующей аксонопатией. Иммунологическая теория объясняет развитие полинейропатии (ПНП) как результат перекрестной выработки аутоантител к структурам ПНС с последующим аутоиммунным воспалением и некрозом. Исследования образцов биопсии мышц с помощью электронного парамагнитного резонанса обнаружили при критическом состоянии митохондриальную дисфункцию [23]. Активация протеолиза происходит двумя механизмами: Са-зависимый путём активации калпаинов [19] и АТФ-зависимый через убеквинтиновые протеосомы [14]. Потеря белка происходит в основном за счёт тяжёлых цепей миозина, в норме составляющего до 40 % всего миофибриллярного протеина взрослого здорового человека. Одним из значимых механизмов - это нарушение функции натриевых каналов мембраны нервного и мышечного волокон, что приводит к снижению, а в дальнейшем к отсутствию возбудимости клеток. Нарушение электровозбудимости мышц объясняется механизмом инактивации натриевых каналов мышечной ткани [17]. Натриевые каналы могут быть инактивированы ФНО-α [4], а также за счёт экспрессии генов натриевых каналов [18]. Отсутствие структурных нарушений при биопсии икроножного нерва и мышц на начальных стадиях полиорганной недостаточности, при сепсисе может объясняться функциональными нарушениями мембранной возбудимости при септической ПНП и миопатии [13].
Лечение. Лечение поражений ПНС при КС проводится в соответствии с общими принципами терапии ПНП: (1) поддержание жизненно важных функций организма; (2) проведение коррекции системных метаболических нарушений; (3) восполнение дефицита витаминов и питательных веществ; (4) назначение нейрометаболических и нейротрофических средств; (5) осуществление активной поэтапной реабилитации, включающей лечебную гимнастику, массаж, методы физиотерапии; (6) обеспечение психологической поддержки пациента. Адекватная инсулинотерапия в течение 7 дней снижает частоту ПКС до 38,9 % и время механической вентиляции больных [12].
Заключение. Проведенный анализ современных исследований поражения ПНС и мышц при КС показывает, что полинейропатия и миопатия являются серьезными осложнениями критических состояний, которые ведут к более длительному выздоровлению или инвалидизации. Своевременная диагностика и мониторинг состояния нервно-мышечной системы при КС должна включать как золотой стандарт использование ЭНМГ исследования у пациентов, находящихся в КС более 5 дней. Единичные исследования состояния ПНС при КС у детей и при инфекционной патологии, к сожалению, не позволяют определить специфику и особенности развития и течения поражения ПНС, требуют углубленного и сравнительного с взрослой возрастной группой изучения.
Аксональная полинейропатия
Полинейропатия — это патология периферической нервной системы, которая развивается в результате диффузного повреждения периферических нервов и их аксонов. Отсюда и название болезни. В ее основе — генерализованное поражение осевого цилиндра периферических нервов.
Что такое аксональная полинейропатия
Полиневропатия (второе название — полиневрит) — это клинический синдром, который возникает из-за ряда факторов, влияющих на периферическую нервную систему, и отличается размытыми патогенетическими изменениями. Заболевание занимает одно из лидирующих мест в перечне недугов периферической нервной системы, уступая первенство только вертеброгенной патологии, превосходящей по сложности клинической картины и последствиям, развивающимся из-за нее.
Аскональная полинейропатия считается междисциплинарной проблемой, с ней часто сталкиваются доктора различных специализаций. В первую очередь с данным заболеванием обращаются к неврологу. Частота возникающего синдрома неизвестна, так как отсутствуют статистические данные.
На данный момент известны всего три важных патоморфологических механизма, которые лежат в истоках формирования полинейропатии:
- валлеровская дегенерация;
- первичная демиелинизация;
- первичная аксонопатия.
В соответствии с иммунологической теорией полинейропатия является результатом перекрестного образования иммунных глобулинов, уничтожающих собственные клетки, в результате чего возникает некроз тканей и мышечное воспаление.
Исследователи выдвигают ряд гипотез возникновения и проблем течения аксональной полинейропатии:
- Сосудистая. Базируется на вовлечении в процесс сосудов, по которым кислород и питательные вещества поступают в периферические нервы. Изменяются характеристики крови по качественному и количественному составу, что может привести к ишемии нервных окончаний.
- Теория оксидативного стресса. Позиционирует формирование болезни со стороны нарушения обмена оксида азота, вследствие чего изменяются калий-натриевые механизмы, лежащие в основе формирования нервного возбуждения и проведения импульсов по нервам.
- Теория деактивации факторов роста нерва. Говорит о том, что болезнь возникает из-за недостатка аксонального транспорта с последующим развитием аксонопатии.
- Иммунологическая. Объясняет развитие заболевания в результате перекрестного образования антител к структурам периферической нервной системы, которое сопровождается аутоиммунным воспалением, а затем и некрозом нервов.
Даже при использовании ультрасовременных методов диагностики сложно найти достоверную причину патологии, выяснить ее получается только у 50-70% пострадавших.
Факторов возникновения полинейропатии нижних конечностей по аксональному типу очень много. Однако даже инновационные способы исследования не позволяют установить истинную этиологию заболевания.
Мнение эксперта

- Сахарный диабет нарушает структуру крови, питающей нервы, в свою очередь происходит сбой в обменных процессах.
- Длительный дефицит витаминов В. Именно они максимально важны для правильной работы нервной системы, поэтому долгая нехватка способна привести к аксональной полинейропатии.
- Воздействие токсинов на организм. К ним относят разнообразные отравляющие вещества, например, алкоголь, а также ВИЧ. При отравлении опасными веществами заболевание может развиться уже через несколько дней.
- Наследственный фактор.
- Синдром Гийена-Барре.
- Различные травмы, к которым также относится длительное сдавливание нервов, которое характерно при грыже или остеохондрозе.
Лечение аксональной полинейропатии обязательно должно быть комплексным, иначе нужного эффекта достичь не удастся. Категорически запрещается заниматься самолечением и при возникновении первых же симптомов нужно срочно обратиться к доктору. Врачи Юсуповской больницы подбирают лечение индивидуально для каждого пациента. В зависимости от тяжести патологии и симптоматики назначается комплексное лечение под наблюдением опытных специалистов.
Причины
Самые распространенные причины возникновения аксональной полинейропатии нижних конечностей:
- истощение организма;
- длительный недостаток витаминов группы В;
- недуги, ведущие к дистрофии;
- острые инфекции;
- токсическое поражение ртутью, свинцом, кадмием, угарным газом, спиртными напитками, метиловым спиртом, фосфорорганическими соединениями, медицинскими препаратами, принимаемыми без согласования с врачом;
- болезни сердечно-сосудистой, кроветворной, кровеносной и лимфатической систем;
- эндокринологические патологии, в том числе инсулинозависимость.
Главными факторами, которые провоцируют развитие моторной или сенсомоторной аксональной полинейропатии, являются:
- эндогенная интоксикация при почечной недостаточности;
- аутоиммунные процессы, протекающие в организме;
- амилоидоз;
- вдыхание токсических веществ или паров.
Также болезнь может быть обусловлена наследственностью.
Нехватка в организме витаминов группы В, а в особенности пиридоксина и цианокобаламина, крайне негативно воздействует на проводимость нервных и моторных волокон и может вызывать сенсорную аксональную полинейропатию нижних конечностей. Это же происходит при хронической алкогольной интоксикации, глистной инвазии, заболеваниях желудочно-кишечного тракта, которые ухудшают скорость всасывания.
Токсическое отравление лекарственными препаратами, аминогликозидами, золотыми солями и висмутом занимают большой процент в структуре факторов аксональной невропатии.
У пациентов с сахарным диабетом нарушена функция периферических нервов из-за нейротоксичности кетоновых тел, то есть метаболитов жирных кислот. Происходит это из-за невозможности организма использовать глюкозу как главный источник энергии. Поэтому вместо нее окисляются жиры.
При аутоиммунных заболеваниях, протекающих в организме, иммунная система человека атакует собственные нервные волокна, воспринимая их как источник опасности. Это происходит из-за провокации иммунитета, возникающей при неосторожном приеме иммуностимулирующих медикаментов и нетрадиционных методик лечения. Поэтому у людей, которые склонны к возникновению аутоиммунных заболеваний, пусковыми факторами аксональной полинейропатии являются:
- иммуностимуляторы;
- вакцины;
- аутогемотерапия.
При амилоидозе в организме накапливается такой белок, как амилоид. Именно он нарушает основные функции нервных волокон.
Первые признаки
Заболевание обычно начинает развиваться с поражения толстых или тонких нервных волокон. Зачастую аксональная полинейропатия имеет дистальное симметричное распределение на кисти или стопы. Нейропатия чаще всего сначала поражает нижние конечности, а затем симметрично распространяется вверх по телу. К самым частым первичным симптомам поражения относят:
- мышечную слабость;
- болевой синдром в конечностях;
- жжение;
- ощущение ползания мурашек;
- онемение кожных покровов.
Симптоматика ярче всего проявляется в вечернее и ночное время суток.
Симптомы
Врачи подразделяют хроническое, острое и подострое течение аксональной полинейропатии. Заболевание подразделяется на два вида: первично-аксональный и демиелинизирующий. В ходе течения болезни к ней присовокупляется демиелинизация, а затем и вторично аксональный компонент.
К основным проявлениям недуга относятся:
- вялость в мышцах ног или рук;
- спастический паралич конечностей;
- чувство подергивания в мышечных волокнах;
- головокружение при резкой перемене положения тела;
- отек конечностей;
- жжение;
- покалывание;
- ощущение ползания мурашек;
- снижение чувствительности кожных покровов к высокой или низкой температуре, боли и касаниям;
- нарушение ясности речи;
- проблемы с координацией.
Вегетативными признаками сенсомоторной полинейропатии асконального типа считаются следующие симптомы:
- учащенный или, напротив, замедленный сердечный ритм;
- неумеренное потоотделение;
- чрезмерная сухость кожи;
- изменение цвета кожных покровов;
- нарушение эякуляции;
- эректильная дисфункция;
- проблемы с мочеиспусканием;
- сбой двигательных функций желудочно-кишечного тракта;
- повышенное слюнотечение или, наоборот, сухость во рту;
- расстройство аккомодации глаза.
Заболевание проявляется в нарушениях функций поврежденных нервов. Именно периферические нервные волокна отвечают за двигательные функции мышечной ткани, чувствительность, а также оказывают вегетативное воздействие, то есть регулируют сосудистый тонус.
Для нарушения функции проводимости нервов характерны расстройства чувствительности, например:
- чувство ползания мурашек;
- гиперестезия, то есть увеличение чувствительности кожи к внешним раздражителям;
- гипестезия, то есть уменьшение чувствительности;
- отсутствие ощущения собственных конечностей.
Когда поражены вегетативные волокна, то из-под контроля выходит регуляция сосудистого тонуса. При аксонально-демиелинизирующей полинейропатии наступает сдавление капилляров, из-за чего ткани отекают. Нижние, а затем и верхние конечности из-за скапливания в них жидкости существенно увеличиваются в размерах. Так как при полинейропатии нижних конечностей основное количество крови накапливается именно в пораженных областях тела, то у пациента возникает стойкое головокружение при принятии вертикального положения. Из-за того, что пропадает трофическая функция, могут возникнуть эрозивно-язвенные поражения нижних конечностей.
Аксональная моторная полинейропатия проявляется в двигательных нарушениях верхних и нижних конечностей. Когда моторные волокна, отвечающие за движения рук и ног, повреждены, то наступает полный или частичный паралич мышц. Обездвиживание может проявляться совершенно нетипично — может ощущаться как скованность мышечных волокон, так и чрезмерная их расслабленность. При средней степени поражения ослаблен мышечный тонус.
В ходе течения заболевания могут быть усилены или ослаблены сухожильные и надкостничные рефлексы. В редких случаях доктор-невролог их не наблюдает. При болезни часто могут быть поражены черепные нервы, которые проявляются следующими нарушениями:
- глухотой;
- онемением подъязычных мышц и мускулатуры языка;
- невозможностью проглотить еду или жидкость из-за проблем с глотательным рефлексом.
Когда поражен тройничный, лицевой или глазодвигательный нерв, изменяется чувствительность кожных покровов, развиваются параличи, возникает асимметрия лица и подергивание мышц. Иногда при диагностированной аксонально-демиелинизирующей полинейропатии поражения верхних или нижних конечностей могут быть асимметричными. Такое случается при множественной мононейропатии, когда коленные, ахилловы и карпорадиальные рефлексы несимметричны.
Главной методикой исследования, которая позволяет обнаружить локализацию патологического процесса и степень пораженности нервов, является электронейромиография.
Чтобы определить причину заболевания, врачи назначают следующие анализы:
- определение уровня сахара в плазме крови;
- токсикологические тесты;
- полный анализ мочи и крови;
- выявление уровня холестерина в организме.
Нарушение нервных функций устанавливается при помощи определения температурной, вибрационной и тактильной чувствительности.
При первичном осмотре применяется зрительная методика исследования. То есть врач, к которому обратился с жалобами пострадавший, осматривает и анализирует такие внешние симптомы, как:
- уровень давления крови в верхних и нижних конечностях;
- чувствительность кожных покровов к прикосновениям и температуре;
- наличие всех необходимых рефлексов;
- диагностика отечности;
- изучение внешнего состояния кожи.
Выявить аксональную полинейропатию можно при помощи следующих инструментальных исследований:
- магнитная резонансная томография;
- биопсия нервных волокон;
- электронейромиография.
Лечение аксональной полинейропатии
Лечение аксональной полинейропатии должно быть комплексным и направленным на причину развития заболевания, его механизмы и симптоматику. Гарантией эффективной терапии является своевременное выявление болезни и лечение, которое сопровождается абсолютным отказом от сигарет, алкоголя и наркотических веществ, ведением здорового образа жизни и соблюдением всех рекомендаций врача. В первую очередь проводятся следующие терапевтические мероприятия:
- избавление от токсического воздействия на организм, если оно присутствует;
- антиоксидантная терапия;
- прием препаратов, которые воздействуют на тонус кровеносных сосудов;
- восполнение дефицита витаминов;
- регулярный контроль концентрации глюкозы в плазме крови.
Отдельное внимание уделяется лечению, направленному на купирование острого болевого синдрома.
Если присутствуют периферические парезы, то есть существенное снижение мышечной силы с многократным уменьшением амплитуды движений, то в обязательном порядке показана лечебная физкультура и специальные физические упражнения, направленные на возвращение тонуса мышечным тканям и предотвращение образования различных контрактур. Особенно важна регулярная психологическая поддержка, которая не дает пациенту впасть в депрессию, сопровождающуюся расстройством сна и чрезмерной нервной возбудимостью.
Лечение аксональной полинейропатии — это продолжительный процесс, так как нервные волокна восстанавливаются долго. Поэтому не стоит ожидать моментального выздоровления и возвращения к привычному образу жизни. Медикаментозная терапия включает такие препараты, как:
- обезболивающее;
- глюкокортикоиды;
- витамины группы В;
- антиоксиданты;
- сосудорасширяющие;
- средства, ускоряющие метаболизм и улучшающие микроциркуляцию крови.
Терапия лекарственными препаратами направлена на восстановление функций нервов, улучшение проводимости нервных волокон и скорости передачи сигналов центральной нервной системе.
Лечение следует проводить длительными курсами, которые не стоит прерывать, хоть и эффект от них проявляется не сразу. Чтобы устранить болевые ощущения и расстройство сна, назначают следующие медикаменты:
- антидепрессанты;
- противосудорожные;
- препараты, купирующие аритмию;
- обезболивающие.
Для избавления от боли используют нестероидные противовоспалительные препараты. Но стоит помнить, что применять их можно только короткий промежуток времени, так как длительное употребление может привести к повреждению слизистой оболочки желудочно-кишечного тракта.
К физиотерапевтическим методам лечения аксональной полинейропатии относятся:
- терапия магнитными волнами;
- грязелечение;
- электростимуляция;
- иглоукалывание;
- лечебный массаж;
- физкультура;
- ультрафонофорез;
- гальванотерапия.
Именно лечебная физкультура позволяет сохранить работоспособность мышечных тканей и поддерживать конечности в нужном положении. Регулярные занятия спортом вернут мышцам тонус, гибкость и увеличат амплитуду движений до нормальной.
Прогноз
Если заболевание обнаружено на ранней стадии и комплексно лечится квалифицированными специалистами, то прогноз для жизни и здоровья пациента более чем благоприятный. Стоит вести правильный образ жизни, рацион должен быть богат витаминами и минералами, необходимыми для правильного функционирования организма.
Если долгое время игнорировать болезнь и не предпринимать никаких действий, результат будет плачевным вплоть до полного паралича.
Профилактика
Пациент в обязательном порядке должен совершать профилактические мероприятия, которые помогут избежать рецидива или возникновения опасного заболевания. Они включают в себя обогащение рациона витаминами, регулярный контроль уровня сахара в крови, полный отказ от табакокурения, наркотических веществ и алкогольных напитков.
В целях профилактики болезни рекомендуется:
- носить удобную обувь, которая не пережимает стопу, ухудшая кровоток;
- регулярно осматривать обувь, чтобы избежать образования грибка;
- исключить пешие прогулки на длительные расстояния;
- не стоять долгое время на одном месте;
- мыть ноги прохладной водой или делать контрастные ванночки, что помогает улучшить циркуляцию крови в организме.
Пострадавшим в стадии ремиссии категорически запрещается принимать лекарственные препараты без согласования с лечащим врачом. Важно своевременно лечить воспалительные заболевания, соблюдать меры предосторожности при работе с токсическими веществами, которые оказывают пагубное воздействие на организм, регулярно выполнять лечебные физические упражнения.
Читайте также:
- Импетиго что это за болезнь? Лечение, причины, профилактика, осложнения
- Ушные шумы при болезнях внутреннего уха. Шум в ухе при лабиринтите
- Отсоединение протеза и оставшиеся зубы. Шарнирное соединение зубного протеза
- Холодное антицеллюлитное обертывание в домашних условиях. Методика
- Легочная артерия и аорта на рентгенограмме. Причины расширения корня аорты
