Постоянная артериовенозная гемофильтрация (ПАВГ) у новорожденных - принципы
Добавил пользователь Владимир З. Обновлено: 01.02.2026
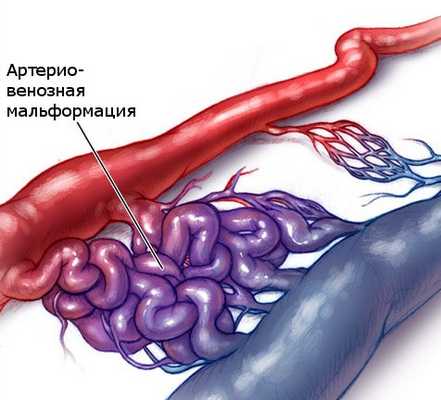
Сосудистые пороки - это общий термин, который включает в себя врожденные сосудистые аномалии : только вен - венозные мальформации (ВМ) только лимфатические сосудов - лимфатические пороки одновременно вен и лимфатических сосудов: вено-лимфатические мальформации аномалии артерий, связанных непосредственно с венами без капиллярной сети между ними: артериовенозные мальформации(АВМ)
Происхождение сосудистых мальформаций
Мальформации возникают во внутриутробном периоде . Генетики проводят много исследований по изучению этого феномена, но к определённой концепции до сих пор не пришли. Поэтому вопрос о причинах возникновения мальформаций остается не до конца изучен.
Врожденные ангиодисплазии (синдром Паркса-Вебера-Рубашова) - характеризуются наличием патологических соустий (фистул) между артериями и венами.
Артериовенозные соустья часто бывают множественными, имеют разнообразный калибр и форму. В зависимости от диаметра различают макрофистулы, заметные невооруженным глазом, и микрофистулы, которые выявляются только при микроскопическом исследовании тканей конечности.
Окончательно причины развития синдрома Паркса-Вебера-Рубашова не установлены. Ряд авторов рассматривают его как результат мутаций в гене RASA1, который кодирует белок p120-RasGAP, участвующий в передаче химических сигналов из внеклеточного пространства к ядру клетки. Вместе с тем, каким именно образом эти изменения приводят к специфическим сосудистым аномалиям у лиц с синдромом Паркса Вебера-Рубашова, не установлено.
Патологические соустья чаще располагаются в зоне бедренной, ветвей подколенной артерии, а также по ходу большеберцовых артерий. Интенсивный сброс артериальной крови через артерио-венозные свищи ведет к повышению давления крови в венах.
Из-за повышенной функциональной нагрузки изменяется гистологическая структура венозной стенки. Происходит утолщение ее мышечной оболочки и формирование внутренней эластической мембраны ("артериализация" вены).
Значительная часть артериальной крови при наличии свищей поступает в венозное русло, минуя капиллярную сеть, поэтому возникает тяжелое кислородное голодание в тканях и нарушаются обменные процессы. Из-за венозной гипертензии усиливается нагрузка на сердце, что постепенно приводит к расширению его границ и сердечной декомпенсации.
Основные симптомы
Каковы симптомы сосудистой мальформации? Сосудистые мальформации могут вызвать различные симптомы, зависящие от расположения их в теле: Общим симптомом всех мальформаций является боль. Венозный и лимфатический пороки могут вызвать подкожную припухлость, над которой может располагаться родинка. При поражениях кожи может сочиться лимфа или возникнуть кровотечение . Лимфатические мальформации, как правило, осложняются инфекционным процессом, требуя лечения антибактериальными препаратами. Вено-лимфатические мальформации могут быть связаны с феноменом под названием синдром Клиппеля-Треноне.
Артериовенозные мальформации (АВМ) могут также вызвать боль. Они являются наиболее опасными из-за быстрого сброса крови из артерий в вены. В зависимости от их расположения, они также могут привести к кровотечению (например , из матки, мочевого пузыря). Легочные артериовенозные мальформации несколько отличаются тем, что они как бы являются шунтом, по которому кровь из правых отделов сердца сбрасывается в левые отделы сердца, не повышая уровень кислорода в легких. Это приводит к симптомам пониженного содержания кислорода, одышке, усталости. Такие пороки могут кровоточить, в результате чего возникает кровохарканье или гемоторакс (появление крови в грудной клетке). Кроме того, эта аномалия может позволить сгусткам крови пройти через легкие и попасть в другие артерии тела человека, тем самым вызвав инсульт или абсцесс мозга. Это является существенной причиной для немедленного лечения легочных артериовенозных мальформаций.
Преимущества лечения в клинике
Диагностика
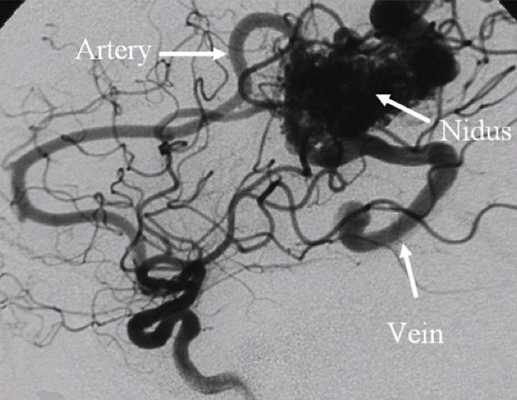
Помимо клинической картины и внешнего осмотра, для диагностики мальформаций используются ультразвуковые методы, компьютерная и магнито-резонансная томография, ангиография. С помощью этих методов удается выявить распространенность процесса в мягких тканях, те угрозы которые таит эта мальформация и подобрать правильное лечение. Диагностические исследования проводятся последовательно от простых к сложным. Наиболее трудны в диагностике артериовенозные мальформации головного мозга и внутренних органов. Нередко о них можно думать только при развитии осложнений связанных с кровотечением.
Клиническая симптоматика обусловлена нарушениями регионарного кровообращения и центральной гемодинамики. Конечность удлинена на 3-8 см, мягкие ткани ее гипертрофированы. Удлинение конечности обусловлено продуктивной перестройкой костной ткани из-за усиленной васкуляризации эпифизарных линий.
Характерно наличие варикозно расширенных поверхностных вен на нижней или верхней конечности. Их появление связано с высокой венозной гипертензией вследствие заброса крови из артерии. Стенки вен плотноэластической консистенции, с трудом сжимаемые. Расширенные вены не исчезают после придания конечности возвышенного положения. Иногда при осмотре над ними определяется пульсация.
Рука, приложенная к месту проекции артериовенозного соустья, ощущает вибрацию (симптом "кошачьего мурлыкания"). При аускультации в этой области выслушивают непрерывный систоло-диастолический шум, усиливающийся в момент систолы.
Наиболее ранний и постоянный симптом заболевания - повышение температуры кожи конечности, особенно значительное над местом расположения артериовенозных соустий. Разница в температуре симметричных участков непораженной и пораженной конечности достигает 4-8°.
Нарушения микроциркуляции, связанные с регионарными гемодинамическими расстройствами, в ряде случаев приводят к образованию язв и некрозов дистальных отделов конечностей. Из язв часто возникают повторные обильные кровотечения, приводящие к тяжелой анемии. Нередко бывает гипертрихоз и гипергидроз.
Ряд клинических симптомов связан с изменениями центральной гемодинамики. При значительной венозной гипертензии увеличивается нагрузка на правые отделы сердца, следствием ее являются гипертрофия сердечной мышцы, увеличение ударного и минутного объема сердца Однако по мере прогрессирования заболевания сократительная функция сердца начинает ослабевать, происходит миогенная дилатация сердца с расширением его полостей Развивается сердечная недостаточность, проявляющаяся одышкой, сердцебиениями, отеками, застойной печенью, асцитом, анасаркой. Для врожденных артериовенозных свищей характерно урежение пульса, наступающее после пережатия приводящей артерии.
Реографическая кривая, записанная с сегмента конечности, где расположены артериовенозные соустья, характеризуется высокой амплитудой, отсутствием дополнительных зубцов на катакроте, увеличением реографического индекса. В дистальных сегментах конечности амплитуда кривой, напротив, снижена. Артериализация венозной крови ведет к увеличению насыщения ее кислородом, содержание которого в расширенных венах увеличивается на 20-30%.
Наиболее важным методом диагностики врожденных артериовенозных свищей является ангиография. Различают прямые и косвенные ангиографические признаки артериовенозных свищей Наличие на ангиограммах контрастированного соустья или сосудистой полости, сообщающейся с артерией и веной, относят к прямым признакам. Косвенно о наличии свища свидетельствуют одновременное контрастирование артерий и вен, расширение просвета приводящей артерии, обеднение сосудистого рисунка дистальнее расположения артериовенозного свища.
Высокообъемная гемофильтрация

Гемофильтрация представляет собой заместительную терапию, подобную гемодиализу, очищение крови посредством фильтрации и удаление отходов, таких как креатинин и мочевина, а также свободной воды из крови. Это метод гемокоррекции, основанный на принципе конвекционного и фильтрационного переноса воды, низко- и среднемолекулярных веществ из циркулирующей вне тела крови через полупроницаемую мембрану с внутривенным замещением кровезаменяющим раствором. Используется в основном в условиях интенсивной терапии.
В отличие от гемодиализа и перитонеального диализа, оба из которых основаны на диффузии молекул через градиент концентрации, гемофильтрация использует конвективный перенос растворенного вещества (известный как растворитель), в результате чего молекулы захватываются движущимся потоком растворителя. Процесс приводит к получению большого объема фильтрата, содержащего избыток частиц отходов. Для эффективного удаления низкомолекулярных веществ объем фильтрации должен быть равен объему воды тела (не менее 60-80%).
Гемофильтрация была впервые использована для лечения пациентов с почечной недостаточностью в 1977 году. Основными причинами её развития были нехватка технического оборудования и специалистов, необходимых для обеспечения гемодиализа, в сочетании с отличной толерантностью даже у пациентов с гемодинамически скомпрометированными состояниями. Кроме того, баланс жидкости можно точно контролировать и регулировать, позволяя использовать другие вспомогательные меры, такие как общее парентеральное питание.
Гемофильтрация большого объема (высокообъемная гемофильтрация или вено-венозная гемофильтрация) является привлекательной терапией для лечения септической острой почечной недостаточности и абдоминальной ишемии. Скорость ультрафильтрации при этом достигает 6 литров в час.
При высокообъемной гемофильтрации её доза выше обычной почечной дозы. Объем замещения жидкости зависит от клинических показателей пациента.
Показания и противопоказания к методу лечения
- Острая почечная недостаточность,
- Абдоминальная ишемия,
- Дисбаланс жидкости и электролита,
- Общее парентеральное питание с ограничением жидкости,
- Отек мозга с повышенным внутричерепным давлением,
- Тяжелые ожоги,
- Септический шок с множественной недостаточностью органа,
- Гепаторенальный синдром,
- Печеночная энцефалопатия,
- Отек легких, сердца, печени или почек,
- Сепсис,
- Гипергидратация при неправильном плазмозамещении,
- Осложнения хронической диализной терапии.
Процедура гемофильтрации практически не имеет противопоказаний (к ним можно отнести длительные кровтечения и геморрагический инсульт). Однако, каждый конкретный случай рассматривается индивидуально.
Как проходит метод лечения

Для проведения гемофильтрации используют аппарат называемый гемопроцессор. Пациент при этом лежит на кровати. Продолжительность процедуры зависит от состояния пациента.
Перед процедурой пациенту вводят препарат предупреждающий свертывание крови.
Во время гемофильтрации кровь пациента пропускается через набор насосно-компрессорных труб (фильтровальная схема) через машину на полупроницаемую мембрану (фильтр), где удаляются отходы и вода. Добавляется заместительная жидкость, подогреваемая термостатом, и кровь возвращается пациенту.
Кроме того, гемопроцессор снабжен весами, определяющими количество фильтрата и замещающего раствора, и микропроцессором для автоматического управления процедурой.
Диализный катетер помещается в одну из основных вен тела. Также аппарат можно подсоединить к пациенту с помощью артериовенозного шунта. Этот катетер имеет две отдельные линии. Кровь вытекает из катетера в гемопроцессор, затем попадает в фильтр, где отбирается отработанная жидкость. Затем заменяются текучие среды и электролиты (например, натрий и калий). Наконец, кровь возвращается пациенту через катетер.
Скорость удаления растворенного вещества пропорциональна приложенному давлению, которое может быть настроено в соответствии с требованиями медицинских условий. Гемофильтрация нуждается в огромном потоке воды через полупроницаемую мембрану. Этот поток воды стимулируется градиентом давления со стороны крови на так называемую сторону фильтрата мембраны.
Гемофильтрация обычно используется до тех пор, пока функция почек пациента не вернется в норму.
Как правило, замещающая жидкость, буферный раствор электролита, близкий к составу плазменной воды0. Существует также несколько видов замещающего раствора, отличающиеся по содержанию катионов, анионов, глюкозы и осмотическому давлению.
Замещающий раствор вводят после фильтра (посдилюция) или перед фильтром (предилюция).
Возможные осложнения при лечении
Современные гемопроцессоры предусматривают защиту от воздушной эмболии, утечки крови и жидкостного дисбаланса, поэтому осложнения редки.
Иногда может наблюдаться кровотечение, гипер- или дегидратация, стресс, гипокликемия, озноб или повышение температуры тела, артериальная гипотензия и сердечная слабость.
Прогноз после метода лечения
Высокообъемная гемофильтрация позволяет укоротить противовоспалительную фазу сепсиса, уменьшить проявления имунопаралича и риск развития вторичной инфекции.
Гемофильтрация

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Гемофильтрация основана на использовании высокопроницаемой мембраны в гемофильтре, который соединён с артерией и веной с помощью модифицированных гемодиализных магистралей. Градиент артериовенозного давления создаёт возможность продвижения крови по экстракорпоральному контуру без применения насоса. Медленная продолженная ультрафильтрация и реинфузия жидкости, служат основными способами поддержания жидкостного баланса у пациентов отделений интенсивной терапии. Постоянная артериовенозная гемофильтрация основана только на конвекции. Очищения крови достигают за счёт ультрафильтрации и замещения жидкости, потерянной при фильтрации, в отличие от диффузии, применяемой в «классическом» гемодиализе. Начиная с 80-х годов прошлого столетия у пациентов, критическое состояние которых не позволяло использовать другие виды ЗПТ, эта методика стала регулярно применяться в отделениях интенсивной терапии. Важно отметить, что её использование давало возможность клиникам, не оборудованным гемодиализной техникой и аппаратурой, проводить ЗПТ у больных с острой почечной недостаточностью. Безусловное преимущество постоянной артериовенозной гемофильтрации - отсутствие отрицательного влияния на систему кровообращения и возможность адекватного контроля баланса жидкости. Кроме того, возможность проводить больным с олигоанурией интенсивное лечение, включающее инфузионно-трансфузионную и лекарственную терапию, парентеральное и энтеральное питание. Но у пациентов с синдромом полиорганной недостаточности у данной методики были выявлены и определенные ограничения. Максимальная эффективность, которой возможно добиться с её помощью, достигает 14-18 л ультрафильтрата в сутки. Следовательно, суточный клиренс мочевины не может превышать 18 л. Учитывая, что у большинства пациентов с синдромом полиорганной недостаточности отмечают выраженное состояние гиперкатаболизма, данный клиренс мочевины приводит к недостаточному контролю её уровня и, естественно, к неадекватному лечению.
Механизм действия
При перфузии крови через гемофильтр с фильтратом удаляется широкий спектр свободно циркулирующих токсикантов и их метаболитов (молекулярная масса до преальбумина). Фильтрат по своему составу сравним с первичной мочой, образующейся в почках. Количество удаляемых токсикантов зависит от объема замещенной в сосудистом русле жидкости. Интенсивность детоксикации пропорциональна скорости фильтрации и коэффициенту просеивания метаболитов через данную полупроницаемую мембрану. Объем замещения жидкости и продолжительность процедуры устанавливают в зависимости от клинико-биологических показателей больного.
Беспрепятственное прохождение через мембрану в жидкостном потоке осмотически активных веществ сохраняет исходную осмолярность крови и ОЦК Изоосмолярная дегидратация лежит в основе профилактики внутриклеточной гипергидратации и отека мозга (синдрома нарушенного равновесия).
Важным недостатком доступа служит нестабильная скорость кровотока в экстракорпоральном контуре, обусловленная снижением артериовенозного градиента при гипотензии, часто наблюдаемой у больных в отделениях интенсивной терапии, или тромбоз циркулирующего контура и фильтра. Эти осложнения часто наблюдают при постоянной артериовенозной гемофильтрации, поскольку её высокая скорость приводит к значительному увеличению уровня гематокрита, вязкости крови и гиперпротеинемии в объёме крови внутри самого фильтра, который при замедлении кровотока по экстракорпоральному контуру тромбируется. Данные недостатки метода нередко являются причиной прекращения крайне необходимого пациенту лечения, снижая тем самым его эффективность в целом. Все это послужило поводом к существенному ограничению применения артериовенозной гемофильтрации в отделениях интенсивной терапии и к разработке новых технических средств и методов постоянной заместительной ЗПТ.
Благодаря внедрению в клиническую практику двухпросветных катетеров и перфузионных модулей нового поколения большое распространение получили вено-венозная гемофильтрация и вено-венозная гемодиафильтрация, которые считают «золотым стандартом» диализной терапии в отделениях интенсивной терапии. При данных видах лечения для обеспечения кровотока по экстракорпоральному контуру применяют перфузионный модуль. За счёт использования конвекции, ультрафильтрации и диффузии эффективность метода значительно повышается. Кровоток, не превышающий 200 мл/мин, с аналогичной скоростью диализата, подающегося противотоком к направлению потока крови, позволяет поддерживать клиренс мочевины в процессе процедуры на высоких значениях (до 100 мл/мин).
Постоянная вено-венозная гемодиафильтрация в сравнении с «классическим» гемодиализом обеспечивает булыную стабильность гемодинамики, неограниченный контроль за жидкостным балансом, позволяет осуществлять адекватную нутритивную поддержку, даёт возможность контролировать концентрацию растворённых веществ, корригировать или предупреждать развитие электролитного дисбаланса. Опубликованные в 2000 г. Claudio Ronco результаты рандомизированного контролируемого исследования показали, что увеличение объёма гемофильтрации при постоянных методах терапии может улучшить выживаемость больных с острой почечной недостаточностью и сепсисом. Потенциальная выгода от увеличения объёма ультрафильтрации связана с положительным воздействием постоянной ЗПТ на гуморальные медиаторы сепсиса, которые адсорбируются на фильтрующей мембране или непосредственно выводятся путём процесса конвекции. Это исследование доказало обоснованность увеличения «дозы» гемофильтрации у больных острой почечной недостаточностью и сепсисом.
Таким образом, эта методика сегодня служит эффективной формой искусственной поддержки функций почек и имеет «внепочечные» показания к очищению крови в комплексной интенсивной терапии полиорганной недостаточности и сепсиса.
Использование синтетических, биосовместимых, обладающих высокой проницаемостью мембран позволяет за счёт конвекции достигнуть прироста клиренса веществ со средней молекулярной массой, прежде всего цитокинов, многие из которых растворимы в воде. Благодаря этому существует возможность снизить их концентрацию в кровотоке с помощью методик экстракорпорального очищения крови. Поскольку многие про- и противовоспалительные медиаторы относят к веществам со «средним» молекулярным весом, постоянно ведутся исследования, изучающие эффективность конвективных методов (гемофильтрации и гемодиафильтрации) в их элиминации. Результаты экспериментальных и клинических исследований последних лет свидетельствуют, что с помощью современных методов экстракорпоральной детоксикации удаётся элиминировать лишь ограниченное количество «средних» молекул, таких, как цитокины, компоненты комплемента и др. Безусловно, конвективный механизм массопереноса значительно более эффективен в этом плане, чем диффузионный, однако обычно при проведении постоянных процедур у больных острой почечной недостаточностью применяют «почечную дозу» скорости гемофильтрации до 2 л/ч. Этой дозы достаточно для осуществления адекватной ЗПТ и минимальной, клинически малозначимой способности элиминировать медиаторы воспаления. С другой стороны, было доказано, что адсорбция медиаторов воспаления на мембране гемофильтров весьма значительна, в особенности на ранних этапах экстракорпорального очищения крови (первые 2-3 ч от начала процедуры). Адсорбция циркулирующих цитокинов и компонентов комплемента на пористой мембране фильтра позволяет временно понизить их концентрацию в плазме, что имеет существенную как биологическую, так и клиническую значимость. К сожалению, мембраны гемофильтров не предназначены для сорбции и по мере насыщения пор их эффективность в удалении цитокинов быстро снижается.
Таким образом, «почечная доза» гемофильтрации (до 2 л/ч) достаточна для замещения функции почек при терапии острой почечной недостаточности, но недостаточна для изменения уровня медиаторов воспаления при синдроме полиорганной недостаточности и сепсисе. Поэтому постоянную гемофильтрацию при сепсисе не применяют, за исключением случаев его сочетания с тяжёлой дисфункцией почек.
Высокообъёмная гемофильтрация
По данным исследований, у больных с полиорганной недостаточностью и сепсисом очевидны преимущества использования высокообъёмной вено-венозной гемофильтрации. Клинические исследования показали эффективность применения высокообъёмной вено-венозной гемофильтрации со снижением летальности среди больных с сепсисом и улучшением параметров гемодинамики на фоне снижения потребности в применении вазопрессоров и адреномиметиков. По данным исследований, повышение дозы гемофильтрации выше обычной «почечной дозы» оказывает положительное влияние на выживаемость больных с синдромом полиорганной недостаточности.
Скорость ультрафильтрации при этом методе достигает 6 л/ч и более, а суточный объём равен 60-80 л. Высокообъёмную вено-венозную гемофильтрацию применяют только в дневное время (6-8 ч), и методика носит название пульсирующей. Это обусловлено необходимостью высокой скорости кровотока, точного подсчёта объёма ультрафильтрации и повышенной потребностью в замещающих растворах.
Причины положительного влияния высокообъёмной вено-венозной гемофильтрации в комплексной терапии сепсиса:
- Укорочение провоспалительной фазы сепсиса путём фильтрации несвязанной части цитокинов, уменьшение тем самым сопутствующих поражений органов и тканей.
- Снижение концентрации и элиминация компонентов крови, отвечающих за шоковое состояние у человека (эндотелин-1, ответственный за развитие ранней лёгочной гипертензии при сепсисе; эндоканнабиноиды, отвечающие за вазоплегию; миокард-депрессивный фактор, участвующий в патогенезе острой сердечной недостаточности при сепсисе).
- Снижение концентрации в плазме фактора РАМ (ингибитор активации плазминогена), уменьшение диффузной внутрисосудистой коагулопатии. Известно, что уровень фактора PAI-I при сепсисе коррелирует с высокими значениями по шкале APACHE II и значительным уровнем летальности.
- Уменьшение проявлений иммунопаралича после сепсиса и снижение риска развития вторичной инфекции.
- Подавление апоптоза макрофагов и нейтрофилов.
Таким образом, высокообъёмная вено-венозная гемофильтрация - метод экстракорпоральной детоксикации, позволяющий значительно снизить концентрацию в плазме большинства медиаторов воспаления, обеспечивая возможность «управления» системной воспалительной реакцией. Однако фильтры и мембраны, применяемые для гемофильтрации при лечении острой почечной недостаточности с их величиной пор и коэффициентами просеивания, маловероятно будут иметь существенное значение для экстракорпоральной терапии сепсиса.
Лечение артериовенозных мальформаций

С одной стороны, ответить на вопрос, каким методом лечить артериовенозную мальформацию, довольно просто, поскольку только хирургический метод позволяет избавить больного от самой АВМ и от тех осложнений, к которым она приводит. Но, с другой стороны, зачастую очень сложно оценить риск хирургического вмешательства и риск развития этих осложнений. Поэтому каждый раз следует учитывать множество факторов, суммарная оценка которых может склонить врача к активному хирургическому лечению или отказаться от него.
Выбор тактики лечения артериовенозных мальформаций
Эпилептические припадки, вызванные АВМ, могут быть разнообразными по тяжести и частоте: малые припадки типа абсансов или сумеречного сознания, локальные судорожные припадки типа Джексона и развернутые судорожные припадки. Они могут повторяться с частотой один раз в несколько лет и по несколько раз в течение суток. При этом следует учитывать социальное положение больного, его профессию, возраст. Если малые редкие эквиваленты существенно не влияют на профессию больного, не ограничивают степень его свободы и качество жизни, то от сложной и опасной операции следует воздержаться. Но если риск операции не высок, то следует ее предпринимать, т.к. опасность разрыва АВМ остается и к тому же сами припадки, даже редкие, постепенно приводят к изменению личности больного, так же, как и длительный прием противосудорожных препаратов. Операция с высокой степенью риска может производиться лишь у больных, страдающих частыми развернутыми эпиприпадками, непозволяющими им самостоятельно даже выходить из квартиры и практически превращающих их в инвалидов.
Тяжелыми и опасными являются псевдотуморозный и инсультоподобный варианты клинического течения АВМ, поскольку они приводят даже без кровоизлияния к инвалидизации больного, поэтому операция может быть противопоказанной лишь в том случае, если она сопряжена с риском для жизни больного или вероятностью развития более грубого неврологического дефицита, чем уже имеется. Несколько меньшую опасность представляют преходящие нарушения мозгового кровообращения, особенно единичные, но не следует забывать, что при таком варианте течения может развиться и ишемический инсульт. Учитывая тяжесть различных вариантов клинического течения АВМ и риск возможных осложнений при попытке их радикальной экстирпации, нами разработана простая методика определения показаний к операции.
Нами выделено 4 степени тяжести клинического течения и 4 степени операционного риска в зависимости от размеров и локализации АВМ.
Тяжесть клинического течения.
- степень - бессимптомное течение;
- степень - единичные эпиприпадки, единичные ПИМК, редкие приступы мигрени;
- степень - инсультноподобное течение, псевдотуморозное течение, частые (чаще 1 раза в месяц ) эпиприпадки, повторные ПИМК, частые упорные приступы мигрени;
- степень - апоплексический тип течения, характеризующийся одним или несколькими спонтанными внутричерепными геморрагиями.
Степень операционного риска при радикальной экстирпации АВМ.
- степень - АВМ малого и среднего размеров, корково-подкорковые, расположенные в функционально “немых” зонах мозга.
- степень - АВМ малого и среднего размеров, расположенные в функционально важных зонах мозга, и большие АВМ в “немых” зонах мозга.
- степень - АВМ малого и среднего размеров, расположенные в мозолистом теле, в боковых желудочках, в гиппокампе и большие АВМ в функционально важных зонах мозга.
- степень - АВМ любого размера, расположенные в базальных ганглиях, АВМ функционально важных отделов мозга.
Для того чтобы определить показания к открытому оперативному вмешательству, нужно провести простое математическое действие: от показателя степени тяжести клинического течения вычесть показатель степени операционного риска. И если при этом получится положительный результат - операция показана; в случае получения отрицательного результата, от операции следует воздержаться.
Пример: У больного К. АВМ проявляется развернутыми эпиприпадками 1-2 раза в месяц (III степень тяжести). По данным ангиографии АВМ до 8 см в диаметре расположена в медиобазальных отделах левой височной доли (IV степень операционного риска): 3-4=-1 (операция не показана).
В случае получения нулевого результата следует учитывать субъективные факторы: настроенность больного и родственников на операцию, опыт и квалификацию хирурга. При этом не следует забывать о том, что 45% мальформаций, независимо от их клинического проявления, могут разрываться. Поэтому при получении нулевого результата все же следует склониться к оперативному лечению. Мальформации, открытое удаление которых сопряжено с риском IV степени, лучше оперировать эндоваскулярным методом, но лишь в случае, если клиническое течение АВМ и степени операционного риска позволяют избрать адекватную тактику лечения. Иначе определяется тактика в остром периоде АВМ. В этом случае учитывается тяжесть состояния больного, объем и локализация внутричерепной гематомы, наличие крови в желудочках мозга, выраженность дислокационного синдрома, размеры и локализация самой АВМ. Основной вопрос, нуждающийся в решении, это выбор оптимальных сроков и объема оперативного вмешательства.
Выбор лечебной тактики в остром периоде разрыва артериовенозной мальформации
Лечебная тактика в остром периоде разрыва артериовенозной мальформации определяется многими факторами: размером и локализацией АВМ, объемом и локализацией внутримозгового кровоизлияния, сроком с момента разрыва, тяжестью состояния больного, возрастом и соматическим статусом, опытом хирурга в проведении таких операций, оснащенностью операционной и многими другими. В подавляющем большинстве случаев при разрыве ABM формируются внутримозговые гематомы, которые могут быть ограниченными, а могут прорываться в желудочковую систему либо в субдуральное пространство. Значительно реже разрыв АВМ сопровождается субарахноидальным кровоизлиянием без формирования гематомы. В этом случае лечебная тактика в остром периоде должна быть только консервативной. Оперативное удаление артериовенозной мальформации может быть произведено лишь через 3-4 недели, когда состояние больного станет удовлетворительным и по АКТ исчезнут признаки отека мозга. В случае формирования внутримозговой гематомы следует учитывать ее объем, локализацию, выраженность дислокационного синдрома и перифокального отека мозга. Необходимо оценить тяжесть состояния больного и если оно тяжелое, определить причину: объем ли гематомы и дислокация мозга обусловливают тяжесть состояния или это вызвано локализацией кровоизлияния в функционально важных центрах, а возможно и другими причинами. В первом случае ставится вопрос об оперативном вмешательстве, но необходимо определиться со сроками его проведения и объемом операции. Неотложное оперативное лечение проводится, если тяжесть состояния прогрессивно нарастает и обусловлена гематомой, имеющей объем более 80 см3 и контралатеральным смещением срединных структур мозга более, чем на 8 мм, а деформация охватывающей цистерны моста указывает на начальные признаки височно-тенториального вклинения. Объем операции зависит от состояния больного, размеров и локализации самой мальформации. Тяжелое состояние больного с грубым нарушением сознания до сопора и комы, пожилой и старческий возраст, грубая сопутствующая патология не позволяют выполнить операцию в полном объеме. Это так же невозможно, если разорвалась артериовенозная мальформация среднего или большого размера и для ее удаления требуется многочасовая операция, длительный наркоз и не исключена возможность гемотрансфузии. В таких случаях необходимая операция по жизненным показаниям должна выполняться в сокращенном объеме: удаляется только гематома и останавливается кровотечение из сосудов мальформации. При необходимости и неуверенности в надежном гемостазе устанавливается приточно-отточная система. Сама мальформация не удаляется. Вся операция по времени не должна превышать одного часа. Если же источником гематомы стал разрыв АВМ малого размера, то она может быть одномоментно удалена вместе с гематомой, поскольку это существенно не усложнит и не удлинит операцию.
Таким образом, неотложная операция при разрыве АВМ выполняется лишь при больших гематомах, вызывающих грубую компрессию и дислокацию мозга, угрожающую жизни больного. При этом только артериовенозная мальформация малого размера удаляются вместе с гематомой, а удаление средних и больших АВМ должно быть отложено на 2-3 недели, до выхода больного из тяжелого состояния.
В остальных случаях, когда тяжесть состояния обусловлена не объемом гематомы, а локализацией кровоизлияния в жизненно-важных структурах мозга (желудочек мозга, мозолистое тело, базальные ганглии, варолиев мост, ножки мозга или продолговатый мозг) экстренное оперативное вмешательство не показано. Лишь при развитии гидроцефалии предпринимается наложение двухстороннего вентрикулярного дренажа. Неотложная операция так же не показана, если объем гематомы менее 80 см3 и при этом состояние больного хотя и тяжелое, но стабильное и нет прямой угрозы его жизни. В таких случаях АВМ может быть удалена вместе с гематомой в отсроченном периоде. Чем больше размеры АВМ и чем сложнее в техническом отношении ее удаление, тем позднее должна выполнятся операция. Обычно эти сроки колеблются между второй и четвертой неделями с момента разрыва. Итак, при разрыве АВМ в остром периоде чаще предпринимается консервативная тактика либо неотложная операция по жизненным показаниям в сокращенном объеме. Радикальная экстирпация АВМ по возможности должна производиться в отсроченном периоде (через 2-4 недели).
Интенсивная терапия в остром периоде разрыва артериовенозной мальформации
Больные с тяжестью состояния I и II степеней по Ханту и Хессу в интенсивной терапии не нуждаются. Им назначаются анальгетики, седативные препараты, антагонисты кальция, реологические препараты, ноотропы. Более тяжелая категория больных - III, IV и V степеней тяжести, нуждается в проведении интенсивной терапии, которая наряду с общими мероприятиями (обеспечение адекватного дыхания и поддержание стабильной центральной гемограммой) должна включать реологическую терапию, противоотечную, нейронопротекторную, коррегирующую и восстановительную.
Реологическая терапия включает введение плазмозамещающих растворов (0,9% раствор NaСl, раствор Рингера, плазма, поляризующая смесь), реополиглюкина и др. В небольших количествах (200-400 мл в сутки) может использоваться изотонический раствор глюкозы. Применение гипертонических растворов глюкозы сопровождается повышением метаболического ацидоза, поэтому не рекомендуется. Общий суточный объем внутривенной инфузии должен составлять 30-40 мл/кг веса. Основным критерием для расчета этого объема является гематокрит. Он должен быть в пределах 32-36. При спонтанных внутричерепных кровоизлияниях, как правило, наблюдается сгущение крови, повышение ее вязкости и свертываемости, что приводит к затруднению гемоциркуляции в самых мелких сосудах - прекапиллярах и капиллярах, микрососудистому свертыванию и капилляростазу. Реологическая терапия направлена на предотвращение или сведения до минимума этих явлений. Наряду с гемодилюцией проводится дезагрегантная и антикоагулентная (трентал, сермион, гепарин, фраксипарин). Противоотечная терапия включает мероприятия, направленные на максимальное устранение любых отрицательных влияний на головной мозг. Это, прежде всего, гипоксия. Она может быть обусловлена как нарушением внешнего дыхания, так и гемоциркуляторными нарушениями. Внутричерепная гипертензия так же затрудняет кровоток по мозговым сосудам. Способствует развитию отека и интоксикации, вследствие распада форменных элементов крови, и всасывания в кровь продуктов этого распада, ацидозу (в основном молочная и пировиноградная кислоты), повышение уровня протеолитических ферментов, вазоактивных веществ. Поэтому уже сама гемодилюция устраняет некоторые перечисленные отрицательные факторы (сгущение крови, повышенная вязкость, сладж-синдром, капилляростаз, интоксикация). Для устранения ацидоза назначается 4-5% сода, количество которой рассчитывается по данным кислотно-щелочного состояния. Хорошо защищают нейроны от отека кортикостероидные гормоны (преднизолон, дексаметазон, дексазон и др.). Вводятся они внутримышечно 3-4 раза в сутки. Так преднизолон назначается в дозе 120-150 мг в сутки. При этом артериальное давление может незначительно повышаться, что хорошо коррегируется введением антагонистов кальция.
В условиях гипоксии эффективно защищают мозговые клетки от отека антигипоксанты - препараты, тормозящие скорость биохимических реакций, в связи с чем уменьшается потребность клеток в кислороде. К ним относятся: оксибутират натрия или ГОМК, седуксен, сибазон, тиопентал натрия, гексенал. Суточная доза тиопентала и гексенала может достигать 2 г. Оксибутират натрия вводится в дозе 60-80 мл в сутки. Особенно показаны эти препараты больным в психомоторном возбуждении и при развитии диэнцефального синдрома. В случаях превалирования мезенцефало-бульбарного синдрома (низкое артериальное давление, мышечная гипотония, нормо- или гипотермия, бульбарный тип нарушения дыхания) антигипоксанты не показаны.
Поскольку у всех больных с внутричерепным кровоизлиянием резко повышается активность калликреин-кининовой системы и протеолитических ферментов, целесообразно назначение ингибиторов протеаз. Контрикал, трасилол, гордокс вводятся на физиологическом растворе Рингера капельно по 30-50 тыс. ед. в сутки, в течение 5 дней. К этому времени активация калликреин-кининовой системы снижается.
Важным в лечении спонтанных внутримозговых кровоизлияний является назначение антагонистов кальция. Блокируя кальциевые каналы клеточных мембран, они защищают клетку от избыточного проникновения в нее ионов кальция, который всегда устремляется в клетки, страдающие от гипоксии, и приводит к их гибели. Антагонисты кальция также, воздействуя на миоциты артерий мозга, препятствуют прогрессированию ангиоспазма, что очень важно у больных с разрывом мальформаций и развивающейся вследствие этого компрессией головного мозга. Применяются различные представители этой группы препаратов - изоптин, феноптин, веропамил, нифедипин, коринфар и др. Наиболее активным из них в отношении мозговой патологии является нимотоп фирмы Байер (Германия). В отличие от других подобных препаратов, нимотоп обладает способностью проникать через гемато-энцефалический барьер. В остром периоде нимотоп вводится внутривенно капельно постоянно в течение 5-7 суток. Для этой цели используется нимотоп во флаконах по 50 мл, в которых содержится 4 мг активного вещества. Лучше для этой цели использовать дозатор. Скорость введения контролируется по частоте пульса (нимотоп замедляет сердечный ритм) и по артериальному давлению. При быстром введении препарата может развиться гипотомия. Артериальное давление следует удерживать на уровне умеренной гипертензии (140-160 мм рт.ст.). В среднем один флакон нимотопа разводится на 400 мл физраствора и этого количества хватает на 12-24 часа. Через 5-7 дней, если состояние больного улучшается, ему назначается таблетированный нимотол по 1 -2 таблетки четыре раза в день.
В отношении ноотропов и церебролизина, глицина следует придерживаться выжидательной тактики. В острейшем периоде разрыва, когда нервные клетки страдают от гипоксии и отека стимулировать их деятельность нецелесообразно. Эти препараты сыграют важную роль в восстановлении функций мозга после того, как будет проведено оперативное вмешательство.
Важным является назначение антиоксидантов: витаминов А, Е, препаратов селена. Наряду с этим проводится коррегирующая терапия, направленная на нормализацию всех показателей гомеостаза. В случаях, если кровоизлияние не относится к разряду несовместимых с жизнью, такая терапия приводит к улучшению состояния больных с тяжестью III-IV степеней уже через 7-10 дней, после чего может решаться вопрос о сроках радикальной операции.
ГЕМОФИЛЬТРАЦИЯ (греч, haima кровь + франц. filtre фильтр, от позднелат. filtrum войлок; син.: гемодиафильтрация, гемоультрафильтрация) — метод внепочечного очищения крови посредством фильтрации через искусственные мембраны с повышенной проницаемостью и замещения удаляемого фильтрата эквилибрированным раствором.
По молекулярному спектру удаляемых веществ и уремических токсинов Гемофильтрация стоит близко к клубочковой фильтрации. Этот метод был предложен Гендерсоном (L. W. Henderson) и соавт. в 1967 г.; по мере совершенствования фильтрационных мембран и аппаратуры все больше применяется в клинической практике.
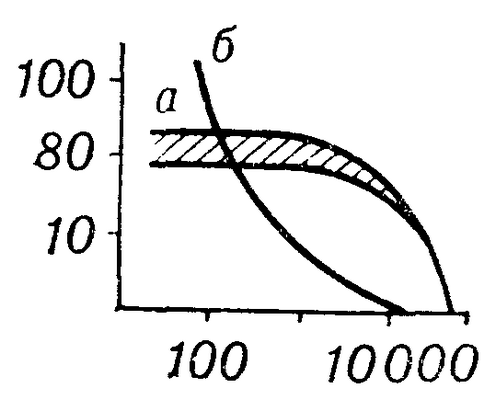
Рис. 1. График зависимости клиренса (по оси ординат, в мл/мин) различных токсических веществ от их молекулярного веса (по оси абсцисс) при гемофильтрации (а) и гемодиализе (б). Гемофильтрация эффективнее гемодиализа по клиренсу среднемолекулярных веществ, но уступает гемодиализу по клиренсу низкомолекулярных веществ. Заштрихована область колебаний показателей клиренса при гемофильтрации с применением гемофильтров различного типа.
Механизм Гемофильтрации существенно отличается от гемодиализа (см.). Очищение крови при Гемофильтрации осуществляется благодаря конвекционному транспорту растворенных в плазме веществ через фильтрационную мембрану под действием трансмембранного давления. Клиренс, или очищение крови от веществ с мол. весом до 20 000, в первом приближении равен величине фильтрации и не определяется молекулярным спектром, как это имеет место при гемодиализе (рис. 1). От ультрафильтрации при гемодиализе Гемофильтрацию отличает большая интенсивность перемещения р-ра через пористую мембрану. Диализные мембраны не могут обеспечить такого очищения путем ультрафильтрации прежде всего из-за низкого клиренса среднемолекулярных веществ. Для Г. применяют высокопроницаемые мембраны из полиакрилнитрила или тетраацетатцеллюлозы. Изготавливают их в виде листов и капилляров, что и определяет конструкцию основного приспособления — гемофильтра. Из мембран в виде листов сконструированы гемофильтр RP-6 с транспортной поверхностью 1,2 м 2 , гемофильтр «Sartorius» дисковидной формы с поверхностью 0,3 м 2 и 0,6 м 2 . Капиллярные мембраны использованы в гемофильтрах «Amicon» с транспортной поверхностью 0,2, 0,5 и 1,6 м 2 . Применяемые в клинике гемофильтры в зависимости от назначения обеспечивают получение от 40 до 200 мл ультрафильтрата в 1 мин. Они компактны, стерильны, апирогенны; предназначены для разового применения.
Производительность гемофильтра определяют пористость и площадь мембраны, трансмембранное давление, величина кровотока, гематокрит, содержание плазменного белка. Судят о ней по клиренсу (см.). Поскольку количество удаляемого из крови вещества равно его содержанию в ультрафильтрате, то клиренс может быть определен по ультрафильтрату:
где С — клиренс в мл/мин; Quf — скорость ультрафильтрации; Cuf — концентрация вещества в ультрафильтрате; СbI — концентрация вещества на входе в аппарат.
Учитывая, что многие вещества, в первую очередь среднемолекулярные, растворены преимущественно в плазме и их концентрация в плазме будет больше, чем в цельной крови, для более точного определения клиренса вносят поправку на гематокрит (см. Гематокритное число) и распределение между плазмой и эритроцитами:
где С — клиренс в мл/мин) Cpi — концентрация вещества в плазменной фракции на входе в аппарат; Quf — скорость ультрафильтрации; Cuf — концентрация вещества в ультрафильтрате; Ht — гематокрит; К — коэффициент, показывающий отношение концентрации вещества в плазме к концентрации в цельной крови.
Клиренс веществ, равномерно распределенных в цельной крови, напр, мочевины, равен скорости ультрафильтрации, тогда как клиренс веществ, растворенных гл. обр. (или только) в плазме, напр, инулина, среднемолекулярных веществ, превышает ультрафильтрацию тем значительнее, чем выше гематокрит.
Скорость Г. в пределах 1 — 200 мл/мин имеет прямую зависимость от трансмембранного давления, при больших величинах давления и одном и том же кровотоке прирост фильтрации уменьшается и постепенно приближается к нулю. Дальнейшее увеличение ультрафильтрации (см.) возможно лишь при увеличении потока крови через гемофильтр. Явление это, не ощутимое при гемодиализе, представляет принципиальную особенность Г. Связано оно с так наз. концентрационной поляризацией мембраны, т. е. с образованием на поверхности мембраны динамического слоя из веществ, молекулы к-рых по своей величине не проходят с потоком жидкости через фильтр и тем самым препятствуют фильтрации. С увеличением скорости кровотока и пристеночного движения уменьшается концентрирование поляризующих веществ на мембране и возрастает поток фильтрации. Учитывая явление концентрационной поляризации, рекомендуют использовать для Г. относительно большие кровоток (250—300 мл/мин) и давление в гемофильтре (ок. 0,22 бар). Дополнительный подпор на выходе из аппарата неприемлем из-за угрозы повышенного гемолиза (см.).
Замещение удаляемого фильтрата инфузией специального р-ра является вторым ответственным процессом, моделирующим канальцевую реабсорбцию. Р-р по составу должен быть близким к безбелковой части плазмы, иметь нормальные осмолярность и pH, обладать корригирующей способностью. Может быть рекомендован следующий его состав (в мэкв/л): калия — 2, натрия — 140, кальция — 3,5, магния — 1,5, хлора — 106, ацетата — 41; р-р включает также глюкозу из расчета 1 г на 1 л. На сеанс Г. требуется 18—25 л р-ра; кроме того, необходим 1 л для заполнения и удаления воздуха из аппарата, 0,5 л для возвращения крови при отключении.
Объем инфузии определяется ультрафильтрацией, но на практике ультрафильтрация всегда превышает инфузию на заранее установленную величину, требующуюся для удаления избытка воды из организма и управления АД. Во избежание гемодинамических расстройств весь объем чистой ультрафильтрации забирают не сразу, а постепенно, на протяжении всей процедуры. В целом скорость удаления жидкости должна быть точно сбалансирована с замещением.
Р-р добавляют в кровь до гемофильтра (предилюция) или после (постдилюция). Метод предилюции обеспечивает меньшее концентрирование крови в гемофильтре, однако он требует вдвое больше р-ра. Чаще поэтому применяют постдилюцию. Пользуются только пригодными для парентерального введения р-рами, т. е. стерильными, апирогенными, расфасованными в герметичные пластиковые емкости определенной величины.
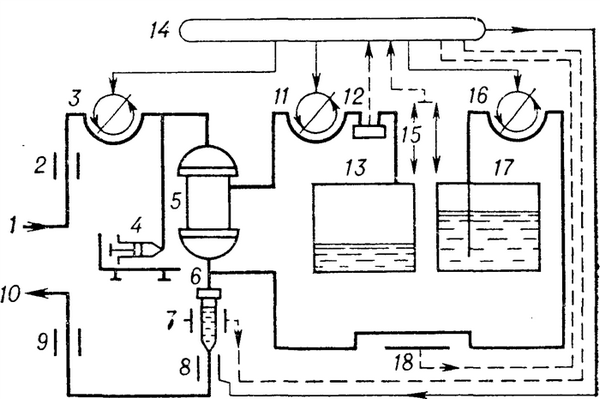
Рис. 2. Принципиальная схема гемофильтратора: 1 — артериальная магистраль, 2 — артериальный (минимальный) манометр, 3 — насос крови, 4 — шприцевой насос для дозирования гепарина, 5 — гемофильтр, 6 — венозная ловушка воздуха, 7 — ультразвуковой детектор воздуха, 8 — электромагнитный зажим для прерывания кровотока, 9 — венозный (максимальный) манометр, 10 — венозная магистраль, 11 — насос ультрафильтрата, 12 — фотоэлектрический детектор крови в ультрафильтрате, 13 — резервуар для ультрафильтрата, 14 — аналоговое устройство и микропроцессор, 15 — электронные весы, 16 — насос замещающего раствора, 17 — резервуар с замещающим раствором, 18 — нагреватель замещающего раствора. Сплошными линиями показаны функциональные связи между рабочими узлами гемофильтратора, штриховыми — связи аналогового устройства и микропроцессора с рабочими и контролирующими устройствами.
Для Г. используют аппарат гемопроцессор, оснащенный электронным аналоговым устройством (микропроцессором) , обеспечивающим автоматическое управление и контроль за ходом операции. Конструкцией большинства гемопроцессоров (рис. 2) предусмотрены роликовые насосы для перфузии крови, удаления ультрафильтрата и введения замещающего р-ра. В нек-рых моделях есть еще небольшой насос для удаления части ультрафильтрата. Работу насосов программируют исходя из объема и продолжительности Г. Общий баланс жидкости поддерживают с помощью прецизионных весов, от к-рых информация о количестве фильтрата и раствора поступает на микропроцессор. Сюда же поступают данные о продолжительности Г., температуре р-ра и др. Замещающий р-р перед введением подогревают до температуры тела в специальном термостатирующем устройстве.
Контроль ведется за величиной и пропорциональностью фильтрации и замещения, температурой р-ра, давлением крови в начальном и конечном участках магистрали, герметичностью фильтра, уровнем крови в венозной ловушке воздуха. Для этого аппарат оснащен артериальным и венозным манометрами, фотоэлектрическим детектором утечки крови, ультразвуковым детектором воздуха в крови, а также электромагнитным зажимом, перекрывающим кровоток в случае угрожающих отклонений в работе аппарата. Имеются звуковой и световой сигналы тревоги.
В оснащение аппарата входят емкости для сбора ультрафильтрата, стандартные магистрали для крови, ультрафильтрата и замещающего р-ра, инфузионный насос для дозирования гепарина.
Техника гепаринизация при Г. мало чем отличается от таковой при гемодиализе, следует лишь иметь в виду, что гемофильтрационные мембраны проницаемы для гепарина. Обычно гемофильтр и кровопроводящие магистрали заполняют солевым р-ром с гепарином (5000 ЕД на 1 л). За время процедуры вводят еще 3000—4500 ЕД гепарина из расчета по 1500 ЕД в 1 час. Введение гепарина производят на протяжении всей процедуры или прекращают за час до ее окончания. По показаниям может быть применена регионарная гепаринизация. От качества гепаринизации зависит эффективность Г.
Для соединения больного с аппаратом используют любой из долговременных доступов к сосудистому руслу, разработанных и применяемых для нужд гемодиализа. Предпочтение отдают обычно артериовенозной фистуле по Чимино и Брешии (J. E. Cimino, М J. Brescia). Сеанс Г. не превышает 4—5 час., за это время может быть замещено от 18 до 40 л ультрафильтрата. Во время Г. намеченный объем замещения постоянно контролируют и исправляют.
После окончания Г. освобождают систему, возвращая кровь больному.
Основным показанием для Г. является уремия вследствие хронической или острой почечной недостаточности (см.). Помимо уремии, Г. показана при лечении отеков у больных с нефротическим синдромом (см.), сердечной недостаточностью (см.), циррозом печени (см.); причем тахикардия, аритмия и умеренная гипотензия не препятствуют проведению процедуры. Применяют Г. самостоятельно и в комбинации с гемодиализом. С использованием высокопроницаемых мембран существенно расширились возможности для удаления из крови среднемолекулярных уремических токсинов (мол. вес 500—5000). Однако в отношении клиренса низкомолекулярных веществ Г. уступает гемодиализу. Поэтому более полная коррекция уремических проявлений достигается комбинацией двух методов.
Противопоказания к проведению Г. такие же, как и при гемодиализе (кровоизлияния в мозг, продолжающееся кровотечение, сердечно-сосудистая недостаточность с некорригируемой гипотонией).
Клинический опыт показал, что Г. обладает рядом достоинств; с ее помощью удается устранить или сделать управляемой артериальную гипертензию и тем создать предпосылки для лечения сердечной недостаточности; предупредить или добиться обратного развития полинейропатии и остеодистрофии; улучшить течение сахарного диабета. Г. не сопровождается синдромом нарушенного равновесия, проявляющимся тошнотой, рвотой, головной болью, судорогами, расстройством сознания. Очевидно, это связано с отсутствием осмотического градиента между экстра- и интрацеллюлярным пространствами из-за малой скорости выведения мочевины. К недостаткам Г. относят неизбежную потерю белка (20—40 г), аминокислот, гормонов и витаминов.
Конструкцией аппарата и техникой выполнения Г. предусмотрена защита пациента от целого ряда опасных осложнений. Однако возможно развитие гемолиза, кровопотери, расстройства гемодинамики в случае избыточного удаления жидкости, недостаточное очищение крови при нерегулярном и недостаточном по объему замещении ее. В числе так наз. технических осложнений отмечаются неадекватная гепаринизация и образование сгустков крови в гемофильтре, перегревание замещающего р-ра, воздушная эмболия. При нарушении асептики возможно инфицирование пациента.
В перспективе развития метода предусматривают сочетание Г. с перфузией ультрафильтрата через сорбенты и возврат регенерированного фильтрата в кровь больного.
Библиогр.: Левицкий Э. Р. и Дмитриев А. А. Новые методы внепочечного очищения крови и дальнейшие пути их развития при лечении хронической почечной недостаточности, Тер. арх., т. 50, «No 6, с. 115, 1978; Artificial kidney, artificial liver and artificial cells, ed. bv Th. M. S. Chang, N. Y.— L., 1978; Bergstrom J. Ultrafiltration without dialysis for removal of fluid and solutes in uremia, Clin. Nephrol., v. 9, p. 156, 1978; Heber H. W. a. o. Simultaneous hemo-filtration hemodialysis, ibid., p. 115; Henderson L. W. a. o. Blood purification by ultraiiltration and fluid replacement (diafiltration), Trans. Amer. Soc. artif. intern. Org., v. 13, p. 216, 1967; Herrath D. u. a. Klinische Erfahrungen und Probleme bei chronischer Hamo-filtration, Nieren- und Hochdruckkrankh., Bd 7, S. 16, 1978; Quellhorst E. Hamofiltration, ibid., S. 3; Streiсher E., Schneider H. u. Mylius U. Theoretische und technische Grundlagen der Hamofiltration, ibid., S. 9.
Читайте также:
