Появление систолического шума при инфаркте миокарда. Разрыв межжелудочковой перегородки, папиллярных мышц
Добавил пользователь Алексей Ф. Обновлено: 28.01.2026
Кардиология:
Разрыв папиллярной мышцы при инфаркте миокарда
Частичный или полный разрыв папиллярной мышцы происходит редко, но часто является фатальным осложнением трансмурального ИМ. ИМ нижней стенки может привести к разрыву заднесрединной мышцы, что наблюдается чаще, чем разрыв передне-боковой мышцы как осложнения переднебокового ИМ.
Разрыв правой папиллярной мышцы также происходит редко, но приводит к выраженной митральной регургитации и правожелудочковой недостаточности. Полный разрыв левой папиллярной мышцы желудочка является несовместимым с жизнью осложнением, поскольку приводит к внезапной тяжелой МР, при которой невозможна стабилизация состояния.
Частичный разрыв папиллярной мышцы, как правило, происходит в области головки и приводит к развитию тяжелой, но не всегда очень сильной МР. Такое осложнение наблюдается наиболее часто и не всегда приводит к летальному исходу. В отличие от разрыва межжелудочковой перегородки (МЖП), наблюдаемого при больших ИМ, разрыв папиллярной мышцы происходит в 50% относительно небольших ИМ. Такие больные, как правило, имеют КБС средней степени тяжести.
У небольшого количества больных формирование разрыва более чем одной структурной единицы сердца можно выявить либо при клиническом осмотре, либо на вскрытии. Описаны все возможные сочетания разрыва свободной стенки ЛЖ, МЖП, а также папиллярной мышцы.
Как и в случае разрыва межжелудочковой перегородки (МЖП), у больных с разрывом папиллярной мышцы появляется новый пансистолический шум, сопровождающийся развитием тяжелой сердечной недостаточности (СН). В обоих случаях шум может становиться менее звучным или полностью исчезать с падением АД. Частичный или полный разрыв папиллярной мышцы можно диагностировать с помощью ЭхоКГ.
Цветовая допплерография помогает дифференцировать острую МР от разрыва межжелудочковой перегородки (МЖП) при ИМ↑ST. При подозрении на разрыв необходимо в срочном порядке выполнить ЭхоКГ, поскольку гемодинамические нарушения в данной ситуации развиваются крайне быстро. Часто при ЭхоКГ удается дифференцировать разрыв папиллярной мышцы от других, менее острых форм МР, возникающих при ИМ↑ST.
Хирургический препарат: папиллярная мышца (слева вверху),
хорда и передняя створка митрального клапана (справа внизу) пациента с частичным разрывом папиллярной мышцы,
подвергнутого пластике митрального клапана из-за тяжелой митральной регургитации после ИМ↑ST.
Разрыв сердца
Разрыв сердца - это нарушение целостности миокарда с формированием в нем сквозного или неполного дефекта. Основные причины: трансмуральный инфаркт, опухоли, заражение некоторыми паразитами. Проявляется тахикардией, снижением артериального давления, возникновением грубого систолического шума. Пациент жалуется на одышку, головокружение, боль за грудиной. Поиск причины патологии осуществляется с помощью УЗИ, ЭКГ, катетеризации правых отделов. Лечение - оперативное ушивание дефекта. Консервативные методы обладают недостаточной эффективностью. Они используются только тогда, когда операция невозможна.
МКБ-10
Общие сведения
Разрыв сердца - жизнеугрожающее состояние, при котором происходит механическое нарушение целостности наружной сердечной стенки или межжелудочковой перегородки. Патология впервые описана в XVII веке английским врачом и биологом Уильямом Гарвеем. Сегодня она возникает у 2-6% больных с острым инфарктом, а также у 1-2% людей, страдающих опухолями миокарда и паразитарной инвазией. Разрыв сердца, причиной которого является инфаркт, чаще встречается у мужчин. В остальных случаях связь с половой принадлежностью больного отсутствует.
Причины
Разрыв сердца - полиэтиологическое заболевание, вызываемое кардиогенными и некардиогенными причинами. Чаще всего разрыв миокарда происходит на фоне выраженного атеросклероза коронарных артерий. Его непосредственными причинами могут выступать:
- Острый инфаркт миокарда. Является причиной разрыва в 92% случаев. Обычно происходит повреждение свободной стенки левого желудочка, которое сопровождается тампонадой. Другие участки органа (сосочковые мышцы, межжелудочковая перегородка) поражаются реже. Разрыв может возникать в течение 2-х недель с момента развития ОИМ.
- Травмы грудной клетки. Происходят при автомобильных авариях, падениях с высоты, прямых ударах по грудине, колотых ранениях. Наиболее часто встречаются повреждения правого желудочка. Это объясняется его анатомическим расположением. Патология обычно сопровождается тампонадой, быстро приводит к развитию жизнеугрожающих состояний.
- Паразитарная инвазия. Ткани сердечной мышцы могут поражаться цистицерками свиного цепня, аскаридами, токсоплазмой. Известны случаи выявления эхинококковых кист. Абсолютное большинство заболевших сообщает о регулярных контактах с животными, нарушении правил личной гигиены, употреблении плохо обработанного мяса.
- Опухоли. Могут быть первичными или представлять собой метастазы неопластических процессов, поражающих другие органы. В сердце метастазирует рак молочной железы, легких, желудка, почек. Достигая больших размеров, новообразование растягивает миокард, который не выдерживает нагрузки и разрывается.
- Неопухолевые процессы. Причины повреждения миокарда - абсцессы, гранулемы, гуммы. Кроме того, ткани поражаются конгломератами кальциноза. Рост патологических структур приводит к перерастяжению и повреждению мышечного слоя. Травма может быть поверхностный или сквозной.
Патогенез
Разрыв сердца может быть полным или незавершенным. В первом случае происходит сквозная перфорация стенки органа с дальнейшим перикардиальным истечением крови. Заполнение полости перикарда ограничивает кардиальное рабочее пространство и делает нормальные сердечные сокращения невозможными. Развивается тампонада. Кроме того, механическое повреждение миокарда снижает его сократительную способность. Это приводит к острой сердечной недостаточности.
Незавершенный разрыв опасен резким снижением сократительной функции миокарда. У пациента с нарушением целостности левого желудочка, независимо от его причины, развивается отек легких, сердечная астма. Правожелудочковые разрывы способствуют возникновению застоя в большом круге кровообращения. Происходит быстрое увеличение печени, скопление жидкости в брюшной полости, мягких тканях. Формируется аневризма - выбухание сердечной стенки на месте повреждения.
Разрыв межжелудочковой перегородки - причина генерализованной сердечной недостаточности: возникает отек легких, асцит, происходит смешение артериальной и венозной крови. Развивается кардиогенный шок. Изначально отверстие может быть небольшим, при этом гемодинамика сохраняется на приемлемом уровне. Постепенно разрыв увеличивается, а гемодинамические показатели ухудшаются. Летальность при отсутствии операции достигает 90%.
Классификация
Существует несколько параметров классификации разрывов сердца: по времени возникновения (ранние, поздние); по глубине (полные, неполные); по длительности (моментальные, растянутые во времени). Чаще всего патология подразделяется по локализации дефекта. Различают следующие разновидности:
1. Внешний разрыв. Встречается наиболее часто. Является причиной возникновения тампонады. Разделяется по местонахождению:
- Поражение левого желудочка. Самый частый вариант. Обычно бывает вызвано сквозным некроза миокарда, трудно поддается коррекции.
- Поражение правого желудочка. Встречается в 2-3% случаев. Чаще возникает на фоне травм груди. Также причиной может оказаться паразитарная инвазия или онкология.
- Поражение предсердия. Встречается крайне редко. Возникает при врожденных дефектах атриальной стенки, дилатационных кардиомиопатиях, опухолях.
2. Внутренний разрыв. Происходит интракардиально, тампонады не возникает. Сопровождается нарушением внутрисердечного кровотока, возникновением признаков недостаточности кровообращения. Различают:
- Травму межжелудочковой перегородки. Сопровождается патологическим смешиванием венозной и артериальной крови. Делает нормальный легочный газообмен невозможным.
- Повреждение сосочковых мышц. Приводит к нарушению работы клапанов внутри сердца. Полный отрыв мышечного волокна становится причиной скоропостижной гибели пациента. При частичных разрывах пациенты сохраняют жизнеспособность 7-14 суток.
Симптомы разрыва сердца
Клиническая картина развивается внезапно, быстро достигает максимума. Больные жалуются на неожиданно возникшую резкую боль в груди, слабость, одышку. При осмотре выявляют синеватый оттенок носогубного треугольника, мочек ушей. Больной испуган, покрыт холодным липким потом, беспокоен. Он занимает вынужденное положение сидя, при укладывании жалуется на резкое затруднение дыхания, ухудшение самочувствия.
По мере развития патологии состояние больного ухудшается. При правожелудочковой локализации повреждений и нарушении целостности межжелудочковой перегородки развиваются отеки ног, которые постепенно поднимаются выше. Возникает асцит, увеличение размеров печени. Дефект в области левого желудочка становится причиной отека легких, возникновения выраженной одышки с выделением пенистой мокроты.
Большие повреждения приводят к резкому нарушению гемодинамики. Происходит снижение артериального давления, отмечается компенсаторная тахикардия, которая сменяется брадикардией. Возможно развитие картины шока: критическое падение АД, централизация кровообращения, нарушение сознания. При отсутствии помощи у человека развивается фибрилляция желудочков, которая приводит к возникновению клинической смерти.
Осложнения
При отсутствии своевременной диагностики и медицинской помощи витальные осложнения возникают у 90% больных. У абсолютного большинства из них через несколько минут или часов (зависит от размеров и локализации дефектов) развивается крупноволновая, а затем мелковолновая фибрилляция желудочков. Она завершается полным прекращением сердечной деятельности и смертью. Если этого не произошло, существует вероятность формирования нарушений внутрисердечной проводимости.
К числу осложнений, которые встречаются практически у всех больных, относится кардиогенный отек легких, гепатоспленомегалия, асцит. Возможны нарушения со стороны внутренних органов, спровоцированные гипергидратацией и механическим сдавлением. У выживших пациентов нередко формируется аневризма сердечной стенки.
Диагностика
Постановка диагноза осуществляется врачом-кардиологом при участии специалиста по функциональной диагностике, реаниматолога, кардиохирурга. Причины патологического состояния должны быть установлены в течение 1 часа. Дифференциальная диагностика проводится с неосложненным ОИМ, экссудативным перикардитом, коронарной патологией, имеющей другие причины. Обязательное обследование:
- Физикальное. Выявляет внешние признаки разрыва сердца. При аускультации выслушивается грубый систолический шум, в легких - крупнопузырчатые влажные хрипы. Возможно появление пенистой мокроты. Живот увеличен, вздут, печень выходит за края реберной дуги.
- Лабораторное. При инфаркте миокарда обнаруживается повышенный уровень сердечных тропонинов I и T. Отмечается рост активности и массы КФК МВ. Разрывы межжелудочковой перегородки сопровождаются нарушением газового состава крови. Содержание O2 в пробах из правого желудочка выше, чем из правого предсердия. Возможно общее снижение оксигенации.
- Инструментальное. Посредством УЗИ обнаруживается накопление крови в перикарде, патологическая митральная регургитация, дилатация левых отделов. На ЭКГ отмечается M-образный подъем участка ST, электромеханическая диссоциация. С помощью катетеризации правого желудочка и вентрикулографии удается обнаружить зону повреждения.
Лечение разрывов сердца
Шансы больного на жизнь зависят не только от локализации и размеров повреждения, но и от того, насколько быстро и правильно будет оказана помощь. Медицинское пособие должно быть начато на догоспитальном этапе (ДГЭ). После госпитализации показана экстренная операция.
Помощь на этапе СМП
Выявить разрыв миокарда на ДГЭ удается редко, поэтому помощь оказывают в соответствии с имеющейся симптоматикой. При инфарктах показано введение наркотиков, нитратов, антиагрегантов. Торакальные травмы требуют иммобилизации пациента, качественного обезболивания. При снижении АД нужна инфузия, вазопрессоры. Дыхательная недостаточность - показание для интубации трахеи и перевода больного на аппаратное дыхание.
Консервативная терапия
Консервативное лечение отличается крайне низкой эффективностью и используется только в тех ситуациях, когда интраоперационный риск превышает вероятность гибели больного без операции. Показана ИВЛ, объемная инфузия, прессорные амины. Кроме того, используются гемостатические, кардиотропные средства, после заживления дефекта - антиагреганты. Проводится симптоматическое лечение антиаритмиками, мочегонными, гипотензивными лекарствами. Больного госпитализируют в кардиореанимацию.
Хирургическое лечение
Выполняется экстренно, по жизненным показаниям. Повреждения межжелудочковой перегородки закрывают окклюдером в ходе эндоваскулярного малоинвазивного вмешательства. Наружный разрыв сердца, независимо от глубины, устраняется открытым способом. Доступ - продольная стернотомия или переднебоковая левосторонняя торакотомия. Хирург вскрывает перикард, ушивает миокард матрацным швом с использованием тефлоновых прокладок, при необходимости устанавливает дренажи.
Прогноз и профилактика
Разрыв сердца, причины которого имеют ишемическую природу, прогностически неблагоприятен. При оперативном лечении летальность достигает 51%, если операция не проводилась, погибает около 90% больных. Колотые ранения сердца приводят к смерти в 29-35% случаев. Прогноз при опухолях зависит от их локализации, размеров и природы. Неопухолевые образования и паразитарные кисты - причина летального исхода в 30-40% наблюдений.
Профилактика разрывов миокарда при ОИМ - реперфузионная терапия. При отсутствии на базе клиники рентген-операционной проводятся тромболитические мероприятия. Используются ферменты: альтеплаза, стрептокиназа, тенектеплаза. Современным методом восстановления кровотока считается оперативное удаление тромба и стентирование коронарных артерий. Для предотвращения повреждений миокарда при опухолях и паразитарных кистах патологический очаг удаляют.
1. Диагностика и лечение больных острым инфарктом миокарда с подъемом сегмента ST на кардиограммы, клинические рекомендации/ МЗ РФ - 2013.
2. Разрывы межжелудочковой перегородки в остром периоде инфаркта миокарда/ И.М. Кузьмина, А.М. Шкляров, С.Р. Гиляревский - 2017.
Гипертрофическая кардиомиопатия
Гипертрофическая кардиомиопатия - первичное изолированное поражение миокарда, характеризующееся гипертрофией желудочков (чаще левого) при уменьшенном или нормальном объеме их полостей. Клинически гипертрофическая кардиомиопатия проявляется сердечной недостаточностью, болью в грудной клетке, нарушениями ритма, синкопальными состояниями, внезапной смертью. Диагностика гипертрофической кардиомиопатии включает проведение ЭКГ, суточного ЭКГ-мониторирования, ЭхоКГ, рентгенологического исследования, МРТ, ПЭТ сердца. Лечение гипертрофической кардиомиопатии проводится b-адреноблокаторами, блокаторами кальциевых каналов, антикоагулянтами, антиаритмическими препаратами, ингибиторами АПФ; в ряде случаев прибегают к кардиохирургической операции (миотомии, миоэктомии, протезированию митрального клапана, двухкамерной электрокардиостимуляции, имплантации кардиовертер-дефибриллятора).
В кардиологии различают первичные (идиопатические) кардиомиопатии (гипертрофическую, констриктивную, дилатационную, рестриктивную, аритмогенную дисплазию правого желудочка) и специфические вторичные кардиомиопатии (алкогольную, токсическую, метаболическую, климактерическую и ряд других).
Гипертрофическая кардиомиопатия - самостоятельное, не зависящее от других сердечно-сосудистых заболеваний, значительное утолщение миокарда левого (реже правого) желудочка, сопровождающееся уменьшением его полости, нарушением диастолической функции с развитием нарушений сердечного ритма и сердечной недостаточности.
Гипертрофическая кардиомиопатия развивается у 0,2-1,1% населения, чаще мужского пола; средний возраст пациентов составляет от 30 до 50 лет. Коронарный атеросклероз среди больных гипертрофической кардиомиопатией встречается в 15-25 % случаев. Внезапная смерть, вызванная с тяжелыми желудочковыми аритмиями (пароксизмальной желудочковой тахикардией), наступает у 50% пациентов с гипертрофической кардиомиопатией. У 5-9 % больных заболевание осложняется инфекционным эндокардитом, протекающим с поражением митрального или аортального клапана.
Гипертрофическая кардиомиопатия - заболевание с аутосомно-доминантным типом наследования, поэтому обычно носит семейный характер, что не исключает, однако, возникновение спорадических форм.
В основе семейных случаев гипертрофической кардиомиопатии лежат передаваемые по наследству дефекты генов, кодирующих синтез сократительных белков миокарда (гена тяжелой цепи b-миозина, гена сердечного тропонина Т, гена а-тропомиозина, гена, кодирующего сердечную изоформу миозин-связывающего белка). Спонтанные мутации этих же генов, происходящие под воздействием неблагоприятных факторов среды, обусловливают развитие спорадических форм гипертрофической кардиомиопатии.
Гипертрофия миокарда левого желудочка при гипертрофической кардиомиопатии не связана с врожденными и приобретенными пороками сердца, ИБС, гипертонической болезнью и другими заболеваниями, которые обычно приводят к подобным изменениям.
В патогенезе гипертрофической кардиомиопатии ведущая роль принадлежит компенсаторной гипертрофии сердечной мышцы, обусловленной одним из двух возможных патологических механизмов - нарушением диастолической функции миокарда или обструкцией выходного тракта левого желудочка. Диастолическая дисфункция характеризуется поступлением в желудочки недостаточного количества крови в диастолу, что связано с плохой растяжимостью миокарда, и обусловливает быстрый подъем конечного диастолического давления.
При обструкции выходного отдела левого желудочка имеет место утолщение межжелудочковой перегородки и нарушение движения передней створки митрального клапана. В связи с этим в период изгнания возникает перепад давления между полостью левого желудочка и начальным отрезком аорты, что сопровождается повышением конечного диастолического давления в левом желудочке. Возникающая в этих условиях компенсаторная гиперфункция сопровождается гипертрофией, а затем и дилатацией левого предсердия, в случае же декомпенсации развивается легочная гипертензия.
В ряде случаев гипертрофической кардиомиопатии сопутствует ишемия миокарда, обусловленная снижением вазодилататорного резерва коронарных артерий, увеличением потребности гипертрофированного миокарда в кислороде, сдавлением во время систолы интрамуральных артерий, сопутствующим атеросклерозом венечных артерий и т. д.
Макроскопическими признаками гипертрофической кардиомиопатии служит утолщение стенок левого желудочка при нормальных или уменьшенных размерах его полости, гипертрофия межжелудочковой перегородки, дилатация левого предсердия. Микроскопическая картина гипертрофической кардиомиопатии характеризуется беспорядочным расположением кардиомиоцитов, замещением мышечной ткани на фиброзную, аномальным строением интрамуральных венечных артерий.
В соответствии с локализацией гипертрофии выделяют гипертрофическую кардиомиопатию левого и правого желудочков. В свою очередь, гипертрофия левого желудочка может быть асимметричной и симметричной (концентрической). В большинстве случаев выявляется асимметричная гипертрофия межжелудочковой перегородки на всем протяжении или в ее базальных отделах. Реже встречается асимметричной гипертрофия верхушки сердца (апикальная гипертрофическая кардиомиопатия), задней или переднебоковой стенки. На долю симметричной гипертрофии приходится около 30 % случаев.
С учетом наличия градиента систолического давления в полости левого желудочка различают обструктивную и необструктивную гипертрофическую кардиомиопатию. Симметричная гипертрофия левого желудочка, как правило, представляет собой необструктивную форму гипертрофической кардиомиопатии.
Асимметричная гипертрофия может являться как необструктивной, так и обструктивной. Так, синонимом асимметричной гипертрофии межжелудочковой перегородки служит понятие «идиопатический гипертрофический субаортальный стеноз», гипертрофии средней части межжелудочковой перегородки (на уровне папиллярных мышц) - «мезовентрикулярная обструкция». Верхушечная гипертрофия левого желудочка, как правило, представлена необструктивным вариантом.
В зависимости от степени утолщения миокарда выделяют умеренную (15-20 мм), среднюю (21-25 мм) и выраженную (более 25 мм) гипертрофию.
На основании клинико-физиологической классификации выделяют IV стадии гипертрофической кардиомиопатии:
- I - градиент давления в выходном тракте левого желудочка (ВТЛЖ) не более 25 мм рт. ст.; жалобы отсутствуют;
- II - градиент давления в ВТЛЖ возрастает до 36 мм рт. ст.; появляются жалобы при физической нагрузке;
- III - градиент давления в ВТЛЖ увеличивается до 44 мм рт. ст.; появляются стенокардия, одышка;
- IV - градиент давления в ВТЛЖ выше 80 мм рт. ст.; развиваются выраженные нарушения гемодинамики, возможна внезапная сердечная смерть.
Симптомы гипертрофической кардиомиопатии
Длительное время течение гипертрофической кардиомиопатии остается бессимптомным, клиническая манифестация чаще происходит в возрасте 25-40 лет. С учетом преобладающих жалоб выделяют девять клинических форм гипертрофической кардиомиопатии: малосимптомную, вегетодистоническую, кардиалгическую, инфарктоподобную, аритмическую, декомпенсационную, псевдоклапанную, смешанную, молниеносную. Несмотря на то, что каждый клинический вариант характеризуется определенными признаками, всем формам гипертрофической кардиомиопатии присущи общие симптомы.
Необструктивная форма гипертрофической кардиомиопатии, не сопровождающаяся нарушением оттока крови из желудочка, обычно малосимптомна. В этом случае жалобы на одышку, перебои в работе сердца, неритмичный пульс могут отмечаться при выполнении физической нагрузки.
Типичными симптомами обструктивной гипертрофической кардиомиопатии служат приступы ангинозных болей (70%), выраженная одышка (90%), головокружения и обморочные состояния (25-50%), преходящая артериальная гипотензия, нарушения ритма сердца (пароксизмальная тахикардия, фибрилляция предсердий, экстрасистолия). Возможно возникновение приступов сердечной астмы и отека легких. Нередко первым эпизодом проявления гипертрофической кардиомиопатии служит внезапная смерть.
При диагностическом поиске обнаруживается систолический шум, высокий, скорый пульс, смещение верхушечного толчка. Инструментальные методы обследования при гипертрофической кардиомиопатии включают ЭхоКГ, ЭКГ, ФКГ, рентгенографию грудной клетки, холтеровское мониторирование, поликардиографию, ритмокардиографию. С помощью эхокардиографии выявляется гипертрофия МЖП, стенок миокарда желудочка, увеличение размеров левого предсердия, наличие обструкции ВТЛЖ, диастолическая дисфункция левого желудочка.
ЭКГ-признаки гипертрофической кардиомиопатии малоспецифичны и требуют дифференциальной диагностики с очаговыми изменениями миокарда, гипертонической болезнью, ИБС, аортальным стенозом и другими заболеваниями, осложняющимися гипертрофией левого желудочка. Для оценки тяжести гипертрофической кардиомиопатии, прогноза и выработки рекомендаций по лечению используются нагрузочные пробы (велоэргометрия, тредмил-тест).
Суточное мониторирование ЭКГ позволяет документировать пароксизмальные эпизоды желудочковой экстрасистолии и тахикардии, фибрилляции и трепетания предсердий. На фонокардиограмме регистрируется систолический шум различной степени выраженности, сохранность амплитуды I и II тонов. Сфигмография демонстрирует двухвершинную кривую каротидного пульса, характеризующуюся дополнительной волной на подъеме.
При рентгенологическом исследовании изменения контуров сердца (увеличение левых отделов сердца, расширение восходящей части аорты, выбухание ствола и расширение ветвей легочной артерии) обнаруживаются только в развернутой стадии гипертрофической кардиомиопатии. Для получения дополнительных данных за гипертрофическую кардиомиопатию прибегают к проведению зондирования левых отделов сердца, вентрикулографии, коронарографии, сканированию сердца с радиоизотопом таллия, МРТ, ПЭТ сердца. Окончательным подтверждающим методом служит генодиагностика.
Лечение гипертрофической кардиомиопатии
Пациентам с гипертрофической кардиомиопатией (особенно с обструктивной формой) рекомендуется ограничение физических нагрузок, которые могут спровоцировать увеличение градиента давления «левый желудочек-аорта», аритмии сердца и обмороки.
При умеренно выраженных симптомах гипертрофической кардиомиопатии назначают b-адреноблокаторы (пропранолол, атенолол, метопролол) или блокаторы кальциевых каналов (верапамил), уменьшающие ЧСС, удлиняющие диастолу, улучшающие пассивное наполнение левого желудочка и снижающие давление наполнения. В связи с наличием высокого риска развития тромбоэмболий необходим прием антикоагулянтов. При развитии сердечной недостаточности показаны диуретики, ингибиторы АПФ; при нарушениях желудочкового ритма - антиаритмические препараты (амиодарон, дизопирамид).
При обструктивной гипертрофической кардиомиопатии проводится профилактика инфекционного эндокардита, т. к. в результате постоянной травматизации передней створки митрального клапана на ней могут появляться вегетации. Кардиохирургическое лечение гипертрофической кардиомиопатии целесообразно при градиенте давления между левым желудочком и аортой >50 мм рт.ст. В этом случае может выполняться септальная миотомия или миоэктомия, а при структурных изменениях митрального клапана, вызывающих значительную регургитацию, - протезирование митрального клапана.
Для уменьшения обструкции ВТЛЖ показана имплантация двухкамерного электрокардиостимулятора; при наличии желудочковых нарушений ритма - имплантация кардиовертер-дефибриллятора.
Прогноз гипертрофической кардиомиопатии
Течение гипертрофической кардиомиопатии вариабельно. Необструктивная форма гипертрофической кардиомиопатии протекает относительно стабильно, однако при длительном стаже заболевания все же развивается сердечная недостаточность. У 5-10% пациентов возможен самостоятельный регресс гипертрофии; у такого же процента больных отмечается переход гипертрофической кардиомиопатии в дилатационную; еще столько же пациентов сталкивается с осложнением в виде инфекционного эндокардита.
Без лечения летальность при гипертрофической кардиомиопатии составляет 3-8 %, при этом в половине подобных случаев возникает внезапная смерть вследствие фибрилляции желудочков, полной атриовентрикулярной блокады, острого инфаркта миокарда.
Дефект межжелудочковой перегородки
Дефект межжелудочковой перегородки (ДМЖП) - отверстие в перегородке, разделяющей полости левого и правого желудочка, наличие которого приводит к патологическому шунтированию крови. В кардиологии дефект межжелудочковой перегородки - наиболее часто встречающийся врожденный порок сердца (9-25% от всех ВПС). Частота критических состояний при дефекте межжелудочковой перегородки составляет около 21%. С одинаковой частотой порок обнаруживается у новорожденных мальчиков и девочек.
Дефект межжелудочковой перегородки может быть единственной внутрисердечной аномалией (изолированный ДМЖП) или входить в структуру сложных пороков (тетрады Фалло, общего артериального ствола, транспозиции магистральных сосудов, атрезии трехстворчатого клапана и др.). В ряде случаев межжелудочковая перегородка может отсутствовать полностью - такое состояние характеризуется как единственный желудочек сердца.
Причины дефекта межжелудочковой перегородки
Чаще всего дефект межжелудочковой перегородки является следствием нарушения эмбрионального развития и формируется у плода при нарушениях закладки органов. Поэтому дефекту межжелудочковой перегородки часто сопутствуют другие сердечные пороки: открытый артериальный проток (20%), дефект межпредсердной перегородки (20%), коарктация аорты (12%), стеноз устья аорты (5%), аортальная недостаточность (2,5—4,5%), недостаточность митрального клапана (2%), реже - аномальный дренаж легочных вен, стеноз легочной артерии и др.
В 25-50% случаев дефект межжелудочковой перегородки сочетается с пороками развития внесердечной локализации - болезнью Дауна, аномалиями развития почек, расщелиной твердого неба и заячьей губой.
Непосредственными факторами, вызывающими нарушение эмбриогенеза, выступают вредные воздействия на плод в I триместре гестации: заболевания беременной (вирусные инфекции, эндокринные нарушения), алкогольная и лекарственная интоксикации, ионизирующая радиация, патологическое течение беременности (выраженные токсикозы, угроза самопроизвольного прерывания беременности и пр.). Имеются данные о наследственной этиологии дефекта межжелудочковой перегородки. Приобретенные дефекты межжелудочковой перегородки могут являться осложнением инфаркта миокарда.
Особенности гемодинамики при дефекте межжелудочковой перегородки
Межжелудочковая перегородка образует внутренние стенки обоих желудочков и составляет примерно 1/3 площади каждого из них. Межжелудочковая перегородка представлена мембранозным и мышечным компонентами. В свою очередь, мышечный отдел состоит из 3-х частей - приточной, трабекулярной и отточной (инфундибулярной).
После рождения и установления кровотока в большом и малом кругах кровообращения из-за дефекта межжелудочковой перегородки возникает лево-правый сброс крови, объем которого зависит от размеров отверстия. При небольшом объеме шунтируемой крови давление в правом желудочке и легочных артериях остается нормальным либо незначительно повышается. Однако при большом поступлении крови через дефект в малый круг кровообращения и ее возврате в левые отделы сердца, развивается объемная и систолическая перегрузка желудочков.
Значительное повышение давления в малом круге кровообращения при больших дефектах межжелудочковой перегородки способствует возникновению легочной гипертензии. Повышение легочно-сосудистого сопротивления взывает развитие сброса крови из правого желудочка в левый (обратного или перекрестного шунтирования), что приводит к артериальной гипоксемии (синдром Эйзенменгера).
Многолетняя практика кардиохиругов показывает, что наилучших результатов закрытия дефекта межжелудочковой перегородки можно добиться при сбросе крови слева направо. Поэтому при планировании операции тщательно учитываются гемодинамические параметры (давление, сопротивление и объем сброса).
Классификация дефекта межжелудочковой перегородки
Размер дефекта межжелудочковой перегородки оценивается, исходя из его абсолютной величины и сопоставления с диаметром аортального отверстия: маленький дефект составляет 1-3 мм (болезнь Толочинова-Роже), средний - равен примерно 1/2 диаметра аортального отверстия, большой - равен или превышает его диаметр.
С учетом анатомического расположения дефекта выделяют:
- перимембранозные дефекты межжелудочковой перегородки - 75% (приточные, трабекулярные, инфундибулярные) расположены в верхней части перегородки под аортальным клапаном, могут закрываться самопроизвольно;
- мышечные дефекты межжелудочковой перегородки - 10% (приточные, трабекулярные) - расположены в мышечном отделе перегородки, на значительном удалении от клапанной и проводящей систем;
- надгребневые дефекты межжелудочковой перегородки - 5% - расположены выше наджелудочкового гребня (мышечного пучка, отделяющего полость правого желудочка от его выносящего тракта), самопроизвольно не закрываются.
Симптомы дефекта межжелудочковой перегородки
Клинические проявления больших и малых изолированных дефектов межжелудочковой перегородки различны. Малые дефекты межжелудочковой перегородки (болезнь Толочинова—Роже) имеют диаметр менее 1 см и встречаются в 25-40% от числа всех ДМЖП. Проявляются нерезко выраженной утомляемостью и одышкой при нагрузке. Физическое развитие детей, как правило, не нарушено. Иногда у них определяется слабо выраженное куполообразное выпячивание грудной клетки в области сердца - «сердечный горб». Характерным клиническим признаком малых дефектов межжелудочковой перегородки служит аускультативно выявляемое наличие грубого систолического шума над областью сердца, который фиксируется уже на первой неделе жизни.
Большие дефекты межжелудочковой перегородки, имеющие размеры более 1/2 диаметра устья аорты или более 1 см, проявляются симптоматически уже в первые 3 месяца жизни новорожденных, приводя в 25-30% случаев к развитию критического состояния. При больших дефектах межжелудочковой перегородки отмечается гипотрофия, одышка при физической нагрузке или в покое, повышенная утомляемость. Характерны затруднения при кормлении: прерывистое сосание, частые отрывы от груди, одышка и бледность, потливость, пероральный цианоз. В анамнезе у большинства детей с дефектом межжелудочковой перегородки - частые респираторные инфекции, затяжные и рецидивирующие бронхиты и пневмонии.
В возрасте 3-4-лет, по мере нарастания сердечной недостаточности, у таких детей появляются жалобы на сердцебиение и боли в области сердца, склонность к носовым кровотечениям и обморокам. Транзиторный цианоз сменяется постоянным пероральным и акроцианозом; беспокоит постоянная одышка в покое, ортопноэ, кашель (синдром Эйзенменгера). На наличие хронической гипоксии указывают деформация фаланг пальцев и ногтей («барабанные палочки», «часовые стекла»).
При обследовании выявляется «сердечный горб», развитый в меньшей или большей степени; тахикардия, расширение границ сердечной тупости, грубый интенсивный пансистолический шум; гепатомегалия и спленомегалия. В нижних отделах легких выслушиваются застойные хрипы.
Диагностика дефекта межжелудочковой перегородки
К методам инструментальной диагностики дефекта межжелудочковой перегородки относятся ЭКГ, ФКГ, рентгенография грудной клетки, ЭхоКС, катетеризация камер сердца, ангиокардиография, вентрикулография.
Электрокардиограмма при дефекте межжелудочковой перегородки отражает перегрузку желудочков, наличие и степень выраженности легочной гипертензии. У взрослых больных могут регистрироваться аритмии (экстрасистолия, мерцание предсердий), нарушения проводимости (блокада правой ножки пучка Гиса, синдром WPW). Фонокардиография фиксирует высокочастотный систолический шум с максимумом в III-IV межреберье слева от грудины.
Эхокардиография позволяет выявить дефект межжелудочковой перегородки или заподозрить его по характерным нарушениям гемодинамики. Рентгенография органов грудной клетки при больших дефектах межжелудочковой перегородки обнаруживает усиление легочного рисунка, усиленную пульсацию корней легких, увеличение размеров сердца. Зондирование правых полостей сердца выявляет повышение давления в легочной артерии и правом желудочке, возможность проведения катетера в аорту, повышенную оксигенацию венозной крови в правом желудочке. Аортография проводится для исключения сопутствующих ВПС.
Дифференциальная диагностика дефекта межжелудочковой перегородки проводится с открытым атриовентрикулярным каналом, общим артериальным стволом, дефектом аортолегочной перегородки, изолированным стенозом легочной артерии, стенозом аорты, врожденной митральной недостаточностью, тромбоэмболией.
Лечение дефекта межжелудочковой перегородки
Асимптомное течение дефекта межелудочковой перегородки при его небольших размерах позволяет воздержаться от хирургического вмешательства и осуществлять динамическое наблюдение за ребенком. В ряде случаев возможно спонтанное закрытие дефекта межжелудочковой перегородки к 1-4 годам жизни или в более позднем возрасте. В остальных случаях показано хирургическое закрытие дефекта межжелудочковой перегородки, как правило, после достижения ребенком 3-х лет.
При развитии сердечной недостаточности и легочной гипертензии проводится консервативное лечение с помощью сердечных гликозидов, мочегонных препаратов, ингибиторов ангиотензинпревращающего фермента, кардиотрофиков, антиоксидантов.
Кардиохирургическое лечение дефекта межжелудочковой перегородки может быть радикальным и паллиативным. К радикальным операциям относятся ушивание малых дефектов межжелудочковой перегородки П-образными швами; пластика больших дефектов синтетической (тефлон, дакрон и др.) заплатой или биологической (консервированный ксеноперикард, аутоперикард) тканью; рентгенэндоваскулярная окклюзия дефекта межжелудочковой перегородки.
У грудных детей с выраженной гипотрофией, большим лево-правым шунтированием крови и множественными дефектами предпочтение отдается паллиативной операции, направленной на создание искусственного стеноза легочной артерии с помощью манжетки. Данный этап позволяет подготовить ребенка к радикальной операции по устранению дефекта межжелудочковой перегородки в более старшем возрасте.
Течение беременности при дефекте межжелудочковой перегородки
Женщины с небольшим дефектом межжелудочковой перегородки, как правило, в состоянии нормально выносить и родить ребенка. Однако, при больших размерах дефекта, аритмии, сердечной недостаточности или легочной гипертензии риск осложнений во время беременности значительно повышается. Наличие синдрома Эйзенменгера является показанием для искусственного прерывания беременности. У женщин с дефектом межжелудочковой перегородки имеется повышенная вероятность рождения ребенка с аналогичным или другим врожденным пороком сердца.
Перед планированием беременности пациентке с пороком сердца (оперированным или нет) необходимо проконсультироваться с акушером-гинекологом, кардиологом, генетиком. Ведение беременности у категории женщин с дефектом межжелудочковой перегородки требует повышенного внимания.
Прогноз при дефекте межжелудочковой перегородки
Естественное течение дефекта межжелудочковой перегородки в целом не позволяет надеяться на благоприятный прогноз. Продолжительность жизни при данном пороке зависит от величины дефекта и составляет в среднем около 25 лет. При больших и средних дефектах 50-80% детей умирают в возрасте до 6 мес. или 1 года от сердечной недостаточности, застойной пневмонии, бактериального эндокардита, нарушений ритма сердца, тромбоэмболических осложнений.
В редких случаях ДМЖП не оказывает существенного влияния на продолжительность и качество жизни. Спонтанное закрытие дефекта межжелудочковой перегородки наблюдается в 25-40% случаев, преимущественно при его малом размере. Однако даже в этом случае больные должны находиться под наблюдением кардиолога в связи с возможными осложнениями со стороны проводящей системы сердца и высоким риском возникновения инфекционного эндокардита.
Разрывы сердца при инфаркте
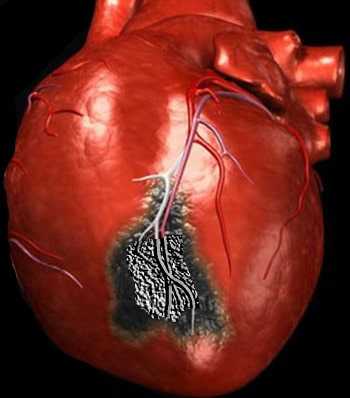
Разрыв сердца — это нарушение целостности стенок сердца, которое чаще всего встречается как осложнение острого инфаркта миокарда (гибели участка сердечной мышцы вследствие прекращения притока крови к нему) и сопровождается высокой смертностью. У большинства больных происходит разрыв стенки левого желудочка, реже - правого желудочка, еще реже - межжелудочковой перегородки (перегородки между левым и правым желудочками сердца) и папиллярных мышц (внутренние мышцы сердца, обеспечивающие движение клапанов).
Вероятность разрыва сердца
Разрывы сердца возникают при инфаркте миокарда в 3% случаев, чаще в первую неделю (в 50% случаев) первого, как правило, переднего обширного трансмурального «ИМ с зубцом Q» и у пожилых женщин. В дальнейшем риск развития разрыва снижается по мере формирования постинфарктного рубца Разрывы сердца являются причиной летальности в 15% случаев и занимают 3-е место после фибрилляции желудочков и коронарного шунтирования.
Разрывы сердца обычно происходят в интервале от первых суток инфаркта миокарда до 3 недель и имеют два пика в первые 24 часа и на 4— 7-й день от начала инфаркта миокарда. Подавляющая часть больных с разрывами сердца гибнет от гемоперикарда в течение нескольких минут.
Классификация
По времени:
- ранними (возникают чаще, в 80% случаев), пик — 3—5-й дни инфаркта миокарда, когда еще нет рубцевания,
- поздними — вследствие истончения некротизированного участка,
По локализации
По клиническому развитию:
- медленнотекущими,
- подострыми (в течение нескольких часов с клиническими симптомами нарастающей тампонады сердца, когда еще возможно помочь больному),
- острыми, одномоментными (с острой гемотампонадой).
Наружные разрывы свободной стенки левого желудочка сердца (встречаются у 2—10% больных инфаркта миокарда) с истечением крови из левого желудочка в полость перикарда (быстро заполняющей ее) и развитием тампонады сердца, чаще возникают между 1-м и 21-м днем и встречаются в зоне обширного (более 20% площади миокарда) трансмурального инфаркта миокарда передней стенки или заднебокового сегмента левого желудочка (особенно у гипертоников) и в 10—20% случаев ответственны за больничную летальность от инфаркта миокарда. Левый желудочек подвержен таким разрывам в 7 раз чаще, чем правый желудочек. Разрывы часты у пожилых женщин (старше 60 лет) между 1-м днем и 3 неделями трансмурального инфаркта миокарда и у гипертоников.
Причины разрывов сердца
- Истончение стенки левого желудочка,
- Некроз стенки миокарда на всю толщу (трансмуральный инфаркт)
- Попадание крови в зону ишемии (что ослабляет миокард);
- Неблагоприятное влияние тромболитиков на организацию коллагена и его синтез в зоне инфаркта;
- Рассасывание коллагена вследствие наплыва лимфоцитов в зону инфаркта миокарда;
- Плохое развитие коллатералей;
- Неадекватное моделирование миокарда;
- Нагрузка на стенку миокарда в «жесткой» зоне некроза в период систолы и разрывы микроструктур миокарда;
- Сохраняющееся высокое АД в первые дни инфаркта миокарда;
- Поздняя госпитализация (12—24 ч);
- Сохраняющийся кашель, рвота или состояние психодвигательного возбуждения;
- Распространенный инфаркт миокарда (более 20% площади миокарда);
- Возможное продолжение инфаркта миокарда (поздние разрывы).
Диагностика
Анализ анамнеза заболевания и жалоб, когда появились боли в груди, слабость, с чем пациент связывает появление этих симптомов, были ли травмы грудной клетки, отмечал ли пациент приступы загрудинных болей ранее, имеет ли ишемическую болезнь сердца), переносил ли ранее инфаркт миокарда.
Физикальный осмотр. При аускультации сердца определяются характерные шумы. Этот шум часто сопровождается дрожанием в околосердечной области. При разрыве или отрыве папиллярной мышцы появляется выраженная недостаточность клапана, сопровождающаяся систолическим шумом над всей областью сердца, особенно над его верхушкой.
Определение тропонина Т или I крови помогает выявить наличие острого инфаркта миокарда.
Развернутая коагулограмма позволяет определить повышенную свертываемость крови, значительный расход факторов свертывания, выявить появление в крови продуктов распада.
Электрокардиография (ЭКГ). При разрыве сердца на ЭКГ продолжает определяться синусовый или замещающий его ритм. Определяется электромеханическая диссоциация - несоответствие между наличием ритма сердца на ЭКГ и отсутствием нормального тока крови (отсутствие пульса и артериального давления, или слабый пульс и низкое артериальное давление). Со временем нормальный ритм урежается (становится редким), сменяется единичными ударами сердца и развивается остановка сердца.
Эхокардиография (ЭхоКГ). При эхокардиографическом исследовании определяется расположение разрыва сердца, его размеры, оценивается накопление крови в полости перикарда (околосердечной сумки), выявляется изменение тока крови при нарушении функции клапанов сердца (например, при разрыве папиллярных мышц - внутренних мышц сердца, обеспечивающих движение клапанов).
Лечение разрыва сердца
Шанс дает только хирургическое лечение. Предоперационный период очень короткий, только во время подготовки операционной, так как оперативное лечение должно быть экстренным. В предоперационном периоде возможна попытка стабилизации гемодинамики. Для этого применяют:
- внутриаортальную баллонную контрпульсацию - имплантацию механического устройства для временной поддержки насосной функции сердца. Данный метод позволяет понизить нагрузку сердца и повысить кровоснабжение всех органов, в том числе собственных артерий сердца;
- внутривенное капельное введение растворов из группы нитратов;
- перикардиоцентез — уменьшает тампонаду сердца кровью.
Хирургическое лечение подразумевает открытую операцию, с ушиванием разрыва миокарда с постановкой заплаты и восстановление его кровоснабжения.
Осложнения и последствия
Каждый больной с разрывом сердца быстро погибает при отсутствии экстренного хирургического лечения. Даже пациенты с маленьким разрывом сердца, самостоятельно закрывшимся, крайне редко живут более 2-х месяцев без проведении операции.
Профилактика разрыва сердца
Профилактика возникновения ишемической болезни сердца:
- нормализация уровня холестерина в крови: отказ от приема жирной пищи, при наличии повышенного уровня холестерина - терапия холестерин-снижающими препаратами;
- отказ от курения;
- нормализация артериального давления (поддержание артериального давления в пределах от 90/60 мм рт.ст. до 140/90 мм рт.ст.).
- Своевременное обращение за медицинской помощью при появлении длительного (более 5 минут) приступа загрудинных болей.
- Своевременная диагностика и лечение ишемической болезни сердца обеспечивает профилактику инфаркта миокарда как основной причины разрывов сердца.
- Раннее полноценное лечение имеющегося инфаркта миокарда.
Разрыв сердца - одна из основных причин смерти пациентов с острым инфарктом миокарда. Частота разрывов сердца резко увеличивается по мере старения человека и составляет около 4% у лиц до 50 лет, 20% — у больных в возрасте 50—59 лет, более 30% — у лиц старше 60 лет. Вероятность разрыва сердца не зависит от размера зоны некроза. С высоким риском развития разрыва сердца связаны пожилой возраст, женский пол, первый передний обширный трансмуральный ИМ с более чем 20% зоной поражения левого желудочка, слабое развитие коллатерального кровообращения, нижняя локализация инфаркта миокарда, наличие артериальной гипертензии или сахарного диабета в анамнезе, чрезмерная двигательная активность в острый период инфаркта миокарда, проведение тромболитической терапии позднее 14 часов от начала развития инфаркта миокарда.
Читайте также:
