Преципитат иммунных комплексов. Взаимодействие доменов в цепях антител
Добавил пользователь Владимир З. Обновлено: 22.01.2026
Преимущества иммунологического метода исследования.
Серологические реакции различаются по способности выявлять отдельные классы антител. Реакция агглютинации, например, хорошо выявляет lgM-антитела, но менее чувствительна для определения lgG-антител. Реакции связывания комплемента и гемолиза, которые требуют участия комплемента, не выявляют антитела, не присоединяющие комплемент, например lgA-антитела и lgE-антитела. В реакции нейтрализации вирусов участвуют лишь антитела, направленные против антигенных детерминант поверхности вириона, связанных с патогенностью. Чувствительность иммунулогических методов превосходит все другие методы исследования антигенов и антител, в частности радиоиммунный и иммуноферментный анализы позволяют улавливать присутствие белка в количествах, измеряемых в нанограммах и даже в пикограммах.
С помощью предложенного способа определяют группу и проверяют безопасность крови (гепатит В и ВИЧ-инфекция). При трансплантации тканей и органов, иммунологический метод позволяет определять совместимость тканей и тестировать методы подавления несовместимости. В судебной медицине используют реакцию Кастеллани для определения видовой специфичности белка и реакцию агглютинации для определения группы крови.
Иммунологические методы широко применяют в лабораторной диагностике инфекционных болезней. Этиологию заболевания устанавливают также на основании прироста антител к возбудителю в сыворотке крови реконвалесцента по сравнению с пробой, взятой в первые дни болезни. На основе исследования изучают иммунитет населения по отношению к массовым инфекциям, например к гриппу, а также оценивают эффективность профилактических прививок.
Развитию иммунологических методов способствовало создание моноклональных антител, продуцируемых гибридомой, полученной в результате слияния иммунокомпетентной клетки В-лимфоцита и клетки миеломы мышей. Моноклональные антитела несут только одну химически однородную популяцию антител, комплементарную специфической детерминанте антигена, что позволяет осуществлять тонкую дифференциацию белков. Развитие иммунологического метода исследования идет как по линии совершенствования реагентов (чистоты антигенов и антител), так и по линии создания автоматизированных систем постановки реакций и их инструментального учета.
Виды реакций метода иммунологического исследования
В зависимости от их механизма и учета результатов, иммунологический метод исследования можно подразделить на 5 видов реакции.
1.Реакции, основанные на феномене агглютинации.
Агглютинация представляет собой склеивание клеток или отдельных частичек — носителей антигена с помощью иммунной сыворотки к этому антигену.
Реакция агглютинации бактерий с использованием соответствующей антибактериальной сыворотки относится к наиболее простым серологическим реакциям. Взвесь бактерий добавляют к различным разведениям испытуемой сыворотки крови и через определенное время контакта при t 37° регистрируют, при каком наивысшем разведении сыворотки крови происходит агглютинация. Реакцию агглютинации бактерий используют для диагностики многих инфекционных болезней: бруцеллеза, туляремии, брюшного тифа и паратифов, бациллярной дизентерии, сыпного тифа.
Реакции агглютинации для определения группы крови и резус-фактора основаны на взаимодействии аллоантител (изоантител) и антигенов эритроцитов. Антитела против резус-фактора являются неполными, они не способны к прямой реакции с резус-положительными эритроцитами, поэтому для их обнаружения используют реакцию Кумбса, основанную на выявлении неполных антител с помощью антиглобулиновых сывороток. К эритроцитам известной специфичности добавляют исследуемую сыворотку крови, а вслед за этим антиглобулиновую сыворотку против lgG (непрямая реакция Кумбса). Fab-фрагменты неполных антител исследуемой сыворотки крови присоединяются к эритроцитам, а к свободным Fc-фрагментам этих антител присоединяются антитела против lgG, и происходит агглютинация эритроцитов.
Реакция пассивной или непрямой гемагглютинации (РПГА, РНГА). В ней используют эритроциты или нейтральные синтетические материалы (например, частицы латекса), на поверхности которых сорбированы антигены (бактериальные, вирусные, тканевые) или антитела. Их агглютинация происходит при добавлении соответствующих сывороток или антигенов. Эритроциты, сенсибилизированные антигенами, называют антигенным эритроцитарным диагностикумом и используют для выявления и титрования антител. Эритроциты, сенсибилизированные антителами, называют иммуноглобулиновыми эритроцитарными диагностикумами и применяют для выявления антигенов.
Реакцию пассивной гемагглютинации используют для диагностики заболеваний, вызванных бактериями (брюшной тиф и паратифы, дизентерия, бруцеллез, чума, холера и др.), простейшими (малярия) и вирусами (грипп, аденовирусные инфекции, вирусный гепатит В, корь, клещевой энцефалит, крымская геморрагическая лихорадка и др.), а также для определения некоторых гормонов, выявления повышенной чувствительности больного к лекарственным препаратам и гормонам, например пенициллину и инсулину.
Реакция торможения гемагглютинации (РТГА) основана на феномене предотвращения (торможения) иммунной сыворотки гемагглютинации эритроцитов вирусами, используется для выявления и титрования противовирусных антител. Она служит основным методом серодиагностики гриппа, кори, краснухи, эпидемического паротита, клещевого энцефалита и других вирусных инфекций, возбудители которых обладают гемагглютинирующими свойствами, например, для серодиагностики клещевого энцефалита, в лунки панели разливают двукратные разведения сыворотки больного на щелочном боратном буферном растворе. Затем добавляют определенное количество, обычно 8 АЕ (агглютинирующих единиц), антигена клещевого энцефалита и после 18 ч экспозиции при t 4° вносят взвесь гусиных эритроцитов, приготовленную на кислом фосфатно-буферном растворе. Если в сыворотке крови больного есть антитела к вирусу клещевого энцефалита, то антиген нейтрализуется и агглютинация эритроцитов не происходит.
2.Реакции, основанные на феномене преципитации.
Преципитация происходит в результате взаимодействия антител с растворимыми антигенами. Простейшим примером реакции преципитации является образование в пробирке непрозрачной полосы преципитации на границе наслоения антигена на антитело. Широко применяют различные разновидности реакции преципитации в полужидких гелях агара или агарозы (метод двойной иммунодиффузии по Оухтерлоню, метод радиальной иммунодиффузии, иммуноэлетрофорез), которые носят одновременно качественный и количественный характер. В результате свободной диффузии, в геле антигенов и антител в зоне оптимального их соотношения образуются специфические комплексы — полосы преципитации, которые выявляют визуально или при окрашивании. Особенностью метода является то, что каждая пара антиген-антитело формирует индивидуальную полосу преципитации, и реакция не зависит от наличия в исследуемой системе других антигенов и антител.
Для постановки двойной иммунодиффузии наливают слой растопленного геля на стеклянную пластинку и после затвердевания вырезают лунки диаметром 1,5-3 мм. В расположенные по кругу лунки помещают исследуемые антигены, а в центральную лунку — иммунную сыворотку известной специфичности. Диффундируя навстречу друг другу, гомологичные сыворотки и антигены образуют преципитат.
При радиальной иммунодиффузии (по методу Манчини), иммунную сыворотку вносят в агар. Антиген, помещенный в лунки, диффундирует через агар, и в результате преципитации с иммунной сывороткой, вокруг лунок образуются непрозрачные кольца, внешний диаметр которых пропорционален концентрации антигена. Метод используют для определения классов иммуноглобулинов, а модификации метода можно применять для определения противомикробных антител, относящихся к различным классам иммуноглобулинов.
Иммуноэлектрофорез основан на усилении миграции в геле антигенов и антител путем помещения пластины геля с реагентами в электрическое поле. При этом достигается разделение антигенов и антител на компоненты в соответствии с их подвижностью и зарядом.
Разновидностью иммуноэлектрофореза является радиоиммунофорез. В этом случае после электрофоретического разделения антигенов в канавку, вырезанную параллельно движению антигенов в геле, наливают сначала меченную радиоактивным йодом иммунную сыворотку против определяемых антигенов, а затем иммунную сыворотку против lgG-антител, которая преципитирует образовавшиеся комплексы антитела с антигеном. Все несвязавшиеся реагенты вымывают, а комплекс антиген-антитело обнаруживает методом авторадиографии.
3.Реакции с участием комплемента.
В качестве комплемента используют свежую сыворотку крови морской свинки, основанную на способности субкомпонента комплемента Clq и затем других компонентов комплемента присоединяться к иммунным комплексам.
Реакция связывания комплемента (РСК) позволяет титровать антигены или антитела по степени фиксации комплемента комплексом антиген-антитело. Эта реакция состоит из двух фаз: взаимодействия антигена с испытуемой сывороткой крови (исследуемая система) и взаимодействия гемолитической сыворотки с эритроцитами барана (индикаторная система). При положительной реакции в исследуемой системе происходит связывание комплемента, и тогда при добавлении сенсибилизированных антителами эритроцитов, гемолиза не наблюдается. Реакцию применяют для серодиагностики сифилиса (реакция Вассермана), вирусных и бактериальных инфекций.
Реакция радиального гемолиза эритроцитов может протекать в геле. Взвесь эритроцитов барана помещают в агарозный гель с комплементом; в застывшем на стекле слое делают лунки и вносят в них гемолитическую сыворотку. Вокруг лунок в результате радиальной диффузии антител образуется зона гемолиза, радиус которой прямо пропорционален титру сыворотки. Если сорбировать на эритроцитах какой-либо антиген, например гликопротеиновый гемагглютинин вируса гриппа, краснухи или клещевого энцефалита, то можно воспроизвести феномен гемолиза иммунными сыворотками к этим вирусам. Реакцию радиального гемолиза в геле применяют в диагностике вирусных инфекций. Она характеризуется простотой постановки, нечувствительностью к сывороточным ингибиторам, позволяет титровать сыворотки крови по диаметру зоны гемолиза, не прибегая к серийным разведениям.
Иммунное прилипание. Эритроциты, тромбоциты и другие клетки крови имеют на поверхности рецепторы к третьему компоненту комплемента (СЗ). Если к антигену (бактериям, вирусам и др.) добавить соответствующую иммунную сыворотку и комплемент, то образуется комплекс антиген-антитело, покрытый СЗ-компонентом комплемента. Эту реакцию применяют при изучении ряда вирусных инфекций (клещевого энцефалита, денге), которые сопровождаются иммунопатологическими процессами и циркуляцией в крови вирусных антигенов в комплексе с антителами.
4.Реакция нейтрализации.
Основана на способности антител нейтрализовать некоторые специфические функции макромолекулярных или растворимых антигенов, например активность ферментов, токсины бактерий, болезнетворность вирусов. В бактериологии эту реакцию используют для обнаружения антистрептолизинов, антистрептокиназы и антистафилолизинов. Реакцию нейтрализации токсинов можно оценивать по биологическому эффекту, так, например, титруют антистолбнячные и антиботулинические сыворотки. Смесь токсина с антисывороткой, введенная животным, не вызывает их гибели. Различные варианты реакции нейтрализации применяют в вирусологии. При смешивании вирусов с соответствующей антисывороткой и введении этой смеси животным или в клеточные культуры, патогенность вирусов нейтрализуется и при этом животные не заболевают, а клетки культур не подвергаются деструкции.
5.Реакции с использованием химических и физических меток (ИФА).
Иммунофлюоресценция заключается в использовании меченых флюорохромом антител, точнее, иммуноглобулиновой фракции антител lgG. Меченое флюорохромом антитело образует с антигеном комплекс антиген-антитело, который становится доступным наблюдению под микроскопом в УФ-лучах, возбуждающих свечение флюорохрома. Реакцию прямой иммунофлюоресценции используют для изучения клеточных антигенов, выявления вируса в зараженных клетках и обнаружения бактерий и риккетсий в мазках. Так, для диагностики бешенства, отпечатки кусочков мозга животных, подозреваемых на вирусоносительство, обрабатывают люминесцирующей антирабической сывороткой. При положительном результате, в цитоплазме нервных клеток выявляются глыбки ярко-зеленого цвета. На обнаружении антигенов вирусов в клетках отпечатков со слизистой оболочки носа основана экспресс-диагностика гриппа, парагриппа и аденовирусной инфекции.
Более широко применяют метод непрямой иммунофлюоресценции, основанный на выявлении комплекса антиген-антитело с помощью люминесцирующей иммунной сыворотки против lgG-антител и используемой для обнаружения не только антигенов, но и титрования антител. Метод нашел применение в серодиагностике герпеса, цитомегалии, лихорадки Ласса. Препараты с наслоенной исследуемой сывороткой крови помещают в термостат при t 37° для образования иммунных комплексов, а затем, после отмывания несвязавшихся реагентов, выявляют эти комплексы меченой люминесцирующей сывороткой против глобулинов человека. Применяя меченые иммунные сыворотки против lgM- или lgG-антител, можно дифференцировать тип антител и обнаруживать ранний иммунный ответ по наличию lgM-антител.
Иммунофлюоресценцию широко используют не только в бактериологии, вирусологии, паразитологии, но и в иммунопатологии для обнаружения антител к тканевым антигенам человека.
Иммуноферментные или энзим-иммунологические методы основаны на использовании антител, конъюгированных с ферментами, главным образом пероксидазой хрена или щелочной фосфатазой. Чтобы обнаружить соединение меченых антител с антигеном, добавляют субстрат, разлагаемый присоединенным к lgG ферментом, с окрашиванием в желто-коричневый (пероксидаза) или желто-зеленый (фосфатаза) цвет. Используют также ферменты, разлагающие не только хромогенный, но и люмогенный субстрат. В этом случае при положительной реакции появляется свечение. Подобно иммунофлюоресценции, иммуноферментный метод применяют для обнаружения антигенов в клетках или титрования антител на антигенсодержащих клетках.
Наиболее популярной разновидностью иммуноферментного метода является иммуносорбция. На твердом носителе, которым могут быть целлюлоза, полиакриламид, декстран и различные пластмассы, сорбируют антиген. Чаще носителем служит поверхность лунок микропанелей. В лунки с сорбированным антигеном вносят исследуемую сыворотку крови, затем меченую ферментом антисыворотку и субстрат. Положительные результаты учитывают по изменению цвета жидкой среды. Для обнаружения антигенов, на носитель сорбируют антитела, затем вносят в лунки исследуемый материал и проявляют реакцию меченой ферментом антимикробной сывороткой. Повышению чувствительности иммунофлюоресцентного и иммуноферментного методов способствует введение в систему реакции авидина и биотина.
Радиоиммунологический метод основан на применении радиоизотопной метки антигенов или антител. Является наиболее чувствительным методом определения антигенов и антител, используется для определения гормонов, лекарственных веществ и антибиотиков, для диагностики бактериальных, вирусных, риккетсиозных, протозойных заболеваний, исследования белков крови, тканевых антигенов. Первоначально он был разработан как специфический метод измерения уровня циркулирующих в крови гормонов. Тест-системой являлись меченый радионуклидом гормон (антиген) и антисыворотка к нему. Если к такой антисыворотке добавить материал, содержащий искомый гормон, то он свяжет часть антител, при последующем внесении меченого титрованного гормона с антителами свяжется уменьшенное по сравнению с контролем его количество. Результат оценивают по сопоставлению кривых связанной и несвязанной радиоактивной метки. Эта разновидность метода носит название конкурентной реакции. Существуют и другие модификации радиоиммунологического метода.
Иммуногистологические методы предназначены для определения антигенов на поверхности или внутри клетки, например для обнаружения маркеров лимфоцитов и иммунокомплексов при гломерулонефритах и других заболеваниях почек. В этой реакции для выявления антигенов пользуются или иммунофлюоресценцией, или иммуноферментными конъюгатами с пероксидазой. Количество специфических антигенов определяют по интенсивности окрашивания. Иногда используют автоматическую регистрацию с помощью спектрофотометра.
Серологические реакции
Антигены и антитела. Серологические реакции между антигенами и антителами.
Антигены - генетически чужеродные вещества, которые при введении в организм животного или человека вызывают специфический иммунный ответ — синтез антител, формирование сенсибилизированных Т-лимфоцитов, иммунологической памяти или толерантности. Под чужеродными веществами понимаются химические структуры, которых нет в организме. Инородными для организма человека являются вирусы, микроорганизмы, а также клетки, ткани, органы животных и других людей. Антигены имеют несколько рецепторов для связи с антителами и способны вступать в реакцию с ними как в организме животного или человека (in vivo), так и вне организма - в пробирке (in vitro).
Антитела - высокомолекулярные белки глобулиновой фракции сыворотки крови. Антитела синтезируются под влиянием антигена и способны специфично реагировать (соединяться) с соответствующим антигеном. Все антитела имеют характерную структуру иммуноглобулинов; отличаются по иммунологическим, биологическим и физическим свойствам; и делятся на 5 классов - ІgG , ІgА, ІgМ, ІgD и ІgЕ.
В лабораторной практике используют серологические реакции — лабораторные реакции между антигенами и антителами, которые приводят к регистрируемым изменениям в исследуемой системе. Эти реакции получили название серологических, так как для их постановки используют сыворотку (serum), содержащую антитела.
Серологические исследования, выполняемые для обнаружения специфических антител и антигена возбудителя при инфекционных заболеваниях, — более доступные методы лабораторной диагностики, чем бактериологическое выявление возбудителя. В ряде случаев серологические исследования остаются единственным методом диагностики инфекционных заболеваний.
Некоторые методы определения антител, используемые в лабораторной практике
В основе всех серологических реакций лежит взаимодействие антигена и антитела с образованием иммунных комплексов, которые можно обнаружить в тестах in vitro (т.е. «в пробирке» — вне живого организма). Реакции антиген-антитело в системе in vitro могут сопровождаться возникновением нескольких феноменов - агглютинации, преципитации, лизиса и других. Внешние проявления реакции зависят от физико-химических свойств антигена (размеры частиц, физическое состояние), класса и вида антител, а также условий опыта (консистенция среды, концентрация солей, рН, температура).
1. Реакция связывания комплемента
Комплемент - это система белков плазмы крови, которая включает в себя 9 компонентов указанных буквой С (С1, С2, С3. С9), фактор В, фактор D и ряд регуляторных белков. Некоторые из этих компонентов состоят из 2 - 3 белков, например С1 - это комплекс из трех белков. Эти белки циркулируют в кровеносном русле и присутствуют на мембранах клеток. Комплемент является важнейшей системой как врождённого, так и приобретённого иммунитета. Эта система предназначена для защиты организма от действия чужеродных агентов и участвует в реализации иммунного ответа организма. Комплемент был открыт в конце 19-го столетия бельгийским ученым Ж. Борде.
Реакция связывания комплемента (РСК) - серологическая реакция, используемая для количественного определения комплементсвязывающих антител и антигенов. Впервые описана Борде и Жангу (Bordet - Gengou) в 1901 году. РСК основана на том, что комплекс "антиген - антитело" способен поглощать комплемент, который добавляют в реакционную смесь. При соответствии друг другу антигенов и антител они образуют иммунный комплекс, к которому присоединяется комплемент. Специфический иммунный комплекс адсорбирует комплемент, добавленный в систему, т.е. происходит связывание комплемента комплексом антиген - антитело. Чем больше антител, тем больше фиксируется комплемента. Если же комплекс "антиген - антитело" не образуется, то комплемент остается свободным.
Сложность РСК состоит в том, что реакция образования комплекса "антиген - антитело - комплемент" невидимая. Для выявления компонентов реакции используют дополнительную индикаторную гемолитическую систему. С помощью реакции гемолиза проводится количественное определение остатка комплемента после окончания реакции антигена с антисывороткой.
Реакцию связывания комплемента (РСК) используют для выявления антител на определенный антиген или определяют тип антигена по известному антителу. В этой сложной серологической реакции участвуют две системы и комплемент. Первая система - бактериологическая (основная), состоит из антигена и антитела. Вторая система - гемолитическая (индикаторная). В нее входят эритроциты барана (антиген) и соответствующая им гемолитическая сыворотка (антитело).
РСК ставят в два приема: вначале соединяют антиген с испытуемой сывороткой крови, в которой отыскивают антитела, а затем добавляют комплемент. Если антиген и антитело соответствуют друг другу, то образуется иммунный комплекс, который связывает комплемент. При отсутствии в сыворотке антител иммунный комплекс не образуется и комплемент остается свободным. Поскольку процесс адсорбции комплемента комплексом визуально невидимый, то для выявления этого процесса добавляют гемсистему.
В связи с высокой чувствительностью реакция связывания комплемента (РСК) применяется как для серологической диагностики бактериальных и вирусных инфекций, аллергических состояний, так и для идентификации антигенов (выделенной бактериальной культуры).
2. Реакция преципитации
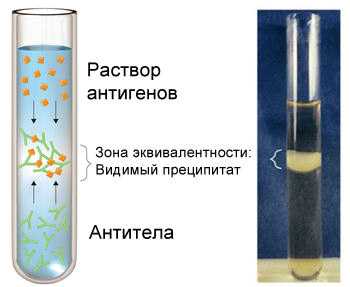
Реакция преципитации (РП) (от лат. praecipitatio - выпадение осадка, падение вниз) основана на выпадении в осадок специфического иммунного комплекса, состоящего из растворимого антигена и специфического антитела в присутствии электролита. В результате реакции образуется мутное кольцо или рыхлый осадок - преципитат. Реакция преципитации происходит между водорастворимым антигеном и антителом, получаются крупные комплексы, которые выпадают в осадок
3. Реакция флоккуляции
Реакция флоккуляции (по Рамону) (от лат floccus - хлопья шерсти, flocculi - клочья, хлопья; flocculation - образование рыхлых хлопьевидных агрегатов (флокул) из мелких частиц дисперсной фазы) - появление опалесценции или хлопьевидной массы (иммунопреципитации) в пробирке при реакции токсин - антитоксин или анатоксин - антитоксин. Ее применяют для определения активности антитоксической сыворотки или анатоксина.
Реакция флокуляции основана на выявлении «инициальной» флокуляции - помутнения при образовании комплекса экзотоксин (анатоксин) + антитоксин в оптимальных количественных соотношениях ингредиентов.
4. Реакция агглютинации
Агглютинация (от лат. agglutinatio — склеивание) - это реакция взаимодействия антигена со специфическим антителом, которая проявляется в виде склеивания. При этом антигены в виде частиц-корпускул (микробные клетки, эритроциты и др.) склеиваются антителами и выпадают в осадок (агглютинат) в виде хлопьев. Агглютинаты обычно видны невооруженным глазом. Для появления реакции необходимо присутствие электролитов (например, изотонического раствора хлорида натрия), ускоряющих процесс агглютинации.
С помощью реакции агглютинации (РА), reactio agglutinationis (англ. agglutination test) выявляют антитела или корпускулярные антигены. В зависимости от вида используемого иммунодиагностикума различают реакцию микробной агглютинации, гемагглютинации, латексагглютинации, коаглютинации и т.д.
5. Название антител, участвующих в осадочных реакциях
Антитела, участвующие в осадочные реакциях, получили традиционное название по своему взаимодействию с антигеном:
агглютинины - вызывают склеивание корпускулярного антигена - агглютиногена и осаждение комплекса антиген - антитела (агглютината);
В лизирующих реакциях участвуют бактериолизины (вызывают лизис бактерий) и гемолизины (вызывают лизис эритроцитов).
ПРЕЦИПИТАЦИЯ
ПРЕЦИПИТАЦИЯ (лат. praecipitatio стремительное падение) — иммунологическая реакция осаждения из раствора комплекса антиген—антитело, образующегося в результате соединения растворимого антигена (преципитиногена) со специфическими антителами (преципитинами).
Реакцию Преципитации широко используют для идентификации и количественного определения самых разнообразных антигенов и антител (см. Иммунодиагностика), при серодиагностике инфекционных болезней (см. Серологические исследования), для обнаружения примесей в пищевых продуктах, при изучении эволюционных взаимосвязей в животном и растительном мире, при исследовании структуры различных биол, соединений, в судебной медицине для определения видовой принадлежности пятен крови и других биол, жидкостей.
Преципитация открыта в 1897 т. Краусом (R. Kraus), наблюдавшим выпадение осадка (преципитата) при смешивании бесклеточных прозрачных фильтратов бульонных культур бактерий чумы, холеры, тифа с гомологичными иммунными сыворотками. В 1899 г. Ф. Я. Чистович, иммунизируя кроликов сывороткой угря, получил преципитирующие антитела и тем самым впервые продемонстрировал видовую специфичность белков сыворотки крови. Применение П. в суд.-мед. экспертизе для определения видовой принадлежности крови было предложено в 1901 г. П. Уленгутом. Реакция получила название реакции Чистовича — Уленгута. Впоследствии было показано, что преципитирующие антитела (см.) образуются у представителей различных видов позвоночных к любым чужеродным высокомолекулярным веществам (см. Антигены). Преципитирующие антитела принадлежат к иммуноглобулинам классов G и M (см. Иммуноглобулины). Скорость и интенсивность биосинтеза преципитирующих антител определяются рядом факторов: дозой и путем введения антигена, схемой иммунизации, особенностями хим. структуры антигена и генетическими особенностями иммунизируемого организма.
Для получения преципитирующих сывороток используют различные схемы иммунизации. Хорошие результаты дают схемы из нескольких циклов иммунизации, каждый из которых включает несколько внутривенных или внутримышечных инъекций антигена в возрастающих количествах. В 1915 г. М. И. Райский предложил схему, состоящую из первичной иммунизации и отдаленной реиммунизации. На этом принципе основано получение преципитирующих сывороток высокого титра. Первичную иммунизацию принято проводить антигеном в смеси с каким-либо депонирующим веществом (ланолином, минеральным маслом, алюмокалиевыми квасцами и др.), усиливающим иммунный ответ, а отдаленную реиммунизацию — только антигеном. Широко применяют в качестве депонирующего вещества адъювант (усилитель) Фрейнда, состоящий из смеси минеральных масел и убитых микобактерий туберкулеза (см. Адъюванты).
Раствор антигена, эмульгированный в равном объеме адъюванта Фрейнда, вводят экспериментальным животным подкожно или внутримышечно в несколько точек спины либо в подушечки задних лапок или в подколенные лимфатические узлы задних конечностей. В некоторых схемах используют комбинации перечисленных способов введения. Через месяц животным вводят р-р антигена внутривенно или внутримышечно. При необходимости перед реиммунизацией проводят гипосенсибилизацию по Безредке (см. Безредки методы). При незначительном расходе антигена (1—3 мг для белковых антигенов на курс иммунизации) количество образующихся антител достигает нескольких миллиграммов в 1 мл иммунной сыворотки.
Для реакции преципитации характерна высокая специфичность. В серии работ К. Ландштейнера с антисыворотками к конъюгированным антигенам, в качестве детерминантных групп которых выступали различные органические радикалы, было продемонстрировано, что в реакции П. можно дифференцировать стереоизомеры органических соединений. Сила наблюдающихся перекрестных реакций определяется близостью хим. структуры детерминантных групп иммуноантигенов и тест-антигенов. В состав преципитата входят антигены и специфичные к ним антитела и практически не включаются другие белки сыворотки крови, кроме комплемента.
П.— высокочувствительная реакция. С ее помощью могут быть обнаружены десятые доли микрограмма антигена. При определении антител порог чувствительности реакции составляет ок. 20 мкг белка. Чувствительность реакции значительно повышается, если применяют антигены или антитела, меченные радиоактивными изотопами (см.).
Постановка реакции
При постановке реакции преципитации необходимо учитывать ее зональный характер, который выражается в том, что молекулярный состав и количество образующегося преципитата определяются соотношением введенных в реакцию антигена и антител (см. Антиген — антитело реакция). При использовании постоянного количества антисыворотки и возрастающих количеств антигена количество преципитата в ряду пробирок вначале увеличивается, достигает максимума, а затем уменьшается вплоть до полного исчезновения. В надосадочной жидкости первых пробирок обнаруживают свободные антитела (зона избытка антител), в жидкости над максимальным преципитатом не содержатся ни свободные антитела, ни свободный антиген (зона эквивалентности), в надосадочной жидкости последних пробирок находят растворимые иммунные комплексы и свободный антиген (зона избытка антигена). Образование растворимых иммунных комплексов с небольшим молекулярным весом в зоне избытка антигена характерно для всех преципитирующих систем, антитела в которых принадлежат к IgG. Эта зона реакции названа поэтому зоной задержки, или постзоной. Следует отметить, что иммунные комплексы антигенов с IgM-антителами нерастворимы в очень большом избытке антигена, в десятки раз превышающем его количество, достаточное для образования растворимых иммунных комплексов с IgG-антителами.
Для лошадиных противобелковых сывороток характерно образование растворимых иммунных комплексов и в зоне избытка антител, т. е. образование прозоны (см. Нейссера-Вексберга феномен). Эту особенность реакции впервые обнаружил Г. Рамон в системе дифтерийный токсин — антитоксическая лошадиная сыворотка (см. Флоккуляция). Растворение иммунных комплексов в зоне избытка антител наблюдали впоследствии при проведении П. с кроличьими и собачьими сыворотками крови против бычьего сывороточного альбумина, с человеческой сывороткой крови против тиреоглобулина, овечьей антисывороткой против синтетических полипептидов.
Молекулярный состав преципитата определяется также мол. весом (массой) антигена. Для яичного альбумина, мол. вес к-рого 42 000 дальтон, в зоне эквивалентности на одну молекулу антигена приходится в среднем 2,5 молекулы антител. С увеличением мол. веса антигена число молекул антител, связываемых одной молекулой антигена, увеличивается.
П. используют для качественного и количественного определения антигенов и антител. Быстрый, простой и чувствительный качественный метод П.— кольцепреципитация, предложенная в 1902 г. Асколи . Кольцепреципитацию применяют для идентификации растворимых антигенов микроорганизмов. Реакцию выполняют в узких пробирках или капиллярах, осторожно наслаивая р-р антигена на иммунную сыворотку. При положительной реакции на границе двух жидкостей появляется кольцо преципитации. На результат реакции не влияет избыток антигена благодаря постепенной диффузии реагентов к границе жидкостей. Если в качестве антигенов используют прокипяченные и профильтрованные водные экстракты органов или тканей, то реакция носит название «термопреципитация» (см. Асколи реакция). С помощью термопреципитации обнаруживают термостабильные бактериальные антигены (коктоантигены) в тканях и органах погибших животных при диагностике чумы, холеры, сибирской язвы. Кольцепреципитацию и термопреципитацию выполняют с антисыворотками высокого титра.
К полуколичественным методам П. могут быть отнесены методы оценки силы сывороток и количества антигенов по их предельному разведению, дающему еще видимую П. со стандартным антигеном или анти-сывороткой, и методы оптимальных пропорций.
При титровании сывороток по предельному разведению необходимо подбирать такое количество антигена, чтобы не попасть в зону задержки. Поэтому предварительно определяют наименьшее разведение тест-антигена, при к-ром происходит реакция с заведомо положительной сывороткой. Это рабочее разведение (дозу) антигена используют для определения предельного разведения (титра) испытуемых сывороток. Сравнительное титрование антигена методом предельных разведений можно проводить без предварительного подбора рабочей дозы сыворотки, если она содержит антитела преципитирующего, но не флоккулирующего типа.
Метод оптимальных пропорций основан на определении точки эквивалентности серол. системы по инициальной И. и на том наблюдении, что точка эквивалентности в каждой серол. системе возникает при определенном отношении антитела к антигену. Поэтому при титровании сывороток, определив по быстроте П. количество стандартного антигена, соответствующее точке эквивалентности, можно выразить ее активность в любых условных биол. единицах, если в предварительном титровании с сывороткой известной силы установлено, скольким ее единицам эквивалентен стандартный антиген. Аналогичные расчеты проводят при титровании антигена со стандартной сывороткой. Метод оптимальных пропорций может быть выполнен в a-варианте, предложенном Дином и Уэббом (H. Dean, R. Webb, 1928),— с постоянным объемом сыворотки и возрастающими разведениями антигена и в ß-варианте, предложенном Г. Рамоном (1922),— с постоянным объемом антигена и возрастающими разведениями сыворотки.
Количественный метод определения антител в весовых единицах, предложенный в 1933 г. Гейдельбергером (М. Heidelberger) и Кендаллом (F. Е. Kendall), основан на том, что в зоне эквивалентности из раствора в осадок выпадают практически весь антиген и все антитела. Определив любым хим. методом количество белка преципитата в этой точке и вычтя из него количество прибавленного в пробу антигена, рассчитывают количество белка в осадке, приходящееся на долю антител.
При постановке П. любым из описанных методов следует работать с хорошо отцентрифугированными р-рами антигенов и сывороток. Реакция должна сопровождаться контролем: иммунная сыворотка + изотонический р-р хлорида натрия, нормальная сыворотка + антиген, гетерологическая сыворотка + антиген. Следует предотвращать возможность бактериального загрязнения, выполняя П. в стерильных условиях или применяя консерванты типа мертиолата, амида натрия. Реакцию выполняют при физиол. концентрации соли (0,15 М раствор хлорида натрия), в диапазоне pH 6,5—8,0.
Определение индивидуальных антигенов, находящихся в смеси с другими веществами, возможно в реакции П. только при использовании моноспецифических сывороток. Специфические антитела в сыворотках могут быть идентифицированы, если П. выполняют с индивидуальными антигенами. Для анализа, характеристики и сравнения многокомпонентных систем антиген — антитело без их предварительного фракционирования используют методы, основанные на проведении П. в геле, в частности метод двойной иммунодиффузии по Оухтерлоню (см. Иммунодиффузия) .
П.— двухфазная реакция. Фазы реакции отличаются по механизму и скорости протекания (см. Антиген-антитело реакция). Следует учитывать, что на вторую фазу реакции — собственно образование преципитата — оказывает влияние ряд неспецифических факторов: концентрация в растворе солей и водородных ионов, температура, объем реагентов. При увеличении концентрации солей выше физиол, значения (0,15 М) количество образующегося преципитата уменьшается. В 15% р-ре хлорида натрия преципитаты, образованные полисахаридными антигенами, диссоциируют. Изменение концентрации водородных ионов в физиол. пределах pH (от 6,5 до 8,0) заметно не влияет на формирование преципитата. При снижении pH раствора до 5,0 или повышении до 9,0 существенно уменьшается количество образующегося преципитата, а при pH ниже 3,0 и выше 11,0 ранее образованные преципитаты диссоциируют. На свойстве преципитатов диссоциировать в крепких солевых р-рах и при крайних значениях pH основаны методы выделения чистых антител и антигенов из специфических преципитатов. Наиболее употребляемые диссоциирующие агенты — концентрированные р-ры нейтральных солей, разбавленные к-ты и щелочи, концентрированные р-ры амидов, полианионы.
Преципитация в судебно-медицинском отношении
В судебной медицине П. применяют для дифференцирования крови человека и животных (см. Кровь). Наибольшее распространение получила кольцепреципитация, но она не пригодна для исследования мутных р-ров антигена и подвержена неспецифическим влияниям загрязнений объекта экспертизы. Этих недостатков лишена П. в агаровом геле, однако она требует длительных сроков наблюдения и менее чувствительна. Внедряют в практику электропреципитацию, или встречный иммуноэлектрофорез (см.), сочетающий достоинства П. в агаре с высокой чувствительностью и быстротой проведения реакции. Все варианты П. осуществляют с иммунными сыворотками (см.), преципитирующими белки человека, собаки, лошади и др. Они должны быть активны и специфичны, т. е. вызывать П. гомологичного антигена (напр., соответствующей нормальной сыворотки крови человека пли животного) и не образовывать преципитата с гетерологичными (чужеродными) антигенами.
Из исследуемых пятен крови готовят вытяжки и разводят их до необходимой концентрации белка. Для П. в агаре можно брать вырезки (вытяжки) из пятен и проводить реакцию с несколькими преципитирующими сыворотками. Параллельно испытывают контрольные участки предмета — носителя пятен, которые не должны вызывать П. При положительном результате с пятном крови и преципитирующей сывороткой делают вывод о видовой принадлежности крови, напр. кровь человека, собаки и др. При этом нельзя точно установить происхождение крови, если она принадлежит близкородственным животным (напр., кровь собаки или волка). Отрицательный результат при наличии в вытяжке белка свидетельствует о принадлежности крови животному, белок к-рого не выявляется с помощью обычного набора преципитирующих сывороток. Если в вытяжке не установлен белок, то принимают во внимание лишь положительный результат, т. к. отсутствие преципитата можно объяснить недостаточным количеством белка в вытяжке.
Библиография: Бойд У. Основы иммунологии, пер. с англ., с. 314, М., 1969; Кэбот Е. и Мейер М. Экспериментальная иммунохимия, пер. с англ., с. 8 и др., М., 1968; Райский М. Быстрое получение крепких преципитинов, Харьковск. мед. журн.,т. 20, № 8, с. 135, 1915; он же, Повторная иммунизация, как метод получения преципитирующих сывороток, там же, с. 142; он же, Как долго сохраняются в крови иммунизированного животного крепкие преципитины, там же, № 9, с. 161; он же, Как нужно иммунизировать, чтобы животное устойчиво и длительно сохраняло в крови крепкие преципитины, там же, с. 169; Туманов А. К. Основы судебно-медицинской экспертизы вещественных доказательств с. 57,М., 1975; Чарный В. И. Установление видовой специфичности белков крови, М., 1976; Чистович Ф. Я. Изменения свойств крови при впрыскивании инородной сыворотки и крови, в связи с теорией иммунитета Ehrlich’a, Рус. арх. патол., клин, мед. и бакт., т. 8, в. 1, с. 21, 1899; Carpenter Ph. L. Immunology and serology, Philadelphia, 1975; Methods in immunology and immunochemistry, ed. by C. A. Williams a. M. W. Chase, v. 3, N. Y.— L., 1971.
Преципитат иммунных комплексов. Взаимодействие доменов в цепях антител
- электростатические; они включают ионные (между заряженными группами аминокислотных остатков, например, карбоксильными и аминогруппами) и полярные (связанные с формированием диполей) взаимодействия;
- водородные (связаны с формированием водородных мостиков между гидрофильными группами);
- гидрофобные (обусловлены энергетическими преимуществами контакта гидрофобных участков молекул между собой);
- силы Ван-дер-Ваальса (основаны на взаимодействии электронных облаков).
- преципитации (осаждения) иммунных комплексов;
- агглютинации (склеивания) частиц, несущих антиген (эритроцитов, частиц латекса и т.д.);
- связывания и активации комплемента с последующим лизисом эритроцитов, несущих антиген и т.д.
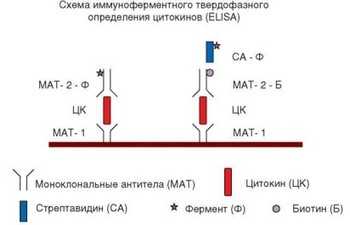
Рис. 3.26. Схема иммуноферментного твердофазного определения антигена (ELISA) на примере цитокина. Коричневая полоса — пластиковая поверхность, на которую последовательно наслаивают указанные реагенты
Научная электронная библиотека

Антитела (иммуноглобулины, ИГ, Ig) - это особый класс гликопротеинов (т.е. белков с присоединенных к ним углеводными остатками), присутствующих в сыворотке крови, тканевой жидкости или на клеточной мембране, которые распознают и связывают антигены. Иммуноглобулины синтезируются В-лимфоцитами (плазматическими клетками) в ответ на вещества определенной структуры - антигены. Антитела используются иммунной системой для идентификации и нейтрализации чужеродных и нежелательных эндогенных объектов - например, бактерий и вирусов, опухолевых клеток и др. Они являются важнейшим фактором специфического гуморального иммунитета. Антитела выполняют две функции: антиген-связывающую и эффекторную (вызывают тот или иной иммунный ответ, например, запускают классическую схему активации комплемента).
Антитела синтезируются плазматическими клетками, которыми становятся В-лимфоциты в ответ на присутствие антигенов. Для каждого антигена формируются соответствующие ему специализировавшиеся плазматические клетки, вырабатывающие специфичные для этого антигена антитела. Антитела распознают антигены, связываясь с определённым эпитопом - характерным фрагментом антигена.
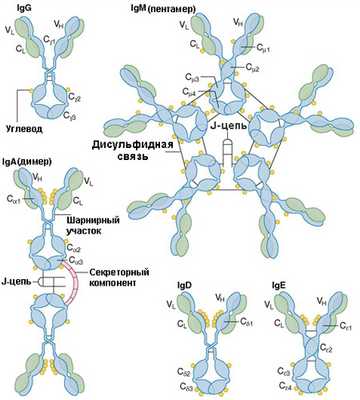
Антитела являются относительно крупными (~150 кДа для IgG) гликопротеинами, имеющими сложное строение. Антитела состоят из двух идентичных тяжелых цепей и из двух идентичных лёгких цепей, т.е.
фрагментов с меньшим и большим молекулярным весом (рис. 3). К тяжелым цепям ковалентно присоединены олигосахариды. При помощи протеазы папаина антитела можно расщепить на два Fab (англ. fragment antigen binding - антиген-связывающий фрагмент) и один Fc (англ. fragment crystallizable - фрагмент, способный к кристаллизации). Fab фрагменты называются также вариабельной областью антител, т.к. именно их строение определяет связывающую функцию Ат и варьируется в зависимости от структуры антигена. Fc фрагмент называется константной областью Ат, т.к. у особей данного вида для всех молекул Ат этот фрагмент является идентичным.
Рис. 5. Структура антител
В зависимости от выполняемых функций антитела могут существовать как в различных формах (классы иммуноглобулинов): мономерной (IgG, IgD, IgE, сывороточный IgA) или в олигомерной форме (димер-секреторный IgA, пентамер - IgM). Схематичное строение
Иммуноглобулины класса G (IgG) - основной иммуноглобулин сыворотки здорового человека, составляет 70-75 % всей фракции иммуноглобулинов. IgG наиболее активны во вторичном иммунном ответе и антитоксическом иммунитете. Являются единственной фракцией иммуноглобулинов, способной к транспорту через плацентарный барьер и тем самым обеспечивают иммунитет плода и новорожденного. IgG являются самыми небольшими молекулами по сравнению с другими классами Ig (молекулярная масса М = 146 кДа).
Иммуноглобулины класса А (IgA) содержатся в сыворотке (15-20 %
всей фракции Ig), в секреторном компоненте: слюне, слезах, молозиве, молоке, отделяемом слизистой оболочки мочеполовой
и респираторной системы. IgA представлены в виде мономеров (80 % в сыворотке), димеров (в секрете), и тримеров. Средняя молекулярная масса IgA М = 500 кДа.
Иммуноглобулины класса М (IgM) являются пентамерами IgG и составляют до 10 % фракции иммуноглобулинов. Появляются IgM при первичном иммунном ответе B-лимфоцитами на неизвестный антиген. IgM встроены в плазматическую мембрану B-лимфоцитов и выполняют роль антиген распознающего рецептора. Средняя молекулярная масса IgМ М = 970 кДа.
Иммуноглобулины класса Е (IgE) - мономеры. Их функция заключается в связывании с поверхностью базофилов и тучных клеток, с последующим присоединением к ним антигена, при этом происходит дегрануляцию и выброс в кровь гистамина и серотонина - медиаторов воспаления. IgE участвуют в защите от паразитарных инфекций, обуславливают многие аллергические реакции. М = 200 кДа.
Рис. 6. Классы иммуноглобулинов
Антитела также классифицируют по типу антигена и, соответственно, по выполняемым Ат функциям. По этому принципу можно выжделить несколько основных классов антител:
● Антиинфекционные или антипаразитарные антитела, вызывающие гибель или нарушение жизнедеятельности возбудителя инфекции либо паразита.
● Антитоксические антитела, не вызывающие гибели самого возбудителя или паразита, но обезвреживающие вырабатываемые им токсины, либо другие экзогенные токсические вещества.
● «Антитела-свидетели заболевания», наличие которых в организме сигнализирует о знакомстве иммунной системы с данным антигеном (возбудителем) в прошлом или о текущем присутствии этого антигена (возбудителя), но которые не играют существенной роли в борьбе организма с возбудителем (не обезвреживают ни самого возбудителя, ни его токсины, а связываются со второстепенными белками возбудителя).
● Естественные антитела - антитела к эндогенным соединениям, присутствующие в здоровом организме и выполняющие регулятор-
ные функции;
● Аутоагрессивные антитела, или аутологичные антитела, аутоантитела - антитела, способные образовываться из естественных антител и вызывающие разрушение или повреждение нормальных, здоровых тканей самого организма хозяина и запускающие механизм развития аутоиммунных заболеваний.
● Аллореактивные антитела, или гомологичные антитела, аллоантитела - антитела против антигенов тканей или клеток других организмов того же биологического вида. Аллоантитела играют важную роль в процессах отторжения аллотрансплантантов, например, при пересадке почки, печени, костного мозга, и в реакциях на переливание несовместимой крови.
● Гетерологичные антитела, или изоантитела - антитела против антигенов тканей или клеток организмов других биологических видов. Изоантитела являются причиной невозможности осуществления ксенотрансплантации даже между эволюционно близкими видами (например, невозможна пересадка печени шимпанзе человеку) или видами, имеющими близкие иммунологические и антигенные характеристики (невозможна пересадка органов свиньи человеку). К изоантителам относятся также вторичные (антивидовые) антитела, используемые в различных видах ИХМ.
● Антиидиотипические антитела - антитела против антител, вырабатываемых самим же организмом. Этот вид антител специфичен
к вариабельному участку антител, так называемому идиотипу. Антиидиотипические антитела играют важную роль в связывании и обезвреживании избытка антител, в иммунной регуляции выработки антител. Кроме того, антиидиотипическое «антитело против антитела» зеркально повторяет пространственную конфигурацию исходного антигена, против которого было выработано исходное антитело (рис. 5). И тем самым антиидиотипическое антитело служит для организма фактором иммунологической памяти, аналогом исходного антигена, который остаётся в организме и после уничтожения исходных антигенов. В свою очередь, против антиидиотипических антител могут вырабатываться анти-антиидиотипические антитела и т.д.
Читайте также:
