Причины развития устойчивости к противоопухолевым препаратам. Гипотеза Голди—Гольдмана
Добавил пользователь Skiper Обновлено: 28.01.2026
Всемирная организация здравоохранения выделяет среди наиболее опасных болезней 21-го века диабет и раковые заболевания. По статистике, на сегодняшний день рак - причина каждой шестой смерти в мире, и число случаев заболевания будет продолжать расти (от 14 до 22 миллионов в год). Поэтому исследование в данном проекте посвящено анализу связи этих болезней (диабет и раковые заболевания) и определению перспективных направлений по их профилактике.
Отдельный интерес представляют биологические механизмы опухолевых клеток, которые обуславливают формирование устойчивости к противоопухолевым препаратам. Данные препараты могут иметь достаточный эффект подавления роста и деления клеток рака в многоклеточном механизме, но при повышении концентрации способны нанести непосредственный урон здоровым клеткам.
В данной работе также рассматривается вопрос о том, каким образом можно вернуть чувствительность клеток рака к препаратам, к которым выработалась резистентность.
Цель
Исследование биологических механизмов, обуславливающих резистентность к противоопухолевым препаратам.
Задачи
- Освоить методику ведения клеточных культур.
- Научиться подготавливать питательные среды для культур in vitro.
- Освоить метод MTT-теста для оценки метаболической и пролиферативной активности клеток.
- Описать противоопухолевую активность препарата растительного происхождения на линии клеток MCF-7.
- Вывести резистентную сублинию опухолевых клеток MCF-7/M, путем длительного культивирования на фоне присутствия в питательной среде противоопухолевого препарата.
- Провести сравнительный анализ активности белков внутриклеточного сигналинга линий MCF-7 и MCF-7/M.
- Подобрать условия для восстановления (повышения) чувствительности резистентных клеток рака молочной железы к метформину.
Гипотеза
Агрессивная пролиферация раковых клеток позволяет им сформировать устойчивость к противоопухолевым препаратам, однако, т. к. устойчивость обусловлена перегруппировкой внутриклеточного белкового сигналинга, изменение условий воздействия препарата может восстановить чувствительность.
Описание
Работа над проектом проходила в несколько этапов:
- Освоение методик работы с клеточными культурами (культивация, питательные среды, измерение клеточного роста, анализ активности белков).
- Изучение результатов действия противоопухолевого препарата на линию клеток рака молочной железы для выявления концентрации, при которой клетки гибнут.
- Создание резистентной сублинии рака молочной железы к противоопухолевому препарату.
- Сравнительный анализ устойчивости новой полученной сублинии к противоопухолевому препарату и «родительской» линии клеток.
- Сравнительный анализ активности белков данных линий и их связь с устойчивостью к препарату.
- Восстановление чувствительности сублинии к противоопухолевому препарату за счет снижения уровня сахара в питательной среде.
Методы исследования
- Литературный анализ;
- Культивирование клеток (термостат, инкубатор);
- МТТ-тест (скорость клеточного роста и выживаемость клеток - применяется краситель).
- Электрофорез, вестернблоттинг, иммунопреципитация (лизирование клеток различных сублиний, получение белковых растворов, разгонка белков в геле, анализ активности белков) - спектрофотометр, камера для электрофореза, камера для вестернблоттинга.
Результаты работы/выводы
В результате работы подтвердилась гипотеза, что раковые клетки могут приобретать чувствительность даже к самым сильным противоопухолевым препаратам. Примечательно, что сам препарат метформин изначально использовался как противодиабетический, однако, как показала статистика, снизил количество раковых заболеваний среди людей, которые его применяли.
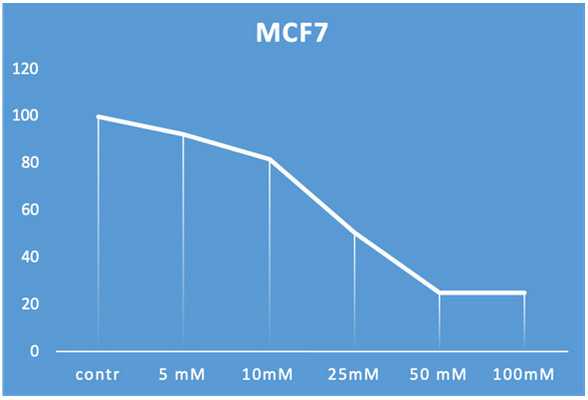
Зависимость выживаемости клеток MCF-7 при различной концентрации метформина в питательной среде.
Как раковые клетки становятся устойчивыми к противоопухолевым препаратам?
Прорывное исследование, результаты которого были недавно опубликованы в научном журнале Science, показало, что раковые клетки могут активировать альтернативные пути копирования ДНК, чтобы стать устойчивыми к противоопухолевым препаратам. Этот процесс называется стресс-индуцированным мутагенезом. Бактерии также его используют, чтобы выработать устойчивость к антибиотикам.
Каждый раз, когда делится клетка в организме человека, она должна очень точно скопировать около трех миллиардов «букв» генетического кода. Высокая точность нужна для того, чтобы дочерние клетки были жизнеспособны и нормально функционировали. Для раковых клеток это не так важно.
Ученые обнаружили, что при разных типах злокачественных опухолей, включая меланому, рак поджелудочной железы, саркомы и рак молочной железы, в ДНК раковых клеток во время деления при воздействии противоопухолевых препаратов происходит множество мутаций. Благодаря этим генетическим «ошибкам» и развивается устойчивость к химиопрепаратам.
Проблема резистентности рака
Даже если поначалу те или иные противоопухолевые препараты работали в конкретном клиническом случае очень хорошо, со временем они перестают быть эффективны. С этой проблемой ежегодно сталкиваются сотни тысяч онкологических больных. Зачастую еще остается возможность назначить «запасные» схемы терапии, но они тоже работают только в течение определенного времени. Рано или поздно, возникает ситуация, когда не помогает ни одна комбинация препаратов из актуальной версии протоколов лечения.
Ученым давно известно, что раковые клетки вырабатывают резистентность (устойчивость) к терапии в результате мутаций. Но пока непонятно, какие механизмы приводят к этим мутациям, и можно ли на них повлиять.
Команда ученых из Института медицинских исследований Гарвана (Garvan Institute of Medical Research, Австралия) во главе с профессором Дэвидом Томасом (David Thomas) проанализировала образцы опухолевой ткани, полученные от пациентов до и после курса таргетной терапии.
Исследователи были удивлены, когда увидели, что в опухолевых клетках после применения таргетных препаратов резко увеличился уровень повреждения ДНК, даже в случаях, когда ее не повреждал сам препарат. Было проведено секвенирование ДНК раковых клеток, чтобы оценить, как лечение привело к ускоренной эволюции генома опухолевой ткани.
Первый автор исследования, Аркади Сиппони (Arcadi Cipponi) отмечает:
Наши исследования показали, что в раковых клетках, подвергшихся воздействию таргетных препаратов, происходит стресс-индуцированный мутагенез. Они генерируют случайные генетические вариации с гораздо большей скоростью, чем раковые клетки, не подвергшиеся воздействию таргетных препаратов. Этот же механизм используют бактерии, когда оказываются в стрессовых условиях.
Рак использует двухступенчатую стратегию
Чтобы разобраться, почему в опухолевых клетках происходит стресс-индуцированный мутагенез, ученые начали поочередно «выключать» в них разные гены.
Когда был «отключен» ген, кодирующий белок MTOR, ученые обнаружили, что раковые клетки перестали расти, но парадоксальным образом ускорилась их эволюция в присутствии противоопухолевых препаратов.
Доктор Сиппони объясняет:
MTOR является сенсорным белком, он сигнализирует нормальным клеткам о том, что они оказались в стрессовых условиях, и им нужно прекратить расти. Мы обнаружили, что во время противоопухолевой терапии сигналы MTOR способствуют тому, что в раковых клетках меняется экспрессия (активность) генов, кодирующих белки, которые копируют и восстанавливают ДНК. Например, активируются ферменты, которые копируют ДНК и при этом часто совершают ошибки. Из-за этого в генах опухолевых клеток происходит большое количество изменений, благодаря чему и развивается резистентность к противоопухолевым препаратам.
Не менее интересен и тот факт, что такие реакции со стороны опухолевой ткани носят временный характер. Как только развивается устойчивость к препаратам, копирование ДНК снова становится точным, и генетические изменения перестают накапливаться в таком большом количестве.
Новые подходы к лечению онкологических заболеваний
Авторы исследования считают, что можно повысить эффективность лечения рака, если сочетать традиционную таргетную терапию с препаратами, влияющими на репарацию ДНК. Ученые проверили свое предположение на мышах с раком поджелудочной железы. Животным вводили два препарата:
- Палбоциклиб — блокирует ферменты циклинзависимые киназы, которые активируют размножение клеток.
- Рукапариб (Рубрака) — блокирует фермент PARP, который восстанавливает поврежденную ДНК.
В течение 30 дней терапии этой комбинацией рост злокачественной опухоли удалось затормозить на 60% эффективнее, чем при использовании только палбоциклиба.
Материалы конгрессов и конференций
Несмотря на достижения современной фармакологии, эффективность химиотерапии опухолей остается недостаточной. Это связано с важнейшей особенностью живых систем (в т.ч. опухолевых клеток) - способностью адаптироваться к изменениям внешней среды. Одно из проявлений такой пластичности - развитие в опухолевых клетках устойчивости к лекарственным препаратам. Множественная лекарственная устойчивость (МЛУ) злокачественных новообразований — сохранение клетками жизнеспособности в ответ на воздействие ряда лекарственных веществ — одна из основных причин прогрессирования болезни: опухоль нечувствительна к химиотерапии независимо от комбинации применяемых лекарств. Не будет преувеличением сказать, что МЛУ — наиболее подробно исследованный (и исследуемый) вид лекарственной устойчивости.
Основной механизм МЛУ - пониженное накопление препаратов в клетке, обусловленное активным выведением веществ в межклеточную среду [7]. Такой транспорт осуществляется белком плазматической мембраны Р гликопротеином (Pgp), кодируемым геном MDR1 (multidrug resistance 1) [6]. Этот механизм обеспечивает долговременное выживание клеток в присутствии веществ, различных по структуре и биологическому действию. Антрациклиновые антибиотики (адриамицин, даунорубицин), винкаалкалоиды (винкристин, винбластин), таксаны (таксол, таксотер), митоксантрон, ингибиторы топоизомераз (этопозид) — вот неполный перечень групп противоопухолевых препаратов, устойчивость к которым обусловлена Pgp-опосредованным транспортом. Увеличение количества иРНК MDR1 и Pgp часто служит фактором устойчивости многих типов опухолей к лечению [4, 9, 11, 15, 16, 20].
Рассмотрим два аспекта проблемы преодоления МЛУ: 1) срочное становление резистентности в ответ на действие противоопухолевых препаратов и 2) расширение роли Pgp за пределы транспортной функции и представление об этом белке как “универсальном” факторе выживания клетки. Анализ этих вопросов позволяет критически оценить подход к терапии новообразований, основанный на воздействии на конкретный механизм в опухолевой клетке.
МЛУ формируется в ответ на воздействие химиопрепаратов. Как клетка накапливает иРНК MDR1 и белок Pgp? Правомерно предположить, что устойчивые клетки несут несколько копий гена MDR1 (амплификация гена). Однако такой механизм не выявлен в опухолях человека. Следовательно, этот ген должен активироваться в ответ на внеклеточные сигналы. Действительно, однократного кратковременного (несколько часов) воздействия лекарств на культивируемые клетки достаточно, чтобы накопились иРНК MDR1 и функционирующий Pgp. Активация МЛУ подтверждена и в клинической ситуации, например, при интраоперационной перфузии адриамицином легких у больных с метастазами фибросаркомы [2]. МЛУ может развиваться в клетках различного тканевого происхождения в ответ на действие многих химиопрепаратов. В активации МЛУ участвуют многочисленные механизмы проведения внутриклеточных сигналов. Важно, что эти механизмы не уникальны для регуляции данного гена, а обеспечивают другие защитные реакции клетки на стресс.
Регуляция гена MDR1 (а значит и МЛУ) осуществляется на многих уровнях; возможны “обходы” сигналов, если тот или иной механизм не функционирует. Такая взаимозаменяемость механизмов надежно обеспечивает развитие МЛУ при действии лекарств.
Итак, МЛУ “с готовностью” развивается в клетках, переживших воздействие химиопрепаратов. Более того, активация гена MDR1 возрастает с увеличением концентрации токсина [5]. Поэтому применение высокодозных режимов лечения (оправданное потребностью повысить его эффективность) может вести к развитию МЛУ в выживших клетках. Снижение доз (с целью избежать развития МЛУ) заведомо неэффективно; концентрации же лекарств, требуемые для полной элиминации опухоли, могут оказаться выше допустимых для больного, что определяет предел эскалации доз.
МЛУ - компонент многофакторной защиты клетки. Казалось бы, один механизм устойчивости (даже обеспечивающий резистентность к нескольким веществам) не способен сильно ограничить возможности противоопухолевой терапии. Однако МЛУ оказывается не единственным фенотипом устойчивости, а Pgp — не только молекулярный транспортер. Исследования последних лет показывают, что Pgp может защищать клетку и помимо транспортной роли. Накапливаются свидетельства того, что Pgp может препятствовать гибели клетки, сопровождающейся активацией каспаз — протеолитических ферментов, вызывающих деградацию важнейших клеточных структур в ответ на действие токсинов [12]. Так Pgp выступает как один из механизмов анти-апоптоза.
Кроме того, Pgp - не единственный фактор защиты. Опухолевые клетки, пройдя отбор в организме на способность “ускользать” от контроля пролиферации и дифференцировки, накапливают механизмы, способствующие выживанию. Классические примеры - химерная тирозинкиназа Bcr-Abl в клетках острого лимфобластного лейкоза, хронического миелоидного лейкоза, стромальных опухолей желудочно-кишечного тракта, нарушения структуры и функции р53, рецепторов семейства фактора некроза опухоли и др. Это не удивительно: выдержали отбор те опухолевые клетки, в которых имеются (до лечения) молекулярные детерминанты выживаемости. Если в процессе химиотерапии в таких клетках накопится Pgp, то их резистентность будет действительно многофакторной. Таким образом, способность быстро приобретать МЛУ проявляется в уже устойчивых клетках. Как преодолеть эту плейотропную резистентность?
Механизм-специфическая химиотерапия и МЛУ. Возможно ли преодоление резистентности воздействием на конкретный механизм? Представляется дискутабельным доминирующее в современной литературе стремление к непременной идентификации клеточных мишеней в надежде на создание конкретного для отдельной опухоли (или, шире, клинической ситуации) подхода к лечению (mechanism-based therapy). Это стремление продиктовано необходимостью добиться максимального противоопухолевого эффекта при возможно меньшей обще резорбтивной токсичности. Мишенями направленной терапии служат нарушения, чаще встречаемые в опухолях (но не всегда специфичные для новообразований), чем в интактных клетках. Такие нарушения могут быть обусловлены изменениями структуры генов (например, инактивация функции р53 за счет мутаций или делеций гена) и/или эпигенетической дизрегуляцией экспрессии онкогенов и антионкогенов. Несомненно, детальное изучение механизмов выживания и смерти опухолевых клеток плодотворно и для фундаментальной биологии, и для практической онкологии. Уже сегодня в клинике применяются препараты-антагонисты конкретных механизмов регуляции пролиферации, в частности, ингибитор эпидермального фактора роста ZD1839 (Иресса) и блокатор тирозинкиназы Bcr-Abl STI-571 (Гливек). Однако безупречен ли подход к терапии опухолей, основанный на взаимодействии препарата с одной клеточной мишенью? Всегда ли целесообразно уменьшать обще резорбтивный эффект химиотерапии за счет прицельной манипуляции с конкретной структурой опухолевой клетки? Не послужит ли такая индивидуализация лечения сужению терапевтического спектра и снижению эффективности препарата?
Во-первых, специфичность взаимодействия малых молекул — а именно они составляют подавляющее большинство современных средств противоопухолевой терапии — с биологическими структурами относительна. Например, ингибиторы того или иного семейства протеинкиназ реагируют и с другими киназами. Ингибирование фермента предполагает взаимодействие малой молекулы с участком (участками) молекулы энзима, существенным для ее активности, в частности, с каталитическим сайтом или сайтом связывания АТФ. Однако структура этих районов редко бывает уникальной для конкретного фермента. Кроме того, проникновение в клетку чужеродного химического соединения вызовет ряд общих стрессорных реакций. Эти реакции (а они неизбежны как ответ на раздражитель!) в клетке налагаются на эффект взаимодействия потенциального модулятора с его основной мишенью. Еще более проблематична оценка эффекта ингибитора на уровне организма.
Второе возражение связано с биологической гетерогенностью опухоли. Экспрессия того или иного механизма может широко варьировать между участками опухоли. Поэтому неодинаковой будет и чувствительность к лечебному препарату отдельных клеток или клеток в разных зонах новообразования. Если так, то применение узко специфического агента предоставит селективное преимущество в выживании клеткам, в которых механизм-мишень экспрессирован слабее. Но тогда остаточная опухоль будет резистентна к препарату из-за отсутствия его мишени в клетках, т.е. эффект лечения оказывается заведомо неполным. Предположение же о том, что мишень, против которой действует препарат, есть единственный или главный фактор злокачественности в данной опухоли, может оказаться неправомерным. Ведь основные черты злокачественной трансформации — неконтролируемая пролиферация, способность к выживанию и делению без контакта с адгезивным субстратом, инвазия, метастазирование — обеспечиваются многочисленными механизмами, и блокирование одного фактора приведет к смене фенотипов резидуальной опухоли, но не обязательно к ее исчезновению. Как быть в случаях рецидивов опухоли в результате развития устойчивости, например, к STI571, благодаря выживанию клеток с мутацией в киназном домене Bcr-Abl [24]? А ведь МЛУ может развиваться быстро в ответ на воздействие многих веществ (см. выше); тогда рецидивная опухоль окажется резистентной и к STI571, и к ряду других препаратов.
Наконец, третье, важнейшее возражение, возвращает нас к поставленной в начале статьи проблеме необычайной пластичности опухолевой клетки как биологической системы. Функции клетки, нарушенные при злокачественном росте — пролиферация, смена фаз клеточного цикла и др. — регулируются чрезвычайно “надежно”. Мы представили это многообразие регуляторных механизмов на примере становления МЛУ; и преодоление этого фенотипа путем обхода механизмов устойчивости также обосновано сложностью (многочисленностью, взаимозаменяемостью) процессов, обеспечивающих выживание клеток. В ряде ситуаций удается блокировать приобретение клетками Pgp-опосредованной МЛУ, воздействуя на конкретный механизм [5, 12, 27]. Однако всегда остается возможность ускользания опухолевой клетки от терапевтических воздействий. Такая возможность может возрастать при прогрессии опухоли. Важнейшая особенность онкологического заболевания — именно развертывание каскадов регуляции клетки. “Вооружаясь” таким образом, клетка и получает способность ускользать от систем биологического контроля.
Приведенные соображения не умаляют значимости терапии опухолей, ориентированной на конкретный механизм. Однако постоянная возможность (или угроза) “ускользания” опухоли заставляет критически оценить стремление этой стратегии к универсальности. Многофакторная устойчивость — результат постоянного ускользания, приобретения опухолью новых возможностей надежного регулирования функций, важных для ее выживания; эта способность злокачественных клеток предполагает, что оптимизация противоопухолевой терапии может быть достигнута сочетанием механизм-специфических воздействий с активацией путей гибели, сохраняющих функцию при формировании резистентности.
Одним из таких путей является нарушение целостности плазматической мембраны. Некроз не нарушен в Pgp-экспрессирующих клетках с МЛУ [13, 25, 26]. При некрозе быстро произойдут повреждения практически любых субклеточных структур, в отличие от апоптотических каскадов, сопровождающихся последовательным расщеплением субстратов и строгой специфичностью взаимодействия протеаз с мишенями [29]. Блокирование одного или нескольких звеньев апоптотических каскадов прервет передачу сигналов на нижележащие механизмы, результатом чего станет ускользание клетки от гибели и, в итоге, формирование устойчивости. Такая возможность не исключена при формировании многофакторной резистентности, в том числе Pgp-опосредованной МЛУ. Еще и по этой причине для борьбы с МЛУ желательно, чтобы механизмы смерти были множественными и включали активацию каспаз и других протеаз (лизосомальных, протеосомальных, ядерных), путей потенцирования сигнала (митохондриальный путь) и нарушения проницаемости мембран. Таким образом, терапевтическими мишенями выступают не только отдельные молекулы, но и надмолекулярные комплексы (органеллы, плазматическая мембрана).
МЛУ — не единственный фенотип устойчивости клеток к ксенобиотикам, а Pgp — не единственный механизм, обеспечивающий выживание в присутствии токсинов. Сегодня не представляется возможным предсказать, совокупность каких факторов резистентности (транспорт веществ через плазматическую мембрану, внутриклеточный катаболизм токсинов, антиоксидантная защита и др.) определит неэффективность конкретного лечебного режима в отношении конкретной опухоли. Блокирование отдельного “специфического” механизма может оказаться заведомо недостаточным. Чем больше механизмов смерти удастся активировать в резистентных клетках, чем менее зависима такая стратегия от динамичного “молекулярного профиля” опухоли, тем надежнее конечный результат — преодоление многофакторной резистентности.
Список литературы:
1. Трунова С.А. Инициация вхождения в митоз и проблема избыточности функций митотических циклинов // XIV Всероссийский симпозиум “Структура и функции клеточного ядра”. Санкт-Петербург, 15-17 октября 2002 г.: Цитология. — 2002. — Т. 44. С. 910.
2. Abolhoda A., Wilson A.E., Ross H. et al. Rapid activation of MDR1 gene expression in human metastatic sarcoma after in vivo exposure to doxorubicin. // Clin. Cancer Res. — 1999. — Vol. 5. — P. 3352-3356.
3. Ambudkar S.V., Dey S., Hrycyna C.A. et al. Biochemical, cellular, and pharmacological aspects of the multidrug transporter // Annu. Rev. Pharmacol. Toxicol. — 1999. — Vol. 39. — P. 361-398.
4. Arceci R.J. Clinical significance of P-glycoprotein in multidrug resistance malignancies // Blood. 1993. — Vol. 81. — P. 2215-2222.
5. Chaudhary P.M., Roninson I.B. Induction of multidrug resistance in human cells by transient exposure to different chemotherapeutic drugs // J. Natl. Cancer Inst. — 1993. — Vol. 85. — P. 632-639.
6. Chen C.-J., Chin J.E., Ueda K. et al. Internal duplication and homology with bacterial transport proteins in the mdr1 (P-glycoprotein) gene from multidrug-resistant human cells // Cell. — 1986. — Vol. 47. — P. 381-389.
7. Dano K. Active outward transport of daunorubicin in resistant Ehrlich ascites tumor cells // Biochim. Biophys. Acta. — 1973. — Vol. 323. — P. 466-483.
8. Fang B., Roth J.A. Tumor-suppressing gene therapy // Cancer Biol. Ther. 2003. — Vol. 2. — P. S115-S121.
9. Goldstein L.J., Galski H., Fojo A. et al. Expression of a multidrug resistance gene in human cancers // J.Natl. Cancer Inst. 1989. — Vol. 81. — P. 116-124.
11. Hegewisch-Becker S., Hossfeld D.K. The MDR phenotype in hematologic malignancies: prognostic relevance and future perspectives // Ann. Hematol. 1996. — Vol. 72. — P. 105-117.
12. Johnstone R.W., Cretney E., Smyth M.J. P-glycoprotein protects leukemia cells against caspase-dependent, but not caspase-independent, cell death // Blood. 1999. — Vol. 93. — P. 1075-1085.
13. Johnstone R.W., Taiinton K.M., Rueffli A.A. et al. P-glycoprotein does not protect cells against cytolysis induced by pore-forming proteins // J.Biol. Chem. 2001. — Vol. 276 — P. 16667-16673.
14. Juliano R., Ling V. A surface glycoprotein modulating drug permeability in Chinese hamster ovary cell mutants // Biochim. Biophys. Acta. — 1976. — Vol. 455. — P. 152-162.
15. Leith C.P., Kopecky K.L., Godwin J. et al. Acute myeloid leukemia in the elderly: assessment of multidrug resistance (MDR1) and cytogenetics distinguishes biologic subgroups with remarkably distinct responses to standard chemotherapy. A Southwest Oncology Group study // Blood. 1997. — Vol. 89. — P. 3323-3329.
16. Marie J.P. Drug resistance in hematologic malignancies // Curr. Opin. Oncol. 2001. — Vol. 13. — P. 463-469.
17. O'Dwyer M.E., Mauro M.J., Druker B.J. STI571 as a targeted therapy for CML // Cancer Invest. 2003. — Vol. 21. — P. 429-438.
19. Pallares-Trujillo J., Lopez-Soriano F., Argiles J.M. Lipids: A key role in multidrug resistance? // Int.J.Oncol. — 2000. — Vol. 16. — P.783-798.
20. del Poeta G., Stasi R., Aronica G. et al. Clinical relevance of P-glycoprotein expression in de novo acute myeloid leukemia // Blood. 1996. — Vol. 87. — P. 1997-2004.
21. Reddy A., Kaelin W.G.Jr. Using cancer genetics to guide the selection of anticancer drug targets // Curr. Opin. Pharmacol. — 2002. — Vol. 2. — P. 366-373.
23. Sattler M., Scheijen B., Weisberg E., Griffin J.D. // Adv. Exp. Med. Biol. 2003. — Vol. 532. — P.121-140.
24. Shah N.P., Sawyers C.L. Mechanisms of resistance to STI571 in Philadelphia chromosome-associated leukemias // Oncogene. — 2003. — Vol. 22. — P. 7389-7395.
25. Shtil A., Turner J., Durfee J. et al. Cytokine-based tumor cell vaccine is equally effective against parental and isogenic multidrug-resistant myeloma cells: the role of cytotoxic T-lymphocytes // Blood. — 1999. — Vol. 93. — P. 1831-1837.
26. Shtil A., Turner J., Dalton W., Yu H. Alternative pathways of cell death to circumvent pleiotropic resistance in myeloma cells: role of cytotoxic T-lymphocytes // Leukemia and Lymphoma. — 2000. Vol. 38. — P. 59-70.
27. Shtil A.A. Emergence of multidrug resistance in leukemia cells during chemotherapy: mechanisms and prevention. // J.Hematother. Stem Cell Res. — 2002. — Vol. 11. — P. 231-241.
28. Tamura K, Fukuoka M. Molecular target-based cancer therapy: tyrosine kinase inhibitors. // Int. J. Clin. Oncol. 2003. — Vol. 8. — P. 207-211.
29. Thornberry N.A., Lazebnik Y. Caspases: enemies within. //Science. — 1998. — Vol. 281(5381). — P.1312-1316.
30. Warmuth M., Damoiseaux R., Liu Y. et al. SRC family kinases: potential targets for the treatment of human cancer and leukemia. // Curr. Pharm. Des. 2003. — Vol. 9. — P. 2043-2059.
Copyright © Российское общество клинической онкологии (RUSSCO).
Полное или частичное использование материалов возможно только с разрешения администрации портала.
Противоопухолевые препараты
Противоопухолевые препараты пугают онкологических пациентов непредсказуемостью позитивного и частого негативного действия. Большинство пациентов предпочло бы остановиться на хирургическом лечении или облучении, но эти строго локальные методы не всегда технически возможны. На все опухолевые очаги системно удается воздействовать только лекарственными препаратами, поскольку они проникают всюду, где есть кровь вне зависимости от способа введения.
Что такое противоопухолевые препараты и как они работают?
Все убивающие злокачественные клетки препараты можно называть противоопухолевыми, не смотря на существенную разнородность лекарственных молекул и механизм повреждающего действия. Большинство противоопухолевых препаратов влияет на деление клеток, нарушая структуру их ДНК или веретена, помогающего развести хромосомы в образующиеся дочерние клетки. Вероятно, цитостатики повреждают не только геном, лучше всего изучено их действие образование сшивок между частями одной нити ДНК и двумя параллельными нитями, заплетенными в спираль. У клетки есть способы для восстановления малого повреждения генетического аппарата, но при существенном нарушении она вынуждена уйти в сторону апоптоза — смерти.
Клеточные популяции в опухолевом узле очень разнородны: какие-то клетки только собираются делиться, другие уже вошли в процесс и активно синтезируют две копии структур для дочерней клеточки, некоторые находятся в покое, а часть после завершения жизненной программы устремилась к гибели. Считается, что находящиеся в состоянии покоя клеточные популяции устойчивы к агрессии противоопухолевых лекарств, зато делящиеся и планирующие войти в эту фазу — самые чувствительные к химиопрепаратам. Делящиеся клетки составляют фракцию опухолевого роста, чем она крупнее, тем агрессивнее рак и одновременно более чувствителен к противоопухолевому воздействию.
Классификация и виды противоопухолевых средств
Противоопухолевые лекарства представлены химиотерапевтическими препаратами, то есть цитостатиками, эндокринными или гормональными средствами, таргетными препаратами. Все они различаются механизмом инициации клеточной смерти.
Цитостатики используются с 1946 года и представлены несколькими группами лекарственных средств:
- алкилирущие получили свое название от химической реакции, реализующей ведущий механизм повреждения — алкилирование, то есть замену атома водорода нуклеиновых кислот нитей ДНК на алкильную группу лекарства с образованием связок и деформацией структуры;
- антиметаболиты прекращают жизнедеятельность клетки, вмешиваясь в её метаболизм и подменяя собой структурные компоненты нуклеиновых оснований ДНК и РНК или блокируя участвующие в синтезе этих оснований ферменты;
- противоопухолевые антибиотики тоже формируют ДНК-сшивки, а традиционное для антибактериальных препаратов противовоспалительное и противомикробное действие у них практически равно нулю;
- препараты растительного происхождения очень разнородны, преимущественный механизм действия — нарушение клеточного деления, общее у них одно — их выделили из растительного сырья, а позже стали синтезировать химическим способом, удешевляя и облегчая процесс производства;
- различные препараты невозможно было отнести к четырём основным группам ни по одному объединяющему критерию.
Алкилирующие средства
Это самые первые противораковые лекарства, начавшие историю химиотерапии. Ярчайшие представители группы — циклофосфамид, нитрозометилмочевина и производные платины.
Алкилирование противоопухолевыми агентами ДНК приводит к разрывам её цепи и сшиванию с закрученной в параллельную спираль второй нитью, образуемые сшивки не хаотичны — в определенном месте и с конкретным нуклеотидом. В конечном итоге предотвращается репликация, то есть сборка второго комплекта структур для разделения клетки. Принципиально алкилирование возможно в любую фазу клеточного цикла, но особенно активно осуществляется во время синтеза.
Препараты этой группы обладают широким противоопухолевым спектром, используются в терапии рака, в том числе сарком и онкогематологических процессов.
Циклофосфамид, более привычное торговое наименование циклофосфан, применяется более 60 лет в качестве компонента полихимиотерапии, в одиночку используется при злокачественных заболеваниях крови и лимфатической ткани. Вводится разными способами: в таблетках, внутривенно и внутримышечно. Для местного применения бесполезен, потому что активируется исключительно в ткани печени, куда попадает с кровью.
Редкая особенность препарата ифосфамида — наличие антидота уромитексана, защищающего слизистую мочевого пузыря от повреждений.
Первое производное платины — цисплатин было синтезировано в середине XIX века, а в клинику пришло в последней четверти прошлого века. Препарат легко проникает в клетки, потому что его молекула не заряжена ни положительно, ни отрицательно, чем и обусловлена его высокая агрессивность в отношении множества злокачественных процессов. Сегодня применяются уже три поколения платиновых производных, при неизменно высокой активности существенно различаются побочные эффекты.
Препараты нитрозометилмочевины преимущественно используются при злокачественных новообразованиях ЦНС и в онкогематологии.
Противоопухолевые препараты растительного происхождения
Вещества растительного происхождения представлены несколькими группами:
- винкаалкалоиды выделены из растения барвинок, у всех четырёх лекарственных средств идентичный механизм противоопухолевого действия — нарушение белка тубулина и вследствие этого остановка клеточного митоза;
- таксаны немногочисленны, первоначально был выделен из коры тихоокеанского тисового кустарника паклитаксел, а через 15 лет уже из игл европейского тиса добыли доцетаксел, сегодня таксаны наполовину синтетические, кроме высокой эффективности они стали первенцами среди слишком дорогих химиопрепаратов;
- камптотецины добывают из южно-китайского ниссового кустарника, препарат нарушает фермент топоизомеразу, не позволяя раскрутиться суперспирали ДНК, сегодняшние полусинтетические аналоги камптотецина топотекан используются при опухолях ЦНС, иринотекан незаменим в схемах химиотерапии карцином толстой кишки, легкого и яичников;
- эпиподофиллотоксины — полусинтетические аналоги смолы из корней американской мадрагоры и самый яркий представитель подгруппы — этопозид оказался эффективнее природного аналога.
Противораковые препараты нового поколения
Противоопухолевое действие цитостатиков обнаруживали почти случайно, таргетные препараты синтезируют на основе научных исследований. Таргетные препараты работают «точечно», блокируя важный внутриклеточный элемент, понуждая к клеточной гибели. Эту группу также называют ингибиторами за подавление ими клеточных процессов. Особенность лекарственных средств в невозможности полного уничтожения опухоли, как правило, они приостанавливают размножение популяции, поэтому используются вместе с цитостатиками.

Иммуноонкологические средства способствуют восстановлению естественной иммунной защиты организма, подавленной злокачественной опухолью. Средства отличаются от стандартных иммунных препаратов, аналогом которых были вырабатываемые организмом цитокины — интерферон и интерлейкин. Лекарства, как и таргетные, создаются целенаправленно на основе фундаментальных достижений науки. Иммунотерапия сдвинула с мертвой точки лечение меланомы, устойчивой к цитостатикам, мало чувствительный рак легкого и желудка, почечноклеточную карциному и рак печени.
Препараты на гормональной основе
Эндокринная терапия призвана снизить выработку половых гормонов или не допустить их внутрь опухолевой клетки, дабы исключить стимуляцию роста чувствительного к уровню гормонов злокачественного процесса.
Классификация эндокринных препаратов по механизму действия:
- центральные, подавляющие выработку гормонов гипофиза, регулирующих синтез эндокринных веществ половыми клетками, и главные представители группы — агонисты ЛГРГ;
- периферические — снижают функцию половых желез или нарушают в жировой ткани работу фермента ароматазы, отвечающего за трансформацию тестостерона в эстроген — группа ингибиторов ароматазы;
- клеточные — связывающиеся на мембране с рецептором и не пропускающие гормоны внутрь клетки и по своей сути антигормоны, как антиэстроген тамоксифен.
Применяются гормональные противоопухолевые лекарства при карциномах молочной и предстательной железы, а также некоторых вариантах рака тела матки, несущие на своей клеточной поверхности специальные рецепторы гормонов. Как правило, лечение рассчитано на несколько лет, поскольку реализация противоопухолевого эффекта очень медленная.
Побочные явления
Точка приложения противоопухолевых препаратов — клетка, причём не только опухолевая, но и нормальная, поэтому при противоопухолевой терапии закономерны осложнения. Спектр побочных эффектов каждого препарата изучен, но токсические проявления у отдельного пациента строго индивидуальны и непредсказуемы по интенсивности.
Даже препараты одной подгруппы при общем механизме действия имеют разные точки приложения, к примеру, очень небольшие отличия в строении алкалоидов барвинка винкристин и винбластин обернулись существенными различиями в спектре активности и токсичности, их применяют при разных болезнях. Скопированный с натурального растительного винбластина синтетический аналог виндезин, по биологическому действию и осложнениям больше походит на винкристин. Структурно схожий с природными винкаалкалоидами и полностью синтетический винорелбин по спектру действия и токсичности совсем не походит на натуральные аналоги.
Противоопухолевые лекарства не гарантируют 100% результата, раковые клетки уникальны в способности самовосстановления и скорости воспроизводства популяции.
Искусство химиотерапии — это не только умелый подбор оптимальной комбинации, обещающей максимально возможный результат, но и минимизация программных осложнений лекарственного лечения. В нашей Клинике не только помогают каждому пациенту легче перенести химиотерапию, но заблаговременно по индивидуальной программе, учитывающей все особенности организма, готовят к курсу лечения.
Противоопухолевые препараты - средства, применяемые для лечения злокачественных опухолей. Химические средства выпускаются в форме таблеток, инъекций, субстанций для перорального применения. Они используются для того, чтобы остановить процесс развития злокачественных новообразований, проверить уровень созревания и разрастания злокачественных клеток.
Какие противоопухолевые средства при лечении?
Практическое применение в онкологии получили следующие группы противоопухолевых препаратов:
| алкилирующие вещества - хлорэтиламины (эмбихин, новэмбихин, сарколизин, допан, дегранол, новэмбитол, хлорбутин, циклофосфан), этиленимины (тиофосфамид, дипин, тиодипин, спиразидин, бензотэф, фторбензотэф) |
| антиметаболиты - антагонисты пурина (6-меркаптопурин), антагонисты пиримидина (5- фторурацил), антагонисты фолиевой кислоты (метотрексат) |
| вещества растительного происхождения — винка-алкалоиды (винбластин, винкристин), колхамин |
| противоопухолевые антибиотики (актияомицины С и D, хризомаллин, оливомицин, брунеомицин, доксорубицин, рубомицин) |
| агонисты и агонисты гормонов (половые гормоны - кортикостероиды) |
| противоопухолевые средства растительного происхождения |
| моноклональные антитела |
| прочие противоопухолевые средства (натулан, ортопара ДДД) |
Особое внимание уделяется эндогенным противоопухолевым препаратам, а также была выявлена эффективность интерферонов и лимфокинов при некоторых злокачественных новообразованиях.
Лекарственная терапия, в большинстве случаев, может лишь дополнять оперативные и лучевые методы лечения. В качестве единственного метода лечения может быть использована при лейкозах, лимфогранулематозе, ретикулосаркоматозе, миеломной болезни, хорионэпителиоме матки.
Побочные действия и возможные осложнения препаратов для химиотерапии
Препараты токсичны и помимо терапевтического действия на больные клетки, они также оказывают неблагоприятное воздействие на здоровые клетки и органы. Противоопухолевые препараты вводятся большими дозами и негативно влияют на кроветворную систему.
В связи с этим могут проявляться следующие побочные явления:
- развитие гиперурикемии;
- лейкопения, тромбоцитопения;
- стоматиты, поносы (повреждение слизистых оболочек пищеварительного тракта);
- тошнота, рвота, теряется аппетит;
- дерматиты;
- гормональные расстройства;
- депрессия;
- иммуносупрессивное воздействие на организм (развиваются различные инфекционные заболевания);
- нарушение овуляторного цикла и др.
Применение противоопухолевых препаратов в Юсуповской больнице проводится под постоянным контролем лечащего врача, который следит за их переносимостью пациентом, динамикой лейкоцитов и тромбоцитов в периферической крови, выявлением первых признаков повреждения оболочек пищеварительного тракта и пр.
Противопоказания к применению противораковых препаратов

Для устранения побочных эффектов в Юсуповской больнице применяются противорвотные препараты, которые не только уменьшают тошноту и рвоту, но и снижают риск развития нейтропении.
Противоопухолевые средства в Юсуповской больнице назначаются врачом-онкологом, который индивидуально подбирает схему приёма, дозировку, оценивает сочетаемость с другими препаратами. Комбинирование терапий зависит от состояния здоровья пациента, стадии развития заболевания и от особенностей ее течения. Эффект от препаратов будет больше на ранней стадии с маленькой опухолью, чем с большим злокачественным новообразованием. Онкологи Юсуповской больницы рекомендуют регулярно проходить диагностику. Своевременно выявленное новообразование увеличит шансы на полное выздоровление.
Читайте также:
- Зачем, когда и как наносить румяна? Румяна
- Преэклампсия
- Создание влагалища по способу Джузеппе Веккьетти. Техника
- Психологическое привыкание к боли в сердце. Кровь как причина нейроциркуляторной боли в сердце
- Гормональные пробы у женщин в гинекологии. Проба с прогестероном, хорионическим гонадотропином
