Пример торакоскопической операции на грудном отделе позвоночника при опухоли (ганглионевроме)
Добавил пользователь Morpheus Обновлено: 28.01.2026
ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, 117997, Москва, Россия
кафедра детской хирургии Российского научно-исследовательского медицинского университета им. Н.И. Пирогова;
ФГБУ «Федеральный научно-клинический центр детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева»;
Европейский медицинский центр
Кафедра детской хирургии Российского государственного медицинского университета, ДГКБ №13 им. Н.Ф. Филатова, Москва
Кафедра детской хирургии Российского государственного медицинского университета им. Н.И. Пирогова
ФГБУ «Федеральный научно-клинический центр детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева»
Кафедра детской хирургии Российского государственного медицинского университета, Детская городская клиническая больница №13 им. Н.Ф. Филатова, Москва
Кафедра детской хирургии Российского научно-исследовательского медицинского университета им. Н.И. Пирогова;
отделение торакальной хирургии и хирургической гастроэнтерологии ДГКБ №13 им. Н.Ф. Филатова, Москва
Торакоскопические операции при нейрогенных опухолях у детей
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2015;(9): 68‑73
Цель — представить объединенный опыт применения эндохирургических операций у детей с нейрогенными опухолями в двух лечебных учреждениях. Материал и методы. За период с 2010 по 2014 г. всего в двух клиниках торакоскопические операции в объеме удаления опухоли выполнены в 19 наблюдениях. Возраст оперированных детей от 1 мес до 7,5 года (в среднем 1,5 года). Возраст 9 (47,3%) детей не превышал 1 года. В нашем исследовании по данным гистологического исследования у 9 пациентов выявлена ганглионеврома, у 2 — ганглионейробластома, у 8 больных — нейробластома I стадии. Все пациенты находились под наблюдением и получали лечение согласно протоколу NB2004. Диаметр опухоли составлял от 1 до 6 см (в среднем 4,9±1,9 см). Средняя продолжительность операции составила 62±22 мин. Интраоперационных осложнений не было. Ранний послеоперационный период у всех больных после эндохирургических операций протекал значительно легче, чем у больных, перенесших открытые оперативные вмешательства. Результаты. За период наблюдения не отмечено ни одного локального рецидива заболевания. Торакоскопические операции могут стать методом выбора в лечении детей с нейрогенными новообразованиями при отсутствии вовлечения магистральных сосудов в опухолевый процесс и при ограниченном объеме образования.
В последние годы малоинвазивная хирургия (МИХ) бесспорно играет важную роль в диагностике и лечении злокачественных заболеваний у взрослых [4, 8, 14], но и в детской онкологии МИХ применяется для первичной диагностики новообразований, биопсии лимфоузлов, стадирования онкологического процесса, диагностики/удаления метастазов, паллиативных операций при нерезектабельных опухолях, удаления объемных образований, для исследований при подозрении на рецидив заболевания [5, 6, 12, 17]. Большинство исследований в детской онкохирургии посвящено эндохирургическому лечению нейрогенных опухолей [5, 7, 13, 18].
Все опухоли симпатической нервной системы развиваются из клеток нервного гребня, которые в норме образуют симпатический ствол и мозговое вещество надпочечников. В зависимости от того, на каком этапе развития ткани произошло нарушение клеточной дифференцировки, нейрогенные новообразования могут быть разной степени зрелости (нейробластома, ганглиобластома или ганглионеврома). Нейробластома представляет собой низкодифференцированную опухоль, развивающуюся из клеток нервного гребня, и является самой распространенной экстракраниальной опухолью в детском возрасте [1, 2, 8]. Эта опухоль чаще всего (32% наблюдений) имеет надпочечниковую локализацию. Ганглионеврома состоит из зрелых ганглионарных клеток и относится по своей природе к доброкачественным опухолям. Она часто обызвествляется. В литературе описаны случаи спонтанного созревания нейробластомы до ганглионевромы [1, 3, 15]. Ганглионейробластома — это промежуточная — между ганглионевромой и нейробластомой — форма неоплазмы. Зрелые ганглионарные клетки и недифференцированные нейробластомы встречаются в различных отделах опухоли в разных пропорциях. Примерно у 15% пациентов нейрогенные опухоли локализуются в грудной клетке [2, 3]. В грудной полости нейрогенные опухоли чаще всего расположены в заднем средостении и исходят из симпатических паравертебральных ганглиев. Считается, что нейробластома в грудной клетке менее агрессивна, в связи с этим прогноз лучше, чем при опухоли, исходящей из забрюшинного пространства [10].
Нейробластома сама по себе уникальна: с одной стороны, подтверждена ее способность к спонтанной регрессии и «дозреванию», особенно у детей в возрасте от года, с другой стороны, выживаемость при нейробластоме высокого риска не превышает 30% [1, 3, 10]. В настоящее время резекция первичной опухоли должна быть обязательно произведена на первом или последующих этапах комплексной терапии [1, 2, 6]. Выбор оптимального хирургического лечения (доступа, объема и методики операции) в каждом наблюдении будет иметь свои особенности и может зависеть от первичной локализации, распространенности опухоли, вовлечения в патологический процесс магистральных сосудов. Выбор схемы лечения нейробластомы во многом определяется стадией процесса и биологическим типом опухоли [1, 3]. В настоящее время общепризнанной является классификация таких опухолей INSS (International Neuroblastoma Staging System) в модификации 1993 г.
Несмотря на относительно большое (по сравнению с другими онкологическими заболеваниями) количество публикаций, посвященных эндохирургическому лечению нейрогенных опухолей, опыт применения МИХ ограничивается небольшими сериями или единичными наблюдениями [10, 15]. В нашей стране опыт использования эндохирургических операций в лечении этого заболевания невелик [4, 7]. Это позволило нам объединить опыт использования малоинвазивных технологий на хирургическом этапе лечения нейробластом в двух клинических учреждениях — ДГКБ № 13 им. Н.Ф. Филатова и ФНКЦ ДГОИ им. Дмитрия Рогачева.
Материал и методы
В отделении торакальной хирургии ДГКБ № 13 им. Н.Ф. Филатова Москвы с 2010 г. по декабрь 2014 г. находились под наблюдением 34 ребенка с диагнозом: объемное образование средостения. У 12 пациентов были выявлены солидные нейрогенные опухоли средостения (рис. 1). В аналогичный промежуток времени 16 детей с тем же диагнозом проходили лечение в ФНКЦ ДГОИ им. Дмитрия Рогачева, нейрогенные опухоли выявлены у 11 из них. За период с января 2012 г. по декабрь 2013 г. В двух клиниках всего 19 детям выполнены операции в объеме удаления опухоли с использованием торакоскопического доступа. 4 пациента в связи с большим объемом новообразования были оперированы из торакотомического доступа. Возраст детей от 1 мес до 7,5 года, средний возраст составил 1,5 года. Возраст 9 (47,3%) детей не превышал 12 мес. В наших наблюдениях среди пациентов с нейрогенными опухолями было 7 девочек и 12 мальчиков.
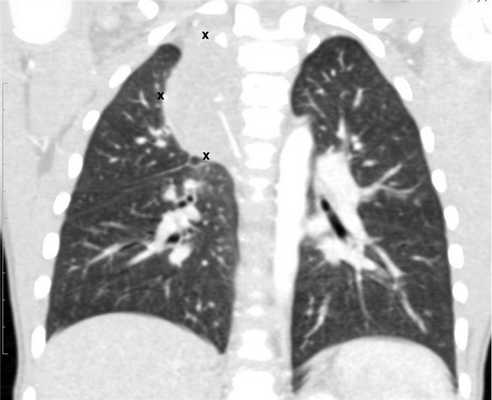
Рис. 1. Нейрогенная опухоль верхнего средостения.
Все дети проходили предоперационное обследование, включающее, помимо рутинных тестов, исследование онкологических маркеров, катехоламинов в моче, УЗИ, КТ и МРТ грудной клетки. При подозрении на злокачественный характер образования выполняли пункцию костного мозга и дополнительные исследования для выявления возможных метастазов в других органах.
Отбор больных для выполнения эндохирургических операций происходил на междисциплинарных обсуждениях детских хирургов, онкологов и рентгенологов на основании следующих показаний и противопоказаний.
Показание к торакоскопическому удалению нейрогенной опухоли: локализованная опухоль диаметром менее 6 см.
1) распространенная нейробластома III, IV и IVS стадии;
2) инкапсуляция в опухоль магистральных сосудов и вовлечение в опухолевый процесс органов средостения;
3) большая опухоль средостения (диаметром более 6 см), переходящая за среднюю линию.
Приводим технику оперативного вмешательства.
Положение пациента на животе с приподнятым под углом 30° боком на пораженной стороне. Под грудной клеткой располагают валик. Руку на стороне поражения поднимают и отводят. Зонд в желудке может помочь в локализации пищевода при удалении опухолей относительно большого размера. Конкретное положение хирурга и ассистента зависит от того, в какой части средостения локализуется опухоль. Головной или ножной конец стола может быть наклонен так, чтобы сила гравитации обеспечила отклонение легкого от зоны операции. Это позволяет избежать введения дополнительного троакара для тракции легкого.
Техника операции. Для торакоскопического удаления нейрогенных опухолей средостения мы используем три 5-миллиметровых троакара даже у маленьких детей. Это связано с использованием эндохирургических инструментов с функцией «заваривания тканей» (BiClamp/Ligasure/ENSEAL), диаметр которых 5 мм. Использование подобных инструментов повышает безопасность выполнения операции, обеспечивая надежный гемостаз. Возможность введения инструментов в любой из рабочих троакаров повышает комфорт выполнения операции и уменьшает ее длительность. Кроме того, необходимо учитывать, что нейрогенные опухоли могут быть очень плотными, что создает повышенную нагрузку на тонкие 3-миллиметровые инструменты. Для уменьшения травматизации тканей при захвате опухоли целесообразно использовать либо эндозажим с плоскими атравматичными браншами, либо окончатый зажим. Необходимо помнить о том, что удаленная опухоль должна быть извлечена из грудной клетки с помощью эндомешка диаметром минимум 10 мм. Эндомешок может быть введен для удаления опухоли без установки дополнительного 10-миллиметрового троакара — через расширенное отверстие одного из рабочих троакаров. Первый троакар устанавливают в пятом или шестом межреберье по средней подмышечной линии. После обзора плевральной полости устанавливают 2-й и 3-й троакары, используя правило «треугольника», под видеоконтролем, чтобы избежать ранения легкого.
Перед началом удаления опухоли необходимо сориентироваться в топографии новообразования по отношению к крупным артериальным и венозным стволам: в первую очередь к подключичной артерии и вене, аорте, верхней полой вене; к диафрагмальному нерву, возвратному гортанному нерву, нервам плечевого сплетения и т. д. (рис. 2, а).
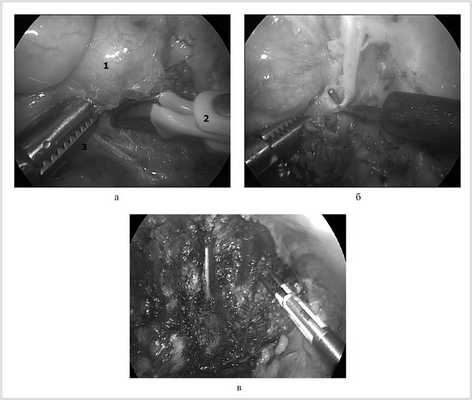
Рис. 2. Этапы операции.
Операцию начинают с выделения и пересечения симпатического ствола выше и ниже опухоли. Следующим этапом отсекают опухоль от задней грудной стенки. Особое внимание необходимо уделить гемостазу в межреберных промежутках. Опухоль может быть легко травмирована, поэтому лучше избежать непосредственного ее захвата инструментом, стараясь использовать для тракции медиастинальную плевру или отводя тупым путем без захвата собственно за ткань опухоли. При повреждении опухоли браншами зажима может отмечаться кровотечение. L-образный крючок использовали для выполнения тонкой диссекции объемного образования в бессосудистой зоне (см. рис. 2, б). Более зрелые опухоли имеют более плотную структуру и хорошо отделяются от окружающих тканей. Часто опухоль имеет плотные сращения с ребрами и прорастает в межпозвоночные отверстия, выходя в позвоночный канал. В такой ситуации целью операции не является полное удаление опухоли «en bloc». Основную часть опухоли удаляют, а оставшиеся фрагменты иссекают дополнительно или уничтожают путем аргоновой или электрокоагуляции (см. рис. 2, в). Удаленную опухоль погружают в эндомешок и удаляют через расширенное при необходимости отверстие 10-миллиметрового троакара. Ложе удаленной опухоли промывают, промывную жидкость полностью аспирируют. Гемостаз проверяют под эндоскопическим контролем. К ложу опухоли устанавливают плевральный дренаж. Легкое раздувают под визуальным контролем. Места вколов ушивают внутрикожным швом.
Результаты и обсуждение
У всех детей нейрогенные опухоли располагались в заднем средостении. У 8 детей при операции использовали левосторонний доступ, у 11 — правосторонний. Диаметр опухоли составлял от 1 до 6 см (в среднем 4,9±1,9 см). Операция продолжалась в среднем 62±22 мин. Интраоперационных осложнений не было. 5 пациентов в возрасте до 1 года находились в отделении реанимации в течение 1 сут. Ранний послеоперационный период у всех больных после эндохирургических операций протекал значительно легче, чем у больных, перенесших открытые оперативные вмешательства: ранние сроки прекращения ИВЛ, менее выраженный болевой синдром, ранняя активизация пациентов. Дренирование плевральных полостей продолжалось в большинстве наблюдений (14) 1 день. У одного ребенка возникли явления транзиторного хилоторакса, который был разрешен на 5-е сутки после операции на фоне тотального парентерального питания.
В нашем исследовании на основании данных гистологического исследования у 9 пациентов выявлена ганглионеврома, у 2 — ганглионейробластома, у 8 больных — нейробластома I стадии. Все пациенты с нейробластомой находились под наблюдением и получали лечение согласно протоколу NB2004. За период наблюдения не отмечено ни одного локального рецидива заболевания.
Косметические результаты операции в отдаленные сроки были хорошими во всех наблюдениях (рис. 3).
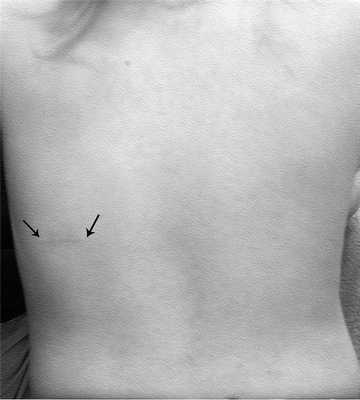
Рис. 3. Косметический результат через 1 год после операции у девочки 1,5 года.
Группа авторов из РОНЦ АМН сообщала о торакоскопическом удалении нейрогенных опухолей у 13 пациентов [6]. Показаниями к выбору эндохирургического метода лечения, как и в нашей группе наблюдений, были небольшой размер опухоли и отсутствие диагностических критериев хирургического риска. В своей работе авторы отмечают возможность комбинированного использования эндоскопического и открытого доступа при лечении нейробластом сложной анатомической локализации.
Особо обсуждается возможность комбинированного хирургического лечения при прорастании опухоли в спинномозговой канал. Показания к удалению опухоли в позвоночном канале возникают лишь в том случае, если существуют клинические признаки сдавления спинного мозга новообразованием, резистентным к химиотерапевтическому лечению [1, 2]. В такой ситуации операцию выполняет нейрохирург. При удалении больше 90% опухоли остаточная часть может подвергаться самостоятельному регрессу в зависимости от генотипа и морфологического характера образования.
Гистологический характер опухоли очень важен для определения дальнейшей тактики лечения и наблюдения пациента. Стремление выполнить операцию из малоинвазивного доступа не должно нарушать общие принципы онкохирургии и ухудшать долгосрочный прогноз заболевания. Вопрос о возможности удаления солидных опухолей у детей с помощью эндоскопических операций до сих пор дискутируется. Однако при наличии доброкачественных нейрогенных опухолей и нейробластом низкого риска многие авторы считают, что эндоскопические операции должны быть рассмотрены как метод выбора [9, 18]. P. John и соавт. [16] проводили сравнение отдаленных результатов у детей с нейрогенными опухолями, оперированных с использованием открытого и торакоскопического доступов. Риск развития отдаленных метастазов в этих группах был одинаковым. Мы не выявили ни у одного ребенка локального рецидива или отдаленных метастазов.
Наши наблюдения показывают, что эндохирургические операции могут стать методом выбора в лечении детей с нейрогенными опухолями при отсутствии вовлечения магистральных сосудов в опухолевый процесс и при ограниченном объеме образования. Необходимо подчеркнуть, что хирургическое вмешательство является важным, но не всегда единственным компонентом лечения при нейрогенных опухолях у детей. Выбор тактики лечения, необходимость и объем послеоперационной химиотерапии, регулярность катамнестического наблюдения должны быть определены совместно онкологами и хирургами на основании общепринятых протоколов лечения больных с этой опухолью.
Авторы благодарят д.м.н. Н.В. Мякову и других сотрудников ФНКЦ ДГОИ им. Дмитрия Рогачева (Москва), участвовавших в подготовке этого материала.
Метастазы в позвоночник
Метастазы в позвоночник - вторичное злокачественное поражение позвоночного столба, возникающее при миграции опухолевых клеток из очага, расположенного в другом органе. Проявляются болями, нарушениями чувствительности и движений, парезами, параличами, тазовыми расстройствами, гиперкальциемией и патологическими переломами. Диагноз «метастазы в позвоночник» устанавливают с учетом анамнеза, общего и неврологического осмотра, рентгенографии позвоночника, КТ позвоночника и других диагностических процедур. Лечение - химиопрепараты, радиотерапия, гормональная терапия, ламинэктомия, стабилизирующая операция.

Общие сведения
Метастазы в позвоночник - вторичные очаги злокачественной опухоли другой локализации, поражающие позвонки и близлежащие анатомические структуры. Являются самым распространенным вторичным злокачественным поражением скелета. Составляют 13% от общего количества онкологических заболеваний. Встречаются чаще первичных неоплазий позвоночного столба. В 80% случаев метастазы в позвоночник диагностируются при раке легких, раке молочной железы и предстательной железы. Нередко обнаруживаются при саркомах и лимфомах. Может поражаться любой отдел позвоночника. Чаще страдают грудной и поясничный отделы, в шейном отделе метастазы в позвоночник выявляются относительно редко. Прогноз неблагоприятный. Лечение проводят специалисты в сфере онкологии и вертебрологии.
Классификация метастазов в позвоночник
С учетом характерных изменений костного вещества выделяют два вида метастазов в позвоночник:
- Остеолитические (остеокластические) вторичные очаги - характеризуются преимущественной активизацией остеокластов, растворяющих костную ткань. Сопровождаются видимым на рентгенограммах снижением высоты позвонков.
- Остеобластические (остеосклеротические) метастазы в позвоночник - характеризуются бесконтрольным разрастанием и увеличением плотности костной ткани. На рентгенограммах проявляются «пятнистостью», изменением формы и увеличением объема пораженной кости. Наряду с телами в процесс могут вовлекаться дуги и отростки позвонков.
Морфологическая структура метастазов в позвоночник отличается большой вариабельностью и зависит от типа первичной неоплазии. В процессе гистологического исследования могут выявляться высоко- средне- и низкодифференцированные и анапластические карциномы, плоскоклеточный рак и прочие типы злокачественных новообразований.
Симптомы метастазов в позвоночник
Первым проявлением обычно становится болевой синдром. Боли чаще тупые, ноющие, локальные либо распространяющиеся за пределы уровня поражения. Неинтенсивные боли при метастазах в позвоночник могут напоминать аналогичный симптом при остеохондрозе, однако отличаются от него большей стойкостью и быстрым прогрессированием. На ранних этапах болезненность при метастазах в позвоночник может быть незначительной, провоцироваться постукиванием по позвонкам, поворотами шеи или подъемом выпрямленной нижней конечности.
В последующем боли становятся постоянными, сохраняются в покое. Типичной особенностью метастазов в позвоночник являются ночные боли. Возможна стойкая локальная болезненность, на фоне которых возникает ощущение «ударов током» при движениях. Места «ударов» совпадают с проекцией корешков. При метастазах в позвоночник в области шеи боли иррадиируют в верхние конечности, при поражении грудного отдела опоясывают туловище, при локализации в поясничном либо крестцовом отделе отдают в нижние конечности.
При прогрессировании процесса возникают корешковые расстройства в виде пояснично-крестцового либо шейно-плечевого радикулита. В ходе неврологического осмотра у больных с метастазами в позвоночник выявляются положительные симптомы Нери, Ласега, посадки Минора и т. д. У некоторых пациентов определяются расстройства болевой чувствительности по корешковому типу. Для корешковых болей при метастазах в позвоночник характерна определенная цикличность: на начальном этапе поражения очередного корешка интенсивность болевого синдрома нарастает, после его полного разрушения исчезает, чтобы затем появиться вновь при распространении на следующий корешок.
У больных с метастазами в позвоночник обнаруживаются полиневропатии в виде парестезий, снижения чувствительности по типу чулок и перчаток, гипергидроза и покраснения дистальных отделов конечностей. Парезы и параличи при метастазах в позвоночник развиваются внезапно либо постепенно. Наблюдаются нарушения движений и чувствительности в сочетании с тазовыми расстройствами. Особенности клинической картины определяются уровнем поражения, скоростью прогрессирования компрессии, расположением метастаза по отношению к спинному мозгу и особенностями кровоснабжения пораженной зоны. Синдром Броун-Секара при метастазах в позвоночник встречается редко.
При усиленной резорбции костной ткани может развиваться гиперкальциемия, проявляющаяся сонливостью, заторможенностью, эмоциональной лабильностью, ухудшением памяти, когнитивными расстройствами, мышечно-суставными болями, ухудшением аппетита, нарушениями пищеварения, аритмией, повышением артериального давления, кожным зудом и другими симптомами. Гиперкальциемические расстройства усугубляют состояние больного. Наряду с перечисленными выше проявлениями, вызванными метастазами в позвоночник, у пациента могут выявляться симптомы, обусловленные первичной неоплазией и метастазами, расположенными за пределами позвоночного столба.
Диагностика метастазов в позвоночник
Диагноз выставляется с учетом истории болезни, клинических проявлений и дополнительного обследования. При изучении анамнеза обращают внимание на наличие злокачественных опухолей, способных к метастазированию в область позвоночного столба. При этом онкологи учитывают, что симптомы метастазов в позвоночник могут возникать как одновременно или почти одновременно с проявлениями первичной неоплазии, так и через несколько месяцев либо даже лет после ее радикального лечения. Отсутствие в анамнезе онкологического заболевания не является поводом для исключения метастазов в позвоночник. Иногда определить локализацию первичного процесса не удается, несмотря на проведение комплексного обследования пациента.
О наличии онкологического заболевания свидетельствует положительный анализ крови на онкомаркеры. На начальном этапе диагностики больным с подозрением на метастазы в позвоночник назначают рентгенографию позвоночника. На ранних стадиях метастазирования рентгенологические признаки поражения позвонков могут отсутствовать, поэтому при отрицательном результате исследования пациентов с подозрением на метастазы в позвоночник направляют на сцинтиграфию, КТ и МРТ позвоночника. Для выявления первичной неоплазии и вторичных очагов проводят УЗИ органов брюшной полости, рентгенографию органов грудной клетки, маммографию и другие диагностические процедуры. Дифференциальную диагностику метастазов в позвоночник осуществляют с сосудистыми поражениями, последствиями воспалительных заболеваний, вторичной демиелинизацией и первичными неоплазиями позвоночного столба.
Лечение метастазов в позвоночник
План лечения определяется типом и распространенностью первичного новообразования, общим состоянием пациента, объемом и проявлениями метастазов в позвоночник. Основными целями терапии являются уменьшение болевого синдрома, предотвращение или устранение сдавления спинного мозга, улучшение качества и увеличение продолжительности жизни пациентов. В процессе лечения метастазов в позвоночник используются химиопрепараты, дифосфонаты, лучевая терапия, гормональная терапия и оперативные вмешательства.
Решение о необходимости химио- и радиотерапии при метастазах в позвоночник принимают с учетом чувствительности первичной опухоли. При гормонально зависимых неоплазиях осуществляют гормональную терапию. Для подавления резорбции кости и устранения гиперкальциемии назначают дифосфонаты. Хирургические вмешательства при метастазах в позвоночник обычно носят паллиативный характер. Показаниями к операции являются интенсивные боли, прогрессирующее сдавление спинного мозга, острый корешковый синдром при нестабильности позвоночника и патологический перелом пораженного позвонка со сдавлением спинного мозга. Объем вмешательства зависит от состояния больного с метастазами в позвоночник, прогноза заболевания, типа неоплазии и распространенности поражения в области позвоночного столба. Все операции при метастазах в позвоночник можно разделить на две группы: декомпрессивные и декомпрессивно-стабилизирующие.
Декомпресивные операции (ламинэктомии) относительно просты и легче переносятся больными. Их основным недостатком является высокая вероятность повторного ухудшения состояния пациентов вследствие прогрессирования метастазов и нестабильности позвоночного столба, обусловленной ламинэктомией. Декомпрессивно-стабилизирующие операции (с использованием фиксаторов, имплантатов, ауто- и аллотрансплантатов) позволяют рано активизировать больных, обеспечивают долговременный эффект и существенно улучшают качество жизни пациентов с метастазами в позвоночник. Основными недостатками таких вмешательств являются их высокая травматичность, невозможность проведения при тяжелом состоянии и диссеминированных процессах.
Прогноз при метастазах в позвоночник
Метастазы в позвоночник возникают при IV стадии онкологического процесса, которая считается прогностически неблагоприятной. Вместе с тем, метастазы в кости протекают достаточно благоприятно в сравнении с вторичными поражениями висцеральных органов. Средняя продолжительность жизни при метастазах в позвоночник составляет от 1 до 2 лет. В качестве неблагоприятных прогностических факторов рассматривают быстрый агрессивный рост первичной неоплазии, множественные метастатические поражения различных органов, непродолжительный период времени между терапией первичного новообразования и возникновением метастазов в позвоночник, большой размер метастатической опухоли, отсутствие признаков склероза на рентгенограммах позвонков до и после терапии, тяжелое состояние пациента. Благоприятными прогностическими факторами являются медленный рост первичной опухоли, одиночный характер метастазов в позвоночник, небольшой размер вторичной неоплазии, наличие признаков склероза на рентгенограммах до и после терапии, удовлетворительное состояние больного.
Ганглионеврома ( ганглиома , ганглионарная неврома , ганглиоцитома )
Ганглионеврома (ганглиома, ганглионарная неврома, ганглиоцитома) — доброкачественная опухоль, сформированная из элементов симпатических нервных узлов (ганглиев). Ганглионеврома может иметь самую разную локализацию. Наиболее часто она связана с различными отделами позвоночника, может располагаться в головном мозге, реже — в надпочечниках, желудочно-кишечном тракте, коже, стенке мочевого пузыря. Клинические симптомы, которыми проявляется ганглионеврома, не имеют специфики и зависят от расположения опухоли. Диагностика осуществляется в основном методами компьютерной и магнитно-резонансной томографии, а также путем гистологического исследования биопсийного образца тканей опухоли. Лечение ганглионевромы возможно только хирургическим путем.
МКБ-10

Ганглионеврома представляет собой плотно-эластический узел, не имеющий отчетливо выраженной капсулы. Форма узла может быть неправильной или округлой. На разрезе ганглионеврома имеет дольчатое или волокнистое строение; характерна белесовато-серая окраска опухоли. Микроскопически ганглионеврома состоит из нервных волокон, ганглиозных клеток и волокон соединительной ткани. Соотношение структурных элементов ганглионевромы может быть весьма разным. Так, ганглиозные клетки могут быть единичными в препарате, а могут присутствовать в большом количестве; количество соединительнотканных волокон бывает и значительным, и минимальным; нервные волокна чаще безмякотного типа, но встречаются ганглионевромы, в состав которых входят миелиновые нервные волокна.
Причины возникновения ганглионевромы
В современной неврологии на первый план выходит мнение, что ганглионеврома возникает в результате нарушений, происходящих во внутриутробном периоде при закладке симпатической нервной системы. Это предположение подтверждается частым наличием у пациентов с ганглионевромой других врожденных пороков (аномалий развития позвоночника, волчьей пасти, заячьей губы, врожденной базилярной импрессии, ассимиляции атланта, аномалии Кимерли и др.).
Вероятно факторами, способствующими образованию ганглионевромы, являются неблагоприятные воздействия на организм матери и плода. Это не только радиоактивное облучение, но и различные инфекции (краснуха, цитомегаловирус, корь, сифилис, хламидиоз и пр.), интоксикации (алкоголем, наркотическими веществами, химикатами), хронические заболевания матери, приводящие к гипоксии плода.
Классификация ганглионевромы
В зависимости от локализации процесса выделяют следующие виды опухолей: ганглионевромы головного мозга, ганглионевромы симпатического нервного ствола, ганглионевромы надпочечников и ганглионевромы прочей локализации (кожа, мочевой пузырь, стенка желудка или кишечника). Существенное клиническое значение имеет деление ганглионевром на зрелые и созревающие, из которых первые имеют более благоприятный прогноз.
Симптомы ганглионевромы
Более, чем в 50% случаев ганглионеврома обнаруживается у лиц моложе 20 лет. По некоторым данным эта опухоль чаще поражает лиц женского пола. Клинические проявления ганглионевромы зависят от ее местонахождения, размеров и распространения в соседствующие с ней анатомические структуры.
Наиболее часто ганглионевромы берут свое начало из клеток симпатического ствола на уровне различных отделов позвоночника. При этом в зависимости от уровня расположения опухоль распространяется в позвоночный канал и кзади — в заднее средостение, забрюшинное пространство или клетчатку малого таза. Реже встречаются опухоли шейного отдела. Ганглионеврома, прорастающая в позвоночник, имеет вид песочных часов, поскольку она состоит из двух узлов, один из которых расположен паравертебрально, а второй — в позвоночном канале. Клинически такая опухоль проявляется симптомами сдавления спинного мозга, а при прорастании в него — неспецифической клиникой опухоли спинного мозга. Ганглионеврома отличается медленным ростом, что при локализации в забрюшинном пространстве позволяет ей достигать огромных размеров, не вызывая никаких клинических симптомов.
Ганглионеврома головного мозга чаще носит название ганглиоцитома. На ее долю приходится от 0,1 до 0,4 % всех опухолей внутричерепной локализации. Опухоль может локализоваться в любом отделе головного мозга, но наиболее часто встречаются ганглионевромы дна III желудочка, гипоталамуса, подкорковых структур, височной и лобной долей, а также диффузная ганглионеврома коры мозжечка. Как правило, ганглиоцитома имеет размер не более 3-4 см, характеризуется медленным ростом и полным отсутствием капсулы. Такая опухоль может в виде выростов распространяться в ткань мозга и прорастать мозговые оболочки. Ганглионеврома головного мозга не имеет специфических симптомов. Как и другие внутримозговые опухоли ганглионеврома проявляется общемозговыми и очаговыми симптомами, соответствующими ее расположению. Внутримозговая ганглионеврома может претерпевать бластоматозную трансформацию, перерождаясь в злокачественную нейробластому (ганглионейробластому).
В редких случаях ганглионеврома имеет органную локализацию. Она может поражать надпочечники, органы ЖКТ, мочевой пузырь. При этом отмечается клиническая картина, характерная соответственно для опухолей надпочечников, опухоли желудка, пищевода или тонкого кишечника, доброкачественной опухоли мочевого пузыря.
Диагностика ганглионевромы
Характерный медленный рост приводит к длительному бессимптомному развитию ганглионевромы и затрудняет ее своевременную диагностику. В некоторых случаях она является случайной находкой при обследовании пациента. Так, при рентгенографии позвоночника или органов грудной клетки ганглионеврома может визуализироваться как примыкающее к позвоночнику однородное затемнение округлой формы. В случае опухоли большого размера может наблюдаться симптом «раздвигания ребер» и появления на них «узур» (вдавлений), обусловленных постоянным давлением опухоли. При озлокачествлении ганглионевромы рентгенологически определяются деструктивные изменения расположенных рядом с ней позвонков и ребер.
Широкий диапазон локализации ганглионевромы способствует тому, что с ней в своей практике сталкиваются не только неврологи, но и вертебрологи, гастроэнтерологи, эндокринологи, урологи и др. специалисты. Клинически заподозрить опухоль невролог может по результатам неврологического обследования пациента. Для подтверждения диагноза в зависимости от расположения опухоли необходимо проведение МРТ или КТ позвоночника, КТ грудной клетки и средостения, МРТ головного мозга. Подтвердить диагноз опухолевого образования и верифицировать его как ганглионеврому возможно только при гистологическом исследовании образца ткани, который получают в ходе пункционной биопсии позвонка или стереотаксической биопсии головного мозга.
Лечение ганглионевромы
В отношении ганглионевромы возможно только хирургическое лечение. Оно проводится в соответствии с принципами операций на позвоночнике и оперативных вмешательств при опухолях головного мозга. Сложность радикального удаления опухоли заключается в том, что она зачастую имеет значительные размеры и располагается в жизненно важных структурах ЦНС, оперативное вмешательство на которых сопряжено с опасностью для жизни оперируемого. Возможность проведения операции и ее объем рассматривается нейрохирургом индивидуально в каждом конкретном случае.
Полное удаление опухоли типа «песочных часов» зачастую требует двух хирургических доступов: ламинэктомии и вскрытия грудной или брюшной полости. Подобная операция может потребовать участия не только нейрохирургов, но и торакальных хирургов. Радикальное удаление интрамедуллярной опухоли часто не представляется возможным. В таких случаях ганглионеврома удаляется частично, производится декомпрессия спинного мозга и восстановление ликвороциркуляции.
Удаление ганглионевромы головного мозга часто представляет собой паллиативное вмешательство с частичным удалением опухоли из-за ее больших размеров и значительного распространения в мозговой ткани. При невозможности полного удаления вентрикулярных опухолей хирургическое вмешательство дополняют шунтирующей операцией — вентрикулоперитонеальным шунтированием или наружным вентрикулярным дренированием. После удаления ганглионевромы проводится обязательное гистологическое исследование опухоли для исключения ее трансформации в ганглионейробластому.
Прогноз ганглионевромы
Зрелые ганглионевромы небольших размеров, успешно удаляемые хирургическим путем, имеют благоприятный прогноз, хотя в некоторых случаях наблюдается их рецидивирование. Опухоли больших размеров и созревающие ганглионевромы прогностически менее благоприятны. Худший прогноз как для выздоровления, так и для жизни, имеют опухоли с бластоматозным перерождением.
Нейрохирургическое отделение
Нейрохирургическое отделение НЦН является «колыбелью» стереотаксической и функциональной нейрохирургии в нашей стране.
Сотрудниками отделения внесен крупнейший вклад в разработку методов хирургического лечения паркинсонизма, дистонии и других тяжелых двигательных расстройств, разработаны уникальные стереотаксические технологии клипирования аневризм и удаления внутримозговых гематом, позволившие более чем вдвое снизить послеоперационную летальность у данной тяжелой категории пациентов.
В отделении накоплен самый большой в стране опыт хирургической реваскуляризации мозга с помощью операции наложения экстра-интракраниального микроанастомоза. Получен ряд приоритетных результатов в области хирургической церебральной и спинальной нейромодуляции.
Сотрудники отделения являются пионерами во внедрении текалоскопии и других уникальных малоинвазивных эндоскопических и микрохирургических технологий оперативного лечения заболеваний ЦНС.
В стране и в мире отделение занимает лидирующие позиции по всем основным разделам современной спинальной нейрохирургии.
ГРУППА СОСУДИСТОЙ И ЭНДОВАСКУЛЯРНОЙ ХИРУРГИИ>>>
ГРУППА ЭНДОСКОПИЧЕСКОЙ И МИНИМАЛЬНО-ИНВАЗИВНОЙ ХИРУРГИИ>>>
XИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ ЭПИЛЕПСИИ>>>
ОСНОВНЫЕ НАПРАВЛЕНИЯ НАУЧНОЙ И КЛИНИЧЕСКОЙ ДЕЯТЕЛЬНОСТИ:
- Опухоли головного мозга, арахноидальные кисты
- Аномалии развития (н., аномалия Арнольда-Киари)
- Нарушения циркуляции спинномозговой жидкости (н., гидроцефалия)
- Невралгия тройничного и подъязычного нервов, гемифациальный спазм, болезнь Меньера (при нейроваскулярных конфликтах)
- Сосудистые патологии головного мозга (н., аневризмы, артериовенозные мальформации, кавернозные ангиомы)
- Внутричерепные кровоизлияния (н., эпидуральные, субдуральные, субарахноидальные, внутримозговые кровоизлияния)
- нейромодуляция при дистонии
- нейромодуляция при болезни Паркинсона
- эпидуральная стимуляция при синдроме оперированного позвоночника
- эпидуральная стимуляция при спастических синдромах
- селективная ризотомия
- эндоскопические операции при грыжах межпозвонковых дисков всех отделов позвоночника
- шейная эндоскопическая дискэктомия
- торакоскопическая трехмерная дискэктомия
- портальная поясничная минимально-инвазивная дискэктомия
- трансфораминальные эндоскопические доступы на всех отделах позвоночника
- радиочастостная деструкция
- холодно-плазменная нуклеопластика
- текалоскопия
- вентрикулоскопия
- фенестрация арахноидальных кист
- эндоскопические и микрохирургические операции по поводу туннельных синдромов с нейрофизиологическим мониторингом и УЗИ навигацией
- по поводу опухолей периферических нервов
- по поводу травматических повреждений периферических нервов
Баклофеновая помпа - инновационный метод лечения тяжелых спастических синдромов.
- Гаспарян Т.Г. Опухоли хондроидного ряда краниофациального распространения: клиника, диагностика и результаты лечения. Дисс. . канд. мед. наук; 2014
- Копачев Д.Н. Стентирование желудочковой системы в хирургии глубинных опухолей головного мозга. Дисс. . канд. мед. наук; 2012
- Гуща А.О. Диагностика и лечение компрессионных синдромов на уровне шейного отдела позвоночника. Дисс. . докт. мед. наук; 2007
- Арестов С.О. Эндоскопическая нейрохирургия при лечении грыж межпозвонковых дисков грудного и пояснично-крестцового отела позвоночника. Дисс. . канд. мед. наук; 2006
- Тюрников В.М. Катамнез комбинированного (медикаментозного и хирургического) лечения больных паркинсонизмом. Дисс. . канд. мед. наук; 1998
- Под. ред. Гущи А.О., Коновалова Н.А., Гриня А.А. Хирургия дегенеративных поражений позвоночника. Национальное руководство.М.: ГЭОТАР-Медиа, 2019, 480 с.
- Исагулян Э.Д., Томский А.А., Шабалов В.А., Гуща А.О., Древаль О.Н., Коновалов Н.А., Кащеев А.А., Дорохов Е.В., Зайцев А.М., Кирсанова О.Н. Хирургическое лечение хронического нейропатического болевого синдрома. Клинические рекомендации. Реалграфика М. 2016. 47 с.
- Грачев Ю.В., Тюрников В.М. Непароксизмальная тригеминальная боль. Краткое практическое руководство для неврологов, стоматологов и врачей общей практики. М.: 2009
№ 2615905, 27.04.2016. Способ декомпрессии срединного нерва при карпальном туннельном синдроме. Авторы: Гуща А.О., Вершинин А.В., Арестов С.О., Супонева Н.А., Белова Н.В., Вуйцик Н.Б., Низаметдинова Д.М.
Пример торакоскопической операции на грудном отделе позвоночника при опухоли (ганглионевроме)
Московский научно-исследовательский онкологический институт им. П.А. Герцена Росмедтехнологий
Хирургическое лечение при солитарном поражении позвоночного столба
Журнал: Онкология. Журнал им. П.А. Герцена. 2017;6(1): 12‑18
Цель — улучшить результаты лечения пациентов с солитарным опухолевым поражением позвоночника. Материал и методы. За период с 2006 по 2016 г. по поводу опухолевого поражения позвоночника хирургическое лечение выполнено 221 пациенту, из них 29 (13%) пациентам онкохирургическое пособие выполнено с эндопротезированием. Болевой синдром в позвоночнике был у большинства — 26 (90%) пациентов. Операции у 19 (65,5%) больных выполнены в объеме корпорэктомии и у 10 (34,5%) — вертебрэктомии с различными вариантами стабилизации. Результаты. Уменьшение болевого синдрома и улучшение качества жизни отмечены у 80—86% пациентов, улучшение неврологического статуса после хирургического лечения наступило у 89% пациентов. Вывод. Солитарное метастатическое поражение позвоночного столба является показанием к проведению расширенного оперативного вмешательства, которое позволяет улучшить качество жизни пациентов, их функциональный статус, купирует болевой синдром и клинику неврологического дефицита, не влияя на сроки проведения специального лечения.
Позвоночник является одной из основных локализаций костных метастазов. По данным ряда авторов, частота его поражения может достигать 70%. При этом первичные доброкачественные и злокачественные опухоли позвоночника диагностируются у 1—3%, а метастатические опухоли — у 96% пациентов [1—4]. Наиболее распространенные типы опухолей, которые метастазируют в позвоночник, — рак молочной железы, легких и предстательной железы [5, 6].
Ключевой и основополагающей проблемой этой категории больных является выраженный болевой синдром, обусловленный компрессией опухолью нервных корешков, либо состоявшийся патологический перелом тела позвонка с развитием компрессионного и болевого синдрома различной степени выраженности и, как следствие, значительным снижением качества жизни [7—9].
До недавнего времени пациенты с метастазами в костях, и в частности с поражением позвоночника, были прикованы к постели и получали только симптоматическое лечение. В настоящее время благодаря совершенствованию анестезиологического пособия, разработке новых методик реконструкции и стабилизации позвоночника стало возможным проводить не только паллиативную химио- и лучевую терапию, но и хирургическое лечение этой группе пациентов.
Хирургическое лечение при опухолевом поражении позвоночника возможно как в «радикальном» объеме при солитарном поражении, когда удаляется весь пораженный сегмент позвоночного столба (корпор-, вертебрэктомия) и производятся различные виды реконструкции и стабилизации, так и с паллиативной целью (декомпрессивная ламинэктомия, вертебро-, кифопластика) в случае множественного метастатического поражения.
Вышеизложенное позволяет расширить показания к видам хирургического лечения в вертебральной онкологии и тем самым добиться улучшения качества жизни, значительно сократить сроки реабилитации и продолжить специализированное противоопухолевое лечение пациентам с вторичными изменениями позвоночника.
В этой статье мы хотели привести свой опыт хирургического лечения пациентов с солитарным опухолевым поражением позвоночника, которым выполнялось радикальное удаление опухоли с последующим эндопротезированием удаленного сегмента позвоночника.
За период с 2006 по 2016 г. по поводу опухолевого поражения позвоночника хирургическое лечение выполнено 221 пациенту, из них 29 (13%) пациентам онкохирургическое вмешательство выполнено с эндопротезированием тел позвонков. Показанием для корпор- и/или вертебрэктомии с эндопротезированием у 22 (10%) пациентов явилось солитарное метастатическое поражение и у 7 (3%) пациентов — первичный опухолевый процесс. Мужчин было 12 (41%), женщин — 17 (59%). Средний возраст пациентов составил 51 год (от 27 до 64 лет).
Всем больным проводилось полное клиническое обследование по диагностическом алгоритму, включающему оценку общего состояния, степени костной и висцеральной диссеминации, неврологического статуса (по шкале Frankel), уровня качества жизни (по шкале Karnofski) и интенсивности болевого синдрома (по шкале Watkins).
Морфологические формы опухолей представлены в табл. 1.
![]()
Таблица 1. Морфологические формы опухоли
Наиболее часто встречалось метастатическое поражение при раке молочной железы — 10 (34%) больных, почки — 7 (24%) больных. Из первичных опухолей наиболее часто встречались гигантоклеточные опухоли — 4 (14%) больных.
Болевой синдром в позвоночнике был у большинства — 26 (90%) пациентов. Средняя продолжительность болевого синдрома в позвоночнике составила 3,9 мес (от 0,5 до 12) от момента появления болей до хирургического лечения.
Угроза патологического перелома позвоночника вследствие его поражения выявлена у 18 (62%) пациентов, а состоявшийся патологический перелом — у 11 (38%) больных. Компрессия спинного мозга костными отломками позвонка или интраканальным мягкотканым компонентом, исходящим из пораженного сегмента, была у 10 (34%) больных.
Неврологический дефицит, связанный с компрессией спинного мозга, диагностирован у 9 (31%) пациентов. Данные о степени неврологического дефицита больных представлены в табл. 2.
![]()
Таблица 2. Степень неврологического дефицита у больных с метастатическими опухолями позвоночника по шкале Frankel
Оценка качества жизни пациентов определялась по шкале Karnofski. В табл. 3 представлены данные до хирургического лечения. Незначительное снижение качества жизни пациентов (Karnofski 80—90%) отмечались у 8 (28%) пациентов. 12 (41%) больных до операции могли самостоятельно обслуживать себя (Karnofski 60—70%). 9 (31%) пациентов нуждались в постоянной посторонней помощи (Karnofski <50%).
Таблица 3. Оценка качества жизни больных по шкале Karnofski до лечения
Болевой синдром значительной степени выраженности (Watkins 3—4 балла) был у 8 (28%) больных. У 21 (72%) пациента отмечались умеренные проявления болевого синдрома (Watkins 1—2 балла). Клиника болевого синдрома в этой группе представлена в табл. 4.
![]()
Таблица 4. Оценка болевого синдрома у больных с метастатическими опухолями позвоночника по шкале R. Watkins
Хирургическое вмешательство на шейном отделе позвоночника выполнено у 12 (41%) пациентов, на грудном — у 10 (35%) и поясничном — у 7 (24%) больных.
Операции у 19 (65,5%) больных выполнены в объеме корпорэктомии и у 10 (34,5%) — вертебрэктомии с различными вариантами стабилизации. Среднее время операции составило 160 мин (от 90 до 300). Средняя кровопотеря 1200 мл (от 300 до 6000). Для сокращения интраоперационной кровопотери пациентам с метастазами в позвоночнике гиперваскуляризированных опухолей (рак щитовидной железы, рак почки) в предоперационном периоде выполнялась эмболизация сосудов, кровоснабжающих опухолевый очаг. Во время выполнения основного этапа хирургического лечения на грудном и поясничном отделах позвоночника производилась реинфузия крови при помощи аппарата «cell saver».
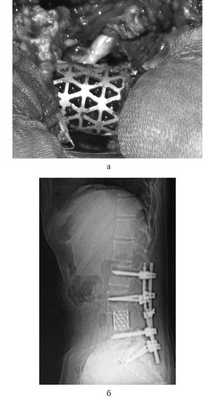
Для замещения удаленных позвонков у 8 (28%) больных применен сетчатый титановый протез «MASH» (рис. 1), который использовался нами с 2006 по 2010 г. Телескопическая система эндопротезирования, которая использовалась с 2010 по 2016 г., применена у 21 (72%) пациента (рис. 2). Спондилодез при помощи пластин выполнен у 19 (65,5%) больных, комбинированная стабилизация (титановые винты и пластины) — у 10 (34,5%) пациентов.
![]()
Рис. 1. Вертебрэктомия позвонка LIV с замещением дефекта сетчатым эндопротезом тела позвонка системой «MASH» и транспедикулярной фиксацией. а — интраоперационная фотография; б — послеоперационная рентгенограмма поясничного отдела позвоночника.
![]()
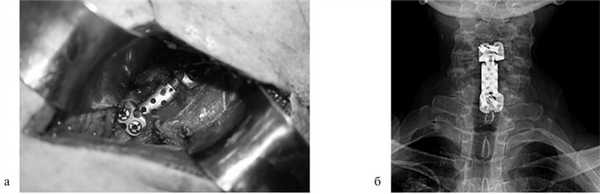
Рис. 2. Корпорэктомия позвонка СV с замещением дефекта раздвижным эндопротезом тела позвонка. а — интраоперационная фотография; б — послеоперационная рентгенограмма шейного отдела позвоночника.
Клинический пример
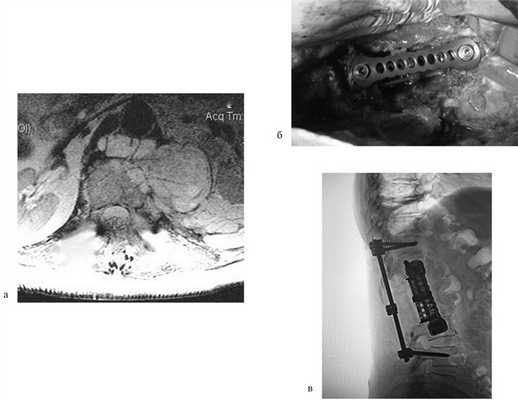
Пациентка Н., 69 лет, поступила в апреле 2016 г. в отделение онкоортопедии МНИОИ им. П.А. Герцена с диагнозом хондросаркома позвонка LII T3N0M0 G1 III стадии. Пациентка самостоятельно не передвигалась из-за выраженного болевого синдрома в проекции поясничного отдела позвоночника. 3 балла по ECOG, 50 баллов по шкале Карновского и 3 балла по Watkins. Парапарез нижних конечностей до 2 баллов. В апреле 2016 г. 1-м этапом выполнена декомпрессивная ламинэктомия позвонков LI—II с задней стабилизацией на уровне позвонков ThXII—LIII. Послеоперационный период без осложнений. Далее в мае того же года выполнен 2-й этап хирургического лечения: корпорэктомия позвонков LI—II с эндопротезированием тел позвонков телескопическим эндопротезом (рис. 3). Пациентка выписана на 9-е сутки после операции, передвигалась самостоятельно без дополнительных средств опоры (1 балл по ECOG, 80 баллов по шкале Карновского, 1 балл по шкале Watkins), рекомендован динамический контроль онколога по месту жительства.
![]()
Рис. 3. МРТ-картина до хирургического лечения (а). Тело позвонка LII с признаками деструкции, структура его представлена опухолевой массой размером 87×57×67 мм. Интраоперационная фотография (б), боковой доступ. Установленный телескопический эндопротез тел позвонков LI—II c боковой фиксирующей пластиной. Послеоперационная рентгенограмма поясничного отдела позвоночника (в). Металлоконструкция установлена корректно. Исследование выполнено на 1-е сутки после хирургического лечения.
Результаты
Оценка качества жизни, неврологического статуса и болевого синдрома осуществлялась на 21-е сутки после операции.
Улучшение неврологического статуса после хирургического лечения из 9 пациентов наступило у 8 (89%), не изменился неврологический дефицит у 1 (11%) больного. Ухудшения неврологической симптоматики отмечено не было. Динамика изменения неврологического статуса представлена в табл. 5.
![]()
Таблица 5. Динамика изменения неврологического статуса больных после хирургического лечения (по шкале Frankel)
Динамика изменения качества жизни после хирургического лечения представлена в табл. 6. Улучшение качества жизни после хирургического лечения наступило у 24 (80%) больных, ухудшения не было, у 5 (20%) пациентов качество жизни осталось прежним.
![]()
Таблица 6. Динамика изменения качества жизни после хирургического лечения (по шкале Karnofski)
Динамика изменения болевого синдрома после хирургического лечения представлена в табл. 7. Уменьшение болевого синдрома после хирургического лечения отмечено у 25 (86%) больных, усиление болей отмечено не было, не изменилась интенсивность болевого синдрома у 4 (14%) больных.
![]()
Таблица 7. Динамика изменения болевого синдрома после хирургического лечения (по шкале Watkins)
Активизация пациентов после операции осуществлялась на 2—3-и сутки после операции при помощи дополнительных средств опоры и наружных средств фиксации (корсет). Средний срок наблюдения за пациентами составил 16 мес (от 6 до 54). За указанный срок наблюдения нестабильности металлоконструкции отмечено не было. В процессе наблюдения 12 пациентов умерли от прогрессирования основного заболевания в сроки от 6 до 24 мес.
У 12 пациентов в процессе наблюдения выявлен продолженный рост опухоли в области хирургического вмешательства в сроки от 6 до 12 мес после операции, что у 8 из них привело к рецидиву болевого синдрома.
Осложнений во время операции не встречалось. В послеоперационном периоде у 3 (10%) пациентов диагностировано осложнение в виде ликвореи. У двух пациентов оно купировано на 6—7-е сутки после установки люмбального дренажа (консервативно). Одной пациентке потребовались ревизия послеоперационной раны и ушивание дефекта твердой мозговой оболочки, после чего явление ликвореи было купировано.
В лечении пациентов с опухолевым поражением позвоночника преобладает комбинированный метод с включением лекарственной терапии (химио-, гормоно-, иммунотерапия, таргерная терапия), лучевой терапии и хирургического лечения. Ведущее место в лечении занимает хирургический метод, направленный не только на удаление опухолевого очага, но и улучшение качества жизни пациентов [2, 10].
Большинство авторов, выполняя декомпрессивно-стабилизирующие операции, рассматривают только варианты заднего доступа как наименее травматичного [9, 11]. По нашему мнению, в случае множественной диссеминации опухоли и наличия компрессии спинного мозга на одном из уровней эти операции являются наиболее целесообразными, так как позволяют улучшить качество жизни менее травматичным методом. При отсутствии компрессии структур спинного мозга ведущую роль отводят малоинвазивным вмешательствам, таким как вертебропластика. Она позволяет предотвратить патологический перелом позвонка и в короткие сроки уменьшить болевой синдром [12, 13].
Qiang Yang и соавт. [15] в период с 2007 по 2011 г. выполнили 18 операций в объеме удаления тел позвонков с эндопротезированием системой «MASH», заполненной костным цементом. Продолжительность операций составила в среднем 450 мин (от 340 до 610), кровопотеря — 4850 мл (от 3000 до 10 200). Серьезных послеоперационных осложнений не было. Значительное улучшение неврологического статуса в послеоперационном периоде отмечалось у 14 (90%) пациентов.
Учитывая собственный опыт и данные зарубежной литературы, следует отметить, что выполнение расширенных хирургических вмешательств в радикальном варианте (корпор-, вертебрэктомия) с эндопротезированием тел удаленных позвонков целесообразно при солитарном опухолевом поражении позвоночника, так как связано с высоким риском интра- и/или послеоперационных осложнений. Несмотря на то что нам пока не удается достичь хороших онкологических результатов и риск рецидива или продолженного роста опухоли еще очень велик (у 12 (40%) пациентов в процессе наблюдения выявлен рецидив или продолженный рост опухоли), выполнение открытых оперативных вмешательств в объеме корпорэктомии с различными видами замещения образовавшегося дефекта, направленных на удаление опухоли и декомпрессии спинного мозга, оправдано. Уменьшение болевого синдрома и улучшение качества жизни отмечено у 80—86% пациентов, улучшение неврологического статуса после хирургического лечения наступило у 89% пациентов, что позволило этой сложной категории пациентов продолжить противоопухолевую терапию.
Дополнительными специальными методами лечения опухолевого поражения позвоночника можно считать лучевую и системную лекарственную терапию. Однако ни один из этих методов не дает гарантий полной иррадикации опухоли пораженного сегмента [16—18]. У 17 из 29 прооперированных пациентов не получено данных, подтверждающих рецидив или продолженный рост опухоли в зоне операции. Из них 7 пациентов умерли от прогрессирования заболевания (метастатическое поражение легких и/или печени), однако у них сохранялся высокий уровень качества жизни, отсутствовали болевой синдром и неврологические нарушения.
В настоящее время хирургическое лечение злокачественных опухолей позвоночника может рассматриваться исключительно как этап комбинированного противоопухолевого лечения, включающий лучевую терапию и различные виды лекарственного лечения (химио-, гормоно-, иммунотерапия, таргетная терапия). Все пациенты с солитарным метастатическим поражением позвоночника, которым было произведено хирургическое лечение, в пред- и послеоперационном периоде получали противоопухолевое лечение, и, безусловно, на представленном небольшом материале невозможно достоверно оценить влияние этого объема хирургического вмешательства на онкологические результаты.
В процессе накопления опыта объем кровопотери, продолжительность и травматичность операций значительно уменьшились. Мы не подвергали анализу различия в применении того или иного вида имплантата, так как объем исследования достаточно мал, а травматичность и эффективность хирургического вмешательства в первую очередь связаны с объемом опухолевого поражения, степенью его кровоснабжения, оснащенностью специализированной медицинской аппаратурой учреждения и опытом хирургической бригады.
Количество осложнений (10%) соответствует данным ведущих зарубежных клиник, занимающихся хирургическим лечением опухолевого поражения позвоночника. Избежать большинства осложнений позволяет правильный выбор тактики ведения пациента и объема оперативного вмешательства с учетом гистологической структуры опухоли, степени ее распространенности и соматического состояния пациента [2, 19].
Заключение
Солитарное метастатическое поражение позвоночного столба является показанием к проведению расширенного оперативного вмешательства, которое позволяет улучшить качество жизни пациентов, их функциональный статус, купировать болевой синдром и клинику неврологического дефицита и не препятствует срокам проведения специального лечения. Эндопротезирование тела позвонка после корпор- и/или вертебрэктомии по поводу опухолевого поражения позволяет адекватно стабилизировать пораженный сегмент позвоночника. При резекции передних и задних отделов позвонка, помимо переднебоковой стабилизации, должна применятся и транспедикулярная фиксация.
Продолжение разработок и внедрение в онкохирургию и, в частности, в онкологическую вертебрологию новых методов реконструкций позвоночника позволяет расширить показания и варианты хирургического лечения, направленного на улучшение качества жизни онкологических больных с опухолевым поражением позвоночника.
Читайте также: