Синдром Зелзера-Огдена (Zuelzer-Ogden) - синонимы, авторы, клиника
Добавил пользователь Валентин П. Обновлено: 22.01.2026
Zuelzer Wolf W. (род. 1909), американский педиатр; Kaplan Eugene, американский врач.
Зельцера-Каплана с. — наследственная несфероцитарная гемолитическая анемия (вероятно, аутосомно-рецессивное наследование): гемолитическая желтуха, гепато- и спленомегалия, изменения в костях, так называемые монголоидные черты лица. Кровь: нормохромная анемия, эритроциты нормо- или макроцитарные, слегка овалоцитарные, сфероциты не наблюдаются, осмотическая и механическая резистентность эритроцитов нормальна, продолжительность жизни эритроцитов укорочена. Тест Кумбса отрицателен. В костном мозге усиленный эритропоэз.
Синдром Zuelzer-Kaplan (II)
Синдром Kaplan-Zuelzer, haemoglobin C-thalassemia (англ.), thalassemia hemoglobin С disease (англ.)
Зельцера-Каплана с. — вероятно, наследственная гипохромная микроцитарная анемия (возможно, аутосомно-доминантное наследование): гипохромная, микроцитарная анемия с микросфероцитозом, умеренный сидероцитоз, фрагментоцитоз, картина белой крови и тромбоцитов нормальна, повышена максимальная осмотическая устойчивость эритроцитов. В костном мозге усиленный эритропоэз, нормобласты базофильно гранулированы.
Синдром Zuelzer-Ogden, anaemia megaloblastica
Zuelzer Wolf W. (род. 1909), американский педиатр; Ogden F. N., американский врач.
Зельцера-Огдена с. — мегалобластическая форма анемии: болезнь начинается постепенно в первые годы жизни с появления признаков инфекции дыхательного и пищеварительного трактов, нарастающая бледность. В крови — гиперхромная анемия, в периферической крови — мегалобласты. В костном мозге — мегалобластическая реакция, переходящая под действием фолиевой кислоты и витамина B12 в нормальный эритропоэз. Ахилия желудка реагирует на гистамин, признаки цинги.
Синдром Огдена - Ogden syndrome
Синдром Огдена, также известный как N-терминал ацетилтрансфераза дефицит (NATD), [1] является Х-связанный расстройство младенческого возраста, включающее отчетливую комбинацию отличительных черепно-лицевых особенностей, приводящую к старению, задержке роста, гипотония, глобальные задержки в развитии, крипторхизм, и спонтанный сердечные аритмии. Первая семья была идентифицирована в Огден, Юта, с пятью пораженными мальчиками в двух поколениях членов семьи. Мутация была идентифицирована как вариант c.109T> C (p.Ser37Pro) в NAA10, ген, кодирующий каталитическая субъединица главного человека N-концевая ацетилтрансфераза ферментная система (NatA ). Эта же мутация была обнаружена во второй неродственной семье, где в двух поколениях было трое больных мальчиков. Это тяжелое генетическое заболевание было условно названо синдромом Огдена, поскольку именно здесь проживает первая пострадавшая семья.
Содержание
Признаки и симптомы
Это заболевание, связанное с Х-хромосомой, поражает мужчин больше, чем женщин, и характеризуется послеродовой задержкой роста с задержкой развития и дисморфические особенности характеризуется морщинистым лбом, передним и задним роднички, выпуклые глаза, большие наклонные вниз глазные щели утолщенные или закрытые веки, большие уши, расширенные ноздри, гипоплазия крыльев носа, короткая колумелла, выступающая верхняя губа и микроретрогнатия. Также есть отложенное закрытие родничок, а также у мальчиков широкие большие пальцы ног. Кожа отличается избыточностью или дряблостью с минимальным подкожный жир, кожный капиллярные аномалии и очень тонкие волосы и брови. Смерть в результате кардиогенный шок после аритмии, что было отмечено у всех пострадавших. У мальчиков были нарушения сердечного ритма и черепно-лицевые аномалии, что объясняло их схожий внешний вид. Мальчики никогда не могли самостоятельно сесть, и никто не научился говорить. [2] Все они имели характерную старую внешность, за что получили семейное прозвище «старички». [2] У некоторых мальчиков были структурные аномалии сердца, в том числе дефект межжелудочковой перегородки, предсердие дефект перегородки, и стеноз легочной артерии. События, записанные на ЭКГ перед смертью включены torsades de pointes, преждевременное сокращение желудочков (ПВХ), преждевременное сокращение предсердий (PAC), суправентрикулярная тахикардия (SVtach) и вентрикулярная тахикардия (Втач). У большинства детей паховые грыжи, и большинство имело, по крайней мере, одностороннее крипторхизм. У всех был неонатальный гипотония прогрессирует к гипертония, и церебральная атрофия на МРТ; у нескольких, но не у всех, был нейрогенный сколиоз. Смерть наступила до 2 лет во всех случаях и до 1 года в большинстве. В исходной публикации приведены подробные клинические сведения о каждом ребенке.
Биохимия
Диагностика
Секвенирование всего экзома это окончательный диагностический метод, используемый для подтверждения ОС.
Паллиативная помощь - единственный вариант, поскольку болезнь неизлечима и, по всей видимости, всегда приводит к летальному исходу, когда смерть наступает в возрасте до трех лет.
История
У Халены Блэк родился ее первый сын, Кенни Рэй, в 1979 году. Поскольку он был ее первенцем, Блэк не заметил, что что-то не так. Кенни Рэй Блэк скончался в 1980 году, прямо перед своим первым днем рождения, и был первым известным младенцем, умершим от синдрома Огдена. [5] Однако на этом дело не закончилось. Халена Блэк продолжала иметь детей, и в 1987 году у нее родился следующий мальчик Хайрам. С самого начала Блэк заметил, что Хайрам имел те же характеристики, что и Кенни Рэй, но подумал, что это связано с тем, что они были братьями. Ей и в голову не приходило, что у них могло быть одно и то же заболевание. Как и Кенни Рэй, Хайрам скончался до своего первого дня рождения. Только до тех пор, пока дочери Блэка не стали иметь собственных детей, она поняла, что что-то не так. Сыновья, рожденные от дочерей Блэка, были идентичны ее собственным сыновьям, и именно тогда Халена обратилась за медицинской помощью. [5] Ответы пришли через тридцать лет после смерти Кенни Рэй. Синдром Огдена был обнаружен в 2011 году группой исследователей под руководством Голсона Дж. Лайона, в состав которой входили: Алан Ф. Роуп, Кай Ван, Руне Эвджент, Джинчуань Син, Дженнифер Дж. Джонстон, Джеффри Дж. Свенсен, У. Эван Джонсон, Барри Мур, Чад Д. Хафф, Линн М. Берд, Джон К. Кэри, Джон М. Опиц, Кэти А. Стивенс, Тао Цзян, Криста Шанк, Хайди Дебора Файн, Рид Дж. Робисон, и еще 10. Незадолго до того, как Лион собирался опубликовать свои выводы, с ним связалась другая группа, изучающая семью, живущую в основном в Калифорнии. Недавно найденная семья также потеряла трех маленьких мальчиков со схожими характеристиками. Эта новая семья имела ту же редкую мутацию, что и семья Блэков. Существование другой семьи сделало эту мутацию синдромом, а не чем-то изолированным. [2]
Синдром Туретта - симптомы и лечение
Что такое синдром Туретта? Причины возникновения, диагностику и методы лечения разберем в статье доктора Диордиева Максима Борисовича, психиатра со стажем в 8 лет.
Над статьей доктора Диордиева Максима Борисовича работали литературный редактор Вера Васина , научный редактор Владимир Вожжов и шеф-редактор Маргарита Тихонова

Определение болезни. Причины заболевания
Синдром Туретта (Tourette's syndrome) — это заболевание нервной системы, при котором возникают множественные двигательные и вокальные тики. Для постановки диагноза они должны присутствовать дольше года.

Впервые заболевание, похожее на синдром Туретта, было описано в 1486 году в книге «Молот ведьм». Там упоминался священник с моторными и вокальными тиками, считавшийся одержимым. В конце XIX века симптомы заболевания на примере нескольких пациентов описал вместе с коллегами французский невролог Жорж Жиль де ла Туретт, в честь которого и назван синдром [1] .
Обычно синдром Туретта проявляется уже в детстве, но часто заболевание выявляют поздно или не диагностируют вовсе, так как родители не обращают на тики должного внимания. Из-за этого маленькие пациенты не получают своевременной помощи и могут страдать не только от самих тиков, но и от психологических проблем, связанных с заболеванием. В Европе от возникновения первых симптомов синдрома Туретта до постановки диагноза проходит в среднем более 5 лет [2] .
Распространённость синдрома Туретта
Синдром Туретта очень распространён — он встречается примерно у 10 из 1000 детей. В России его диагностируют у 8 человек на 10 000 населения, им могут страдать до 5 % школьников [3] . Мужчины болеют чаще, чем женщины: соотношение между ними составляет примерно 3 к 1.
Причины синдрома Туретта
Синдром Туретта — это генетическое расстройство, которое передаётся от родителей. Однако точный механизм наследования и ген, ответственный за болезнь, не известны. Риск передачи заболевания ребёнку составляет около 50 %. В прошлом, в начале XX века, тики считались следствием психотравм, но современная медицина это отвергает, так как такое предположение не удалось доказать [4] . Психосоциальные факторы и аутоиммунные заболевания не являются причиной синдрома Туретта, но могут влиять на тяжесть течения болезни.
Существует теория, что недостаток магния в организме и связанные с ним нарушения обмена веществ могут влиять на развитие синдрома Туретта. Косвенным доказательством этого служит то, что препараты с некоторыми соединениями магния могут улучшать состояние больных. Однако большие исследования на эту тему не проводились [5] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы синдрома Туретта
Синдром Туретта проявляется тиками — быстрыми, внезапными, повторяющимися навязчивыми движениями или произнесением звуков. Чаще всего они возникают у мальчиков в возрасте от 4 до 11 лет. Тяжесть тиков доходит до пика примерно в 10-12 лет и ослабляется в подростковом возрасте. Большинство тиков исчезают спонтанно, но примерно у 1 % детей они сохраняются во взрослой жизни [7] .
Выделяют две основные группы тиков:
- Моторные тики — это непроизвольные движения частей тела. Самый распространённый из них — усиленное моргание. Также могут возникать подпрыгивания, постукивания по себе, развороты и повороты тела, гримасы, плевки, нецензурная жестикуляция и повторения чужих движений (копропраксия и эхопраксия).
- Вокальные, или звуковые, тики — это навязчивое произношение звуков, реже слов. Может проявляться кашлем, покашливанием, кряхтением. Иногда таких детей ошибочно лечат от бронхитов, трахеитов и бронхиальной астмы. Синдром Туретта часто ассоциируется с копролалией — внезапным высказыванием нецензурных фраз или слов, которое зачастую сопровождается копропраксией. Однако копролалия возникает только у 10 % пациентов [6] . Помимо копролалии, они могут повторять чужие слова, собственное слово или фразу (эхолалия и палилалия).
При синдроме Туретта моторные тики обязательно сочетаются с вокальными. Если присутствуют моторные тики, но нет вокальных, то стоит заподозрить другие заболевания: органическое поражение головного мозга, эпилепсию, синдром дефицита внимания (СДВГ), обсессивно-компульсивное расстройство (ОКР).
У многих детей и подростков с синдромом Туретта также отмечается СДВГ, ОКР, повышенная агрессивность, тревожность и склонность к депрессиям.
При синдроме Туретта интеллектуальные способности не нарушаются. Дети с этим заболеванием могут сильно расстраиваться от подшучиваний своих сверстников. При эмоциональном напряжении, вызванном пристальным вниманием или насмешками окружающих, тики могут усиливаться.
Форма тиков при синдроме Туретта может меняться в течение суток или недели, например от лёгких единичных моторных тиков утром или в начале недели до сложных и множественных по вечерам или под конец учебной недели. Видимо, их выраженность зависит в том числе от психоэмоциональных нагрузок.
Иногда дети пытаются сдерживать тики, но такой контроль возможен лишь в некоторой степени. Когда ребёнок старается подавить тики, симптомы могут усилиться. Попытка сдержать тик вызывает выраженный дискомфорт, из-за чего возрастает тревога — тикозные движения, наоборот, немного успокаивают. Из-за стресса, тревожных состояний и усталости тики могут учащаться и усиливаться.
Патогенез синдрома Туретта
Патогенез синдрома Туретта до конца не изучен. Известно лишь, что расстройство вызвано генетическими причинами. Скорее всего, при определённых генетических факторах нарушается работа нейромедиаторных систем в подкорковых образованиях и лобной коре.
Помимо генетических факторов, в патогенезе может участвовать и органическое повреждение головного мозга, например при патологии беременности и родов, черепно-мозговых травмах или нейроинфекциях.
Основная роль в патогенезе заболевания, вероятно, принадлежит дисфункции лобных долей. Считается, что большую роль в развитии синдрома Туретта играет правая лобно-височная область, сенсомоторные отделы орбитофронтальной коры, моторная область, базальные ганглии и поясная извилина. Также важное значение имеют нарушения в кортико-стрио-таламо-кортикальном контуре — нейронных цепях, связывающих кору, базальные ганглии и таламус.

Нарушения в работе этих структур также характерны для детей с ОКР и СДВГ — эти заболевания часто сопутствуют синдрому Туретта. Даже известны генетически связанные с синдромом Туретта формы ОКР (преимущественно ОКР с навязчивыми действиями — F42.1).
Предположительно, при синдроме Туретта нарушается работа дофаминергической системы. Изменения, вероятно, затрагивают серотонин-, норадреналин-, глутамат-, холин-, ГАМКергическую и опиоидную системы. Косвенно на связь синдрома Туретта с дофамином указывает то, что тики уменьшаются при лечении препаратами, которые воздействуют на передачу нервного импульса, вызванную дофамином ( например, путём блокады постсинаптических D2-рецепторов) [2] .
Классификация и стадии развития синдрома Туретта
Синдром Туретта — это разновидность хронических тиковых (или тикозных) нарушений. В Международной классификации болезней (МКБ-10) заболевание кодируется как F95.2 Комбинированные голосовые и множественные двигательные тики.
В следующей Международной классификации болезней (МКБ-11) тики и синдром Туретта из психических расстройств перенесены в неврологические [1] .
Согласно классификации Американской психиатрической ассоциации (DSM-IV), тики подразделяются на следующие группы:
- по виду — двигательные или голосовые;
- по продолжительности — преходящие или хронические.
Преходящее тиковое расстройство — это множественные двигательные, голосовые или тики обоих видов, которые длятся от 1 до 12 месяцев. Хронические тиковые расстройства присутствуют больше года. Они могут быть одиночными или множественными, двигательными или голосовыми, но не оба вида сразу. Синдром Туретта относится к хроническому тиковому расстройству. Для постановки диагноза необходимо, чтобы множественные двигательные тики и хотя бы один голосовой тик наблюдались более года.
Стадии синдрома Туретта не выделяют. Но обычно расстройство начинается с преходящих двигательных тиков, как правило подёргивания лица, которые длятся до года. Часто это гримасничание, затем покашливание и шипение. Постепенно тики распространяются на руки, ноги и мышцы шеи. Затем, обычно через год, присоединяются вокальные тики, которые осложняют картину болезни.
Осложнения синдрома Туретта
Синдром Туретта может сопровождаться депрессией, тревожным расстройством, ОКР и СДВГ, что осложняет прогноз. Депрессия возникает из-за того, что детей с этим синдромом часто обижают и унижают. В результате у них формируется чувство одиночества и может развиться аутоагрессия, вплоть до попытки суицида. Поэтому важно не оставлять ребёнка один на один с этим расстройством: ему особенно необходима поддержка родителей и друзей.
При симптоме копролалии дети выкрикивают нецензурную брань, из-за чего могут подвергаться агрессии со стороны окружающих. Поэтому для таких пациентов очень важно организовать правильную социальную среду [7] .
Диагностика синдрома Туретта
Синдром Туретта диагностирует врач-психиатр или невролог, основываясь на наблюдении и сборе сведений об истории болезни, условиях жизни и перенесённых заболеваниях. Сейчас разрабатываются генетические карты, которые позволят с самого рождения определять совокупность генов, характерных для синдрома Туретта, но пока этот метод недоступен.
Чтобы установить диагноз «синдром Туретта», состояние должно соответствовать следующим критериям:
- присутствуют множественные двигательные тики и как минимум один голосовой тик;
- тики возникают много раз в день, почти ежедневно;
- расстройство длится более года, но необязательно непрерывно, ремиссии продолжаются меньше двух месяцев;
- симптомы появились в возрасте до 18 лет [8] .
Очень важно отличать тики при синдроме Туретта от вторичных тиков, которые появились на фоне инфекций или черепно-мозговых травм при беременности, родах или в раннем детстве. Их различают только на основе анамнеза и физикального обследования. Другие методы, например магнитно-резонансная томография и анализы крови, для диагностики синдрома Туретта не используются.
Лечение синдрома Туретта
Перед врачом всегда стоит выбор — назначать ли препараты при синдроме Туретта. При этом важно ориентироваться на состояние пациента, так как более чем в половине случаев симптомы исчезают без приёма медикаментов.
Психологическая помощь
Если тики не мешают человеку общаться, учиться и работать, то, скорее всего, принимать препараты не нужно. В такой ситуации будет полезно психологическое консультирование ребёнка и родителей. Важно рассказать родителям, что от ребёнка ни в коем случае нельзя требовать, чтобы он перестал кашлять и гримасничать, — это только усилит эмоциональное напряжение и, соответственно, тики.
В зарубежных странах, особенно в США, хорошо зарекомендовал себя метод под названием «Habit reversal training», т. е. тренировка отмены привычки [10] . Пациента учат отслеживать ощущение, предшествующее тикам, и пытаться заменить их на более приемлемые действия. Метод не избавляет от тиков, но заметно уменьшает их проявления.
Также для коррекции поведения используется когнитивно-поведенческая психотерапия [12] .
Медикаментозное лечение
Для лечения синдрома Туретта могут применяться антипсихотики (нейролептики) в невысоких дозировках, которые воздействуют на дофаминэргическую активность. Наиболее эффективны Арипипразол, Рисперидон и Галоперидол. Из них лучше всего переносится Арипипразол. Однако в российских инструкциях по лечению синдрома Туретта это лекарство не упоминается, хотя в США оно одобрено Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) и активно используется в терапии. В России назначают Галоперидол и Рисперидон, а также ряд ноотропов (чаще всего гопантеновую и аминофенилмасляную кислоту) без достаточной доказательной базы.
Есть данные об эффективности Клонидина, но этот препарат опасен при передозировке. Среди возможных побочных эффектов — коллаптоидные состояния, т. е. резкое падение артериального давления, которое может привести к развитию обморока.
Существуют не подтверждённые данные об эффективности инъекции ботулотоксина в мышцы лица.
При возникновении сопутствующих заболеваний, таких как тревожно-депрессивное расстройство и ОКР, применяются селективные ингибиторы обратного захвата серотонина: Сертралин, Пароксетин, Эсциталопрам. При выраженной агрессии, направленной на себя или окружающих, назначаются нормотимики (препараты лития и другие) [12] .
Транскраниальная магнитная стимуляция
В настоящее время изучается влияние транскраниальной магнитной стимуляции на синдром Туретта как у детей, так и у взрослых, но пока недостаточно данных об эффективности этого метода [11] .
Нейрохирургическое лечение
При тяжёлом течении заболевания и выраженной устойчивости к медикаментам может применяться нейрохирургический подход — глубокая стимуляция подкорковых структур головного мозга (бледного шара и таламуса). Её используют для взрослых пациентов.
Прогноз. Профилактика
Прогноз благоприятнее и заболевание чаще заканчивается ремиссией или выздоровлением, если тики появились в возрасте до 7 лет.
Синдром Туретта часто вызывает у людей страх и ассоциации, что эта особенность мешает нормально общаться с другими. Но если грамотно подойти к терапии и исключить провоцирующие факторы, расстройство может протекать вполне благоприятно. Примером служит певица Билли Айлиш. Из-за тяжести заболевания она не ходила в школу и обучалась дома. Это не помешало певице в 2019 году записать сингл, завоевавший первые места в мировых хит-парадах, а в 2021 году войти в список 100 наиболее влиятельных людей года по версии журнала Time. Также синдромом Туретта, предположительно, страдал Вольфганг Моцарт [13] .
Синдром Туретта — это генетическое заболевание, поэтому предупредить его развитие нельзя. Однако если своевременно обратиться к врачу, можно снизить тяжесть болезни и предотвратить развитие депрессии, аутоагрессии и обсессивно-компульсивного расстройства.
При сильных тиках, не поддающихся лечению и мешающих общаться, учиться или работать, пациент может пройти медико-социальную экспертизу: специалисты оценят тяжесть состояния и, при необходимости, определят группу инвалидности.
Синдром Жильбера - симптомы и лечение
Что такое синдром Жильбера? Причины возникновения, диагностику и методы лечения разберем в статье доктора Васильева Романа Владимировича, гастроэнтеролога со стажем в 15 лет.
Над статьей доктора Васильева Романа Владимировича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Синдром Жильбера — это генетический пигментный гепатоз с аутосомно-доминантным типом наследования, протекающий с повышением уровня неконъюгированного (свободного) билирубина, чаще проявляющееся в период полового созревания и характеризующийся доброкачественным течением [1] .
Краткое содержание статьи — в видео:
Синонимы названия болезни: простая семейная холемия, конституциональная или идиопатическая неконъюгированная гипербилирубинемия, негемолитическая семейная желтуха.
По распространённости данное заболевание встречается не менее, чем у 5 % населения, в соотношении мужчин и женщин — 4:1. Впервые заболевание описал французский терапевт Августин Жильбер в 1901 году.
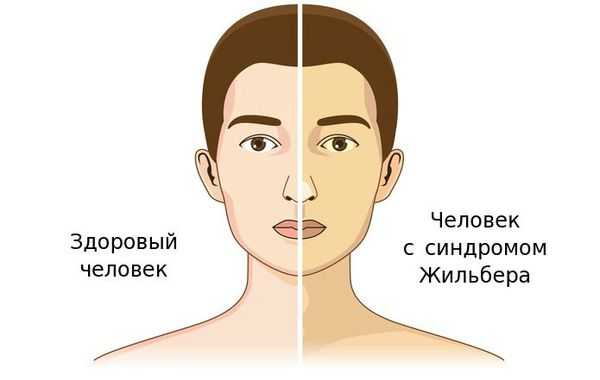
Чаще синдром Жильбера проявляется в период полового созревания и характеризуется доброкачественным течением. Основным проявлением этого синдрома является желтуха.
К провоцирующим факторам проявления синдрома можно отнести:
- голодание или переедание;
- жирную пищу;
- некоторые лекарственные средства;
- алкоголь;
- инфекции (грипп, ОРЗ, вирусный гепатит);
- физические и психические перегрузки;
- травмы и оперативные вмешательства.
Причина заболевания — генетический дефект фермента УДФГТ1*1, который возникает в результате его мутации. В связи с этим дефектом функциональная активность данного фермента снижается, а внутриклеточный транспорт билирубина в клетках печени к месту соединения свободного (несвязанного) билирубина с глюкуроновой кислотой нарушается. Это и приводит к увеличению свободного билирубина.
Симптомы синдрома Жильбера
Некоторые специалисты трактуют синдром Жильбера не как болезнь, а как физиологическую особенность организма.
До периода полового созревания данный синдром может протекать бессимптомно. Позже (после 11 лет) возникает характерная триада признаков:
- желтуха различной степени выраженности;
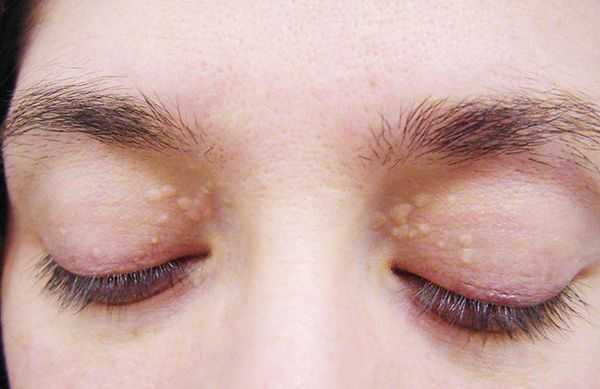
- ксантелазмы век (жёлтые папулы);
- периодичность появления симптомов [1] .
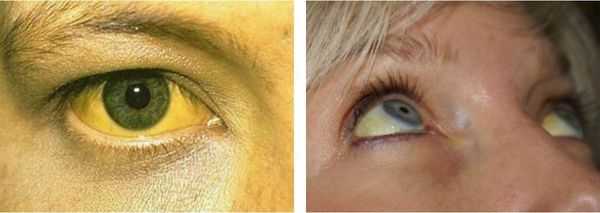
Желтуха чаще всего проявляется иктеричностью (желтушностью) склер, матовой желтушностью кожных покровов (особенно лица), иногда частичным поражением стоп, ладоней, подмышечных впадин и носогубного треугольника.
Заболевание нередко сочетается с генерализованной дисплазией (неправильным развитием) соединительной ткани.
Усиление желтухи может наблюдаться после перенесения инфекций, эмоциональной и физической нагрузки, приёма ряда лекарственных препаратов (в частности, антибиотиков), голодания и рвоты.
Клиническими проявлениями заболевания общего характера могут быть:
- слабость;
- недомогание;
- подавленность;
- плохой сон;
- снижение концентрации внимания.
В отношении ЖКТ синдром Жильбера проявляется снижением аппетита, изменением привкуса во рту (горечь, металлический привкус), реже возникает отрыжка, тяжесть в области правого подреберья, иногда наблюдается боль ноющего характера и плохая переносимость лекарственных препаратов.
При ухудшении течения синдрома Жильбера и существенном повышении токсичной (свободной) фракции билирубина может появляться скрытый гемолиз, усиливая при этом гипербилирубинемию и добавляя в клиническую картину системный зуд.
Патогенез синдрома Жильбера
В норме свободный билирубин появляется в крови преимущественно (в 80-85 % случаев) при разрушении эритроцитов, в частности комплекса ГЕМ, входящего в структуру гемоглобина. Это происходит в клетках макрофагической системы, особенно активно в селезёнке и купферовских клетках печени. Остальная часть билирубина образуется из разрушения других гемсодержащих белков (к примеру, цитохрома P-450).
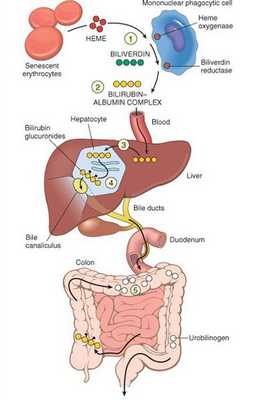
У взрослого человека в сутки образуется приблизительно от 200 мг до 350 мг свободного билирубина. Такой билирубин слаборастворим в воде, но при этом хорошо растворяется в жирах, поэтому он может взаимодействовать с фосфолипидами ("жирами") клеточных мембран, особенно головного мозга, чем можно объяснить его высокую токсичность, в частности токсичное влияние на нервную систему.
Первично после разрушения комплекса ГЕМ в плазме билирубин появляется в неконъюгированной (свободной или несвязанной) форме и транспортируется с кровью при помощи белков альбуминов. Свободный билирубин не может проникнуть через почечный барьер за счёт сцепления с белком альбумином, поэтому сохраняется в крови.
В печени несвязанный билирубин переходит на поверхность гепатоцитов. С целью снижения токсичности и выведения в клетках печени свободного билирубина при помощи фермента УДФГТ1*1 он связывается с глюкуроновой кислотой и превращается в конъюгированный (прямой или связанный) билирубин. Конъюгированный билирубин хорошо растворим в воде, он является менее токсичным для организма и в дальнейшем легко выводится через кишечник с желчью.
При синдроме Жильбера связывание свободного билирубина с глюкуроновой кислотой снижается до 30% от нормы, тогда как концентрация прямого билирубина в желчи увеличивается.
В основе синдрома Жильбера лежит генетический дефект — наличие на промонторном участке A(TA)6TAA гена, кодирующего фермент УДФГТ1*1, дополнительного динуклеотида ТА. Это становится причиной образования дефектного участка А(ТА)7ТАА. Удлинение промонторной последовательности нарушает связывание фактора транскрипции IID, в связи с чем уменьшается количество и качество синтезируемого фермента УДФГТ1, который участвует в процессе связывания свободного билирубина с глюкуроновой кислотой, преобразуя токсичный свободный билирубин в нетоксичный связанный.
Вторым механизмом развития синдрома Жильбера является нарушение захвата билирубина микросомами сосудистого полюса клетки печени и его транспорта глутатион-S-трансферазой, которая доставляет свободный билирубин к микросомам клеток печени.
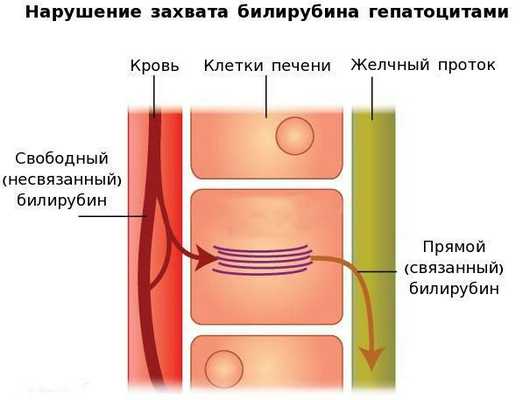
В конечном итоге вышеперечисленные патологические процессы приводят к увеличению содержания свободного (несвязанного) билирубина в плазме, что обуславливает клинические проявления заболевания [6] .
Классификация и стадии развития синдрома Жильбера
Общепринятой классификации синдрома Жильбера не существует, однако условно можно разделить генотипы синдрома по полиморфизму.
Синдром Золлингера - Эллисона
Синдром Золлингера-Эллисона - симптомокомплекс, обусловленный наличием гастринпродуцирующей опухоли поджелудочной железы или двенадцатиперстной кишки, гипергиперсекрецией соляной кислоты в желудке и ее ульцерогенным действием на слизистую оболочку желудочно-кишечного тракта. Заболевание проявляется симптомами язвы: болью, диареей, изжогой, отрыжкой, желудочно-кишечными кровотечениями. Диагностика синдрома Золлингера-Эллисона основана на определении уровня базального гастрина, данных эндоскопического и рентгенологического исследований, УЗИ, КТ, селективной ангиографии. Лечение синдрома Золлингера-Эллисона может включать удаление гастриномы, полную гастрэктомию, ваготомию, прием H2-блокаторов, м-холинолитиков, ингибиторов протонного насоса, химиотерапию.
Общие сведения
Синдром Золлингера-Эллисона обусловлен развитием гормонально активной опухоли поджелудочной железы или двенадцатиперстной кишки, продуцирующей избыточное количество гастрина, что приводит к повышенному кислотообразованию в желудке и развитию пептических и дуоденальных изъязвлений.
Гастринпродуцирующие опухоли (гастриномы) относятся к аденомам эндокриноподобных клеток APUD-системы и представлены одиночным или множественными узлами темно-красного цвета округлой (овоидной) формы, плотной консистенции, небольшого размера (обычно от 0,2 до 2 см). При синдроме Золлингера-Эллисона гастриномы в подавляющем большинстве случаев локализуются в области тела или хвоста поджелудочной железы, около трети - в двенадцатиперстной кишке или перипанкреатических лимфоузлах (редко - в желудке, селезенке, печени). Две трети гастрином являются злокачественными опухолями, растут медленно, метастазируют в основном в регионарные и супраклавикулярные лимфоузлы, печень, селезенку, средостение, брюшину и кожу.
Для синдрома Золлингера-Эллисона характерно наличие множественных язв верхних отделов ЖКТ нетипичной локализации (например, в дистальной части двенадцатиперстной кишки, в тощей кишке), имеющих длительное течение и частые рецидивы. Синдром Золлингера-Эллисона является нечастой патологией в гастроэнтерологии (около 4 случаев на 1 млн. чел.), встречается преимущественно у лиц мужского пола в возрасте от 20 до 50 лет.
Причины
Основная причина синдрома Золлингера-Эллисона - упорная, неконтролируемая гипергастринемия, вызванная наличием гастринпродуцирующей опухоли поджелудочной железы или двенадцатиперстной кишки. Почти у четверти больных с синдром Золлингера-Эллисона обнаруживается множественный эндокринный аденоматоз I типа с поражением не только поджелудочной железы, но и гипофиза, щитовидной и паращитовидных желез, надпочечников.
Иногда синдром Золлингера-Эллисона может быть связан с гиперплазией гастринпродуцирующих G-клеток антрального отдела желудка. В норме секреция гастрина G-клетками регулируется с помощью механизма отрицательной обратной связи (ингибитор - выделяющаяся соляная кислота). Продукция гастрина опухолью при синдроме Золлингера—Эллисона никак не регулируется, что и приводит к бесконтрольной гипергастринемии.
Симптомы синдрома Золлингера-Эллисона
При синдроме Золлингера-Эллисона может обнаруживаться тяжелая язвенная болезнь желудка и двенадцатиперстной кишки нетипичной локализации, толерантная к противоязвенной терапии. Клиническими симптомами синдрома Золлингера-Эллисона служат упорные, интенсивные боли в верхней части живота, обильный, полуоформленный или водянистый стул, содержащий большое количество жира (диарея и стеаторея), длительная изжога и отрыжка, эзофагит, стриктуры пищевода. Диарея обусловлена закислением содержимого тощей кишки, усилением перистальтики, развитием воспаления и нарушением функции всасывания.
На злокачественную природу синдрома Золлингера-Эллисона может указывать значительное снижение массы тела. При синдроме Золлингера-Эллисона наблюдается склонность к развитию деструктивных процессов и осложнений (перфорации и желудочно-кишечных кровотечений).
Трудности ранней диагностики синдрома Золлингера-Эллисона связаны с наличием симптоматики, схожей с обычной язвенной болезнью. Пальпаторно выявляется выраженная болезненность в эпигастрии, локальная болезненность в области язвы (положительный симптом Менделя).
Дифференциально-диагностическое значение при синдроме Золлингера—Эллисона имеет исследование уровня базального гастрина в сыворотке крови и показателей желудочной секреции с проведением функциональных тестов со стандартизированной пищевой нагрузкой или внутривенным введением секретина, глюкагона, солей кальция. Для синдрома Золлингера-Эллисона, в отличие от обычной язвенной болезни, характерно значительное повышение уровня гастрина в крови (до 1000 пг/мл и более) и величины дебита свободной соляной кислоты (в 4-10 раз). Специфичным для синдрома Золлингера-Эллисона является тест с секретином, в/в введение которого приводит к повышению уровня гастрина у большинства больных (при обычных дуоденальных язвах его концентрация снижается). Аналогичный эффект вызывает нагрузочный тест с глюкагоном и глюконатом кальция.
Диагностику синдрома Золлингера-Эллисона дополняют инструментальными методами исследования. Подозрение на синдром Золлингера-Эллисона может вызвать наличие множественного язвенного поражения и необычное расположение язв, выявленное при рентгенографии желудка и ФГДС. УЗИ органов брюшной полости и КТ позволяет визуализировать опухоль поджелудочной железы, при злокачественной гастриноме возможно также значительное увеличение печени и наличие в ней опухолевых образований. Наиболее информативным, но технически более сложным методом диагностики синдрома Золлингера-Эллисона является селективная абдоминальная ангиография с определением уровня гастрина в панкреатических венах.
Синдром Золлингера-Эллисона дифференцируют с трудно рубцующимися и часто рецидивирующими язвами верхних отделов ЖКТ, целиакией, опухолями тонкой кишки, с гипергастринемией при гипертиреозе, гастрите, стенозе привратника, В12-дефицитной анемии.
Лечение синдрома Золлингера-Эллисона
Радикальным методом лечения синдрома Золлингера-Эллисона является полное удаление гастриномы с проведением волоконно-оптической диафаноскопии двенадцатиперстной кишки и латеральной дуоденотомии с тщательной ревизией слизистой оболочки. Нередко к моменту операции обнаруживаются метастазы гастриномы в различных органах, поэтому полное излечение после такой операции возможно лишь у 30% больных.
Эффективность резекции желудка с проксимальной селективной ваготомией или пилоропластикой при синдроме Золлингера-Эллисона невысока, в связи с тем, язвы могут очень быстро рецидивировать. Ранее широко используемая тотальная гастрэктомия в настоящее время показана только при отсутствии результата консервативного лечения и осложненном течении язвенного процесса.
В качестве консервативной лечебной практики при синдроме Золлингера-Эллисона применяются препараты, снижающие выделение соляной кислоты: блокаторы H2-рецепторов гистамина (ранитидин, фамотидин), иногда в комбинации с селективными м-холинолитиками (платифиллин, пирензепин), ингибиторы протонного насоса (омепразол, лансопразол). Препараты могут назначаться пожизненно из-за высокого риска рецидива язвы, их дозы более высокие, чем при лечении обычной язвенной болезни и зависят от уровня базальной секреции соляной кислоты. При злокачественном характере и неоперабельности гастриномы применяется химиотерапия (комбинация стрептозоцина, фторурацила и доксорубицина).
Прогноз
Прогноз при синдроме Золлингера-Эллисона несколько лучше, чем при остальных злокачественных опухолях и связан с ее достаточно медленным ростом: 5-летняя выживаемость даже при наличии метастазов в печени составляет 50-80 %, после радикальных операций - 70-80 %. Летальный исход может быть вызван не самой опухолью, а осложнениями тяжелых язвенных поражений.
Читайте также:
