Примеры лечения первичной витреоретинальной лимфомы
Добавил пользователь Alex Обновлено: 08.01.2026
НИИ нейрохирургии им. Н.Н. Бурденко РАМН, Москва
ФГБУ "НИИ нейрохирургии им. акад. Н.Н. Бурденко" РАМН, Москва
ФГАУ «НИИ нейрохирургии им. акад. Н.Н. Бурденко» Минздрава России, Москва, Россия
Многократное применение стереотаксической радиотерапии для лечения рецидивирующей В-клеточной первичной интраокулярной лимфомы (клинический случай)
Журнал: Вестник офтальмологии. 2018;134(3): 78‑85
В статье представлено клиническое наблюдение 41-летней женщины с неходжкинской В-клеточной первичной лимфомой ЦНС с вовлечением обоих глаз. Приводятся данные катамнеза (срок наблюдения — 85 мес), описаны клинико-инструментальные особенности заболевания. Анализируются результаты длительного комбинированного лечения рецидивирующей первичной интраокулярной лимфомы, включающего повторные курсы лучевой терапии.
Первичная интраокулярная лимфома (ПИОЛ) является подтипом неходжкинской первичной лимфомы ЦНС, поражающей органы-мишени: головной мозг и в 11—25% наблюдений — глазные яблоки [1—5]. Эта опухоль относится к гемобластозам, отличается высокой степенью злокачественности и по своей морфологической структуре в 90% случаев представлена диффузной крупноклеточной В-клеточной лимфомой [5—9]. По данным Национального гематологического общества, показатель 5-летней общей выживаемости у пациентов с первичной лимфомой ЦНС после проведения комбинированного лечения, включающего химио- и радиотерапию, составляет 30—50% [7].
Появление ПИОЛ в большинстве случаев опережает поражение головного мозга на 1—2 года [3]. Клинические проявления ПИОЛ, в отличие от острой манифестации первичной лимфомы ЦНС, имеют медленное развитие. Чаще возникает инфильтрация опухолевыми клетками стекловидного тела с появлением белесых «сальных» преципитатов на эндотелии роговицы (скопление бластных клеток), реже образуются субретинальные инфильтраты. Таким образом, поражается витреоретинальный комплекс. В финале заболевания развивается тракционная отслойка сетчатки, за которой следуют функциональная гибель глаза и амавроз [10].
Известно, что диффузная крупноклеточная В-клеточная лимфома имеет склонность к рецидивирующему течению. Это обстоятельство диктует необходимость постоянной смены линии лекарственной терапии и выбора дополнительного метода лечения. К сожалению, до настоящего времени стандартов лечения первичной лимфомы ЦНС и ПИОЛ не существует [1, 5, 7, 9], а среди выживших больных становится актуальным вопрос об улучшении качества жизни.
Клиническое наблюдение
У пациентки Л. в возрасте 41 года заболевание проявило себя эпилептическими приступами, парезом правой руки (до 2 баллов), элементами моторной афазии, акалькулией (нарушением счета). Индекс Карновского — 80. На сериях магнитно-резонансной томографии (МРТ) определялось внутримозговое объемное образование в левой лобной доле с зоной перифокального отека и неоднородным гиперинтенсивным сигналом во всех режимах (признак кровоизлияния в строму опухоли) (рис. 1, а—в). Рис. 1. Первичная лимфома ЦНС левой заднелобно-теменной области. а — МР-картирование; б — МРТ в Т1-режиме с контрастным усилением; в — МРТ Т2 FLAIR; г — полная ремиссия опухоли после ИА ХТ. Впервые больная госпитализирована в ФГАУ «ННПЦН им. акад. Н.Н. Бурденко» Минздрава России в 2010 г. После костно-пластической трепанации черепа проведено удаление внутримозговой опухоли левой заднелобно-теменной области с применением интраоперационного картирования речевых и двигательных центров. Иммуногистохимическое исследование биоптата обнаружило В-клеточную лимфому c положительной экспрессией общего лейкоцитарного антигена, CD10 и CD20. Пациентке проведено 9 сеансов интраартериальной химиотерапии (ИА ХТ). После временного открытия гематоэнцефалического барьера по катетеру введено 3000 мг метотрексата, а также 300 мг карбоплатина + 1000 мг циклофосфамида. Однако при осмотре офтальмологом была выявлена двусторонняя ПИОЛ в начальной стадии. Несмотря на сохранные зрительные функции обоих глаз, пациентку в течение 2—3 лет беспокоили плавающие помутнения. При биомикроскопии с медикаментозным мидриазом в стекловидном теле на фоне его деструкции имелась взвесь белесых мелкоклеточных форменных элементов. Ультразвуковое исследование (УЗИ) продемонстрировало участки повышения Эхо-плотности в стекловидном теле (рис. 2, а, Рис. 2. В-сканы глазных яблок. а — ПИОЛ правого глаза до лечения; б — после ИВ ХТ (полный ответ); в — ПИОЛ левого глаза до лечения; г — после ИВ ХТ (полный ответ). в). Роговицы и сетчатки были интактны. В конце курса ИА ХТ была достигнута полная ремиссия лимфомы головного мозга (рис. 1, г). При участии офтальмоонколога проф. Е.Е. Гришиной больной проведены интравитреальные инъекции метотрексата (разовая доза 400 мкг/0,1 мл) через плоскую часть цилиарного тела (табл. 1, 2). Таблица 1. Результаты лечения ПИОЛ правого глаза Примечание. * — visus — острота зрения; ** — в феврале 2013 г. проведена факоэмульсификация катаракты с имплантацией интраокулярной линзы; *** — на момент написания статьи; прочерк — осложнений не наблюдалось. Таблица 2. Результаты лечения ПИОЛ левого глаза Примечание. * — visus — острота зрения; ** — на момент написания статьи. Лечению предшествовали частичная витрэктомия, аспирационная биопсия стекловидного тела левого глаза. Полимеразная цепная реакция подтвердила В-клеточную клональность по реаранжировкам генов тяжелых цепей иммуноглобулинов. В результате интравитреальной ХТ (ИВ ХТ) достигнут полный ответ на лечение (рис. 2, б, г). Безрецидивный период составил 4 мес для правого глаза и 5 мес — для левого. В связи с рецидивом ПИОЛ правого глаза (рис. 3, а) Рис. 3. В-сканы глазных яблок. а — рецидив ПИОЛ правого глаза после ИВ ХТ; б — после СРТ (частичный ответ); в — рецидив ПИОЛ левого глаза после ИВ ХТ; г — после СРТ (полный ответ). в сентябре 2012 г. проведен курс стереотаксической радиотерапии (СРТ) с применением линейного ускорителя «Novalis» с микромультилепестковым коллиматором. Лучевую терапию проводили на область правого глазного яблока с разовой дозой облучения (РДО) =1,8 Гр до суммарной очаговой дозы (СОД) 36 Гр при 5-дневном облучении в неделю. СРТ проводили с трех динамических арок с одним изоцентром, энергия излучения составляла 6 МэВ, объем мишени GTV=CTV=7,516 см 3 включен в 80% изодозную кривую (рис. 4, табл. Рис. 4. План облучения ПИОЛ правого глаза с применением линейного ускорителя «Novalis», схема изодозного распределения полей с защитой хрусталика. 1). Эффект лечения — уменьшение инфильтрации стекловидного тела и стабилизация процесса (рис. 3, б). На фоне ИВ ХТ метотрексатом сформировалась осложненная заднекапсулярная катаракта правого глаза, и в феврале 2013 г. выполнена факоэмульсификация катаракты с имплантацией интраокулярной линзы. В марте 2013 г. в связи с рецидивом ПИОЛ после ИВ ХТ (рис. 3, в) проведена СРТ на область левого глаза с использованием линейного ускорителя «Novalis» с микромультилепестковым коллиматором. Энергия излучения составляла 6 МэВ: объем мишени GTV=CTV=8,649 см 3 включен в 80% изодозную кривую. Облучение проводили методом интесивно модулированной радиотерапии c 6 полей с одним изоцентром. Подведено 20 фракций по 2 Гр до СОД 40 Гр (табл. 2). В результате получен полный ответ на лечение (рис. 3, г). В феврале 2014 г. у пациентки развился рецидив лимфомы головного мозга на отдалении от первичного очага поражения. На серии МРТ выявлялось накопление контрастного вещества в области левого таламуса, в правой теменной области, в правой гемисфере мозжечка. Это состояние сопровождалось рецидивом ПИОЛ правого глаза в виде появления белесых преципитатов на эндотелии роговицы и усилением лимфоидной инфильтрации стекловидного тела. После 8 сеансов ИА ХТ (схема и дозы химиопрепаратов приведены выше) проведен курс СРТ на область всего головного мозга и правого глазного яблока (единой мишенью). Лечение осуществляли с помощью линейного ускорителя «Primus» по системе планирования «Амфора». Объем мишени PTV составлял 1328,8 см 3 . Облучение проводили методом статических пучков (n=2), за 20 фракций подведено РДО 1,8 Гр до СОД 36 Гр. Критические структуры были в пределах толерантности (рис. 5). Рис. 5. План облучения с использованием линейного ускорителя Primus. В мишень включены весь головной мозг и зона правого глазного яблока; изодозное распределение, ориентация полей. В результате комбинированной терапии отмечались полный регресс множественных очагов лимфомы головного мозга и полный ответ со стороны ПИОЛ правого глаза после очередного курса СРТ. cведения о дальнейшем проведении третьего курса СРТ по поводу рецидива ПИОЛ правого глаза и второго курса СРТ по поводу рецидива интраокулярной лимфомы левого глаза приведены в табл. 1 и 2. Признаков рецидива лимфомы головного мозга в эти периоды не было. Безрецидивный период к моменту написания статьи для левого глаза составил 12 мес, для правого — 1 мес. Следует отметить, что во время планирования облучения анализировались дозы облучения, которые будут подведены к критическим структурам обоих глаз (табл. 3, 4). Таблица 4. Дозовые нагрузки на критические структуры левого глаза в процессе лучевой терапии ПИОЛ (в Гр) Таблица 3. Дозовые нагрузки на критические структуры правого глаза в процессе лучевой терапии ПИОЛ (в Гр)
Диффузная крупноклеточная В-клеточная лимфома является высокорадиочувствительной опухолью [7]. Однако следует учитывать, что СРТ может сопровождаться ранними лучевыми реакциями (во время проведения СРТ или непосредственно после ее окончания) и чревата поздними осложнениями (сроки от 6 мес), которые могут стать различной причиной потери зрения. В литературе описаны следующие осложнения лучевой терапии опухолевых заболеваний глаза: к ранним реакциям относятся эритема кожи, отек век, конъюнктивит, снижение чувствительности роговицы и ее эпителиальные дефекты; к поздним осложнениям — симблефарон, синдром сухого глаза, помутнение роговицы с неоваскуляризацией, катаракта, неоваскулярная глаукома, ретинопатия, нейрооптикопатия [13—16]. На основе анализа результатов облучения опухолевых заболеваний органа зрения в дозе от 18 до 54 Гр в группе из 67 пациентов M. Kaushik и соавторы сообщают, что постлучевая ретинопатия развилась в 12% наблюдений в сроки от 15 до 24 мес, кератопатия — в 6%, синдром сухого глаза — в 39%, катаракта — в 33%. Авторы делают вывод, что развитие этих осложнений напрямую зависит от параметров СРТ (РДО, СОД, количество фракций) [15]. Критическая доза облучения для сетчатки, по мнению разных исследователей, составляет 45—50 Гр [17, 18]. Нейрооптикопатия может сопровождаться резкой потерей зрения, появлением дефектов поля зрения в сроки до 3 лет после проведения СРТ. Данное осложнение чаще всего наблюдается при подведении СОД более 50 Гр. По данным А. Чумаченко, доза 50—70 Гр приводит к нейрооптикопатии в 10% наблюдений, более 70 Гр — в 16% [14]. Среди радиологов распространено мнение, что проведение СРТ опухолевого заболевания глаза опасно развитием постлучевой катаракты, поскольку хрусталик является наиболее радиочувствительной структурой глаза. Для формирования катаракты достаточно РДО=2 Гр или СОД от 5 Гр и выше [14, 17]. Однако в нашем наблюдении начало развития осложненной заднекапсулярной катаракты правого глаза было положено во время проведения ИВ ХТ метотрексатом. И наличие ПИОЛ не явилось препятствием для успешного хирургического лечения катаракты. Собственный опыт проведения СРТ у 12 пациентов с ПИОЛ показал, что постлучевая катаракта развилась у 2 (18,3%) больных. Таких грозных осложнений, как ретинопатия или нейрооптикопатия, при классическом режиме фракционирования СРТ мы не наблюдали [19]. Приведенное в табл. 3 и 4 распределение доз облучения, подведенных к критическим структурам глаз, также указывает на их толерантность при выбранном режиме СРТ.
Склонность к рецидивированию диффузной крупноклеточной В-клеточной лимфомы диктует необходимость повторной терапии ПИОЛ, выбора метода и сроков ее лечения. Мы предпочли повторную СРТ как неинвазивный и менее длительный способ лечения по сравнению с ИВ ХТ метотрексатом. При этом безрецидивный период после СРТ у пациентки Л. значительно превысил таковой после химиотерапии. Повторная СРТ проводилась не ранее, чем через 12 мес после предыдущего курса. Одномоментно осуществлялось лечение только одного пораженного глаза. Под рецидивом ПИОЛ мы подразумеваем появление/усиление лимфомной инфильтрации стекловидного тела (по данным УЗИ) после предшествующего лечения, а также появление «запотелости» роговицы и преципитатов на ее эндотелии [10].
Первичная лимфома ЦНС — одна из самых агрессивных экстранодальных лимфом [7]. По данным Г.Л. Кобякова, медиана общей выживаемости пациентов с лимфомой ЦНС составляет 35 мес, а среднее время до прогрессирования заболевания после ИА ХТ — 24 мес [6]. В представленном клиническом случае время наблюдения на фоне проведения комбинированной терапии составило 85 мес, что значительно превышает среднестатистические показатели. Многократно проводимая СРТ позволила сохранить высокими зрительные функции пациентки и как следствие — качество жизни.
Заключение
Первичная интраокулярная лимфома — высокорадиочувствительная опухоль. При ее рецидивах возможно проводить повторные курсы СРТ. Рекомендуемые дозы облучения составляют по 2 Гр за фракцию при 5-дневном облучении в неделю до СОД 40 Гр. Повторение курса СРТ возможно не ранее чем через 12 мес после предыдущего. Потенциальное развитие постлучевой катаракты не является противопоказанием для проведения курса СРТ, а наличие ПИОЛ не препятствует хирургическому лечению катаракты с имплантацией интраокулярной линзы. Критические структуры глаза (сетчатка, зрительный нерв) остаются в пределах толерантности облучения при рекомендуемом режиме фракционирования, который позволяет добиться стойкого локального контроля заболевания с минимальными проявлениями токсичности.
Участие авторов:
Концепция и дизайн исследования: О.Т., Е.В., Н.С.
Сбор и обработка материала: О.Т., Е.В., Н.Ф.
Написание текста: О.Т.
Редактирование: Н.С., А.Г.
Авторы заявляют об отсутствии конфликта интересов.
Сведения об авторах
Тропинская Ольга Феликсовна — врач, канд. мед. наук, группа офтальмологических исследований
Первичная витреоретинальная лимфома (Blood, март 2020)
02 марта 2020 г. в журнале Blood опубликована статья: "Темозоломид является эффективным и хорошо переносится пациентами с первичной витреоретинальной лимфомой".
Первичная витреоретинальная лимфома является редкой неходжкинской лимфомой, очень часто связанной с первичной лимфомой ЦНС. Данное заболевание имеет особенное значение для пациентов в пожилом возрасте ввиду ограничений в получении химиотерапии. Прогноз очень плохой из за риска вовлечения ЦНС, где у 60-85% пациентов развивается ЦНС локализация в течение 29 месяцев.
Имеется очень мало публикаций по лечению. Темозоломид является хорошо переносимым алкилирующим препаратом второго поколения с отличной пенетрацией в ЦНС и цереброспинальную жидкость.
В представленном мультицентровом исследовании, которое прошло во Франции, оценили эффективность и безопасность темозоломида для лечения рецидивной или рефрактерной болезни, либо у пациентов, не подходящих на интенсивное изначальное лечение.
В исследование вошли 21 пациент, средний возраст 75 лет (35-90 лет), у которых диагноз первичной витреоретинальной лимфомы был установлен путем цитологического исследования материала витрэктомии и окраски с применением анти-CD3, анти-CD20 и анти-CD79b антител. Также выполнялся анализ интерлейкин 10 и 6 с подсчетом по шкале ISOLD (Interleukin Score for intraOcular Lymphoma Diagnosis, шкала интерлейкина для диагностики внутриглазной лимфомы). Считается, что по шкале ISOLD выше 4,6 имеет вероятность 99% наличия первичной витреоретинальной лимфомы.
Пациенты прошли МРТ с гадолинием, люмбальную пункцию и ПЭТ-сканирование или КТ. Цереброспинальную жидкость тестировали на цитологию, проточную цитометрию, клональность и интерлейкин 10 и 6. Ответ на лечение оценивался офтальмологическим осмотром, МРТ с гадолинием, измерением уровня интерлейкинов на контрольных осмотрах.
Детали в статье. Пациенты получали дозу препарата 150 или 200 мг/м2 пять дней в месяц каждый месяц в течение в среднем 5-ти месяцев, и далее велись в среднем 42 месяца:
- у 3-х пациентов был уровень 3 токсичности (анемия и рвота), у 1-го пациента был уровень 4 токсичности (нейтропения и тромбоцитопения).
Авторы заключают, что темозоломид с его общим уровнем ответа на лечение, низкой токсичностью и доступной ценой может рассматриваться как хороший терапевтический метод для пожилых пациентов, либо для пациентов с рефрактерной первичной витреоретинальной лимфомой.
Авторы указали отсутствие связи с фармкомпанией, изготовителем темозоломида, и других возможных конфликтов интересов.
Подробнее смотрите в прикрепленном файле.
Посмотреть другие обзоры
Автор обзора
Автор обзоров мировой медицинской периодики на портале MedElement - врач общей практики, хирург Талант Иманалиевич Кадыров.
Закончил Киргизский Государственный медицинский институт (красный диплом), в совершенстве владеет английским языком. Имеет опыт работы хирургом в Чуйской областной больнице; в настоящий момент ведет частную практику.
Регулярное повышение квалификации: курсы Advanced Cardiac Life Support, International Trauma Life Support, Family Practice Review and Update Course (Англия, США, Канада).
Первичная витреоретинальная лимфома (Blood, май 2021)
25 мая 2021 г. в журнале Blood опубликована статья “Первичная витреоретинальная лимфома: диагностические трудности и трудности в лечении”.
Первичная витреоретинальная лимфома является редкой формой первичной лимфомы ЦНС, развивающейся из внутриглазного компартмента без вовлечения головного мозга. Не смотря на вялое клиническое течение, первичная витреоретинальная лимфома может привести к перманентной потере зрения и рецидиву в ЦНС - главной причине смерти у пациентов с первичной витреоретинальной лимфомой.
Патофизиология первичной витреоретинальной лимфомы неизвестна. Также как и при первичной лимфоме ЦНС, трансформация опухолевых клеток скорее всего происходит за пределами ЦНС, до того, как клетки мигрируют в глаз и происходит пролиферация в иммуно-предрасполагающей микросреде.
Диагностика остается затруднительной и требует тесного координирования между офтальмологами и цитологами. Клетки лимфомы не всегда могут быть идентифицированы. Используются комбинации уровней интерлейкинов, молекулярной биологии и методов визуализации с клиническим офтальмологическим обследованием для диагностики первичной витреоретинальной лимфомы.
Подробнее смотрите в прикрепленном файле.
Автор обзоров мировой медицинской периодики на портале MedElement - врач общей практики, хирург Талант Иманалиевич Кадыров.
Закончил Киргизский Государственный медицинский институт (красный диплом), в совершенстве владеет английским языком. Имеет опыт работы хирургом в Чуйской областной больнице; в настоящий момент ведет частную практику.
Регулярное повышение квалификации: курсы Advanced Cardiac Life Support, International Trauma Life Support, Family Practice Review and Update Course (Англия, США, Канада).
Примеры лечения первичной витреоретинальной лимфомы
ФГБНУ «НИИ глазных болезней»
Фомин А.В. Редкий клинический случай витреоретинальной лимфомы
Журнал: Вестник офтальмологии. 2014;130(4): 63‑67
Тропинская О.Ф., Серова Н.К., Голанов А.В., Ветлова Е.Р., Фомин А.В. Фомин А.В. Редкий клинический случай витреоретинальной лимфомы. Вестник офтальмологии. 2014;130(4):63‑67.
Tropinskaia OF, Serova NK, Golanov AV, Vetlova ER, Fomin AV. Rare case of vitreoretinal lymphoma. Vestnik Oftalmologii. 2014;130(4):63‑67. (In Russ.).
Первичная B-клеточная неходжкинская интраокулярная лимфома (ИОЛ) чаще встречается как заболевание, сопровождающее первичную лимфому головного мозга, реже - в качестве самостоятельной нозологии.
Впервые E. Cooper и J. Ricker [1] описали ИОЛ в 1951 г. как «ретикулоклеточную саркому глаза», обладающую высокой степенью злокачественности. По данным Ch. Chan и D. Wallace [2], среди пациентов с лимфомой центральной нервной системы (ЦНС) внутриглазная лимфома встречается в 15-25% наблюдений. Анализируя в 2008 г. данные 79 больных с первичной лимфомой головного мозга, мы выявили, что ИОЛ развилась у 9 пациентов, что составило 11,4% и было несколько реже, чем представлено в публикации зарубежных авторов [3]. Первичная ИОЛ может поражать сетчатку, хориоидею, стекловидное тело, интраокулярную часть зрительного нерва [2, 4].
В нашей клинической практике в НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН за период с 2004 по 2013 г. были выявлены 34 пациента с поражением B-клеточной лимфомой головного мозга и одного/обоих глаз. Чаще лимфома ЦНС манифестировала поражением глаза, а спустя несколько месяцев/лет присоединялись клинические симптомы лимфомы головного мозга, соответствующие топической локализации одного или нескольких очагов. Практически у всех пациентов ИОЛ на ранних стадиях проявляла себя деструкцией и инфильтрацией стекловидного тела лимфомными клетками, образующими на фоне задней отслойки стекловидного тела «лимфомное тело», патологии сетчатки не было. В дальнейшем могли присоединиться крупные сальные белесые преципитаты на эндотелии роговицы, представляющие скопления лимфомных клеток. Если скопление В-лимфобластов блокировало пути оттока из передней камеры глаза, развивалась офтальмогипертензия. У шести пациентов ИОЛ достигла терминальной стадии, которая характеризовалась возникновением тракционной отслойки сетчатки, субатрофией глазного яблока и функциональной гибелью глаза. Наряду с вышеперечисленными признаками у одного пациента мы выявили лимфоматозную инфильтрацию диска зрительного нерва в терминальной стадии заболевания. Среди наших 34 пациентов лишь у одной больной мы обнаружили витреоретинальную форму лимфомы. Это редкое клиническое наблюдение мы хотели бы представить.
Наблюдение
Пациентка Ч., 68 лет, в сентябре 2011 г. заметила зрительные расстройства левого глаза в виде нарушения цветоощущения. Через полгода этот глаз ослеп вследствие развития тотальной тракционной отслойки сетчатки. На ухудшение зрения правого глаза больная активно жалоб не предъявляла, но на глазном дне были выявлены диссеминированные хориоретинальные очаги (рис. 1). Рисунок 1. Рис. 1. Глазное дно правого глаза. Неоднократно больная была консультирована в различных ведущих офтальмологических учреждениях Москвы с диагнозами: «генерализованный хориоретинит правого глаза неясной этиологии», «тотальная отслойка сетчатки, исход гемофтальма левого глаза». В июле 2012 г. появились шаткость походки, головные боли, ухудшение памяти. МРТ головного мозга с контрастным усилением в Т1-взвешенном режиме выявила первично-множественные очаги поражения (рис. 2). Рисунок 2. Рис. 2. МРТ головного мозга в режиме Т1, аксиальная проекция: очаги В-клеточной лимфомы, расположенные перивентрикулярно (а) и в стволе головного мозга (б) (указаны стрелками). Была проведена стереотаксическая биопсия патологического очага, расположенного в области валика мозолистого тела. Последующий иммуногистохимический анализ выявил положительную экспрессию антигенов CD20 и СD45. Индекс мечения Ki-67=80%. Патоморфологический диагноз: «первичная лимфома ЦНС». Пациентка получила 6 сеансов интраартериальной химиотерапии метотрексатом. Курс лечения был прерван в связи с развитием тромбоза глубоких вен правой ноги.
При первом поступлении в НИИ нейрохирургии им. акад. Н.Н. Бурденко РАМН пациентка была осмотрена офтальмологом. Правый глаз: vis=1,0. Поле зрения - границы в норме (кинетическая периметрия), для выявления скрытых дефектов проведена автоматическая статическая периметрия (рис. 3). Рисунок 3. Рис. 3. Схема автоматической статической периметрии правого глаза. ВГД=16 мм рт.ст. (пневмотонометрия). Глазное яблоко спокойное, передний отрезок глаза не изменен. Начальное помутнение под задней капсулой хрусталика. Выраженная деструкция стекловидного тела с включением клеточных элементов. Глазное дно: (за легким флером) диск зрительного нерва светло-розовый, границы четкие, артерии сужены, вены умеренно полнокровны. В центральной зоне сетчатки, на ее ближней и дальней периферии, множественные округлые светло-желтые очаги с четкими краями, местами образующие гроздья, некоторые из них слабо пигментированы. Сетчатка прилежит на всем протяжении (см. рис. 1). При исследовании на спектральном оптическом когерентном томографе RTVue 100 («OPTOVUE», США) обнаружены участки истончения пигментного эпителия сетчатки и повреждения фоторецепторов (рис. 4). Рисунок 4. Рис. 4. Oптическая когерантная томограмма правого глаза. а - истончение пигментного эпителия сетчатки (стрелка); б - участки повреждения фоторецепторов (указаны стрелками).
Левый глаз: vis-ноль. ВГД=5 мм рт.ст. (пневмотонометрия). Глаз спокоен, субатрофия глазного яблока. Роговица прозрачна, преципитатов нет. Осложненная катаракта, из-за которой стекловидное тело не визуализируется, рефлекс с глазного дна отсутствует.
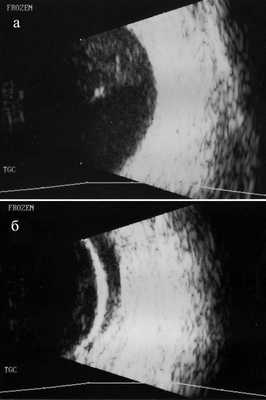
Ультразвуковое исследование глазных яблок в режиме «general» и «vitreous»: OD - в стекловидном теле участок повышения эхо-сигнала, сетчатка прилежит. OS - тотальная отслойка сетчатки с утолщением оболочек глаза. Инфильтрация стекловидного тела отсутствует (рис. 5). Рисунок 5. Рис. 5. В-сканы глазных яблок в витреальном режиме: небольшой участок повышения эхо-сигнала в стекловидном теле правого глаза (а); субатрофия глазного яблока, отслойка сетчатки, утолщение оболочек левого глаза (б).
Таким образом, у пациентки была клиническая картина, соответствующая интраокулярной лимфоме обоих глаз, OD - витреоретинальная форма, OS - исход в тракционную отслойку сетчатки и субатрофию глазного яблока.
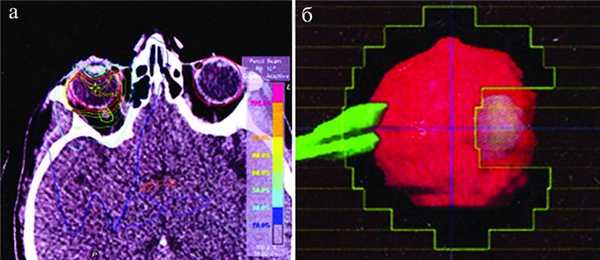
В качестве метода выбора лечения ИОЛ правого глаза больной была выполнена стереотаксическая радиотерапия (СРТ) на медицинском линейном ускорителе Novalis с микромультилепестковым коллематором. Дозиметрическое планирование осуществлялось с защитой хрусталика и зрительного нерва (рис. 6). Рисунок 6. Рис. 6. Карта дозиметрического планирования СРТ лимфомы правого глаза (а); схема защиты хрусталика и зрительного нерва (б). Объем мишени GTV=CTV=8,711 ссm, включен в 80% изодозную кривую. Энергия излучения 6 MэB. Облучение проводилось с трех динамических арок с одним изоцентром. Получена 21 фракция по 1,8 Гр, до суммарной дозы облучения СОД ср =37,8 Гр. Лечение больная перенесла хорошо, осложнений не наблюдалось. В связи с тем что запланированный курс лечения интраартериальной химиотерапией был прерван, спустя 1 мес после СРТ лимфомы правого глаза, было проведено облучение всего головного мозга на приборе Primus, СОД=14,4 Гр. Одновременно с этим на приборе Novalis проведена СРТ левого слепого глаза, СОД=40 Гр.
В процессе лечения отмечался лишь преходящий постлучевой эпидермит кожи век слева. Через 8 мес после СРТ острота зрения OD сохранилась на прежнем уровне. Небольшая инфильтрация стекловидного тела осталась без динамики. Новых очагов на глазном дне не выявлено. Таким образом, была достигнута стабилизация лимфоматозного процесса в правом глазу. Состояние левого глаза без динамики.
Результаты и обсуждение
Интраокулярная лимфома - «великий мистификатор», поэтому в литературе широкое распространение получил термин «маскарадный синдром» 3. В случаях преимущественного поражения стекловидного тела наиболее часто ИОЛ ошибочно принимают за увеит, гемофтальм, реже - витреит неясной этиологии. Следует отметить, что при лимфомном процессе отсутствуют признаки воспаления, такие как опалесценция жидкости передней камеры, распыление пигмента на передней капсуле хрусталика, задние синехии, гипопион. S. Coupland и соавт. [4] полагают, что длительное и безуспешное лечение таких больных глюкокортикоидной и антибиотикотерапией служит поводом для проведения диагностической пункции стекловидного тела. От гемофтальма ИОЛ отличается отсутствием скопления эритроцитов, которые вследствие наличия гемосидерина имеют характерное бурое окрашивание. Если ИОЛ поражает преимущественно сетчатку и возникают очаговые изменения, может фигурировать диагноз «хориоретинит неясной этиологии», как в нашем клиническом наблюдении. Очаги носят инфильтративный характер, имеют четкие границы и желтовато-кремовое окрашивание. По мнению S. Coupland и соавт. [4], в этом случае для верификации патологического процесса необходимо проведение трансвитреальной тонкоигольной биопсии такого новообразования. Мы воздержались от этой инвазивной процедуры, так как правый глаз у пациентки Ч. был единственно зрячим. Также имелось иммуногистохимическое подтверждение диагноза лимфомы головного мозга, что позволяло рассматривать процесс как единый, а именно как В-клеточную лимфому ЦНС. Оптическая когерентная томография также выявляла характерную картину, представляющую участки повреждения фоторецепторов и истончения слоя пигментного эпителия сетчатки, наглядно представленную в литературе [7].
По мнению разных авторов, наиболее частым осложнением и СРТ, и химиотерапии является развитие/прогрессирование катаракты. Так, R. Mikami и соавт. [11], анализируя группу из 22 пациентов с ИОЛ, которые получили радиотерапию с СОД=30-40 Гр, выявили развитие катаракты у 5 больных, что составило 45%. J. Smith и cоавт. [10] приводят сведения о более частом возникновении катаракты после интравитреальной химиотерапии ИОЛ с использованием метотрексата. В их группе из 16 пациентов токсическая катаракта развилась в 73% наблюдений. У нашей пациентки за период наблюдения после СРТ в течение 8 мес сохранилась высокая острота зрения, не было отмечено прогрессирования начальной катаракты. В то же время была достигнута редукция/стабилизация ретинальных очагов и инфильтрации стекловидного тела, что свидетельствует об адекватно подобранной дозе облучения.
ИОЛ имеет разнообразные клинические проявления и имитирует другие глазные заболевания, поэтому она может вызывать диагностические трудности у офтальмологов. Особенно часто это происходит в тех случаях, когда ИОЛ протекает самостоятельно или возникает задолго до поражения В-клеточной лимфомой головного мозга. СРТ является современным и эффективным методом лечения ИОЛ, позволяющим достичь ремиссии заболевания. Отсутствие своевременного лечения ведет к тотальной тракционной отслойке сетчатки и функциональной гибели глаза.
Радиотерапия первичных интраокулярных лимфом, ассоциированных с первичной лимфомой центральной нервной системы
Журнал: Журнал «Вопросы нейрохирургии» имени Н.Н. Бурденко. 2016;80(3): 74‑81
Цель исследования - определить показания к проведению стереотаксической радиотерапии (СРТ) первичной интраокулярной лимфомы (ПИОЛ) и оценить эффективность и уровень токсичности лечения. Материал и методы. 12 иммунокомпетентным пациентам с ПИОЛ, ассоциированной с первичной лимфомой ЦНС, проведена СРТ на область пораженного глаза/обоих глаз. Трем пациентам в связи с рецидивом ПИОЛ проведена повторная СРТ. Результаты. У 6 пациентов отмечено повышение остроты зрения. Отсутствовала динамика у пациентов с высокой остротой зрения, с амаврозом, с сопутствующими глазными заболеваниями. У 11 пациентов исчезла/уменьшилась инфильтрация стекловидного тела, за исключением 1 наблюдения с ретинальной формой ПИОЛ. Рецидив ПИОЛ развился у 6 пациентов. Безрецидивный период составил от 1 до 24 мес. Развитие/прогрессирование катаракты выявлено у 2 пациентов. Постлучевой эпидермит возник у 7 пациентов и имел кратковременный характер. У 3 пациентов развилась офтальмогипертензия. У 1 пациентки возник выворот нижнего века. Заключение. Применение СРТ показано при рецидиве ПИОЛ после ранее проведенных интравитреальных инъекций метотрексата, а также в случае невозможности реализации программы локальной химиотерапии. При сочетанном поражении головного мозга и глаз целесообразно при планировании облучения всего головного мозга включить в зону облучения глазные яблоки. При изолированном поражении лимфомой глаза (обоих глаз) и отсутствии признаков проявления болезни в головном мозге возможно проведение локальной СРТ. Проведение радиотерапии ПИОЛ позволяет добиться стойкого локального контроля заболевания с минимальными проявлениями токсичности.
Список сокращений
ОВГМ - облучение всего головного мозга
ПИОЛ - первичная интраокулярная лимфома
ПЛЦНС - первичная лимфома центральной нервной системы
ПЦР - полимеразная цепная реакция
РОД - разовая очаговая доза
СРТ - стереотаксическая радиотерапия
СОД - суммарная очаговая доза
АГ - аденома гипофиза
АТ-ТПО - антитела к тиреоидной пероксидазе
ГНА - гормонально-неактивная аденома гипофиза
ИМГ - иммуногистохимическое исследование
ИРФ-1 - инсулиноподобный ростовой фактор 1
ОГТТ - оральный глюкозотолерантный тест
ПГ - первичный гипотиреоз
СТГ - соматотропный гормон
Св.Т3 - свободный Т3
Св.Т4 - свободный Т4
ТТГ - тиреотропный гормон
ТТГ-АГ - ТТГ-секретирующая аденома гипофиза
ЭЭТА - эндоназальная транссфеноидальная аденомэктомия
Первичная ПИОЛ является подтипом ПЛЦНС, составляет 2-3% всех неходжкинских лимфом и встречается у 3-4% пациентов, имеющих опухоли головного мозга, чаще поражает лиц старше 60 лет [1, 2]. По данным разных авторов 2, ПИОЛ возникает у 11-25% пациентов с ПЛЦНС. Морфологический диагноз ПИОЛ, как и ПЛЦНС, более чем в 90% наблюдений представлен В-клеточным вариантом [6]. ПИОЛ вызывает, как правило, повреждение витреоретинального комплекса и носит двусторонний характер [2-5, 7], сопровождается снижением зрительных функций, появлением преципитатов на эндотелии роговицы (скопления В-клеточных лимфоцитов), лимфоидной инфильтрацией стекловидного тела, субретинальными инфильтратами. В терминальной стадии заболевания ПИОЛ вызывает тракционную отслойку сетчатки, приводящую к функциональной гибели глаза и амаврозу.
Основными методами инструментальной диагностики ПИОЛ являются биомикроскопия переднего отрезка глаза, УЗИ глазного яблока в «витреальном» режиме, офтальмоскопия глазного дна в условиях медикаментозного мидриаза.
В 2012 г. нами впервые были опубликованы собственные предварительные результаты лечения 7 пациентов с ПИОЛ, у которых проведены транссклеральные интравитреальные инъекции метотрексата через плоскую часть цилиарного тела [8]. У 4 из них развился рецидив ПИОЛ. Было принято решение о проведении радиотерапии в рамках комбинированного лечения ПИОЛ или самостоятельного лечения в случае невозможности химиотерапии на первом этапе лечения.
В зарубежной литературе [2, 5, 7, 9, 10] представлен опыт радиотерапии ПИОЛ. Так, R. Mikami и cоавт. [10] сообщают о 22 иммунокомпетентных пациентах с ПИОЛ, которым проведена СРТ с СОД от 30,0 до 40,0 Гр. Авторы делают вывод, что в 81% наблюдений после СРТ отмечалось повышение зрительных функций или их стабилизация, у 5 пациентов сформировалась катаракта, и в целом в результате СРТ получен локальный контроль опухоли. Данных по проведению радиотерапии ПИОЛ в отечественной литературе не представлено, что определяет актуальность этой работы [3, 11, 12].
Цель исследования - определить показания к проведению СРТ ПИОЛ и оценить эффективность и уровень токсичности лечения.
Материал и методы
В исследование включены 12 иммунокомпетентных пациентов (7 женщин в возрасте от 41 года до 74 лет и 5 мужчин в возрасте от 47 до 57 лет, средний возраст всех пациентов составил 58 лет) с ПИОЛ, ассоциированной с ПЛЦНС, получивших лечение в НИИ нейрохирургии им. акад. Н.Н. Бурденко с 2011 по 2015 г. (табл. 1).
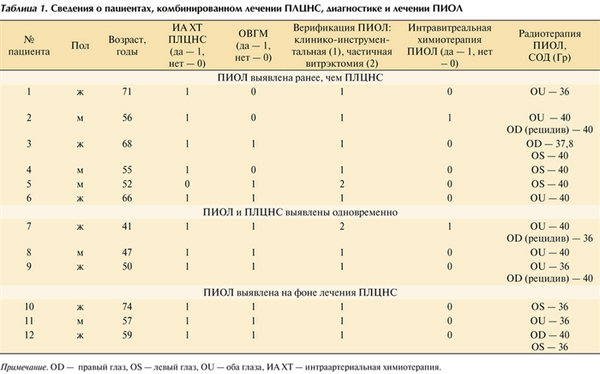
Таблица 1. Cведения о пациентах, комбинированном лечении ПЛЦНС, диагностике и лечении ПИОЛ Примечание. OD - правый глаз, OS - левый глаз, OU - оба глаза, ИА ХТ - интраартериальная химиотерапия.
Результаты
После проведения радиотерапии ПИОЛ у 6 пациентов отмечены повышение остроты зрения (табл. 2), исчезновение преципитатов на эндотелии роговицы. Зрительные функции остались без динамики, если пациент имел изначально высокое зрение (visus=1,0) или глаз, пораженный лимфомой, был слепым до СРТ (2 пациента). Также динамики зрительной функции не отмечалось у 4 пациентов, имевших сопутствующие глазные заболевания (катаракта, макулодистрофия, дистрофия сетчатки).
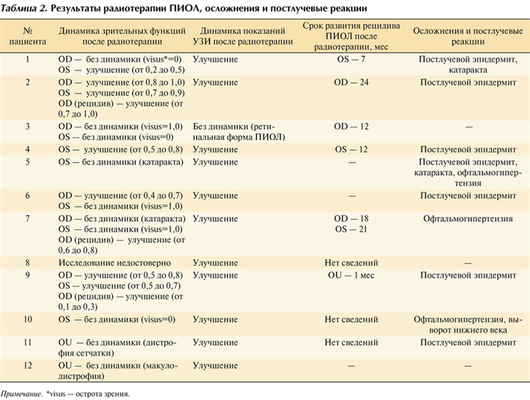
Таблица 2. Результаты радиотерапии ПИОЛ, осложнения и постлучевые реакции Примечание. *visus - острота зрения.
При проведении контрольного УЗИ после СРТ у 11 пациентов было отмечено уменьшение/исчезновение инфильтрации стекловидного тела лимфомными клетками. Исключение составил 1 случай, когда преобладали субретинальные лимфомные очаги. У 1 пациентки с терминальной стадией ПИОЛ после СРТ купировался болевой синдром.
Рецидив ПИОЛ после СРТ развился в половине наблюдений (6 пациентов), безрецидивный период составил от 1 до 24 мес. У 2 пациентов на фоне облучения глазных яблок отмечено развитие/прогрессирование катаракты, требующей хирургического вмешательства. Современные возможности офтальмохирургии позволяют решить эту проблему. Постлучевой эпидермит был отмечен у 7 больных и носил кратковременный характер. У 3 пациентов развилась офтальмогипертензия, купированная гипотензивными каплями. У 74-летней пациентки после СРТ интраокулярной лимфомы возник выворот нижнего века.
Клиническое наблюдение
Пациентка Л., 41 года, впервые была госпитализирована в НИИ нейрохирургии в 2010 г. с диагнозом: опухоль левой задне-лобно-теменной области, которая проявлялась эпилептическими приступами и моторной афазией. Проведена операция по удалению внутримозговой опухоли с интраоперационным картированием речевых и двигательных центров. Морфологический диагноз: В-клеточная лимфома с положительной экспрессией специфических маркеров - OLA, СD 10, CD 20.
Проведено 9 сеансов интраартериальной химиотерапии метотрексатом с предварительным открытием гематоэнцефалического барьера, получен полный ответ на лечение. Безрецидивный период составил 19 мес.
Одновременно с клиническими проявлениями ПЛЦНС при осмотре офтальмолога обнаружена ПИОЛ обоих глаз в начальной стадии развития. После частичной витрэктомии с аспирационной биопсией стекловидного тела проведена ПЦР, которая выявила B-клеточную клональность по реаранжировкам генов тяжелой цепи иммуноглобулина * * . Выполнено 25 транссклеральных инъекций метотрексата в стекловидное тело правого глаза * . В конце лечения отмечена положительная динамика в виде стабилизации опухолевого процесса, но развилась осложненная катаракта. Проведена операция экстракции катаракты с имплантацией интраокулярной линзы. Через 3 мес после интравитреальных инъекций возник рецидив ПИОЛ правого глаза (рис. 1, а) и проведена СРТ * * * .
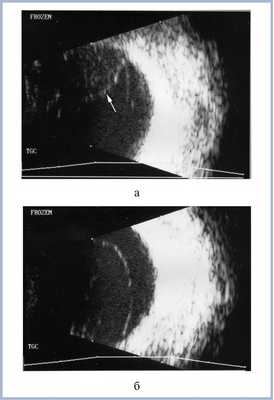
Рис. 1. УЗИ правого глазного яблока в «витреальном режиме». 0 - рецидив интраокулярной лимфомы (указано стрелкой) перед СРТ; б - регресс лимфомы через 1 мес после СРТ.
Использовали линейный ускоритель «Novalis» с микролепестковым коллиматором. Облучение проводилось с трех динамических арок с одним изоцентром, с защитой критических структур (зрительного нерва и сетчатки). Объем мишени - GTV=CTV=7,516 см 3 - включен в 80% изодозную кривую (рис. 2).
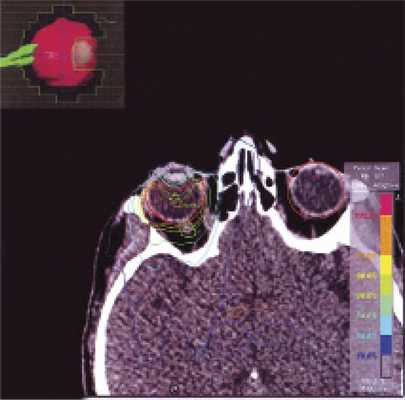
Рис. 2. Изодозное распределение при СРТ интраокулярной лимфомы на линейном ускорителе Novalis.
В процессе лечения подведено 20 фракций с РОД=1,8 Гр до СОД ср.=36,0 Гр. Облучение проводили 5 дней в неделю. На фоне лучевой терапии возникла офтальмогипертензия, которая была купирована инстилляциями Sol. Arutimoli 0,5%. В результате СРТ достигнута полная регрессия ПИОЛ (см. рис. 1, б), безрецидивный период составил 18 мес. Затем появились преципитаты на эндотелии роговицы, увеличилась инфильтрация стекловидного тела лимфомными клетками, что было расценено как локальный рецидив. Одновременно контрольная МРТ головного мозга выявила появление очага накопления контраста в правой теменной области - рецидив лимфомы полушарной локализации (рис. 3).
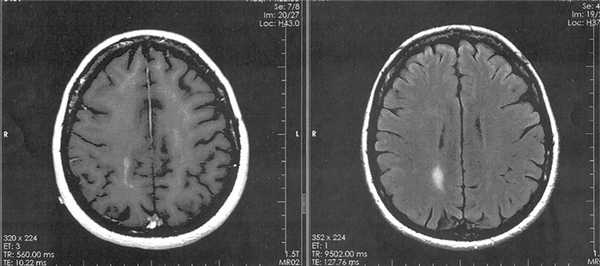
Рис. 3. МРТ головного мозга в аксиальной проекции: слева - в режиме Т1, справа - в режиме FLAIR, T2 (очаг накопления контраста в правой теменной области).
На линейном ускорителе Primus проведен курс СРТ * * * : к мишени «весь головной мозг и область правого глаза» (PTV=1328,8 ccm) подведено 20 фракций с РОД=1,8 Гр до СОД ср.=36,0 Гр в режиме классического фракционирования (рис. 4).
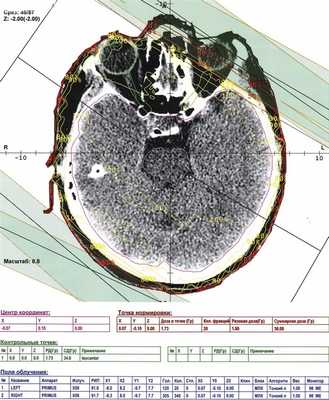
Рис. 4. План ОВГМ с одновременным облучением пораженного глазного яблока на линейном ускорителе Primus. Изодозное распределение, ориентация полей.
Контрольная МРТ головного мозга после облучения не выявила очага накопления контраста в правой теменной области или появления новых очагов лимфомы (рис. 5).
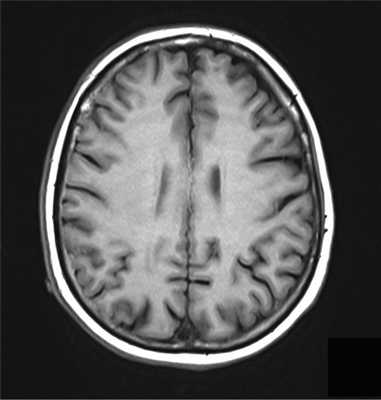
Рис. 5. МРТ головного мозга в аксиальной проекции через 3 мес после облучения на линейном ускорителе Primus.
Со стороны глаза также отмечалась положительная динамика: исчезли преципитаты на эндотелии роговицы, менее интенсивной стала инфильтрация стекловидного тела лимфомными клетками. Безрецидивный период к настоящему моменту составил 9 мес.
После завершения локальной химиотерапии ПИОЛ правого глаза проведена курсовая химиотерапия ПИОЛ левого глаза (20 интравитреальных инъекций метотрексата) * , в результате которой достигнута ремиссия. Безрецидивный период прослежен в течение 5 мес. В связи с рецидивом ПИОЛ левого глаза на линейном ускорителе Novalis проведена СРТ * * * , подведено 20 фракций с РОД=2,0 Гр до СОД ср.=40,0 Гр. В конце СРТ наступила полная регрессия ПИОЛ. Рецидив возник через 21 мес. Решается вопрос о проведении повторной СРТ.
Развитие современных методов лечения злокачественных заболеваний головного мозга изменило качество и продолжительность жизни больных. ПЛЦНС и ПИОЛ являются междисциплинарной проблемой и требуют участия патоморфолога, рентгенолога, нейрохирурга, химиотерапевта, радиолога, офтальмолога, гематолога. Известно, что В-клеточная лимфома ЦНС обладает высокой чувствительностью к ионизирующему излучению, что позволяет применять радиотерапию как эффективный метод лечения этой злокачественной опухоли. Сочетанное поражение B-клеточной лимфомой головного мозга и глазных яблок является свидетельством ее «тропности» к этим органам-мишеням [3, 8]. Клиническая манифестация ПИОЛ может опережать развитие ПЛЦНС. В этом случае возникает так называемый «маскарадный синдром», когда ошибочно диагностируют «увеит», «витреит», «гемофтальм», «диффузный васкулит сетчатки», «хориоретинит», и проводимая в связи с этим противовоспалительная или глюкокортикоидная терапия оказывается неэффективной [3, 4, 7, 12-15]. В-клеточная лимфома может обнаруживаться одновременно в головном мозге и глазном яблоке. Реже ПИОЛ развивается отсроченно после успешно проведенного лечения ПЛЦНС или рецидивирует после локальной химиотерапии, радиотерапии при отсутствии признаков поражения головного мозга. Возникает вопрос, как лечить этих больных в каждом конкретном случае?
На собственном опыте лечения ПИОЛ нами выработан и принят следующий алгоритм. Если на момент ОВГМ выявлялись клинические проявления ПИОЛ, при планировании радиотерапии в зону облучения включали пораженное глазное яблоко. При первичном поражении глазного яблока и отсутствии признаков заболевания в головном мозге или в случае рецидива ПИОЛ после предварительного введения метотрексата в полость глаза, СРТ интраокулярной лимфомы проводили локально на область глаза. Дозы облучения как при локальной СРТ, так и при ОВГМ с захватом области глазных яблок были одинаковы. Учитывая потенциальную суммарную токсичность радиотерапии, одинаковую дозу применяли для различных стадий ПИОЛ и при ее рецидиве.
Проведение СРТ при редкой форме ПИОЛ, поражающей преимущественно сетчатку, позволило отсрочить наступление амавроза единственно зрячего глаза [15]. Через 12 мес после СРТ развился рецидив с тракционной отслойкой сетчатки, и этот глаз ослеп.
Особый интерес, на наш взгляд, представляет и клиническое наблюдение пациентки Л., приведенное выше, которой СРТ проведена повторно с интервалом в 2,5 года и дала ремиссию в течение 9 мес к моменту написания статьи.
Длительность СРТ в среднем составляет 1 мес, курсовое лечение при введении метотрексата в полость глаза проводится в течение 9 мес. После интравитреального введения метотрексата у 2 из 7 пациентов развилась осложненная катаракта, что сопоставимо с количеством 2 больных с постлучевой катарактой. Упоминаемая в литературе постлучевая ретинопатия в серии наших больных не встречалась [9]. Сравнивая эффекты от СРТ и химиотерапии ПИОЛ, можно отметить, что облучение глаза, как неинвазивный метод лечения, переносилось пациентами легче.
Применение радиотерапии показано при рецидиве ПИОЛ после ранее проведенных интравитреальных инъекций метотрексата, а также в случае невозможности реализации программы локальной химиотерапии. При сочетанном поражении головного мозга и глаз и принятии решения о проведении ОВГМ целесообразно при планировании лучевой терапии включить в зону облучения глазные яблоки. При изолированном поражении глаза (или обоих глаз) лимфомой и отсутствии признаков проявления болезни в головном мозге возможно проведение локальной СРТ. Проведение радиотерапии ПИОЛ позволяет добиться стойкого локального контроля заболевания с минимальными проявлениями токсичности.
Конфликт интересов отсутствует.
Комментарий
Наличие и успешная работа современного радиологического отделения в НИИ нейрохирургии им. Н.Н. Бурденко коренным образом изменили подходы к лечению больных с онкологическими заболеваниями не только по профилю «нейрохирургия», но и по другим смежным специальностям. В частности, это коснулось такой междисциплинарной проблемы, как первичные интраокулярные лимфомы. Авторы статьи представили первый российский опыт применения радиотерапии этой патологии с хорошими результатами - стойким контролем заболевания и минимальными проявлениями радиотоксичности. Предложен уже апробированный алгоритм действий, учитыващий наличие очага поражения в головном мозге, а также применение химиотерапии в процессе лечения. На мой взгляд, представлен материал, крайне необходимый и востребованный в практике врачей разных специальностей: нейрохирургов, офтальмологов, радиологов, химиотерапевтов, гематологов, участвующих в лечении первичных интраокулярных лимфом.
В.А. Лазарев (Москва)
* В лаборатории молекулярной гематологии Гематологического научного центра РАМН.
* В отделении радиологии и радиохирургии НИИ нейрохирургии им. акад. Н.Н. Бурденко.
Читайте также:
- Терминология расположения сердца. Термины транспозиции сосудов
- Причины и диагностика серной пробки наружного слухового прохода
- Липидный обмен при нейроциркуляторной дистонии. Клиника перехода вегето-сосудистой дистонии в ИБС
- Острый нелимфобластный лейкоз с мультилинейной дисплазией
- Обсуждение анализа затрат-результативности в медицине. Анализ затрат-полезности
