Примеры метастазов в хориоидею оранжевого цвета
Добавил пользователь Дмитрий К. Обновлено: 28.01.2026
ФГБУ "НИИ глазных болезней" РАМН, Москва
Кафедра офтальмологии ГБОУ ДПО "Российская медицинская академия последипломного образования"
Выживаемость больных меланомой хориоидеи больших размеров
Журнал: Вестник офтальмологии. 2014;130(4): 39‑44
Стоюхина А.С., Чесалин И.П. Выживаемость больных меланомой хориоидеи больших размеров. Вестник офтальмологии. 2014;130(4):39‑44.
Stoiukhina AS, Chesalin IP. Survival rates for large choroidal melanomas. Vestnik Oftalmologii. 2014;130(4):39‑44. (In Russ.).
В современной онкологии одним из важных критериев оценки эффективности лечения принято считать 5- и 10-летнюю выживаемость больных после проведенного лечения.
Общая 5-летняя выживаемость больных меланомой хориоидеи (МХ) после лечения, по данным литературы, составляет 72% [1]. Следует подчеркнуть, что авторы не приводят сведений о зависимости выживаемости от метода лечения и исходных размеров опухоли. В то же время имеются данные о 79-95% 5-летней [2, 3] и 85% 10-летней [4] выживаемости больных МХ после брахитерапии (БТ).
Что касается энуклеации как метода лечения глаз с МХ, то имеются сведения, указывающие на зависимость смертности в течение 5 лет после энуклеации от исходных размеров опухоли. Так, при малых меланомах она составляет 16%, при опухолях средних размеров - 32%, а при больших МХ достигает 53% [5]. Спустя 15 лет после публикации указанных сведений появились исследования J. Gambrelle и соавт. [6], доказывающие низкую 5-летнюю специфическую выживаемость после первичной энуклеации (всего 31,45%). Все перечисленные данные касаются европейской популяции больных, в которой, как известно, преобладает смешанно-клеточный гистотип меланомы, который следует расценивать как один из неблагоприятных прогностических факторов 7.
В немногочисленной отечественной литературе приведены сравнительные показатели продолжительности жизни больных МХ после локального разрушения опухоли и энуклеации при больших МХ [10, 11]. Но в данных работах отсутствует сравнительная характеристика результативности как органосохранного, так и ликвидационного (энуклеация) лечения с учетом исходных размеров опухоли.
Как известно, при анализе выживаемости больных МХ имеют значение не только клиническая стадия и размеры опухоли, но и ее гистологический, генетический типы и уточненная причина смерти [13].
По данным COMS, 2-, 5- и 10-летний уровень метастазирования МХ составляет 10, 25 и 34% соответственно и только у 0,24% больных метастазы выявляют в момент постановки диагноза [14]. Но каждый 1 мм увеличения толщины меланомы повышает риск метастазирования в течение 10 лет на 5% [15]. Таким образом, исходные размеры опухоли являются определяющими для оценки витального прогноза.
С учетом изложенного возрастает значение метрической классификации меланом хориоидеи.
В настоящее время существуют две наиболее часто используемые метрические классификации МХ. Речь идет о классификациях J. Shields [16] и COMS (Collaborative Ocular Melanoma Study) [17]. Параметры МХ, согласно приведенным классификациям, представлены в табл. 1.
Как следует из табл. 1, в классификации COMS значительно увеличена толщина меланом в группе средних и больших опухолей. Это, естественно, привело к расширению показаний для их органосохранного лечения. Локальное разрушение опухоли (БТ, транспупиллярная термотерапия - ТТТ) начали проводить при проминенции ее более 6 мм [18, 19].
Обоснованием такого подхода к лечению МХ явились сведения о том, что общая и специфическая смертность, а также продолжительность жизни без метастазов достоверно не различаются после энуклеации и органосохранного лечения больших МХ [11, 20, 21].
В связи с изложенным была сформулирована цель настоящего исследования: проанализировать 5-летнюю специфическую выживаемость пациентов с большими МХ (по классификации J. Shields) с учетом проведенного лечения.
Материал и методы
Методом сплошной выборки исследована медицинская документация 103 больных, получивших лечение по поводу больших МХ в различных специализированных офтальмологических центрах Москвы в течение 2002-2007 гг. и находящихся на диспансерном наблюдении в городском офтальмоонкологическом центре при Московской офтальмологической больнице. В исследование включены пациенты с исходной проминенцией опухоли от 5,0 до 10,2 мм, так как при наличии б́ольшей проминенции опухоли органосохранное лечение не проводили. Исходный диаметр основания опухоли варьировал от 7,3 до 20 мм. До начала лечения, по данным проведенного общего обследования, метастазы у всех пациентов отсутствовали.
Органосохранное лечение получили 60 человек. БТ была выполнена 46 пациентам (в 37 случаях однократно), БТ в сочетании с ТТТ - 14 больным (в одном случае с последующей эндорезекцией опухоли). В этой группе у 16 больных была выполнена вторичная энуклеация.
Первичная энуклеация по поводу большой МХ проведена 63 больным.
Протоколы патогистологического исследования, подтверждающие диагноз МХ, изучены во всех 79 случаях.
Статистическая обработка результатов выполнена в программах Microsoft Excel и Statistica 6.0. Для оценки выживаемости использовали метод Каплана-Мейера и двувыборочный анализ по Гехану-Вилкоксону, в котором группирующей переменной являлся тип лечения.
Результаты и обсуждение
В зависимости от проведенного лечения пациенты разделены на две группы. 1-ю группу составили лица, получившие органосохранное лечение (в том числе и те, которым была выполнена вторичная энуклеация), во 2-й группе единственным методом лечения была первичная энуклеация. Характеристика обеих групп представлена в табл. 2.
Как следует из табл. 2, представленные группы по показателям практически не различались и все МХ по проминенции выходили за пределы 6 мм, иными словами, были отнесены к большим опухолям.
В 1-й группе от гематогенного метастазирования умерли 16 (26,67%) больных в среднем через 4,06±1,03 года после начала лечения. Обращает на себя внимание тот факт, что средний исходный диаметр опухоли у этих больных составил 15,37±1,24 мм, что достоверно отличалось (р=0,002) от исходного диаметра у пациентов без метастазов (13,12±0,78 мм). Достоверных различий в исходной проминенции МХ получено не было (6,68±0,64 и 7,06±0,44 мм соответственно). Таким образом, нельзя исключить из факторов риска метастазирования и диаметр опухоли.
У 16 больных этой группы была выполнена вторичная энуклеация в среднем через 2,95±1,44 года после начала лечения. До лечения у этих больных средняя максимальная проминенция опухоли составляла 7,33±1,82 мм, а средний максимальный диаметр - 13,82±1,52 мм. Таким образом, указанные параметры меланомы у этих больных существенно не отличались от исходных размеров опухоли у пациентов, получивших только органосохранное лечение.
Как показывают наши наблюдения, вторичную энуклеацию после органосохранного лечения больших МХ пришлось выполнить у 26,67% больных, основной причиной для энуклеации явился продолженный рост опухоли.
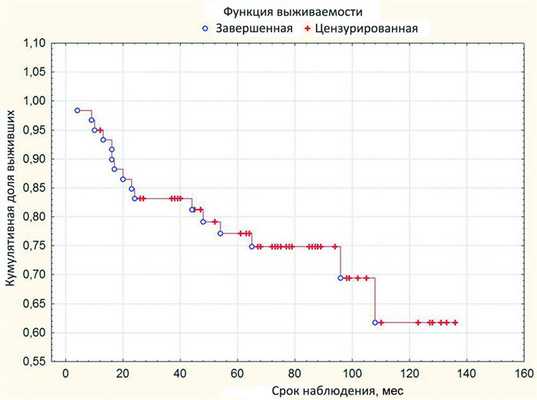
При анализе по Каплану-Мейеру 5-летняя выживаемость без энуклеации составляет 0,7708, стандартная ошибка 0,0563, а 9-летняя - достигает 0,6175 при стандартной ошибке 0,0988 (рис. 1). Рисунок 1. Рис. 1. Выживаемость без энуклеации после проведения органосохранного лечения.
И тем не менее, в наших наблюдениях в среднем через 35 мес энуклеация оказалась необходимой практически у каждого 4-го больного. Полученные данные совпадают с данными литературы о высоком риске энуклеации после проведении БТ с рутением-106 в течение 5 лет наблюдения [2].
Во 2-й группе от гематогенного метастазирования умерли 10 (15,83%) пациентов в среднем через 5,2±1,54 года после энуклеации. Несмотря на то что исходные размеры опухолей у этих больных несколько превышали таковые у больных без метастазов, статистической значимости различий не получено.
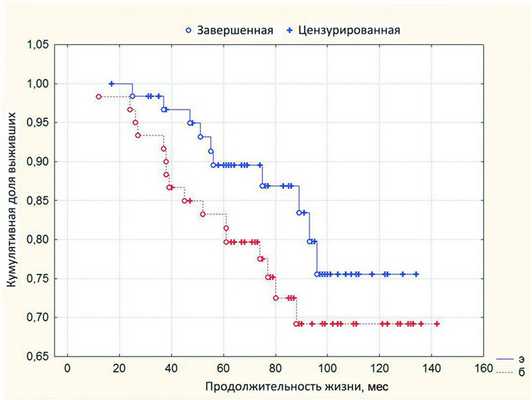
Таким образом, в группе больных, перенесших первичную энуклеацию, витальный прогноз оказался несколько лучше, чем после органосохранного лечения. Тем не менее при проведении двухвыборочного анализа по Геноху-Вилкоксону статистически значимой разницы в выживаемости (р=0,11) у пациентов этих двух групп не получено (рис. 2). Рисунок 2. Рис. 2. Выживаемость после органосохранного лечения (б) и первичной энуклеации (э). Разница продолжительности жизни также оказалась статистически недостоверной (р=0,17).
Как видно из табл. 3 , имеются различия в результатах, полученных в ходе исследований [11, 20], которые можно объяснить разным подходом к формированию групп исследования. К примеру, в работе Т.В. Шириной [20] сравниваются группы больных, получивших только органосохранное лечение, с группой больных, которым была проведена и первичная, и вторичная энуклеация. С нашей точки зрения, это не совсем корректно, так как проведение предшествующего органосохранного лечения также может оказывать влияние на витальный прогноз (техника проведения операции, гистотип опухоли). Кроме того, при исследовании общей выживаемости не учтен возраст больных в анализируемых группах. А между тем хорошо известно, что старший возраст больных - один из факторов риска метастазирования меланомы. В работе А.А. Ярового и соавт. [11] сравниваются показатели метастазирования после органосохранного лечения и первичной энуклеации больших меланом. Случаи вторичной энуклеации не включены в исследование. Хотя доказано, что продолжительность жизни больных с момента выявления метастазов может достигать 62 мес и зависит от общеонкологического лечения [12].
Заключение
Как показали наши исследования, при условии однотипности исходных биометрических показателей опухоли после первичной энуклеации витальный прогноз несколько лучше, чем после органосохранного лечения, даже с учетом старшего возраста больных этой группы.
Следует отметить, что после органосохранного лечения за более короткий промежуток времени (в 1,3 раза) от гематогенного метастазирования умерли в 1,6 раза больше больных, чем после первичной энуклеации, хотя при анализе по Гехану-Вилкоксону подтверждения статистической значимости этих различий не получено.
Таким образом, в каждом конкретном случае большой МХ следует подходить индивидуально и решать вопрос о методе лечения с учетом возраста больных, размеров опухоли и психологического настроя пациентов. Следует учитывать, что даже при отсутствии достоверной разницы выживаемости у пациентов со средними МХ, получивших БТ и перенесших энуклеацию, имеются различия в качестве жизни: у пациентов, перенесших энуклеацию, достоверно ниже частота тревожных состояний, связанных с риском рецидива опухоли [22].
Опухоли хориоидеи
Опухоли хориоидеи - это группа патологических образований сосудистой стенки, которая включает в себя невус, увеальную меланому и гемангиому. В течение длительного промежутка времени клинические симптомы отсутствуют. Снижение остроты зрения и страбизм возникают только при увеличении диаметра новообразования. Диагностика опухолей хориоидеи основывается на проведении офтальмоскопии, визометрии, ФАГ, биомикроскопии, ОКТ, УЗД. В зависимости от формы заболевания тактика лечения сводится к проведению лазерной коагуляции, криотерапии, брахитерапии, фотодинамической терапии, транспупиллярной термотерапии. При отсутствии эффекта или большом размере опухоли хориоидеи показана энуклеация.
Общие сведения
Опухоли хориоидеи - это доброкачественные или злокачественные новообразования сосудистой оболочки глазного яблока. Невус - наиболее распространённое доброкачественное образование органа зрения. Частота его выявления при офтальмоскопии составляет 2%. В тоже время, при аутопсии данную патологию диагностируют у 6,5-20% пациентов. У лиц женского и мужского пола невусы определяются в равной степени. Распространенность увеальной меланомы среди всех патологий глаз составляет 5%. Риск образования этой опухоли хориоидеи существенно увеличивается с возрастом больного и после 69 лет с каждым годом возрастает на 50 случаев (из расчета на 1 млн. населения). Общая заболеваемость гемангиомой глаза среди общего числа интраорбитальных патологических новообразований составляет 0,76%. Данный вид опухоли хориоидеи встречается во всех возрастных группах, но чаще диагностируется после 10 и до 60 лет.
Причины
Зачастую опухоли хориоидеи развиваются спорадически. Однако в литературе описаны семейные случаи увеальной меланомы, что позволяет отнести ее к числу генетически детерминированных патологий. Дисфункция генов-супрессоров опухолевого роста (CDKN2A, CDK4) приводит к развитию хромосомных мутаций, локализирующихся на коротком плече 21 или длинном плече 14 хромосомы. Каскад патологических процессов включает в себя нарушение синтеза белков p16 и p14ARF. Развитию данной опухоли хориоидеи может предшествовать окулодермальный меланоз или нарушение пигментного обмена. Нередко она возникает в результате малигнизации прогрессирующего невуса, но наиболее распространенная причина появления неоплазии - мутация «de novo». С учетом морфологической картины различают веретеноклеточный, эпителиоидный и смешанный варианты увеальной меланомы. Специфическая окраска опухоли хориоидеи обусловлена отложением липофусциновых зёрен.
Гемангиома относится к числу гамартом. Причина образования - тканевая аномалия развития. Состав новообразования имеет те же компоненты, что и окружающие ткани, но степень его дифференциации и строение резко нарушены. Риск развития опухолей хориоидеи возрастает при длительном контакте с ультрафиолетовым излучением или на фоне солнечных ожогов глаз. В популяции заболевание чаще встречается среди лиц, в фенотипе которых присутствуют голубые глаза, светлая кожа и волосы, множественные невусы (более 50).
Симптомы опухолей хориоидеи
С клинической точки зрения выделяют сосудистые и пигментные опухоли хориоидеи. Также различают доброкачественные и злокачественные новообразования. К пигментным формам относят невусы (стационарные и прогрессирующие). В большинстве случаев это врожденный вид опухолей хориоидеи, но интенсивность пигментной окраски усиливается после 30-летнего возраста. Их выявляют в заднем полюсе глазного яблока, реже в экваториальной области или перед ней. Описаны случаи бинокулярного поражения органа зрения. Как правило, течение заболевания бессимптомное. Увеличение в размере прогрессирующего невуса в редких случаях приводит к снижению остроты зрения.
Клинические проявления увеальной меланомы зависят от ее диаметра и степени вовлечения в патологический процесс окружающих сосудов. Ангиогенез в области опухоли хориоидеи и изменения сосудистой стенки (утолщение и уплотнение) приводят к разрыву внутренней оболочки глазного яблока. Зачастую симптоматика отсутствует. В редких случаях пациенты предъявляют жалобы на вспышки света, снижение зрительных функций, появление «мушек» или «чёрной занавеси» перед глазами. При большой распространенности опухолевого процесса у больных прогрессивно снижается острота зрения.
Гемангиома относится к группе доброкачественных опухолей хориоидеи. Для нее характерен быстропрогрессирующий рост, который очень часто приводит к полной отслойке сетчатки. Первый симптом заболевания у взрослых - нарушение зрительных функций. В детском возрасте данная опухоль хориоидеи становится причиной страбизма. С клинической точки зрения выделяют ограниченную и диффузную формы. При ограниченном варианте формируется небольшой узел с четко очерченными краями. Клинические проявления мало выражены. При диффузном распространении опухолевого процесса, заболевание осложняется энцефалофациальным ангиоматозом (синдром Стерджа-Вебера).
Диагностика
Диагностика опухолей хориоидеи основывается на результатах офтальмоскопии, визометрии, флуоресцентной ангиографии, биомикроскопии, оптической когерентной томографии (ОКТ), ультразвукового исследования (УЗД) в В-режиме. При офтальмоскопии невусы имеют вид плоских, приподнятых над уровнем окружающих тканей образований размером до 0,1 см. В зависимости от выраженности пигментации их цвет варьирует от сероватого до серо-коричневого. Границы зачастую неровные, но с четкими очертаниями. Неровность контуров обусловлена прилежащими сосудами. Для невусов, лишенных пигмента, характерна овальная или округлая форма с ровными, но менее очерченными контурами. В отличие от прогрессирующих невусов, на поверхности стационарных присутствуют друзы. Для их дифференциальной диагностики проводится офтальмоскопия с цветными фильтрами. Красная окраска фильтра позволяет визуализировать данный тип опухоли хориоидеи, при зеленой патологическое образование не определяется.
Методом флуоресцентной ангиографии при стационарной форме выявляется снижение флуоресценции на протяжении всего обследования. При этом в окружающей сосудистой оболочке изменения не выявляются. Об изменениях хориоидеи свидетельствует пропотевание и яркое свечение красителя. При офтальмоскопии увеальной меланомы обнаруживается небольшой узелок с постэкваториальной локализацией. Опухоль хориоидеи - желто-коричневой или аспидной окраски с друзами на поверхности или в окружающих тканях. Методом ОКТ устанавливается точная локализация, размеры, степень распространения на окружающие ткани. У большинства пациентом при визометрии диагностируется снижение остроты зрения.
При проведении офтальмоскопии отграниченная гемангиома имеет вид небольшого узелка округлой формы с ровными контурами диаметром 0,3-1,5 см. Средняя толщина патологического образования составляет 0,3-0,4 см. Цвет данной формы опухоли хориоидеи - от светло-серого до темно-красного. Для дифференциальной диагностики гемангиомы от меланомы следует провести флуоресцентную ангиографию. При гемангиоме средний диаметр сосудов опухоли соответствует таковому сосудов хориоидеи, также на ее поверхности могут появляться небольшие очаги кровоизлияния. Из-за прогрессирующего ангиогенеза при меланоме новообразованные капилляры имеют меньший калибр и более извитой ход. На УЗД опухоли хориоидеи определяется ток крови и характерная пульсация сосудов, что позволяет подтвердить диагноз. Наружный осмотр проводится для выявления типичной симптоматики страбизма.
Лечение опухолей хориоидеи
Тактика лечения при опухолях хориоидеи зависит от формы заболевания. При появлении признаков, свидетельствующих о трансформации стационарного невуса в прогрессирующий, показана лазерная коагуляция. При обнаружении увеальной меланомы большого размера следует провести энуклеацию глазного яблока. Если диаметр патологического новообразования незначительный, а опухоль не распространяется за пределы первичного очага, рекомендована контактная лучевая терапия (брахитерапия глаза). Преимущество данного метода лечения опухолей хориоидеи - местное воздействие на меланому максимальной дозой лучевой терапии. При этом на окружающие ткани и критические органы излучение не влияет. Альтернативный вариант - транспупиллярная диод-лазерная термотерапия. Данный метод относится к числу малоинвазивных техник. При этом вся процедура проводится под визуальным контролем.
Выявление гемангиомы - это показание к проведению оперативного вмешательства, что обусловлено большим риском экссудативной отслойки сетчатки и снижения зрительных функций. В лечении отграниченной формы опухоли хориоидеи используется криотерапия, брахитерапия, фотодинамическая терапия и транспупиллярная диод-лазерная термотерапия. Высокой эффективностью обладает лазерокоагуляция в желтом спектре излучения. Тактика лечения сводится к облитерации кровеносных сосудов. Преимущество этой методики - ликвидация выпота экссудата из новообразованных сосудов за счет адгезии пигментного слоя и сенсорной сетчатки. Субретинальная жидкость при этом резорбируется.
Прогноз и профилактика
Специфических мер по профилактике опухолей хориоидеи в офтальмологии не разработано. Все пациенты с установленным диагнозом доброкачественного или злокачественного новообразования сосудистой оболочки должны находиться на диспансерном учете у офтальмолога. После проведения оперативного лечения периодически необходимо проходить профилактическое обследование у специалиста, ограничить пребывание на солнце, избегать работы при высокой температуре окружающей среды.
Прогноз для жизни и трудоспособности при стационарной форме невуса благоприятный. Прогрессирующий вариант следует рассматривать как предраковое состояние. Наиболее злокачественная среди опухолей хориоидеи - меланома, прогноз для жизни определяется стадией развития. Гемангиома сосудистой оболочки - прогностически благоприятное заболевание, однако у отдельных больных возможна полная потеря зрения.
Меланома хориоидеи
Меланома хориоидеи - это злокачественное новообразование сосудистой оболочки глаза с преимущественно гематогенным путем метастазирования. Клинически наиболее часто проявляется болевым синдромом, снижением остроты зрения, фотопсиями и метаморфопсиями. Диагностика заключается в проведении биомикроофтальмоскопии, офтальмоскопии, флуоресцентной ангиографии, ультразвукового доплеровского цветного картирования, КТ и МРТ. Распространенными методами лечения меланомы хориоидеи являются лучевая терапия и энуклеация. Также возможны проведение брахитерапии с диод-лазерной термотерапией, эндовитреальное удаление опухоли и эндорезекция меланомы хориоидеи.
Меланома хориоидеи - это генетически-детерминированная опухоль, которая развивается спорадически или у лиц с отягощенным семейным анамнезом по поводу данного заболевания. Впервые меланому хориоидеи описал Г. Бартиш в 1563 году. Детальная характеристика заболевания в офтальмологии была представлена в 1819 году французским врачом Рене Лаэннеком. Согласно статистическим данным, около 70% от всех злокачественных опухолей глаз занимает увеальная меланома. Общая распространенность в популяции составляет 9:1000000. Наиболее часто патология встречается в скандинавских странах, Франции и Израиле. Неоплазия чаще развивается у людей со светлыми глазами. Меланому хориоидеи обычно диагностируют в возрасте 50-60 лет. Дети болеют очень редко, казуистическими являются случаи заболевания у младенцев. Большему риску развития онкологического новообразования подвержены лица белой расы, мужчины страдают данным заболеванием реже женщин.
Причины меланомы хориоидеи
Зачастую этиологию меланомы хориоидеи установить не удается, поскольку опухоль развивается спорадически. Прослеживается генетическая предрасположенность к развитию этой патологии. В 0,37% случаев заболевание носит семейный характер. Триггерами являются мутации гена GNAQ или GNA11. Патологические изменения в одном из генов исключают развитие изменений в другом, поскольку при обеих мутациях в процесс вовлечен кодон Q209 (5 экзон) или R183 (4 экзон). Редкая причина меланомы хориоидеи - аномалии генов BRAF, NRAS. При этом имеют место мутации 3 (моносомия), 6 или 8 (трисомия) хромосомы.
Существенные отличия молекулярно-генетического профиля меланомы хориоидеи приводят к тому, что современные методы лечения меланомы других локализаций оказываются неэффективными в отношении этой формы заболевания. Появлению патологического новообразования обычно не предшествуют изменения со стороны сосудистой оболочки, реже меланома образуется на месте невуса хориоидеи или окулодермального меланоза. Предрасполагающими факторами являются голубой цвет глаз, 1 и 2 фототипы кожных покровов по Фицпатрику. Отрицательное влияние ультрафиолетового излучения на развитие новообразований хориоидеи не доказано.
Симптомы меланомы хориоидеи
Клинические проявления меланомы хориоидеи разнообразны и зависят от размеров и типа роста новообразования. Выделяют узловой, диффузный и чашеобразный характер роста. Для опухоли более свойственна постэкваториальная локализация, реже - преэкваториальная или экваториальная. Как правило, в патологический процесс вовлечен только один глаз. Билатеральные формы встречаются только у 2% пациентов. В большинстве случаев поражаются височные отделы хориоидеи. На начальных стадиях развития меланома хориоидеи имеет вид небольшого округлого образования желто-коричневого или серого цвета с незначительным возвышением. При диаметре опухоли не более 6-7 мм ее сложно отличить от невуса. При этом для заболевания характерно латентное течение, зачастую патологию диагностируют в ходе планового осмотра.
Вместе с тем, развитие меланомы хориоидеи в центральных отделах может сопровождаться снижением остроты зрения, искаженным восприятием формы, величины или цвета предметов, появлением дефектов полей зрения в виде скотом. Эпизоды фотопсий воспринимаются пациентами как «блестящие шары света», которые склонны мигрировать с одних участков поля зрения к другим. Данные явления возникают 2-3 раза в день и появляются при сумеречном освещении. Болевой синдром при меланоме хориоидеи связан с развитием вторичной глаукомы или увеита.
Рост патологического новообразования приводит к сдавливанию собственных вен опухоли или сосудов хориоидеи, расположенных вокруг меланомы. Компрессия венозного аппарата сопровождается транссудацией жидкости с последующим присоединением экссудативного компонента на фоне некротических изменений, вызванных быстрым развитием патологического процесса. Таким образом, по мере увеличения размера новообразования развивается локальная отслойка сетчатки, которая в последующем достигает большой протяженности. В случае диффузного роста меланомы хориоидеи вторичная отслойка может сочетаться с клапанным разрывом. При этом наряду с фотопсиями и метаморфопсиями пациенты отмечают у себя появление черных точек, «мушек» или «пелены» перед глазами.
Для меланомы хориоидеи при экваториальной локализации характерно появление синдрома Ирвина-Гасса. В зоне патологического новообразования развивается клиническая картина васкулита и периваскулита. Повышенная проницаемость сосудов хориоидеи приводит к отеку макулярной области в дистальных отделах. Пациенты предъявляют жалобы на размытость, искаженность и розовый оттенок изображения перед глазами, повышенную чувствительность к свету. Кроме того, при синдроме Ирвина-Гасса может наблюдаться циклическое снижение остроты зрения в определенное время суток (чаще утром).
Наиболее распространенными симптомами меланомы хориоидеи являются «туман» или плавающие помутнения черного или красного цвета перед глазами, фотопсии и внезапное снижение остроты зрения. Возможно развитие гемофтальма. Часто данное патологическое состояние по своим клиническим проявлениям напоминает хориоретинальную макулодистрофию. В свою очередь, токсические вещества, выделяющиеся при распаде опухоли, вызывают развитие увеита. Частота возникновения воспалительных процессов напрямую зависит от клеточного состава опухоли. Изначально в большинстве случаев наблюдается хориоидит, который является почвой для возникновения заднего увеита или склерита. Как правило, воспалительные поражения структур органа зрения выявляются при диаметре меланомы хориоидеи более 15 мм и толщине более 5 мм. Некротические изменения опухоли приводят к эндофтальмиту или панофтальмиту. При этом пациенты предъявляют жалобы на сильную боль пораженного глаза с иррадиацией в одноименную половину головы, отечность и покраснение век.
Меланома хориоидеи относится к числу злокачественных новообразований со склонностью к гематогенному метастазированию. Наиболее часто метастазы определяются в печени и легких, на терминальных стадиях возможно их обнаружение во всех органах и тканях организма.
Диагностика меланомы хориоидеи
Диагностика меланомы хориоидеи основывается на анамнестических данных, результатах биомикроофтальмоскопии, офтальмоскопии, флуоресцентной ангиографии, ультразвукового доплеровского цветного картирования, компьютерной томографии (КТ) и магнитно-резонансной томографии (МРТ). Отягощенный семейный анамнез может указывать на наследственную предрасположенность к меланоме или на то, что онкологический процесс является одним из проявлений первично-множественной опухоли.
Методом офтальмоскопии определяется наличие патологического образования на поверхности хориоидеи, устанавливаются его размеры, характер роста и форма. Зачастую меланома хориоидеи покрыта друзами и «полями оранжевого пигмента», которые представлены отложением зерен липофусцина. Появление данного диагностического критерия указывает на быстрое прогрессирование заболевания. При детальном изучении поверхностной структуры меланомы хориоидеи методом биомикроофтальмоскопии удалось установить, что цвет липофусцина зависит от природы и окраски опухоли. Поэтому коричневый или розово-коричневый оттенок неоплазии не может исключить симптом «поля оранжевого пигмента».
Кроме того, офтальмоскопия позволяет выявить новообразованные сосуды при толщине опухоли 3,5 мм и более. Для их обнаружения на ранних этапах развития меланомы хориоидеи выполняется флуоресцентная ангиография. Этот метод делает доступным для визуализации первые признаки ангиогенеза при толщине новообразования в 1,3 мм. При большом размере опухоли сосуды выглядят толстыми, короткими, с выраженными деформациями структуры, отмечается склонность к образованию хаотической сети. Сосудистые аномалии предрасполагают к развитию кровоизлияний в ткань меланомы хориоидеи и прилежащие структуры глаза, что также можно установить при проведении офтальмоскопического исследования. При ультразвуковом допплеровском цветном картировании выявляются ретинотуморальные шунты. КТ и МРТ осуществляются в предоперационном периоде для точного определения размера и локализации неоплазии, а также для выявления метастазов в другие органы и ткани.
Лечение меланомы хориоидеи
Тактика лечения меланомы хориоидеи зависит от размера, локализации и распространенности патологического процесса. Применяются такие методы, как лучевая терапия (органосохраняющая методика) и оперативное вмешательство, заключающееся в энуклеации глаза. К полному удалению глазного яблока прибегают при обширном диффузном росте опухоли или большом размере узловой меланомы хориоидеи. Альтернативными вариантами являются брахитерапия глаза с диод-лазерной термотерапией, эндовитреальное удаление опухоли, эндорезекция меланомы и различные комбинированные методики. Проведение эндорезекции совместно с брахитерапией возможно даже при больших размерах новообразования. Все виды оперативного вмешательства должны выполняться в соответствии с принципами абластики.
Прогноз и профилактика меланомы хориоидеи
Специфических мер по профилактике меланомы хориоидеи не разработано. Прогноз для жизни и трудоспособности зависит от стадии онкологического процесса, размера и локализации опухоли. Смертность при диаметре новообразования до 10 мм составляет 16%, при диаметре более 15 мм - 53%. Для ранней диагностики и лечения меланомы хориоидеи необходимо проходить регулярные осмотры офтальмолога с проведением визиометрии, тонометрии, офтальмоскопии и биомикроскопии. При диффузном росте или большом диаметре узловой формы существенно снижается острота зрения вплоть до полной слепоты. При невозможности проведения органосберегающей операции, показана энуклеация глаза. Данное оперативное вмешательство влечет за собой инвалидизацию пациента.
Метастазы
Метастазы - вторичные злокачественные опухоли различных органов и тканей, возникшие в результате гематогенного, лимфогенного или имплантационного распространения злокачественных клеток первичного новообразования. Могут обнаруживаться в любом органе. На ранних стадиях протекают бессимптомно. В последующем клинические проявления зависят от локализации метастаза. Диагноз устанавливается с учетом анамнеза, жалоб, данных объективного осмотра, результатов анализов и инструментальных исследований. Лечение - химиотерапия, радиотерапия, хирургические вмешательства.
Метастазы - отдаленные очаги онкологического процесса, возникшие при перемещении злокачественных клеток по организму. Выявляются у лиц любых возрастов, однако наибольшее количество поражений обнаруживаются у пациентов старше 50 лет. Могут появляться при большинстве злокачественных опухолей и поражать любые органы. Чаще всего злокачественные новообразования метастазируют в лимфатические узлы, легкие и печень. Несколько реже встречаются метастазы в кости, надпочечники, почки и центральную нервную систему. Редко диагностируются метастатические поражения поджелудочной железы, селезенки, кожи, скелетных мышц и сердечной мышцы.
Нарушения функции различных органов, обусловленные ростом метастазов, являются ведущей причиной смертности при онкологических заболеваниях. Появление вторичных очагов ухудшает прогноз и делает невозможным радикальное лечение злокачественной опухоли либо создает существенные ограничения при выборе методов терапии. Диагностику и лечение метастазов осуществляют специалисты в области онкологии и других специальностей (в зависимости от локализации вторичного очага).
Этиология и патологическая анатомия метастазов
Без соответствующего лечения со временем метастазы возникают почти при всех злокачественных опухолях, однако сроки их появления могут существенно варьировать. Иногда метастазы обнаруживаются через несколько лет после развития первичного процесса, иногда - через несколько месяцев, а иногда и вовсе становятся первым проявлением онкологического заболевания, поэтому временной интервал между развитием первичной опухоли и возникновением метастазов не удается установить даже приблизительно.
Специалисты считают, что в некоторых случаях злокачественные клетки могут мигрировать в различные органы, образовывая «спящие очаги», которые в последующем активизируются и начинают быстро расти. Однако причины, по которым метастазы при одном и том же заболевании появляются и развиваются с разной скоростью, пока не установлены. Можно лишь перечислить ряд факторов, способствующих быстрому возникновению и прогрессированию вторичных образований.
В числе таких факторов - большое количество мелких сосудов вокруг первичного новообразования, особенности расположения и гистологического строения первичного очага, иммунные расстройства и возраст пациентов (у молодых метастазы возникают и прогрессируют быстрее, чем у пожилых). Большое значение имеет противоопухолевая терапия - после такой терапии трудно прогнозировать вероятность и возможное время появления метастазов. Иногда вторичные очаги возникают спустя несколько лет после прохождения курса лечения, на фоне изменения каких-то жизненных условий или без всяких видимых причин.
Клетки первичной опухоли могут распространяться по организму тремя путями: лимфогенным (по лимфатическим сосудам), гематогенным (по кровеносным сосудам) и имплантационным. Имплантационное метастазирование становится возможным после разрушения капсулы органа и выхода злокачественных клеток в ту или иную естественную полость. Например, клетки рака яичника через брюшную полость могут мигрировать на поверхность печени, а клетки первичного рака легких через плевральную полость - на поверхность плевры.
Преобладающий путь метастазирования определяется происхождением и степенью злокачественности опухоли. Клетки соединительнотканных и эпителиальных новообразований чаще мигрируют по лимфатическим путям. При опухолях высокой степени злокачественности преобладает гематогенное распространение. В большинстве случаев лимфогенные метастазы появляются раньше гематогенных. В первую очередь страдают регионарные лимфоузлы. Затем злокачественные клетки могут распространяться дальше по лимфатической системе.
Знание особенностей лимфотока в той или иной анатомической зоне позволяет определять возможные пути метастазирования и выявлять вторичные скопления злокачественных клеток (за исключением случаев микрометастазирования). Гематогенные метастазы возникают на значительном удалении от органа, пораженного первичным процессом, поэтому для их обнаружения приходится проводить комплексное обследование с учетом наиболее вероятных областей метастазирования.
Разные виды рака с различной частотой метастазируют в те или иные органы. Так, рак молочной железы, рак почек, рак предстательной железы и рак щитовидной железы чаще всего дают метастазы в легкие, кости и печень. При раке желудка, раке яичников, раке толстой кишки, раке тела матки и раке поджелудочной железы поражаются печень, брюшина и легкие. Рак прямой кишки и рак легкого распространяются в печень, надпочечники и легкие (при раке легкого страдает второе легкое). Меланома дает метастазы в печень, легкие, кожу и мышцы.
Среди вторичных новообразований преобладают солидные узловые формы, реже встречаются язвенные поверхности (например, при поражении кожи), слизеобразующие объемные образования (метастазы Крукенберга) и другие типы опухолей. Размер метастазов может варьировать от нескольких миллиметров до 20 и более сантиметров. Возможно одиночное поражение определенного органа, множественное поражение определенного органа, а также одиночные или множественные вторичные очаги в нескольких органах. Отдельно стоит упомянуть так называемые «пылевые» метастазы - множественные мелкие очаги в брюшной полости, провоцирующие развитие асцита.
По своей гистологической структуре вторичные новообразования обычно соответствуют первичной опухоли. Вместе с тем, в отдельных случаях метастазы могут иметь гистологическое строение, отличающееся от строения первичного рака. Обычно такие отличия выявляются при метастазировании опухоли полого органа в паренхиматозный орган (например, при метастатическом раке печени, возникшем вследствие первичного рака толстой кишки). Иногда из-за различия в структуре первичного и вторичного очагов возникают сложности при дифференцировке метастазов и множественного рака.
Симптомы метастазов
На начальных стадиях метастазы обычно протекают бессимптомно. В последующем клинические проявления зависят от локализации вторичного новообразования. Местная симптоматика сочетается с общими признаками онкологического заболевания: гипертермией, потерей аппетита, уменьшением массы тела вплоть до раковой кахексии, общей слабостью и анемией. При метастазах в лимфатические узлы наблюдается увеличение их размера, определяемое при пальпации или в процессе визуального осмотра.
Узлы обычно безболезненные, мягко-эластической консистенции. Чаще всего метастазы локализуются в шейных, паховых, подмышечных и надключичных лимфоузлах. При достаточно большом размере такие очаги могут быть обнаружены уже на этапе обычного осмотра. Выявление метастазов в некоторых лимфатических узлах (забрюшинных, парааортальных, узлах брюшной полости, узлах средостения) возможно только при проведении инструментальных исследований, поскольку эти анатомические образования недоступны для объективного обследования. Подозрение на наличие таких метастазов может возникнуть при их значительном увеличении, вызывающем сдавление близлежащих анатомических образований.
Проявления гематогенных метастазов определяются их локализацией. При вторичных очагах в головном мозге возникают головокружения, распирающие головные боли, тошнота, рвота и очаговые неврологические расстройства. При метастазировании в спинной мозг появляются боли, быстрая утомляемость при физической нагрузке, нарушения деятельности тазовых органов, прогрессирующие расстройства движений и чувствительности. При метастазах в легких наблюдаются частые рецидивы воспалительных заболеваний (бронхита, пневмонии, гриппа, ОРВИ), в последующем присоединяется одышка и кашель с примесью крови в мокроте.
Метастазы в печень проявляются тяжестью и болями в правом подреберье, нарушением печеночных функций, увеличением и бугристостью печени. На поздних стадиях выявляются желтуха, асцит и прогрессирующая печеночная недостаточность. Вторичные новообразования в костях вызывают мучительные боли, гиперкальциемию и патологические переломы. Возможно сдавление спинного мозга, нервных и сосудистых стволов. При метастазах в брюшину возникает асцит, обусловленный нарушением регуляции процесса выделения и всасывания жидкости тканями брюшины.
Метастазы в кожу представляют собой плотные, быстро растущие одиночные или множественные узлы телесного, синеватого или розоватого цвета. В последующем наблюдается их распад и изъязвление. При некоторых первичных новообразованиях (например, при карциноме молочной железы, раке толстого кишечника, раке яичника и раке мочевого пузыря) симптомы вторичных кожных опухолей могут имитировать клиническую картину рожистого воспаления. Реже (обычно - при опухолях молочной железы) выявляются склеродермоподобные метастазы.
Диагностика метастазов
Диагноз устанавливается на основании клинических данных и результатов дополнительных исследований. Из-за высокой склонности к развитию метастазов любое злокачественное новообразование является показанием для расширенного обследования (даже если признаки поражения других органов отсутствуют). Больным с подозрением на метастазы назначают общий анализ крови, биохимический анализ крови и анализ крови на маркеры рака. Пациентов направляют на рентгенографию грудной клетки, УЗИ органов брюшной полости, УЗИ органов малого таза, КТ и МРТ головного мозга, КТ и МРТ спинного мозга, сцинтиграфию костей скелета, рентгенографию костей скелета и другие исследования.
Наличие метастазов окончательно подтверждают при проведении гистологического либо цитологического исследования измененной ткани. Забор гистологического материала из мягких тканей осуществляют путем инцизионной, сердцевинной или щипковой биопсии. При поверхностном расположении метастазов используют скарификационную биопсию, при поражении костей - трепан-биопсию. Материал для цитологического исследования получают путем взятия обычных отпечатков или мазков-отпечатков. Для забора жидкости проводят аспирационную биопсию.
Дифференциальную диагностику метастазов осуществляют с первичными новообразованиями и с множественным раком (при одновременном или почти одновременном обнаружении нескольких очагов в одном или разных органах). В некоторых случаях требуется дифференцировка с дегенеративно-дистрофическими и воспалительными процессами. Так, симптоматическую пневмонию при метастазах в легких необходимо дифференцировать с обычной пневмонией, мелкие метастазы в позвоночник на фоне предшествующего остеопороза - с возрастными изменениями позвоночника и т. д.
Лечение метастазов
Тактика лечения определяется индивидуально с учетом вида рака, состояния первичной опухоли, общего состояния больного, чувствительности клеток к тому или иному типу лечебного воздействия, количества, локализации и размера метастазов. Возможно использование радиотерапии, химиотерапии, иммунохимиотерапии, гормонотерапии, классических хирургических вмешательств, радиохирургии, криохирургии и эмболизации питающих артерий. Как правило, при метастазах применяется комбинация нескольких методов лечения (например, химиотерапии и лучевой терапии, химиотерапии и иммунотерапии, лучевой терапии и хирургического вмешательства и т. д.). Показания к оперативному лечению и объем вмешательства также зависят от количества и локализации метастазов.
При метастазах в регионарные лимфатические узлы обычно проводят лимфаденэктомию в сочетании с удалением первичного новообразования. При контролируемых первичных опухолях и одиночных метастазах в отдаленные органы в некоторых случаях возможно радикальное иссечение вторичных очагов. При множественных метастазах хирургическое вмешательство, как правило, не показано. Исключением являются ситуации, когда паллиативная операция может отсрочить летальный исход или улучшить качество жизни больного (например, краниотомия для снижения опасного внутричерепного давления, вызванного метастатической опухолью мозга).
Прогноз при метастазах
До недавнего времени наличие метастазов рассматривалось, как свидетельство скорой гибели пациента. Сейчас ситуация постепенно меняется, хотя наличие вторичных опухолей по-прежнему рассматривается, как крайне неблагоприятный прогностический признак. Использование новых методов диагностики и лечения в ряде случаев позволяет увеличить среднюю продолжительность жизни больных. При определенных условиях стало возможным радикальное лечение метастазов некоторых локализаций, например, одиночных очагов метастатического рака печени или метастатического рака головного мозга.
В целом прогноз при метастазах определяется степенью запущенности онкологического процесса, возможностями конкретного лечебного учреждения (некоторые лечебные и диагностические методики доступны только в крупных центрах), видом, локализацией и стадией первичной опухоли, возрастом больного, состоянием его иммунной системы, степенью истощения, уровнем нарушения функций различных органов и пр. Средняя продолжительность жизни при метастатическом раке печени составляет около полугода, поражении головного мозга - несколько недель, при метастазах в кости - несколько лет, при вторичных новообразованиях в почках - 1-3 года.
Примеры метастазов в хориоидею оранжевого цвета
ГБОУ ДПО «Российская медицинская академия последипломного образования» Минздрава России, Москва
Метрическая классификация меланом хориоидеи и ее роль в выборе лечения
Журнал: Вестник офтальмологии. 2016;132(2): 4‑7
Цель — уточнить показания для брахитерапии (БТ) больших меланом хориоидеи (МХ) с учетом значимости их размеров для витального прогноза. Материал и методы. В рамках ретроспективного исследования изучена медицинская документация больных с МХ (161 человек), получивших БТ в Офтальмологической клинической больнице (ОКБ) и других медицинских центрах Москвы и находящихся на учете в городском офтальмоонкологическом центре при ОКБ и городском онкологическом канцерорегистре. Результаты. На момент начала лечения средний возраст пациентов составлял 56,89±1,93 года (17—84 года). В процессе наблюдения за больными МХ, получавшими БТ, в течение 12—275 мес (в среднем 95,65±8,4 мес), гематогенные метастазы диагностированы у 23 (14,29%) человек. У 8 больных метастазы в печень выявлены в среднем через 23,13 мес. Продолжительность жизни этих больных на фоне метастатической болезни составила в среднем 11 мес. Более 36 мес наблюдались 142 человека (в среднем 104,87 мес), метастазы в этой группе диагностированы у 15 человек в период 37—167 мес после БТ (в среднем 80,27 мес). Средние показатели продолжительности жизни у них на фоне метастатической болезни оказались в 2,8 раза больше (30,8 мес). Все МХ были разделены на 3 группы согласно классификации J. Schields. У пациентов с начальными МХ при сроках наблюдения 99,96±12,47 мес метастазы отсутствовали. При средних МХ метастазы выявлены у 13,45% пациентов (средняя продолжительность жизни — 20,66 мес). Частота метастазирования в группе пациентов с большими МХ составила 19,51%, а средняя продолжительность жизни — 13,5 мес. Заключение. При одинаковых средних сроках наблюдения (более 7— 8 лет) после БТ МХ частота гематогенных метастазов повышается по мере увеличения размеров опухоли. Оптимальный максимальный диаметр МХ для успешного ее локального лечения не должен превышать 10 мм. При МХ с максимальным диаметром более 15 мм почти каждый пятый случай заканчивается гематогенным метастазированием. Приведенные результаты данного исследования свидетельствуют о целесообразности сокращения классификационных параметров МХ, в первую очередь для меланом малых и средних размеров.
Учение о меланомах хориоидеи (МХ) насчитывает почти 5-вековую историю, но метрическая классификация опухоли с целью определения показаний для применения локальных методов ее разрушения, и в первую очередь для проведения брахитерапии (БТ), появилась только в начале 80-х годов прошлого столетия [1]. Были определены четкие метрические характеристики для начальных (маленьких), средних и больших МХ (табл. 1). Несмотря на то, что более половины всех увеальных меланом локализуются постэкваториально и они доступны визуальному контролю, первично, как правило, все еще выявляют опухоли средних и больших размеров. К примеру, в Англии при первичном обращении проминенция МХ достигает 4,9 мм [2], в Финляндии — 6,3 мм [3], в Корее — 7,8 мм [4], а во Франции М.Х. средних и больших размеров при первичном осмотре составляют 82% [5]. В России первично выявляют большие и средние МХ в 76% случаев [6]. И это серьезнейшая проблема успешного лечения опухолей этой категории. Спустя 10 лет в США Collaborative Ocular Melanoma Study (COMS) предложила изменить параметры МХ (см. табл. 1) [7, 8].
Таблица 1. Метрическая классификация МХ
На протяжении многих лет не оспаривается возможность успешного локального лечения начальных и средних М.Х. Но широко обсуждаются факторы риска развития метастазов. К примеру, одним из статистически значимых факторов риска развития гематогенных метастазов МХ признаны не только толщина опухоли [4, 9], но и ее максимальный диаметр [10, 11]. Увеличение диаметра для начальных и средних МХ по классификации COMS в определенной степени нарушило четкие границы метрических показателей размеров опухоли. Так, при оценке смертности, обусловленной начальной МХ, ее параметры определяют размерами 2 или 3×10 или 11 мм; величину средних МХ — 3—8 или 10 (!)×15 или 16 мм, а большие МХ характеризуют соответственно показателями более 10 и 15 мм [12—14]. Предложенные значения проминенции опухоли одной классификационной схемы, равные 3, 8 и даже 10 мм, — это значительные расхождения показателей толщины М.Х. Показатели метрической классификации не только разнятся по цифрам, но и вступают в противоречия при оценке витального прогноза. В ходе долгосрочного исследования 289 больных МХ E. Kujala с соавторами показали существенную зависимость смертности больных от размеров базального диаметра опухоли [10]. Доказано, что при начальных МХ в течение 5 лет от метастазов погибают 16% больных, при средних и больших меланомах (диаметр опухоли 15—16 мм) этот показатель увеличивается до 32—53% [15, 10]. При этом увеличение базального диаметра МХ на 5 мм повышает риск метастазирования в 5,6 раза [16]. Имеющиеся сведения вызывают неоднозначное отношение к существующей метрической классификации МХ при определении показаний к их локальному лечению.
Цель исследования — уточнить показания для БТ больших МХ с учетом значимости их размеров для витального прогноза.
В рамках ретроспективного исследования изучена медицинская документация больных с МХ (161 человек), получивших БТ в Офтальмологической клинической больнице (ОКБ) и других медицинских центрах Москвы и находящихся на учете в городском офтальмоонкологическом центре при ОКБ и городском онкологическом канцерорегистре. На момент начала лечения средний возраст пациентов составлял 56,89±1,93 года (17 лет — 84 года).
Все больные после лечения МХ в течение первых двух лет подвергались офтальмологическому контролю (включая офтальмоскопический и ультразвуковой контроль зоны облучения) 1 раз в 3 мес, далее 1 раз в 6 мес. Кроме того, каждые 6 мес проводили УЗИ печени, 1 раз в год — рентгенографию органов грудной клетки.
Все МХ были разделены на 3 группы согласно классификации J. Schields (табл. 2).
Таблица 2. Распределение М.Х. согласно классификации J. Schields
В процессе наблюдения за больными с МХ, получавшими БТ в течение 12—275 мес (в среднем 95,65±8,4 мес), гематогенные метастазы диагностированы у 23 (14,29%) человек, сроки их появления значительно разнились: у 8 больных метастазы в печень выявлены в среднем через 23,13 мес, продолжительность их жизни на фоне метастатической болезни составила в среднем 11 мес (1—30 мес). Более 36 мес наблюдались 142 человека (в среднем 104,87 мес), метастазы в этой группе диагностированы у 15 человек в период 37—167 мес после БТ (в среднем 80,27 мес). Средние показатели продолжительности жизни на фоне метастатической болезни оказались в 2,8 раза больше (30,8 мес). Мнения о скорости возникновения метастазов при МХ достаточно разноречивы. Полагают, что после обнаружения метастазов МХ 80% больных умирают в течение 1 года и 92% — в течение 2 лет [17]. Наряду с этим имеются публикации [4], в которых утверждается, что время от первого обнаружения отдаленных метастазов до метастатической смерти ограничено в среднем 4,8 мес (диапазон 1—15 мес). В то же время при первичном диагностировании МХ у 1,98—4% больных на фоне хорошего общего состояния с помощью компьютерной томографии выявляют скрытый метастатический очаг в печени [18, 19]. Таким образом, раннее появление метастазов и их скоротечность можно объяснить существованием на момент проведения БТ клинически скрытого метастазирования. Доказательством этому служат не только приведенные нами данные, но и результаты исследований группы авторов, также подтверждающие при поздних выявлениях метастазов МХ длительное течение метастатической болезни (до 35,2 мес) [20, 21].
Общепризнано, что риск метастазирования повышается по мере увеличения размеров опухоли. Частота метастазирования с учетом метрической классификации и сроков наблюдения представлена в табл. 3.
Таблица 3. Частота метастазирования в зависимости от размеров опухоли и сроков наблюдения
Пациенты с начальными МХ (4 человека) после БТ наблюдаются в среднем 26,75 мес, оставшиеся 23 человека находятся под наблюдением в течение 36—263 мес (в среднем 99,96±12,47 мес). У всех больных в указанные сроки наблюдения метастазы отсутствуют (см. табл. 3). По данным литературы, среднее время от начала лечения начальных МХ до выявления метастазов в печени составляет 7 лет [20]. В наших наблюдениях этот показатель превышает 8 лет.
Больные, имеющие средние МХ (52 человека), после лечения наблюдались в среднем 100,88±14,28 мес (14—167 мес). Метастазы в этой группе возникли у 13,45%, причем у 6 из них они диагностированы в сроки 37—167 мес (в среднем через 69,8 мес), медиана продолжительности жизни составила 18,5 мес (среднее 20,66 мес).
Больные с большими МХ после БТ находились под наблюдением в течение 14—261 мес (среднее 94,79±12,21 мес). Частота метастазирования в этой группе составила 19,51%. В течение первых 35 мес наблюдения после БТ метастазы диагностированы у двух больных в сроки 24 и 27 мес. Наиболее «уязвимыми» сроками метастазирования после БТ оказались последующие 37—85 мес. При раннем возникновении метастазов (до 35 мес) продолжительность жизни с метастатической болезнью составила 4 и 8 мес, в группе с метастазами, развившимися в сроки от 37 до 85 мес, медиана продолжительности жизни составила 13,5 мес. Только 1 больная после секторальной резекции печени по поводу метастаза жива на протяжении 172 мес. Таким образом, по мере увеличения размеров МХ угроза метастазирования повышается почти в 20 раз, а средних — в 1,5 раза по сравнению с аналогичным показателем при начальных меланомах. Соответственно сокращаются и сроки жизни больных после начала лечения. Полученным результатам имеются подтверждения и в литературе. Увеличение диаметра начальных МХ (исходный диаметр
При одинаковых средних сроках наблюдения (более 7—8 лет) после БТ МХ частота гематогенных метастазов повышается по мере увеличения размеров опухоли. Оптимальный максимальный диаметр МХ для успешного ее локального лечения не должен превышать 10 мм. При М.Х. с максимальным диаметром более 15 мм почти каждый пятый случай заканчивается гематогенным метастазированием. Приведенные результаты данного исследования свидетельствуют о целесообразности сокращения классификационных параметров МХ и в первую очередь для меланом малых и средних размеров.
Читайте также:
