Примеры плеоформной аденокарциномы беспигментного эпителия цилиарного тела
Добавил пользователь Валентин П. Обновлено: 21.01.2026
Пигментированная киста радужки в отличие от меланомы имеет гладкую поверхность. Во время выбора операции чрезвычайно важно определение границ опухоли, что осуществляется при помощи биомикроскопии, гониоскопии трансиллюминации.
Лечение. При распространении опухоли не более чем на одну четвертую часть радужки показано ее частичное удаление (иридэктомия). При начальных признаках роста опухоли в корне радужной оболочки следует произвести иридоциклэктомию. В случаях прорастания меланомы в зону угла передней камеры и цилиарное тело показана иридо-циклосклерэктомия. При аннулярных иридоцилиарных меланомах необходима энуклеация.
Небольшую ограниченную меланому радужки можно попытаться разрушить при помощи фото- или лазеркоагуляции. Проведение предоперационной и послеоперационной лучевой терапии при меланомах радужек нецелесообразно.
Прогноз. При начальной опухоли и своевременном ее иссечении в пределах здоровой ткани прогноз благоприятный. Он серьезен при иридоцилиарной аннулярной форме опухоли, которая склонна к метастазированшо.
Меланома цилиарного тела. Клиническая картина. Начальный рост опухоли бессимптомный. В процессе ее роста появляются изменения, связанные с механическим воздействием опухоли на прилежащие отделы глаза и дистрофическими процессами, развивающимися в опухоли. Ранним симптомом является застойная инъекция в системе передних цилиарных сосудов глаза на ограниченном участке. Гониоскопией выявляется закрытие угла передней камеры. Отмечается парез радужной оболочки и контактное помутнение хрусталика. Клиническая картина зависит от направления роста опухоли. Иногда опухоль обнаруживается в углу передней камеры как темное образование на поверхности радужки. В других случаях определяется рост опухоли в заднюю камеру, иногда видно выпячивание радужки, на которую давит опухоль, изменение формы зрачка, смещение хрусталика, образование в нем секторной катаракты соответственно расположению меланомы. Опухоль может также расти преимущественно в стекловидное тело и обнаруживается только при сильно расширенном зрачке. В этих случаях имеется выпячивание желтовато-серого или коричневого цвета, исходящее из цилиарного тела. Растущая опухоль может вызвать отслойку сетчатки в зоне роста. В дальнейшем возникает воспалительная реакция с явления - ирита, иридоциклита и вторичной глаукомы. В более поздних стадиях меланома прорастает через склеру по ходу сосудов и проявляется очаговой пигментацией серовато-аспидного цвета или темными узлами позади лимба.
Диагноз начальной меланомы очень труден. К числу ранних признаков следует отнести расширение и извитость передних цилиарных сосудов на ограниченном участке склеры, уплощение зрачкового края радужной оболочки соответственно этому участку, пигментацию радужней оболочки или склеры на ограниченном участке, неравномерность глубины передней камеры. Ценные диагностические сведения дает гониоскопия, биомикроскопия и диафаноскопия. При транссклеральном просвечивании (когда конец диафаноскопа заводят максимально в конъюнктивальный свод) удается видеть на склере тень опухолевого узла цилиарного тела. При помощи радиофосфорного метода можно определить границы новообразования.
Меланому цилиарного тела может симулировать ряд доброкачественных опухолей, исходящих из цилиарного тела (ангиома, лейомиома, невринома, киста), при которых глаз обычно удаляют с диагнозом: меланома. Истинную природу новообразования возможно установить лишь гистологически или после удаления глаза. Клинически имеется возможность отдифференцировать меланому только от кисты цилиарного тела, при которой отмечаются гладкость поверхности, дрожание при движении глаза и хорошая просвечиваемость.
Лечение. Небольшие ограниченные опухоли цилиарного тела могут быть иссечены в пределах здоровых тканей с сохранением глазного яблока. При больших опухолях, вышедших за пределы цилиарного тела, показана энуклеация.
Прогноз серьезен, особенно при прорастании опухоли в эмиссарии склеры и за пределы глазного яблока. Метастазы могут развиваться в первые 3—5 лет после операции.
Цилиарное тело
Кровеносные сосуды создают в цилиарном теле густые сплетения, питая непосредственно цилиарное тело, а также радужную оболочку. Мельчайшие капилляры, в ресничных отростках, бесперебойно образуют внутриглазную жидкость в необходимом для функционирования глаза объеме, посредством фильтрации из кровотока. Внутриглазная жидкость создает постоянное внутриглазное давление, которое и обеспечивает все основные функции органа зрения. Вместе с тем, цилиарное тело, прикрепленное к выступу склеры, служит опорой для следующего элемента сосудистой оболочки - радужки глаза.
Строение цилиарного тела
В сосудистой оболочке глаза, цилиарное тело занимает среднюю часть. Оно расположено за радужкой по окружности глаза. Снаружи цилиарное тело прикрыто склерой, поэтому не определяется при визуальном осмотре. На срезе тело имеет форму треугольника, вершина которого выступает в полость глаза. Структурно цилиарное тело включает две части: плоскую - шириной 4 мм, прилегающую к зубчатой линии, и ресничную - шириной 2 мм, на которой помещается около 80 ресничных отростков.
Ресничным отростком называют небольшую пластинку, внутри которой выявляется выраженная сеть сосудов крови, занятых фильтрацией кровотока, для образования внутриглазной жидкости.
На клеточном уровне, строение цилиарного тела состоит из мезодермального слоя, включающего мышечную и соединительную ткани, а также нейроэктодермального слоя, который содержит нефункциональные слои перешедшего с сетчатой оболочки эпителия.
Слои клеток в цилиарном теле, располагаются следующим образом изнутри наружу: мышечный слой, сосудистый, базальная пластинка, эпителий пигментный и беспигментный, внутренняя пограничная мембрана.

Мышечный слой в цилиарном теле играет главную роль при аккомодации. В нем принято разделять группы мышечных пучков, пролегающих разнонаправленно: мышца Брюке - расположена снаружи в продольном направление, лежащие глубже мышечные волокна направленны радиально (мышца Иванова) и циркулярно (мышца Мюллера). Внутренней поверхностью цилиарное тело связывается с хрусталиком глаза посредством ресничного пояска. Задача пояска - удерживать хрусталик в нужном положении, а кроме того, обеспечивать работу аккомодации при помощи цилиарной мышцы. В цилиарном теле, принято выделять цилиарные волокна - передние и задние. Передние крепятся в зоне экватора хрусталика, а также за ним, а задние крепятся начиная от зубчатой линии, спереди от экватора. Натяжение цилиарной мышцы расслабляет связки, снимая напряжение капсулы хрусталика и хрусталик становится округой формы. Если мышца расслабляется, напрягаются связки и хрусталик вытягивается.
Сосудистый слой является продолжением слоя сосудов хориоидеи. Большей частью, он содержит различного калибра вены. Артерии хориоидеи лежат в околососудистом пространстве, при этом, в цилиарном теле они расположены в мышечном слое, отдавая назад в хориоидею мелкие веточки.
Также и базальная пластинка является продолжением слоев хориоидеи. Изнутри ее устилает пигментированный и беспигментный эпителий, слои которого представляют собой нефункциональную сетчатую оболочку, ограниченную от стекловидного тела пограничной внутренней мембраной.
Снабжение цилиарного тела кровью и питательными компонентами обеспечивается двумя длинными задними цилиарными артериями, проходящими от заднего полюса до цилиарного тела глаза в надсосудистом пространстве сосудистой оболочки.
К цилиарному телу подведено много нервных окончаний, правда, у новорожденных они развиты недостаточно, что делает многие заболевания безболезненно протекающими. Функции цилиарного тела полностью развиваются у детей лишь к возрасту 7-10 лет.
Примеры плеоформной аденокарциномы беспигментного эпителия цилиарного тела
ГУНУ "Факультет фундаментальной медицины МГУ им. М.В. Ломоносова", Москва
ФГБУ "НИИ глазных болезней" РАМН, Москва
ФГБУ "Московский научно-исследовательский онкологический институт им. П.А. Герцена" Минздрава РФ;
ГБОУ ДПО "Российская медицинская академия последипломного образования", Москва
Алгоритм дифференциальной диагностики предраковых и регенераторных изменений эпителия шейки матки
Журнал: Архив патологии. 2013;75(1): 46‑51
Сазонова В.Ю., Федорова В.Е., Данилова Н.В. Алгоритм дифференциальной диагностики предраковых и регенераторных изменений эпителия шейки матки. Архив патологии. 2013;75(1):46‑51.
Sazonova VIu, Fedorova VE, Danilova NV. Algorithm for the differential diagnosis of precancerous and regenerative changes in the cervix uteri. Arkhiv Patologii. 2013;75(1):46‑51. (In Russ.).
К предопухолевым изменениям эпителия шейки матки относят цервикальную интраэпителиальную неоплазию (CIN). CIN III степени необходимо дифференцировать от регенераторных изменений при эпидермизации эндоцервикозов. Эпидермизация представляет собой пролиферацию резервных клеток, дифференцирующихся в направлении плоского эпителия с вытеснением эктопированного железистого эпителия эндоцервикального типа. Этот процесс был назван "незрелой плоскоклеточной метаплазией" (immature squamous metaplasia - ISM). Целью работы являлось определение значимости разных морфологических признаков в дифференциальной диагностике CIN III и ISM. Для исследования было отобрано 112 биопсий шейки матки c CIN III и плоскоклеточной метаплазией. Препараты шейки матки были разделены на 2 группы по наличию или отсутствию экспрессии маркеров р16 и СК17. Препараты с фенотипом p16+, СК17- принимались за истинную CIN III, р16-, СК17+ - за регенераторный процесс. В основу работы положены признаки, включенные О.К. Хмельницким в алгоритм дифференциальной диагностики эпидермизирующейся псевдоэрозии и внутриэпителиального рака шейки матки. Алгоритм пересмотрен с целью объективизации. В результате исследования в группах установлены значимые различия по количеству достоверных митозов. Выявлена четко выраженная тенденция к различию в количестве акантотических тяжей. Предложен новый алгоритм дифференциальной диагностики CIN III и ISM, включающий количество достоверных митозов и акантотических тяжей, экспрессию р16 и СК17.
Рак шейки матки является одним из самых распространенных злокачественных новообразований в России среди женщин детородного возраста (15—44 года) [1]. Высокая заболеваемость определяет необходимость точной и своевременной диагностики в первую очередь предопухолевых изменений эпителия шейки матки.
Согласно концепции, предложенной R. Richart [2], все предраковые изменения плоского эпителия шейки матки представляют собой единый патологический процесс, для обозначения которого предложен термин «цервикальная интраэпителиальная неоплазия» (cervical intraepithelial neoplasia — CIN). Интраэпителиальную неоплазию предложено считать облигатным предраком, т.е. многостадийным процессом, который при прогрессировании неизбежно приводит к развитию инвазивного рака, если не проведено адекватное радикальное лечение. Классификация включает 3 степени CIN: CIN I, CIN II и CIN III [3]. Изменения эпителия, относящиеся к данным рубрикам, отличаются степенью выраженности тканевой и клеточной атипии и распространением анаплазированных клеток в эпителиальном пласте. CIN I соответствует слабой дисплазии (mild dysplasia), CIN II — умеренной дисплазии (moderate dysplasia), а CIN III объединяет тяжелую дисплазию (severe dysplasia) и карциному in situ (CIS) в связи с тем, что они имеют сходные морфологические признаки, генетические аномалии и прогноз, определяющие одинаковую тактику лечения.
Имеется новая информация о патогенезе рака шейки матки [4]. Например, показано, что CIN I представляет собой морфологическое выражение продуктивной HPV-инфекции и чаще всего обратима [3]. Таким образом, CIN I не является облигатным предраком и по сути представляет собой регенераторно-воспалительный процесс. Чаще всего в контексте неоплазии обсуждаются морфологические признаки, соответствующие CIN II и CIN III [5].
С точки зрения профилактики рака шейки матки особое внимание необходимо уделять диагностике CIN III, так как она имеет наибольший риск прогрессирования в инвазивный рак [6].
CIN III характеризуется пролиферацией незрелых клеток типа базальных, распространяющихся более чем на 2 /3 эпителиального пласта [7]. Для этих клеток характерны преимущественная моноклональность, анеуплоидия и потеря гетерозиготности в специфических хромосомных локусах [8]. Выявляются значительное увеличение размеров ядра, ядерный полиморфизм, потеря полярности клеток, большое количество митозов, в том числе и патологических, границы клеток трудно различимы. При CIN III значительно реже, чем при CIN I, в эпителии обнаруживаются цитопатические эффекты HPV (койлоцитоз и мультинуклеация). В поверхностных слоях эпителия может наблюдаться дискератоз.
CIN III необходимо дифференцировать в первую очередь от регенераторных процессов при эпидермизации эндоцервикозов, а также от атрофии и реактивных изменений плоского эпителия шейки матки.
Эпидермизация представляет собой пролиферацию резервных клеток, дифференцирующихся в направлении плоского эпителия с вытеснением эктопированного железистого эпителия эндоцервикального типа. Одним из способов эпидермизации эндоцервикоза является плоскоклеточная метаплазия [3]. Этот процесс тщательно описан F. Flushmann и соавт. [9, 10]. Термин «незрелая плоскоклеточная метаплазия» (immature squamous metaplasia — ISM) введен C. Crum и соавт. [11] для обозначения изменений, характеризующихся пролиферацией клеток базального типа, с гиперхромией ядер и отсутствием признаков дифференцировки. Чаще всего за неопластические изменения принимают незрелую плоскоклеточную метаплазию. На первом этапе появляются мелкие кубические клетки под цилиндрическим эпителием — так называемые субцилиндрические резервные клетки, имеющие большие ровные круглые ядра, нечеткие клеточные границы и скудную цитоплазму. Прогрессивный рост и стратификация резервных клеток приводят к формированию подушечек незрелого плоского эпителия. В фокусах эпидермизации эпителий на всю толщу состоит из незрелых парабазальных клеток с высоким ядерно-цитоплазматическим индексом, ядра, как правило, мономорфные, располагаются вертикально. Могут выявляться типичные митозы. Полярность клеток сохраняется, цитоплазматические мембраны четко очерчены. Часто наблюдается неглубокий акантоз. Метапластический плоский эпителий «подрастает» под цилиндрический эпителий эндоцервикального типа, поэтому на поверхности новообразованного плоского эпителия могут выявляться вытесненные им клетки эндоцервикального эпителия [3].
В качестве дополнительных критериев дифференциальной диагностики используют иммуногистохимические маркеры р16 и СК17. р16 ассоциирован с HPV высокого онкогенного риска, его экспрессия отмечается при CIN III и плоскоклеточном раке шейки матки [12—11]. CK17 является маркером резервных клеток шейки матки [16]. Результаты проведенных исследований свидетельствуют о том, что клетки при CIN III активно экспрессируют р16, но не содержат СК17 [17, 18]. В фокусах эпидермизации отмечаются выраженная экспрессия CK17 и отсутствие р16. Таким образом, иммуногистохимический метод позволяет дифференцировать CIN III от регенераторных процессов [19].
Целью работы являлась оценка диагностической значимости морфологических критериев CIN III и ISM и оптимизация данных критериев для улучшения воспроизводимости диагноза.
Материал и методы

В основу работы положены признаки, включенные О.К. Хмельницким в алгоритм дифференциальной диагностики эпидермизирующейся псевдоэрозии и внутриэпителиального рака шейки матки (табл. 1) [20].
Базируясь на алгоритме О.К. Хмельницкого, мы попытались объективизировать такие понятия, как клеточная атипия, ядерный полиморфизм и др. Некоторые признаки заменены более объективными в силу причин, связанных с трудностью их практической оценки. Далее приведено обоснование отбора учитываемых признаков. Для каждого оцениваемого параметра нами был предложен наиболее удобный и информативный метод его оценки.
С учетом указанных пояснений, окончательный список оцениваемых морфологических признаков выглядит следующим образом.
I. Характеристика эпителиального пласта. Оценивали положение эпителиального пласта на базальной мембране (0), его отторжение (1) или частичное отсутствие (2).
II. Вертикальная анизоморфность. Оценивали наличие (1) или отсутствие (0) вертикальной анизоморфности. Считали, что вертикальная анизоморфность сохранена, если в исследуемом препарате сохранена дифференцировка всех слоев многослойного плоского неороговевающего эпителия, хорошо различимая глазом. В противном случае считали, что вертикальная анизоморфность в препарате отсутствует.
III. Стратификация. Оценивали наличие (1) или отсутствие (0) стратификации эпителия — четкого разделения эпителиального пласта на слои, характерные для многослойного плоского неороговевающего эпителия шейки матки (базальный, промежуточный, поверхностный), без их смещения друг относительно друга. Отсутствие в препарате вертикальной анизоморфности обусловливало автоматическое отсутствие в нем стратификации.
IV. Для морфологической характеристики клеток базального слоя эпителиального пласта оценивали следующие параметры:
1. Ядерный полиморфизм оценивали полуколичественным методом:
0 — ядерный полиморфизм в эпителии отсутствует;
1 — полиморфные ядра занимают 1—33% поля зрения;
2 — полиморфные ядра занимают 34—66% поля зрения;
3 — полиморфные ядра занимают 67—100% поля зрения.
2. Количество укрупненных ядер. Подсчитывали количество ядер, диаметр которых превышает диаметр эритроцита в 3 раза и более. Учитывая размеры ядер клеток базального слоя эпителия шейки матки в норме, размер эритроцита и высокую вероятность его нахождения в каждом изучаемом препарате, мы сочли возможным считать ядра клеток базального слоя, диаметр которых превышает 3 диаметра эритроцита, укрупненными, а сравнение размера ядер базального слоя с размером эритроцита — удобным для практического использования.
3. Вместо исключенного признака «окрашивание цитоплазмы и ядер» подсчитывали количество резко гиперхромных ядер, предполагая значимость выраженности гиперхромии ядер при оценке митотической активности клеток базального слоя.
4. Количество обычных митозов и атипичные митозы были объединены в один признак в силу трудности дифференцирования обычных и атипичных митозов в зависимости от плоскости проведенного среза. Подсчитывали количество достоверных митозов в поле зрения (достоверный — четко отличимый от апоптотических телец и пикнотичных ядер, с наличием хромосом в метафазной пластинке).
5. Гиперцеллюлярность (многоклеточность). Оценивали наличие (1) или отсутствие (0) многоклеточности в базальном слое эпителия. Критерием было выбрано увеличение рядов базальных клеток больше 3.
6. Количество многоядерных клеток, возникающее вследствие патологии их деления, учитывали как признак, необходимый для оценки клеточного атипизма.
V. Базально-клеточная гиперактивность. Отнесена нами в группу признаков, описывающих тканевую атипию. Мы оценивали гиперплазию базальных клеток как наиболее современное выражение патологического процесса. Определяли площадь поля зрения, занимаемую клетками базального типа в поле зрения, оцениваемую в процентах:
+ — клетки базального типа занимают 0—33% поля зрения;
++ — клетки базального типа занимают 34—66% поля зрения;
+++ — клетки базального типа занимают 67—100% поля зрения.
VI. Толщина эпителиального пласта. Оценивалась полуколичественным методом при увеличении объектива микроскопа 40:
1 — эпителиальный пласт занимает 0—33% поля зрения;
2 — эпителиальный пласт занимает 34—66% поля зрения;
3 — эпителиальный пласт занимает 67—100% поля зрения.
VII. Для определения выраженности акантоза оценивали:
— количество акантотических тяжей в исследуемом поле зрения при увеличении объектива микроскопа 40;
— максимальную глубину и ширину акантотического тяжа — использовали полуколичественный метод при увеличении объектива микроскопа 40:
+ — максимальная глубина (ширина) тяжа занимает 0—33% поля зрения;
++ — максимальная глубина (ширина) тяжа занимает 34—66% поля зрения;
+++ — максимальная глубина (ширина) тяжа занимает 67—100% поля зрения.
— количество кровеносных сосудов, окруженных эпителием (как признак слияния акантотических тяжей).
VIII. Паракератоз. Оценивали наличие (1) или отсутствие (0) паракератоза. Термин «паракератоз» использовали как наиболее общий, отражающий патологическое ороговение единичных клеток базального и парабазального слоя покровного эпителия слизистых оболочек, где в норме его быть не должно.
Для исследования отобрали 112 биопсий шейки матки, окрашенных гематоксилином и эозином, с CIN III и плоскоклеточной метаплазией. Морфологические признаки оценивали в каждом препарате в 5 полях зрения при увеличении микроскопа 40.
Отобранные препараты шейки матки были разделены на две группы по наличию или отсутствию экспрессии маркеров р16 и СК17. Препараты с фенотипом p16 + , СК1 - принимали за истинную CIN III, р16 - и СК17 + — за регенераторный процесс [19]. В работе оценивали выраженность описанных морфологических признаков для каждой группы препаратов.
Полученные данные обрабатывали с помощью программы SPSS. Для каждой группы препаратов подсчитывали описательные статистические данные — среднее значение и стандартное отклонение для каждого показателя. Для сравнения двух групп использовали непараметрический критерий Манна—Уитни, так как распределение изучаемых параметров не предполагалось нормальным [21].
Результаты анализа числовых параметров представлены в табл. 2, порядковых — в табл. 3. На основе полученных данных можно сделать вывод о том, что митозов было значимо больше в группе CIN III (1,4 против 0,7, р=0,018; рис. 1). Рисунок 1. Среднее количество достоверных митозов. Асимптотическая значимость: р0,05 — группы значимо не различались. Также акантотических тяжей в группе без экспрессии СК17 оказалось больше, чем во 2-й группе (1,5 против 0,93, р=0,066; рис. 2). Рисунок 2. Среднее количество акантотических тяжей. Асимптотическая значимость: р0,05 — группы значимо не различались. Однако полученный уровень значимости позволяет говорить лишь о существующей тенденции по данному показателю. Многоклеточность была высокой в обеих группах, однако в препаратах группы с экспрессией СК17 (ISM) она выявлялась несколько чаще (71,1% против 85%, р=0,091). Кровеносных сосудов в зоне акантоза было больше в группе CIN III, что соответствует более интенсивному акантозу. Количество укрупненных и гиперхромных ядер, многоядерных клеток и выраженность базально-клеточной гиперплазии в обеих группах практически не отличались. Отторгающийся эпителиальный пласт встречался чаще при ISM, в то время как эпителиальный пласт, находящийся на базальной мембране, чаще выявлялся в группе CIN III. Толщина эпителиального пласта и выраженность ядерного полиморфизма в группах существенно не различались. Не обнаружено отличий при изучении паракератоза, вертикальной анизоморфности, стратификации. Данные по таким показателям, как глубина и ширина акантотических тяжей были собраны не по всем исследуемым препаратам, и полученная выборка не позволяет провести для них адекватную статистическую обработку.
На основании полученных данных можно сделать вывод о том, что статистически значимые различия между двумя группами выявлены только по количеству достоверных митозов (р=0,018). Однако следует отметить наличие тенденции к различию по количеству акантотических тяжей (р=0,066), которых было больше при CIN III. По остальным 13 морфологическим признакам группы статистически значимо не различались.
Таким образом, единственным математически достоверным признаком различия CIN III и ISM является число достоверных митозов.
Заключение
В исследованных группах установлены значимые различия по количеству достоверных митозов. Имеется четко выраженная тенденция к различию в количестве акантотических тяжей. Признаки были отобраны нами с учетом доступности их ежедневного использования в рутинной практике врача-патологоанатома. Они хорошо видны глазом и не требуют специальных гистохимических методов окрашивания, что позволяет использовать их для дифференциальной диагностики регенераторных и предопухолевых заболеваний шейки матки, используя только окраску гематоксилином и эозином. В то же время результаты, полученные после оценки гистологических срезов по данным признакам, с высокой достоверностью совпадают с данными, полученными при оценке материала, окрашенного р16 и СК17, а, следовательно, позволяют установить объективный диагноз. Также для данных признаков характерна низкая вариабельность результатов при оценке патологического материала разными специалистами. Все указанное позволяет рекомендовать данный алгоритм дифференциальной диагностики регенераторных и предопухолевых изменений и заболеваний шейки матки к практическому применению в рутинной практике врача-патологоанатома (табл. 4).
ФГБУ «Московский НИИ глазных болезней им. Гельмгольца» Минздрава России, Москва
ФГБУ "Московский НИИ глазных болезней им. Гельмгольца" Минздрава России
ФГБУ «Российский научный центр рентгенорадиологии» Минздрава России, Москва, Россия
ФГБУ «Московский НИИ глазных болезней им. Гельмгольца» Минздрава России, ул. Садовая-Черногрязская, 14/19, Москва, 105062, Российская Федерация
ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» РАМН, 115478 Москва, Каширское шоссе, д. 23
ФГБУ «Российский онкологический научный центр им. Н.Н. Блохина» Минздрава России, Каширское ш., 23, Москва, 115478, Российская Федерация
. Злокачественная медуллоэпителиома, симулирующая ретинобластому — клинико-гистологический анализ случая и опыт получения клеточной культуры
Журнал: Вестник офтальмологии. 2016;132(6): 64‑69
В работе представлен клинико-морфологический анализ случая первичной внутриглазной злокачественной медуллоэпителиомы редкой локализации — центрального отдела сетчатки с вовлечением диска зрительного нерва, — симулирующей ретинобластому, у ребенка 2 лет. Подробно приведены гистологические особенности опухоли (трубчатые и сетчатые структуры опухоли, розетки, ленточные образования, клетки с гиперхромными ядрами, клеточный полиморфизм). Описан единственный на сегодняшний день в Российской Федерации опыт создания первичной культуры внутриглазной злокачественной медуллоэпителиомы с последующей оценкой чувствительности (МТТ-тест) к четырем препаратам (оксалиплатин, иринотекан, ифосфамид, аскорбиновая кислота) в различных концентрациях. Из четырех исследованных препаратов IC50 (3,3 мг/мл) получена только для раствора аскорбиновой кислоты. Несмотря на относительную редкость первичной внутриглазной злокачественной медуллоэпителиомы, необходимо проводить дифференциальный диагноз с другими внутриглазными образованиями, прежде всего ретинобластомой. Полученные данные об эффективности раствора аскорбиновой кислоты в отношении клеток внутриглазной злокачественной медуллоэпителиомы могут быть использованы для дополнения существующих химиотерапевтических протоколов в детской нейро- и офтальмоонкологии.
Внутриглазная медуллоэпителиома (диктиома) — редкая врожденная эмбриональная опухоль, растущая из эпителия цилиарного тела, ресничной части сетчатки и зрительного нерва, которая встречается как у взрослых, так и у детей [1, 2]. Опухоль состоит из тубулярных структур, выстланных псевдомногослойным нейроэпителием. Данная опухоль чаще всего выявляется в первой декаде жизни. Диагностика медуллоэпителиомы не всегда очевидна. Эхографическая локализация зачастую затруднена в связи с плоскостным характером роста, что объясняет позднюю (послеоперационную) диагностику [3].
В литературе за последние 30 лет доступны лишь 10 работ, посвященных первичной внутриглазной медуллоэпителиоме диска зрительного нерва (ДЗН) [2, 4, 5]. В работе Pastora-Salvador и соавторов описан случай медуллоэпителиомы зрительного нерва у мальчика 12 лет. Пациенту провели локальную резекцию опухоли, при этом безрецидивный период наблюдения составил 25 лет [5].
Медуллоэпителиомы классифицируются на тератогенные и нетератогенные варианты, подразделяемые в свою очередь на доброкачественные и злокачественные типы. Основной признак нетератогенного типа опухолей — множественность слоев и полос низкодифференцированных нейроэпителиальных клеток, внешне схожих с эмбриональной сетчаткой или цилиарным эпителием [6].
Дифференциальный диагноз следует проводить с ретинобластомой и другими редкими внутриглазными опухолями, включая беспигментную меланому, шванному и аденокарциному ретинального пигментного эпителия, а также неопухолевыми процессами, такими как воспалительная гранулема [7, 8]. Несмотря на то что медуллоэпителиомы могут выглядеть в виде крупных нейробластных псевдорозеток, для них характерны трубчатые конгломераты клеток, а не рост в виде «перчаток» или «рукоятки», что типично для ретинобластом. Дифференциальными признаками могут служить также тесная взаимосвязь с подлежащими тканями и отсутствие псевдофоторецепторов, в отличие от розеток Флекснера—Винтерштайнера [6]. Иммуногистохимические исследования медуллоэпителиом с псевдорозетками Флекснера—Винтерштайнера выявляют положительный результат на нейронспецифичную енолазу и синаптофизин во всех случаях [6].
В некоторых случаях исход заболевания неблагоприятен. Такое развитие новообразования чаще всего связано с распространением за пределы глаза, но также описаны отдаленные метастазы в лимфатические узлы, околоушные железы, легкие и средостение [9]. Медуллобластома как примитивная нейроэктодермальная опухоль центральной нервной системы у детей поражает преимущественно мозжечок и встречается значительно чаще первичной опухоли внутри глаза [10]. На сегодняшний день доступны несколько химиотерапевтических протоколов для лечения данного заболевания [11]. Первичная внутриглазная медуллоэпителиома, несмотря на низкую частоту встречаемости, представляет интерес для офтальмологов в связи со сложностью ее дифференциальной диагностики с другими внутриглазными новообразованиями, а также единичными данными о возможном химиотерапевтическом лечении.
Цель настоящей работы — клинико-гистологический анализ случая злокачественной медуллоэпителиомы у ребенка, а также описание опыта получения клеточной культуры опухоли и проведения МТТ-теста.
Клинические данные. Мальчик в возрасте 2 лет и 3 мес поступил на обследование и лечение в стационар. Из анамнеза известно, что в возрасте 2 лет родители заметили изменение «окраски» зрачка левого глаза на фотографии, а через 2 мес обратились к врачу по месту жительства, диагноз — подозрение на ретинобластому группы D. До появления первых симптомов ребенка осматривали в 1 год и 7 мес, но без мидриаза. При поступлении острота зрения на левом глазу соответствовала правильной проекции света, передний отрезок глаза без изменений. На глазном дне, по данным осмотра на RetCam, — ДЗН и макула не определяются, прикрыты серо-белой опухолевой тканью с неровными границами и бугристой поверхностью (рис. 1). На правом глазу изменений не выявлено.
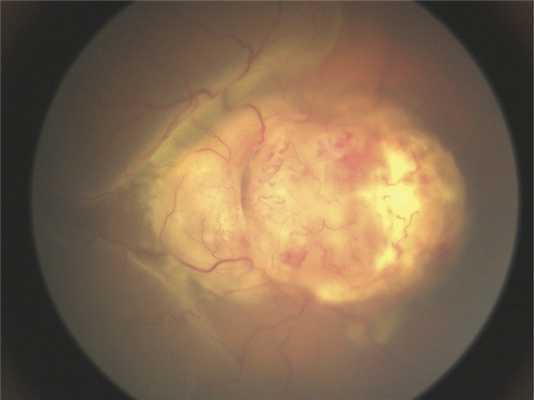
Рис. 1. Клиническая картина опухоли при осмотре на RetCam.
Согласно данным ультразвукового исследования, у заднего полюса выявлены плюс-ткань гетерогенной эхоструктуры с единичными кальцинатами, размером 6,4×13,3 мм, вторичная отслойка сетчатки (рис. 2). Учитывая локализацию опухоли (солитарный опухолевый узел, полностью перекрывающий ДЗН), отсутствие шансов на зрение, размеры образования и высокий риск экстрабульбарного распространения опухоли, выполнена энуклеация левого глаза с пластикой культи. После получения патогистологического заключения (злокачественная медуллоэпителиома) ребенок направлен на консультацию к детскому онкологу с целью возможного выявления новообразования в головном мозге. По данным магнитно-резонансной томографии, опухолевых очагов в ЦНС не выявлено, однако в связи с прорастанием опухоли за laminacribrosa пациенту назначен курс лучевой и химиотерапии (циклофосфан, вепезид, карбоплатин).
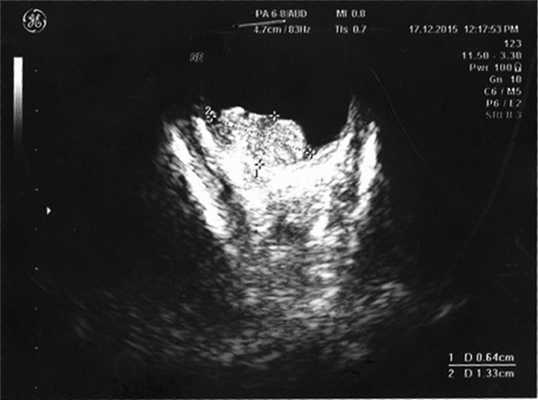
Рис. 2. Результат эхографии левого глаза у ребенка с подозрением на монокулярную форму ретинобластомы.
Патоморфологическое исследование. При морфологическом исследовании кусочка новообразования из боковой колодки выявлена опухоль, состоящая из кубических эпителиальных клеток, которые формировали единичные розетковидные структуры и небольшие участки солидного роста. Поставлен предварительный диагноз — недифференцированная ретинобластома без опухолевых комплексов в дистальном отрезке зрительного нерва. Далее при изучении срезов всего глазного яблока выявлен большой опухолевый узел в центральных отделах глазного дна, тесно связанный со зрительным нервом. Узел состоял преимущественно из трубчатых и сетчатых структур, розеток, ленточных образований, что придавало опухоли местами вид «кружева» (рис. 3).
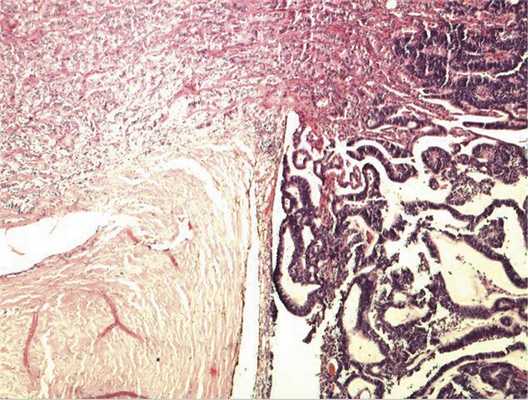
Рис. 3. Часть узла опухоли снаружи от ДЗН, имеющая вид «кружева». Окраска гематоксилином и эозином. Ув. 100.
Отмечалось наличие ленточных структур из низкодифференцированных эпителиальных клеток (рис. 4). Параллельно встречались участки солидного строения из клеток с гиперхромными ядрами с признаками клеточного и ядерного полиморфизма. В них почти исчезает строма, появляются митозы, встречаются участки дистрофии и некроза (рис. 5). Опухоль врастает в ткань ДЗН с переходом за laminacribrosa, но не достигает линии отсечения (рис. 6). В таком виде опухоль обладает местнодеструирующим характером роста и может давать метастазы, глубоко инфильтрируя прилежащую к ДЗН ткань хориоидеи. Окончательный гистологический диагноз: злокачественная медуллоэпителиома центрального отдела сетчатки с вовлечением ДЗН и инвазией перипапиллярной хориоидеи, с глубоким прорастанием по зрительному нерву, не достигая линии отсечения.
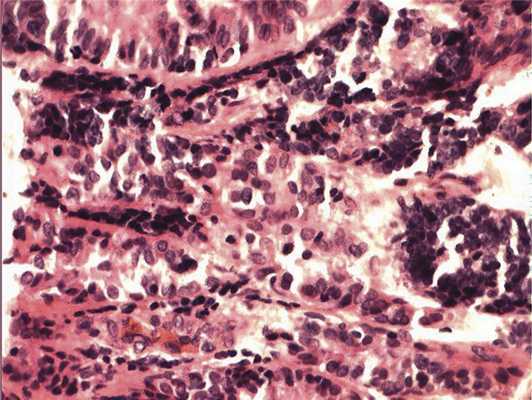
Рис. 4. Формирование полос из низкодифференцированных нейроэпителиальных клеток. Окраска гематоксилином и эозином. Ув. 400.
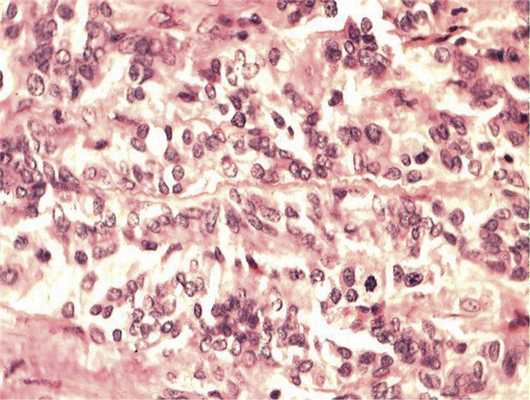
Рис. 5. Зоны солидного роста опухоли. Клеточный полиморфизм с фигурами митозов. Окраска гематоксилином и эозином. Ув. 400.
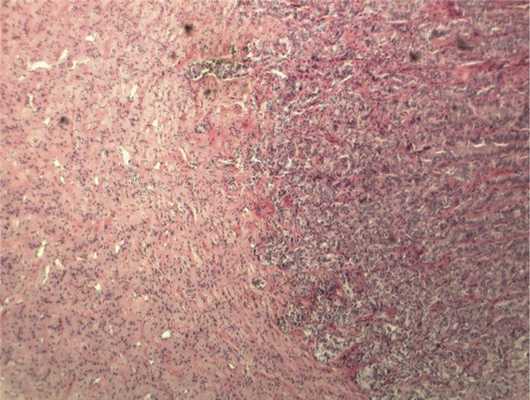
Рис. 6. Врастание опухоли в ткань ДЗН с ростом по ходу пучков нервных волокон. Окраска гематоксилином и эозином. Ув. 100.
Получение первичной культуры опухоли. После вскрытия глазного яблока взят образец опухолевой ткани для получения клеточной культуры с последующим исследованием лекарственной устойчивости (МТТ-тест). Опухолевый образец транспортировали в лабораторию генетики опухолевых клеток РОНЦ им. Н.Н. Блохина в течение 2—3 ч в бессывороточной среде RPMI («ПанЭко», Россия) с добавлением 100 мкг/мл гентамицина («Микроген», Россия). Далее полученную ткань обрабатывали механически (измельчали стерильными ножницами) и ферментативно (0,25% трипсин—0,04% ЭДТА; «ПанЭко», Россия) до получения клеточной суспензии, которую переносили в культуральные флаконы («Corning—Costar», США) со средой RPMI c добавлением 10% эмбриональной сыворотки коров («PAALaboratories», Австрия) и гентамицина 50 мкг/мл. Центрифугировали транспортировочную среду, полученный осадок клеток высевали на флаконы, которые помещали в термостат («Memmert», Германия) при температуре 37 °C и содержанием 5% СО2. Далее в течение 1 мес культивировали полученные клетки, по мере необходимости закисленную среду с погибшими клетками заменяли на новую питательную среду, при достижении клетками 60—80% уровня конфлюэнтности производили рассев клеток на новые культуральные флаконы. В течение культивирования клетки прошли 2—4 пассажа.
МТТ-тест. Метод основан на способности митохондриальных дегидрогеназ живых клеток метаболизировать желтый тетразол-реагент МТТ-3-(4,5-диметилтиазол-2)-2,5-дифенилтетразол-бромид в синий формазан. По интенсивности окраски конечного раствора судят о количестве живых клеток в лунке.
Клетки первичной культуры медуллоэпителиомы MB1 рассевали на 96-луночное плато по 1,5∙10 3 клеток в лунку в объеме 90 мкл культуральной среды RPMI. Препараты (иринотекан, ифосфамид, оксалиплатин и аскорбиновую кислоту) в объеме 10 мкл добавляли в различных концентрациях на следующий день. В контрольные лунки добавляли 10 мкл бессывороточной среды. Клетки культивировали в присутствии химиопрепаратов в течение 3 сут. Затем в лунки добавляли реагент МТТ в концентрации 5 мг/мл в объеме 20 мкл на лунку (рис. 7). Через 1,5—2 ч среду с реагентом удаляли и осадок растворяли в 60 мкл ДМСО. Уровень оптической плотности растворов в каждой лунке определяли с помощью спектрофотометра (планшетного ридера) Multiskan FC («ThermoScientific», EС) при длине волны 594 нм.

Рис. 7. 96-луночное плато с клетками первичной культуры злокачественной медуллоэпителиомы и исследуемыми препаратами.
Далее в «Программе для расчета IC50 химиотерапевтических веществ», написанной в лаборатории генетики опухолевых клеток, строили график зависимости уровня оптической плотности (проценты от контроля) от концентрации вещества и рассчитывали искомую концентрацию IC50 (полумаксимальное ингибирование). Использованы следующие химиопрепараты:
а) Иринотекан («Actavis», Исландия) в концентрациях 0,25; 0,5; 1,0 и 2,0 мг/мл;
б) Ифосфамид («Верофарм», Россия) в концентрациях 0,25; 0,5; 1,0 и 5,0 мг/мл;
в) Оксалиплатин («Medac», Германия) в концентрациях 0,1; 0,2; 0,38; 0,75 и 1,5 мг/мл;
г) Аскорбиновая кислота («Alvils», Россия—Китай) в концентрациях 0,6; 1,25; 2,5 и 5 мг/мл.
Результаты МТТ-теста представлены на рис. 8, а—г. Для аскорбиновой кислоты получена IC50 3,3 мг/мл. Результаты данного теста показывают, что с повышением концентрации препарата выживаемость клеток увеличивается.
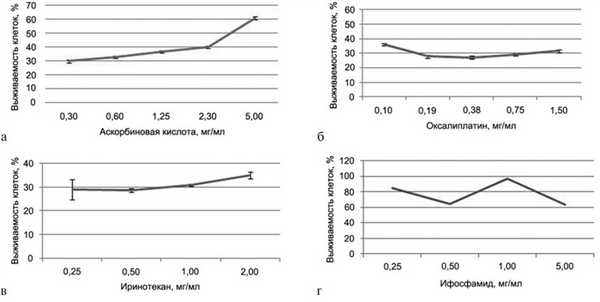
Рис. 8. IC50 (полумаксимальное ингибирование). а — для аскорбиновой кислоты; б — для оксалиплатина; в — для иринотекана; г — для ифосфамида.
IC50 для оксалиплатина, иринотекана и ифосфамида не получена. Для оксалиплатина при минимальной используемой концентрации 0,1 мг/мл выживаемость клеток составила 36%, для иринотекана при минимальной используемой концентрации 0,25 мг/мл — 29%, а для ифосфамида при максимальной используемой концентрации 5 мг/мл — 64%. Таким образом, из четырех исследованных препаратов IC50 (3,3 мг/мл) получена только для раствора аскорбиновой кислоты.
Заключение
К настоящему времени патогномоничные симптомы, свидетельствующие о первичной внутриглазной злокачественной медуллоэпителиоме, не описаны, а диагноз ставится на основании патогистологического заключения. Вместе с тем ряд симптомов, включая наличие кальцификатов и нехарактерные рентгенографические признаки, затрудняют дифференциальную диагностику с другими внутриглазными опухолями детского возраста, прежде всего ретинобластомой. К характерным патоморфологическим особенностям ретинобластомы, отличающим ее от медуллоэпителиомы, относят наличие «истинных» розеток, состоящих из цилиндрической формы нейроэпителиальных клеток эмбрионального типа [12]. Для медуллоэпителиомы, напротив, характерно наличие псевдорозеток, располагающихся диффузно или вокруг сосудов [2]. Несмотря на относительную редкость опухоли, необходимо проводить дифференциальный диагноз с другими внутриглазными образованиями, особенно при наличии сопутствующих длительно существующих глазных симптомов. Полученные данные об эффективности раствора аскорбиновой кислоты в отношении клеток внутриглазной злокачественной медуллоэпителиомы могут быть использованы для дополнения существующих химиотерапевтических протоколов в детской нейро- и офтальмоонкологии. Клеточная культура медуллоэпителиомы и возможная животная модель опухоли являются потенциальными объектами для изучения как экспрессии генов, так и специфических мутаций в ткани опухоли, что в свою очередь представляет интерес в перспективе для селективной химиотерапии опухоли и сохранения глаза.
Аденокарцинома
Аденокарцинома - это опасная для жизни опухоль, которая развивается в клетках, выделяющих слизь, пищеварительные соки и другие жидкости. Она представляет из себя разновидность карциномы - самого распространенного типа рака. Ее клетки способны прорастать в окружающие ткани, разрушать их, распространяться по телу и создавать различных его частях метастазы - дополнительные онкологические новообразования.
Что такое аденокарцинома и как она развивается?
В организме человека есть более 30 триллионов клеток, каждая из которых действует согласно строго определенной встроенной «программе»: рождается, работает и умирает. Иногда из-за влияния некоторых заболеваний, химических веществ, радиации, наследственных особенностей или случайных сбоев в процессе их деления возникают ошибки. В результате чего в теле появляются мутировавшие, или измененные клетки, обладающие особыми свойствами:
- Бесконтрольно размножаются.
- Не погибают по окончанию нормального жизненного цикла.
- Со временем из их множества формируется опухоль, которая не раздвигает окружающие ткани, а прорастает в них и разрушает.
- Они отрываются от основного, так называемого первичного очага, попадают в сосуды кровеносной и лимфатической Лимфатическая система дублирует кровеносную. В ней циркулирует лимфа - межклеточная жидкость, которая омывает все клетки тела, доставляет в них необходимые вещества и забирает отходы. На всем протяжении ее сосудов расположены лимфоузлы - похожие на горошину маленькие органы, которые обезвреживают и выводят из организма опасные вещества. систем.
- С кровью и лимфой - жидкостью, омывающей все клетки организма, перемещаются в различные части тела.
- Закрепляются в других структурах и органах, таких как мозг, печень, легкие или кости, и создают в них метастазы - дополнительные раковые новообразования.
Со временем все большее количество жизненно важных тканей повреждается, а их работа нарушается.
Измененными могут стать и клетки желез, выделяющие различные жидкости. Чаще всего аденокарциномы возникают в:
- Желудке, в котором происходит накопление и расщепление пищи.
- Легких, и составляют около 40% всех видов опасных опухолей дыхательных путей. Они развиваются в клетках, которые производят слизь, необходимую для выведения из тела пыли и микробов, содержащихся в воздухе. Обычно медленно растут и чаще встречаются у курильщиков, в том числе бывших.
- Молочной железе, и составляют большинство видов рака данного органа. Формируются в клетках, производящих грудное молоко.
- Пищеводе - трубке, по которой пища проходит из рта в желудок. Как правило, измененными становятся клетки, которые выстилают ее нижнюю часть и создают смазывающую слизь.
- Поджелудочной железе, расположенной за желудком. Около 85% всех случаев ее онкологических заболеваний - это аденокарциномы, возникающие в протоках, переносящих необходимые для пищеварения вещества.
- Предстательной железе у мужчин, находящейся чуть ниже мочевого пузыря. Развивается в клетках, производящих защищающую сперматозоиды жидкость.
- Прямой кишке, выводящей остатки переваренной пищи из организма.
- Толстой кишке, в которой происходит всасывание воды и питательных веществ. Аденокарцинома - это самый распространенный тип рака данного органа. Обычно они начинаются с небольшого полипа - нароста ткани на внутренней стенки.
Причины развития аденокарциномы
Сегодня научное сообщество не знает, почему именно возникают все случаи онкологии. Врачам известны только так называемые факторы риска, которые увеличивают вероятность появления в организме измененных клеток. Наличие одного или даже нескольких из них не гарантируют того, что заболевание обязательно разовьется. У каждого типа аденокарциномы есть свой список возможных причин.
Легкое:
- Курение, в том числе пассивное, то есть вдыхание табачного дыма.
- Загрязнение воздуха и химические вещества, такие как радиоактивный газ радон, диоксид кремния, прочие тяжелые металлы и использующийся в строительстве и другой промышленности асбест.
- Семейный анамнез - наличие кровных родственников, у которых уже есть подобный диагноз.
- Облучение: радиация, полученная в ходе диагностики и лечения различных видов онкологических заболеваний при воздействии на область грудной клетки.
Предстательная железа:
- Риск развития рака увеличивается после 50 лет, при этом большинство случаев выявляется у мужчин старше 65 лет.
- Мутации, или изменения генов BRCA1 и BRCA2, которые отвечают за устранение ошибок в клетках и предотвращение развитие опухолей.
- Синдром Линча, повышающий вероятность возникновения опасных новообразований у людей в возрасте до 50 лет.
- Курение.
- Ожирение и лишний вес.
- Семейный анамнез - наличие кровных родственников с подобным диагнозом.
- Неправильное питание: лишние калории, избыток животных жиров и сахара в рационе, а также нехватка фруктов и овощей.
- Недостаточная физическая активность.
- Воспалительные заболевания простаты.
Поджелудочная железа:
- Вероятность развития аденокарциномы повышается с возрастом. Большая часть случаев выявляется у пациентов старше 65 лет, причем у мужчин чаще, чем у женщин.
- Наследственные генетические синдромы, увеличивающие риск возникновения опухолей.
- Мутации, или изменения, вызывающие панкреатит - воспаление поджелудочной железы.
- Некоторые факторы образа жизни: курение, лишний вес, нехватка физической нагрузки, злоупотребление алкоголем и диета с высоким содержанием жира и красного мяса.
Пищевод:
- Пол и возраст: большинство случаев новообразований выявляется у мужчин старше 55 лет.
- Травмы и повреждения пищевода, в том числе от кислоты, забрасываемой из желудка, алкоголя и горячих жидкостей.
- Другие виды рака: легких, ротовой полости или горла.
- Наследственность - наличие кровных родственников, у которых уже есть подобный диагноз.
- Тилоз - чрезмерное разрастание верхнего слоя кожи на ладонях и подошвах стоп, а также образование папиллом, которые представляют из себя небольшие наросты ткани в пищеводе.
- Питание: нехватка в рационе фруктов и овощей.
- Воздействие химикатов и раздражителей, таких как сажа, табачный дым, выхлопные газы, металлическая пыль и других.
Кишечник:
- Чаще всего колоректальные аденокарциномы встречаются у мужчин старше 50 лет.
- Воспалительные заболевания, приводящие к постоянному повреждению стенок органа.
- Ожирение.
- Сидячий образ жизни и отсутствие физической нагрузки.
- Употребление алкоголя и табака.
- Полипы - разрастания тканей на стенке кишечника.
- Диета с низким содержанием клетчатки и высоким - жира и полуфабрикатов из мяса.
Молочная железа:
- Семейный анамнез - наличие родственников с подобным диагнозом.
- Возраст от 55 лет.
- Мутации, или изменения генов BRCA1 и BRCA2, которые отвечают за устранение ошибок в клетках и предотвращение развитие опухолей.
- Ранние менструации - до 12 лет, и менопауза после 55 лет.
- Лучевая терапия - облучение области грудной клетки.
- Плотная ткань молочной железы.
- Употребление алкоголя.
- Ожирение.
- Наличие рака груди или яичников, в том числе находящихся в ремиссии Ремиссия - это полное отсутствие признаков заболевания.
- Нехватка физической активности.
- Отсутствие беременностей, грудного вскармливания и роды после 30 лет.
Желудок:
- Большинство пациентов - мужчины в возрасте от 60 лет.
- Избыточный вес.
- Алкоголь и табак.
- Полипы - разрастания ткани на стенке органа.
- Синдром Линча, повышающий вероятность возникновения опасных новообразований у людей в возрасте до 50 лет.
- Избыток красного мяса в рационе, употребление большого количества соленой, маринованной или копченой пищи.
- Инфекция Helicobacter pylori - бактерии, повреждающие слизистую оболочку желудка и приводящие к развитию язвы и гастрита Гастрит - это воспаление слизистой оболочки желудка. .
- Наличие родственников с подобным диагнозом.
- Группа крови А (II).
- Наследственные синдромы, провоцирующие разрастание тканей или возникновение опухолей.
Аденокарцинома развивается из-за ошибок в генах, которые контролируют рождение, работу и смерть клеток. Такие изменения происходят по нескольким причинам.
- Часть возникает при делении клеток.
- Некоторые из них вызваны воздействием вредных веществ и образом жизни.
- И в части случаев они наследуются от родителей.
Так называемые онкогены стимулируют развитие клеток, а супрессоры опухолей - замедляют их рост и вызывают гибель по окончанию жизненного цикла. Если в результате различных нарушений первые из них активируются, а вторые «выключаются», в организме человека появляется рак.

Диагностика аденокарциномы
Сегодня медицина предлагает множество различных методов, позволяющих выявлять раковые опухоли даже на самых ранних этапах.
- Биопсия - изъятие небольшого количества тканей для изучения свойств ее клеток. Данное исследование - единственный способ постановки точного диагноза. Материал забирается в ходе хирургической операции или прокола иглой, после чего передается в лабораторию, где специалисты выявляют в нем раковые клетки и определяют их тип. Эта информация необходима врачам для подбора правильного лечения и определения прогнозов пациента.
- Рентгенография грудной клетки, а также маммография, обнаруживающая новообразования в молочной железе.
- УЗИ, или сонография - оценка состояния внутренних структур с использованием звуковых волн. Процедура не наносит вреда организму пациента и часто выполняется для выявления очагов заболевания, расположенных в том числе в лимфатических узлах - органах иммунной системы, задерживающих и уничтожающих опасные вещества.
- Магнитно-резонансная томография, МРТ - создание крайне подробного и детализированного изображения мягких тканей, включая мозг, нервы и сосуды при помощи мощных магнитов и радиоволн. МРТ обнаруживает опухоли и определяет их точные размеры и границы. Она не назначается людям с несовместимыми трансплантатами и протезами и не дает возможности исследовать части скелета, в которые часто проникают измененные клетки.
- Компьютерная томография, или КТ. Специальный аппарат делает множество рентгеновских снимков и объединяет их в одну четкую черно-белую картинку. КТ позволяет изучать не только мягкие структуры, но и кости, а также содержащие большое количество воздуха органы, такие как легкие.
- Позитронно-эмиссионная томография.До начала процедуры человек получает небольшое количество радиоактивного сахара, который накапливается в быстро делящихся клетках, в том числе раковых. Затем проводится сканирование, выявляющее любые, даже самые маленькие их скопления. ПЭТ применяется для поиска в организме метастазов - дополнительных очагов онкологии, если врачи точно не знают, в какой именно области они могут находиться. Некоторое оборудование позволяет одновременно выполнять ПЭТ и КТ, благодаря чему доктор получает гораздо больше информации, чем дает каждое из данных исследований.
- Анализы крови. Назначаются для поиска онкомаркеров - белков, выделяемых некоторыми типами измененных клеток, а также для оценки качества работы внутренних органов, таких как почки и печень.
Пройти полную диагностику аденокарциномы можно в онкологическом центре «Лапино-2».
У нас есть высококвалифицированные специалисты и современное оборудование, которое позволяет выявлять опасные опухоли на самых ранних стадиях.
У пациентов нашей клиники нет необходимости тратить времени на поездки по разным медицинским учреждениям - все процедуры выполняются на территории Центра. Исследования проводятся без очереди, в максимально сжатые сроки, а результаты анализов мы получаем из собственной лаборатории.
Стадии аденокарциномы
После выявления рака врачи выясняют его стадию - количество пострадавших от измененных клеток тканей. Для определения этапа аденокарциномы используется международная система TNM, основанная на 3 ключевых моментах:
- Т: размере основной опухоли.
- N: количестве поврежденных лимфатических узлов.
- М: наличии или отсутствии метастазов - дополнительных очагов заболевания в различных областях организма.
Стадии:
В тканях присутствуют измененные клетки, но они есть только там, где впервые возникли.
I. Опухоль имеет минимальные размеры и находится в пределах органа, в котором она образовалась.
II. На этом этапе очаг разрастается до более крупных габаритов, но другие структуры здоровы.
III. Новообразование увеличивается еще сильнее и выходит за границы органа, в котором появилось. Либо неправильные клетки обнаруживаются в лимфатических узлах - «фильтрах» иммунной системы, задерживающих и обезвреживающих опасные вещества.
IV. Единственная стадия, в медицинском шифре которой рядом с буквой «М» стоит цифра «1», а не ноль. Это значит, что в теле пациента присутствуют метастазы - дополнительные раковые опухоли в других областях организма, расположенных далеко от первичного очага.

Лечение аденокарциномы
Тактика борьбы с раком зависит от большого количества факторов: количества пострадавших тканей, размера и расположения опухоли, возраста человека, наличия у него других тяжелых заболеваний и его общего состояния здоровья.
Часто основным методом лечения аденокарциномы является хирургия - удаление новообразования и небольшого количества окружающей ее здоровой ткани. Нормальные структуры изымаются для того, чтобы в организме не осталось ни одной измененной клетки, которая могла бы размножиться и сформировать новый очаг заболевания.
Операции проводятся как классическим способом - с выполнением крупных разрезов, так и лапароскопически - с использованием специального инструмента через небольшие проколы. Такие вмешательства позволяют повреждать минимум тканей и сокращают кровопотерю, болевые ощущения и сроки восстановления, но требуют большого опыта и мастерства хирурга.
Химиотерапия - применение препаратов для уничтожения неправильных клеток. Они вводятся в вену или принимаются внутрь, попадают в кровоток, распространяются по всему телу и действуют во всех его областях. Благодаря такому свойству их можно использовать в том числе на запущенных стадиях, при распространении рака и появлении метастазов Метастаз - это новая, дополнительная онкологическая опухоль, возникшая в тканях или органах, расположенных далеко от основного ракового очага. . «Химия» проводится циклами, каждый из которых чередуется с периодом отдыха, необходимого для восстановления организма.
Лучевая терапия - разрушение измененных клеток радиацией. Лечение предполагает 2 вида воздействия:
- внешнее - облучение из специального аппарата, расположенного вне тела;
- и внутреннее, или брахитерапию - размещение радиоактивных веществ в опухоли или близких к ней тканях.
Может назначаться совместно с химиотерапией. Проводится до операции для уменьшения размеров опухоли и облегчения ее удаления, а также после хирургического вмешательства для уничтожения всех оставшихся неправильных клеток.
Таргетная терапия - прием препаратов, которые воздействуют только на определенные изменения в клетках. С их помощью можно остановить рост новообразования или уменьшить его размеры. В отличие от обычной «химии», влияющей на любые быстро делящиеся клетки, такие вещества практически не повреждают здоровые ткани.
Гормональная терапия. Гормоны - это вещества, которые создаются железами, с кровью перемещаются в различные ткани и сообщают им, как действовать - работать или отдыхать, поглощать что-то или выделять. Данные соединения влияют на развитие некоторых видов аденокарцином. Контроль их количества или прекращение выработки с помощью специальных лекарств может замедлить или прекратить увеличение опухолей.
Иммунотерапия - средства, которые помогают собственной иммунной системе человека выявлять и разрушать измененные клетки. Такие препараты обычно назначаются пациентам с распространенным раком для сокращения размеров новообразований и остановки их роста.
В онкологическом центре «Лапино-2» проводится лечение различных типов аденокарцином на любой стадии.
У нас работают отличные специалисты - врачи с мировым именем и огромным опытом в области выявления и борьбы с онкологическими заболеваниями.
Мы применяем все современные методики и используем исключительно оригинальные препараты, дающие предсказуемый результат.
Нашим пациентам не приходится терять драгоценное время - у нас нет очередей, а все процедуры проводятся точно в срок, с максимальным комфортом для каждого посетителя.
Прогнозы и выживаемость при аденокарциноме
Прогноз индивидуален для каждого человека и зависит от множества факторов: возраста, наличия других тяжелых заболеваний, типа рака, его распространенности, свойств его клеток и реакции на проводимую терапию.
Врачи определяют примерные перспективы пациента, ориентируясь на данные «пятилетней выживаемости». Этот показатель представляет из себя статистическую выборку - количество больных, оставшихся в живых через 5 или более лет с момента постановки диагноза.
Для различных типов аденокарциномы общая для всех стадий цифра выглядит следующим образом:
Читайте также:
