Синдром Кеннона (Cannon) - синонимы, авторы, клиника
Добавил пользователь Alex Обновлено: 21.01.2026
Синдром Конна, или первичный гиперальдостеронизм, — не такое уж редкое гормональное (эндокринное) заболевание, характеризующееся повышенным уровнем альдостерона в крови. Альдостерон — важный гормон, вырабатываемый надпочечниками. При первичном гиперальдостеронизме надпочечники вырабатывают избыток альдостерона по разным причинам, и это имеет неприятные последствия для организма, наиболее серьезным из которых, вероятно, является повышение артериального давления. Даже сегодня синдром
Конна считается наиболее частой причиной так называемой вторичной гипертонии (первичная, идиопатическая гипертензия — это врожденная предрасположенность к этой проблеме, чему, конечно, помогает в основном неправильный образ жизни). Хотя раньше он считался редким заболеванием, в последнее время многие врачи диагностировали синдром Конна как объяснение высокого кровяного давления у ряда пациентов, которые плохо реагируют на гипотензивную терапию.
Факторы риска синдрома Конна
В основном страдают женщины в возрасте от 30 до 50 лет, поэтому им следует проявлять особую бдительность. Конечно, факторами риска этого синдрома являются уже упомянутые различные изменения и аномалии надпочечников, их увеличение, врожденная гиперплазия, доброкачественные и злокачественные опухоли и тому подобное.
Надпочечники — очень маленькие органы, но они чрезвычайно важны для всего тела. Они располагаются забрюшинно (в задней части брюшной полости за брюшиной) над обеими почками парным органом треугольной формы. Эти органы вырабатывают ряд различных гормонов — одни в коре головного мозга, другие в костном мозге. Катехоламины (адреналин и норадреналин) производятся в костном мозге, глюкокортикоиды, андрогены и минералокортикоиды — альдостерон — производятся в коре.
Функция альдостерона — поддерживать ионный баланс и, таким образом, способствовать рациональному использованию водных ресурсов. Благодаря своему действию натрий всасывается обратно в почки, а калий выводится из организма. Так увеличивается уровень натрия и снижается уровень калия в крови. Поскольку вода движется вместе с натрием, она также удерживает воду в организме, тем самым увеличивая объем крови и, следовательно, кровяное давление. Секреция, выработка альдостерона зависит от секреции гормона ренина в почках.
Причины синдрома Конна
Причины синдрома Конна, то есть первичный гиперальдостеронизм (первичный, потому что он возникает непосредственно в надпочечниках), часто бывают, например, доброкачественными, особенно из-за клеток, продуцирующих альдостерон (эта опухоль тогда называется альдостероном). Наиболее частой причиной, до семидесяти процентов, может быть гиперплазия или отек и высокая реактивность обоих надпочечников. Редко синдром может возникнуть из-за генетической мутации или злокачественного рака коры надпочечников. Редкий тип первичного альдостеронизма имеет семейное происхождение, он поражает целые семьи, в том числе детей, у которых с раннего возраста очень высокое кровяное давление. Довольно часто причину вообще не удается отследить, тогда речь идет об идиопатическом синдроме Конна.
Симптомы синдрома Конна
Основные симптомы — высокое кровяное давление и гипокалиемия, то есть низкий уровень калия в крови. Это связано с повышенным pH крови, то есть метаболическим алкалозом, поскольку почки выделяют больше катионов водорода. В этой ситуации доступность кальция к тканям снижается, что вызывает такие симптомы, как гипокальциемия (снижение уровня кальция). Гипонатриемия, повышенный уровень натрия встречаются реже. Поэтому пациенту следует обратиться к врачу, если он замечает такие проблемы, как частое мочеиспускание (особенно ночью) и, как следствие, усиление чувства жажды, слабости, утомляемости, мышечных спазмов, временного и преходящего паралича, учащенного сердцебиения и сильного пульса, головных болей, ощущение покалывания в мышцах.
Первичный гиперальдостеронизм следует отличать от вторичного. Это происходит в результате любых процессов, повышающих уровень ренина в крови (ренин — это гормон, вырабатываемый почками и оказывающий основное влияние на производство, высвобождение и уровень альдостерона). Причиной повышения уровня ренина может быть, например, снижение почечного кровотока, низкое кровяное давление или низкий уровень натрия в моче. Однако наиболее важной и частой причиной является сужение или закупорка почечных артерий, которые отходят непосредственно от аорты и снабжают почки кровью. Однако они также включают застойную сердечную недостаточность, цирроз печени, заболевания почек и беременность.
Туннельные синдромы
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Для корректной оценки результатов ваших анализов в динамике предпочтительно делать исследования в одной и той же лаборатории, так как в разных лабораториях для выполнения одноименных анализов могут применяться разные методы исследования и единицы измерения.
Синонимы: компрессионная невропатия, компрессионно-ишемическая невропатия, ловушечная невропатия, капканный синдром, Tunnel syndrome
Туннельные синдромы: причины появления, симптомы, диагностика и способы лечения.
Определение
Туннельные синдромы - это группа заболеваний, причиной которых является локальная компрессия (защемление) и ишемия (нарушение кровоснабжения) периферических нервов, характеризующаяся болью и/или снижением их функций (двигательных и чувствительных).
Туннельные невропатии среди всех заболеваний периферической нервной системы составляют до 40%, причем чаще страдают лица наиболее трудоспособного возраста - 30-50 лет. В литературе описано более 30 форм туннельных невропатий.
Причины появления туннельных синдромов
Головной и спинной мозг получают и отсылают информацию к мышцам, железам и рецепторам. Информация, поступающая к внутренним органам, проходит по нервам. Для большинства периферических нервов характерны три особенности, защищающие их от физической деформации:
- волнообразный ход ненатянутого нерва;
- эластичность;
- расположение нервов относительно суставов предохраняет их от избыточных растяжений во время движений конечностей.
Туннели являются естественными анатомическими структурами, образованными мышцами, связками, фасциями, сухожилиями, костями.
Основным предрасполагающим фактором развития туннельной нейропатии является узость того или иного анатомического туннеля, через который проходят нервы. Сдавлению подвергаются не только нервы, но и сосуды, идущие параллельно нервным стволам, поэтому некоторые туннельные синдромы являются нейроваскулярными.
Широкое распространение туннельных синдромов - это прямое следствие профессиональной деятельности, связанной с длительной статической нагрузкой (монотонной работой за компьютером у офисных работников, профессиональной деятельностью музыкантов, художников, спортсменов). Основным фактором местного патологического воздействия является перенапряжение связочного аппарата и мышц, окружающих нерв. Наибольшая доля туннельных синдромов (80%) связана с поражением верхних конечностей.
Второе место по распространенности занимают посттравматические периферические нейропатии - они развиваются на фоне или после перенесенной инфекции, чаще вирусной этиологии.
Туннельные невропатии часто наблюдаются при эндокринных заболеваниях (сахарном диабете, гипотиреозе, акромегалии), патологиях суставов (подагре, деформирующем остеоартрозе, ревматоидном артрите), объемных образованиях самих нервов (шванноме, невроме), при паранеопластических полиневропатиях (саркоме, липоме), депозитарных невропатиях (амилоидозе), наследственной склонности к параличам от сдавления, а также при некоторых физиологических изменениях гормонального статуса (беременности, лактации, климаксе), приеме пероральных контрацептивов. К нарушению функции периферических нервов могут приводить механическая травматизация, ишемия (которая может быть первичной или возникать вслед за компрессией или одновременно с ней), венозный застой, отек тканей.
Известны семейные формы туннельных невропатий, обусловленные, по-видимому, как избыточным анатомическим сужением тех или иных каналов, так и наследуемыми аномалиями (дополнительными мышцами и сухожилиями, рудиментарными костными шпорами и фиброзными тяжами).
Туннельные синдромы разделяются в зависимости от пораженных нервов на нейропатии черепных нервов, нейропатии плечевого пояса и верхних конечностей, нейропатии тазового пояса и нижних конечностей.
- Карпальный синдром (запястный туннельный синдром) является самой распространенной формой компрессионно-ишемической невропатии, встречающейся в клинической практике. Развивается вследствие сдавливания срединного нерва в том месте, где он проходит через запястный канал под поперечной связкой запястья - удерживателем сухожилий сгибателей пальцев.
- Кубитальный синдром развивается при компрессии локтевого нерва на уровне локтевого сустава.
- Фибулярный синдром - невропатия малоберцового нерва при его сдавлении на уровне коленного сустава, а именно в области головки малоберцовой кости.
- Тарзальный синдром - невропатия нижней конечности, которая возникает в результате сдавления большеберцового нерва, проявляющаяся болью в области голеностопного сустава по внутренней стороне стопы.
- В случае краниальных нейропатий поражаются глазодвигательный, тройничный, лицевой нервы.
По срокам развития туннельные синдромы подразделяют на острые (развиваются от нескольких дней до 4-х недель), подострые (развиваются в течение нескольких недель) и хронические, в т.ч. рецидивирующие (развиваются в течение нескольких месяцев или лет).
Симптомы туннельных синдромов
Тяжесть повреждения нерва, вызванного острой или хронической компрессией, зависит от силы и продолжительности компрессии, а также от размеров нервного волокна, его положения в нервном стволе, количества и размеров пучков нервных волокон.
Полная картина туннельного синдрома включает в себя чувствительные (боль, парестезии, онемение), двигательные (снижение функции, слабость, атрофии) и трофические нарушения.
Возможны различные варианты клинического течения. Чаще всего заболевание дебютирует болью или другими чувствительными расстройствами. Реже - начало характеризуется двигательными нарушениями. Трофические изменения обычно выражены незначительно и только в запущенных случаях.
Сначала боль появляется во время движения (нагрузки), а по мере развития патологии возникает и в покое. Для туннельных синдромов характерны чувство онемения, покалывания по ходу поврежденного нерва, ощущение прохождения электрического тока (электрический прострел), жгучая боль. Двигательные нарушения возникают вследствие поражения двигательных ветвей нерва и проявляются снижением силы, быстрой утомляемостью. В некоторых случаях прогрессирование заболевания приводит к атрофиям, развитию контрактур («когтистая лапа», «обезьянья лапа»). При компрессии артерий и вен возможно развитие сосудистых расстройств, что проявляется побледнением, снижением локальной температуры кожного покрова или появлением синюшности и отечности в области поражения.
Диагностика туннельных синдромов
Как правило, диагноз устанавливается на основании характерных клинических проявлений. Удобным для клинициста является использование ряда клинических тестов, которые позволяют дифференцировать различные виды туннельных синдромов.
При наличии у больного признаков компрессионно-ишемического поражения периферических нервов необходимо проведение стандартного комплекса исследований, который включает:
- общий соматический осмотр с определением основных витальных функций;
- неврологический осмотр с использованием специфических тестов; (добавочные ребра, костные мозоли, костные отростки, переломы, вивихи и др.);
- нейровизуализацию (магнитно-резонансную или компьютерную томографию) участка компрессии нервного ствола, позвоночника и др.;
- электрофизиологические методы исследования (электронейромиографию для определения скорости проведения импульса по нерву и уточнения уровня поражения нерва);
- допплерографию сосудов конечностей с выполнением сгибательно-разгибательных проб;
Ультразвуковое сканирование артерий верхних конечностей в комплексной диагностике сердечно-сосудистых заболеваний.
Синдром Конна (первичный гиперальдостеронизм) - симптомы и лечение
Что такое синдром Конна (первичный гиперальдостеронизм)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Лукьянова Сергея Анатольевича, хирурга-эндокринолога со стажем в 18 лет.
Над статьей доктора Лукьянова Сергея Анатольевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина
Определение болезни. Причины заболевания
Синдром Конна (первичный гиперальдостеронизм) — это гормональное расстройство, при котором надпочечники в избыточном количестве вырабатывают гормон альдостерон. Проявляется повышением артериального давления.
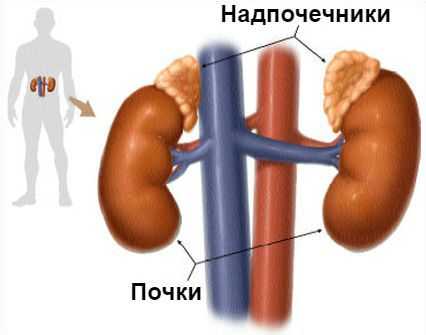
Основная задача альдостерона состоит в регулировании уровня натрия и калия в крови. Если этого гормона становится слишком много, организм начинает терять калий и удерживать слишком много воды, из-за чего объём крови и артериальное давление увеличиваются.
Первичный гиперальдостеронизм может быть вызван гиперактивностью либо одного, либо обоих надпочечников, т. е. быть односторонним или двусторонним. Одностороннее заболевание обычно вызывается альдостерон-продуцирующей аденомой (доброкачественной опухолью ), гиперплазией (усиленным ростом клеток) или, реже, раком одного надпочечника. На развитие этих причин влияют генетические факторы. Двустороннее заболевание обычно вызывает двусторонняя гиперплазия, т. е. усиленный рост клеток обеих желёз . Причиной такой гиперактивности надпочечников могут быть редкие генетические синдромы: семейный гиперальдостеронизм 1-го и 2-го типа.
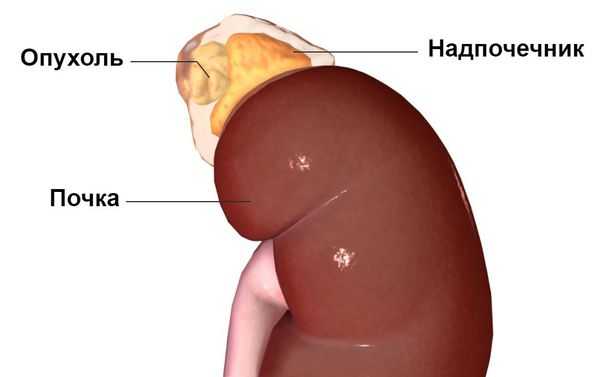
Наиболее часто синдром Конна встречается у людей 30-50 лет, преимущественно среди женщин — в 60-70 % случаев. Изначально он считался крайне редким заболеванием. В настоящее время установлено, что это одна из наиболее распространённых причин симптоматической артериальной гипертензии. Последние исследования показывают, что данное заболевание встречается у 5-15 % пациентов с гипертонией. Но так как пациентов, устойчивых к лечению артериальной гипертензии, редко направляют для обследования к эндокринологу, синдром Конна, по-видимому, часто остаётся недиагностированным [1] .
Хотя первичный гиперальдостеронизм всё ещё является значительной диагностической проблемой, его распознавание имеет решающее значение, поскольку артериальную гипертонию при этом заболевании можно полностью вылечить с помощью хирургического вмешательства (в отличие от гипертонической болезни, когда пациенты вынуждены пожизненно принимать гипотензивные препараты).
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы синдрома Конна
Высокое давление является постоянным и зачастую единственным симптомом первичного гиперальдостеронизма. Оно наблюдается в 75-98 % случаев, вызывает головные боли, помутнение зрения и головокружение [2] [4] .
Повышение артериального давления может быть как незначительным, так и очень высоким. Причём высокие цифры при синдроме Конна обычно трудно контролировать, поэтому пациенты вынуждены принимать по четыре препарата для снижения давления или даже больше.
Часто у больных могут наблюдаться гипертонические кризы, при которых верхнее (систолическое) давление поднимается выше 250 мм рт. ст [3] . Клиническая картина таких кризов при синдроме Конна не отличается от обычного гипертонического криза: пациентов беспокоит головная боль, тошнота, рвота, головокружение, мелькание мушек перед глазами, избыточная потливость, боли в области сердца, учащённый пульс, чувство страха, звон в ушах и др.

Гипокалиемия (низкий уровень калия в крови) — второй по частоте симптом первичного гиперальдостеронизма. Его выявляют у 9-37 % больных [5] . Гипокалиемия может вызвать такие симптомы, как усталость, онемение, учащённое мочеиспускание, жажда, судороги и мышечная слабость. Увеличение объёма мочи (полиурия) и ночные пробуждения из-за позыва к мочеиспусканию (ноктурия) являются результатом нарушения работы почек. Иногда гипокалиемия может быть вызвана приёмом диуретиков. Уровень натрия в этом случае может быть нормальным или умеренно повышенным. Отёчный синдром, в отличие от других заболеваний почек, при этом встречается редко.
Все перечисленные жалобы часто встречаются и при других заболеваниях. Заподозрить именно синдром Конна можно, если у пациента:
- очень высокое артериальное давление, плохо поддающееся лекарственной терапии;
- семейный анамнез первичного альдостеронизма;
- высокое артериальное давление в возрасте до 40 лет;
- высокое артериальное давление и опухоль в одном из надпочечников;
- высокое артериальное давление и низкий уровень калия;
- высокое артериальное давление и апноэ во время сна.
Патогенез синдрома Конна
В связи с высоким уровнем альдостерона почки начинают сильнее всасывать натрий, задерживать воду и выводить калий из организма. Повышенное всасывание натрия почками, в свою очередь, увеличивает объём плазмы, что является первичным инициирующим механизмом гипертонии. Все эти изменения могут вызвать воспаление и отёк тканей с последующим развитием фиброза в жизненно важных органах, таких как сердце, почки и сосудистая сеть. В результате этого в дальнейшем развивается хроническая почечная недостаточность, мерцательная аритмия, инсульт, ишемическая болезнь сердца и застойная сердечная недостаточность.
Первичный гиперальдостеронизм может быть семейным (наследственным) и спорадическим (ненаследственным). Семейный вариант заболевания вызывает один из 4-х генетических вариантов гиперальдостеронизма, которые передаются по наследству. Также он может возникать спорадически, т. е. от случая к случаю. Генетические формы болезни связаны с мутацией генов, спорадические — с развитием альдостерон-продуцирующей аденомы или двусторонней гиперплазии надпочечников. До 2011 года причина возникновения этих аденом была не известна. Позже врачи установили, что в возникновении этих заболеваний особую роль также играют различные мутации [14] .
Не менее 6 % всех случаев первичного гиперальдостеронизма передаётся по наследству. Первый тип вызывается химерным геном, который содержит определённую последовательность структурных элементов ДНК гена 11β-гидроксилазы (CYP11B1). Этот ген регулируется АКТГ — адренокортикотропным гормоном, поэтому при первом типе заболевания также нарушается синтез глюкокортикоидов — других гормонов надпочечников. Тяжесть гиперальдостернизма может быть различной, отмечается раннее начало заболевания и высокая частота инсульта.
Клиническое течение второго типа неотличимо от спорадической формы болезни. Он диагностируется тогда, когда по крайней мере у двух членов семьи установлен этот диагноз. Генетическая основа данного типа остаётся неизвестной.
Третий тип ассоциируется с мутациями в гене KCNJ. Данные мутации приводят к нарушению транспорта калия и увеличению проводимости для натрия. В результате этого клеточная мембрана деполяризуется и вызывает открытие зависимых от каналов ионов кальция, который затем активирует выработку альдостерона. Для этого типа характерен дебют заболевания в раннем возрасте.
Недавно был описан новый, четвёртый тип семейного гиперальдостеронизма. Его вызывает мутация в гене CACNA1H, который кодирует работу кальциевых каналов. Этот тип также часто развивается ещё в детском возрасте и протекает с высоким артериальным давлением.
Спорадические формы гиперальдостеронизма (ненаследственные), тоже обусловлены различными мутациями, но уже соматическими (возникающими в течение жизни). Это в основном мутации усиления функции в генах, кодирующих ионные каналы или транспортёры (KCNJ5, CACNA1D, ATP1A1 и ATP2B3), которые приводят к избыточной продукции альдостерона [6] .
Достижения в области секвенирования генома человека (направленного на определение последовательности структурных элементов в молекуле ДНК) значительно продвинули наше понимание патогенеза первичного гиперальдостеронизма и показали, что чрезмерная выработка альдостерона при этой наиболее распространённой форме эндокринной гипертензии не так проста, как считалось ещё каких-то 10 лет назад.
Классификация и стадии развития синдрома Конна
Первичный гиперальдостеронизм классифицируется на основании анатомических характеристик и физиологических реакций.
Анатомически синдром Конна можно разделить на неопластический (аденомы, карциномы и эктопический гиперальдостеронизм) и неопухолевый (односторонняя или двусторонняя гиперплазия надпочечников).
Физиологически выделяют две формы заболевания:
- Ангиотензин чувствительная форма. К ней относится двусторонняя гиперплазия надпочечников и редкие формы односторонней аденомы. Они частично зависят от гормональной системы человека, которая регулирует артериальное давление.
- Ангиотензин нечувствительная форма. К ней относятся большинство альдостерон-продуцирующих аденом, рак или гиперплазия одного надпочечника. Они полностью не зависят от гормональной системы, регулирующей артериальное давление.
Частота встречаемости различных типов заболевания:
- Альдостерон-продуцирующие аденомы — 60 %.
- Первичная двухсторонняя гиперплазия надпочечников — 40 %.
- Односторонняя гиперплазия надпочечников — менее 1 %:
- альдостерон-продуцирующие ненадпочечниковые опухоли;
- альдостерон-продуцирующий рак коры надпочечника;
- глюкокортикоид-зависимый гиперальдостеронизм [7] .
Осложнения синдрома Конна
Повышенное артериальное давления и низкий уровень калия при синдроме Конна становятся причинами развития других проблем [8] . Так, гипокалиемия может привести к слабости, нарушению сердечного ритма, мышечным судорогам, чрезмерной жажде или мочеиспусканию, а постоянно высокое давление — к проблемам с сердцем и почками, в том числе инфаркту, инсульту и почечной недостаточности.
Риск возникновения сердечно-сосудистых проблем у пациентов с первичным гиперальдостеронизмом гораздо выше, чем у людей, которые имеют только высокое артериальное давление. Чтобы избежать возможных последствий синдрома Конна, больным с гипертонией, не поддающейся лечению, следует обратиться к эндокринологу для проведения обследования.
Диагностика синдрома Конна
Первичный гиперальдостеронизм диагностируется путём измерения в крови уровня альдостерона и ренина (гормона, вырабатываемого почками). Для более точной диагностики анализы необходимо сдавать утром. При синдроме Конна уровень альдостерона будет высоким, а уровень ренина — низким. При этом уровень калия может быть низким или нормальным.
Если результаты этих анализов будут положительными, то пациенту могут назначить дополнительные тесты для подтверждения диагноза. Они направлены на снижение количества альдостерона. Это можно сделать несколькими способами: ввести определённое лекарство, выполнить внутривенное вливание солевых растворов или ввести дополнительную соль с помощью диеты. Если после этих тестов уровень альдостерона останется высоким, а уровень ренина снизится, то диагноз подтверждается.
Альдостерон-рениновое соотношение (АРС). Этот анализ крови является скрининговым тестом, то есть он проводится при подозрении на гиперальдостеронизм. В настоящее время АРС является самым надёжным тестом по выявлению синдрома Конна. Однако различные методики определения этого соотношения часто приводят к ложноположительным или ложноотрицательным результатам. Об этом обязательно нужно помнить. Поэтому даже при высоком АРС, которое указывает на первичный гиперальдостеронизм, для подтверждения диагноза может потребоваться дополнительное тестирование.
Существует ряд правил по выполнению этого анализа:
- кровь необходимо брать в утренние часы (с 8:00 до 10:00);
- перед забором крови пациенту необходимо спокойно посидеть 5-10 минут;
- если у пациента есть гипокалиемия, то перед проведением анализа уровень калия необходимо нормализовать. Для этого в течение трёх дней перед забором крови рекомендуют соблюдать диету без ограничения соли, при которой пациенту нужно употреблять минимум 5-6 г поваренной соли в день;
- приём препаратов, которые могут повлиять на уровень альдостерона, необходимо отменить (например диуретики, противовоспалительные средства и др.) [9] .
Тест на подавление каптоприлом. Этот анализ крови измеряет реакцию альдостерона на каптоприл — лекарство, используемое для лечения высокого артериального давления. При отсутствии первичного гиперальдостеронизма уровень альдостерона в крови снизится более чем на 30 % от исходного.
24-часовая экскреция альдостерона с мочой. Для проведения этого теста пациент в течение пяти дней придерживается диеты с высоким содержанием соли, а затем сдаёт анализ мочи, собранной за сутки. Если уровень альдостерона в моче будет высоким, то наличие первичного гиперальдостеронизма будет подтверждено.
Тест на подавление физиологическим раствором. В этом тесте пациент получает солевой раствор через капельницу, затем ему измеряют уровень альдостерона и ренина. Первичный гиперальдостеронизм может быть подтверждён, если уровень альдостерона в крови после такой солевой нагрузки останется высоким, а уровень ренина понизится.
Для пациентов с доказанным первичным гиперальдостеронизмом следующим шагом является выяснение, каким заболеванием он вызван, — односторонним или двусторонним. Это очень важно, так как лечение каждого из них отличается. Компьютерная или магнитно-резонансная томография позволяют увидеть, есть ли опухоль в надпочечнике. Если пациент младше 40 лет и у него есть опухоль только в одном надпочечнике, то в этом случае можно приступать к лечению. Если пациент старше 40 лет и/или у него либо нет опухоли, либо есть опухоль, но в обоих надпочечниках, то возникает необходимость в проведении специального теста — селективного забора венозной крови из центральной вены надпочечников. В ходе этого теста хирург или рентгенолог берёт кровь непосредственно из вен обоих надпочечников, чтобы определить, какой именно орган вырабатывает патологическое количество гормона.
Лечение синдрома Конна
Лечение синдрома Конна зависит от его основной причины.
У пациентов с односторонней аденомой надпочечника единственным способом лечения является адреналэктомия — удаление опухоли вместе с надпочечником. Эта операция обычно выполняется ретроперитонеоскопически, т. е. через несколько очень маленьких разрезов со стороны спины. После односторонней адреналэктомии почти у 100 % пациентов снижается артериальное давление и нормализуется уровень калия в крови. При этом более чем у 50 % пациентов артериальная гипертензия полностью излечивается (без приёма лекарственных препаратов). Причинами стойкого повышения артериального давления после адреналэктомии может быть сопутствующая гипертоническая болезнь неизвестной причины и пожилой возраст пациентов.
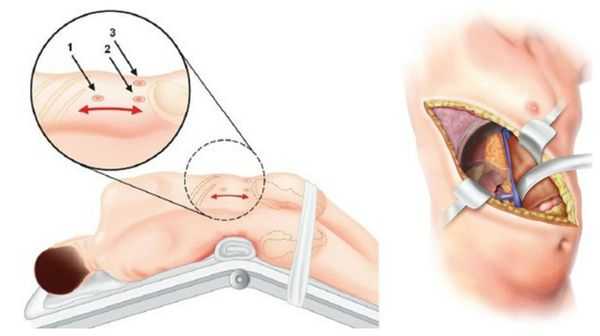
В крайних случаях проводится открытая адреналэктомия. Во время такой операции выполняется широкий разрез через грудную, брюшною полость и диафрагму. По сравнению с таким вмешательством, эндоскопическая адреналэктомия снижает сроки пребывания в стационаре и сочетается с меньшим количеством осложнений. Уже через неделю при эндоскопической операции пациент может вернуться к работе и обычным физическим нагрузкам.
Медикаментозное лечение рекомендуется пациентам с крайне высоким уровнем риска оперативного лечения (например при тяжёлой сердечной недостаточности). Поскольку односторонняя эндоскопическая адреналэктомия может полностью избавить пациента от медикаментозного лечения, её необходимо выполнять во всех остальных случаях. При этом важно, чтобы такое лечение выполнял хирург-эндокринолог, имеющий большой опыт проведения эндоскопических адреналэктомий.
Перед операцией артериальное давление и уровень калия в крови необходимо привести в норму. Если достичь этого в короткие сроки не удаётся, то операцию следует отложить.
После операции следует измерять уровень активности альдостерона и ренина в плазме крови, чтобы сделать предварительные выводы об эффективности оперативного лечения. Также в послеоперационном периоде нужно отменить приём добавок калия, прекратить приём спиронолактона и, при необходимости, уменьшить антигипертензивную терапию. Обычно артериальное давление улучшается или нормализуется через 1-6 месяцев после односторонней адреналэктомии, но у некоторых пациентов оно может оставаться повышенным до 1 года.
Для пациента с двусторонней гиперплазией лучшим способом лечением является консервативное — приём препарата под названием спиронолактон, который блокирует действие альдостерона. Кроме того, пациент должен придерживаться диеты с низким содержанием соли [10] .
Прогноз. Профилактика
Заболеваемость и смертность при синдроме Конна в первую очередь связаны с гипокалиемией и артериальной гипертензией. В случае своевременной диагностики болезнь излечивается полностью.
Причиной смерти могут стать сердечно-сосудистые осложнения. Установлено, что факторами риска развития этих осложнений при первичном гиперальдостеронизме являются гипокалиемия, односторонний первичный гиперальдостеронизм и высокий уровень альдостерона в плазме (не менее 125 пг/мл) [13] . Так, гипокалиемия, особенно тяжёлая, вызывает нарушения сердечного ритма, которые могут привести к летальному исходу.
Другими осложнениями гиперальдостеронизма являются инфаркт миокарда, цереброваскулярные болезни и сердечная недостаточность. Также у пациентов с синдромом Конна с большей вероятностью, чем у пациентов с гипертонией, развиваются острые коронарные синдромы, гипертрофия левого желудочка и инсульт [12] .
Существуют доказательства того, что хронический гиперальдостеронизм при отсутствии повышенного кровяного давления (как это происходит при вторичном гиперальдостеронизме) также связан с повышенным риском сердечных осложнений, включая ишемические, гипертрофические и фиброзные повреждения [11] .
Профилактика синдрома Конна предполагает своевременное лечение болезней, которые могут его вызвать. Пациентам с длительно существующей или трудно контролируемой артериальной гипертензией рекомендуется проходить скрининг на гиперальдостеронизм. В зоне риска находятся молодые люди до 40 лет и те, чьи родители страдают гипертонией.
Болезнь Кенига: чем страшна и как ее вовремя выявить?
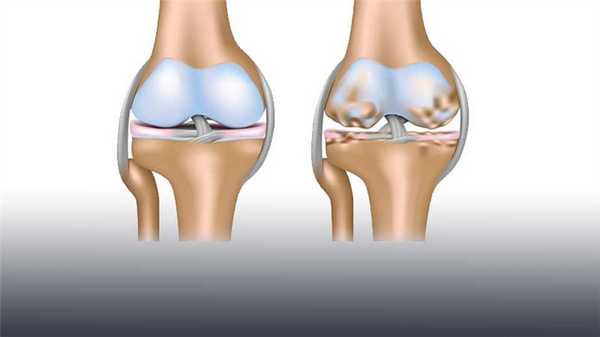
Омертвение хрящевой ткани внутри коленного сустава - сложная патология, приводящая к весьма серьезным последствиям. Развитие некроза полости костных сочленений называется болезнью Кенига и требует безотлагательного лечения.
Этиология рассматриваемого недуга предполагает постепенное разрушение и отслоение хрящевой ткани от кости сустава, что создает трудности свободного движения, вызывая воспаление, ограничение подвижности и сильные болевые ощущения. Все это сильно снижает качество жизни человека и требует квалифицированной медицинской помощи.
Краткое определение
Прежде чем понять каковы предпосылки и симптомы рассматриваемой патологии, следует прежде всего понять, хотя бы в общих чертах, что собой представляет это заболевание.
Болезнь Кёнига - это ничто иное рассекающий остеохондрит колена. Заболевание имеет достаточно обширную клиническую картину и относится к категории патологий очагового, идиопатического типа.
По мере прогрессирования патологического состояния, у пациента поражаются субхондральные костные ткани, что приводит не просто к потере стабильности хряща, а еще и к его постепенному разрушению, влекущему за собой некроз и патологическое изменение кости.
Невозможность своевременной диагностики, отсутствие лечение и пренебрежение профилактикой и терапией может спровоцировать преждевременное развитие остеоартрита различной стадии.
Болезни Кенига подвержен любой человек на планете, вне зависимости от возраста и пола. В подавляющем большинстве диагностированных случаев, патология развивается в молодом, подростковом возрасте. Несмотря на обширную группу риска, стоит отметить, что статистика показывает, что диагностирование приходится на 21 случай из 100 000.
Различия рассекающего остеохондрита и болезни Кёнига
Несмотря на то, что рассматриваемое заболевание может иметь два популярных и при этом повсеместно используемых названия, между этими понятиями есть существенная разница.
Безусловно, оба дегенеративно-дистрофических процесса относятся к нарушениям целостности опорно-двигательного аппарата, вот только важным является одно отличие: остеохондрит может быть локализован в сочленениях различного типа, а вот болезнь Кенига - исключительно в коленном.
Патогенез
Несмотря на то, что диагностированные случаи встречаются в современной медицинской практике, патогенез рассекающего остеохондрита остается изученным не до конца.
На сегодняшний день существует большое количество предположений, каждое из которых дает возможность для формирования более-менее полноценной картины. Так, выделяют несколько теорий. Попробуем рассмотреть несколько из них.
Воспалительные процессы
Большое количество специалистов всего мира склоняются к тому, что патогенез рассматриваемого заболевания кроется именно в воспалительных процессах, что подтверждается несколькими гистологическими образцами. Так, одним из авторов было описано 24 подобных случая, в то время, как другой отметил 42 случая за 12 месяцев.
Стоит отметить, что было проведено достаточно большое количество гистологических анализов, которые при наличии симптоматики вовсе не показали наличие изменений воспалительного характера.
Теория о происхождении патологии из воспаления не имеет научно-литературного подкрепления.
Травматизм
Двумя другими американскими учеными было отмечено 14 случаев патологии при которой имело место предположение о том, что прогрессирование ухудшения состояния тканей может быть вызвано травмами (как острыми, так и хроническими).
Рассматривая эту теорию, можно проследить достаточно очевидную связь: патологические процессы зарождаются в наиболее уязвимом месте сустава, повреждения которого крайне сложно диагностировать. С течением времени костные ткани разрушаются, что вызывает некроз и отделение костно-хрящевого фрагмента.
Систематические микротравмы
Говоря о травмах не следует игнорировать такую ситуацию, как микротравмирование. Несмотря на кажущуюся незначительность, повторяющиеся повреждения целостности тканей (например, незначительные удары конечностью), вполне могут повлечь за собой весьма серьезные последствия.
Наследственная предрасположенность
Огромное количество научных трудов посвящено вопросу изучения генетических факторов.
Несмотря на большое количество проведенных исследований, а также бесконечно актуальные рассуждения медицинских работников всего мира, о влиянии генетического фактора, точного подтверждения о существовании связи между формированием остеохондрита рассекающего типа и наследственностью - нет.
Ишемия (снижение сосудистого питания)
Как известно, недостаток кровообращения может привести к крайне негативным, порой даже, необратимым последствиям. Так, в связи с результатами многочисленных исследований, изучением диагностированных случаев и учета ряда прочих факторов, было замечено значительно сокращение количества сосудов.
Рассматривая этот вопрос теоретически, можно прийти к выводу, что нарушение кровообращения может быть вызвано различными факторами, например, травмой различного типа или аномалиями сердечно-сосудистой системы.
Что относят к наиболее вероятным причинам болезни Кенига?
Патологическое поражение костно-хрящевых тканей рассматриваемого типа наиболее часто локализуется в колене. Несмотря на системность патологии и относительно тщательное изучение вопросов ее развития, с точностью определить однозначные причины ее возникновения - практически невозможно. В связи с этим, принято считать, что болезнь Кенига - это заболевание криптогенного характера (с неизвестным происхождением).
К числу наиболее вероятных причин принято относить:
систематический травматизм различных сегментов опорно-двигательного аппарата;
наличие сопутствующих дегенеративно-дистрофических заболеваний различного типа;
заболевания сердечно-сосудистой системы;
врожденные аномалии скелета, а именно - костно-хрящевой ткани;
повышенные нагрузки, специфика трудовой деятельности.
Общая симптоматическая картина
Любой неприятный симптом, который человек может заметить у себя - должен быть сигналом обращения за профессиональной медицинской помощью. В особенности, если речь идет об опорно-двигательном аппарате.
Симптоматика недуга достаточно обширна, что обусловлено невозможностью установления истиной причины ее появления. Так, к числу общих симптомов заболевания принято относить:
появление дискомфорта в области колена;
боли различной интенсивности, преимущественно ноющего характера в колене;
усиление неприятных ощущений, дискомфорта во время движения;
приступы болевого синдрома без веских причин;
локальная отечность, покраснение тканей;
затруднения в выполнении привычных движений, сокращение амплитуды подвижности нижней конечности, появление хруста;
суставные воспаления различной этиологии;
визуально заметные и ощутимые для человека изменения походки, появление хромоты;
Стадии болезни Кенига
Течение рассекающего остеохондрита имеет преимущественно постепенный, размеренный характер. Изучив особенности развития заболевания, а также познакомившись с его симптоматической картиной, можно выделить 4 стадии поражения:
I стадия - человек начинает испытывать незначительный дискомфорт и легкие болевые ощущения, локализующиеся в месте поражения (в основном, в коленных суставах). На этом этапе хрящевая ткань еще не деформирована, однако, процесс поражения костного мозга уже запущен.
II стадия - образуется все больше участков с некрозом (отмершими тканями), что вызывает усиление симптоматической картины. Прогресс заболевания становится отчетливо заметен при рентгенологическом исследовании. Со временем, у пациента формируется синовит (воспаление синовиальной оболочки) и начинается разрушение гиалинового хряща.
III стадия - отмерший участок ткани отделяется от поверхности кости, что провоцирует усиление симптоматической картины и вызывает ограничение подвижности пациента, обусловленное сильной болью.
IV стадия - пораженные ткани обосабливаются и формируют тело прямо в синовиальной сумке, что вызывает серьезный воспалительный процесс и значительно снижает качество жизни больного.
Разновидности болезни Кенига
На сегодняшний день не существует как-таковой классификации рассекающего остеохондрита. Однако, при этом, принято условно подразделять диагностированную патологию на несколько видов, в зависимости от:
место локализации патологии (колено);
В зависимости от интенсивности проявляемой симптоматики, собранного анамнеза, а также прочих особенностей, определяется индивидуальный план лечения, который начинается прежде всего с точной диагностики.
Комплекс диагностических мероприятий
В целях постановки максимально точного диагноза и выявления наиболее вероятной причины возникновения заболевания, применяется комплексный подход, предполагающий тщательное обследование пациента с применением таких методов обследования, как:
рентгенография - дает возможность сформировать актуальную информацию о состоянии, степени сохранности структуры тканей, а также определить точную локацию некротических процессов (преимущественно на III-IV стадии);
КТ (компьютерная томография) - создает оптимальные условия для оценки состояния и области поражения мягких тканей внутренней полости сочленения;
УЗИ (ультразвуковое исследование) или МРТ (магнитно-резонансная терапия) - наиболее эффективные методы, позволяющие выявить наличие проблемы еще на начальных этапах ее развития, предоставляя детальный анализ тканей;
артроскопия - малоинвазивное оперативное вмешательство диагностического характера, позволяющая с помощью микропрокола изучить состояние хряща;
лабораторное исследование - анализ крови пациента позволяет сформировать представление об уровне его здоровья, а также помогает выявить степени ревматоидного фактора.
Лечение болезни Кёнига
В связи с особенностями протекания клинической картины заболевания, лечение болезни Кенига преимущественно радикальное, что предполагает иссечение поврежденных тканей хирургическим путем. Однако, подход специалистов является комплексным, что предполагает сочетание радикальных и консервативных методик.
Разновидности хирургической операции
Несмотря на радикальность основного метода лечения, его применение является наилучшим решением, позволяющим избавить пациента от насущной проблемы.
Лечение болезни Кёнига хирургическим методом реализуется с применением артротомии - вскрытия суставной полости в целях устранения некротизированных фрагментов пораженных тканей. При этом, классическая методика имеет более щадящую вариацию - проведение оперативного вмешательства с применением эндоскопических методов с минимальным количеством повреждений (три небольших разреза/прокола).
Медикаментозная терапия
Назначение препаратов при лечении болезни Кёнига является одним из ключевых этапов и вторым по значимости, ведь именно от приема лекарственных препаратов во многом зависит успешность оперативного вмешательства и сроки реабилитации пациента.
Медикаментозная терапия предполагает применение таких препаратов, как:
анальгетики и спазмолитики;
нестероидные противовоспалительные средства (НПВС);
В связи с тем, что по мере прогрессирования патологии отмирает часть хрящевой ткани, особое внимание уделяется такой группе препаратов, как хондропротекторы. Благодаря курсу приема хондропротекторов, ускоряется регенеративный, что обеспечивает положительную динамику процесса заживления и стимулирует улучшение качества жизни пациента.
Одним из наиболее востребованных и эффективных препаратов группы «хондропротекторы» принято считать «Артракам».
Современные методы физиотерапии применяются преимущественно на начальных стадиях патологии, при необходимости активизации обменных процессов путем улучшения кровообращения пораженного сустава, а также в период реабилитации.
Среди широкого применяемых физиотерапевтических методик при лечении болезни Кенинга, стоит обратить внимание на такие, как электрофорез, ударно-волновая терапия, а также магнитная терапия и пр.
Физиотерапевтическое лечение допускается исключительно после качественной консультации лечащего врача, который берет во внимание не только общее состояние пациента, но также и динамики развития недуга, особенности его течения и другие факторы.
Чем грозит отсутствие лечения?
Вне зависимости от того, почему пациент не начал своевременное лечение патологически опасного суставного заболевания, его неизбежный прогресс и активное развитие рано или поздно приведут к необратимым последствиям.
Думаете, что легкий дискомфорт в коленном суставе «пройдет как-нибудь сам» или «просто стечение обстоятельств»? Как бы не так. Запущенные стадии приводя к тому, что некротизированный (отмерший) фрагмент отделяется в полость сустава, что приводит к ограничению его подвижности и интенсивному развитию воспалительной симптоматики. Блокада, вызванная локализацией подобного рода фрагментов, провоцирует появление деформирующего артроза.
Как защититься от болезни Кенига?
От развития патологий опорно-двигательного аппарата, в частности, заболеваний по типу болезни Кенига, не застрахован ни один человек на планете. В связи с этим, при желании обезопасить себя и снизить риски появления суставных патологий, нужно начинать действовать как можно раньше.
К большому сожалению, особых, специальных профилактических мер от болезней коленей - нет. Однако, большое количество исследований и имеющиеся знания об этиологии патологических процессов, позволяют сформировать общее представление о профилактике недугов опорно-двигательного аппарата.
Минимизировать вероятность развития патологии колена можно, если соблюдать следующие рекомендации:
Вне зависимости от возраста, увлечений, места проживания и прочих особенностей - вести максимально здоровый образ жизни (правильно питаться, больше двигаться и пр.).
Отказаться от пагубных привычек в пользу формирования новых, например, выполнения ежедневной утренней зарядки.
Следить за рациональностью нагрузки на нижние конечности и дозировать нагрузку на колени.
Не забывать о важности сохранности работы сердечно-сосудистой системы и систематически проводить профилактические осмотры.
При первых симптомах болезни Кенига коленного сустава - обращаться за квалифицированной медицинской помощью.
Даже самый слабый дискомфорт в коленном суставе - повод прислушаться к собственному самочувствию и обратиться к врачу за консультацией.
Помните, что практически любое известное медицине заболевание лучше всего поддается лечению именно на начальных этапах.
Узники собственного тела: синдром «взаперти»

Почти в любом сериале, посвященном работе врачей, есть эпизоды, связанные с лечением больного с синдромом «запертого человека» (Locked-in-syndrome). Что это за заболевание, и почему оно привлекает столько внимания, больше, чем другие редкие болезни? MedAboutMe предлагает разбираться вместе.
Заперты в собственном теле: псевдокома
В отличие от истинной комы, «запертый» человек находится в полном сознании. Но во многих случаях не может никак сообщить об этом окружающим, так как утрачивает способность управлять собственным телом. Врачи выделяют три степени синдрома запертого человека (СЗЧ):
- Полный СЗЧ. В этом состоянии нарушены все двигательные волокна, идущие от головного мозга, а также расположенные в стволе головного мозга центры дыхания, глотания, речи и мимики. Помимо тетраплегии (паралича всех четырех конечностей), у больного отсутствует возможность двигать всеми остальными мышцами тела, включая даже мышцы, обеспечивающие моргание и движение глаз.
- Классический СЗЧ. Все, что описано выше, за исключением вертикального движения глаз и моргания. Это дает возможность для общения с помощью специального кода, простейшим является код «Да-Нет», в котором утвердительному ответу соответствует одинарное моргание, отрицательному — двойное.
- Неполный СЗЧ. Помимо движения глаз, могут сохраняться или быстро восстанавливаться некоторые другие движения. Обычно это движения головы или всех или некоторых пальцев на руках и ногах, или движения мимических мышц.
Во всех случаях электроэнцефалограмма показывает нормальную активность мозга, но гораздо более показательным методом диагностики является позитронно-эмиссионная томография (ПЭТ). Болевая чувствительность может полностью отсутствовать или частично сохраняться.
По имеющейся статистике, чаще всего СЗЧ диагностируется у людей 40-50 лет, половая принадлежность не играет роли. Чем моложе больной, тем больше у него шансов на восстановление, особенно при адекватной терапии.
У врачей нет достаточно полной информации относительно редкости синдрома «запертого человека», так как, по всей видимости, многие случаи остаются недиагностированными. До 2009 года в медицинской литературе было описано всего 33 случая болезни. А это означает, что «запертые» в своем теле пациенты не получали того лечения, которое помогло бы им восстановиться хотя бы частично. А это возможно благодаря современным возможностям медицины. Еще недавно 80% пациентов с синдромом «взаперти» умирали в течение первых 6 месяцев после начала заболевания. Сегодня пятилетняя выживаемость — более 60%. Причем сами больные отмечают удовлетворительное качество своей жизни, несмотря на все имеющиеся ограничения возможностей.
Причины развития синдрома
Чаще всего СЗЧ развивается вследствие инсульта с локализацией очага поражения в мосте головного мозга.
Мост представляет собой подковообразное скопление нервных волокон, соединяющее продолговатый мозг и мозжечок, среди функций которого координация движений и управление двигательными функциями тела.
Другими причинами могут стать инфекционные заболевания мозга, синдром Гийена-Барре, боковой амиотрофический склероз (БАС), рак мозга с расположением опухоли в области задней черепной ямки, а также серьезные черепно-мозговые травмы.
Клинический случай: Рикке Кьергаард
В 2013 году, во время рождественских праздников, живущая в Великобритании Рикке Кьергаард внезапно почувствовала себя плохо. Всего за четверть часа ее температура поднялась до 42°С, женщина начала бредить. На следующий день она уже не могла даже сесть без помощи окружающих, и вскоре впала в кому. В отделении больницы скорой помощи у Рикке была обнаружена полиорганная недостаточность, тромбоз множества сосудов, токсический шок, поставлен диагноз бактериальный менингит. Сердце женщины останавливалось на 40 секунд, но реанимационные мероприятия оказались успешными, и сердцебиение возобновилось, но сознание не вернулось. На тот момент врачи оценивали шанс Рикке выжить как очень низкий — не выше 5%.
Женщина пробыла в состоянии комы 10 дней.
Но потом сознание начало к ней возвращаться. И она услышала, как врачи говорят ее мужу, что ему стоит начать готовиться к похоронам, так как шансов на то, что мозг его жены не умер, близки к нулю.
Рикке повезло: ее семья верила в нее. В какой-то момент муж Питер обратил внимание на то, что на вопросы жена отвечает морганием. Это стало сигналом, что функции мозга сохранились, что Рикке не только слышит, но и может общаться.
Процесс восстановления был долгим и трудным, ведь женщине пришлось не только заново учиться дышать, глотать, жевать, говорить, ходить, но и пережить ампутацию почти всех пальцев на руках из-за развившейся гангрены, и частичную потерю зрения: один глаз перестал видеть. Через 4 месяца Рикке смогла произнести первое слово.
Восстановившись, насколько это было возможно, Рикке Кьергаард основала компанию, главная цель которой — помогать людям с тяжелыми хроническими заболеваниями. А еще она написала книгу о своем удивительном опыте узника собственного тела.
Не всем «узникам» везет так же, как Рикке. Медицинский персонал или родственники (если они есть) могут не заметить проявлений сознания, особенно в случае полного СЗЧ, когда больной не может даже морганием дать понять, что слышит и осознает окружающее. Еще сложнее диагностировать СЗЧ, если у больного есть нарушения слуха и зрения.
Бельгийские исследователи сообщают в статье, опубликованной в 2005 году о том, что иногда диагностика синдрома требовала от 4 до 6 лет — пока окружающие улавливали признаки того, что больной находится в сознании. В той же статье указывается, что как только пациент после диагностики СЗЧ начинает получать адекватную медицинскую помощь, ожидаемая продолжительность жизни увеличивается до нескольких десятилетий, хотя шансы на восстановление двигательных функций могут оставаться низкими.
Лечение синдрома «взаперти»

Специфического лечения не существует, как и лекарств. В каждом случае терапия подбирается индивидуально, и направлена на устранение причин, вызвавших паралич. Однако замечено, что если в остром периоде заболевания начата интенсивная, или даже агрессивная терапия, шансов на восстановление больше. Известны случаи даже полного восстановления, но они очень редки. В большинстве случаев можно рассчитывать только на частичную реабилитацию.
На начальном этапе важнее всего поддерживающая терапия и обучение самого больного и окружающих навыкам общения с использованием имеющихся возможностей.
Проблемы могут возникать на разных уровнях, начиная с дыхания и питания. Из-за нарушения дыхательных функций пациенты с СЗЧ часто находятся на аппарате искусственного дыхания, воздух поступает в легкие через трахеостому — специальную трубку, вводимую в дыхательные пути через отверстие в трахее. Питание через рот в этом случае представляет опасность, поэтому больного кормят через зонд. Переход к обычному питанию возможен только после восстановления дыхательной и глотательной функций, и только жидкой или пюреобразной пищей.
Из-за неподвижности больного высок риск развития пневмонии, тромбоза, инфекций мочевыводящих путей, образования пролежней и контрактур конечностей. Пациент нуждается в частой смене положения тела, в массаже, физиотерапевтическом лечении.
С помощью логопедов устанавливается система общения. Благодаря современным технологиям у больных с СЗЧ появилась возможность использовать для общения компьютер. Для этого используются специальные датчики, реагирующие на движения глаз, а также синтезаторы речи. Если сохранились или восстановились двигательные функции каких-либо мышц, то возможности еще более расширяются: такие больные могут использовать коляски с электроприводом, с управлением, приспособленным к имеющимся возможностям.
Прогноз излечения
Несмотря на то, что многие люди, столкнувшиеся с синдромом «взаперти», не выживают из-за несовершенной диагностики или развившихся осложнений, у остальных есть довольно много шансов не только выжить, но и прожить несколько десятков лет.
Вот что говорят проведенные исследования.
Анализ информации, полученной от самих больных и их родственников, показывает, что окружающие часто оценивают качество жизни больных существенно ниже, чем сами больные. То есть, несмотря на все ограничения, очень многие пациенты с СЗЧ оценивают качество своей жизни как удовлетворительное и даже хорошее. При этом оценка качества жизни прямо связана с уровнем оценки психосоциальной поддержки со стороны окружающих. Это дает основания для вывода о том, что тяжелая двигательная инвалидность не обязательно воспринимается человеком как невыносимая. Анкетирование больных СЗЧ показало, что подавляющее большинство ценят жизнь, хотят и намерены жить столько, сколько получится.
В интернете можно найти несколько книг, написанных людьми, пережившими «заключение» в собственном теле, или остающимися взаперти. Каждая из них — история успешной борьбы и победы, маячок для тех, кто ищет опору и мотивацию, знак, что не стоит сдаваться и «умирать раньше смерти».
Читайте также:
