Примеры связи гемангиобластомы сетчатки с синдромом Гиппеля-Линдау
Добавил пользователь Евгений Кузнецов Обновлено: 17.01.2026
ФГУ Эндокринологический научный центр, Москва
Эндокринологический научный центр, Москва
Болезнь фон Гиппеля-Линдау (VHL-синдром)
Болезнь фон Гиппеля-Линдау является наследственным опухолевым синдромом, предполагающим развитие различных доброкачественных и злокачественных новообразований (гемангиобластома центральной нервной системы и сетчатки глаза, опухоль внутреннего уха, карцинома и кисты почек, феохромоцитома, нейроэндокринная опухоль и кисты поджелудочной железы, цистаденома придатка яичка у мужчин и широкой связки у женщин). Болезнь фон Гиппеля-Линдау - наиболее распространенная причина наследственного рака почки.
В 1895 г. Ю. фон Гиппель [1] описал пациента с ретинальной ангиомой, а в 1926 г. А. Линдау [2] — пациента с ретинальной ангиомой и гемангиоматозом центральной нервной системы. Год спустя тот же автор обнаружил ассоциацию этих проявлений с почечными и панкреатическими кистами [3]. Термин «синдром von Hippel—Lindau» (VHL) был введен Мелмоном и Роузеном [4]. Этот синдром выявляется приблизительно у 1 из 36 000 человек [5] и обусловлен мутацией в участке 3p25/26, где локализован ген подавления роста опухоли VHL [6—8]. 23% пациентов не имеют семейного анамнеза заболевания [9—13].

Ген VHL был идентифицирован в 1993 г. [8, 14]. Приблизительно у 20% пациентов выявляется делеция VHL-локуса в материнской или отцовской аллели [15, 16]. Герминальные мутации VHL наследуются по аутосомно-доминантному типу. Почти все мутации VHL у пациентов с феохромоцитомой являются миссенс-мутациями. Ген VHL состоит из 3 экзонов. Белок VHL (pVHL) включает 213 аминокислотных остатков, и его молекулярная масса равна приблизительно 28 кДa. Клетки с дефицитом pVHL накапливают фактор, индуцирующий гипоксию (HIF), что приводит к перепроизводству HIF-зависимых продуктов (которые вовлечены в адаптацию к гипоксии): сосудистого эндотелиального фактора роста (VEGF), эритропоэтина и трансформирующего ростового фактора альфа (TGF). Это объясняет сильную васкуляризацию VHL-ассоциированных опухолей [17—19]. Таким образом, продукт мутированного гена VHL приводит к сверхрегулированию различных генов, участвующих в патогенезе гипоксии, ускоряет ангиогенез, изменяет внеклеточный матрикс и регуляцию клеточного цикла [20—28]. Однако точные механизмы туморогенеза при синдроме VHL в настоящее время остаются неизвестными (рис. 1). Рисунок 1. Комплекс VBC (VHL protein and Elongin B, C) и механизм его действия. а — Normoxic condition — нормальное давление кислорода; Ub — убиквитин; HIF — фактор, индуцирующий гипоксию; pVHL — VHL-протеин; α — элонгин C-связывающий домен pVHL; β — β-домен (субстратсвязывающий домен) pVHL; CUL2 — куллин-2, формирующий комплекс с элонгином-B, C и pVHL; б — мутация гена VHL и, как результат, отсутствие регуляции HIF, VEGF, PDGF и TGF-α; в — мутация гена VHL и отсутствие регуляции aPKC λ (атипичная протеинкиназа C) [29].
VHL-синдром характеризуется развитием гемангиобластом сетчатки глаза (ангиомы сетчатки) и центральной нервной системы (ЦНС), билатеральной и мультифокальной дифференцированной карциномы почки, поликистоза почек, феохромоцитомы, кист и нейроэндокринных опухолей поджелудочной железы, папиллярной цистаденомы придатка яичка у мужчин и широкой связки у женщин, опухолей внутреннего уха. Поражение различных органов и степень этого поражения очень вариабельны (табл. 1, 2).

Клинически заболевание делится на две группы. Тип 1 включает главным образом большие делеции или мутации гена VHL и характеризуется полным фенотипом заболевания [поражение сетчатки, кисты или опухоли головного и спинного мозга, панкреатические, почечные, и селезеночные кисты, солидные панкреатические опухоли (реже аденокарциномы), карциномы почек, цистаденомы эпидидимуса и опухоль внутреннего уха], но без феохромоцитомы. Тип 2, при котором развивается феохромоцитома (миссенс-мутации гена VHL может иметь и неполный фенотип [13, 37, 40]. Тип 2 подразделяется на подтипы с низким (тип 2A) и высоким (тип 2B) риском развития рака почки, а также тип 2C, проявляющийся только феохромоцитомой [35, 38, 41—43] (табл. 3).

Гемангиобластомы ЦНС могут выявляться в детском возрасте, однако средний возраст диагностирования составляет 29 лет [32, 45, 46]. VHL-ассоциированные гемангиобластомы выявляются в среднем на 15 лет раньше, чем спорадические [47]. В зависимости от размера и местоположения опухоли клинические признаки гемангиобластомы ЦНС включают головную боль, тошноту, головокружение, атаксию, расстройство координации движений, нистагм, расстройства речи. Гемангиобластома спинного мозга может приводить к слабости конечностей и парестезиям. Диагноз устанавливается с помощью МРТ головного мозга и позвоночника. Гемангиобластомы обычно характеризуются медленным ростом и имеют высокий риск кровотечений, часто являются мультифокальными. Понимание патогенеза заболевания важно для выбора оптимального времени скрининга на опухоли и лечение [19]. Исследование тканей ЦНС умерших пациентов помогло пониманию гистогенеза гемангиобластом [49]. Активация фактора, индуцирующего гипоксию 2-альфа (HIF 2-α) происходит в маленьких мезенхимальных опухолях и в мезенхимальном компоненте больших опухолей. Активация HIF 1-α наблюдается в эпителиальном компоненте. Это позволило предполагать, что поражение ЦНС при VHL-синдроме — длительный процесс гемангиобластической пролиферации и дифференцировки [50] (рис. 2). Рисунок 2. Гемангиобластома ЦНС.
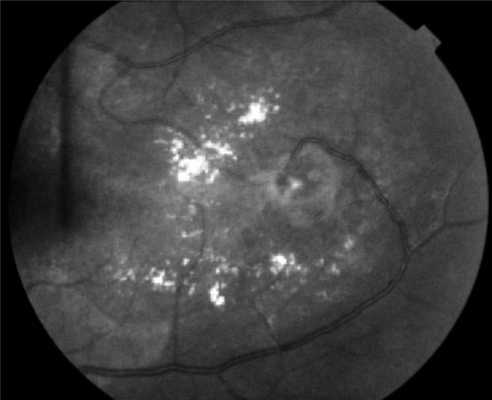
Поражения глаз выявляются примерно у 37% пациентов с VHL-синдромом, среди них только у 14% обнаруживается полная делеция VHL [51, 52]. Приблизительно у 8% пациентов снижена острота зрения [53]. Для лечения ангиомы сетчатки используют лазерную или криотерапию [32, 34, 54]. Недавние исследования [ 55, 56] показали, что при внутривенном введении антагониста сосудистого эндотелиального фактора роста (anti-VEGF) в течение 7 мес размер гемангиобластом не уменьшается (рис. 3). Рисунок 3. Ангиоматоз сетчатки.
У пациентов с синдромом VHL могут встречаться как кисты, так и рак почек [57—62]. Средний возраст манифестации — 37 лет. Для диагностики используют КТ и УЗИ [36, 63, 64]. Поскольку со`лидные раки могут содержать кистозные части (что затрудняет дифференцирование доброкачественных и злокачественных процессов с помощью визуализирующих методик), при отсутствии данных о метастазах лечение должно быть направлено на удаление этих образований по возможности с соблюдением принципа органосохраняющей операции. Это позволяет поддерживать почечную функцию максимально долго и избежать диализа [58, 65]. Опухоли почек отличаются медленным ростом (3 см (по стандартам США) или 5 см (по стандартам Европы) [58, 60, 67, 68]. Некоторые авторы [69] сообщают о высоком риске местного рецидива (приблизительно 50%) в среднем в течение 53 мес (диапазон 10—115 мес) и росте опухоли со скоростью 34 мм/год (диапазон 1—10,8 мм). «Золотым» стандартом лечения небольших опухолей является открытая и лапароскопическая частичная нефрэктомия. В настоящее время используются также альтернативные методы — криотерапия и радиочастотная аблация [70]. Последние методы могут повлиять на результат патоморфологического диагноза, хотя, по некоторым данным, патоморфологический диагноз после первого цикла криотерапии приблизительно в 91% случаев подтверждает результаты предварительной биопсии [71].
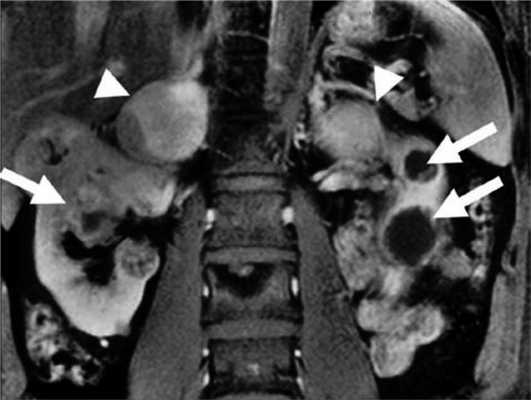
Феохромоцитома выявляется примерно у 26% пациентов с синдромом VHL [37]. У пациентов с очевидно спорадической феохромоцитомой в 3—11% случаев впоследствии выявляют мутацию VHL [10, 12, 13]. Феохромоцитома может быть первым проявлением синдрома [30, 72]. В большинстве случаев надпочечниковые феохромоцитомы при VHL-синдроме двусторонние (синхронные или метахронные) [37, 73]. Вненадпочечниковые феохромоцитомы встречаются примерно в 30% случаев [37, 74—76]. Феохромоцитомы как часть синдрома VHL имеют исключительно норадреналиновый фенотип. Биохимические маркеры опухоли могут помочь отличить VHL-ассоциированные феохромоцитомы от феохромоцитом при синдроме МЭН 2-го типа [75]. Различия в биохимическом фенотипе при VHL-синдроме и МЭН 2-го типа связаны с различной экспрессией тирозингидроксилазы (TH) — лимитирующего фермента синтеза катехоламинов, и фенилэтаноламин-N-метилтрансферазы (PNMT). У пациентов с синдромом VHL отмечена низкая экспрессия PNMT, преобразующей норадреналин в адреналин. Различия биохимического фенотипа также связаны с различиями хранения, транспорта и секреции катехоламинов [77]. МЭН 2-ассоциированные феохромоцитомы содержат более высокие концентрации катехоламинов из-за более выраженной экспрессии TH. VHL-ассоциированные феохромоцитомы, секретируют катехоламины непрерывно, тогда как при синдроме МЭН 2 отмечен эпизодический характер секреции. Это определяет и различия клинических проявлений двух синдромов. Например, пациенты с МЭН 2 чаще жалуются на кризовые подъемы АД [78]. Помимо генетических различий [26], регистрируется разная экспрессия эритропоэтина и его рецептора [79]. Кроме того, около 80% феохромоцитом бессимптомны и выявляются случайно при визуализирующих исследованиях. Низкая чувствительность некоторых радионуклидных методов визуализации может объясняться относительной нехваткой гранул хранения или уменьшенной экспрессией мембранного норадреналина или везикулярных моноаминных транспортеров [80]. Поэтому сцинтиграфия с 123 I-MIBG (метайодбензилгуанидином) часто не обнаруживает VHL-связанные надпочечниковые феохромоцитомы [81, 82]. ПЭТ с 6-18F-фтордопамином более чувствительный метод [36, 83]. Злокачественные феохромоцитомы с метастазами в легких, печени, костях, лимфоузлах редко встречаются при синдроме VHL [37, 74, 84—87]. Метастазы выявляются менее чем в 7% случаев [37]. К сожалению, в настоящее время нет четких признаков, позволяющих надежно отличить доброкачественную от злокачественной феохромоцитомы, хотя уже известно, что герминальная мутация гена SDHB, является в этом отношении точным маркером [86—88]. Выявление феохромоцитомы у пациентов с синдромом VHL особенно важно, учитывая высокую вероятность хирургических вмешательств по поводу других опухолей (гемангиобластом ЦНС и др.). Невыявленная феохромоцитома при других вмешательствах может привести к опасным для жизни гипертоническим кризам. Более 70% феохромоцитом у детей являются VHL-ассоциированными. Каждому пациенту с VHL-синдромом и подтвержденной феохромоцитомой до оперативного лечения необходимо проводить ПЭТ с 6-18F-фтордопамином или сцинтиграфию с 123 I-MIBG для выявления вненадпочечниковой феохромоцитомы или метастазов [89]. Лечение феохромоцитомы оперативное. В то же время 6-месячная терапия ингибиторами тирозинкиназы приводит к уменьшению опухоли на 21% и сокращению уровня норметанефринов и хромогранина А в плазме [90] (рис. 4). Рисунок 4. Двусторонняя феохромоцитома и поликистоз почек.
Цистаденомы эпидидимуса — доброкачественные опухоли, которые могут быть двусторонними [48]. Чаще они имеют около 2 см в диаметре, могут распространяться на семенной канатик, приводя к бесплодию. Хирургическое лечение обычно не проводят; необходимо наблюдение [92].
У 35—75% пациентов с синдромом VHL имеются доброкачественные кисты и микрокистозные аденомы поджелудочной железы [93—96]. По данным КТ, у 17% пациентов выявляются панкреатические нейроэндокринные опухоли [95, 97, 98]. Из 633 пациентов с VHL-синдромом у 108 (17%) обнаруживались панкреатические эндокринные опухоли, и у 9 (8%) были выявлены метастазы [99]. Метастазирование более вероятно, если размеры опухоли превышают 3 см. У 78% пациентов с метастазами (7 из 9) мутация локализовалась в экзоне 3 гена VHL, и удвоение массы опухоли в среднем происходило за 337 дней. Таким пациентам необходимо оперативное лечение. Если размеры опухоли меньше 3 см, она растет медленно, а мутация локализована не в экзоне 3, то можно ограничиться наблюдением за пациентом. Средний возраст диагностики нейроэндокринных опухолей поджелудочной железы — 35 лет. Панкреатические кисты встречаются у больных начиная с 15 лет и чаще являются бессимптомными. В зависимости от размера и местоположения клинические симптомы могут быть вызваны обструкцией желчных путей и/или ферментной недостаточностью. В таких случаях устанавливают желчный стент и/или назначают ферментные препараты.
Гормонально-активные нейроэндокринные опухоли встречаются редко [95, 100]. По данным последних исследований, смертность при панкреатических эндокринных опухолях составляет 6%. В 60% случаев при сцинтиграфии обнаруживают рецепторы соматостатина; злокачественные опухоли выявлялись в 58% случаев [101].
Опухоли внутреннего уха располагаются в лабиринте, под твердой мозговой оболочкой на задней поверхности пирамиды височной кости [102—104]. Эти опухоли практически не метастазируют [105]. Симптомы включают потерю слуха, звон в ушах, головокружение и/или парез лицевого нерва [106, 107]. Таким образом, пациентам с мутацией VHL абсолютно показаны аудиологический осмотр, а также КТ или МРТ внутреннего уха с высокой разрешающей способностью, так как раннее хирургическое вмешательство способно сохранить слух. У пациентов с двусторонними опухолями, приводящими к глухоте, слух может быть восстановлен кохлеарным имплантом [108].
У 90% носителей мутации VHL к 60-летнему возрасту имеются те или иные клинические проявления синдрома [45]. На долгосрочный прогноз и смертность обычно влияет наличие гемангиобластом сетчатки и ЦНС, а также карциномы почки на поздних стадиях [31—33]. Таким образом, своевременное обследование и выявление патологии, ассоциированной с VHL-синдромом, является залогом успешного лечения и увеличения продолжительности жизни пациента (табл. 4).
Болезнь Гиппеля-Линдау ( Цереброретинальный ангиоматоз )
Болезнь Гиппеля-Линдау — аутосомно-доминантная генная патология, обуславливающая развитие в организме целого ряда полиморфных опухолей. Наиболее часто это ангиомы сетчатки, гемангиобластомы ЦНС, феохромоцитомы, новообразования почек и поджелудочной железы. Иногда проявлением заболевания выступает единичный опухолевый процесс. Диагноз верифицируется после неврологического и офтальмологического обследований, проведения КТ или МРТ головного мозга и позвоночника, УЗИ или КТ почек, поджелудочной железы, надпочечников, генетической диагностики. Лечение состоит в раннем выявлении и удалении появляющихся опухолевых образований.
МКБ-10

Общие сведения
Болезнь встречается с частотой 1 случай на 36 тыс. чел. Отличается большим полиморфизмом и различной локализацией возникающих опухолей. Наиболее распространенным признаком является ретинальный ангиоматоз, который сопровождает до 75% случаев заболевания. Зачастую он выступает диагностическим маркером данной патологии. Гемангиобластомы мозжечка по различным данным наблюдаются в 35-70% случаев, новообразования и кисты почек — у 25% больных, поражение поджелудочной железы — у 24%, феохромоцитома — у 7%. По причине большой вариабельности новообразований пациенты, имеющие болезнь Гиппеля-Линдау, нуждаются в совместной курации специалистов в области офтальмологии, неврологии, онкологии, урологии, гастроэнтерологии, эндокринологии.
Причины болезни Гиппеля-Линдау
Болезнь Гиппеля-Линдау является генной патологией. Примерно в 80% случаев она наследуется аутосомно-доминантным способом с неполной пенетрантностью гена. Еще в 20% случаев болезнь Гиппеля-Линдау возникает вследствие новых мутаций. Аберрации затрагивают расположенный в 3-ей хромосоме участок р25-26, а именно ген VHL, который играет роль супрессора, подавляющего рост новообразований. На сегодняшний день известно около 140 мутаций данного гена.
В результате недостаточной онкосупрессии происходит рост новообразований, преимущественно ангиоретикулом и гемангиобластом. Опухоли поражают мозжечок и сетчатку глаза, реже отмечаются внутримозговые опухоли полушарий, новообразования подкорковых структур и продолговатого мозга, еще реже — опухоли спинного мозга и периферических нервов. Из-за неполной проявленности генетических аберраций у некоторых пациентов может наблюдаться лишь один клинический признак болезни.
В соответствии с классификацией, болезнь Гиппеля-Линдау имеет 2 типа: без феохромоцитомы и с ее наличием. Второй тип подразделяется на варианты: 2А — с низким риском развития аденокарциномы почки, 2В — с высоким риском карциномы, 2С — наблюдается только феохромоцитома. При всех вариантах заболевания, кроме 2С, возможно наличие гемангиобластом ЦНС и ангиом сетчатки.
Симптомы болезни Гиппеля-Линдау
Дебют неврологических проявлений обычно приходится на 3-4-е десятилетия жизни. В детском возрасте болезнь Гиппеля-Линдау отличается появлением неврологической симптоматики на фоне уже существующих зрительных расстройств. В ряде случаев заболевание у детей манифестирует субарахноидальным кровоизлиянием.
Поражение ЦНС. Наиболее часто источником первичных симптомов выступают церебеллярные кисты (кисты мозжечка). Они манифестируют общемозговыми симптомами (диффузными головными болями, тошнотой без связи с приемом пищи, рвотой, шумом в ушах), обусловленными повышением внутричерепного давления. К первым признакам также относятся эпиприступы, они могут быть генерализованными либо фокальными. Со временем проявляются признаки поражения мозжечка, формирующие симптомокомплекс мозжечковой атаксии: статическая и динамическая дискоординация, адиадохокинез, гиперметрия и асинергия, интенционный тремор, миодистония. По мере роста церебеллярного новообразования возникает смещение и сдавление мозгового ствола, сопровождающееся стволовыми симптомами, в первую очередь, расстройством глотания, диплопией, дизартрией. Спинальные опухоли (чаще ангиоретикуломы) проявляются корешковыми синдромами, выпадением глубоких видов чувствительности, отсутствием сухожильных рефлексов. В 80% случаев спинальной патологии отмечается клиника, сходная с сирингомиелией. Возможна картина полного поражения поперечника спинного мозга.
Поражение глаз на ранних стадиях диагностируются лишь при офтальмоскопии. После 8 лет появляются жалобы на туманность изображения и его искажение (метаморфопсии). У половины пациентов выявляется поражение обоих глаз. Увеличивающиеся со временем ангиомы сетчатки приводят к расстройству кровообращения в ее сосудах, ишемии и кистозной дегенерации. В поздней стадии возможны увеит, катаракта, отслойка сетчатки, глаукома, гемофтальм.
Поражение почек в 60-90% случаев представлено кистами, в 45% случаев — ренальноклеточной карциномой. Как правило, почечная карцинома клинически дебютирует в возрасте от 40 до 50 лет у больных, которые ранее уже лечились по поводу новообразований. В половине случаев на момент диагностирования карциномы выявляются ее метастазы. Сочетание поликистоза почек с ангиоматозом сетчатки более характерно, чем его комбинация с церебральными ангиомами. У 35% пациентов, имеющих болезнь Гиппеля-Линдау, поликистоз диагностируется посмертно. В детском возрасте при семейном типе заболевания поликистоз почек зачастую является его единственным проявлением.
Феохромоцитома почти в половине случаев имеет двусторонний характер. Может выступать единственным клиническим проявлением болезни. В сочетании с почечной карциномой наблюдается довольно редко.
Поражение поджелудочной железы от 30 до 72% составляют ее кисты. Кисты поджелудочной железы носят доброкачественный характер и редко приводят к клинически значимой ферментативной недостаточности панкреас. Хотя известны случаи полного замещения кистой нормальных тканей железы с развитием сахарного диабета.
Диагностика болезни Гиппеля-Линдау
Полная верификация диагноза осуществляется коллегиально неврологом, офтальмологом и генетиком при участии других врачей: онколога, эндокринолога, уролога, гастроэнтеролога.
На начальном этапе проводят полный неврологический и офтальмологический осмотр. С целью выявления церебеллярных образований назначают КТ или МРТ головного мозга. Для обнаружения опухолей другой локализации необходимо УЗИ или КТ почек, УЗИ поджелудочной железы или ее МРТ, МРТ позвоночника, КТ надпочечников. Проводится анализ уровня катехоламинов и ферментов поджелудочной железы. ДНК-диагностика направлена на выявление мутаций в VHL-гене.
Предполагать и исключать болезнь Гиппеля-Линдау следует в каждом случае выявления ангиоматоза сетчатки в ходе офтальмоскопии, особенно при наличии отягощенного семейного анамнеза. В начальной стадии офтальмоскопия может определять одиночную ангиому сетчатки с дилатацией питающих ее сосудов, впоследствии ангиомы становятся множественными, характерны аневризмы и змееобразная извитость сосудов. Диагностировать самые ранние изменения сосудов сетчатки и стертые формы позволяет флюоресцентная ангиография сетчатки. С ее помощью можно дифференцировать изменения сетчатки, сопровождающие болезнь Гиппеля-Линдау, от другой офтальмологической патологии: ретинопатий, ритинита, ретинобластомы, нейропатии зрительного нерва и пр. Уточнение диагноза возможно при помощи лазерной томографии сетчатки.
Лечение и прогноз болезни Гиппеля-Линдау
Сегодня болезнь Гиппеля-Линдау имеет лишь симптоматическое лечение. Оно направлено на ликвидацию возникающих опухолевых образований. Для как можно более раннего выявления опухолей рекомендовано наблюдение и ежегодное обследование пациентов.
Ранние стадии ангиоматоза сетчатки являются показанием к фокусной лучевой терапии, однако через год после ее проведения может возникнуть радиационная ретинопатия. В отношении ангиом небольшого размера возможна лазерная коагуляция, диатермокоагуляция, при больших образованиях — транссклеральная криопексия. Если болезнь Гиппеля-Линдау сопровождается новообразованиями ЦНС, необходима консультация нейрохирурга.
Возможно хирургическое удаление опухоли мозжечка, полушарий мозга, зрительного нерва. Описаны случаи применения стереотаксической хирургии. При диагностировании почечной карциномы производится частичная нефрэктомия, при выявлении феохромоцитомы — ее удаление. Хирургическое лечение доброкачественных новообразований поджелудочной железы показано при увеличении их размеров свыше 2-3 см.
Без проведения лечения заболевание приводит к слепоте вследствие прогрессирующего ангиоматоза сетчатки и к летальному исходу вследствие развития опухолей церебральной и соматической локализации. При наблюдении и лечении пациенты доживают в среднем до 40-50-летнего возраста. Половина летальных исходов обусловлена гемангиобластомами ЦНС. На ранних стадиях радикальное удаление этих опухолей удается у большинства больных, однако новообразования склонны рецидивировать в среднем через 6 лет после их удаления.
Примеры связи гемангиобластомы сетчатки с синдромом Гиппеля-Линдау
МЭН-2 — множественная эндокринная неоплазия 2-го типа
ПГПТ — первичный гиперпаратиреоз
ПЖ — поджелудочная железа
СМРЩЖ — семейная форма медуллярного рака щитовидной железы
ЦНС — центральная нервная система
ЩЖ — щитовидная железа
NF1 — нейрофиброматоз 1-го типа
Множественная эндокринная неоплазия 2-го типа (МЭН-2). Это синдром с аутосомно-доминантным типом наследования с предполагаемой распространенностью 1 на 30 000 населения. Заболевание вызвано герминальной мутацией протоонкогена RET в результате перестройки во время трансфекции, которая влечет за собой бесконтрольную клеточную пролиферацию. Более чем в половине случаев причиной синдрома служит вновь возникшая мутация в отцовском аллеле. Ранее этот синдром распознавался главным образом через семейную хронологию. В настоящее время с разработкой генетического тестирования, МЭН-2 все чаще диагностируются в педиатрической практике, предоставляя возможность изменить клиническую картину заболевания [1].
МЭН-2 состоит из типа, А (МЭН-2А, синдром Сиппла), семейной формы медуллярного рака щитовидной железы (СМРЩЖ) и типа В (МЭН-2 В, синдром Горлина; табл. 1). Синдромы различаются распространенностью, возрастом манифестации заболевания, генетическими аспектами, ассоциацией с другой патологией, агрессивностью опухолевого процесса и прогнозом [2].

Таблица 1. Варианты поражений при мутации протоонкогена RET Примечание. ПГПТ — первичный гиперпаратиреоз; ЖКТ — желудочно-кишечный тракт.
В структуре МЭН-2 60—80% приходится на тип A, 5—10% на тип B и 10—35% составляет СМРЩЖ, который клинически проявляется только МРЩЖ.
МЭН-2 имеет высокую пенетрантность (более 90%) относительно МРЩЖ — продуцирующей кальцитонин опухоли из C-клеток (парафолликулярных) щитовидной железы (ЩЖ). Уровень кальцитонина почти всегда повышен при МРЩЖ. Медуллярный рак составляет 2—8% от всех видов раков ЩЖ и клинически проявляется в возрасте от 5 до 25 лет, а при МЭН-2B на первом году жизни. Основная тяжесть клинических проявлений при МЭН-2 зависит от МРЩЖ. Агрессивность последнего уменьшается в следующем порядке: МЭН-2 В >МЭН-2А >СМРЩЖ. Наследственный МРЩЖ отличается двусторонним и мультифокальным поражением. МРЩЖ — самая частая причина смерти больных. МРЩЖ достаточно быстро и рано метастазирует, однако имеет тенденцию к медленному опухолевому росту. МРЩЖ резистентен к радио- и химиотерапии. Хирургическая профилактическая тиреоидэктомия занимает центральную роль в ведении этих пациентов. Генетический анализ дает возможность определить фенотип-генотипическую корреляцию и четко определить время профилактической тиреоидэктомии. Десятилетняя выживаемость пациентов после профилактической тотальной тиреоидэктомии приближаются к 100%. У пациентов без распространения опухоли за пределы ЩЖ выживаемость составляет 95 и 40% для пациентов с отдаленными метастазами. Фактически наследственный МРЩЖ — это практически единственное заболевание, при котором профилактическое удаление органа рекомендуется перед развитием злокачественного процесса на основании исключительно результатов генетического исследования. В послеоперационном периоде регулярно оценивают уровень кальцитонина и карциноэмбрионального антигена, проводят обследования с визуализирующими методами. При послеоперационной прогрессии опухоли и неоперабельных вариантах в последние годы применяют молекулярно-направленную (ингибиторы тирозинкиназы) и радиационно-направленную (с радионуклидами 90 Y и 177 Lu) терапию. До хирургического вмешательства по поводу МРЩЖ должно быть исключено наличие феохромоцитомы (ФХЦ) [3].
У пациентов с МЭН-2 скрининговое обследование для выявления ФХЦ (исследование метилированных катехоламинов) должно проводиться с 8—20 лет (в зависимости от мутации). При МЭН-2 риск развития унилатеральной или билатеральной ФХЦ составляет более 50%. Почти у всех пациентов с МЭН-2 ФХЦ локализована в надпочечниках, имеет метанефриновый тип секреции и казуистически редко является злокачественной. При правильном и своевременном лечении ФХЦ практически не является причиной смерти у этих больных. Хирургическое (лапароскопическое) лечение проводят только после предоперационной подготовки α-адреноблокаторами [4, 5].
При МЭН-2 у 15—30% носителей развивается ПГПТ. Обследование, начиная с 8—20 лет в зависимости от варианта мутации, включает определение общего и ионизированного кальция, паратиреоидного гормона в крови. Большинство наблюдений протекают бессимптомно, в некоторых случаях могут выявляться гиперкальциемия, гиперкальциурия, конкременты моче- и желчевыводящих систем. Показания к хирургическому лечению и диагностические критерии не отличаются от спорадических форм ПГПТ, а тактика хирургического лечения основывается на множественность поражения и высокую вероятность рецидива [2, 6].
Некоторые редкие варианты МЭН-2 ассоциируются с кожным лихеноидным амилоидозом и болезнью Гиршпрунга. Кожный амилоидоз может указывать на наличие мутации в 634-м кодоне. Клинически протекает как красный плоский лишай с зудом. Лечение симптоматическое. Болезнь Гиршпрунга определяют как врожденное отсутствие тонкокишечной иннервации, приводящее к непроходимости кишечника в раннем детстве. Болезнь Гиршпрунга при МЭН-2 имеет низкую пенетрантность, мутации выявляют в 10-м экзоне.
При МЭН-2B встречаются такие фенотипические проявления, как крупные губы и язык с наличием множественных невром, марфаноподобная внешность с деформациями скелета и суставов («полая» стопа и воронкообразная грудная клетка), ганглионевромы слизистой оболочки ЖКТ (ганглионейроматоз), пигментные пятна на лице [7].
Болезнь фон Гиппеля— Линдау (синдром VHL, болезнь VHL). VHL-синдром выявляется приблизительно у 1 из 36 тыс. человек и вызван мутацией в 3-й хромосоме (3p25/26), которая кодирует ген подавления роста опухоли VHL. Герминальные мутации VHL наследуются по аутосомно-доминантному типу. Синдром VHL характеризуется развитием гемангиобластомы сетчатки глаза (ангиома сетчатки) и центральной нервной системы (ЦНС), билатеральной и мультифокальной дифференцированной карциномы почки, поликистоза почек, ФХЦ, кист и нейроэндокринных опухолей поджелудочной железы (ПЖ), папиллярной цистаденомы придатка яичка у мужчин и широкой связки у женщин, опухоли эндолимфатического мешочка (табл. 2, 3, 4) [8, 9].

Таблица 2. Частота выявления различных поражений у пациентов с синдромом VHL
Таблица 3. Возраст манифестации опухолей

Таблица 4. Рекомендации по скрининговому обследованию пациентов с синдромом VHL Примечание. МРТ — магнитно-резонансная томография; УЗИ — ультразвуковое исследование; КТ — компьютерная томография.
Клиническая классификация делит заболевание на две группы, основанная на корреляциях фенотипа и генотипа: тип 1 включает главным образом большие делеции или мутации и выражается полным фенотипическим проявлением за исключением ФХЦ. Тип 2 вследствие миссенс-мутаций включает и ФХЦ и полный фенотип. Тип 2 подразделен на низкий (тип 2A — с раком почки) и высокий (тип 2B — без рака почки) риск развития ФХЦ. Тип 2C представлен только ФХЦ [10] (см. табл. 5).
Таблица 5. Клиническая классификация синдрома VHL Примечание. ГБ С — гемангиобластома сетчатки; ГБ ЦНС — гемангиобластома ЦНС; КП — карцинома почки; ОПЖ — опухоль поджелудочной железы.
Гемангиобластомы в зависимости от размера и местоположения опухоли клинически проявляются головной болью, тошнотой, головокружением, парестезией, атаксией, нистагмом, расстройством речи и координации движений. Гемангиобластомы обычно характеризуются медленным ростом и имеют высокий риск кровотечений, часто бывают мультифокальными.
Ангиома сетчатки глаза проявляется нарушением зрения от незначительного снижения остроты зрения до полной его потери. В качестве лечения применяют лазеро- или криотерапию [11].
У пациентов с болезнью VHL могут встречаться как кисты почек, так и рак почек. Обычно эти опухоли растут медленно, менее чем 0,5 см в год. Риск метастазирования коррелирует с размером опухоли [12].
ФХЦ при болезни VHL чаще надпочечниковой локализации имеет исключительно норметанефриновый фенотип. Вненадпочечниковая ФХЦ встречается в 30% случаев. Приблизительно в 50% случаев опухоли являются двусторонними. Злокачественные ФХЦ встречаются редко [13].
Цистаденомы эпидидимуса — доброкачественные опухоли, которые могут быть двусторонними и приводить к бесплодию. Хирургическое лечение чаще не требуется [14].
У 17% пациентов с болезнью VHL выявляются нейроэндокринные опухоли ПЖ, 8% из них злокачественные. Кисты и цистаденомы ПЖ в большинстве случаев бессимптомные и доброкачественные [15].
Опухоль эндолимфатического мешочка располагается в лабиринте внутреннего уха под твердой мозговой оболочкой на задней поверхности пирамиды височной кости. Эти опухоли практически не метастазируют. Могут проявляться потерей слуха, звоном в ушах, головокружением, парезом лицевого нерва. Лечение хирургическое [16].
Нейрофиброматоз 1-го типа (NF1). NF1, или болезнь фон Реклингхаузена, передается по аутосомно-доминантному типу. Встречается у 1 на 3 тыс. детей. Генетический дефект локализуется в 17-й хромосоме (17q11.2). Ген NF1 кодирует синтез белка нейрофибромина. При повреждении гена нейрофибромин становится дефектными и наблюдается смещение равновесия роста клеток в сторону пролиферации. Диагноз устанавливается на основании выявления 2 из нижеперечисленных признаков и более, которые могут встречаться в любом сочетании: 6 пятен и более на коже цвета кофе с молоком (диаметром более 0,5 см у ребенка или 1,5 см у взрослого); 2 кожных или подкожных нейрофибромы и более или 1 плексиформная; гиперпигментации подмышечной или паховой области; глиома зрительного нерва; 2 гамартомы радужки и более; костные дисплазии; наличие родственника I степени родства с NF1.
При NF1 вследствие нарушения регуляции клеточного роста могут манифестировать различные патологические состояния: шванномы, астроцитомы, менингиомы, спинальные, периферические, висцеральные и кожные нейрофибромы, макроцефалия, кифосколиоз, односторонний дефект крыши орбиты, сирингомиелия, злокачественные опухоли (периферических нервов, ганглиоглиома, саркома, лейкемия, нефробластома), ФХЦ (до 5,5%), стеноз почечной артерии, легочные кисты и интерстициальная пневмония, неправильное формирование ЖКТ, гипертрофия клитора [17].
Показаниями к операции при интраневральных и кожных нейрофибромах служат боли, двигательные нарушения, большие размеры и быстрый рост. Злокачественные формы встречаются с частотой около 5%, поэтому при подозрении на малигнизацию производится биопсия. При спинальных нейрофибромах, глиомах зрительных нервов и других доброкачественных внутричерепных опухолях показаниями к операции являются компрессионный синдром. Односторонний дефект крыши орбиты оперируют по косметическим показаниям. При шванномах и манифестной сирингомиелии показано хирургическое лечение.
Семейные параганглиомы. Герминальные мутации в генах SDHB, SDHD и SDHC ассоциируются с семейной ФХЦ/параганглиомой. Мутация SDHB наиболее распространена у пациентов с ФХЦ. При мутациях SDHB ФХЦ преимущественно имеет вненадпочечниковую локализацию и наиболее часто является злокачественной. Отдаленные метастазы распространяются гематологическим путем в большинстве случаев в кости печень и легкие. При определении метастазирования выживаемость в течение 5 лет составляет 50%. Злокачественные ФХЦ устойчивы к химио- и лучевой терапии. Лечение высокими дозами [ 131 I]MIBG приводит к объективному улучшению у 30% пациентов. Аналоги соматостатина, меченные радиоактивными метками [ 111 In]pentetreotide/[ 111 In]DOTA-octreotide, [ 90 Y]DOTA-octreotide, [ 177 Lu]DOTA-octreotide и [ 90 Y]DOTA-lanreotide, также, используются с одинаковой эффективностью. В 40% случаев был достигнут ответ при лечении новыми противоопухолевыми препаратами молекулярно-направленного действия — темозоломидом и талидомидом. Доказано, что ингибитор белка HSP-90 уменьшает клеточную пролиферацию при злокачественной ФХЦ [18].
Злокачественные параганглиомы нехарактерны для мутаций SDHD и SDHC. Параганглиомы головы и шеи преобладают при мутации в гене SDHD, однако они чаще, чем при мутациях SDHB, являются мультифокальными. Мутации SDHD — результат импринтинга материнского гена, поэтому, носители, унаследовавшие мутацию от матери, не заболевают, а риску подвергается их потомство. SDHC-параганглиомы редки и встречаются как в области головы и шеи, так и в брюшной полости [19].
Новые мутации. Исследование семейных синдромов ассоциированных с ФХЦ — краеугольный камень в понимании механизмов, вовлеченных в развитие этих опухолей. За прошедшие несколько лет важные успехи сделаны в понимании патофизиологии ФХЦ. Новаторскими исследованиями выявлено несколько новых генетических кандидатов, которые предрасполагают к развитию ФХЦ: SDHA, трансмембранный белок 127 (TMEM127), Myc-ассоциированный фактор X (МАХ), β-вариант кинезинподобного белка 1B (KIF1Bβ), содержащий домен белок пролилгидроксилазы 2 (PHD2) и индуцированный гипоксией фактор 2α (HIF-2α).
В настоящее время подтверждена роль гипоксии в развитии опухоли, включая ФХЦ. Гипоксия приводит к активации фактора HIF (hypoxia-inducible transcription factor), что способствует транскрипции связанных с гипоксией генов, которые вовлечены в туморогенез. Открытие белка HIFα существенно улучшило понимание молекулярного механизма в формировании ФХЦ. Белок с его регулирующими элементами играет ключевую роль в патогенезе ФХЦ с различным генетическим причинами. Недавно определен новый синдром (синдром Пацака—Чжуана), связанный с соматической мутацией гена HIF2α. Синдром включает мультифокальную ФХЦ, соматостатиному и полицитемию [20].
Недавно идентифицирована мутация в гене MAX (MYC associated factor X). Отсутствие белка MAX в опухоли и потеря гетерозиготности вследствие односторонней дисомии явились доказательством участия данного белка в развитии заболевания. Мутация наследуется от отца и в большинстве случаев ассоциируется со злокачественной ФХЦ.
SDHAF2, известный также как SDH5 является одним из генов линии SDHA. Белок SDH5 запускает реакцию флавинации, что существенно отражается на функции SDHA, снижая ее на 95%. Ген SDH — супрессор опухоли. Когда этот ген функционирует нормально, он «включает» в работу белки, чтобы построить ткани, когда организму это нужно и «выключает», когда работа сделана. При мутации в этом гене белки продолжают строить ткани, формируя опухоль. Мутация ассоциируется с параганглиомой головы и шеи. У пациентов с отрицательным результатом исследования гена SDHD рекомендовано исследовать ген SDHAF2.
В 2010 г. в семье с аутосомно-доминантным наследованием ФХЦ методом позиционного клонирования локуса на хромосоме 2q11 идентифицирован ген TMEM127. Анализ тканей человека показал выраженную экспрессию белка этого гена в головном мозге, сердце, скелетной мускулатуре, почках, кишечнике, ПЖ и тимусе.
Содержащий домен белок пролилгидроксилазы 2 (PHD2) является ферментом, закодированным геном EGLN1. Белок совместно с HIF-1β отвечает за регулирование экспрессии генов, вовлеченных в клеточную реакцию при гипоксии, ангиогенезе и пролиферации.
Недавно активация HIF как результат соматической мутационной инактивации изоцитратдегидрогеназы (IDH) 1-го и 2-го типов обнаружена в мультифокальной глиобластоме. Предполагается, что инактивирование IDH1 и IDH2 может также играть роль в онкогенезе параганглиомы и ФХЦ, особенно в не-SDH- и не-VHL-ассоциированных опухолях [21].
Таким образом, в настоящее время получено много новой информации о генетической причине феохромоцитомы. Однако требуются годы исследований, прежде чем на основании точных статистических данных мы получим полное описание по каждой мутации [22].
ФГБНУ «Российский научный центр хирургии им. акад. Б.В. Петровского», Москва, Россия
Отделение хирургии пороков сердца Российского научного центра хирургии им. акад. Б.В. Петровского РАМН, Москва
ФГБНУ «Медико-генетический научный центр», Москва, Россия
Медико-генетический центр «Геномед», Москва, Россия
Отделение хирургии печени, желчных путей и поджелудочной железы Российского научного центра хирургии им. акад. Б.В. Петровского РАМН, Москва
Российский научный центр хирургии им. Б.В. Петровского РАМН
Лаборатория электронной микроскопии и иммуногистохимии Централизованного патологоанатомического отделения ГБОУ ВПО "Первый Московский государственный медицинский университет им. И.М. Сеченова" Минздравсоцразвития России
РНЦХ им. акад. Б.В. Петровского РАМН, Москва
Нейроэндокринная опухоль поджелудочной железы и миелолипома надпочечника, ассоциированные с болезнью Гиппеля—Линдау 2-го типа
Болезнь Гиппеля—Линдау (Von Hippel—Lindau syndrome — VHL) — это наследственное заболевание, связанное с делециями и мутациями в гене Va184Leu (VHL tumour suppressor gene) [1]. Частота данного заболевания составляет 1 случай на 36 000—39 000 человек [2]. VHL имеет вариабельный фенотип, который наиболее часто проявляется в виде гемангиобластомы сетчатки, почечно-клеточной карциномы, эндокринных заболеваний надпочечников и поджелудочной железы [3].
По классификации ВОЗ выделяют VHL 1-го и 2-го типов [2]:
1. VHL 1-го типа: ретинальная ангиома, гемангиобластома, почечно-клеточная карцинома. Данный тип встречается в 83% всех случаев болезни Гиппеля—Линдау [4].
2А — ангиома сетчатки, гемангиобластома и феохромоцитома;
2В — ангиома сетчатки, почечно-клеточная карцинома и феохромоцитома;
2С — только феохромоцитома.
VHL в сочетании с феохромоцитомой встречается только в 17% случаев [4].
Опухоли поджелудочной железы при болезни Гиппеля—Линдау довольно редки и представлены нейроэндокринными поражениями, а также кистозными образованиями (простая киста, серозная цистаденома) [3].
Сочетание болезни Гиппеля—Линдау с эндокринными заболеваниями поджелудочной железы наблюдается в 5—10% случаев [2, 5, 6]. Как правило, это нейроэндокринные опухоли (NET), дисплазия островков Лангерганса и дуктулоинсулярные комплексы [7].
Эндокринные опухоли поджелудочной железы чаще всего светлоклеточные (60% наблюдений), с формированием солидных и железистых структур. При этом в строме опухоли определяются тонкостенные кровеносные сосуды с периваскулярными кровоизлияниями и пучками коллагеновых волокон [8, 9]. Данная гистологическая картина очень напоминает метастаз почечно-клеточной карциномы. Однако в отличие от почечно-клеточного рака также можно увидеть трабекулярные и гирляндоподобные структуры, характерные для эндокринных опухолей.
Иногда в нейроэндокринных образованиях поджелудочной железы, ассоциированных с VHL, определяются многовакуольные клетки с большим количеством липидов. В таких случаях данные образования имитируют перстневидно-клеточный рак особенно при пункционной биопсии поджелудочной железы [1, 10].
Иммуногистохимическое исследование в клетках NET выявляет положительную экспрессию хромогранина, А и синаптофизина [8]. 22% NET при болезни Гиппеля—Линдау негативны к хромогранину А, 17% — очагово-позитивны [6].
Известно, что 35% NET имеют очаговую реакцию к панкреатическим полипептидам, соматостатину, инсулину или глюкагону [9]. В отличие от синдрома множественных неоплазий 1-го типа важной особенностью является положительная реакция к ингибину [1]. Сильная коэкспрессия HIF-1-α, cyclinD1, CA9 и VEGF с отрицательной реакцией к инсулину и глюкагону позволяет отличить нормальные и опухолевые островки Лангерганса в случаях VHL [11].
При молекулярно-генетическом исследовании (флюоресцентная in situ гибридизация) определяется аллельная делеция 2-й копии VHL-гена [9].
Большинство нейроэндокринных опухолей поджелудочной железы при болезни Гиппеля—Линдау доброкачественны и имеют первую степень дифференцировки (2 митоза и менее на 10 HPF, индекс Ki-67 ≤2%). Вместе с тем для данной патологии существует 3 дополнительных критерия оценки потенциала злокачественности по Blansfield [3]:
1) размер опухоли 3 см и более в диаметре;
2) мутация в экзоне 3;
3) увеличение опухоли в размере в 2 раза и более за 500 дней.
Если данные критерии отсутствуют, больной с NET поджелудочной железы при VHL наблюдается каждые 2—3 года, при этом оперативное лечение не проводится. Если есть хотя бы один из указанных критериев, больной наблюдается каждые 6 мес — 1 год. При наличии 2 или 3 критериев необходима операция, так как есть риск малигнизации опухоли [3]. Некоторые авторы предлагают при размере образования 2 см в диаметре выполнять энуклеацию опухоли, при размере 3 см — резекцию поджелудочной железы, более 3 см в диаметре — панкреатодуоденальную резекцию [6].
В литературе встретился только один случай ассоциации болезни Гиппеля—Линдау с миелолипомой [12]. Известно, что эта доброкачественная опухоль неизвестной этиологии составляет 2,5% всех первичных опухолей надпочечника и, возможно, развивается в результате эндокринного дисбаланса [2, 13, 14]. В литературе описано 6 случаев сочетания миелолипомы с аденомой коры надпочечников [13, 14]. При этом опухоль состоит из двух клеточных элементов: светлых и эозинофильных клеток аденомы надпочечника, формирующих альвеолярные структуры. Среди этих клеток определяются участки хорошо отграниченной жировой ткани, смешанной с рассеянными островками элементов костного мозга эритробластами, клетками миелоидного и лимфоидного ряда [14]. Случаи сочетания миелолипомы и феохромоцитомы надпочечника в отечественной и зарубежной литературе нами не встретились.
Приводим собственное наблюдение нейроэндокринной опухоли поджелудочной железы и миелолипомы надпочечника, ассоциированной с VHL 2-го типа.
Больная 44 лет поступила в ФГБНУ «Российский научный центр хирургии им. акад. Б.В. Петровского» 14.05.15 с жалобами на сердцебиение, слабость, потливость, головокружение, затруднение дыхания.
В анамнезе дважды оперирована по поводу феохромоцитомы: в 1987 г. выполнена субтотальная адреналэктомия справа, в 1995 г. — субтотальная адреналэктомия слева. Гистологически оба раза была диагностирована доброкачественная феохромоцитома. Племянник больной оперирован по поводу двусторонней феохромоцитомы в возрасте 11 и 17 лет. Сын оперирован в марте 2015 г. также по поводу феохромоцитомы.
При компьютерном томографическом исследовании в январе 2014 г. у пациентки выявлены образования в проекции левого надпочечника и тела поджелудочной железы.
В июле 2014 г. в ФГБНУ «Российский научный центр хирургии им. акад. Б.В. Петровского» больной выполнена энуклеация опухоли головки поджелудочной железы с удалением образования забрюшинного пространства слева. Согласно протоколу операции, опухоль забрюшинного пространства 3 см в диаметре располагалась медиальнее левой почки, между нижним краем тела поджелудочной железы, левой почечной артерией и левой почечной веной. При интраоперационном УЗИ опухоль головки поджелудочной железы имела размер 1,5×1×1 см.
В марте 2015 г. выявлено новое образование в задних отделах головки поджелудочной железы. При УЗИ по заднемедиальному краю культи головки поджелудочной железы определялось гипоэхогенное слабо васкуляризированное образование размером 3,7×2 см с неровными контурами. ПЭТ-КТ в области резекции головки поджелудочной железы показала метаболически активное образование размером 2,6×2,2 см.
25.05.15 больной выполнена панкреатодуоденальная резекция. Во время операции при интраоперационном УЗИ в задненижних отделах головки поджелудочной железы обнаружено гипоэхогенное образование до 2 см в максимальном измерении.
При макроскопическом исследовании материала после первой операции образование поджелудочной железы было неправильной формы, бурого цвета, плотное, размером 2,5×1,5×1,3 см. Опухоль забрюшинного пространства (5×3×2 см) на разрезе имела вид ткани надпочечника с визуализацией коркового слоя в виде узкой полоски. В центральных отделах образование надпочечника было представлено тканью серо-розового цвета с очаговым кровоизлиянием. В материале после второй операции в головке поджелудочной железы выявлено четко отграниченное образование серовато-бурого цвета размером 1,8×1×1 см плотной консистенции.
При гистологическом исследовании опухоли поджелудочной железы в обоих случаях обнаружено инкапсулированное образование, состоящее из мономорфных клеток с хорошо развитой светлой цитоплазмой, образующих тубулярные, гирляндоподобные и трабекулярные структуры без митотической активности и признаков лимфоваскулярной инвазии (рис. 1, а). В некоторых участках клетки опухоли напоминали перстневидные или имели многовакуольную цитоплазму. В строме образования определялись пучки коллагеновых волокон с большим количеством кровеносных сосудов с тонкими стенками неправильной формы. В клетках опухоли отмечалась PAS-негативная реакция, при окраске по Гримелиусу очагово выявлялись аргирофильные гранулы.

Рис. 1. Болезнь Гиппеля—Линдау. а — высокодифференцированная нейроэндокринная опухоль поджелудочной железы состоит из светлых клеток, формирующих тубулярные и трабекулярные структуры; б — доброкачественная феохромоцитома левого надпочечника, светлые клетки мозгового слоя с умеренным ядерным полиморфизмом формируют железистые и альвеолярные структуры; в, г — на фоне феохромоцитомы участки миелолипомы надпочечника, жировая ткань с островками клеток эритроидного, миелоидного и лимфоидного ряда; д — гемангиобластоподобные структуры среди клеток опухоли; е — клетки опухоли поджелудочной железы экспрессируют хромогранин А; а—д — окраска гематоксилином и эозином; е — иммуногистохимическое исследование; а, б, д, е — ×200; в — ×100; г — ×400.
При гистологическом исследовании образования забрюшинного пространства выявлена ткань надпочечника с гиперплазией и узловой перестройкой коркового слоя. В мозговом слое обнаружено образование, состоящее из двух компонентов. Первый компонент представлен светлыми клетками, формирующими трабекулярные и альвеолярные структуры (см. рис. 1, б). Определялись участки с умеренным ядерным полиморфизмом. Второй компонент в виде вкраплений представлен жировой тканью, смешанной с рассеянными островками мегакариоцитов, клеток эритроидного, миелоидного и лимфоидного ряда (см. рис. 1, в, г). Фигуры митоза, некротические изменения и признаки капсулярной и васкулярной инвазии в образовании надпочечника не определялись.
На границе коркового и мозгового слоя надпочечника обнаружены гемангиобластоподобные структуры с большим количеством мелких кровеносных сосудов капиллярного типа и стромальными вакуолизированными клетками со светлой цитоплазмой (см. рис. 1, д).
В светлоклеточном компоненте опухоли надпочечника отмечалась положительная реакция со следующими маркерами: хромогранином, А (см. рис. 1, е), синаптофизином, СD56, Ki-67 (менее 1%) и отрицательная реакция с RCC, CD10, СК18 и CK19.
Для хромосомного микроматричного анализа ткани опухоли поджелудочной железы из парафиновых блоков использована микроматрица Oncoscan («Affymetrix», США). Все этапы лабораторного исследования проведены в соответствии с протоколом производителя («Affymetrix», США). Анализ данных проводился с помощью программы ChAS, версия 3.0.
В результате исследования получен сигнал, соответствующий двум копиям гена VHL. Вне гена в исследуемом образце обнаружены множественные делеции и амплификации (рис. 2). Подобные профили были ранее описаны у пациентов с нейроэндокринными опухолями [15]. При этом делеций и амплификаций гена VHL обнаружено не было (рис. 3).
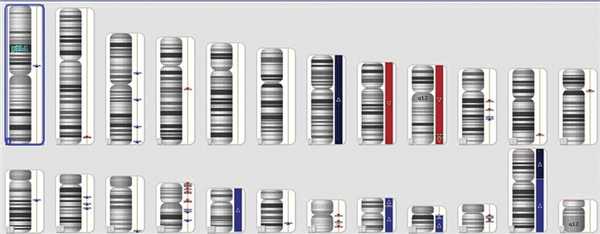
Рис. 2. Делеции и амплификации в образце опухоли поджелудочной железы.

Рис. 3. Ген VHL. Анализ покрытия гена маркерами указывает на отсутствие делеций и амплификаций (стрелкой указана локализация гена на 3-й хромосоме).
Белки, кодируемые геном VHL играют роль в кислородчувствительном пути, в стабильности и ориентации микротрубочек, супрессии опухоли, образовании ресничек, регуляции старения, цитокиновом сигнальном пути и сборке нормального внеклеточного фибронектинового матрикса [15].
С учетом клинических данных, результатов молекулярно-генетического исследования и иммунофенотипа было сделано заключение о болезни Гиппеля—Линдау 2-го типа с наличием высокодифференцированной опухоли поджелудочной железы, доброкачественной феохромоцитомы и миелолипомы надпочечника.
Заключение
Сочетание болезни Гиппеля—Линдау с нейроэндокринной опухолью поджелудочной железы и миелолипомой надпочечника наблюдается крайне редко. Для постановки диагноза необходимо комплексное клинико-морфологическое и молекулярно-генетическое обследование. В плане дифференциальной диагностики обязательны оценка потенциала злокачественности образований, а также исключение метастаза почечно-клеточной карциномы или перстневидно-клеточного рака.
Читайте также:
- Выбор операции при отогенном менингите. Антибактериальная терапия отогенного менингита
- Деятельность глухих и их труд
- Отравление слабительными средствами и его побочные эффекты
- Жизненный цикл лямблий. Патогенез лямблиоза. Клиника лямблиоза. Диагностика, лечение лямблиоза.
- Малярия. История изучения и возбудитель малярии
