Профилактика развития спаек. Хирургическая техника
Добавил пользователь Валентин П. Обновлено: 22.01.2026
Спайки легче предотвратить, чем лечить. Если хирургическое вмешательство плановое, то о профилактике спаек нужно подумать до операции.
Выделяют 4 группы мероприятий по профилактике спаечного процесса, основанные на знании механизма его образования:
- Уменьшение травмы.
- Снижение воспалительной реакции в зоне операции.
- Уменьшение вероятности выпадения фибрина в области операции.
- Отграничение или разобщение поврежденных серозных поверхностей посредством создания защитных барьеров на повреждённых тканях.
Внедрение новых технологий в современную хирургическую практику позволяет снизить хирургическую травму и риск развития спаек:
- лапароскопическая хирургия;
- робот-ассоциированная хирургия;
- современный шовный материал;
- атравматичные хирургически иглы;
- использование в хирургии лазерного луча вместо электрического тока;
- хирургические перчатки без талька.
Несмотря на технологии, главным в профилактике развития спаечного процесса остаётся мастерство хирурга и его бережное обращение с тканями.
- Антибактериальная и противовоспалительная терапия.
- Ранняя активизация пациента: уже на второй день после операции на органах брюшной полости рекомендуется начать поворачиваться то на один, то на другой бок, делать глубокие вдохи, садиться в постели, если позволяет общее состояние.
- Питание должно быть небольшими порциями 6-8 раз в сутки (частое, дробное), пища полужидкая, легко усвояемая.
- Контроль регулярности стула.
- После заживления ран на коже живота или после снятия швов следует начать выполнять лёгкие упражнения: наклоны, повороты туловища. Всё это направлено на смещение внутренних органов друг относительно друга, что предотвращает их слипание и сращение.
- Физиотерапевтическое лечение, в том числе с лекарственными препаратами рассасывающего действия, ферментотерапия.
- Лечебная физкультура с учётом особенностей хирургического вмешательства под контролем врача способствует активации и увеличению диапазона движений (в том числе в зоне вмешательства), что препятствует образованию сращений.
- Крайне важным является состояние иммунной системы организма, т.е. его защитных сил. Для поддержания иммунитета необходимо вести здоровый образ жизни, особенно после операции: спать не менее 8 часов, гулять на свежем воздухе, принимать витамины (по согласованию с врачом), навсегда побороть такие зависимости, как курение и др.
Однако перечисленных мер не всегда бывает достаточно.
В настоящее время с целью профилактики развития спаечного процесса в мировой хирургии наиболее перспективным признано применение во время операции специальных противоспаечных барьеров.
Противоспаечные барьеры в раннем послеоперационном периоде разграничивают повреждённые ткани, предотвращая их слипание и последующее сращение. Противоспаечный барьер с содержанием гиалуроновой кислоты оказывает также противовоспалительный и репаративный (заживляющий) эффект. После выполнения своей функции противоспаечные барьеры рассасываются (биодеградируют).
Готовясь к плановой операции любого профиля, обсудите с Вашим хирургом вопросы послеоперационной реабилитации и профилактики спаечного процесса, в том числе с помощью противоспаечных барьеров.
Профилактика спаечной болезни

Профилактика спаечной болезни после проводимых мною гинекологических и хирургических лапароскопических операций позволяет существенно повысить качество жизни оперируемых пациентов, сократить период их пребывания в стационаре и ускорить восстановительные процессы после операции. Ключевым вопросом для меня является как профилактика возникновения спаек после операций, так и профилактика повторного образования внутрибрюшинных и тазовых спаек после операций по их рассечению.
Существование спаек приводит к снижению качества жизни, хроническим болям в животе, бесплодию. В ряде случаев может развиться кишечная непроходимость.
Причиной развития спаек вне операции являются воспалительные процессы, протекающие в брюшной полости и малом тазу. Фактически спайки это специфическая патологическая реакция брюшины на воспаление, существующее у пациентов с холециститом, язвой желудка, сальпингитом, оофоритом, эндометриозом, миомой матки. Очень часто ранее возникшая спаечная болезнь является причиной бесплодия у пациенток с трубно-перитонеальной формой бесплодия.
При нарушении техники выполнения операций развиваются воспалительные и деструктивные изменения брюшины, которые приводят к появлению сращений (спаек):
- механический - травмирование брюшины при выполнении различных этапов хирургического вмешательства;
- физический - высушивание брюшины воздухом, воздействие высокой температуры (ожоги) при использовании во время операции электроножа, лазерного излучения и других;
- имплантационный - асептическое воспаление брюшины в результате длительного пребывания в брюшной полости дренажных трубок, длительно рассасывающегося шовного материала и др.
C целью профилактики возникновения новых спаек я активно использую все типы противоспаечных барьеров, включая саморассасывающиеся мембраны (Interseed, Seprafilm, Oxiplex, Preclud) и жидкие среды (Мезогель, Intergel, Hyskon, SprayGel, Oxiplex).
Применение современных противоспаечных средств и барьеров во время операции позволяет:
- значительно снизить число новых спаек в малом тазу и брюшной полости; при этом уменьшается распространенность и плотность новых спаек;
- уменьшается болевой синдром в послеоперационном периоде;
- увеличивается проходимость маточных труб;
- восстанавливается фертильность (при трубно-овариальной форме бесплодия).
Противоспаечные средства ( барьеры) используемые в хирургической и гинекологической практике.
Формирование спайки происходит между поверхностями с травмированным брюшинным покровом (Haney A.F., Doty E., 1994). Очевидно, что разделение травмированных поверхностей в течение 5-7 дней, которые требуются для восстановления брюшинного покрова (Raftery A.T., 1973; DiZerega G.S., 1992; Menzies D., 1992), должно теоретически помочь нормальному заживлению, независимо от изменяющихся биохимических процессов. По этой причине, «барьеры» могут быть прямым и простым средством для сокращения или предотвращения спаек. Хотя концепция «барьера» проста, он должен соответствовать ряду требований, чтобы найти широкое применение в клинической практике (DiZerega G.S., 1994; Wiseman D., 1994). «Барьер» должен быть эффективным в присутствии крови, экссудата, должен быть безопасен, инертен, т.е. не быть очагом воспаления, инфекции, фиброза, не должен инкапсулироваться, стимулировать прорастание сосудов. «Барьер» должен полностью растворяться, быть удобным и легким в применении (в том числе при лапароскопии) (Panay N., Lower A.M., 1999), по возможности не нуждаться в креплении с помощью швов.
К группе барьерных средств можно отнести различные высокомолекулярные соединения, вводимые в брюшную полость в виде растворов, аэрозолей, гелей, мембран, пленок.
Кристаллоиды. Всасывание воды и электролитов из брюшной полости происходит быстро - до 500 мл изоосмолярного раствора хлорида натрия всасывается менее чем за 24 ч . Так как для ремезотелизации поверхностей брюшины требуется 5-8 дней, кристаллоидный раствор всосется задолго до того, как процесс отложения фибрина и образования спаек завершится. По данным исследований, частота повторного образования спаек у пациентов, которым вливались кристаллоидные растворы, составляет приблизительно 80%.
После операции брюшная полость закислена, и следует уделять внимание используемому во время операции промывному раствору. Рингер-лактат безопасен, недорог, широко доступен и имеет лучшую буферную емкость, чем обычный изотонический раствор натрия хлорида. Внутрибрюшное вливание Рингер-лактатного раствора животным уменьшает образование спаек. Механизм действия неясен, учитывая краткосрочность гидрофлотации. Возможно, Рингер-лактат очищает свежеобразованный фибриновый экссудат, который может служить матрицей для фибробластной активности и формирования капилляров. Этот первоначальный фибрин, если он не удаляется путем фибринолиза или абсорбции, создает воспалительный ответ, активирует пролиферацию фибробластов и образование спаек. Эффективность Рингер-лактата в клинических ситуациях не была клинически доказана .
Полимеры глюкозы. 32% декстран 70 (Hyskon®, Pharmacia, Швеция), ранее часто использовался для профилактики спаек. Раствор декстрана медленно всасывается и привлекает жидкость в брюшную полость. Он также подавляет образование сгустков . Однако наблюдения в отдаленном периоде не позволили выявить уменьшения образования спаек. Более того, были отмечены существенные побочные эффекты, такие как асцит, увеличение масс тела, выпот в плевральную полость, отек губ, нарушения функции печени, а также, хотя и редко, диссеминированное внутрисосудистое свертывание и анафилаксия . Результаты оказались неудовлетворительными, и препарат в настоящее время практически не применяется.
Икодекстрин был первоначально разработан как перитонеальный диализат и длительное время использовался в виде 7,5% раствора. Для профилактики спаек икодекстрин производится в изотоническом, 4% растворе и носит название Adept® (Baxter Healthcare, США). Препарат применяется в Европе с 2000 г. и в США с 2006 г.
Adept® гораздо дольше (период полувыведения около 96 ч), чем кристаллоидные растворы, задерживается в брюшной полости, обеспечивая гидрофлотацию в течение критического периода образования спаек. Этот препарат не потенцирует инфекцию, распространение злокачественных клеток, не более чем кристаллоидные растворы влияет на заживление и прочность лапаротомных ран и анастомозов, хорошо переносится пациентами, всего на 1/3 введенного объема выделяется по дренажам.
По данным первичного клинического многоцентрового исследования, направленного на подтверждение безопасности препарата, происходит уменьшение спайкообразования 30% по сравнению с 16% увеличением в контроле (Рингер-лактат). На одну операцию требуется около 1 литра раствора. К недостаткам можно отнести достаточно высокую стоимость (около 200 евро), необходимость хранения в холодильнике при температуре 4-6 °C. Кроме того, перед применением препарат следует нагреть до температуры тела, после нагревания невскрытый мешок с препаратом может храниться при комнатной температуре не более 14 дней.
Гиалуроновая кислота (ГК) представляет собой естественно образующийся гликозаминогликан — основной компонент внеклеточного вещества соединительной ткани. ГК биосовместима, неиммуногенна, нетоксична и естественно биоабсорбируема. ГК была объединена с фосфатным буферным раствором и получила название Sepracoat (Genzym Corporation, USA). Применялась интраоперационно, до диссекции, для защиты брюшинных поверхностей от непрямой хирургической травмы (например, абразии и диссекции), а не послеоперационно, для разделения поверхностей после их травматизации. Многие исследования продемонстрировали неэффективность препарата. В итоге он не был одобрен Управлением по контролю над качеством пищевых продуктов и лекарственных препаратов (FDA, США), и был снят с производства. Это же касается и 0,5% геля гиалуроната железа (Intergel®), который был выведен из клинического применения в 2003 г. в связи с развитием поздних послеоперационных болей.
Аутологичные трансплантаты брюшины. Результаты экспериментальных исследований показали, что микрохирургическое покрытие повреждений париетальной брюшины аутотрансплантатами брюшины может полностью предотвратить образование тяжелых спаек. Но получение такого материала сопряжено с дополнительной травмой и потенциальными проблемами со стороны донорских зон.
Окисленная восстановленная целлюлоза (Interceed®) представляет собой нетканный материал, напоминающий марлю. При нанесении на поврежденную брюшину он превращается в гель в течение 8 ч. ОВЦ можно легко наносить при лапароскопии, она следует контурам органа и не нуждается в пришивании. Препарат начал использоваться с конца 80-х годов в гинекологических операциях, экспериментальное и клиническое применение показало уменьшение количества и серьезности послеоперационных спаек (Мынбаев О.А., 1995; Maxson W.S. et al., 1988; Azziz R., 1993; Gomez N.A. et al., 1993, 1994; Fitzgibbons R.J. et al., 1994; Franklin R.R., 1995; Nordic Adhesion Prevention Study Group, 1995; Farquhar C. et al., 2001; Sawada T., 2002). Однако, даже небольшое кровотечение во время наложения ОВЦ приводит к промоканию кровью и короблению материала. На сегодняшний день широкое применение препарата ограничено уменьшением эффективности в присутствии крови или избытка перитонеальной жидкости (DiZerega GS., 1994; Wiseman D., 1999).
Гиалуроновая кислота + карбоксиметилцеллюлоза. Эти два многоанионных полимера были объединены в биорассасывающуюся мембрану (пленку) Seprafilm® (Genzym Corporation, США), которая является нетоксичной, неимуногенной, биологически совместимой (Burns J., 1997; DeCherney A.H., DiZerega G.S., 1997). Она используется в виде пленки и покрывает травмированные поверхности. Мембрана превращается в гель в течение 24-48 часов, но остается на месте размещения до седьмых суток. Полностью рассасывается к 28 дню, не требует фиксации швами, эффективна в присутствии крови. ГК-КМЦ уменьшал частоту образования послеоперационных спаек к линии разреза более чем на 50%, и средняя частота образования спаек была на 40% меньше, чем при лапаротомном контроле. Частота формирования спаек у разреза, вовлекавших сальник, желудок, тонкую кишку, брюшную стенку и мочевой пузырь, была достоверно снижена у пациентов, перенесших абдоминальную операцию через срединный разрез с использованием ГК-КМЦ. Однако относительная разница в клиренсе ГА и КМЦ может приводить к фрагментации пленки и повышению частоты образования эмболов и абсцессов.
Seprafilm® также неэффективен в присутствии крови, как и Interceed®. Негативно влияние Seprafilm® на заживление анастомозов. Для достижения адекватного покрытия в колоректальной хирургии требуется в среднем 4,5 листа Seprafilm® на пациента, что дорого.
Гидрогели. Гелевая система SprayGel™ (Confluent Surgical, США) была разрешена к применению в лапароскопической и открытой хирургии в Европе в конце 2001 г. Она состоит из двух водных синтетических полиэтиленгликолевых растворов - один бесцветный, другой окрашенный метиленовой синью, чтобы легче было видеть место, где он нанесен. При одновременном распылении эти два раствора взаимодействуют друг с другом на ткани, образуя форму гидрогелевой пленки, создающей физический барьер. Этот барьер остается на месте до 7 дней, а затем рассасывается и выводится через почки. Показано, что SprayGel™ достоверно уменьшает частоту образования, тяжесть и распространенность послеоперационных спаек при повторной лапароскопии . Однако препарат сложен в применении и дорог.
То же можно сказать о недавно вышедшем на рынок композитном препарате Prevadh® KLF (Sofradim, Франция), состоящем из двусторонней пленки (ателоколлаген 1-го типа + полиэтиленгликоль + глицерин) и двухкомпонентного клея в 2 шприцах (окисленный мальтодекстрин + фосфатный буфер), а также о геле-эмульсии Prevadh® KMO (ателоколлаген 1-го типа + окисленный мальтодекстрин). Пленка рассасывается в течение 14 дней, замещаясь мезотелием. Первые данные свидетельствуют об их значительной эффективности, но препараты дороги, обусловливают необходимость особой техники применения, в частности нагрева в специальном устройстве, поставляемом вместе с ними.
Карбоксиметилцеллюлоза (Na-KМЦ) — производное целлюлозы. Карбоксиметилцеллюлоза хорошо растворяется в воде, образуя гель. Она нетоксична, не канцерогенна, не оказывает эмбриотоксического эффекта. В пищевой промышленности применяется как загуститель, пищевая добавка (Е466). Na-KМЦ включена в Государственный реестр лекарственных средств России под номером 68/333/16, а также включена в фармакопию США и Европы. В фармакологии применяется как вспомогательное вещество (Nahata M., 1999) и входит в состав, как препаратов применяемых наружно (лигентен - гель для интравагинального и интрауретрального применения) и через рот (мотилиум, актос), так и в состав инъекционных форм препаратов вводимых парэнтерально (преднизолон, кортизон, сандостатин).
В экспериментальных работах изучавших спайкообразование, КМЦ упоминается с середины 80-х годов. За этот период имеются многочисленные положительные отзывы о ее эффективности в борьбе со спайками при использовании 1-3% растворов (Elkins T.E. et al., 1984; Fredericks C.M. et al., 1986; Moll H.D. et al, 1991, 1992; Parra O.M. et al., 1991; Yaacobi Y. et al., 1993; Heidrick G.W., 1994; Harris E.S. et al., 1995; Ryan C.K., Sax H.C., 1995; Wurster S.H. et al., 1995; Petroianu A. et al., 1999; Hay W., 2001; Peck L., 2002), причем многие исследователи отмечают более выраженные антиспаечные свойства КМЦ по сравнению с другими препаратами этого ряда (Elkins T.E., 1984; Ortega-Moreno J., 1993; Yaacobi Y. et al., 1993; Alponat А. et al., 1997).
В клинической практике с 2004 года используется противоспаечный гель Мезогель (Линтекс, Санкт-Петербрг), созданный на основе КМЦ. Гель наносится на поврежденные участки тканей и органов, где возможно спайкообразование. Мезогель наносится путем выдавливания из пакета или через шприц и распределяется тонким слоем по обрабатываемой поверхности, что создает надежное покрытие на время заживления и не дает склеиваться соприкасающимся поверхностям органов. После введения Мезогель начинает медленно растворяться: концентрация уменьшается путем увеличения объема геля (набирает воду) и расщепления молекул КМЦ на более короткие фрагменты. В брюшной полости КМЦ всасывается в капиллярную сеть перитонеальной мембраны, а также проходит сквозь серозную оболочку кишечника в лимфатическую систему. КМЦ выводится с мочой, а часть КМЦ рападается до углекислого газа, воды и глюкозы.
В недавних российских исследованиях было продемонстрировано, что Мезогель не влиял на заживление анастомозов, не потенцировал развитие послеоперационной внутрибрюшной и раневой инфекции, и не воздействовал на местный гемостаз. Количество хирургических осложнений в условиях применения препарата не превышало таковое в стандартных условиях. При анализе результатов УЗИ выявлено, что в 97% случаев Мезогель из брюшной полости полностью рассасывался к 4 суткам после операции, у остальных 3% пациентов основной группы, гель определялся в брюшной полости до 9 суток. После введения геля нарушения пассажа были достоверно ниже и наблюдались в течение 3-4 дней, после чего появлялась активная перистальтика, прекращалось выделение по кишечному зонду, самостоятельно начинали отходить газы, появлялся стул. Выраженность интоксикационного и болевого синдромов также оказалась достоверно ниже (в 2 раза) в исследуемой по сравнению с контрольной.
Применение видеолапароскопии и барьерного противоспаечного препарата Мезогель в лечении спаечной болезни удалось добиться купирования хронического абдоминального синдрома на протяжении 3-х лет у 84,6% больных группы, устранение острой и рецидивирующей спаечной кишечной непроходимости у 99,3% больных и улучшить качество жизни на 10-14%, в течение 3-х летнего наблюдения.
Применение геля Мезогель в гинекологической практике выявило высокую противоспаечную эффективность. Использование в операциях при трубной беременности показало, что спаечный процесс в малом тазу отмечен лишь у 27,7% пациенток, в отличие от контрольной группы, где спайки обнаружены в 88,8%. При проведении хромогидротубации проходимость труб обнаружена у всех пациенток с использованием геля, а в контрольной группе лишь у 44,4% (Алыев Ш.А, 2008). Также положительный эффект от использования геля получен при лечении лейомиомы матки, достоверно снижался болевой синдром, повышалось количество наступивших беременностей (72,5%, в контрольной группе 53,3%) (Медведев М,В, 2008).
Таким образом, на сегодняшний день наиболее оправданным для профилактики спаечного процесса в брюшной полости является использование минимально инвазивной хирургической техники в сочетании с противоспаечнными барьерными средствами.

Когда вы пишете письмо, знайте:
оно попадает мне на мою личную электронную почту .
На все ваши письма я отвечаю всегда только сам. Я помню, что вы доверяете мне самое ценное — свое здоровье, свою судьбу, свою семью, своих близких и делаю все возможное, чтобы оправдать ваше доверие. Каждый день я по нескольку часов отвечаю на ваши письма. Направляя мне письмо с вопросом, вы можете быть уверены, что я внимательно изучу вашу ситуацию, при необходимости запрошу дополнительные медицинские документы. Огромный клинический опыт и десятки тысяч успешных операций помогут мне разобраться в вашей проблеме даже на расстоянии.
Многим пациентам требуется не хирургическая помощь, а правильно подобранное консервативное лечение, в то время как другие нуждаются в срочной операции. И в том, и в другом случае я намечаю тактику действий и при необходимости порекомендую прохождение дополнительных обследований или неотложную госпитализацию. Важно помнить, что некоторым больным для успешной операции требуется предварительное лечение сопутствующих заболеваний и правильная предоперационная подготовка.
В письме обязательно (!) укажите возраст, основные жалобы, место проживания, контактный телефон и адрес электронной почты для прямой связи. Чтобы я мог детально ответить на все ваши вопросы, прошу высылать вместе с вашим запросом сканированные заключения УЗИ, КТ, МРТ и консультаций других специалистов. После изучения вашего случая, я направлю вам либо подробный ответ, либо письмо с дополнительными вопросами.
В любом случае я постараюсь вам помочь и оправдать ваше доверие, которое является для меня наивысшей ценностью.
Хирургическое лечение спаечной болезни лапароскопическим доступом (спайки брюшной полости и малого таза)
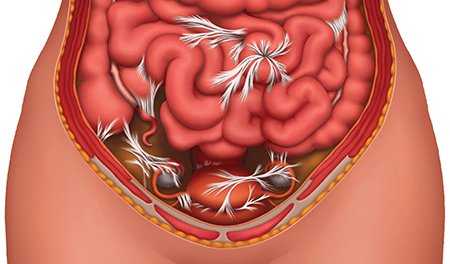
Тактика хирургического лечения спаечной болезни подбирается индивидуально и зависит от локализации спаек, стадии развития болезни и наличия осложнений - острой кишечной непроходимости, а также сопутствующих заболеваний.
При развитии осложнений - острой кишечной непроходимости, пациент обязательно госпитализируется в хирургический стационар и при отсутствии странгуляции (нарушения кровоснабжения участка кишки) лечение необходимо начинать с консервативной терапии. Как правило, это лечение включает голод, инфузионную и спазмолитическую терапию, выполнение сифонных клизм и новокаиновых блокад.
Цель такого лечения - снять боль, уменьшить активность перистальтики, очистить просвет кишки. В большинстве случаев удается купировать атаку острой спаечной кишечной непроходимости и выписать пациента на 2-3 сутки для планового оперативного лечения. Если в течение суток явления острой кишечной непроходимости не стихают, то показано экстренное оперативное вмешательство - лапаротомия или лапароскопия и ликвидация непроходимости. Доступ определяется видом непроходимости и запущенности заболевания, а также временем прошедшим после предыдущей операции.
Хирургическое лечение спаечной болезни
Операция по разделению спаек брюшной полости обязательно должна проводиться хирургом с большим опытом подобных операций, как открытым, так и лапароскопическим методами.
В холодном периоде необходимость проведения операции определяется количеством предшествующих атак непроходимости, количеством перенесенных операций и качеством жизни пациента. При частых приступах острой кишечной непроходимости, неоднократных госпитализаций в стационар и снижении качества жизни, безусловно показано оперативное вмешательство, направленное на рассечение спаек и профилактику их повторного образования. Оптимальным доступом в такой ситуации является лапароскопия.
Преимущество лапароскопического метода заключается в том, что такое оперативное вмешательство проводится через несколько проколов, в брюшную полость вводится углекислый газ (он в отличие от воздуха при открытых операциях, не высушивает брюшину), промывание брюшной полости проводится теплым стерильным раствором Рингера, а не салфетками, травмирующими мезотелий на кишке. При лапароскопии захват органов проводится атравматичными тонкими 5 мм инструментами, без использования ранорасширителей и жестких зажимов.
Лапароскопическим доступом проводить операцию по поводу спаек брюшной полости значительно сложнее, чем открыто лапаротомно, но эффект от вмешательства в несколько раз выше.
Я выполняю подобные операции лапароскопическим доступом с 1993 года и в настоящее время обладаю опытом более 900 лапароскопий при различной форме спаечной болезни органов брюшной полости и малого таза.
Описание хода операции
Видео из операционной. Лапароскопическая цистаднексэктомия при выраженном спаечном процессе
При лапароскопии очень важно безопасно ввести первый троакар. В этом помогает проведение предоперационного ультразвукового исследования с обнаружением, так называемого «акустического» окна - ультразвуковое сканирование брюшной полости в разных положениях тела пациента позволяет определить места фиксации кишечных петель к брюшной стенке и выявить свободный участок от спаек. Именно в этом месте оптимально устанавливать первый троакар для оптики. Его необходимо вводить по методике Хассана, с предварительным вскрытием брюшины под контролем глаза. Далее уже под контролем зрения вводятся последующие рабочие 5 мм троакары.
Суть лапароскопической операции заключается в ревизии органов брюшной полости и последовательном пересечении всех обнаруженных спаек. Обычно, на первом этапе, я рассекаю спайки между сальником и брюшной стенкой или кишкой и брюшной стенкой, освобождая пространство для хирургического маневра. Участок сальника оптимально пересекать аппаратом Liga Sure (Швейцария), который позволяет заваривать все сосуды в толще сальника и проводить бескровное его рассечение. Спайки между петлями кишки или между кишкой и брюшной стенкой я всегда рассекаю «холодным» способом 5 мм острыми ножницами, без использования электрохирургии. Так как, основным осложнением, встречающимся при этой операции, является повреждение стенки кишки электрическим током. Причем перфорация кишки может наступать на 2-3 сутки после операции и вызвать острый перитонит. В случае очень плотных рубцовых спаек между петлей кишки и передней брюшной стенкой, я провожу диссекцию тканей над париетальной брюшиной, оставляя ее участок на стенке кишки, тем самым профилактируя механическое повреждение стенки полого органа. На следующем этапе необходимо обязательно просмотреть всю тонкую кишку от илеоцекального угла до связки Трейца и восстановить проходимость кишки на всем ее протяжении. Не выполнения этого приема является самой частой ошибкой хирургов и сводит на нет все оперативное вмешательство. Так как, в этой ситуации часть спаек остается не пересеченными и эффекта от операции не будет.
Посмотреть видео операций при спайках брюшной полости в исполнении профессора Вы можете на сайте "Видео операций лучших хирургов мира".
Пациенты со спаечной болезнью, как правило, переносят несколько лапаротомий и, вследствие этого, имеют послеоперационную вентральную грыжу. Наличие у пациента грыжи, делает операцию более сложной для хирурга. В такой ситуации требуется одновременно устранить выявленный дефект. Лапароскопический доступ позволяет устранить послеоперационную грыжу любого размера. При грыжах небольших размеров (до 2 см) и при хорошем состоянии соединительной ткани, проводится ушивание дефекта апоневроза. При грыжах большего размера, выполняется пластика с обязательным применением специального синтетического импланта, который я размещаю в области дефекта брюшной стенки разными способами, что позволяет обеспечивать отличный результат для каждого пациента. Процент развития рецидива снижается в 3-4 раза и приближается к нулю. На протяжении нескольких недель протез прорастает соединительной тканью, образуя единый анатомический комплекс, надежно закрывающий дефект брюшной стенки. Современные имплантанты изготавливаются из сверхпрочного материала, а благодаря своим характеристикам эти конструкции невосприимчивы к инфекциям. Спустя некоторое время после операции отличить протез от ткани брюшины становится невозможным.
В конце операции я использую современные противоспаечные барьеры, которые минимизируют выпадение фибрина (белка, способствующего свертываемости) в области вмешательства и в несколько раз снижают вероятность развития рецидива спаечной болезни. Барьеры располагаются между органами и препятствуют прилипанию и сращениям. Эти материалы в течение 7-10 дней самостоятельно бесследно рассасываются в брюшной полости. Не стоит забывать, что это обязательный компонент хирургического лечения. В современной хирургии, без использования противоспаечных барьеров не надо брать пациентов на плановое вмешательство по поводу спаечной болезни брюшной полости и малого таза.
Собственно, лапароскопический доступ является сегодня «золотым стандартом» в лечении спаечной болезни. Малоинвазивность, использование противоспаечных барьеров, отличный косметический результат — основные достоинства метода.
Послеоперационный период
Благодаря лапароскопическому доступу реабилитационный период после операции значительно сокращен, срок пребывания в клинике составляет от 2 до 4 дней. Однако уже в первые сутки пациент может ходить, ему разрешается принимать жидкую пищу. И хотя восстановительный период зависит от множества факторов, пациент, как правило, через неделю может возвратиться к привычному образу жизни. Нужно учесть, что при одновременной коррекции послеоперационной грыжи, после проведенной операции больной должен носить специальный бандаж, который мы подбираем индивидуально для каждого пациента. Также от пациента требуется неукоснительное соблюдение рекомендаций по питанию и разумной физической активности.
Прогноз
Безусловно, спаечная болезнь органов брюшной полости снижает физическую активность пациента, что не может не отразиться на его качестве жизни. При развитии острой спаечной кишечной непроходимости послеоперационная летальность составляет более 10% случаев.
Однако при своевременной выполненной операции в «холодном» периоде прогноз более чем удовлетворительный. В большинстве случаев удается достичь полного выздоровления и ремиссии спаечной болезни на долгие годы. Использование современных технологий и инновационных противоспаечных барьеров, а также опыт хирургов гарантируют хороший результат.
Профилактика развития спаек. Хирургическая техника
НИИ акушерства и гинекологии им. Д.О. Отта РАМН, Санкт-Петербург
Этиология, патогенез и профилактика спайкообразования при операциях на органах малого таза
Журнал: Российский вестник акушера-гинеколога. 2011;11(2): 90‑101
Беженарь В.Ф., Айламазян Э.К., Байлюк Е.Н., Цыпурдеева А.А., Поленов Н.И. Этиология, патогенез и профилактика спайкообразования при операциях на органах малого таза. Российский вестник акушера-гинеколога. 2011;11(2):90‑101.
Bezhenar' VF, Aĭlamazian ÉK, Baĭliuk EN, Tsypurdeeva AA, Polenov NI. The etiology, pathogenesis, and prevention of commissure formation during small pelvic surgery. Russian Bulletin of Obstetrician-Gynecologist. 2011;11(2):90‑101. (In Russ.).
Развитие внутрибрюшных спаек встречается в 67-93% после общехирургических абдоминальных операций и составляет почти 97% после так называемых открытых гинекологических вмешательств. По данным патологоанатомических и клинических исследований с участием пациенток, перенесших лапаротомии, число случаев развития внутрибрюшных спаек составляет 70-90% [10]. Спайки образуются между раневой поверхностью и большим сальником более чем у 80% пациенток, при этом они могут вовлекать тонкую кишку у 50% больных (D. Menzies, H. Ellis, 1990).
Послеоперационные спайки резко ухудшают качество жизни миллионов людей во всем мире, приводя к затруднению повторных хирургических доступов, непроходимости тонкой кишки [15], хроническим абдоминальным и тазовым болям, бесплодию [1, 3].
Повторные операции через тот же хирургический доступ могут быть чрезвычайно сложными, рискованными и потенциально опасными, при этом необходимость выполнения адгезиолизиса увеличивает длительность операции, наркоза и последующей реконвалесценции, приводя к дополнительным рискам для пациентки: кровопотере, повреждению внутренних органов, свищам и др. Операции в анамнезе увеличивают продолжительность последующего хирургического доступа в среднем на 18 мин [7] и в 19% случаев приводят к так называемым случайным энтеротомиям [32].
Спайки служат наиболее частой причиной непроходимости толстой и тонкой кишки, вызывая примерно от 1 /3 до 1 /2 всех случаев непроходимости кишечника и 60-70% случаев тонкокишечной непроходимости [30]. При длительном наблюдении примерно у 5% пациенток, подвергшихся лапаротомии, развивается спаечная непроходимость; 10-30% из них переносят повторные эпизоды непроходимости кишечника [29]. Приблизительно 1% всех хирургических госпитализаций и 3% лапаротомий являются следствием спаечной непроходимости кишечника.
Обширные мягкие спайки образуются в течение 72 ч после лапаротомии. Они наиболее распространены в период от 10 дней до 2 нед после операции, по истечении этого времени спайки становятся плотными и васкуляризированными. Более 20% случаев спаечной непроходимости возникают в течение 1 мес после операции, а 40% - в течение 1 года после операции (D. Menzies, 1992). Нарушение местного кровообращения в тонкой кишке вследствие странгуляции вызывается спайками в 30% случаев. Общая летальность больных со странгуляцией и гангреной кишки составляет 6-8% после различных операций [8].
Операции, часто приводящие к спаечной непроходимости, включают хирургические вмешательства на ободочной и прямой кишке, гинекологические операции и экстренную аппендэктомию. Относительно низкий риск образования спаек имеется у пациенток, подвергшихся плановой аппендэктомии через небольшой разрез или кесареву сечению через разрез по Пфанненштилю.
Гинекологические и акушерские операции служат основным источником формирования внутрибрюшных спаек. Гинекологи лечат более 20% всех женщин с непроходимостью кишечника. Сообщалось, что абдоминальная гистерэктомия находится среди наиболее часто выполняемых операций, приводящих к спаечному процессу и кишечной непроходимости. Миомэктомия сопровождается высокой частотой формирования спаек в области придатков матки, особенно в тех случаях, когда разрез делается на задней стенке матки. Хирургическое лечение таких злокачественных новообразований женских половых органов, как рак яичника может часто сопровождаться непроходимостью кишечника либо вследствие продолженного роста опухоли, либо из-за послеоперационных спаек.
Эндометриоз, одна из наиболее частых причин тазовых болей и бесплодия у женщин репродуктивного возраста, сопровождается образованием фиброзных спаек после органосохраняющих вмешательств и иссечения эндометриом яичников. Фиброзные спайки часто образуются в ответ на хроническое раздражение поверхности брюшины эндометриоидными имплантатами и продуктами их секреции.
Хроническая тазовая боль - одно из следствий развития внутрибрюшных спаек [13]. Считается, что она вызывается повышенным натяжением, растяжением и смещением тазовых органов, что стимулирует болевые рецепторы брюшины, и ограничением подвижности и растяжимости тазовых органов. Анализ данных 11 исследований позволил выявить, что спайки были наиболее частой патологией у пациенток, страдавших тазовой болью [9]. Связь между спайками и болью хорошо иллюстрируется облегчением и уменьшением боли после адгезиолизиса в 60-90% случаев [13].
Патогенез и биохимические реакции при формировании спаек
Заживление брюшины отличается от такового кожи. Реэпителизация кожи происходит путем пролиферации эпителиальных клеток от периферии к центру кожной раны. Большие повреждения кожи реэпителизируются дольше, чем маленькие. Напротив, мезотелий брюшины восстанавливается одновременно, независимо от размера повреждения, из островков мезотелиальных клеток, которые разрастаются в слои клеток. Большие перитонеальные раны восстанавливаются (ремезотелизируются) почти так же быстро, как маленькие за 5-6 дней на париетальной брюшине и за 5-8 дней - на висцеральной [8].
Нужно помнить, что спайкообразование служит проявлением так называемого избыточного внутреннего заживления (H. Ellis, 1980), нередко играющего патофизиологическую защитную роль: отграничение зоны повреждения и инфицирования в брюшной полости.
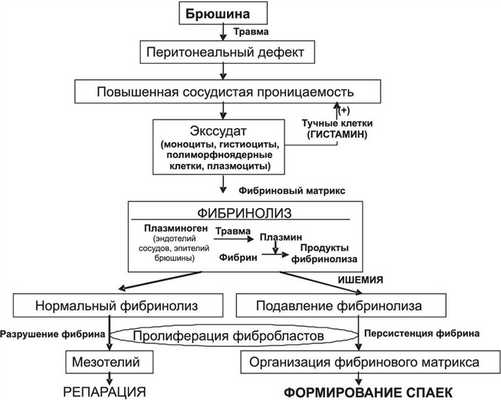
Ключевой зоной образования спаек является поверхностная выстилка брюшины. Хрупкость перитонеальной поверхности и ее чувствительность к повреждению, а также высокая скорость ремезотелизации служат важными факторами образования спаек (рис. 1). Рисунок 1. Патогенез спайкообразования (по G. diZerega, J. Campeau, 1994).
Этиологические факторы образования спаек многочисленны:
- механический - травмирование брюшины при рассечении, захватывании инструментами, промокании и вытирании сухими марлевыми салфетками, иссечении ее участков при выполнении хирургического вмешательства;
- физический - высушивание брюшины воздухом, воздействие высокой температуры (ожоги) при использовании во время операции электроножа, лазерного излучения, плазменного скальпеля, горячих растворов;
- инфекционный - проникновение инфекции в брюшную полость эндогенным (воспаление органа брюшной полости с развитием местного и общего воспаления брюшины) и экзогенным (при ранении, прободении, вскрытии полого органа) путем;
- имплантационный - асептическое воспаление брюшины в результате оставления в брюшной полости инородных тел (тампонов, полотенец, дренажных трубок, инструментов), влияния нерассасывающегося или длительно рассасывающегося шовного материала, кусочков марли, талька с перчаток, кровоизлияний и гематом брюшины в результате использования тупых и не атравматических игл;
- химический - попадание или использование во время операции веществ, вызывающих химический ожог и асептическое воспаление брюшины (йод, спирт, концентрированные растворы антибиотиков, фурацилина, препараты для химиотерапии и др.).
Все перечисленные выше этиологические факторы в отдельности, а чаще в совокупности, являются пусковым механизмом в развитии воспалительного процесса, в результате которого высвобождается множество химических посредников в месте повреждения и возникает патофизиологический каскад определенных событий. Макрофаги, мезотелиоциты и фибрин играют основную роль в этом каскаде.
До операции в брюшной полости присутствует небольшое количество жидкости, содержащей макрофаги и белки плазмы с высокой концентрацией фибриногена [9]. После операции увеличивается число и меняется функция макрофагов. Эти послеоперационные макрофаги полностью отличаются от резидентных макрофагов и выделяют разнообразные вещества, включая метаболиты циклооксигеназы и липоксигеназы, активатор плазминогена, ингибитор активатора плазминогена (PAI), коллагеназу, эластазу, интерлейкины (IL) -1 и -6, фактор некроза опухолей альфа (TNFα), лейкотриен B4, простагландин E2 и др. (C. Drollette, S. Badawy, 1992).
Примитивные стволовые клетки из субмезотелиального слоя, кровотока, брюшной полости или дедифференцированных макрофагов мигрируют на поверхность и дифференцируются в мезотелиоциты. Эти мезотелиальные клетки, позднее в ответ на цитокины и другие секретируемые макрофагами медиаторы, формируют маленькие островки, которые вырастают в слои мезотелиальных клеток на поврежденной области, что приводит к ремезотелизации брюшины. Организация фибриновой гелевой матрицы играет важнейшую роль в образовании спаек. Эта матрица образуется в несколько этапов, начиная с фибрина и фибрина-мономера, переходящего в растворимый полимер фибрина, и, наконец, вследствие промывания тканей во время операции растворами, становящегося нерастворимым полимером фибрина. Этот последний продукт взаимодействует с белками, включая фибронектин, и образует фибриновую гелевую матрицу. Гелевая матрица содержит лейкоциты, эритроциты, тромбоциты, эндотелий, мастоциты, а также осколки клеток. Две перитонеальные поверхности, расположенные напротив друг друга и покрытые фибриновой гелевой матрицей, образуют спайку не только сразу после хирургического повреждения, но и в течение следующих 3-5 дней [9].
Предполагается, что перитонеальная фибринолитическая активность играет важную роль в патофизиологии образования спаек. Тканевый активатор плазминогена (tPA), обнаруживаемый в мезотелиальных клетках и макрофагах, представляет собой важную естественную защиту против послеоперационного спайкообразования. Активный фермент плазмин, который образуется из неактивного плазминогена под воздействием tPA и активатора плазминогена урокиназного типа, расщепляет фибриновую гелевую матрицу на осколки фибрина, которые не способствуют образованию спаек. Фибринозные спайки растворяются, если местный фибринолиз достаточен; однако, если он неадекватен, это может привести к образованию соединительной ткани и развитию спаек [18]. Дополнительное ингибирование фибринолиза может происходить вследствие выработки специфических ингибиторов активатора плазминогена (PAI1 и PAI2), которая стимулируется ишемией, инфекцией и инородными телами. В местах хирургического или воспалительного повреждения повышенные уровни PAI1 и PAI2 не дают tPA и урокиназному активатору плазминогена стимулировать плазмин к удалению фибриновой гелевой матрицы.
Недостаточное кровоснабжение и сниженная оксигенация тканей, часто отмечаемые при хирургическом повреждении, подавляют фибринолиз и уменьшают фибринолитическую активность, позволяя действовать элементам пролиферации соединительной ткани, приводящим к развитию волокнисто-сосудистых спаек [9]. Далее, спайки созревают в фиброзные тяжи, содержащие коллагеновые и эластиновые волокна, кровеносные сосуды, нередко покрытые мезотелиальными клетками [10].
В последние годы активно обсуждается вопрос о генетической предрасположенности к образованию спаек. По мнению ряда исследователей [4], повышенная наклонность к развитию спаек в брюшной полости связана с конституциональными особенностями организма. Исследования фибриллогенеза за последние 15 лет позволили выявить эти конституциональные факторы и по-иному взглянуть на развитие спаечного процесса, его профилактику и лечение. Стало известно, что ингибирование активного центра фермента лизилоксидазы должно влиять на фибриллогенез и, следовательно, на образование рубцов и спаек.
Фибриллогенез соединительной ткани в основном определяется генетически детерминированным полиморфизмом по фенотипу N-ацетилтрансферазы - конституционального фермента, по активности которого в организме люди делятся на две группы: с фенотипом быстрого и медленного ацетилирования. У людей с фенотипом быстрого ацетилирования биосинтез внеклеточного компонента соединительной ткани превалирует над ее катаболизмом, т.е. процесс образования спаечных сращений превалирует над процессом их лизиса. При нанесении таким больным травмы в брюшной полости развивается выраженный спаечный перивисцерит. И, наоборот, у людей с фенотипом медленного ацетилирования замедлен биосинтез внеклеточного компонента соединительной ткани по сравнению с ее катаболизмом. При нанесении травмы брюшной полости этим больным спаечный процесс (даже при повторных травмах) незначительный или вовсе отсутствует.
Таким образом, причиной повышенной склонности к спайкообразованию является ацетилирующая активность организма; в то время как повреждение брюшины, операция, воспаление и т.п. являются лишь неспецифическими разрешающими факторами, «пусковым механизмом» чрезмерного биосинтеза внеклеточного компонента соединительной ткани.
Классификация спаек
С расширением показаний к повторной (second-look) лапароскопии появилась возможность объективно оценивать результаты хирургического лечения женщин в гинекологии, оперированных с применением лапароскопического или лапаротомного доступов. На протяжении последних десятилетий Американским обществом репродукции (AFS) проводилось внедрение и усовершенствование классификации тазовых спаек для оценки степени тяжести спаечного процесса органов малого таза (classification AFS, R-AFS, 1988). При этом для объективизации полученных данных в настоящее время используется классификационная система R-AFS, предусматривающая прогностическую классификацию перитубарных и периовариальных спаек, основанная на их лапароскопической оценке на основе суммы баллов (табл.1, рис. 2). Рисунок 2. Оценка степени тяжести спаечной болезни органов малого таза в соответствии с классификацией R-AFS.
Так, при сумме баллов от 0 до 5 спайки оцениваются как минимальной степени тяжести; от 6 до 10 - средней степени тяжести; от 11 до 20 - умеренной степени и от 21 до 32 - тяжелой степени. При этом также дается прогноз зачатия с последующим рождением живого ребенка, основанный на оценке состояния придатка с наименьшей суммарной патологией при контрольной лапароскопии.
Диагностика спаечного процесса
Остается актуальным вопрос об объективизации диагностики спаечного процесса. В настоящее время «золотым» стандартом предоперационной диагностики является ультразвуковое исследование и магнитно-резонансная томография.
Спайки после полостных операций
Полостными операциями называют группу хирургических вмешательств, выполняемых на органах, расположенных в полостях тела: брюшной полости, грудной полости. Полости тела отграничены особыми защитными барьерами: брюшная полость - брюшиной, грудная полость - плеврой. При хирургических вмешательствах эти барьеры неминуемо нарушаются, что может сопровождаться развитием спаечного процесса в них.
Хирургия живота или брюшной полости иначе называется абдоминальная хирургия. Абдоминальная хирургия направлена на лечение заболеваний желудка и двенадцатиперстной кишки, печени и поджелудочной железы, кишечника, аппендицита и т.д. Исходная патология, объем оперативного вмешательства, хирургические техники определяют риск развития и выраженность спаечного процесса.
Хирургия грудной полости называется торакальная хирургия. Торакальная хирургия направлена на хирургическое лечение органов грудной полости: лёгких, трахеи, бронхов, пищевода, средостения. Хирургия сердца и крупных сосудов, расположенных в средостении, стала отдельным направлением, выделенным из торакальной хирургии.
Профилактические меры
Предупреждение образования спаек после полостных операций — сложная задача, решение которой достигается совместными усилиями пациентов и хирургов.
Предупреждение развития спаек достигается применением малоинвазивных техник хирургического вмешательства, тщательным гемостазом и профилактикой инфекционных осложнений с помощью антибиотиков. В послеоперационном периоде важна ранняя активация пациента, дыхательная гимнастика, контроль моторики кишечника, проведение противовоспалительной терапии и терапии, направленной на улучшение микроциркуляции. Пациенту рекомендуется выполнять ЛФК, после некоторых видов хирургического лечения назначается физиотерапия.
Осуществление даже всех вышеперечисленных методов реабилитации после полостной операции не является гарантией профилактики развития спаек. Некоторые пациенты, например, имеют генетическую предрасположенность к высокой активности роста соединительной ткани. Именно поэтому меры по предотвращению развития спаек необходимо предусмотреть заранее и применить их во время проведения операции.
Применение хирургом во время операции противоспаечного барьера снижает риск образования спаек.
Использование противоспаечных барьеров
Противоспаечный барьер, используемый во время операции, предотвращает слипание раневых поверхностей и последующее их срастание.
В брюшной полости наиболее рационально применение противоспаечного барьера в виде геля, т.к. гель способен обволакивать сложные анатомические образования, чего не может выполнить плёнка, например. Гиалуроно-содержащий противоспаечный гель Антиадгезин доказал свою эффективность в абдоминальной хирургии в клинических исследованиях. Гиалуроновая кислота в составе геля Антиадгезин оказывает противовоспалительный эффект и способствует лучшей регенерации повреждённых тканей. Антиадгезин безопасен, так как стерилен, не обладает иммуногенным или токсическим эффектом. После выполнения своей функции гель биодеградирует под действием собственных ферментов организма и макрофагов.
В торакальной хирургии возможно применение барьеров только в форме геля. Введённый в плевральную полость противоспаечный гель распределяется между листками плевры в результате дыхательных движений лёгких. Сложность анатомических образований средостения также позволяет использовать только гелевую форму противоспаечного барьера.
Однако противоспаечные барьеры используются только в случае так называемых «чистых» операций. В гнойной хирургии после проведения операции всегда оставляются дренажи, по которым проводится отток содержимого полости и возможно промывание стерильными растворами. Противоспаечные барьеры в гнойной хирургии противопоказаны, однако они могут быть применены в отсроченных реконструктивно-пластических операциях, которые проводят в так называемых «чистых» условиях.
В период реабилитации после полостных операций хирурги также рекомендуют:
Читайте также:
- Нарушение жирового обмена при диабете. Поражение сосудов при сахарном диабете
- Признаки доброкачественного образования полости рта
- Клинические проявления пневмококковых поражений. Клиника пневмококковой инфекции. Классическая пневмококковая пневмония. Стрептококковые менингиты. Гематогенные пневмококковые поражения.
- Рентгенограмма, КТ, МРТ при конденсационном остеите
- Применение теоремы сохранения массы к случаям сужения поперечного сечения потока в эхокардиографии (ЭхоКГ)
