Рак молочной железы у беременной - частота, течение
Добавил пользователь Евгений Кузнецов Обновлено: 22.01.2026
В отделении радиохирургии Российского онкологического научного центра им. Н.Н. Блохина оказывают помощь беременным женщинам с диагнозом рак молочной железы на любом сроке. Здесь проводятся все этапы диагностики, лекарственного и хирургического лечения.
Интересно, что более 80 % пациенток отделения полагали, что заболеть раком во время беременности нельзя. К сожалению, и врачи женских консультаций нередко расценивают жалобы женщин «как естественное состояние молочных желез в период беременности и лактации» либо ставят ошибочные диагнозы, наиболее частый из которых - «мастит». В результате к моменту определения правильного диагноза заболевание переходит в неоперабельную стадию.
Часто ли выявляют рак молочной железы у беременных, какова роль наследственности в появлении заболевания, как не пропустить и как правильно диагностировать рак, а главное, можно ли пройти лечение и родить малыша? Об этом нашему корреспонденту рассказывает старший научный сотрудник отделения радиохирургии РОНЦ им. Н.Н. Блохина докт. мед. наук А.А. Пароконная.
- В США ежегодно регистрируется порядка 3,5 тыс. случаев рака молочной железы у беременных. В России статистики, посвященной этой проблеме, нет. Но в одном РОНЦ врачи ежемесячно диагностируют 3-4 случая этого заболевания у беременных, такова же частота выявления болезни и у лактирующих женщин. Можно представить, что в масштабах страны это немалые цифры. Все больше женщин планируют беременность после 30-35 лет. Одновременно растет число женщин, заболевших раком молочной железы в молодом возрасте. Сближение этих групп может привести в ближайшие годы к росту заболеваемости у беременных и лактирующих женщин.
- Отличаются ли причины возникновения рака груди на фоне беременности от таковых у небеременных женщин?
- Факторы риска развития опухоли, видимо, те же: это и раннее начало менструаций, и нерегулярный менструальный цикл, и поздний возраст первой беременности. Отсутствие лактации сопровождается повышением риска возникновения рака молочной железы в 1,5 раза. Пролиферативные формы (интенсивно растущие) фиброзно-кистозной болезни и различных доброкачественных опухолей молочных желез, травмы , лактационные маститы - в 2 раза. Это в равной степени относится ко всем женщинам. Чрезвычайно высока вероятность развития рака у носительниц мутаций генов BRCA1/2 - 80-95% на протяжении всей жизни.
- Беременность и роды влияют на риск развития рака у носительниц мутаций генов BRCA1/2?
- Еще нет единой концепции, позволяющей однозначно ответить на этот вопрос. Но уже известно, что ранние роды, которые являются общепризнанным фактором защиты от рака молочной железы, не оказывают такого же действия у женщин, имеющих мутации BRCA1/2. Рожавшие женщины-носительницы мутаций в 1,7 раза чаще заболевают раком в возрасте до 40 лет, чем нерожавшие. И каждая беременность у них ассоциируется с повышением риска заболеть в возрасте до 40 лет. Семейная история рака молочной железы встречается в 2,5-3 раза чаще среди беременных и лактирующих пациенток, чем среди небеременных больных.
- Известен ли какой-то специфический фактор риска, который заметно повышается только на фоне беременности?
- Этот вопрос активно изучается, но ответа на него пока нет. А потому заранее предсказать, какой из этих факторов риска «сработает» на фоне беременности, пока невозможно. Есть случаи, когда после 2-х, 3-х благополучно завершившихся беременностей, во время следующей диагностируется рак. Вероятнее всего опухоль уже существовала какое-то время и не была ранее выявлена, а доступных для клинической оценки размеров достигла лишь к этому времени. Если бы мы могли с высокой степенью достоверности прогнозировать развитие рака в той или иной группе женщин, проблем у онкологов было бы значительно меньше. Но основываясь на интуиции онколога, много лет работающего по этой теме, я выделю два наиболее грозных фактора риска у беременной женщины: возраст наступления беременности после 30 лет и наличие генетической предрасположенности.
- И если мы говорим о женщинах из этой группы риска, то нужны ли им, если они планируют беременность, специальные обследования в плане профилактики рака молочной железы, в том числе анализ на мутации гена BRCA1/2?
- Если женщина планирует беременность после 30 лет, естественно, что она должна достаточно ответственно к этому подготовиться, пройти обследование у различных специалистов, в том числе и у маммолога. Специалист с учетом жалоб, опроса, осмотра, определяет необходимость дополнительных мероприятий: УЗИ молочных желез или маммографии, необходимость консультации онкогенетика при установленной семейной предрасположенности. Признаки такой предрасположенности - случаи рака молочной железы или яичников в семейной истории женщины.
- Расскажите, пожалуйста, об особенностях обследования маммологом беременных и лактирующих женщин?
- «Золотой стандарт» диагностики при подозрении на рак молочной железы: пальпация и осмотр, УЗИ, маммография, пункция образования и биопсия. Однако, мы знаем, что во время беременности объем груди, консистенция меняются, поэтому пальпация и внешний осмотр могут привести к ложному диагнозу. Маммография возможна при адекватной защите плода, но при беременности она малоинформативна, так как в 25% случаев дает ложноотрицательную картину. УЗИ наиболее подходящий для диагностики рака у беременных метод. Он позволяет различить кисты и подозрительные опухоли у 97% пациенток и гарантированно безопасен для плода.
Точно сказать, является ли опухоль злокачественной или нет, можно только после проведения биопсии - взятия тканей (гистологическое исследование) и клеток (цитологическое исследование) для дальнейшего изучения под микроскопом. Для этого используют тонкую (тонкоигольная биопсия) или толстую (кор-биопсия) иглы. С помощью тонкоигольной биопсии можно получить материал для цитологического исследования, с помощью кор-биопсии — и для цитологического, и для гистологического исследований. Цитологическое исследование материала во многом зависит от опыта работы цитолога и нередко дает ложноположительную картину рака. При подозрении на рак у беременной мы сразу выполняем кор-биопсию. Это позволяет точно поставить диагноз и определить «биологический подтип» опухоли, на основании которого строится все дальнейшее лечение и определяется прогноз болезни.
- Что бы вы посоветовали женщинам, у которых еще до беременности появились признаки «неблагополучия» в молочной железе?
- Если у женщины в семье есть случаи рака молочной железы или яичников, или она стоит на учете у онколога по поводу фиброзно-кистозной болезни, оперирована ранее по поводу узловой формы фиброаденомы, и возраст не юный, ей следует обдуманно подходить к зачатию. Для начала ей необходимо посетить онколога, выполнить УЗИ молочных желез, маммографию (после 39 лет), проконсультироваться с онкогенетиком.
В случае подготовки к ЭКО все вышеперечисленные мероприятия должны быть проведены в строго обязательном порядке, а если женщина при этом имеет неоперированную доброкачественную опухоль или новообразование в молочной железе неясной структуры, ей обязательно нужно обратиться к хирургу до начала всех «репродуктивных мероприятий».
- От каких факторов зависит лечебная тактика у беременных?
- Ее выбор зависит прежде всего от желания женщины сохранить беременность, срока беременности, стадии и распространенности опухолевого процесса. Для онколога, важны «обстоятельства» конкретной болезни - стадия и ожидаемый прогноз. Для будущей мамы чаще приоритетом является жизнь ребенка, ради рождения которого она готова отказаться от лечения. Но отказ от лечения почти не оставляет шансов самой женщине. К счастью, сегодня онкологи начиная с 12-13 недели беременности могут применять все необходимые для лечения рака методы: и радикальную операцию, и адекватную стадии заболевания химиотерапию. Исключение составляет лучевая терапия, хотя, например, в Онкологическом институте Милана (Италия) беременным проводят лучевую терапию в первом триместре. Но группа наблюдаемых больных еще не велика.
На конгрессе Европейского общества медицинских онкологов (ESMO) в Мадриде в 2014 г. обсуждались результаты международного исследования, посвященного здоровью детей разного возраста, родившихся после внутриутробной химиотерапии. Проверялись их умственные способности и слух, деятельность сердечно-сосудистой системы. Обследованные дети не отличались от ровесников по исследуемым показателям.
- Расскажите, пожалуйста, об опыте РОНЦ.
- В отделении радиохирургии нашего центра, которым заведует профессор М.И. Нечушкин, помощь беременным больным оказывают на любом сроке. Здесь проводятся все этапы диагностики, лекарственного и хирургического лечения. Подчеркну, что речь идет о двух жизнях - матери и плода. У нас сложилась команда врачей различных специальностей: лечение рака проводят онкологи, а наблюдение и ведение беременности - акушеры. Наше отделение сотрудничает с Научным центром акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова.
Но подобная схема пока возможна лишь в крупных научных медицинских центрах, где есть необходимые диагностические и лечебные ресурсы. К сожалению, лечение больных раком в учреждениях акушерского профиля приводит к плачевным результатам. Сотрудники акушерских стационаров проводят операции на молочной железе, не имея лицензии на онкологическую помощь и не соблюдая всех правил, принятых у онкологов. Выполняются заведомо нерадикальные операции, хирургический этап осуществляется без предоперационной лекарственной терапии. А после выписки женщина отправляется в «свободное плаванье». Это абсолютно недопустимая практика. Ведь помимо длительного лечения, онкологические больные требуют и реабилитации, наблюдения с использованием специальных иногда радиологических методов диагностики, что, разумеется, не может предложить никакой акушерский и гинекологический центр.
С 2009 года и до декабря 2015 г. в нашем отделении 39 пациенток уже получили химиотерапию в составе комбинированного лечения с последующим родоразрешением, 2 женщины- в процессе химиотерапии. Ни у одного из родившегося затем в Центре Акушерства и Гинекологии им. акад В.И. Кулакова ребенка не было отмечено пороков развития. Если позволяет стадия заболевания, мы максимально продлеваем лечение до нормальных сроков родоразрешения, чтобы избежать осложнений, связанных с маловесностью и недоношенностью плода.
Рак молочной железы у беременных
Рак молочной железы у беременных — это злокачественная неоплазия груди, выявленная на фоне гестации, лактации или в течение 12 месяцев после родов. Проявляется узловым или диффузным уплотнением грудных желез, их тяжестью и болезненностью, дискомфортом, болью в области ареолы, выделениями из соска, локальными изменениями кожи, увеличением аксиллярных лимфоузлов. Диагностируется при помощи УЗИ, трепанобиопсии, МРТ молочных желез. В период гестации используются хирургические методы лечения (обычно модифицированные варианты радикальной мастэктомии), химиотерапия по схеме AC. После родов терапию дополняют гормональными препаратами и лучевыми методиками.
МКБ-10
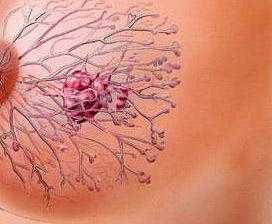
Общие сведения
Злокачественные опухоли молочных желез — второй по распространенности вид неоплазий, диагностируемых у беременных. Их встречаемость составляет 1:3 000 — 1:10 000 гестаций. Средний возраст женщин, у которых диагностирован рак грудной железы, ассоциированный с беременностью, — составляет 33 года. До 82% пациенток выявляют новообразование самостоятельно в I триместре, при этом практически в 3/4 случаев диагностируются поздние стадии неоплазии с размерами опухоли от 6 до 15 см, а у каждой пятой беременной обнаруживаются метастазы во внутренних органах. Из-за несвоевременной диагностики заболевания задержка начала лечения в среднем составляет 2-3,5 месяца.
Причины
Этиология злокачественных неоплазий при гестации является такой же, как у небеременных женщин. В 5-10% случаев развитие рака обусловлено наследуемой мутацией генов BRCA1/BRCA2. У остальных пациенток новообразование возникает на фоне дисгормональных состояний, воздействий неблагоприятных факторов окружающей среды (мутагенных химических веществ, радиации и пр.), недостаточности иммунитета. Как правило, опухоли, выявляемые в грудных железах беременных, возникают до зачатия, однако их рост может ускориться на фоне физиологических гестационных изменений. По мнению специалистов в сфере онкологии и акушерства, специфическими провоцирующими факторами быстрого онкогенеза при беременности являются:
- Гормональная перестройка. Более чем в 70% случаев рак груди у беременных является эстроген-зависимым (ER+). При гестации уровень эстрогенов в крови возрастает почти в 30 раз. Под влиянием гормонов происходит подготовка молочных желез к лактации: грудь набухает, в ней увеличивается количество альвеол, молочных протоков. Гиперэстрогенная стимуляция может способствовать более быстрому развитию раковых клеток.
- Снижение иммунитета. Поскольку генетически плод чужероден материнскому организму, физиологические изменения в иммунной системе беременных направлены на снижение общей реактивности. За счет увеличение числа Т-супрессоров, уменьшения уровня Т-хелперов, появления блокирующих антител подавляется эффекторное звено иммунитета. В результате иммунная система хуже выявляет и уничтожает собственные перерождающиеся клетки.
Патогенез
Вероятный механизм развития рака молочной железы у беременных основан на стимуляции роста трансформированных клеток эстрогенами и прогестероном. Усиленное эстрогенное воздействие индуцирует синтез факторов роста, под влиянием которого пролиферируют эпителиальные клетки грудных желез, в том числе злокачественной опухоли. Одновременно тормозится клеточный апоптоз, за счет индуцированной транскрипции фактора роста сосудистого эндотелия начинается патологическая неоваскуляризация.
Поскольку эстрогены способны нивелировать действие ингибирующих факторов роста, включается отрицательная обратная связь, стимулирующая клеточную гиперплазию. Одним из эстрогенных эффектов является быстрое увеличение числа микрометастазов, вызванное стимуляцией так называемых спящих метастатических образований. Роль прогестерона в онкогенезе неоплазий молочных желез еще уточняется. Его эффекты могут быть связаны с поддержанием циклической пролиферации железистых клеток при гестации и стимуляции роста с потенциальным видоизменением ответа нормального и перерожденного железистого эпителия.
Классификация
Систематизация форм рака груди во время беременности основана на тех же критериях, что и вне гестационного периода, — анатомическом расположении неоплазии, ее размерах, особенностях метастазирования в лимфатические узлы и отдаленные органы, гистологическом строении, уровне клеточной дифференцировки, типе экспрессируемых рецепторов малигнизированных клеток. Наиболее значимую роль в разработке оптимальной тактики сопровождения беременности играет классификация опухоли по стадиям развития. Онкомаммологи различают:
- Неинвазивный рак (карциномаinsitu). Неоплазия локализована в молочном протоке или дольке. Лимфоузлы интактны. Клиника отсутствует. Рак становится случайной находкой при плановом обследовании. Наиболее благоприятная форма. Возможно продолжение гестации после оперативного лечения.
- РакIстадии. Максимальный поперечник новообразования не превышает 2 см. Неоплазия прорастает в окружающие ткани груди, но не метастазирует. Может определяться клинически в виде узлового уплотнения. Проведение хирургического вмешательства позволяет сохранить беременность.
- РакIIстадии. При IIA стадии опухоль имеет размеры до 2 см с метастазированием в аксиллярные лимфоузлы на стороне поражения или до 5 см без метастазов. При раке IIB стадии размеры неоплазии составляют 2-5 см при наличии метастазов в лимфоузлы или от 5 см и более — при их отсутствии. Для сохранения гестации показана радикальная мастэктомия.
- РакIIIстадии. Опухоль разрастается до 5 и более сантиметров либо отмечаются конгломераты спаянных подмышечных лимфатических узлов, прорастание рака в кожу молочной железы, ткани грудной клетки, поражение подключичных и надключичных лимфоузлов. Возможны отдаленные метастазы.
- РакIVстадии. Отмечается массивное поражение молочной железы с прорастанием окружающих тканей, диссеминацией в кожу, изъязвлениями. Возможно вовлечение в процесс второй груди, подмышечных лимфоузлов на противоположной стороне. Характерны множественные отдаленные метастазы.
При III-IV стадиях онкопроцесса по желанию пациентки и ее родственников допустимо сохранение гестации с досрочным родоразрешением в сроки достаточной жизнеспособности ребенка. В таких случаях выполнение радикального оперативного вмешательства позволяет приостановить распространение опухоли и начать активную терапию в послеродовом периоде. Назначение некоторых химиопрепаратов возможно с 15-й недели гестации.
Симптомы РМЖ у беременных
Хотя гестационные физиологические изменения тканей усложняют выявление злокачественного объемного образования, существуют маркерные признаки, повышающие онконастороженность. О развитии рака может свидетельствовать появление в одной из молочных желез узла или неоформленного уплотнения, болезненности и тяжести. У некоторых пациенток на фоне общего нагрубания асимметрично изменяется форма пораженной грудной железы, на коже возникают неровности, участки втяжений или локальной отечности.
Часто отмечается покалывание, боли в сосково-ареолярной области, может втягиваться сосок, появляются сукровичные выделения. При наличии регионарных метастазов в подмышке на пораженной стороне определяются увеличенные лимфатические узлы, в более тяжелых случаях лимфоузлы прощупываются над и под ключицей, в противоположной аксиллярной впадине. Признаки общей интоксикации в виде потери аппетита, снижения веса, нарастающей слабости и быстрой утомляемости характерны только для терминальных стадий болезни.
Осложнения
Рак грудных желез, возникающий у беременных, может быстро прогрессировать и осложняться метастазированием. Распространенные формы заболевания выявляются у 72-85% пациенток, у 20% женщин внутренние органы поражены метастазами. В некоторых случаях развивается воспаление тканей, окружающих опухоль. По мнению большинства акушеров-гинекологов, рак груди не оказывает негативного воздействия на ребенка, однако на поздних стадиях заболевания при наличии опухолевой интоксикации возможна гипоксия плода. Применение во II-III триместрах химиотерапевтических препаратов способно спровоцировать преждевременные роды, миелосупрессию у женщины и ребенка, задержку развития плода, мертворождение, массивные послеродовые кровотечения, инфекционные осложнения (эндометрит, хориоамнионит и др.).
Диагностика
Поскольку беременные женщины часто расценивают начальные признаки опухоли как специфические изменения молочных желез перед лактацией, рак груди при гестации обычно диагностируется на более поздних стадиях. Диагностически значимые радиологические методы исследования при беременности применяются ограниченно из-за возможного негативного влияния на плод, однако другие современные методики позволяют выявить опухоль и правильно оценить стадию онкопроцесса. Наиболее информативными при обнаружении злокачественной неоплазии груди являются:
- Маммосонография. УЗИ молочных желез - оптимальный метод скрининговой диагностики злокачественных опухолей у беременных и лактирующих женщин. Информативность ультрасонографии, дополненной цветовой и энергетической допплерографией, достигает 97%. Обычно на УЗИ рак выглядит как гиперваскуляризированное гипоэхогенное образование неправильной формы и неоднородной структуры. С помощью ультразвука удобно исследовать регионарные лимфоузлы.
- Трепанобиопсия молочной железы. Материал, полученный с помощью биопсийного пистолета, используют для определения морфологической структуры новообразования и его иммуногистохимического профиля (рецепторного статуса, амплификации гена Her2-neu, пролиферативного индекса Ki-67 и др.). Трепанобиопсия обладает большей информативностью, чем пункционная биопсия, позволяет верифицировать диагноз в 99,0-99,8% случаев.
- Томография. МРТ молочных желез проводят при получении неоднозначных результатов сонографии. Послойная визуализация дает возможность максимально точно оценить размеры и распространенность неоплазии. МРТ всего тела рекомендована для выявления метастазов. В I триместре сканирование осуществляют с осторожностью из-за возможной кавитации и перегревания эмбриона. Контрастирование допускается в исключительных случаях.
Маммографию беременным с подозрением на рак груди назначают редко, что связано с возможным повреждающим воздействием на плод и получением в 25% случаев ложноотрицательных результатов. В качестве дополнительных методов обследования рекомендовано определение онкомаркера CA 15-3, цитология мазка, полученного из соска пораженной молочной железы, оценка риска развития BRCA-ассоциированного рака, дуктоскопия, радиотермометрия груди, электроимпедансная маммография. Заболевание дифференцируют с маститом, доброкачественными неоплазиями (кистами, аденомами, фиброаденомами, липомами, листовидными опухолями), галактоцеле, гамартомами, лимфомами, саркомами, туберкулезом. Кроме онкомаммолога пациентку по показаниям консультирует онколог, химиотерапевт, хирург, фтизиатр, инфекционист.
Лечение РМЖ у беременных
Если ранее выявление злокачественного новообразования груди служило достаточным основанием для прерывания беременности, в последние десятилетия применяют стратегии, предполагающие раннее начало терапии и сохранение гестации. Выбор врачебной тактики в каждом конкретном случае рака выполняется индивидуально с учетом стадии процесса, гестационного срока и решения беременной. В 1-м триместре при выявлении инвазивных форм опухоли беременность рекомендуется прервать медицинским абортом, во 2-3-м — при желании пациентки продлить до минимально возможного срока рождения жизнеспособного плода. После искусственного прерывания гестации лечение производится по стандартным протоколам онкологической помощи. При решении сохранить ребенка могут использоваться следующие варианты:
- Хирургическое лечение. Наиболее оправданным вмешательством при ранних стадиях рака является радикальная мастэктомия, при необходимости дополненная аксиллярной диссекцией без последующей лучевой терапии. Лампэктомия, квадрантэктомия, секторальная резекция груди выполняются реже. Онкопластические операции не рекомендованы. Объем и срок проведения вмешательства при поздних стадиях болезни определяются индивидуально.
- Назначение химиопрепаратов. Антинеопластические средства могут применяться после 14 недели гестационного срока. Чем позже начато медикаментозное лечение, тем меньше вероятность возникновения уродств у плода. Препаратами выбора являются алкилирующие цитостатики и антрациклиновые антибиотики. При распространенных формах рака используется неоадъювантная полихимиотерапия как подготовительный этап перед радикальной операцией.
Гормонотерапия, наиболее эффективная при рецепторо-позитивных формах рака, беременным не проводится из-за тератогенного влияния антагонистов эстрогенов. Назначение лучевой терапии возможно только после завершения гестации. Рекомендованным способом родоразрешения являются естественные роды. Кесарево сечение осуществляется только при наличии акушерских показаний или тяжелой экстрагенитальной патологии, несовместимой с родовыми нагрузками.
Прогноз и профилактика
Показатели выживаемости пациенток, у которых в период беременности было диагностировано злокачественное новообразование молочной железы, не отличаются от данных по группам небеременных женщин. Прерывание гестации не влияет на исход заболевания. Однако в целом прогноз является более серьезным, поскольку у беременных зачастую выявляются распространенные формы рака. Минимальный безопасный интервал от момента завершения лечения до следующей беременности, по данным разных авторов, составляет от 6 месяцев до 5 лет. Основная задача профилактики рака грудных желез — обнаружение опухоли на ранних стадиях при помощи скрининговых методов (УЗИ, маммографии).
1. Рак молочной железы и беременность/ Луд Л.Н., Луд Н.Г.// Вестник Витебского государственного медицинского университета. - 2008.
2. Рак молочной железы, ассоциированный с беременностью/ Никулина Л.Р., Кузьмичев Д.Е., Скребов Р.В., Чекашина Д.В.// Здравоохранение Югры: опыт и инновации. - 2016 - №3.
3. Рак молочной железы и беременность: особенности диагностики и лечения/ Иванова О.А., Жильцова Е.К., Иванов В.Г., Попова Р.Т., Ермоченкова А.М.// Злокачественные опухоли. - 2014.
4. Рак молочной железы и беременность. Современное состояние проблемы/ Пароконная А.А.// Практическая онкология. - 2009 - Т. 10, №4.
Материалы конгрессов и конференций
РМЖАБ наблюдается в 0,03% случаев среди беременных (1) и у 0,2-3,8% больных РМЖ (2). Под РМЖАБ понимается совпадение во времени беременности и выявления РМЖ, либо выявление РМЖ на фоне лактации или не позднее одного года после завершения беременности. Беременность может снижать риск развития РМЖ, а может провоцировать бурное прогрессирование этой опухоли. Потенциальный вред больной женщине от плода связан, прежде всего, с мощным эндокринным влиянием на опухоль. Вред для плода - это чаще всего ятрогенное воздействие, от кюретки гинеколога до химиотерапевтических препаратов. Метастатическое поражение плода при РМЖ не описано, хотя при меланоме и лимфоме оно наблюдалось (3).
1. Защитное действие беременности
Возраст первых родов - хорошо известный фактор, влияющий на заболеваемость РМЖ. Так, у женщин, имевших поздние первые роды (в возрасте старше 30 лет) или не имевших родов вообще, риск заболеть РМЖ в 2-3 раза выше, чем у рожавших до 20 лет (4). Каждые последующие роды в возрасте до 30 лет сопровождаются дальнейшим снижением риска развития РМЖ (5). Риск возникновения РМЖ в возрасте до 40 лет в 5,3 раза выше у женщин, рожавших в возрасте >30 лет по сравнению с рожавшими до 20 лет (6). Рожавшие женщины-носительницы мутаций BRCA1 или BRCA2 существенно чаще (в 1,71 раза) заболевают РМЖ в возрасте до 40 лет, чем не рожавшие. Каждая беременность у них ассоциируется с возрастанием риска возникновения РМЖ. Ранняя беременность не оказывает защитного действия у женщин, имеющих мутации BRCA1 или BRCA2 (7).
Лактация. Отсутствие лактации сопровождается повышением риска возникновения РМЖ в 1,5 раза (4). Позитивный защитный эффект лактации реализуется как у женщин репродуктивного периода, так и у находящихся в менопаузе, причём прослеживается обратная зависимость между общей длительностью лактаций и риском развития РМЖ (8, 9).
2. Диагностика рака молочной железы у беременных.
Трудности диагностики объективного (быстрый рост опухоли, изменение консистенции молочных желёз, осложнения лактации) и субъективного характера (психологическая неготовность больной и врача заподозрить РМЖ) приводят к запоздалой диагностике РМЖАБ, и лечение начинается при более распространённых стадиях болезни, чем у небеременных (10, 11, 12, 13).
В связи с опасностью лучевого воздействия на плод исключаются рентгенологические (кроме рентгенографии органов грудной клетки) и радионуклидные методы, а диагностика и определение стадии болезни основываются на ультразвуковом, магнитнорезонансном и гистологическом исследовании биопсийного материала (11, 14). Гиперпластические изменения ткани молочной железы на фоне беременности и лактации могут давать ложноположительную цитологическую картину РМЖ (15).
Определение уровня рецепторов эстрогенов в опухоли на фоне беременности биохимическим методом обычно даёт отрицательный результат, что отчасти связано с блокированием рецепторов эстрогенами, присутствующими в этот период в повышенных концентрациях. По данным иммуногистохимического исследования оказывается, что частота рецепторопозитивных опухолей у беременных не отличается от таковой у небеременных больных (16).
3. Лечение рака молочной железы, сочетающегося с беременностью.
Планирование лечения РМЖ после аборта или родов не отличается от такового у небеременных пациенток. Фактор бывшей беременности в таких случаях может учитываться как фактор плохого прогноза. Кормление молоком больной, получающей ХТ, ЛТ, эндокринную терапию не должно осуществляться.
При планировании лечения на фоне имеющейся беременности в каждом случае неизбежно обсуждение трёх тактических концепций:
1) концепция сохранения плода направлена на устранение каких-либо рисков для плода. Лечение РМЖ откладывается до естественного завершения беременности;
2) концепция спасения матери. Немедленное прекращение беременности (аборт, кесарево сечение, удаление матки с придатками) и начало лечения РМЖ.;
3) компромиссная концепция. РМЖ лечится без прерывания беременности так же, как и при её отсутствии, за исключением ХТ (не проводится в первый триместр беременности) и ЛТ (исключается на всём протяжении беременности).
Первая концепция обычно выдвигается больной. Выполнение органосохраняющей операции с отсрочкой ЛТ до послеродового периода связано с определённым риском, который весьма трудно оценить (17). Yip CH с соавторами описывают 6 больных РМЖ, выявленным на фоне беременности. Пять больных отказались от какого-либо лечения до наступления родов, одна согласилась только на операцию. На протяжении беременности наблюдалось прогрессирование болезни, и лечение было начато в более поздних стадиях, чем на момент диагностики. Все больные умерли в сроки от 14 до 52 месяцев (18).
Вторая концепция подразумевает немедленное прекращение беременности как источника гормональной стимуляции опухоли.
Предлагаем собственный опыт лечения РМЖАБ, проводившегося в 1961-1974 гг. в нашем Центре под руководством проф. О.В. Святухиной (10).
Проанализированы результаты лечения 47 больных раком молочной железы; стадия определена в соответствии с последней версией классификации TNM (19): I стадия - 2 больных, II стадия - 13 больных (T2N0M0 - 5, T1N1M0 - 2, T2N1M0 - 6), III стадия - 26 больных (T2-3N1-2M0 - 6, T4N0M0 - 1, T4N1M0 - 9, T4N2M0 - 10), IV стадия - 6 больных. У 26 из них лечению предшествовало прерывание беременности, у 2 больных - оперативное родоразрешение с двусторонним удалением придатков матки и ещё у 2 - пангистерэктомия. У 16 больных лечение начиналось на фоне лактации. Одной больной беременность была сохранена [РМЖ I стадии, возраст 35 лет, первая 24-недельная беременность, была выполнена радикальная резекция молочной железы (В.В. Вишнякова)]. У больных раком I, II и IIIa стадий лечение включало радикальную мастэктомию, двустороннее удаление придатков матки, ХТ тиофосфамидом и эндокринную терапию кортикостероидами или андрогенами. При раке IIIb стадии десяти больным проводилось аналогичное лечение; у девяти пациенток лечение включало ХТ, затем следовали радикальная мастэктомия, двустороннее удаление придатков матки, и профилактическая терапия; ещё у одной больной лечение началось с ЛТ, затем - радикальная мастэктомия, двустороннее удаление придатков матки, и профилактическая терапия.
Обе больные РМЖ I стадии прослежены без рецидива болезни 13 и 17 лет. Результаты лечения больных РМЖ II и III стадий представлены на графиках. Для РМЖ II стадии 5-летняя безрецидивная выживаемость и общая выживаемость составили 62±14% и 62±14%, 10-летние результаты - аналогичные. Для РМЖ III стадии 5-летняя безрецидивная выживаемость и общая выживаемость составили 38±10% и 46±9%, 10-летние результаты - 38±10% и 39±9% соответственно.
Третья из рассматриваемых нами концепций сформировалась на протяжении последних 20 лет. Предложение проводить противоопухолевое лечение беременным женщинам основывалось в основном на двух позициях. Во-первых, рядом исследований было показано отсутствие терапевтического эффекта аборта (20, 21, 22). Во-вторых, при оценке воздействия ХТ на плод было показано, что тератогенный эффект характерен при применении ХТ в первом триместре беременности, а ХТ, проводимая во втором и третьем триместрах, менее опасна для плода. Так, при проведении ХТ в первом триместре беременности частота врождённых уродств составляет 10-20%, возрастает частота спонтанных абортов. ХТ, проводимая во втором и третьем триместрах беременности, может осложниться преждевременными родами, миелосупрессией у матери и плода, кровотечением и инфекцией, задержкой роста плода, рождением мертвого плода (23, 11, 24, 25).
Практически не оцененными остаются риски возникновения рака, развития стерильности, мутаций половых клеток у людей, перенесших ХТ во внутриутробном периоде. Такая оценка произведена для лучевого воздействия у жителей Японии, подвергшихся атомным бомбардировкам. Наиболее частыми врождёнными аномалиями у лиц, облучённых во внутриутробном периоде, являются микроцефалия, умственная отсталость, задержка роста. Риск развития рака на протяжении жизни составляет 14% на 1 Гр облучения, а наследуемых болезней - 1% на 1 Гр (26).
24 больные РМЖАБ получали противоопухолевое лечение в M.D. Anderson Cancer Center. ХТ по схеме FAC проводилась амбулаторно с интервалом 3-4 недели после первого триместра беременности; в среднем было проведено 4 курса ХТ. Модифицированная радикальная мастэктомия была выполнена 18 больным, двум больным - органосохраняющая операция. Хирургическое лечение производилось в любом триместре беременности. ЛТ проводилась после родов. Осложнений от ХТ не наблюдали. Средний срок родов - 38 недель. Состояние новорожденных по всем показателям не отличалось от нормы (27).
Ibrahim E.M. с соавторами сообщают о 10 больных РМЖ, оперированных во время беременности, и о 7 больных, получавших ХТ во время второго или третьего триместров беременности; ЛТ на фоне беременности не проводили. У новорожденных не наблюдалось врождённых уродств. Результаты лечения РМЖАБ были такими же, как и в группе больных РМЖНАБ (12).
Выбор лечебной тактики у больных РМЖ на фоне беременности должен осуществляться индивидуально с участием онколога, акушера, больной и её родственников. При раке I и II стадий возможно выполнение операции во время любого триместра беременности, более надёжно выполнение модифицированной радикальной мастэктомии. Проведение профилактической ХТ в первом триместре беременности противопоказано.
При раке III стадии, выявленном в первом триместре беременности, возможности для лечения отсутствуют, В этой ситуации необходимо настаивать на прерывании беременности. Проведение предоперационной ХТ во втором и третьем триместрах беременности, по-видимому, возможно; при этом следует обсудить с пациенткой вопрос о необходимости длительного и тяжёлого лечения, проинформировать ее о плохом прогнозе и о нецелесообразности сохранения беременности. Аналогичный подход можно предложить и при диссеминированном РМЖ.
4. Прогноз при раке молочной железы, сочетающемся с беременностью.
По данному вопросу в литературе существует некоторое противоречие. Все согласны с тем, что РМЖАБ имеет худший прогноз, чем РМЖ в целом. Часть исследователей утверждает, что это обусловлено только большей распространённостью болезни, а в рамках одинаковых стадий течение болезни одинаково (10, 11, 28, 29); другие авторы считают, что даже в рамках одинаковых стадий беременность отягощает прогноз. Как и при анализе любого другого фактора прогноза, вывод будет зависеть от числа наблюдений, срока прослеженности, точности подбора групп сравнения и качества математического анализа. Рассматривая наши результаты лечения РМЖАБ III стадии, представленные в настоящей публикации, можно было бы сказать, что они не хуже результатов лечения РМЖ III стадии в целом в том же учреждении (10-летняя безрецидивная выживаемость 31,4±1,9%), (30), однако такой подход нельзя признать корректным.
Анализ отдалённых результатов лечения рака по материалам Memorial Sloan-Kettering Cancer Center показал, что 10-летняя общая выживаемость больных РМЖАБ I-IIа стадий составляет 73%, при РМЖНАБ - 74%. При раке IIIа стадии эти показатели составляют 0% и 35% соответственно (31). Кооперированное исследование, основанное на анализе 407 случаев РМЖ в возрасте от 20 до 29 лет, показало, что беременность повышает риск смерти больной в 2,83 раза вне зависимости от размера опухоли и числа поражённых лимфатических узлов. Каждое увеличение интервала между беременностью и выявлением РМЖ на 1 год снижает риск смерти на 15% (32).
Французское кооперированное исследование провело анализ влияния беременности у 154 больных РМЖАБ в сравнении с 308 больными РМЖНАБ. Показано, что беременность является независимым фактором, достоверно ухудшающим прогноз заболевания (33).
5. Беременность "после рака молочной железы".
В литературе практически отсутствуют сведения о повышении риска рецидива болезни, связанного с беременностью. Только Clark R.M. и Chua T. отмечали ухудшение выживаемости больных, забеременевших в течение 6 месяцев после завершения лечения по поводу РМЖ (22). Другие авторы не наблюдали ухудшения выживаемости больных РМЖ, имевших в последующем беременности (34-38). Collichio F.A. с соавт. сообщают, что сексуальная функция больных не зависит от объёма операции, а частота бесплодия пропорциональна возрасту больных, а также дозе применявшихся алкилирующих препаратов (39). Суждения же о минимальном безопасном интервале между лечением РМЖ и наступлением беременности колеблются от 6 месяцев до 5 лет (11).
Список литературы:
1. Kaiser HE, Nawab E, Nasir A, Chmielarczyk W, Krenn M. Neoplasms during the progression of pregnancy. In Vivo. 2000, 14, 1, 277-285.
2. Wallack M.K., Wolf J.A. Jr., Bedwinek J., et al. Gestational carcinoma of the female breast. Curr. Probl. Cancer, 1983, 7, 1.
3. PotterJ.F., Schoeneman M. Metastases of maternal cancer to the placenta and fetus. Cancer, 1970, 25, 380.
4. L.A.Brinton & S.S.Devesa. Incidence, Demographics, and Environmental Factors. In: Harris JR, Morrow M, Lippman ME, et al., eds.: Diseases of the Breast. Lippincott-Raven Publishers: Philadelphia, Pa, 1996, pp 159-168.
6. Tavani A, Gallus S, La Vecchia C, Negri E, Montella M, Dal Maso L, Franceschi S. Risk factors for breast cancer in women under 40 years. Eur J Cancer, 1999, 35, 9, 1361-1367.
7. Jernstrom H, Lerman C, Ghadirian P, et al. Pregnancy and risk of early breast cancer in carriers of BRCA1 and BRCA2. Lancet, 1999, 354(9193), 1846-1850.
8. Newcomb PA Lactation and breast cancer risk. J Mammary Gland Biol Neoplasia, 1997, 2, 3, 311-318.
9. Newcomb PA, Egan KM, Titus-Ernstoff L, et al. Lactation in relation to postmenopausal breast cancer. Am J Epidemiol 1999, 150, 2, 174-182.
10. Е.Б. Кампова-Полевая. Рак молочной железы у молодых женщин. Дисс. … к.м.н. Москва, 1975, 239с.
11. Petrek J.A. Breast cancer and pregnancy In: Harris JR, Morrow M, Lippman ME, et al., eds. Diseases of the Breast. Lippincott-Raven Publishers: Philadelphia, Pa, 1996, 883-892.
12. Ibrahim EM, Ezzat AA, Baloush A, et al. Pregnancy-associated breast cancer: a case-control study in a young population with a high-fertility rate. Med Oncol, 2000, 17, 4, 293-300.
13. Wohlfahrt J, Andersen PK, Mouridsen HT, Melbye M. Risk of late-stage breast cancer after a childbirth. Am J Epidemiol, 2001, 153, 11,1079-1084.
14. Nicklas AH, Baker ME. Imaging strategies in the pregnant cancer patient. Semin Oncol, 2000, 27, 6, 623-632.
15. Mitre BK, Kanbour AI, Mauser N. Fine needle aspiration biopsy of breast carcinoma in pregnancy and lactation. Acta Cytol, 1997, 41,4, 1121-1130.
16. Elledge R.M., Ciocca D.R., Langone G., et al. Estrogen receptor, progesterone receptor, and HER-2/neu protein in breast cancers from pregnant patients. Cancer ,1993,71,8,2499-2509.
17. Nettleton J., Long J., Kuban D., et al. Breast cancer during pregnancy: quantifying the risk of treatment delay. Obstetrics and Gynecology 1996, 87,3, 414-418.
19. TNM classification of Malignant Tumors. Fifth edition,1997, Willey-Liss, 227p.
20. King R.M., Welch J.S., Martin J.L., et al. Carcinoma of the breast associated with pregnancy. Surg. Gynecol. Obstet., 1985, 160, 228.
21. Nugent P., O`Connell T.X. Breast cancer and pregnancy. Arch. Surg., 1985, 120, 1221.
22. Clark R.M., Chua T. Breast cancer and pregnancy: the ultimate challenge. Clin.Oncol. 1989, 1, 11.
23. Schapira D.V., Chudley A.E., Successful pregnancy following continuous treatment with combination chemotherapy before conception and throughout pregnancy. Cancer, 1984, 54, 800.
24. Buekers TE, Lallas TA. Chemotherapy in pregnancy. Obstet Gynecol Clin North Am, 1998, 25, 2, 323-329.
25. Giacalone PL, Laffargue F, Benos P. Chemotherapy for breast carcinoma during pregnancy: A French national survey. Cancer, 1999, 86, 11, 2266-2272.
26. Greskovich JF Jr, Macklis RM. Radiation therapy in pregnancy: risk calculation and risk minimization. Semin Oncol, 2000, 27, 6, 633-645.
27. Berry DL, Theriault RL, Holmes FA, et al. Management of breast cancer during pregnancy using a standardized protocol. J Clin Oncol, 1999, 17, 3, 855-861.
28. Ezzat A, Raja MA, Berry J, et al. Impact of pregnancy on non-metastatic breast cancer: a case control study. Clin Oncol (R Coll Radiol) 1996, 8, 6, 367-370.
29. Gemignani ML, Petrek JA, Borgen PI. Breast cancer and pregnancy. Surg Clin North Am, 1999, 79, 5, 1157-1169.
30. Летягин В.П., Лактионов К.П., Высоцкая И.В., и др. Рак молочной железы, 1996, 150.
31. Anderson BO, Petrek JA, Byrd DR, Senie RT, Borgen PI. Pregnancy influences breast cancer stage at diagnosis in women 30 years of age and younger. Ann Surg Oncol, 1996, 3, 2, 204-211.
32. Guinee VF, Olsson H, Moller T, et al. Effect of pregnancy on prognosis for young women with breast cancer. Lancet, 1994, 343 (8913), 1587-1589.
33. Bonnier P, Romain S, Dilhuydy JM, et al. Influence of pregnancy on the outcome of breast cancer: a case-control study. Int J Cancer, 1997, 72, 5, 720-727.
34. Lethaby AE, O'Neill MA, Mason BH, et al. Overall survival from breast cancer in women pregnant or lactating at or after diagnosis. Int J Cancer, 1996, 67, 6, 751-755.
35. Malamos NA, Stathopoulos GP, Keramopoulos A, Papadiamantis J, Vassilaros S. Pregnancy and offspring after the appearance of breast cancer. Oncology, 1996, 53, 6, 471-475.
36. Kroman N, Jensen MB, Melbye M, Wohlfahrt J, Mouridsen HT. Should women be advised against pregnancy after breast-cancer treatment? Lancet, 1997, 350 (9074), 319-322.
37. Velentgas P, Daling JR, Malone KE, Weiss NS, Williams MA, Self SG, Mueller BA Pregnancy after breast carcinoma: outcomes and influence on mortality. Cancer, 1999, 85, 11, 2424-2432.
38. Gelber S, Coates AS, Goldhirsch A, et al. Effect of pregnancy on overall survival after the diagnosis of early-stage breast cancer. J Clin Oncol, 2001, 19, 6, 1671-1675.
39. Collichio FA, Agnello R, Staltzer J. Pregnancy after breast cancer: from psychosocial issues through conception. Oncology (Huntingt), 1998, 12, 5, 759-765, 769.
Copyright © Российское общество клинической онкологии (RUSSCO).
Полное или частичное использование материалов возможно только с разрешения администрации портала.
Беременность и рак молочной железы: тактика ведения беременности, особенности диагностики и лечения
В статье рассмотрены вопросы ведения беременности у женщин с онкологическими заболеваниями. На основании данных зарубежных исследователей, а также собственного опыта разработаны и обобщены показания и противопоказания к пролонгированию беременности, приведена тактика ведения пациенток с выявленным во время беременности раком молочной железы. Подчеркивается, что метод лечения следует определять индивидуально, учитывая срок беременности и данные о распространенности опухоли.
- КЛЮЧЕВЫЕ СЛОВА: беременность, рак молочной железы, противоопухолевое лечение
В настоящее время увеличивается доля женщин, рожающих в возрасте после 30 лет, что ассоциировано с более частым выявлением онкологических заболеваний во время беременности. У женщины, ее мужа, семьи и врача возникает трудный выбор: прервать беременность или пролонгировать ее, ухудшив тем самым жизненный прогноз для матери. Рассмотрение вопросов ведения беременности и рекомендаций женщинам с онкологическими заболеваниями является сложной биоэтической проблемой. Согласно одному из принципов биоэтики, пациент вправе самостоятельно принимать решения без вовлечения окружающих людей и вправе получить всю необходимую медицинскую помощь. В этой связи безапелляционное требование некоторых врачей прервать беременность, не оставляющее женщине права на выбор, является нарушением прав пациента. Если женщина, страдающая онкологическим заболеванием, категорически отказывается от прерывания беременности, врачу необходимо придерживаться такой терапевтической тактики, которая, с одной стороны, была бы наиболее эффективной, а с другой - наносила бы наименьший вред матери и плоду.
Эпидемиология
Из всех онкологических заболеваний, выявляемых во время беременности, наиболее часто встречаются рак шейки матки, рак молочной железы (РМЖ) и лимфомы. По данным отечественной статистики, за последние 10 лет заболеваемость раком молочной железы выросла на 32,5%, при этом с каждым годом увеличивается число женщин, болеющих раком в более молодом возрасте. РМЖ занимает 2-е место по частоте встречаемости среди всех злокачественных новообразований, диагностируемых во время беременности. В настоящее время принят международный термин «рак молочной железы, ассоциированный с беременностью» (pregnancy associated breast cancer, РАВС), который включает три клинические ситуации:
1. Рак диагностируется на фоне существующей беременности.
2. Рак диагностируется на фоне лактации.
3. Рак диагностируется в течение первого года после завершения беременности.
Диагностика
В 82% случаев пациентки самостоятельно выявляют опухоль в I триместре беременности. Наиболее частой жалобой (95%) является определение болезненных неоформленных масс в ткани молочной железы, часто сопровождающихся дискомфортом в области соска (болезненность, покалывание, отечность), изменение состояния всей молочной железы в виде асимметричного набухания и уплотнения, одностороннее увеличение лимфатических узлов [1]. Резкое увеличение массы молочной железы во время беременности и лактации не всегда принимается в расчет врачом, наблюдающим беременность, и может быть расценено как нормальное физиологическое явление. Поздняя диагностика РМЖ в период беременности приводит к отсрочке в лечении пациенток в среднем на 2-3,5 месяца [2].
Стандартное пальпаторное исследование при проведении обследования пациенток с РМЖ, ассоциированным с беременностью, неэффективно и в большинстве случаев, особенно на более поздних сроках беременности
(II-III триместры), не позволяет дифференцировать опухоль. Предпочтительным методом диагностики во время беременности и лактации является ультразвуковое исследование, которое позволяет провести дифференциальный диагноз между кистозными и солидными образованиями в 97% случаев. Проведение маммографии, хотя и допустимо при беременности с использованием свинцового фартука для защиты живота, существенного диагностического значения не имеет, поскольку в 25% случаев исследование дает ложноотрицательный результат.
Выявление отдаленных метастазов в печень и малый таз без особого риска может быть произведено с помощью сонографии. Метод магнитно-резонансной томографии, используемый для диагностики метастазов в органы брюшной полости, в головной мозг, не подразумевает ионизирующего излучения или использования каких-либо радиоактивных веществ, однако применяемый для контрастирования препарат (гадолиниум) отнесен к препаратам категории С (использование допустимо, если ожидаемая польза выше потенциального риска для плода).
Наиболее достоверным методом диагностики опухолей остается морфологическое исследование. Эксцизионная биопсия, выполняемая под местной анестезией, является «золотым стандартом» при любой неясной патологии в молочной железе. Чрескожная биопсия с последующим морфологическим исследованием «столбика» ткани позволяет получить достаточное количество материала для верификации диагноза [4].
В связи с поздней диагностикой РМЖ во время беременности средние размеры опухоли колеблются от 5 до 15 см, а распространенные формы наблюдаются в 72-85% случаев. На момент установления диагноза заболевание нередко находится в неоперабельной стадии и в 20% случаев выявляются отдаленные метастазы. Наиболее частой формой при гистологическом исследовании является инвазивный внутрипротоковый рак.
Большинство опухолей молочной железы во время беременности - высокой степени злокачественности с частой лимфоваскулярной инвазией. Более того, во всех исследованиях было показано, что большинство опухолей являются гормон-независимыми. В проспективном исследовании L.P. Middleton и соавт. [6] при иммуногистохимическом исследовании гормонально-позитивными были 28% опухолей с эстрогеновыми рецепторами и 24% с прогестероновыми рецепторами в сравнении с 45% и 36% соответственно у небеременных женщин молодого возраста [3].
Таким образом, во время беременности чаще встречаются более злокачественные гормон-независимые формы опухолей, однако гистопатологические и иммуногистохимические характеристики РМЖ, ассоциированного с беременностью, и РМЖ у молодых небеременных женщин одинаковы. Следовательно, более вероятно, что именно возраст влияет на злокачественность процесса, а не сама беременность. Еще одной особенностью РМЖ, ассоциированного с беременностью, является повышение частоты функционально значимых наследуемых мутаций гена ВRCA1 (17,5%) и полиморфных вариантов гена BRCA2 (40,5%), что значительно выше, чем популяционная частота данных мутаций при спорадическом раке у пациенток моложе 35 лет.
На основании данных зарубежных исследователей, а также собственных данных нами была обобщена тактика ведения беременности у больных раком молочной железы. Метод лечения у беременных с РМЖ следует выбирать индивидуально, учитывая срок беременности и распространенность опухоли и проводя консультацию с хирургом, акушером, химиотерапевтом, генетиком и психологом.
Основным фактором, определяющим метод лечения, является срок беременности. В I триместре рекомендуется прерывание беременности с последующим лечением. Однако если женщина настаивает на сохранении беременности, следует определить метод лечения с меньшими побочными эффектами для плода и лучшим прогнозом для матери. В этом случае, а также во II и III триместрах метод лечения будет зависеть от размера и операбельности опухоли.
При начальных стадиях рака и небольших размерах опухоли в качестве первого этапа лечения возможно выполнение оперативного вмешательства с последующей адъювантной полихимиотерапией во II и III триместрах. Радикальная мастэктомия с сохранением обеих грудных мышц является наиболее рациональным хирургическим вмешательством при начальных стадиях, так как не требует дополнительной лучевой терапии. Следовательно, радикальная мастэктомия не несет в себе риска в отношении плода и не приводит к увеличению частоты прерывания беременности.
Органосохраняющие операции (радикальная резекция) во время беременности нежелательны, поскольку требуют дополнительной лучевой терапии, которая может проводиться только после завершения беременности. Использование нерадикальных оперативных вмешательств, а также длительное откладывание полихимиотерапии после мастэктомии во время беременности характеризуется неблагоприятным прогнозом для матери.
При опухоли больших размеров проводится первичная системная полихимиотерапия с последующей операцией. Основные схемы терапии, использующиеся для лечения РМЖ во время беременности: АС (доксорубицин, циклофосфамид); ЕС (эпирубицин, циклофосфамид); FАС (флуороурацил, доксорубицин, циклофосфамид) [5]. Проведение лучевой терапии может быть отложено до послеродового периода, поскольку прогноз заболевания при отсрочке лечения на 3-4 месяца или незамедлительном начале лучевой терапии не отличается. По данным А.А. Параконной, при стратификации материала по стадиям не получено статистических различий в показателях как общей, так и безрецидивной выживаемости в группе РМЖ, ассоциированного с беременностью, и РМЖ вне беременности. Исключение составили лишь пациентки с РМЖ
IIIС стадии, чей прогноз был хуже по сравнению с аналогичной стадией из контрольной группы [1].
Нами изучались особенности течения беременности, родов и послеродового периода у 11 женщин с РМЖ, ассоциированным с беременностью, наблюдавшихся совместно в Научном центре акушерства, гинекологии и перинатологии им. В.И. Кулакова и Российском онкологическом научном центре им. Н.Н. Блохина с 2007 по 2011 г. Проводился анализ физического развития, частоты врожденной и приобретенной патологии новорожденных, родившихся у женщин с диагностированным во время беременности РМЖ. Во всех случаях патология была обусловлена недоношенностью. У 2 детей, родившихся преждевременно, развился респираторный дистресс-синдром. У 5 детей производилась неинвазивная респираторная поддержка методом NCPAP, из них
в 2 случаях дети были переведены на поддержку BIPHASIC и искусственную вентиляцию легких. У одного недоношенного ребенка на 2-е сутки после рождения развилось желудочно-кишечное кровотечение, у одного ребенка был выявлен двусторонний крипторхизм. Несмотря на предполагаемый риск развития осложнений со стороны плода (генетических, функциональных и т.д.) в связи с полихимиотерапией, проводимой во время беременности по поводу РМЖ, пороков развития у этих новорожденных выявлено не было. В настоящее время в Научном центре акушерства, гинекологии и перинатологии им. В.И. Кулакова запланировано проведение проспективного исследования здоровья детей (возраст от года до 10 лет), матери которых получали противоопухолевое лечение во время беременности.
Обобщенные нами алгоритмы подготовки и ведения беременности позволяют снизить репродуктивные потери, частоту осложнений как для матери, так и плода. Анализ физического развития, частоты врожденной и приобретенной патологии детей, рожденных матерями с онкологическими заболеваниями, не показал достоверного отличия от аналогичных показателей у новорожденных в общей популяции. Таким образом, беременность и ее сохранение на любом этапе заболевания не влияют на эффективность лечения и продолжительность жизни женщин с РМЖ.
Читайте также:
- Чем красивее почерк, тем чувствительнее его обладатель. Определяем характер по почерку
- Вирусная теория врожденных пороков сердца. Внешние факторы как причина врожденных пороков сердца
- У кого высокий риск заболеть панкреатитом? Болезни поджелудочной железы
- Профилактика ятрогенных осложнений у пожилых людей
- Гастростомия. История гастростомии в хирургии.
