Ранения аорты и магистральных сосудов - варианты, шкала тяжести по OIS
Добавил пользователь Евгений Кузнецов Обновлено: 28.01.2026
В повседневной клинической практике необходимо использование шкал объективной оценки тяжести полученной травмы. Одна из наиболее используемых в настоящий момент шкал разработана сотрудниками кафедры Военно-полевой хирургии (ВПХ) Военно-медицинской академии им. С.М.Кирова. В данной статье приводится данная шкала с примечаниями для использования специалистами хирургических специальностей в их повседневной работе.
Таблица №1. Оценка тяжести повреждений по шкале ВПХ-П (ОР)
(ОР - для огнестрельных ранений)
ВПХ-П (ОР) Голова
| № п/п | Характер и локализация повреждений | Тяжесть повреждения в баллах |
| 1 | Ограниченные раны мягких тканей головы | 0,05 |
| 2 | Непроникающие раны черепа без повреждения головного мозга | 0,6 |
| 3 | Непроникающие раны черепа с нетяжелым повреждением головного мозга | 0,8 |
| 4 | Проникающие раны черепа с нетяжелым повреждением головного мозга | 2,0 |
| 5 | Непроникающие раны черепа с нетяжелым повреждением и сдавлением головного мозга | 2,0 |
| 6 | Проникающие раны черепа с нетяжелым повреждением и сдавлением головного мозга | 4,0 |
| 7 | Непроникающие раны черепа с тяжелым повреждением головного мозга | 12,0 |
| 8 | Проникающие раны черепа с тяжелым повреждением головного мозга | 13,0 |
| 9 | Непроникающие раны черепа с тяжелым повреждением и стадвленим головного мозга | 15,0 |
| 10 | Проникающие раны черепа с тяжелым повреждением и сдавлением головного мозга | 16,0 |
| 11 | Непроникающие раны черепа с крайне тяжелым повреждением головного мозга | 19,0 |
| 12 | Проникающие раны черепа с карйне тяжелым повреждением и сдавлением головного мозга | 19,0 |
| 13 | Проникающие раны черепа с кайне тяжелым повреждением головного мозга | 19,0 |
| 14 | Проникающие раны черепа с крайне тяжелым повреждением и сдавлением головного мозга | 19,0 |
Примечание: нетяжелое повреждение головного мозга по клиническим проявлениям соответствует сотрясению, ушибу легкой и средней степени тяжести; тяжелое повреждение головного мозга по клиническим проявлениям соответствует экстрапирамидной и диэнцефальной формам тяжелых ушибов; крайне тяжелое повреждение головного мозга по клиническим проявлениям соответствует мезенцефало-бульбарной форме тяжелого ушиба
ВПХ-П (ОР) Шея
| № п/п | Характер и локализация повреждений | Тяжесть повреждений в балах |
| 15 | Ограниченные раны мягких тканей шеи | 0,05 |
| 16 | Повреждение магистральных сосудов шеи | 6,0 |
| 17 | Повреждение пищевода | 7,0 |
| 18 | Повреждение гортани | 8,0 |
ВПХ-П (ОР) Грудь
ВПХ-П (ОР) Живот
| № п/п | Характер и локализация повреждений | Тяжесть повреждения в баллах |
|---|---|---|
| 30 | Ограниченные раны мягких тканей живота | 0,05 |
| 31 | Повреждение внеорганных образований брюшной полости | 0,6 |
| 32 | Повреждение печени | 1,0 |
| 33 | Повреждение селезенки | 3,0 |
| 34 | Повреждение почки | 3,0 |
| 35 | Повреждение тонкой кишки, желудка | 3,0 |
| 36 | Повреждение двух паренхиматозных органов | 4,0 |
| 37 | Повреждение полого и паренхиматозного органов | 7,0 |
| 38 | Повреждение толстой и прямой кишки | 8,0 |
| 39 | Повреждение тонкой и толстой кишок | 9,0 |
| 40 | Повреждение поджелудочной железы, двенадцатиперстной кишки | 12,0 |
| 41 | Повреждение 3 и более органов брюшной полости | 12,0 |
| 42 | Повреждение аорты, нижней поло, печеочной или воротной вен | 19,0 |
ВПХ-П (ОР) Таз
| № п/п | Характер и локализация повреждений | Тяжесть повреждений в баллах |
| 43 | Ограниченные раны мягких тканей таза | 0,1 |
| 44 | Переломы костей таза | 0,6 |
| 45 | Обширные раны мягких тканей таза | 1,0 |
| 46 | Повреждение наружных половых органов | 1,0 |
| 47 | Повреждение уретры | 2,0 |
| 48 | Повреждение мочевого пузыря | 3,0 |
| 49 | Повреждение прямой кишки | 8,0 |
| 50 | Повреждение нескольких таховых органов | 9,0 |
| 51 | Повреждение крупных сосудов тазовой области | 10,0 |
ВПХ-П (ОР) Позвоночник
| № п/п | Характер и локализация повреждений | Тяжесть повреждений в баллах |
| 52 | Параветребральные раны | 0,1 |
| 53 | Переломы поперечных или остистых отростков позвонков | 0,2 |
| 54 | Переломы тел позвонков без повреждения спинного мозга | 1,0 |
| 55 | Частичное повреждение спинного мозга | 4,0 |
| 56 | Полное повреждение спинного мозга в поясничном отделе | 6,0 |
| 57 | Полное повреждение спинного мозга в грудном отделе | 12,0 |
| 58 | Полное повреждение спинного мозга в шейном отделе | 19,0 |
Примечание: пп. 55-58 характеризуют тяжесть повреждения при проникающих ранениях позвоночника; тяжесть повреждений при непроникающих ранениях соответствует тяжести повреждений при механических травмах по шкале ВПХ-П (МТ) раздел позвоночник
ВПХ-П (ОР) Конечности
| № п/п | Характер и локализация повреждений | Тяжесть повреждений в баллах |
| 59 | Ограниченные раны мягких тканей конечностей | 0,05 |
| 60 | Непроникающие раны крупных суставов | 0,1 |
| 61 | Ограниченные раны мягких тканей стопы | 0,2 |
| 62 | Краевые и дырчатые переломы длинных костей | 0,2 |
| 63 | Проникающие раны мелких суставов | 0,2 |
| 64 | Ограниченные раны мягких тканей и костей кисти | 0,4 |
| 65 | Обширные раны мягких тканей конечностей | 0,6 |
| 66 | Ограниченные раны мягких тканий и костей стопы | 0,8 |
| 67 | Переломы коротких костей, костей предплечья | 0,8 |
| 68 | Проникающие раны крупных суставов | 1,0 |
| 69 | Перелом плеча | 1,0 |
| 70 | Обширные раны мягких тканей и костей кисти | 1,0 |
| 71 | Перелом голени | 2,0 |
| 72 | Обширные раны мягких тканей и костей стопы | 2,0 |
| 73 | Повреждение крупных нервов | 2,0 |
| 74 | Отрыв кисти, стопы | 3,0 |
| 75 | Отрыв предплечья | 3,0 |
| 76 | Перелом бедра | 3,0 |
| 77 | Повреждение магистральных сосудов конечностей | 4,0 |
| 78 | Отрыв плеча | 4,0 |
| 79 | Отрыв голени | 4,0 |
| 80 | Отрыв бедра | 10,0 |
Традиционная качественная градация тяжести повреждений и их характеристика
Коронароангиография

В университетскую программу первых курсов входит изучение строения сердца и его коронарных сосудов. Но чаще всего авторы учебников ограничиваются описанием только крупных сосудов. Клиницисты же используют совершенно иную, но также международную номенклатуру. Коронароангиография и имплантация стентов требуют более подробного описания сосудов сердца, что нашло применение и в международной практике.
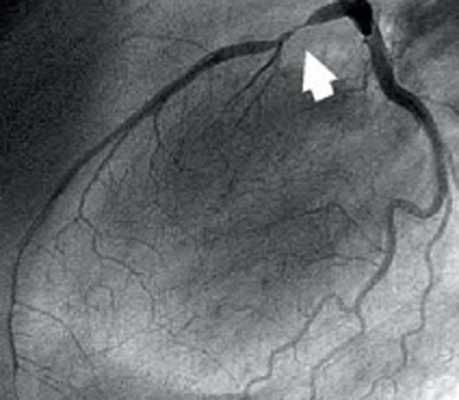
Из курса анатомии каждый узнал, что от аорты отходят две артерии, кровоснабжающие само сердце: левая и правая коронарные артерии. Утолщения на корне аорты, из которых и выходят эти артерии, называются соответственно левым и правым коронарными синусами.
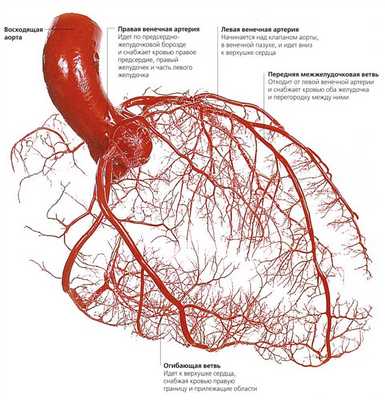
Выделяют следующие части левой коронарной артерии (LCA, left coronary artery): главный ствол, который делится на переднюю межжелудочковую ветвь (ramus interventricularis anterior, RIVA или left anterior descending, LAD), а также огибающую артерию (left circumflex coronary artery, LCх).
Главный ствол этой артерии длиной редко превышает 1 см, а далее делится на две свои конечные ветви. Передняя межжелудочковая ветвь располагается на передней поверхности сердца вплоть до его верхушки. На своем протяжении от этой артерии отходят передние желудочковые ветви (диагональные ветви, RD/R.Diag) и передние перегородочные ветви. В коронароангиографии с целью топического указания места поражения предложено делить коронарное русло на сегменты.
Проксимальный сегмент ПМЖВ начинается своим ответвлением от ствола и продолжается до места отхождения от нее первой перегородочной или первой RD, средняя часть — до ответвления второй перегородочной ветви или второй RD, дистальная — до верхушки сердца/после отхождения второй RD.
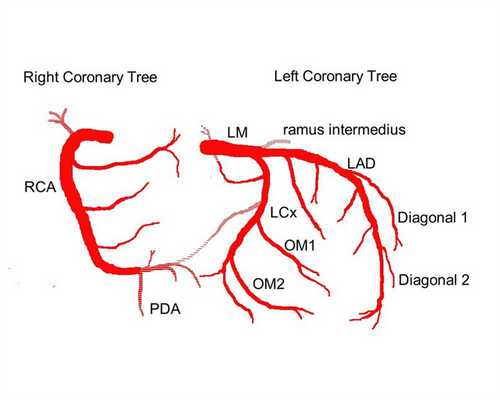
Огибающая артерия всегда располагается на задней поверхности сердца. В ее проксимальной части от нее отходит ветвь тупого края (obtuse marginal artery, obtuse marginal branch, OMB). В зависимости от места этого ответвления различают проксимальную и дистальную части огибающей ветви. Очень редко от главного ствола между передней межжелудочковой ветвью и огибающей ветвью посередине отходит еще одна ветвь, берущая начало непосредственно из общего ствола — промежуточная артерия (RIM, ramus intermedius).
Выделяют следующие три части правой коронарной артерии (RCA): проксимальную (от устья до первого ее поворота, обычно располагающегося горизонтально), среднюю (от первого до второго поворота) и дистальную (после второго ее поворота до разделения артерии на ветви у «креста» сердца (crux cordis) — места пересечения задней межжелудочковой и атриовентрикулярной борозд сердца). Иногда непосредственно после самого устья от сосуда отходит маленькая ветвь — ветвь артериального конуса (ramus coni arteriosi, CB), а также много мелких ветвей к правому предсердию.
Самой главной из этих ветвей является артерия синоатриального узла (S-A node artery, SNA). Она часто располагается под правым ушком сердца. В редких случаях ветвь артериального конуса имеет собственное устье. Этот вариант всегда следует учитывать, поскольку при коронароангиографии можно принять эту артерию за главный ствол правой коронарной артерии. Перекрыв вход в эту артерию катетером, можно вызвать локальную ишемию и, как следствие, нарушения ритма вплоть до трепетания камер сердца. В передней части венечной борозды, в области острого края сердца, от правой коронарной артерии отходит ветвь острого края (acute marginal artery, AMB), чаще от одной до трех, которая в большинстве случаев достигает верхушки сердца.
Итак, перечислим еще раз все сокращения:
Левая коронарная артерия — left coronary artery (LCA):
— Передняя межжелудочковая ветвь (ПМЖВ), или передняя нисходящая артерия — left anterior descending artery (LAD); иначе — ramus interventricularis anterior (RIVA/RIA);
— Диагональные артерии (ветви) — ДА; ramus diagonalis (RD/Diag);
— Огибающая ветвь (ОВ) левой коронарной артерии, огибающая артерия — left circumflex coronary artery (LCх));
— Ветвь тупого края, obtuse marginal artery, obtuse marginal branch, (OMB);
— Перегородочные межжелудочковые ветви, ramus septalis (RSA);
— Промежуточная артерия, ramus intermedius (RIM).
Правая коронарная артерия — right coronary artery (RCA):
— Ветвь острого края, acute marginal artery, (AMB);
— Артерия синоатриального узла — ramus nodi sinuatrialis (S-A node artery, SNASA/RNS);
— Задняя межжелудочковая ветвь (ЗМЖВ), или задняя нисходящая артерия — posterior descending artery (PDA); иначе — ramus interventricularis posterior (RIVP/RIP).
И еще раз для повторения (важное задание для диагностики локализации ишемии при инфаркте миокарда): LAD/RIVA, LCx кровоснабжает левую камеру спереди и сбоку, а RCA — сзади. Левое предсердие кровоснабжают LCx, RCA. Перегородку — RSA от LAD. Правую камеру сзади — RCA, спереди — RCA, LAD. Правое предсердие — RCA.
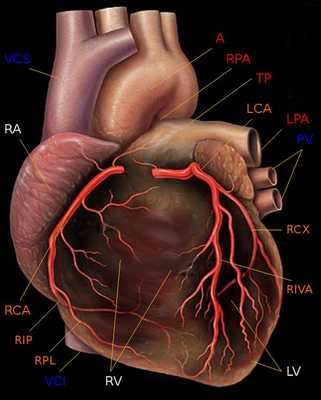
Следует также напомнить о доминантности кровоснабжения миокарда. При так называемом правом типе кровоснабжения сердца, наблюдающемся у 70 % людей, задняя нисходящая артерия (PDA) отходит от правой коронарной артерии. При левом типе кровоснабжения сердца (10 % людей) огибающая артерия (LCx) достигает уровня задней межжелудочковой борозды и образует заднюю нисходящую артерию (PDA). При еще более редком, так называемом смешанном содоминантном типе (20 % людей), имеются две задних желудочковых ветви (RIVP/RIP), отходящих от правой венечной и огибающей артерий.
Для понимания принципа работы ЭКГ необходимо повторить строение проводящей системы сердца. Синоатриальный узел находится в стенке правого предсердия, его импульсы поступают к атриовентрикулярному узлу (также располагается в стенке правого предсердия). Далее импульс распространяется по волокнам пучка Гиса, который делится в межжелудочковой перегородке на две ножки - правую и левую (иногда называются ножками Тавары). К эндокарду сигнал поступает посредством волокон Пуркинье. Иногда встречаются и дополнительные пути передачи возбуждения, как, например, по волокнам Кента. Такие пути часто располагаются между предсердиями и желудочками и идут в обход атриовентрикулярного узла. Из-за этого мускулатура миокарда часто сокращается преждевременно, что становится заметно на ЭКГ, а такие пациенты предрасположены к тахикардии (WPW-синдром).
Электрокардиограмма представляет собой не что иное, как запись распространяемых электрических потенциалов сердца, фиксируемых электродами на конечностях и грудной стенке. ЭКГ включает в себя три стандартных отведения по Эйнтховену (I, II, III), и три усиленных по Гольдбергу (aVR, aVL, aVF). Прикрепление еще шести грудных электродов по Вильсону (V1-V6) позволяет зарегистрировать распространение возбуждение по сердечной стенке в горизонтальной проекции. В зависимости от изменений в этих отведениях еще на догоспитальном этапе при помощи ЭКГ можно предположить локализацию инфаркта и возможную «проблемную» артерию.
Например, при инфаркте правых отделов сердца (задней стенки) часто особенно сильно поражается правый желудочек. Чаще всего это происходит из-за тромба в RCA. Правые отделы сердца не способны сокращаться должным образом, что приводит к снижению преднагрузки левой камеры сердца, поскольку таким образом снижается объем крови, транспортируемый к левому предсердию. Сниженный сердечный выброс сердце пытается компенсировать увеличением частоты сокращений. При инфаркте же левых отделов сердца основным осложнением является кардиогенный шок.
Специально для наших подписчиков мы сделали таблицу, в которой показаны изменения ЭКГ в зависимости от локализации возможного повреждения коронарных артерий.

Стоит также повторить и классификацию острых коронарных синдромов:
- Нестабильная стенокардия без повышения тропонина. Эта форма классифицируется по Браунвальду на 3 класса в зависимости от выраженности клинических признаков:
I — недавно возникшая боль за грудиной (менее 2-х месяцев, более 3-х раз в день);
II — боль за грудиной в покое (минимум один раз за прошедший месяц, но не в течении последних 48 часов);
III — боль за грудиной в покое (минимум один раз за последний 48 часов).
Нестабильную стенокардию классифицируют на 3 группы по причинам возникновения:
А — вторичная нестабильная стенокардия (инфаркт миокарда, анемия, повышение температуры, гипотензия, тахиаритмия, тиреотоксикоз, дыхательная недостаточность);
B — первичная нестабильная стенокардия;
C — нестабильная стенокардия после инфаркта (минимум 2 недели после инфаркта).
- Инфаркт миокарда без элевации сегмента ST (NSTEMI) с повышением концентрации кардиального тропонина в крови.
ПБКА и стентирование
При ПБКА баллонный катетер с помощью проводника вводится вплоть до места стеноза. Баллон раздувается и тем самым «сплющивает» атеросклеротические бляшки, растягивая сосудистую стенку. Мелкие повреждения интимы во время раздувания баллона часто не имеют последствий, однако иногда именно в этих местах позже начинается пролиферация тканей, что в 30-40 % случаев приводит к рестенозам и рецидивам в течение последующих трех месяцев. Частота экстренных операций по созданию шунтов (bypass) составляет менее 0,5 %. С помощью имплантации стента сосудистая стенка стабилизируется. Существовала также техника primary stenting — имплантация стента без предшествующего дилатирования сосудов баллоном, однако ныне она используется крайне редко и только на начальных этапах сужения просвета сосуда. Исследования последних лет показали, что при значительных сужениях просвета сосуда, у таких пациентов в первые часы после ангиопластики наблюдалась ишемия миокарда, что требовало немедленного повторного хирургического вмешательства или повторной дилатации. Это осложнение возникает вследствие отрыва бляшки от эндотелия. Обнажение поверхности гладкомышечных клеток приводит к тромбообразованию за счет высвобождения молекул коллагена и тканевых факторов, запускающих каскад свертывания крови. Во избежание развития тромбов и рестеноза в настоящее время чаще всего ангиопластику совмещают с имплантацией стентов на месте стеноза.
Первую имплантацию стента провел Sigwart в 1987 году. Тогда стенты монтировались непосредственно на баллон самим врачом. Сейчас же вся конструкция идет в комплекте, что позволило снизить риск потери стента в кровеносном русле при его недостаточной фиксации.

Появились и новые типы самих баллонов. Некоторые из них имеют на своей поверхности режущие зубцы, что расположены параллельно оси сосуда, а также баллоны из нитинола и нейлона хеликальные или же параллельные оси сосуда. Эти конструкции позволяют создать идеальную площадку для имплантации будущего стента. Сперва в процессе исследований ученые не заметили разницы между такими баллонами и стандартными, однако недавно выяснилось, что такие надсекающие баллоны, покрытые лекарственными средствами, показывают лучшие результаты.
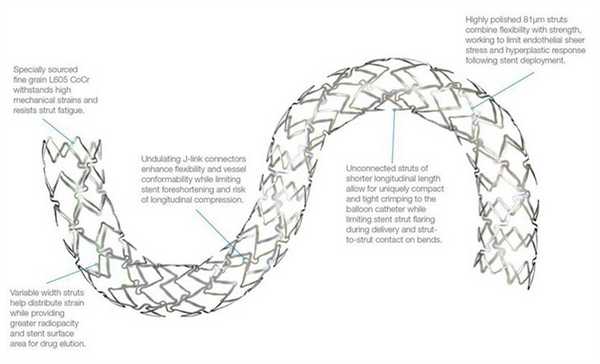
Различают два типа металлических стентов: саморасширяющиеся и прикрепленные к дилатирующему баллону. Исследования показывают, что применение первого типа стентов чаще вызывает развитие неоинтимальной гиперплазии. Поэтому в настоящее время часто используются стенты второго типа. Как правило, они состоят из металлической трубочки, в которой с использованием различных техник создаются отверстия. После расширения сосуда баллонным катетером в его просвете создается сеть, обволакивающая его стенки изнутри. Прототипом такого типа стентов являлся стент Palmaz-Schatz, который сейчас уже не применяется.
Исследование 1994 года не показало разницы между имплантацией такого стента и обычной ангиопластикой. Развитие этого направление позволило разработать новые типы стентов. Чаще всего они состоят из нескольких модулей, соединенных коннекторами. Изначально их производили из стали, однако сейчас в качестве материала для изготовления стентов используется платина, кобальт, нитинол (никель-титан), а также только титан. Из-за этого они стали существенно меньше и легче. РКИ выявили преимущества стентов с толстым каркасом перед таковыми с тонким. Предполагают, что они меньше травмируют сосуды, предотвращая таким образом реэндотелизацию.
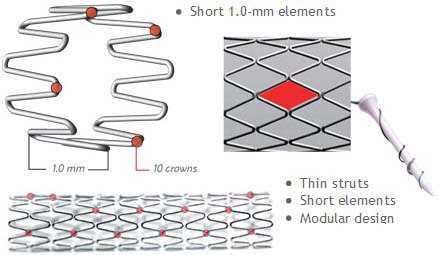
Существуют также стенты с особым покрытием, создающим непроницаемый для крови барьер. К таким вещества относят политетрафторэтилен и полиэтилен. Сперва их использовали для экстренного закрытия небольших перфораций коронарных артерий, однако сейчас их применяют в профилактике коронарных аневризм и артериовенозных фистул.
Drug-eluting-stents (DES) покрыты специальными веществами, подавляющими пролиферацию клеток эндотелия, таким образом препятствуя рестенозированию сосуда, чаще всего развивающемуся в течение 4-8 месяцев после имплантации.
Стенты - ферромагнетики, плотно устанавливающиеся в сосудистом русле не являются противопоказанием для проведения МРТ.
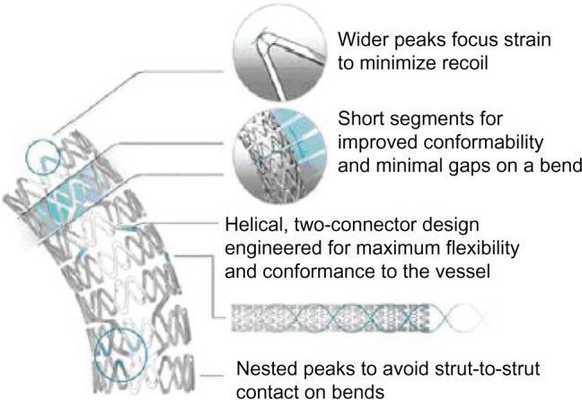
Существуют специальные стенты для позиционирования их в устьях и разветвлениях сосудов. Как и любой инородный объект в кровеносном русле, стенты являются дополнительным фактором тромбообразования. Поэтому после самой процедуры пациенту всегда назначают ДААТ или ТАТ.
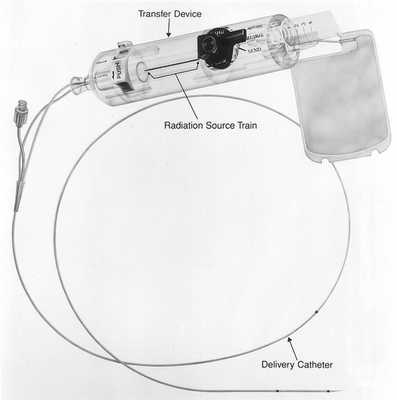
Брахитерапия
Этот метод основан на радиоактивном облучении коронарных артерий при рецидивах после имплантации стентов. Для этого используется бета-излучение, поскольку оно способно проникать лишь на несколько миллиметров внутрь толщи ткани. При этом методе катетер вводят в место стеноза, который прежде был дилатирован баллоном. С помощью этого катетера зону определенное количество времени (3-5 минут) облучают рассчитанной дозой. Васкулярная брахитерапия используется с 1996 года. В феврале 2005 года прекратила свое существование фирма, разрабатывающая аппараты для брахитерапии коронарных сосудов (Beta-Cath-System).
Ротаблационная пластика
Этот метод используется с 1989 года. В сосуд вводится алмазный бор, способный вращаться с частотой 190 000 об. в минуту. С его помощью удаляются ткани в месте рестенозирования. Величина таким образом измельченных частиц составляет 5-10 микрометров (длина эритроцита — 7,5 микрометров). Образуемый канал очень небольшой в диаметре, но достаточный для проведения ПТКА. Как правило, метод используют в случае образования на месте рестеноза кальцификатов. Диаметр головки бора варьируется от 1,25 до 2,5 мм. Поскольку кабель для ротаблационного бора плохо проходит место стеноза, успех операции составляет 80-95 %. К осложнениям относят спазмы сосудов, возникающие чаще (5 %), чем при ПТКА.
Интраваскулярный ультразвук
Еще одним инструментом кардиолога является метод интраваскулярного ультразвука (IVUS). В сосуд вводят ультразвуковой зонд.
Порядок манипуляций напоминает таковой при ПТКА: после позиционирования проводника зонд проводят к месту стеноза. Ультразвук позволяет просмотреть 1 мм тканей на расстоянии от излучателя. Всего на верхушке катетера используется 64 таких кристалла (пьезоэлемента). С помощью этого метода возможно определить состав бляшек и их фибринные, липидные и кальциевые составляющие. Чаще всего к ультразвуку прибегают при неоднозначности ангиографической картины, используя как дополнительный метод обследования.
Всех нас на физиологии мучили графиками давления в сосудах. Мало кто на младших курсах мог подумать, что эти данные действительно используются в диагностике. При каждой коронароангиографии исследуют давление в коронарных артериях и его изменения в зависимости от наличия стенозированных участков. Для этого к исследуемому участку подводят детектор диаметром 0,014 дюймов. Этот катетер продвигают до самого конца коронарной артерии. Потом его тянут обратно. Таким образом фиксируется давление на всем протяжении артерии. На мониторе врачи наблюдают изменение давления; в месте наибольшего его перепада чаще всего и оказывается самый стенозированный участок. Постепенное изменение давления является свидетельством диффузного заболевания сосудов. Важно откалибровать детектор до самого исследования. После аппликации аденозина наблюдается гиперемия, то есть увеличение циркуляции крови, что симулирует состояние нагрузки. После этого давление на протяжении сосуда измеряется еще раз, что позволяет определить, являются ли места стенозирования важными, вызывают ли именно они боли у пациента при физических нагрузках. Аденозиновый тест не является безопасным: возможно развитие нарушений сердечного ритма, однако из-за короткого периода полувыведения аденозина лишь кратковременно.
Спазмы коронарных сосудов и ацетилхолиновый тест
Спазмы коронарных артерий часто являются причиной болей за грудиной в ночное время суток у пациентов без видимых изменений коронарных сосудов. Таким пациентам также назначают коронароангиографию и проводят вышеуказанный провокационный тест, чтобы исключить психогенные или некардиальные причины таких симптомов. Сейчас у каждого человека, уже сдавшего физиологию, должна промелькнуть мысль: «Почему ацетилхолин?». Если вы не находите ответа, возможно, придется снова открыть учебник. Дело в том, что эндотелий сердца при аппликации ацетилхолина вырабатывает NO, что приводит к расширению сосудов. Ацетилхолин оказывает вазоконстрикторное действие на гладкомышечные клетки сосудов в результате прямой их стимуляции, если эндотелий поврежден. Таким образом можно отличить здоровый эндотелий от поврежденного. Здоровые сосуды реагируют на ацетилхолин расширением, поврежденные же сужаются. При сужении сосудов более чем на 75 % по сравнению с аппликацией нитроглицерина внутрикоронарно говорят о коронарном спазме.
Аневризма брюшной аорты разорванная (I71.3)
Разрыв аневризмы брюшной аорты (АБА) имеет наиболее тяжелое течение и неблагоприятный прогноз. В последние годы отмечается выраженная тенденция к увеличению количества таких больных. Значительная их часть поступает в общехирургические стационары с подозрением на внутрибрюшную катастрофу. Иногда подлинная причина острого живота выявляется только во время экстренной лапаротомии.

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
По этиологии: врожденные и приобретенные (атеросклеротические, травматические, сифилитические, микотические, на почве неспецифического аортита)
По форме: веретенообразные, мешковидные
По типу (распространенности) поражения:
I тип - поражение проксимального сегмента брюшной аорты с вовлечением висцеральных ветвей;
II тип - поражение инфраренального сегмента до бифуркации;
III - инфраренальный сегмент с вовлечением бифуркации и подвздошных артерий;
IV - тотальное поражение аорты.
Локализация (направление) разрыва: забрюшинное пространство, свободная брюшная полость, редкие (нижняя полая вена, двенадцатиперстная кишка, мочевой пузырь и т. д.).
Этиология и патогенез
Разрыв эндотелия на фоне истончения внутренней эластической мембраны, уменьшенного содержания эластина и коллагена обусловливают расщепление стенки аорты и формирование второго просвета между интимой и медией. Поступление крови в образовавшийся просвет распространяет расслоение, в т.ч. на места отхождения артерий (чаще всего поражаются левая почечная и левая подвздошная артерии, реже — сонные, левая подключичная), что приводит к нарушению кровотока в их бассейнах. При прогрессирующем течении происходит разрыв всех слоев стенки аорты, которое, как правило, приводит к внезапной смерти.
Разрыв аневризмы аорты чаще всего располагается в нисходящем отделе. Различают разрыв в грудном и брюшном отделах аорты.
Факторы и группы риска
Основные факторы риска развития аневризм абдоминального отдела аорты, в том числе и осложненных: мужской пол, возраст старше 75 лет, артериальная гипертензия, ИБС, поражение других артериальных бассейнов, хронические неспецифические заболевания легких (ХНЗЛ), курение и наследственный фактор (наличие аневризмы брюшного отдела аорты у родственников) .
По данным большинства авторов, потенциальным фактором риска разрыва аневризмы абдоминального отдела аорты является наличие следующего симптомокомплекса: диастолическое АД выше 100 мм рт. ст., переднезадний размер аорты более 5 см на фоне выраженных хронических обструктивных заболеваний легких.
Клиническая картина
Клинические критерии диагностики
геморрагический шок, внезапные приступообразные боли различной локализации ( зависят от места разрыва)
Cимптомы, течение
Клиническая картина разрыва аневризмы брюшной аорты в достаточной степени многообразна, что в первую очередь определяется типом разрыва.
При забрюшинном разрыве аневризмы брюшной аорты болевой синдром имеет постоянный характер. Наиболее часто боли возникают в животе или в поясничной области. Характер болей связан с локализацией и распространенностью забрюшинной гематомы. При обширных, напряженных гематомах наступает компрессия нервных стволов и сплетений, что обусловливает особенно мучительный и непроходящий болевой синдром.
Иррадиация болей также имеет непосредственную связь с локализацией и распространенностью забрюшинной гематомы. Так, если нижний полюс гематомы достигает малого таза, наблюдается иррадиация болей в паховую область, бедро, промежность. При высоком распространении гематомы боли иррадиируют вверх, чаще - в область сердца.
Необходимо отметить одно важное обстоятельство, заключающееся в следующем. У большинства больных степень выраженности болевого синдрома не соответствует объективным симптомам со стороны живота, которые проявляются весьма умеренно. Последние обусловлены растяжением париетальной брюшины и экстравазацией крови в брюшную полость. Следует подчеркнуть, что количество крови в свободной брюшной полости при забрюшинном разрыве аневризмы обычно небольшое - не более 200 мл. Видимо, этим объясняется отсутствие выраженной перитонеальной симптоматики. Крайне важным для диагностики аневризмы является обнаружение пульсирующего образования в брюшной полости. Это удается примерно в 70-80 % случаев. Может быть выявлено и непульсирующее образование, что объясняется массивным тромбозом полости аневризмы или большой забрюшинной гематомой.
Синдром кровопотери, если он выражен, играет решающую роль в установлении клинического диагноза разрыва АБА. Наиболее острые проявления этого синдрома (коллапс с потерей сознания) встречаются примерно у 20 % больных. У остальных клинические проявления внутреннего кровотечения выражены весьма умеренно. Это является характерным для забрюшинного разрыва, так как излияние крови в забрюшинное пространство происходит сравнительно медленно, что оставляет время для включения компенсаторных гемодинамических механизмов. Отсюда и возникают трудности в диагностике забрюшинного разрыва АБА, поскольку резонно ожидать при столь грозном заболевании более значительных гемодинамических расстройств. Вот почему слабая выраженность синдрома кровопотери или его отсутствие не должно служить основанием для отрицания диагноза разрыва АБА. Об этой особенности клинической картины заболевания следует помнить, и тогда будет меньше неоправданных задержек госпитализации больных и излишне длительного наблюдения за ними в условиях стационара.
Внутрибрюшинный разрыв аневризмы брюшной аорты характеризуется крайне тяжелыми клиническими проявлениями: быстрым нарастанием симптомов внутреннего кровотечения и геморрагическим шоком. При осмотре больного отмечается резкая бледность кожных покровов, покрытых холодным потом. Пульс частый, нитевидный. Живот вздут, резко болезненный во всех отделах. Определяется разлитой симптом Щеткина-Блюмберга. При перкуссии живота выявляется свободная жидкость в брюшной полости. Катастрофическое течение болезни в таких случаях исключает проведение каких-либо диагностических мероприятий. Летальный исход наступает очень быстро.
При разрыве (прорыве) АБА в нижнюю полую вену больные жалуются на слабость, одышку, сердцебиение. Локальные симптомы характеризуются болями в животе и поясничной области, наличием пульсирующего образования в животе с характерным систоло-диастолическим шумом над ним. Отмечается отек нижних конечностей и нижней половины туловища. Указанные симптомы развиваются постепенно, но неуклонно прогрессируют, приводя к тяжелой сердечной недостаточности.
Разрыв аневризмы брюшной аорты в двенадцатиперстную кишку характеризуется симптомами профузного желудочно-кишечного кровотечения: внезапный коллапс, кровавая рвота, мелена. Этот симптомокомплекс трудно дифференцировать от кровотечения в желудочно-кишечный тракт другой этиологии. Диагноз облегчается в тех случаях, когда имеются анамнестические указания на аневризму брюшной аорты или она определяется при пальпации живота.
Установление типа аневризмы на основании клинических данных - сложная и не всегда разрешимая задача. В этом плане наиболее практически важным является определение верхнего полюса АБА, т.е. соотношение ее с почечными артериями. Существенное значение при этом имеет симптом Де Бэки, а именно: возможность при пальпации аневризмы «обойти» рукой ее верхний полюс. Если это удается (т.е. симптом Де Бэки положителен), то проксимальная граница аневризматического расширения аорты расположена ниже устья почечных артерий. К сожалению, этот симптом, дающий достоверную информацию при хронической аневризме, при разрыве ее не столь информативен. Прежде всего, это обусловлено наличием парааортальной гематомы, маскирующей истинные границы поражения аорты. Отсюда следует, что отрицательный симптом Де Бэки еще не означает факт распространения расширения аорты до уровня почечных артерий и выше.
Диагностика
Хорошей информативностью обладает неинвазивный метод исследования - ультразвуковое ангиосканирование. Применение этого метода не ухудшает состояние больных и дает достоверную информацию о размерах аневризмы, локализации разрыва и величине парааортальной гематомы.
Компьютерная томография. В последние годы успешно используется предоперационная спиральная компьютерная томография, что позволяет точно определить локализацию и размер аневризмы, отношение ее к почечным артериям и другим ветвям брюшной аорты, точно определить место разрыва. А при стентировании аорты КТ помогает определить необходимый размер стента. Признаками, указывающими на разрыв АБА являются:
1. Обнаружение парааортальной гематомы; причем имеется возможность дифференцировать «свежую» и «старую» гематомы.
2. Смещение гематомой забрюшинно расположенных органов.
Аортография. Более травматичным, но у ряда больных совершенно необходимым, методом исследования является аортография (рис. 17.1). Она показана в клинически неясных случаях с целью установления окончательного диагноза. Но даже при установленном диагнозе разрыва АБА рентгеноконтрастное исследование дает ценную дополнительную информацию: 1) определение взаимоотношений аневризмы с висцеральными ветвями брюшной аорты, ее распространения на бифуркацию аорты и подвздошные артерии; 2) уточнение характера окклюзионных поражений висцеральных артерий и магистральных артерий конечностей; 3) выявление аортокавального свища. Следует отметить, что при аортографии не всегда удается подтвердить факт разрыва аневризмы, так как экстравазации контрастного вещества может не быть в связи с тампонадой дефекта стенки аневризматического мешка кровяными сгустками. Противопоказанием к аортографии является крайняя тяжесть состояния больного и нестабильная гемодинамика со снижением артериального давления ниже 90 мм рт.ст.
В ряде случаев существенную помощь в дифференциальной диагностике разрыва АБА и острых заболеваний органов брюшной полости оказывает лапароскопия. Выявление свободной крови в брюшной полости, гематомы в забрюшинной клетчатке, брыжейке тонкого и толстого кишечника делают диагноз в достаточной степени определенным. Однако указанные признаки не являются строго специфичными для разрыва аневризмы, так как могут наблюдаться при геморрагическом панкреонекрозе, а также при травматических повреждениях органов брюшной полости и забрюшинного пространства.
Лапароскопия показана у больных с подозрением на разрыв АБА при условии: 1) стабильной гемодинамики (с систолическим АД не ниже 90 мм рт.ст.), 2) невозможности проведения в качестве первичных методов инструментального обследования ультразвукового исследования.
Эндоскопические признаки разрыва аневризмы брюшного отдела аорты подразделяются на прямые и косвенные.
К прямым признакам разрыва АБА относятся:
1. Гематома забрюшинной клетчатки и брыжейки тонкого кишечника.
2. Жидкая кровь или интенсивно окрашенная серозная жидкость в брюшной полости.
Особое значение этот метод имеет в послеоперационном периоде (динамическая лапароскопия).
Лабораторная диагностика
Дифференциальный диагноз
Разрыв АБА представляет собой сложную диагностическую проблему. Спектр диагностических ошибок очень широк. Категория больных с разрывом АБА, у которых ошибочно диагностируют какое-либо заболевание группы «острого живота» - самая многочисленная. Наиболее частые ошибочные диагнозы: острый холецистит, панкреонекроз, деструктивный аппендицит и др. Боли в поясничной области, которые наблюдаются у большинства больных с разрывом АБА, могут навести на мысль об остром урологическом заболевании. Острая боль в пояснице, сопровождающаяся корешковым синдромом с иррадиацией болей в ноги, в ряде случаев служит основанием для постановки диагноза «радикулит». Наконец, некоторые больные поступают в клинику с диагнозом острой непроходимости бифуркации аорты и артерий нижних конечностей. Суть ошибки заключается в том, что внимание врачей сосредотачивается только на клинических признаках ишемии нижних конечностей, а более важное обстоятельство - разрыв АБА - упускается из виду. Не являются большой редкостью такие случаи, когда проведение дифференциального диагноза разрыва АБА с другими, сходными по клинике заболеваниями, оказывается не по силам даже опытному клиницисту. При этом неоценимую помощь оказывают специальные методы исследования.
Осложнения
Лечение
Экстренные хирургические вмешательства у больных с разрывом АБА представляют собой сложную проблему. Они сопровождаются высокой летальностью и большим количеством осложнений. В то же время отказ от операции равносилен вынесению пациенту смертного приговора.
Следует иметь в виду 5 факторов риска, ассоциированных с летальностью: возраст старше 76 лет, признаки ишемии миокарда, показатели гемоглобина < 90г/л, креатинина >190ммоль/л и отсутствие сознания при поступлении в больницу.
Наличие у больного свежего инфаркта миокарда или острого нарушения мозгового кровообращения также полностью исключает возможность оперативного лечения разрыва АБА.
Оптимальный оперативный доступ при разрыве аневризмы брюшной аорты - срединная лапаротомия от мечевидного отростка грудины до лобка. Этот хирургический подход дает широкую экспозицию инфраренальной аорты и подвздошных артерий.
Особенность операции заключается, во-первых, в необходимости проведения интенсивных мероприятий, направленных на стабилизацию гемодинамики, профилактику почечной недостаточности и шока, а во-вторых, — в срочном прекращении кровотечения. Выполнение первой задачи достигается переливанием свежеконсервированной крови (в том числе реинфузией излившейся в брюшную полость крови), компонентов крови, кровезаменителей, глюкозо-солевых растворов до нормализации ЦВД, введением диуретиков, кальция глюконата, натрия бикарбоната в целях ликвидации метаболического ацидоза и т. д.
Для временной остановки кровотечений из аорты разработан ряд способов: наложение зажима на аорту выше шейки аневризматического мешка; прижатие аорты выше шейки аневризматического мешка зеркалом-компрессором, кулаком, тупфером; трансфеморальное или трансаксиллярное введение в аорту обтурирующего баллона типа Фолея; введение баллонного катетера в проксимальное русло аорты и в обе подвздошные артерии через разрез передней стенки аневризматического мешка; пережатие аорты в грудном отделе после предварительной торакотомии.
Каждый из указанных методов используется в зависимости от конкретной ситуации, сложившейся в момент выполнения операции.
После остановки кровотечения выполняется резекция аневризмы с ее протезированием, а при необходимости восстанавливается кровоток по висцеральным и почечным ветвям аорты.
Тяжесть общего состояния больных с разорвавшимися аневризмами, техническая сложность хирургического вмешательства обусловливают высокую послеоперационную летальность, колеблющуюся от 10 до 70 %.
В последние годы в качестве альтернативы традиционному хирургическому лечению при разрыве АБА используется установка эндоваскулярного стента. В отличие от открытого хирургического вмешательства этот метод является значительно менее инвазивным. По немногочисленным данным литературы, установка стента уменьшает уровень смертности и количество послеоперационных осложнений. Однако для успешной установки эндоваскулярного стентового протеза в аневризму аорты необходимо, чтобы проксимальная «шейка» аорты не была бы короче 1,5 см и там не должно быть выраженной кальцификации. Перегиб аорты и тазовых сосудов делает установку стента более сложной.
Госпитализация
Целесообразно госпитализировать больного в палату интенсивной терапии, где наряду с продолжающейся подготовкой к операции выполняются УЗИ, при возможности, КТ. Кроме того, должна проводиться оценка функции сердца, легких и почек. На тот случай, когда немедленная операция по каким-либо случаям невозможна, существуют бескровные методы временной остановки кровотечения из разорванной аневризмы аорты. Успешно применяется пневматическая компрессия тела, позволяющая остановить кровотечение из аорты на период около 2-5 часов. Однако область ее использования ограничена временем транспортировки больного.
Профилактика
Необходимо выявлять и лечить артериальную гипертонию, а также устранять факторы риска развития и прогрессирования атеросклероза (повышенное содержание холестерина, курение, гиподинамия, сахарный диабет и т.д.). Кроме того, следует своевременно выявлять и устранять аневризмы аорты. Для этих целей, особенно пациентам с артериальной гипертонией, может быть полезно ежегодное выполнение ЭхоКГ. Лицам с синдромом Марфана и другими наследственными заболеваниями, при которых нарушается прочность аорты (обычно эти болезни имеют семейный характер и о расслоении аорты в таких семьях наслышаны), показано наблюдение у кардиолога. Пациентам, у которых во время операции расслоение было ликвидировано не на всем протяжении, показаны ежегодные ЭхоКГ и МРТ органов грудной клетки и брюшной полости в плановом порядке, а также досрочно при ухудшении их самочувствия.
Гибридные эндоваскулярные вмешательства при аневризмах восходящей аорты и дуги аорты

Эндопротезирование аневризм аорты (EVAR) в последние годы получило широкое распространение, и у многих пациентов с патологией грудного и брюшного отделов аорты данное вмешательство рассматривается в качестве метода выбора [24-27,33,35]. Также в современных условиях активно развивается эндопротезирование аневризм восходящей аорты и дуги. Во многих рандомизированных исследованиях показано преимущество этих операций перед открытыми вмешательствами в ближайшем периоде, прежде всего за счет уменьшения кровопотери, продолжительности операции и пребывания в больнице, а также вследствие снижения частоты летальности и осложнений [24-27,33,37,38].
Наличие короткой шейки или вовлечение в аневризму крупных боковых ветвей по-прежнему ограничивает применение эндоваскулярных методов лечения данной патологии. У этой группы пациентов открытые хирургические вмешательства остаются стандартом лечения, хотя их техническая сложность возрастает из-за необходимости в более проксимальном пережатии аорты, а также из-за продолжительной ишемии органов-мишеней и более обширной реконструкции [27,33,38].
К сожалению, часто аневризмы аорты имеют большую протяженность, сопровождаются расслоением, а также возникают у пациентов пожилого возраста или у больных с тяжелыми сопутствующими заболеваниями.
Для решения этих проблем были разработаны гибридные операции, когда эндопротезирование аневризм аорты сочетается с различными открытыми сосудистыми вмешательствами. Наиболее востребованной технологией в современных условиях является дебранчинг (переключение ветвей).
Дебранчинг (англ. debranching) - это метод гибридной коррекции аневризм аорты, суть которого заключается в предварительном шунтировании (протезировании) крупных ветвей аорты с целью их переключения и дальнейшей имплантации стент-графта в аневризматически расширенный отдел аорты. В результате подобного вмешательства минимизируется риск ишемических осложений и летальных исходов по сравнению с открытыми хирургическими операциями, за счет уменьшения времени пережатия аорты, времени искусственного кровообращения и продожительности ишемии головного мозга и внутренних органов.
Гибридные операции при аневризмах восходящей аорты и дуги аорты
Концепция гибридных операций при аневризмах дуги аорты строится на двух основных принципах: 1) выполнение адекватного дебранчинга брахиоцефальных артерий; 2) создание оптимальных зон для проксимальной и дистальной фиксации стент-графта.
Перед планированием вмешательства необходимо выполнение 3D мультиспиральной компьютерной томографии аорты и брахиоцефальных артерий с контрастированием, для точного понимания анатомии аневризмы и измерения всех необходимых показателей (в т.ч. расчета правильных зон фиксации графта). Протяженность проксимальной зоны фиксации должна быть не менее 2 см от края аневризмы, и только в этом случае эндопротезирование дуги аорты считается оправданным. Во всех остальных случаях рекомендовано выполнение открытой операции 31.
Для планирования различных видов эндопротезирований при расслоении аорты Mitchell с соавт. разработали специальную анатомическую классификацию, на основании которой дуга аорты, а также ее восходящий и нисходящий отделы разделяются на зоны, в пределах которых осуществляется фиксация стент-графта (см. рис. 1) [28]. Данная классификация в последнее время завоевала широкое распространение во всем мире, и активно используется при планировании гибридных вмешательств.
Большинство хирургов в настоящее время выделяют 3 типа гибридных операций при аневризмах дуги аорты, в зависимости от ее анатомии и от состояния зон фиксации графта по классификации Mitchell-Ishimaru (см. рис. 2). При классической изолированной аневризме дуги аорты состояние всех зон прикрепления эндопротеза обычно оптимально (расстояние от края аневризмы 2 см и более, отсутствуют тромбоз, сильный кальциноз или выраженная извитость), поэтому рекомедован 1 тип гибридных вмешательств. При данном виде сначала выполняется классический дебранчинг ветвей дуги аорты, затем имплантируется стент-графт от зоны Z0, либо одномоментно с открытым этапом, либо отсроченно ретроградным доступом.
Если отсутствует хорошая проксимальная зона фиксации (Z0), но при этом достаточно адекватная дистальная зона прикрепления (Z3/Z4), выполняют 2 тип гибридных операций. Главное отличие от 1 типа - необходимость создания адекватной проксимальной зоны фиксации для установки стент-графта, которая достигается с помощью открытого протезирования восходящей аорты и сопровождается гипотермической остановкой кровообращения [24-31,34]. При протяженных аневризмах восходящей аорты и дуги с переходом на нисходящую аорту (т.н. синдром “мега-аорты”), когда и проксимальная, и дистальная зоны прикрепления не являются адекватными, выполняют 3 тип гибридных операций. Обычно он представлен тотальной открытой реконструкцией восходящей аорты и дуги в модификации “хобот слона” (“elephant trunk”) с последующей одномоментной или отсроченной имплантацией стент-графта в грудную аорту, который фиксируется с переходом на вышележащую протезированную часть аорты 42. В современных условиях набирает популярность техника “замороженный хобот слона” (“frozen elephant trunk”), когда раскрытие эндографта происходит в условиях гипотермической остановки кровообращения [41,42]. Для подобных вмешательств, кроме обычных стент-графтов часто используются специальные гибридные устройства, проксимальная часть которых представлена линейным сосудистым протезом, а дистальная часть - стент-графтом, например “Thoraflex Hybrid” (Vascutek) или “E-vita Open Plus” (JOTEC) [37]. Непосредственную имплантацию эндопротеза в зависимости от анатомии и предпочтений хирурга можно выполнить интраоперационно (через открытую дугу аорты, с дальнейшим раскрытием стент-графта в нисходящей аорте), или в рентгенохирургической операционной, после выполнения открытого этапа. В последнее время “замороженный хобот слона” чаще всего выполняется в гибридной операционной, когда стент-графт доставляют стандартным бедренным доступом под контролем рентгена, и имплантируют непосредственно после выполнения открытого этапа. По данным некоторых авторов, подобная техника позволила снизить госпитальную летальность с 10-12% до 5-6% по сравнению с обычным открытым методом выполнения операции “хобот слона” у этой сложной группы пациентов [41,42].
Для выполнения дебранчинга используются различные виды шунтирования и протезирования брахиоцефальных артерий 30. Примеры операций в зависимости от анатомии приведены на рис. 8. Следует отметить, что некоторые авторы не всегда выполняют сонно-подключичное шунтирование (или транспозицию) перед перекрытием стент-графтом области отхождения левой подключичной артерии [33,36]. Абсолютными показаниями к нему являются: 1) доминантная левая позвоночная артерия; 2) наличие функционирующего маммарно-коронарного шунта; 3) наличие диализной артериовенозной фистулы на левой руке; 4) аберрантное отхождение левой позвоночной артерии от дуги аорты; 5) в том случае, если пациент - левша; 6) аберрантное отхождение правой подключичной артерии - a.Luzoria. В остальных случаях, по мнению этих авторов, даже при сопутствующем атеросклеротическом поражении левой подключичной артерии, перекрытие последней стент-графтом редко сопровождается клинической симптоматикой и не требует проведения реваскуляризации левой подключичной артерии. Данная точка зрения получила развитие после проведения исследования EUROSTAR в 2007 году [36]. Тем не менее, данные последних публикаций рекомендуют всегда, если возможно, выполнять реваскуляризацию левой подключичной артерии, т.к. это достоверно снижает частоту инсультов и летальности после гибридных вмешательств на дуге аорты 32.
Также многие авторы рекомендуют в ходе дебранчинга закрывать проксимальную часть левой подключичной артерии с помощью специального эндоваскулярного окклюдера, например, “Amplatzer”. Это проводится для предотвращения возникновения эндоликов 2 типа в отдаленном периоде [25,27,32].
Существуют анатомические варианты, когда вместо стандартного сонно-подключичного шунтирования безопаснее выполнить одномоментное эндоваскулярное эндопротезирование по методике “chimney” (“дымоход”); некоторые авторы докладывали об использовании техник двойного и даже тройного “chimney”, когда стент-графты устанавливались во все брахиоцефальные артерии [43]. К сожалению, после выполнения сложных вариантов “chimney”, в ближайшем послеоперационном периоде высока частота развития эндоликов 1 типа, которые приходится корригировать с помощью открытых операций или различных эмболизаций.
По данным Rango и соавт., после выполнения гибридных операций на дуге аорты у 104 пациентов, частота госпитальной летальности составила 5,8%, инсульта - 3,8%, ишемии спинного мозга 2,9%. У 4 (3,8%) больных возникла ретроградная диссекция типа А, по поводу которой выполнялось протезирование восходящей аорты [44].
По данным Ferrero и соавт., большое значение для результатов вмешательства имеет анатомия аневризмы и локализация зоны фиксации графта. Так, при анализе 1886 гибридных операций на дуге аорты было выявлено, что при перекрытии зоны Z0 частота периоперационной летальности составила 15,1%, а при перекрытии зоны Z1 - только 7,1%. Также показано, что при перекрытии зоны Z0 обнадеживающие результаты показывают многобраншевые эндографты, но ученые в настоящее время ждут данных рандомизированных исследований для их подтверждения этого [27].
Одним из специфических осложнений гибридных вмешательств на аорте является ишемия спинного мозга. Предикторами ее развития являются возраст пациента (старше 75 лет), дистальная зона фиксации стент-графта ниже Th7 позвонка и хирургические вмешательства на брюшной аорте в анамнезе [27,30,35]. Для предотвращения данного осложнения в последнее время активно применяется дренирование спинномозговой жидкости.
Как показывают данные современных исследований, при выполнении адекватного дебранчинга брахиоцефальных артерий частота периоперационного инсульта невысока (до 2%). В то же время при отсутствии реваскуляризации перекрытой стент-графтом артерии частота инсульта может возрастать до 8% [30,35].
Отдельно можно выделить гибридные вмешательства при расслоении аорты I типа по Де Бейки. В случае, если расслоение распространяется на торакоабдоминальную аорту и угрожает перфузии внутренних органов, некоторые специалисты считают предпочтительным выполнение гибридной операции. При этом обычно проводится стандартное протезирование восходящей аорты с гипотермической остановкой кровообращения, далее антеградно в истинный просвет проводится стент-графт, который раскрывается и далее анастомозируется с аортальным протезом. Подобная методика сокращает время операции и способствует увеличению выживаемости у этой сложной группы пациентов [44].
Список литературы:
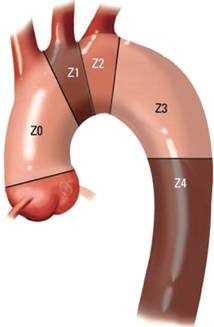
Анатомическое разделение аорты на условные зоны фиксации стент-графтов (Z0-Z4) по классификации Mitchell.
Читайте также:
