Ранения поджелудочной железы - варианты, шкала тяжести по OIS
Добавил пользователь Дмитрий К. Обновлено: 01.02.2026
Материал и методы
Нами проведен ретроспективный анализ историй болезни пострадавших с изолированной и сочетанной травмой живота, которые находились на лечении в НИИ скорой помощи им. Н.В. Склифосовского с января 2000 г. по июль 2009 г. (437 наблюдений). Из исследования исключены пострадавшие, умершие в первые сутки с момента поступления или переведенные из других стационаров. Диагноз ЗК был установлен у 359 больных на основании данных инструментального исследования (УЗИ, КТ) или обнаружения во время операции. Следует отметить, что наиболее часто используемая классификация ЗК F. Henao и J. Aldrete [15] не учитывает распространение кровоизлияний на две зоны и более, поэтому мы дополнили эту классификацию, разделив все ЗК на два вида - распространенные и локальные. Распространенным считаем ЗК первого и второго типов по классификации F. Henao и J. Aldrete, охватывающее тазовую клетчатку, или ЗК третьего типа, вышедшее за пределы таза. Локальным называем ЗК, расположенное в пределах одной зоны.
В 1-ю группу (с распространенным ЗК) включено 75 пострадавших, во 2-ю - 284 пациента с локальными ЗК. У 77 больных данных о наличии ЗК не получено, они составили группу сравнения. В 1-й группе было 75% мужчин, во 2-й - 79,2%, в группе сравнения - 84,4%. Средний возраст пострадавших 1-й группы составил 35,2±14,5 года, 2-й - 33,9±13,0 года, группы сравнения - 35,5±14,2 года. Пол и возраст пострадавших в группах одинаковы, большинство составили мужчины трудоспособного возраста.
Самыми частыми причинами повреждений во всех группах были автодорожные происшествия (38, 47 и 45% соответственно) и кататравма (37, 31 и 30% соответственно). Значимого различия в группах по механизму травмы не обнаружено.
Тяжесть травмы оценивали по шкале ISS. При этом выявлено, что наиболее тяжелая травма была у пострадавших с распространенным ЗК (27±16 баллов). У пациентов с локальным кровоизлиянием тяжесть травмы была меньше (20±14 баллов), у больных группы сравнения - наименьшей (14±10). Наши данные согласуются с результатами, полученными другими исследователями [2, 11], и свидетельствуют о том, что ЗК образуются у пострадавших с наиболее тяжелыми повреждениями.
Состояние пострадавших при поступлении соответствовало тяжести травмы. Наиболее тяжелое состояние было у пострадавших с распространенным ЗК (индекс шкалы RTS=6,683±1,070). У пациентов с локальным кровоизлиянием общее состояние было более стабильным (индекс шкалы RTS=6,927±1,236). Наиболее легкое состояние наблюдали у больных группы сравнения (индекс шкалы RTS=7,438±0,876). Тяжесть травмы и состояние пострадавших при поступлении в группах различались статистически достоверно, что доказано непараметрическим анализом методом Краскелла-Уоллиса (р=0,00).
Экстренно оперировано 50 пострадавших из 1-й группы (оперативная активность 65,8%), 184 из 2-й группы (оперативная активность 64,8%) и 59 из группы сравнения (оперативная активность 76,6%). Всего пациентам 1-й группы выполнены 82 операции, 2-й - 286, группы сравнения - 90. Таким образом, примерное количество оперированных больных и операций у одного пострадавшего одинаково. Наиболее часто выполняли лапаротомию (58,5, 46,2 и 57,8% в 1, 2 и 3-й группе соответственно). На втором месте было дренирование плевральной полости (20,7, 18,2 и 24,4% соответственно). Другие операции (диагностическую видеолапароскопию, первичную хирургическую обработку ран различных локализаций, стабилизацию переломов длинных трубчатых костей или костей таза) выполняли реже.
Наиболее часто ЗК локализовались в латеральной зоне справа (95 наблюдений). Причиной его образования в 23 наблюдениях было повреждение правой почки, у большинства (19 больных) - I-II степени по OIS. В 23 наблюдениях установить причину правостороннего латерального ЗК не удалось, несмотря на применение инструментальных методов диагностики. Оказалось, что повреждение правого надпочечника (12 наблюдений) и одновременное повреждение правого надпочечника и правой почки (11 наблюдений) довольно часто являются причиной развития правостороннего латерального ЗК, хотя в литературе данный вид повреждения практически не описан. У четверти пациентов обнаружить источник ЗК не удалось. Другие источники правостороннего латерального ЗК также обнаружены в четверти наблюдений. Они представлены разрывами VII сегмента печени и переломами нижнегрудного и поясничного отделов позвоночника (по 6 наблюдений), переломами подвздошных костей (4 наблюдения) и разрывом печени и правого надпочечника (2 наблюдения). Гематома правого надпочечника и переломы ребер; разрывы печени и правой почки; повреждения печени, правой почки и правого надпочечника; разрыв двенадцатиперстной или восходящей ободочной кишки; панкреатодуоденальной вены, подвздошно-толстокишечной или правой толстокишечной артерии диагностированы по одному разу.
На втором месте по частоте были распространенные ЗК (76 наблюдений). У большинства пострадавших их причиной послужили изолированные переломы костей таза (35 человек) или переломы костей таза с разрывом мочевого пузыря (7) и почки (3). Переломы таза типа А по классификации Tile-AO были у 13 больных, типа В - у 15, типа С - у 17. Другие причины образования распространенного ЗК диагностировали реже. Так, разрывы почки были установлены у 8 человек (все III или IV степени по OIS), переломы нижнегрудного или поясничного отдела позвоночника - у 4, травма поджелудочной железы - у 3. Источник распространенного ЗК не найден только у 2 пострадавших. Также 2 пациента имели в качестве источника распространенного ЗК разрыв нижней полой или почечной вены, одновременный перелом костей таза и разрыв селезенки. Все остальные причины образования распространенного ЗК обнаружены по одному разу. Среди них были одномоментные повреждения верхней панкреатодуоденальной артерии, поджелудочной железы и почки; диафрагмы, почки и перелом костей таза; травма диафрагмы, селезенки и позвоночника; перелом позвоночника с разрывом правого надпочечника; перелом костей таза с разрывом мочевого пузыря и уретры; перелом костей таза и ребер. К появлению распространенного ЗК также привело два изолированных повреждения сосудов: разрыв левой толстокишечной артерии и отрыв поясничной вены от нижней полой.
Левостороннее латеральное ЗК обнаружено у 66 пациентов. У 28 из них источником развития таких кровоизлияний был разрыв левой почки (в 21 наблюдении II-III степени по OIS). Разрывы селезенки привели к образованию левостороннего латерального ЗК у 20 пациентов. Не обнаружены источники кровоизлияния в забрюшинное пространство у 8 пострадавших. Перелом ребер слева одновременно с разрывом селезенки привел к образованию ЗК у 4 пострадавших, одновременно с травмой левой почки - у 2. Также у 2 пациентов диагностирован разрыв селезенки и поджелудочной железы. Перелом нижнегрудного отдела позвоночника и одновременная травма левой почки и левого надпочечника были констатированы по одному разу.
Тазовое ЗК выявлено у 60 пострадавших. Перелом костей таза обнаружен в большинстве наблюдений (54). В 12 из них он осложнился разрывом мочевого пузыря (внебрюшинным у 10, внутрибрюшным у 2). Переломы таза типа А по классификации Tile-AO были у 34 больных, типа В - у 13, типа С - у 7. Изолированный внебрюшинный разрыв мочевого пузыря привел к образованию тазового ЗК у 2 больных. Было также по одному наблюдению разрыва ветви подвздошной вены, нижней надчревной артерии, перелома костей таза с отрывом уретры. У одного пострадавшего источник тазового ЗК не был установлен.
Комбинированные ЗК, т.е. два не сливающихся кровоизлияния, локализующиеся в различных зонах по Henao и Aldrete, обнаружены у 42 пациентов. Как локализация кровоизлияний, так и их источники были чрезвычайно разнообразными, однако их распределение соответствовало таковым у пациентов с одиночными ЗК. Наиболее часто обнаруживалось тазовое и латеральное ЗК: у 12 больных - справа, у 5 - слева. У 9 больных наблюдали двусторонние латеральные ЗК, у 5 -латеральное (у 4 справа, у 1 слева) и нижнемедиальное ЗК. Правостороннее латеральное и верхнемедиальное кровоизлияние обнаружили у 2 пострадавших, тазовое и верхнемедиальное - у 1. В патологический процесс у 6 больных были вовлечены три зоны: обе латеральные и тазовая - у 3, обе латеральные и верхнемедиальная - у 2, тазовая, нижнемедиальная и латеральная слева - у 1. У 2 пациентов ЗК обнаружены в четырех зонах: латеральное с обеих сторон, верхне- и нижнемедиальное; тазовое, двустороннее латеральное и верхнемедиальное. Наиболее частой причиной комбинированных ЗК были переломы костей таза - у 22 пострадавших. У 16 пострадавших обнаружена травма почек, в таком же количестве наблюдений источник ЗК не найден. Другие источники ЗК диагностировались реже: травма поджелудочной железы - у 5 пострадавших, брыжейки тонкой кишки - у 4, правого надпочечника и селезенки - по 3. Повреждения печени, почечной артерии и почечной вены выявили по 2 раза.
Наиболее частой причиной нижнемедиального ЗК, обнаруженного у 18 пострадавших, была травма поджелудочной железы (6 наблюдений). Разрыв брыжейки тонкой кишки диагностирован у 4 пострадавших, у других 4 пациентов не удалось обнаружить причину кровотечения в забрюшинное пространство. Перелом поясничных позвонков был у 2 больных. А качестве причины нижнемедиального ЗК отмечен разрыв верхних брыжеечных артерии и вены (по одному наблюдению).
Самыми редкими были верхнемедиальные кровоизлияния, выявленные у 3 больных: травма поджелудочной железы - у 1, разрыв панкреатодуоденального комплекса - у 1, источник ЗК не обнаружен в 1 наблюдении.
Таким образом, наиболее часто в клинической практике диагностируют латеральные, распространенные и тазовые ЗК. Причинами кровотечения в забрюшинную клетчатку обычно являются переломы костей таза и травма почек. Распространенность ЗК коррелирует со степенью травмы почки и в меньшей степени с типом перелома костей таза. На третьем месте по частоте находится травма правого надпочечника. При небольших ЗК определить причину кровотечения удается не всегда.
Результаты

Частота осложнений у пострадавших исследуемых групп и группы сравнения приведена в табл. 1. При ЗК наиболее часто развиваются гнойный трахеобронхит и пневмония, острая дыхательная и острая почечная недостаточность, другие осложнения диагностировались реже.
Диагноз пневмонии и гнойного трахеобронхита устанавливали на основании данных рентгенологического или компьютерно-томографического исследования, фибробронхоскопии и микробиологического исследования мокроты.
Острую дыхательную недостаточность диагностировали при наличии одного из следующих критериев: частота дыханий более 35 или менее 8 в 1 мин, paO2 менее 70 мм рт.ст., рaСО2 более 50 мм рт.ст., рaО2FiO2 менее 300, SvO2 менее 90% при дыхании атмосферным воздухом [3].
Острую почечную недостаточность устанавливали на основании критериев ADQI [14].
Тромбоз вен нижних конечностей и нижней полой вены подтверждали с помощью ультразвуковой допплерографии.
Парезом желудочно-кишечного тракта считали стойкое нарушение моторно-эвакуаторной функции желудка или кишечника, подтвержденное данными рентгенологического или ультразвукового исследования.
Печеночную недостаточность в связи с отсутствием четких критериев предполагали при существенном и стойком повышении уровня билирубина в плазме, повышении «индикаторных» ферментов печени, снижении протромбинового индекса или международного нормализованного отношения. Определение печеночной энцефалопатии было затруднено в связи с тяжелой черепно-мозговой травмой, длительной искусственной вентиляцией легких и медикаментозной седацией пациентов.
Диагноз гнойных осложнений (внутрибрюшные абсцессы, забрюшинная флегмона) устанавливали на основании клинико-лабораторной картины, подтверждали с помощью ультразвукового или компьютерно-томографического исследования. После дренирования гнойного очага проводили микробиологическую оценку возбудителя.
Инфекции мочевыводящих путей (пиелонефрит, цистит) верифицировали на основании общего и микробиологического анализа мочи.
Синдром интраабдоминальной гипертензии диагностировали при стойком повышении внутрибрюшного давления более 20 см рт.ст. и наличии признаков органной дисфункции или недостаточности [18].
Поскольку исследуемые группы и группа сравнения различаются не только по распространенности ЗК, но и по тяжести травмы и состояния, применение сравнительных методов статистического анализа неправомочно, поэтому нами использован метод множественной регрессии. Прогностические факторы выделены на основании данных литературы и эмпирического анализа клинического материала. Вид ЗК (распространенное или локальное) включили в регрессионный анализ всех зависимых признаков, которыми было наличие или отсутствие перечисленных выше осложнений. Пороговым значением p принято 0,05. Расчеты проведены с использованием программы Statistica 6.0, StatSoft Inc.

Прогностические факторы и регрессионные коэффициенты для них приведены в табл. 2. Развитию пневмонии способствуют два фактора: тяжелая травма грудной клетки (≥III степени по OIS) и распространенное ЗК. Обнаруженная зависимость имеет патогенетическое объяснение. С одной стороны, развитию пневмонии способствует нарушение каркасной функции грудной клетки при переломах ребер и тяжелая травма легких, с другой - распространенное ЗК приводит к парезу желудочно-кишечного тракта, а он, в свою очередь, к нарушению функции диафрагмы и ателектазам базальных отделов легких. Эти же факторы делают более вероятным развитие острой дыхательной недостаточности, чему также способствует травматический шок, который приводит к респираторному дистресс-синдрому. Наиболее значимой причиной острой почечной недостаточности является вазопрессорная поддержка в течение первых суток после поступления. Объяснением этому является снижение почечного кровотока при применении вазопрессоров. Дополнительными причинами острой почечной недостаточности являются распространенное ЗК (по-видимому, за счет всасывания продуктов ее распада) и массивная гемотрансфузия, влияние которой на функцию почек хорошо известно. К тромбозам нижней полой вены и ее притоков приводят переломы костей таза, позвоночника и бедренной кости. Причиной тромбозов у этих пациентов скорее всего является длительная гиподинамия. Распространенность ЗК не оказывает существенного влияния на развитие тромбоза вен нижних конечностей и нижней полой вены. Парез желудочно-кишечного тракта возникает у больных с распространенным ЗК, что можно объяснить вовлечением в патологический процесс корня брыжейки тонкой кишки. Фактором риска печеночной недостаточности является массивная гемотрансфузия, однако распространенность ЗК не влияет на развитие этого осложнения. У больных исследуемых групп не удалось определить причины развития абдоминальных гнойных осложнений и инфекций мочевыводящей системы, таких как пиелонефрит и цистит. Синдром интраабдоминальной гипертензии чаще развивается у больных, которым в первые сутки проводили массивную инфузионную терапию, однако распространенность ЗК на него не влияет.
Таким образом, пациенты с закрытой травмой живота, таза и забрюшинным кровоизлиянием (ЗК) при поступлении находятся в более тяжелом состоянии, чем пострадавшие с такой же травмой, но без ЗК, при этом чем больше распространенность кровоизлияния, тем тяжелее состояние пострадавшего. Целесообразно выделение двух видов ЗК - локального и распространенного. Причиной первого является травма почек I-II степени по OIS или перелом костей таза (обычно типа А по классификации Tile-AO), второе возникает при переломах костей таза (различных типов по той же классификации) или тяжелой травме почек (III-IV степени по OIS). Типичными осложнениями у больных с распространенным ЗК являются пневмония и гнойный трахеобронхит, острая дыхательная и острая почечная недостаточность, парез желудочно-кишечного тракта. Нам не удалось обнаружить связь между ЗК и развитием осложнений, которые ранее считали типичными, а именно печеночной недостаточности и синдрома интраабдоминальной гипертензии. Наличие ЗК также не увеличивает риск развития гнойных процессов в забрюшинном пространстве. Следовательно, пострадавшим с распространенным ЗК, сочетающимся с тяжелой травмой грудной клетки, показано проведение мероприятий, направленных на профилактику пареза желудочно-кишечного тракта и бронхолегочных осложнений. Больным с распространенным ЗК, которым проводили массивную гемотрансфузию или вазопрессорную поддержку, показан контроль за функцией почек.
Классификация AAST при травмах поджелудочной железы
Травма поджелудочной железы составляет 15-20% повреждений органов брюшной полости. В 90 % случаев они сочетаются с повреждением других органов, прежде всего желудка, печени, кишечника, селезенки. Анатомические особенности поджелудочной железы определяют сложность диагностики повреждений и тяжесть течения патологического процесса при ее ранении.
Важнейшим осложнением повреждения поджелудочной железы является посттравматический панкреатит. По имеющимся данным, при травме поджелудочной железы он развивается в 28-100% наблюдений, имеет различные морфологические формы и сопровождается поражением забрюшинной клетчатки разной степени выраженности.
Летальность при повреждении поджелудочной железы достигает 50%. Основными ее причинами остаются аррозионное кровотечение и полиорганная недостаточность, связанные с вовлечением в воспалительный процесс забрюшинного пространства и сепсисом.
Комитет AAST по градации повреждений органов выпустил руководство по лечению и категоризации травм поджелудочной железы. Оно разработано на основе ряда опубликованных систем классификации, которые были предложены для описания этих повреждений. Это руководство подчеркивает, что главными факторами, определяющими осложнения и смертность при травме поджелудочной железы, являются структурная целостность главного панкреатического протока и расположение места повреждения относительно брыжеечных сосудов.
Шкала AAST, используемая при повреждениях поджелудочной железы:
I степень травмы:
Оценка тяжести острого панкреатита по данным КТ (Balthazar)

Balthazаг и соавторы предложили составной КТ-индекс тяжести (СТ Severily Index — CTSI) для оценки тяжести паренхиматозного некроза (баллы от 0 до 6) и экстрагландулярного воспалительного процесса (стадии А—Е, баллы 0—4).
Диапазон КТ-баллов от 0 до 10 обнаруживает отличные корреляции с клинической тяжестью, осложнениями и смертностью. Пациенты с CTSI от 0 до 1 не имеют смертности и осложнений, в то время как у пациентов с индексом 2 нет смертности, но имеется в 4% случаях осложнения, а с индексом 7—10 — 17% смертности и 92% осложнений.
КТ-оценка тяжести острого панкреатита (СТ Severily Index — CTSI)
Оценка острого воспалительного процесса (по Balthazar)
- Стадия А (0 баллов) - Нормальная поджелудочная железа
- Стадия B (1 балл) - Изменения внутри поджелудочной железы: фокальное или диффузное увеличение железы, легкая гетерогенность паренхимы, маленькие (менее 3 см) интрапанкреатические скопления жидкости.
- Стадия С (2 балла) - То же, что и при В, но с небольшими воспалительными измениями перипанкреатических тканей.
- Стадия D (3 балла) - То же, что и при С, но более выраженные перипанкреатические воспалительные изменения (не более одного скопления жидкости).
- Стадия Е (4 балла) - Множественные и распространенные перипанкреатические скопления жидкости или абсцессы.
Оценка панкреонекроза
- Норма - (0 баллов) - Нет некроза. Равномерное контрастное усиление
- Мягкий некроз - (2 балла) - Менее 30% панкреатической паренхимы
- Умеренный некроз - (4 балла) - 30-50% панкретической паренхимы
- Распространенный некроз - (6 баллов) - Более 50% панкреатической паренхимы
Источник
1. Balthazar EJ. Acute pancreatitis: assessment of severity with clinical and CT evaluation. Radiology. 2002;223 (3): 603-13. Radiology (full text) - doi:10.1148/radiol.2233010680 - Pubmed citation
2. Balthazar EJ, Robinson DL, Megibow AJ et-al. Acute pancreatitis: value of CT in establishing prognosis. Radiology. 1990;174 (2): 331-6. Radiology (abstract) - Pubmed citation
3. 3. Bollen TL, Singh VK, Maurer R et-al. A comparative evaluation of radiologic and clinical scoring systems in the early prediction of severity in acute pancreatitis. Am. J. Gastroenterol. 2011;107 (4): 612-9. doi:10.1038/ajg.2011.438 - Pubmed citation
Ранения поджелудочной железы - варианты, шкала тяжести по OIS
Научно-исследовательский институт скорой помощи им. Н.В. Склифосовского, Москва
Научно-исследовательский институт скорой помощи им. Н.В. Склифосовского Департамента здравоохранения Москвы
Закрытая травма живота. Повреждения поджелудочной железы. Часть 4
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2016;(8): 4‑12
В этой лекции мы обсудим довольно редкий вид повреждения при закрытой травме живота. Повреждение поджелудочной железы (ППЖ) встречается всего у 0,2-1% пострадавших с закрытой травмой 2 и у 3,1% пострадавших с закрытой травмой живота [4]. ППЖ, по-видимому, чаще бывает у детей, однако эта лекция, как предыдущие и последующие, посвящена хирургии повреждений у взрослых.
По мнению D. Dahiya и соавт. [5], ППЖ по частоте находится на четвертом месте после повреждения печени, селезенки и почек. Небольшое количество пострадавших с ППЖ ограничивает возможность выработки доказательных рекомендаций [6]. Для повышения уровня доказательности некоторые ученые объединяют в одну группу пострадавших с закрытой и открытой травмой, однако авторы считают такой дизайн исследования ошибочным.
ППЖ возникает при сдавлении органа между тупым твердым предметом и позвоночником, а также при прямом ударе в область эпигастрия и подреберий 8.
Наиболее частой причиной ППЖ в Европе и развивающихся странах является дорожно-транспортное происшествие [2, 11-14]. По данным судебно-медицинских аутопсий, среди причин смерти пострадавших с ППЖ на первом месте были дорожно-транспортные происшествия, на втором - железнодорожное происшествие и на третьем - кататравма [15].
Особенности топографической анатомии поджелудочной железы (ПЖ) обусловливает ее изолированное повреждение у меньшего числа пострадавших 18.
Существуют несколько классификаций ППЖ, которые приведены в хронологическом порядке (табл. 1,2 2, 3, 4, 5).

Таблица 1. Классификация повреждений поджелудочной железы C. Lucas (1977 г., цит. по [19]) Примечание. ПЖ - поджелудочная железа; ДПК - двенадцатиперстная кишка.
Таблица 2. Классификация повреждений поджелудочной железы D. Smego [20]

Таблица 3. Классификация повреждений поджелудочной железы The American Association for the Surgery of Trauma [21] Примечание. Добавить одну степень при множественных повреждениях поджелудочной железы, но не более III степени; * - дистальный отдел ПЖ расположен справа от верхней брыжеечной вены; ** - проксимальный отдел ПЖ расположен слева от верхней брыжеечной вены.

Таблица 4. Классификация повреждений поджелудочной железы C. Frey и J. Wardell (цит. по [22])
Таблица 5. Классификация повреждений поджелудочной железы T. Takishima [24] Примечание. ПП - панкреатический проток.
В классификацию А.К. Ерамишанцева и А.Б. Молитвословова [23] включены ушиб ПЖ с образованием ненапряженной подкапсульной гематомы без повреждения капсулы; разрыв ПЖ или ее размозжение без повреждения главного панкреатического протока; разрыв ПЖ или ее размозжение с повреждением главного панкреатического протока; сочетанное панкреатодуоденальное повреждение.
Читателю, желающему более подробно ознакомиться с классификацией ППЖ, предлагаем ознакомиться со статьей G. Oniscu и соавт. [22].
Своевременная диагностика ППЖ позволяет рано начать адекватное консервативное лечение или выполнить операцию, а задержка в лечении увеличивает частоту осложнений и неблагоприятных исходов 28.
Симптомы ППЖ неспецифичны и часто замаскированы травмой других органов, поэтому клиническая диагностика этого состояния сложна [31]. Если больному выполняют экстренную лапаротомию, то диагностика ППЖ сводится к полноценной ревизии органов брюшной полости и забрюшинного пространства [32]. Типичные ошибки, заключающиеся в уклонении от ревизии сальниковой сумки и отказе от мобилизации ПЖ, приводят к тому, что ППЖ оказывается недиагностированным даже во время лапаротомии.
Изолированное ППЖ до лапаротомии установить непросто. По данным A. Leppäniemi и R. Haapiainen [33], факторами риска поздней диагностики ППЖ являются закрытая травма, интоксикация при поступлении, низкий индекс тяжести травмы (New Injury Severity Score [34] или Abdominal Trauma Index [35]), отсутствие повреждений других органов брюшной полости и консервативное лечение пострадавшего.
В клинической диагностике ППЖ G. Jurkovich и C. Carrico [36] советуют обращать внимание на травму верхнего отдела живота, классическим примером которой считают удар о рулевое колесо автомобиля или руль велосипеда, на следы травмы верхней половины живота, перелом нижних ребер или реберной дуги. Боль в эпигастральной области, не соответствующая находкам при клиническом осмотре, также является настораживающим признаком.
Роль амилаземии в диагностике ППЖ неясна. D. Potoka и соавт. [19] считают, что этот показатель не обладает достаточной чувствительностью и специфичностью. Следует подчеркнуть, что гиперамилаземия возникает не ранее чем через 3 ч после травмы. Повышение уровня амилазы, по данным K. Xie и соавт. [3], отмечено у 86% пострадавших с ППЖ и у всех пострадавших, наблюдавшихся L. Kaman и соавт. [12]. Эти работы свидетельствуют о достаточно высокой чувствительности амилаземии, однако какой специфичностью обладает этот тест? Повышение уровня амилазы и липазы определяют при разрыве двенадцатиперстной и тощей кишок у некоторых пострадавших, находящихся в шоке или требующих массивной гемотрансфузии [37], у пострадавших с тяжелой черепно-мозговой травмой [38]. В работе [39], которая включила собственное исследование и систематический анализ литературы, доказано, что одновременное повышение уровня амилазы и липазы сыворотки крови имеет 100% специфичность и 85% чувствительность в диагностике ППЖ. Авторы обращают внимание на то, что повышение уровня этих ферментов происходит не ранее, чем через 6 ч после травмы, и рекомендуют применение этих исследований при отсутствии возможности выполнения инструментальных методов диагностики.
Забрюшинное расположение ПЖ делает малоинформативным лапароцентез и перитонеальный лаваж для диагностики ППЖ в ранние сроки после травмы. Ультразвуковое исследование (УЗИ) рассматривается в качестве метода диагностики ППЖ в единичных работах [40, 41]. В протокол FAST, который чаще всего используют в экстренных ситуациях, осмотр ПЖ вообще не входит. УЗИ брюшной полости и забрюшинного пространства в диагностике ППЖ характеризуется невысокой чувствительностью (44,4%, по данным M. Sato и H. Yoshii [42]). Возможно, УЗИ с контрастным усилением будет обладать большей диагностической точностью, однако такие работы только начали появляться [43, 44].
Компьютерная томография (КТ), являющаяся основным методом неинвазивной диагностики при абдоминальной травме, в отношении ППЖ не обладает такой же высокой точностью, как в отношении других паренхиматозных органов. К прямым компьютерно-томографическим признакам ППЖ относят интенсивное кровотечение из ПЖ, ее гематому или разрыв, локальное или диффузное увеличение органа или его отек, пониженное накопление контрастного вещества. Косвенными признаками ППЖ считают жидкостные скопления в забрюшинном пространстве, отек парапанкреатической клетчатки, утолщение переднего листка почечной фасции, воспалительные изменения парапанкреатической клетчатки или брыжейки, жидкость в сальниковой сумке, рядом с поперечной ободочной кишкой, верхней брыжеечной артерией или селезеночной веной, свободную жидкость в брюшной полости 47. Не все признаки позволяют установить степень ППЖ, многие из них являются неспецифическими [48], однако они заставляют продолжить обследование.
Следует отметить, что использование мультиспиральных томографов дало возможность существенно улучшить диагностику ППЖ и, что особенно важно, диагностику повреждения ПП. С 1998 г. по настоящее время чувствительность КТ в диагностике ППЖ возросла с 33,3% [31, 49] до 78,9-91,7% [50, 51], а в диагностике повреждения ПП - с 52,4 до 91% [51, 52]. Специфичность диагностики ППЖ в настоящее время составляет 90,3-98,4% [46]. Наилучшая визуализация повреждения ПП возможна в портальной фазе исследования [53, 54].
Завершая раздел, посвященный компьютерно-томографической диагностике ППЖ, лекторы считают необходимым высказать мнение о том, что наличие признаков травмы ПЖ является показанием к другим методам обследования - магнитно-резонансной холангиопанкреатографии (МРХПГ) или эндоскопической ретроградной холангиопанкреатикографии (ЭРХПГ). J. Duchesne и соавт. [55] придерживаются такой же точки зрения. Признаки повреждения ПП, выявленные при КТ, являются показанием к операции - эндоскопической (стентирование) или открытой. Отсутствие признаков травмы ПЖ позволяет продолжить консервативную терапию.
МРХПГ является неинвазивным и точным методом диагностики разрыва ПЖ [47, 56], однако у пострадавших с абдоминальной травмой его применяют нечасто. Чувствительность МРХПГ в диагностике ППЖ составила 92,8%, в диагностике разрыва ПП - 91,7% [51].
Для диагностики ППЖ иногда используют видеолапароскопию, которая позволяет исключить продолжающееся внутрибрюшное кровотечение, выполнить осмотр передней поверхности ПЖ и дренировать сальниковую сумку и брюшную полость [3, 67].
Считаем нужным подчеркнуть, что опорными пунктами для выбора метода лечения являются наличие или отсутствие разрыва протока ПЖ и его локализация - дистальная или проксимальная часть органа. Основанием для такого вывода явились работы R. Heitsch и D. Smego [20, 68]. Выбирая метод лечения, необходимо также учитывать общую тяжесть состояния пострадавшего, опыт хирурга и врача-эндоскописта, техническую оснащенность стационара.
Если больному показана экстренная лапаротомия, например по поводу внутрибрюшного кровотечения, то адекватная ревизия ПЖ является ключом к успешной постановке диагноза. Ревизия П.Ж. показана при наличии травмы органов верхнего отдела брюшной полости - печени, селезенки, желудка и ДПК. Центрально-медиальное забрюшинное кровоизлияние (расположенное краниальнее корня брыжейки поперечной ободочной кишки), свертки крови в сальниковой сумке, отек или желчное пропитывание вокруг двенадцатиперстной кишки являются показаниями к тщательной ревизии ПЖ.
Для осмотра головки и перешейка необходимо выполнить мобилизацию ДПК по Кохеру, одновременная мобилизация правого изгиба ободочной кишки позволяет улучшить визуализацию и обеспечивает бимануальную пальпацию головки, перешейка и крючковидного отростка. Ревизию передней поверхности тела и хвоста ПЖ обычно осуществляют через рассеченную желудочно-ободочную связку, причем ее разрез должен быть достаточным для адекватного осмотра брюшины, покрывающей П.Ж. Рассечение париетальной брюшины по верхнему и нижнему краям ПЖ позволяет выполнить ее абдоминизацию, улучшает осмотр и пальпацию. Если предполагают повреждение хвоста ПЖ, необходимо мобилизовать его в едином блоке с селезенкой и левым изгибом ободочной кишки. Ткани при этом надо разделять тупо в бессосудистой зоне между передней поверхностью левой почки и упомянутыми выше органами. Осмотр задней поверхности тела ПЖ через так называемый нижний доступ был предложен одним из авторов лекции [69] как продолжение приема R. Cattell и J. Braasch [70]. Подробное изложение оперативных приемов не входит в задачи лекции.
К сожалению, даже адекватная мобилизация ПЖ не всегда позволяет ответить на вопрос, есть разрыв ее протока или нет. Определенная глубина разрыва и его отношение к средней линии ПЖ позволяют заподозрить повреждение ПП [71]. Y. Hsu и соавт. предложили выполнять лаваж сальниковой сумки и исследовать амилазу и липазу в этой жидкости. Авторы показали выраженное различие в уровне ферментов при травме ПП, его ветвей и при отсутствии травмы ПЖ.
Предложения выполнять интраоперационную ЭРХПГ [73], тонкоигольную пункцию желчного пузыря и холангиографию с предварительным введением морфина гидрохлорида [74], несмотря на утверждение, что подобные приемы снизили послеоперационные осложнения с 55 до 15% [75], не прошли проверку временем и практикой.
Итак, во время операции следует вскрыть и опорожнить «подкапсульную» гематому и, при необходимости мобилизовав ПЖ, осмотреть ее. Если разрыв протока отсутствует или сомнителен, т. е. верифицировано повреждение I-II степени по OIS, следует осуществить максимально щадящий, прецизионный гемостаз, выполнить дренирование сальниковой сумки на всем ее протяжении двумя трубками диаметром 24Fr по верхнему и нижнему краям П.Ж. Следует избегать «глухого» ушивания разрыва ПЖ и тампонады - все исследователи считают, что это многократно увеличивает риск травматического панкреонекроза и его осложнений.
Что делать с культей ПЖ после дистальной резекции? Предложено множество различных способов ее обработки: ушивание среза панкреатического протока U-образным швом нерассасывающейся монофиламентной нитью или его наружное дренирование, прошивание культи ПЖ отдельными швами рассасывающейся нитью [79, 83] или сшивающими аппаратами [84], использование биологических клеев и гемостатиков, однако преимущество того или иного метода не доказано. Некоторые авторы не считают необходимым выполнять обработку культи ПЖ [85]. Обязательным является дренирование сальниковой сумки в конце операции [83].
Риск возникновения сахарного диабета после дистальной резекции в плановой хирургии оценивают в 7,5% [86], 14-39% 87, и даже 50,5% [90], причем вероятность диабета возрастает при хроническом панкреатите по сравнению с доброкачественной или злокачественной опухолью и при удалении бóльшей части ПЖ [91]. Риск возникновения сахарного диабета после дистальной резекции ПЖ по поводу травмы составляет 8,3-16% [1, 12].
Альтернативой дистальной резекции ПЖ является наложение дистального панкреатоэнтероанастомоза на отключенной по Ру петле тонкой кишки [83, 92]. Эта операция исключает возможность возникновения сахарного диабета, однако имеет специфическое осложнение - несостоятельность панкреатоэнтероанастомоза.
В качестве казуистических приводим предложения при полном поперечном разрыве ПЖ накладывать панкреатогастроанастомоз конец в бок [9], выполнять центральную резекцию ПЖ [93], а при частичном разрыве ПП с сохранением его задней стенки накладывать панкреатоэнтероанастомоз бок в бок [11, 94].
Повреждение ПЖ IV-V степени по OIS - самое сложное для выбора метода операции и его практической реализации. При стабильном состоянии пострадавшего и значительном опыте хирурга в гепатопанкреатодуоденальной хирургии рекомендуют панкреатодуоденальную резекцию в одном из ее вариантов (пилоросохраняющую или гастропанкреатодуоденальную) [95, 96].
Предельно тяжелое состояние пострадавшего является показанием к этапному лечению (методика damage control) с временным дренированием и тампонадой области повреждения [25, 97-99]. Время до операции и ее объем необходимо минимизировать [100].
Если состояние пострадавшего удается стабилизировать, проводят второй этап лечения - панкреатодуоденальную резекцию. Такая тактика позволяет увеличить шансы на выживание пострадавших в очень тяжелом состоянии, ее недостатком является большое количество послеоперационных осложнений [101].
Если хирург не обладает достаточным опытом операций в этой области и не планирует второй этап лечения, то показано только дренирование сальниковой сумки [5]. Вся тяжелая работа по диагностике и лечению почти неминуемо возникающих при этом специфических осложнений переносится на послеоперационный период.
Назначение соматостатина или его аналогов сразу после установления диагноза ППЖ целесообразно [102], и чем раньше препараты назначены, тем лучше результаты лечения [26]. При повреждении III и более высокой степени считаются целесообразными антибиотикопрофилактика и полное парентеральное питание [5, 103], обсуждается необходимость наложения еюностомы для питания [104].
Организационные аспекты оказания помощи, в том числе необходимость перевода части пострадавших в травматологический центр первого уровня, прекрасно изложены в статье С.Ф. Багненко и А.Е. Чикина [105], а различные алгоритмы диагностики и лечения ППЖ представлены в нескольких работах [4, 26, 30, 36, 106].
Таким образом, очевидная тенденция хирургии повреждений - взвешенное консервативное лечение пострадавших, операции в ранние сроки только по строгим показаниям, четкое соответствие объема операции тяжести повреждений и тяжести общего состояния пострадавшего, внедрение миниинвазивных процедур - актуальна и для диагностики и лечения повреждений поджелудочной железы. Консервативное лечение повреждений поджелудочной железы I-II степени является общепризнанным [13], III степени - внедряется в практику [103], IV-V - пропагандируется [107].
Миниинвазивное лечение в ранние сроки после травмы, если оно возможно, улучшает результаты консервативной терапии и уменьшает частоту специфических осложнений [60, 108, 109, 110], к которым относятся травматический панкреатит [12, 20, 25, 26], парапанкреатическая киста [1, 56, 66, 11, 111], наружный панкреатический свищ [1, 112, 113], стеноз панкреатического протока [114], внутрибрюшной абсцесс [30, 115]. Отдаленные результаты эндоскопического лечения пока не всегда удовлетворительные [114].
По разным данным [2, 14, 104, 116], предикторами неблагоприятного исхода являются возраст пострадавшего, гемодинамическая нестабильность, закрытая травма и множественные повреждения. Повреждением поджелудочной железы, даже тяжелым, в существенно меньшей степени определяется летальный исход [30, 113, 117]. У гемодинамически стабильных пострадавших с изолированным повреждением поджелудочной железы только время до установления правильного диагноза влияет на результат лечения [118].
Сочетанные повреждения двенадцатиперстной кишки и поджелудочной железы, в зарубежной литературе называемые комплексными, будут рассмотрены в одной из следующих лекций.
Повреждения поджелудочной железы (ПЖ) встречаются у 1—20% пострадавших с проникающими ранениями и при закрытой травме живота, этот показатель не имеет тенденции к снижению [1, 3, 5, 6]. Преобладают сочетанные повреждения, изолированная травма ПЖ отмечается примерно у 30% всех наблюдений [2, 10, 11]. Повреждения П.Ж. характеризуются тяжелым течением, прежде всего за счет травматического панкреатита, частота развития которого достигает 87,5% [7, 8, 12]. Его течение сопровождается большим количеством осложнений, частота которых достигает 78% [4, 9], и высокой летальностью, составляющей, по разным источникам, от 12 до 73% [4, 5, 13].
Цель исследования — оценка различных подходов к тактике лечения пострадавших с травмой ПЖ.
Материал и методы
За период 1991—2012 гг. в НИИ СП им. Н.В. Склифосовского наблюдали 342 пострадавших с травмой П.Ж. Из их числа исключены 43 пострадавших, которые умерли в течение первых 2 сут после травмы от шока, кровопотери и тяжести сопутствующих повреждений. Всего в исследование включены 299 пациентов, среди них в период с 1991 по 2001 г. под наблюдением находились 153 больных (1-я группа), с 2002 по 2012 г. — 146 (2-я группа). Ранения и закрытая травма живота стали причинами повреждения ПЖ в 53 и 47% наблюдений соответственно. При закрытой травме (47,0%) наиболее частыми причинами повреждения ПЖ были дорожно-транспортные происшествия, падение с высоты, бытовая травма. Среди открытых травм преобладали колото-резаные ранения (37,6%). Огнестрельные ранения отмечались у 15,4% пострадавших. Повреждение головки ПЖ наблюдалось у 29,6% больных, перешейка — у 3,1%, тела — у 46,9%, хвоста железы — у 20,4% больных. При сочетанных повреждениях чаще других встречались повреждения селезенки (28,6%), печени (27,2%), желудка (23,5%), крупных сосудов (9,4%), толстой кишки (9,1%), тонкой кишки (6,9%), двенадцатиперстной кишки (5,4%).
Диагноз повреждения ПЖ ставили на основании данных УЗИ, спиральной компьютерной томографии (СКТ) с контрастным усилением, видеолапароскопии, данных лабораторного исследования и подтверждали при интраоперационной ревизии или при вскрытии.
Для интраоперационной оценки степени повреждения ПЖ использовали, с нашей точки зрения, наиболее рациональную и практически удобную классификацию D. Smego [13], предложенную в 1985 г. В соответствии с этой классификацией выделяют 4 степени повреждения без учета его локализации и повреждения двенадцатиперстной кишки, но отражающие соотношения повреждения капсулы, паренхимы и протока. I степени повреждения соответствует ушиб или гематома ПЖ, II степени — повреждение капсулы или паренхимы без травмы главного панкреатического протока, III степени — глубокое повреждение паренхимы и главного панкреатического протока (подтвержденное или подозреваемое), IV степени — полное пересечение или размозжение ткани поджелудочной железы. I степень повреждения была установлена у 115 (38,4%) пострадавших, II степень — у 113 (38%), III степень — у 36 (12%), IV степень — у 35 (11,6%) пострадавших.
Все больные оперированы. Характер операции в период до 2001 г. (1-я группа) выбирали произвольно в зависимости от опыта и пристрастий хирурга, тогда как с 2002 г. (2-я группа) — на основании интраоперационной оценки степени повреждения ПЖ по классификации Smego. У одного пациента в процессе лечения выполняли от одного до четырех оперативных вмешательств. Ушивание ран ПЖ было произведено в 47 наблюдениях, гемостаз и дренирование зоны повреждения — в 186, дистальная резекция — в 26, тампонирование раны — в 12, различные миниинвазивные вмешательства под ультразвуковым контролем — в 48 наблюдениях, всего 319 вмешательств у 299 пострадавших.
Результаты и обсуждение
Из 153 пациентов (1-я группа), перенесших операцию, гнойные осложнения наблюдались у 67 (43,8%), умерли 26 (17,0%). Высокая частота гнойных осложнений и летальность заставили искать пути их снижения.
С этой целью было проведено морфологическое изучение препаратов ПЖ у 22 пострадавших, умерших в ранние сроки после травмы. Оно показало, что, независимо от характера и степени травмы, во всех этих наблюдениях развивался травматический панкреатит с поражением всех отделов П.Ж. При интраоперационной ревизии уже через 6—10 ч после закрытой травмы наблюдалось формирование очагов некроза не только по линии разрыва, но и на расстоянии от нее (рис. 1, а). При микроскопическом исследовании в зоне повреждения, как правило, отмечался крупноочаговый панкреонекроз, на расстоянии от очага поражения — мелкоочаговые некрозы ткани ПЖ (см. рис. 1, б).
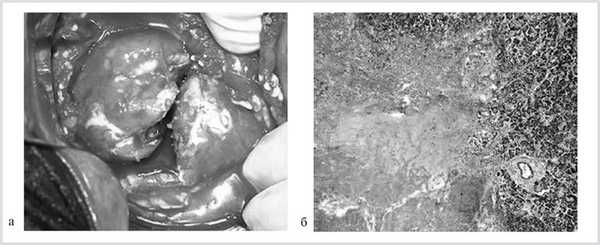
Рис. 1. Интраоперационная фотография.
Таким образом, было установлено, что повреждение ПЖ всегда сопровождается развитием травматического панкреатита, который является закономерным результатом травмы ПЖ и начинает развиваться сразу после травмы. Признание этого факта требует немедленного начала медикаментозной противопанкреатической антисекреторной терапии наряду с хирургическим лечением, не теряя времени на ожидание, пока в ходе прогрессирования панкреонекроза появятся его клинические, лабораторные или инструментально-диагностические признаки. Это тем более важно, что в 1-е сутки после травмы повреждения ПЖ не имеют ярко выраженных клинических специфических признаков, а развитие травматического панкреатита происходит на фоне интенсивной терапии, что создает трудности в диагностике. В связи с этим травматический панкреатит часто впервые проявляется своими деструктивными осложнениями, когда речь о ранней диагностике и своевременном лечении уже не идет.
Это положение подтверждается анализом летальности в зависимости от степени повреждения П.Ж. Этот показатель был наибольшим в группе пострадавших с I степенью тяжести повреждения (см. таблицу). При рассмотрении этих данных было установлено, что большинство пострадавших с I степенью повреждения ПЖ на первом этапе исследования, в период 1991—2001 гг., своевременного специализированного лечения панкреатита не получали. Лечение назначали поздно, по факту развития деструктивных осложнений, когда уже не было возможности заниматься профилактикой их развития, а приходилось следовать в фарватере течения осложнений.
Зависимость летальности и гнойных осложнений от степени повреждения поджелудочной железы
Анализ результатов лечения в зависимости от сроков начала специализированного лечения панкреатита (антисекреторная терапия октреотидом) показал, что при лечении, начатом в 1-е сутки после травмы ПЖ, гнойные осложнения возникли в 13,3% наблюдений, а летальность была минимальной и составляла 5,1%. При терапии, начатой позже, на 2—3-и сутки после травмы, отмечалась троекратное увеличение числа больных с осложнениями — до 39,5% и четырехкратное увеличение летальности — до 21,1%. При запаздывании с началом лечения на 4—5 сут и более его результаты (80% больных с осложнениями и летальность 24%) уже практически не отличались от таковых у больных, вообще не получавших медикаментозного лечения, — 71,7 и 28,3% соответственно.
Представленные данные убеждают в необходимости немедленного начала специализированного лечения (антисекреторной терапии октреотидом) при обнаружении повреждения ПЖ или при подозрении на него, особенно при повышении показателя амилазы крови или мочи.
Исследование активности амилазы крови и мочи является традиционным способом лабораторной диагностики панкреатита. По нашим данным, повышение активности α-амилазы крови наблюдалось в первые 4 сут после травмы у всех пострадавших с повреждением ПЖ, было максимальным в 1—2-е сутки и постепенно снижалось до нормы к 4—5-м суткам (рис. 2). Амилаза мочи не демонстрировала значительного повышения в первые 3 сут после травмы, повышалась незначительно на 4-е сутки и далее более заметно после 6-х суток (рис. 3). Хорошо известно, что повышение уровня амилазы крови и мочи не является абсолютно достоверным признаком панкреатита в связи с относительной специфичностью, однако этот лабораторный показатель вполне может быть использован как скрининговый тест для выделения группы риска повреждения ПЖ среди пострадавших с травмой живота. По нашему мнению, повышение активности α-амилазы у пострадавшего с абдоминальной травмой должно рассматриваться как сигнал к началу специализированной терапии с предположительным диагнозом травматического панкреатита и служить показанием к обследованию, направленному на исключение или подтверждение повреждения ПЖ.
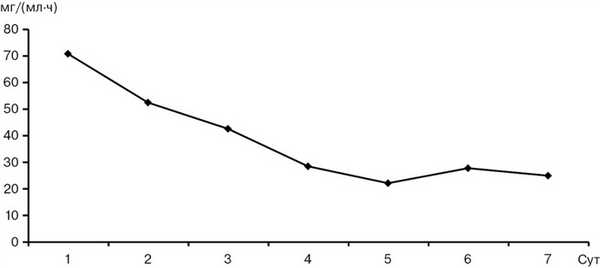
Рис. 2. Концентрация α-амилазы крови после травмы.
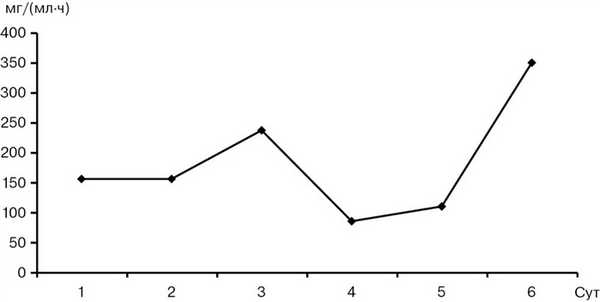
Рис. 3. Концентрация α-амилазы мочи после травмы.
При оценке результатов лечения в зависимости от характера хирургических вмешательств выявлено, что при выполнении только дренирования зоны повреждения ПЖ осложнения наблюдались у 34,2% пострадавших, летальность составила 10,7%.
Ушивание раны ПЖ приводило к росту осложнений и летальности до 51,6 и 15,2% соответственно. По нашему мнению, это связано с тем, что ушивание раны приводит к дополнительной травматизации и ишемизации ткани в зоне повреждения, созданию внутрипротоковой гипертензии, затрудняет отток из раны, что формирует условия для увеличения зоны воспаления и прогрессирования панкреонекроза.
Эта точка зрения находит подтверждение при анализе результатов лечения 21 пострадавшего, которому была произведена дистальная резекция ПЖ при повреждении III и IV степени. В том числе у 10 пострадавших операцию завершали ушиванием культи ПЖ и/или перевязкой вирсунгова протока, у 11 культю ПЖ оставляли открытой, вирсунгов проток не перевязывали, операцию ограничивали прецизионным гемостазом с прошиванием кровоточащих участков ткани культи и дренированием двумя двухпросветными дренажами, один из которых фиксировали у культи ПЖ, другой дренировал сальниковую сумку на всем протяжении. Во всей группе осложнения развились у 38,1% больных, летальность составила 14,3%. Однако если среди 10 больных с ушитой культей ПЖ осложнения наблюдались у 7 (70%) и умерли 2 (20%), то среди 11 больных с «открытой» культей осложнения отмечались у 1 (9,1%), умер 1 (9,1%).
Из-за небольшого числа наблюдений различия статистически недостоверны, однако прослеживается отчетливая тенденция к более благоприятному течению послеоперационного периода у пациентов, которым в ходе операции не наносили дополнительную травму паренхимы ПЖ грубым ушиванием ad mass, не создавали зону ишемии в области швов и условия для протоковой гипертензии, а также препятствия для свободного оттока раневого отделяемого и секрета в дренажи.
В случае если не проводили дренирования области повреждения и полости сальниковой сумки или выполняли тампонирование по поводу повреждения ПЖ, гнойные осложнения развились в 77,8% наблюдений, летальность составила 44,4%. Так, использование только диагностической видеолапароскопии без вскрытия, ревизии, адекватной санации и дренирования сальниковой сумки при повреждении ПЖ у пострадавших с закрытой травмой ПЖ, как правило, приводило к прогрессированию травматического панкреатита и развитию тяжелых гнойных осложнений, что впоследствии требовало множественных повторных операций, сопровождавшихся высокой летальностью.
С учетом выявленных особенностей клинического течения травматического панкреатита в зависимости от степени тяжести повреждения ПЖ, вида хирургического вмешательства и срока начала проведения консервативной терапии был разработан и с 2002 г. внедрен в клиническую практику алгоритм лечебно-диагностической тактики оказания помощи пострадавшим с подозрением на повреждение ПЖ при закрытой травме живота (рис. 4).
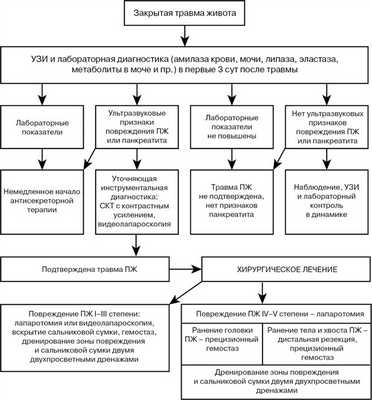
Рис. 4. Лечебно-диагностический алгоритм при закрытой травме ПЖ.
Для пострадавших с открытыми повреждениями (проникающими ранениями) живота диагностический раздел этого алгоритма представляется излишним, поскольку диагностика повреждения ПЖ у них производится при ревизии в ходе экстренной операции, тогда как лечебный раздел полностью идентичен в плане как консервативной терапии, так и хирургической тактики.
Во 2-й группе (2002—2012 гг.) 146 пациентам лечение проводили в соответствии с требованиями единого лечебно-диагностического алгоритма. Каждый пострадавший с диагностированной травмой ПЖ стал рассматриваться как больной с травматическим панкреатитом. В комплекс обязательных лечебных мероприятий была введена антисекреторная терапия октреотидом, назначавшаяся не по мере появления признаков травматического панкреатита, а немедленно по факту обнаружения повреждения ПЖ или подозрения на него. Основными критериями диагностики травмы ПЖ в этот период стали гиперамилаземия, ультразвуковые и компьютерно-томографические признаки повреждения ПЖ, данные видеолапароскопии и интраоперационной ревизии.
Во время лапаротомии по поводу травмы живота с признаками повреждения верхнего отдела брюшной полости считаем необходимым, кроме ревизии диафрагмы, печени, селезенки, передней стенки желудка, двенадцатиперстной кишки, поперечной ободочной кишки и ее брыжейки, широко вскрывать сальниковую сумку через желудочно-ободочную связку с обязательным осмотром задней стенки желудка и ревизией ПЖ.
При подозрении на ранение головки ПЖ или двенадцатиперстной кишки считаем обязательным мобилизовать двенадцатиперстную кишку по Кохеру. При обнаружении подкапсульной гематомы ПЖ ее в обязательном порядке следует вскрыть и выполнить ревизию паренхимы в зоне повреждения, определив ее глубину и отношение к главному панкреатическому протоку. При любой травме ПЖ медикаментозное лечение следует начинать немедленно на операционном столе. В первую очередь это введение октреотида в дозе не менее 300 мкг. В дальнейшем лечение проводится в отделении реанимации и включает продолжение курса октреотида в суточной дозе 900—1200 мкг в течение 5—7 сут после операции, подавление выброса биогенных аминов, интерлейкинов и других медиаторов воспаления, антиферментные препараты, дезинтоксикационную терапию, анальгетическую, спазмолитическую и инфузионную терапию.
Объем и вид оперативного вмешательства определяются в зависимости от тяжести состояния пострадавшего и степени повреждения П.Ж. При повреждении I—II степени, а также при повреждении III степени без размозжения тканей показано дренирование зоны повреждения с прецизионным гемостазом путем прошивания кровоточащих сосудов синтетической нитью на атравматической игле. Коагуляция допустима только в отношении области диффузной кровоточивости, поскольку в условиях панкреатита коагуляционный струп легко отторгается, что не обеспечивает надежного гемостаза.
При повреждении III—IV степени с разрывом или размозжением паренхимы ПЖ показаны резекция нежизнеспособных размозженных тканей, прецизионный гемостаз и дренирование. Если зона повреждения расположена в теле или хвосте ПЖ, показана левосторонняя резекция ПЖ с оставлением «открытой» культи, прецизионным гемостазом и дренированием сальниковой сумки.
Наш опыт свидетельствует, что при обнаружении повреждения ПЖ не следует ушивать дефект паренхимы железы, перитонизировать зону резекции, тампонировать дефект железы, перевязывать культю вирсунгова протока. В такой ситуации должна быть адекватно дренирована зона непосредственного повреждения и сальниковая сумка на всем протяжении по нижнему краю ПЖ с использованием не менее двух двухпросветных дренажей с внутренним диаметром не менее 10—12 мм.
Указанная тактика позволила снизить частоту гнойных осложнений при повреждении ПЖ с 43,8% в период 1991—2001 гг. до 19,9% в период 2002—2012 гг. и летальность с 17,0 до 11,1% соответственно.
За последнее десятилетие хирургическая тактика при травме ПЖ была в значительной степени унифицирована за счет внедрения ряда принципов. Принцип ранней диагностики при закрытой травме живота включает обязательное исследование активности амилазы крови и мочи при поступлении и в течение первых 3—5 сут лечения, что позволяет выделить группу риска и в дальнейшем исключить или подтвердить травму ПЖ с помощью УЗИ, СКТ, видеолапароскопии. У пострадавших с открытой травмой живота ранняя диагностика повреждений ПЖ предусматривает обязательное вскрытие сальниковой сумки и ревизию ПЖ во всех случаях ранений и гематом органов гепатопанкреатодуоденальной зоны, желудка и поперечной ободочной кишки, принцип раннего начала консервативной терапии — немедленное применение октреотида в суточной дозе 900—1200 мкг в случае обнаружения повреждения ПЖ или при обоснованном подозрении на него. Щадящая обработка повреждений ПЖ заключается в отказе от грубого ушивания ран ПЖ и перитонизации культи в случае ее резекции, а также от тампонирования зоны повреждения в пользу открытой раны и открытой культи с прецизионным гемостазом путем атравматического прошивания только кровоточащих сосудов в крае раны или культи и адекватного дренирования с использованием не менее двух широких двухпросветных дренажей: одного к зоне ранения (культе) ПЖ, другого — на всем протяжении сальниковой сумки.
Таким образом, у пострадавших с закрытой травмой живота с целью выделения группы риска повреждения поджелудочной железы (ПЖ) в первые 3 сут после травмы необходимо исследовать активность амилазы крови. При ее повышении показано дообследование с использованием УЗИ, СКТ и/или видеолапароскопии. При подозрении на повреждение ПЖ следует немедленно начать антисекреторную терапию октреотидом в суточной дозе 900—1200 мкг. При открытой травме живота во время лапаротомии для исключения повреждения ПЖ показаны вскрытие сальниковой сумки и ревизия ПЖ во всех случаях ранений и гематом желудка, селезенки, двенадцатиперстной кишки, сквозных ранений печени, поперечной ободочной кишки и ее брыжейки. Хирургическая тактика зависит от степени повреждения П.Ж. При повреждении I—III степени показана щадящая обработка с прецизионным гемостазом путем прошивания кровоточащих сосудов в крае раны тонкой синтетической нитью на атравматической игле. При повреждении IV степени тела и хвоста ПЖ показана корпорокаудальная резекция без лигирования протока железы. Операция должна быть завершена адекватным дренированием с использованием не менее двух широких двухпросветных дренажей. Не следует применять такие приемы, как ушивание дефекта паренхимы ПЖ, перитонизацию зоны резекции или культи ПЖ, тампонирование дефекта ПЖ, перевязку культи вирсунгова протока.
Читайте также:
- Хроническая почечная недостаточность
- Идиопатическая внутричерепная гипертензия на МРТ головного мозга
- Как лечить жировой гепатоз? Причины развития жировой болезни печени
- Развитие малого круга кровообращения. Онтогенез легочного кровообращения
- Улучшение условий труда в прокатных цехах металлургии. Термоизоляция
