Ранняя диагностика пороков сердца плода. Точность эхокардиографии у плода
Добавил пользователь Morpheus Обновлено: 21.01.2026
Состояние всех органов зависит от работы сердечно-сосудистой системы. Широкое распространение врожденных пороков сердца у детей обуславливает необходимость раннего их выявления. Золотым стандартом диагностики кардиальных патологий детского возраста является ультразвуковое исследование (эхокардиография). Метод отличается технической простотой, безопасностью для ребенка и высокой информативностью. Особенности анатомического строения сердца у новорождённого требуют проведения процедуры опытным специалистом.
Показания
Функционирование сердечно-сосудистой системы у ребенка первого года жизни отличается от работы организма взрослого человека. Структурные отличия, которые в норме исчезают до двухлетнего возраста, вызваны особенностями внутриутробного кровоснабжения плода пупочными артериями и венами во время беременности.
Настораживающими симптомами, при которых требуется проведение УЗИ сердца грудному ребенку, являются:
- Вялое сосание, отсутствие аппетита и частые срыгивания — вызваны недостаточным кровообращением детского организма и дефицитом энергии в мышечных органах. Другими словами, малыш истощен, у него нет сил, чтобы активно сосать грудь. Родители отмечают плохую прибавку в массе.
- Деформации в области грудной клетки и сердца (западания и выпячивания) — связаны с увеличением размера органа при комбинированных пороках.
- Тахикардия (увеличенная частота сердечных сокращений). Нормой для детей грудного возраста считается 120—160 ударов за минуту. Повышение уровня сердцебиения является компенсаторной реакцией организма при недостаточном кровоснабжении тканей.
- Одышка (тахипное) характеризуется у детей первого года жизни частотой дыхательных движений более 60 за минуту с привлечением дополнительной мускулатуры (межреберных и грудинно-ключично-сосцевидных мышц).
- Периоральный цианоз — синеватый оттенок области около рта. Данный симптом свидетельствует о сердечной или легочной недостаточности. В зависимости от появления цианоза в покое или при физической нагрузке (кормлении грудью, плаче) определяют степень тяжести нарушений.
Дети старшего возраста жалуются на наличие болей за грудиной, усиленное сердцебиение, отеки нижних конечностей, периодическое похолодание кистей и стоп.
Основанием для назначения эхокардиографии ребенку после объективного обследования является наличие:
- сердечного горба — специфической деформации грудной клетки;
- патологических внутригрудных шумов (систолического, диастолического) с разными путями проведения;
- систолического дрожания грудной клетки в области проекции верхушки сердца;
- расширения поперечника сердца — определяется перкуссионным способом, свидетельствует об увеличении органа в размерах.
Кроме того, исследование проводится пациентам с отягощенным семейным анамнезом (наличие врожденных пороков сердца у родственников) и частыми заболеваниями органов дыхательной системы.
При каких патологиях повторяют исследование и как часто
Проведение УЗИ сердца и сосудов у ребенка раннего возраста чаще всего связано с наличием врожденных пороков, которые не были диагностированы во время беременности:
- Открытый Боталлов (артериальный) проток — соединение между аортой и системой легочной артерии, которое обеспечивало скидывание крови с малого круга кровообращения во внутриутробном периоде. В норме образование должно склерозироваться в течение 1 года.
- Открытое овальное окно — физиологическое отверстие между предсердиями, которое должно ликвидироваться в первые часы жизни малыша.
- Дефект межжелудочковой перегородки — патологическое соединение правого и левого желудочков, которое при расшифровке ЭХО-КГ характеризуется наличием сброса крови из левой половины сердца в правую с чрезмерной нагрузкой последней.
- Комбинированные пороки (тетрада и пентада Фалло), которые состоят из дефекта межпредсердной и межжелудочковой перегородки, гипертрофии (увеличение в размерах) правого желудочка, изменённого отхождения магистральных сосудов. Такие аномалии требуют ранней диагностики и хирургической коррекции.
- Аномалия прикрепления или наличие дополнительной хорды (мышечный пучок) в полости желудочка.
Основными причинами функционального или органического шума в области сердца являются патологии клапанного аппарата: стеноз и недостаточность.
Стеноз характеризуется сужением просвета и дефицитным наполнением желудочков кровью. Компенсаторной реакцией является гипертрофия мышечного слоя предсердия. Недостаточность клапанного аппарата отличается отсутствием полного смыкания створок. Патология сопряжена с наличием регургитации — обратного тока крови в предсердие во время сокращения желудочков.
Лечение врожденных пороков сердца подразумевает хирургическое вмешательство в течение первых 3 лет жизни. Динамический контроль состояния здоровья требует проведения ультразвукового исследования 2 раза в год до операции и 1 раз в год после нее до достижения совершеннолетия.
Расшифровка результатов ЭхоКГ у детей
Исследование проводится в стандартных амбулаторных условиях диагностического центра или поликлиники. Длительность процедуры составляет не более 15 минут, во время которых протокол заполняется полученными параметрами.
Расшифровка полученных результатов УЗИ сердца ребенка проводится специалистами, оценивающими:
- размеры камер (обоих предсердий и желудочков);
- толщину стенок органа;
- состояние клапанного аппарата (митрального, трехстворчатого, аортального и клапана легочной артерии);
- сердечный выброс (количество крови, которое попадает в сосуды после сокращения сердца).
Особенности анатомического строения определяют различные нормы УЗИ сердца у детей первых лет жизни. Наличие открытого овального окна с диаметром отверстия до 19 мм и незначительного кровотока через Боталлов проток считается нормой до 2-летнего возраста ребенка.
Другой характерной чертой формирования заключения при ультразвуковой диагностике у детей грудного возраста является учет веса. Масса при рождении менее 3 кг подразумевает размеры предсердий до 1,7 см и желудочков до 2,2 см, скорость кровотока в легочной артерии до 1,6 м/с. Вес ребенка от 3,5 до 4,5 кг характеризуется увеличением полости желудочков до 2,5 см и снижением скорости кровотока до 1,2 м/с.
Своевременная диагностика патологий сердечно-сосудистой системы у детей позволяет назначить лечение на ранних стадиях и полностью ликвидировать симптомы до наступления критических изменений. Наиболее часто используемый метод в клинической практике — эхокардиография, которая подразумевает применение безопасных для здоровья ультразвуковых волн с целью визуализации структуры и функционального состояния органа.
Постановка клинического диагноза проводится с учетом семейного анамнеза, характеристики течения патологии и имеющихся симптомов. Заключение по результатам ультразвуковой процедуры является не окончательным диагнозом, а только дополнительным методом исследования.
Расшифровка УЗИ сердца у детей должна проводиться с учетом возрастных и индивидуальных особенностей. Грамотный анализ полученных результатов позволяет отличить физиологическую характеристику от патологического дефекта и определить адекватную тактику лечения.
Для подготовки материала использовались следующие источники информации.
Возможности эхокардиографии плода в I триместре беременности (11-14 недель)
Московский областной НИИ акушерства и гинекологии (МОНИИАГ), Россия.
Гомельский областной медико-генетический центр с консультацией "Брак и семья", Гомель, Беларусь.
УЗИ сканер RS80
Эталон новых стандартов! Беспрецедентная четкость, разрешение, сверхбыстрая обработка данных, а также исчерпывающий набор современных ультразвуковых технологий для решения самых сложных задач диагностики.
Введение
Актуальность темы пренатальной диагностики врожденных пороков сердца (ВПС) понятна всем врачам, которые связаны с пренатальной диагностикой, неонатологией, педиатрией, кардиологией, генетикой. ВПС являются одной из ведущих причин перинатальной смертности и регистрируются с частотой 4-13 на 1000 живорожденных [1]. В связи с тем, что профилактические мероприятия по предупреждению ВПС не имеют должного успеха, представляется актуальной и необходимой их пренатальная ультразвуковая диагностика.
- Семьи, имеющие ребенка с ВПС.
- Семьи с ВПС у одного или обоих супругов.
- Женщин, страдающих сахарным диабетом, системными заболеваниями соединительной ткани, гипотиреозом.
- Беременных с тератогенной экспозицией в ранние сроки беременности (герпес ранее 6-7-й недели) [2].
Однако параллельно другими учеными эти группы риска отвергались, потому что большинство ВПС встречались у плодов и детей, матери которых не входили ни в одну из предложенных групп риска. Единственными разумными критериями так называемого селективного отбора были признаны беременные, попавшие в группу риска после проведения скрининга I триместра и беременные с подозрением на ВПС при ультразвуковом исследовании (УЗИ) плода [3].
Неоспоримо, что оптимальными сроками беременности для исследования сердца плода являются 20-22 недели, однако большинство летальных и клинически значимых пороков сердца могут быть диагностированы в конце I триместра беременности. Позволим себе процитировать слова главы Fetal Medicine Foundation Кипраса Николаидеса, высказанные им на страницах сайта FMF (www.fetalmedicine.com): "Специалист ультразвуковой диагностики с 12 недели беременности должен заверить большинство родителей, что у их ребенка нет крупных врожденных пороков сердца. В случае крупных врожденных пороков сердца их раннее выявление может привести к постановке правильного диагноза или хотя бы вызвать подозрение для осуществления ультразвукового мониторинга".
Главная цель пренатальной диагностики сформулирована специалистами пренатальной диагностики всего мира - это обеспечение женщины максимально возможной информацией о пороке как можно раньше. Мы должны дать право женщине и семье в целом решать вопрос о пролонгировании беременности с грубыми пороками развития у плода [4].
С каждым годом все большее количество публикаций посвящается диагностике ВПС в ранние сроки - в I триместре беременности 5. Практически ни один из выпусков журнала ISUOG (Ultrasound In Obstetrics and Gynecology, или "белого" журнала, как его называют специалисты) не обходит своим вниманием тему ранней диагностики врожденных пороков развития.
На самом знаменитом сайте в мире пренатальной диагностики www.thefetus.net (Philippe Jeanty, USA) опубликовано уже более 30 случаев находок ВПС в I триместре беременности. Однако в отечественной периодике встречаются лишь единичные работы по этой теме. Все они пренадлежат "перу" специалистов пренатальной диагностики Российской ассоциации врачей ультразвуковой диагностики в перинатологии и гинекологии, хотя для многих специалистов как раньше, так и сейчас осмотр сердца плода в сроки 11-14 недель заключается лишь в констатации числа сердечных сокращений.
Цель эхокардиографии в I триместре беременности состоит в выявлении летальных и клинически значимых ВПС. Это исследование не ставит целью выявление стенозов и гипоплазий выносящих трактов, диагностику мелких дефектов перегородок, патологий дуги аорты и артериального протока. Многие из этих пороков не только технически невозможно заподозрить в I триместре, манифестируют они после 30-й недели беременности, т.е. их диагностика является прерогативой исследования III триместра.
Точность пренатальной диагностики ВПС во все сроки беременности варьирует в широком диапазоне. Причинами этого могут быть разный опыт специалистов, ожирение беременной, частота использованных ультразвуковых трансдьюсеров и класс ультразвукового аппарата, перенесенные ранее абдоминальные операции, срок беременности, количество околоплодных вод и положение плода. Однако заметим, что многие из этих факторов теряют свою актуальность именно при проведении трансвагинальной эхокардиографии в I триместре беременности. Своевременная диагностика ВПС позволяет идентифицировать плоды высокого риска по генетическим синдромам, что имеет важное значение при проведении пренатального консультирования и оказывает существенное влияние на акушерскую тактику.
Результаты
С 2006 по 2011 г. пренатально в I триместре беременности были выявлены 125 ВПС. Из них 68 (55%) ВПС сочетались с различными хромосомными аномалиями (ХА) плода, 30 (24%) входили в состав различных множественных врожденных пороков развития (МВПР), 27 (21%) ВПС были изолированными.
При эхокардиографии изучались четырехкамерный срез сердца плода (рис. 1) и срез через три сосуда (рис. 2). УЗИ проводилось трансабдоминальным датчиком, лишь при необходимости (затрудненная визуализация) использовался внутриполостной датчик. Четырехкамерный срез сердца плода при ультразвуковом сканировании трансабдоминальным датчиком визуализировался в 85% случаев, срез через сосуды - в 73%, при использовании трансвагинального датчика эти цифры существенно возрастали до 100 и 91% соответственно. Оптимизация пренатальной диагностики ВПС может быть достигнута путем строгого соблюдения основных методических правил. При оценке четырехкамерного среза плода необходимо оценить нормальное расположение сердца плода, исключив его эктопию (рис. 3), положение оси сердца плода, что не представляет никаких трудностей, нормальные пропорции и размеры камер сердца, движение створок атриовентрикулярных клапанов должно быть свободным, септальная створка трикуспидального клапана должна располагаться ближе к верхушке сердца (рис. 4). При оценке среза через три сосуда необходимо оценить взаиморасположение сосудов и их диаметр.
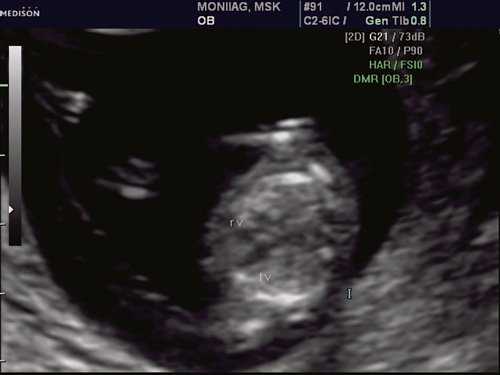
Рис. 1. Беременность 12 недель. Четырехкамерный срез сердца плода. Отчетливо видны камеры сердца.
Закономерности изменений показателей ультразвукового исследования при врожденных пороках сердца у плода в зависимости от особенностей внутрисердечной гемодинамики антенатального периода
ФГУ Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова Минздравсоцразвития России,
Москва.
УЗИ сканер WS80
Идеальный инструмент для пренатальных исследований. Уникальное качество изображения и весь спектр диагностических программ для экспертной оценки здоровья женщины.
Врожденные пороки сердца редко влияют на развитие плода. Впервые это было отмечено в исследованиях B. Mac Mahon и соавт. [1]. Однако есть пороки, не совместимые с жизнью, и после рождения ребенок тотчас погибает. Некоторые врожденные пороки сердца, даже несложные формы, в раннем неонатальном периоде протекают злокачественно, обусловливая развитие декомпенсации кровообращения и дыхательную недостаточность. Главной причиной этого является несовершенство компенсаторных механизмов.
Диагностика врожденных пороков сердца у плода - одна из труднейших задач перинатологии. Многие врожденные пороки сердца, даже сложные, практически не совместимые с жизнью, антенатально не проявляются в силу особенностей внутрисердечной гемодинамики и после рождения становятся катастрофой для жизни ребенка.
Антенатальный период характеризуется особенностями кровообращения, такими как высокое давление в правом желудочке, незначительный объем кровотока в легочной артерии, параллельность работы желудочков сердца, функционирующие артериальный проток и овальное окно, нагнетающие кровь как обходные анастомозы в большой круг кровообращения за счет усиленной работы правого желудочка. Эти особенности внутрисердечной гемодинамики плода, безусловно, должны корректировать характер гемодинамических изменений ультразвуковых показателей сердца в норме и при пороках сердца у плода.
Известно, что у пациентов с врожденными пороками сердца нарушения гемодинамики в результате анатомических изменений в значительной степени влияют на данные ультразвукового сканирования сердца, такие как размеры полостей сердца, степень гипертрофии миокарда, функция клапанного аппарата, сократительная способность миокарда, направленность движения межжелудочковой перегородки.
Метод оценки внутрисердечной гемодинамики базируется на широко известных понятиях о систолической, объемной и смешанной перегрузках сердца, предложенных в 1952 г. E. Cabrera и J. Monroy [2].
В основе разделения использован следующий принцип.
Нагрузка сопротивлением возникает при ситуации, когда выброс крови из желудочков сердца в магистральные сосуды затруднен на уровне полулунных клапанов (стеноз аорты и легочной артерии), подклапанного пространства (идиопатический гипертрофический субаортальный стеноз, подклапанный стеноз аорты или легочной артерии), на протяжении сосудистого русла (коарктация аорты) либо при значительном увеличении выходного сопротивления (синдром Эйзенменгера). В результате затруднения выброса крови резко возрастает напряжение миокарда соответствующего желудочка при относительно стабильном объеме крови, что служит проявлением систолической перегрузки сердца. При систолической перегрузке желудочков сердца независимо от нозологической формы порока полость желудочка, несущего основную нагрузку сопротивлением, умеренно увеличивается в размерах. В ответ на нагрузку сопротивлением на эхокардиограмме выявляется гипертрофия миокарда соответствующего желудочка, и чем больше сопротивление выбросу, тем резче выражена степень гипертрофии миокарда соответствующего желудочка и межжелудочковой перегородки (рис. 1) [3].
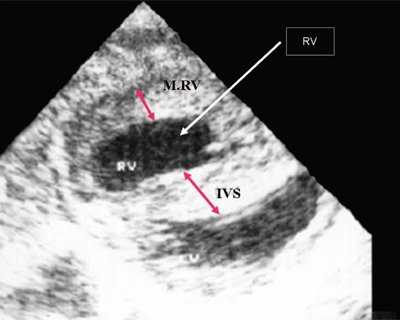
Рис. 1. Систолическая перегрузка правого желудочка. Поперечное сечение желудочков сердца при стенозе легочной артерии. Градиент давления правый желудочек - легочная артерия равен 200 мм рт.ст. Выраженная гипертрофия межжелудочковой перегородки и миокарда передней стенки правого желудочка.
Нагрузка объемом возникает при дополнительном притоке крови в желудочки и в результате шунтирования крови через септальные перегородки или артериальный проток (дефекты межпредсердной и межжелудочковой перегородок, открытый артериальный проток), а также в результате обратного тока крови через атриовентрикулярные клапаны (клапанная недостаточность).
Характерными особенностями выраженной объемной перегрузки правого желудочка являются дилатация желудочка, при которой толщина миокарда не превышает верхней границы нормы, увеличение правого предсердия, парадоксальный характер движения межжелудочковой перегородки и увеличение амплитуды движения трикуспидального клапана (рис. 2, 3).
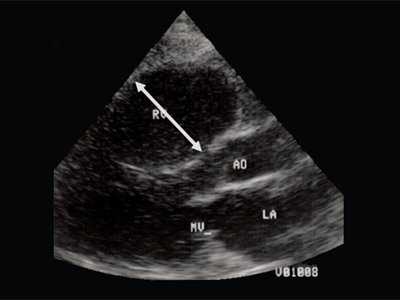
Рис. 2. Длинная ось сердца. Объемная перегрузка правого желудочка при дефекте межпредсердной перегородки. Объем сброса крови превышает 200% МОС. Отмечается выраженная дилатация правого желудочка.
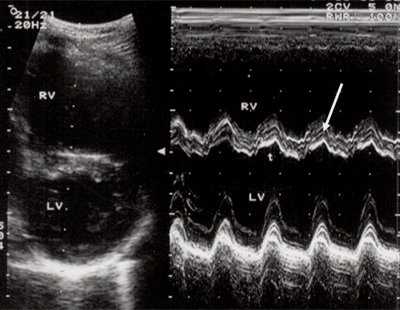
Рис. 3. Объемная перегрузка правого желудочка при дефекте межпредсердной перегородки. В- и М-сканирование. Стрелкой показан парадоксальный характер движения межжелудочковой перегородки.
Для левого желудочка признаком объемной перегрузки являются увеличение полости левого предсердия и желудочка, а также экскурсии межжелудочковой перегородки и миокарда задней стенки левого желудочка (рис. 4).
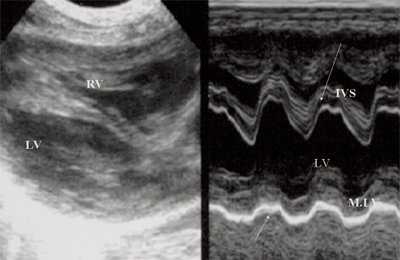
Рис. 4. Объемная перегрузка левых отделов сердца. В- и М-сканирование. Отмечается усиление экскурсии межжелудочковой перегородки и миокарда задней стенки левого желудочка.
IVS - межжелудочковая перегородка, MLV - миокард левого желудочка, LV и RV - левый и правый желудочек.
При сочетании нагрузки сопротивлением и объемом возникает смешанная перегрузка (например, при дефекте межжелудочковой перегородки и повышении давления в легочной артерии для правого желудочка систолическая перегрузка сочетается с нагрузкой объемом, для левого желудочка в результате артериальновенозного сброса крови через дефект).
За многолетний период (с 1980 г. по настоящее время) наблюдений в ФГУ Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова Минздравсоцразвития России было замечено, что в антенатальном периоде не всегда работают принципы гемодинамических эхокардиографических проявлений врожденного порока сердца, которые ранее были разработаны и представлены в современной литературе 6.
Анализ более 2000 наблюдений врожденных пороков сердца у плода показал, что в ряде наблюдений имеются лишь анатомические изменения, характерные для определенной нозологической формы порока. При других врожденных пороках сердца изменения на эхокардиограмме связаны с характером гемодинамической нагрузки на сердце и аналогичны тому, что наблюдается после рождения. Наконец, в ряде наблюдений врожденных пороков сердца у плода вторичные изменения на эхокардиограмме, вызванные гемодинамическими нарушениями, отличаются от гемодинамических проявлений ультразвуковых показателей у детей и взрослых. Это позволило разделить все врожденные пороки сердца плода на три группы в зависимости от изменений на эхокардиограмме, обусловленных особенностями антенатальной внутрисердечной гемодинамики.
В первую группу вошли пороки сердца, которые, имея отчетливые анатомические проявления патологии, при ультразвуковом исследовании не имеют гемодинамических проявлений врожденного порока сердца. К ним относятся: дефект межпредсердной перегородки, дефект межжелудочковой перегородки, общий желудочек, простая форма транспозиции магистральных сосудов и также при наличии дефекта межжелудочковой перегородки общий артериальный ствол, двойное отхождение сосудов от желудочков сердца.
- дилатации правого желудочка (см. рис. 2, 3);
- увеличению правого предсердия;
- парадоксальному характеру движения межжелудочковой перегородки (см. рис. 2, 3).
Антенатально при равных величинах давления в желудочках сердца и в предсердиях объемной перегрузки не возникает. В связи с этим ни один из эхокардиографических гемодинамических признаков, используемых у детей и взрослых, не выявляется у плода. К эхокардиографическим проявлениям порока антенатально относится только прямой признак - перерыв ультразвукового луча в области дефекта. Размеры сердца, соотношение размеров желудочков сердца не отличаются от нормы (рис. 5).
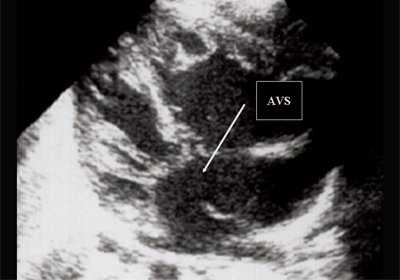
Рис. 5. Четырехкамерное сечение сердца плода. Стрелкой указан первичный дефект межпредсердной перегородки (АVS).
В равной степени это относится к дефекту межжелудочковой перегородки (рис. 6), простой форме транспозиции магистральных сосудов (рис. 7, 8), транспозиции магистральных сосудов с дефектом межжелудочковой перегородки (синдром Тауссиг - Бинга) (рис. 9), общему желудочку (рис. 10), общему артериальному стволу (рис. 10), двойному отхождению сосудов от одного из желудочков сердца (рис. 11).
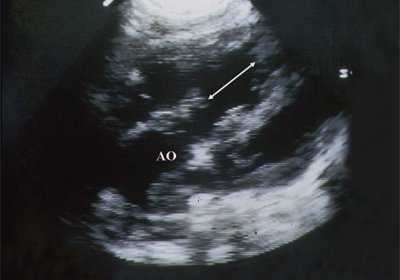
Рис. 6. Дефект межжелудочковой перегородки. Длинная ось сердца. Стрелками показан дефект межжелудочковой перегородки.
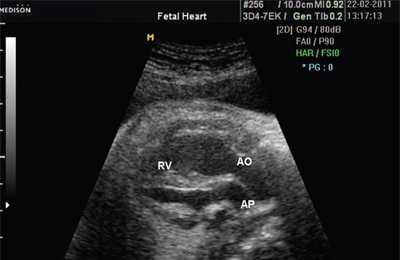
Рис. 7. Транспозиция магистральных сосудов.
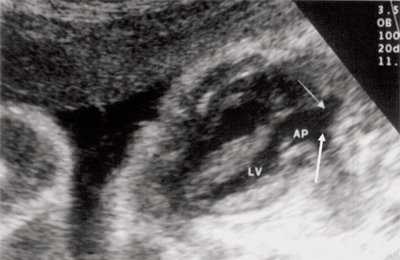
Рис. 8. Транспозиция магистральных сосудов, стрелками показаны ветви легочной артерии.
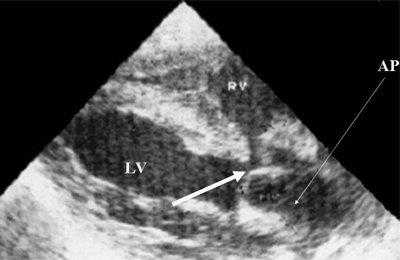
Рис. 9. Синдром Тауссиг - Бинга. Легочная артерия (отмечена стрелкой) расположена над дефектом межжелудочковой перегородки.
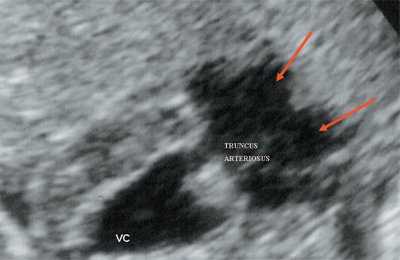
Рис. 10. Общий желудочек с отхождением TRUNCUS ARTERIOSUS. Стрелками показано разделение TRUNCUS ARTERIOSUS на аорту и ствол легочной артерии.
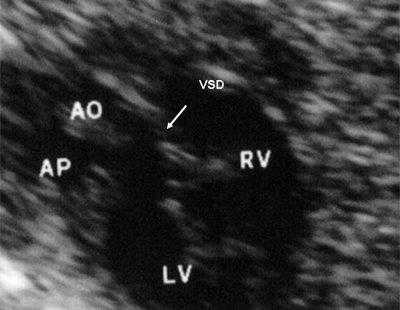
Рис. 11. Двойное отхождение магистральных сосудов от левого желудочка. Длинная ось сердца. Магистральные сосуды инвертированы и отходят от левого желудочка. Аорта расположена "верхом" над дефектом межжелудочковой перегородки (стрелка).
LV и RV - левый и правый желудочек, АР - легочная артерия, АО - аорта, VSD - дефект межжелудочковой перегородки.
Таким образом, диагностика перечисленных выше врожденных пороков сердца основывается на знании анатомических изменений, характерных для определенной нозологической формы патологии.
Вторая группа врожденных пороков сердца. При ультразвуковом исследовании регистрируются анатомические и гемодинамические изменения, характерные для определенной нозологической формы порока. В эту группу были отнесены: стеноз аорты, стеноз легочной артерии, врожденный митральный стеноз, транспозиция магистральных сосудов с сужением легочной артерии, обструкция опухолью выходного тракта одного из желудочков, аномалия Эбштейна, синдром гипоплазии правого и левого желудочков сердца, фиброэластоз, преждевременное закрытие овального окна.
Как пример можно разобрать изменения эхокардиографических показателей при клапанном стенозе легочной артерии. Нарушение гемодинамики при изолированном стенозе легочной артерии обусловлено препятствием на пути выброса крови в легочную артерию. Тяжесть стеноза определяется разницей систолического давления в правом желудочке и легочной артерии, т.е. градиентом давления.
При двухмерной эхокардиографии выявляется утолщение створок клапана легочной артерии, экскурсия их уменьшена, а в систолу они образуют купол. Это анатомические проявления порока. К ним добавляются гемодинамические проявления: выраженная гипертрофия миокарда передней стенки правого желудочка и межжелудочковой перегородки, значительно превышающие нормативы. Степень выраженности гипертрофии миокарда правого желудочка зависит от степени стенозирования легочной артерии и соответственно от величины градиента давления. Эти данные получены при сопоставлении результатов ультразвукового сканирования и данных катетеризации полостей сердца у детей [6]. Следует особо отметить, что при выраженной гипертрофии миокарда полость правого желудочка увеличивается незначительно. Отмечается также увеличение размера правого предсердия.
У плода получены аналогичные изменения, зависящие также от степени стенозирования легочной артерии. Полость правого желудочка, как видно на рис. 12, не увеличена. В то же время имеется значительная гипертрофия стенок правого желудочка. Как и в постнатальном периоде отмечено увеличение полости правого предсердия (рис. 13). После рождения при катетеризации полостей сердца в данном наблюдении был выявлен градиент давления на выходе из правого желудочка, равный 200 мм рт.ст.
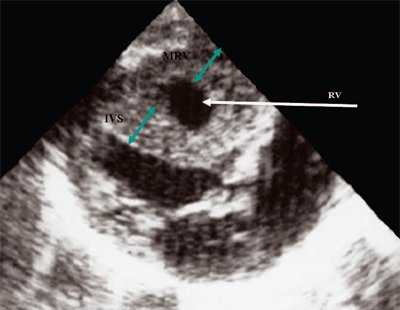
Рис. 12. Стеноз легочной артерии. Гипертрофия миокарда правого желудочка.
Порок развития сердца у плода при беременности: методы определения и тактика действий
Термин «врожденный порок сердца» — причина для серьезного беспокойства родителей. Ситуация осложняется, если этот диагноз был поставлен еще до рождения малыша.
Если в семье уже рождались дети с ВПС, или возраст женщины более 35 лет, следует особенно тщательно планировать беременность. Нужно вести здоровый образ жизни, убедиться в отсутствии инфекций или излечить имеющиеся отклонения.
Конечно, полностью минимизировать риски заболевания не удастся. Здесь совет только один: вовремя проходить все обязательные скрининги и другие обследования, показанные при беременности.
Причины и механизм развития пороков сердца
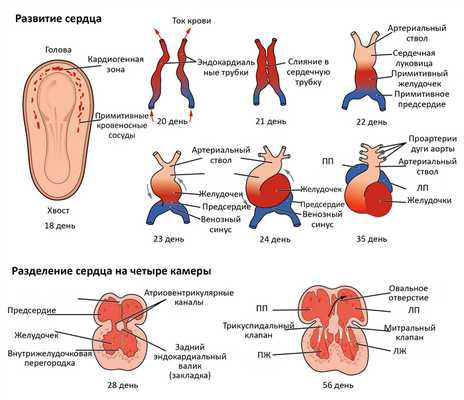
Сердце формируется одним из первых из всех органов эмбриона. Уже в первом триместре оно начинает свою работу. Порок сердца при беременности у плода является чаще всего результатом наследственных факторов, болезней женщины, расплатой за вредный образ жизни будущей матери. Реже формирование ВПС связано с другими аномалиями развития эмбриона, например, с синдромом Дауна.
Женщины с высоким риском: кто подвержен опасности?
- перенесших выкидыши, мертворождения;
- возрастом старше 35 лет;
- куривших во время беременности;
- живущих в районах с неблагополучной экологией;
- переболевших на ранних сроках беременности краснухой;
- употреблявших во время беременности аспирин, сульфаниламидные препараты, антибиотики;
- имеющих тяжелый семейный анамнез по порокам сердца.
Врожденный порок сердца - дефект, находящийся в структуре сердца. По статистике, десять детей из тысячи будут иметь диагноз ВПС в своих медицинских картах. И число их будет расти, в основном по причине повышения доступности и эффективности диагностических методик. Сейчас диагноз можно поставить не дожидаясь рождения малыша, с помощью стандартных аналитических систем на различных сроках внутриутробного развития.
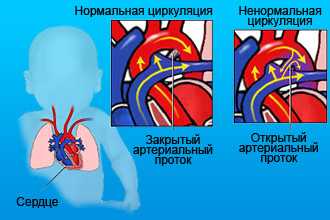
Пороки сердца отличаются разнообразием семиотики. Врачи-кардиологи делят их на «бледные» и «синие». Для первых характерна бледность кожи. К ним относятся в основном дефекты сердечных перегородок. При «синих» кожа приобретает синюшный оттенок. Связано это с тем, что в крови недостаточно кислорода. К «синему» типу пороков относятся более тяжелые состояния: болезнь Фалло, транспозиция магистральных сосудов и другие.
К комбинированным принято относить патологии клапанов сердца. Они вызываются недоразвитием створок, а также их склеиванием, как правило, из-за перенесенной матерью при беременности вирусной инфекции.
Самый важный период в развитии сердца — с четырнадцатого по шестидесятый день от зачатия. Именно тогда сердце разделится перегородками и станет четырехкамерным, из общего артериального ствола выделится аорта и легочная артерия, образуется желудочек, сформируются клапаны.
Если в любой из этих важных для развития эмбриона дней беременный организм столкнется с угрозой, вполне возможны последствия в виде формирования дефекта в сердечно-сосудистой системе.
Как правило, о многих пороках сердца будущие родители узнают на первом скрининге, то есть, начиная с 12 недели беременности. Если аномалия слишком тяжела, после ряда уточняющих обследований матери будет предложено прервать беременность. Если ВПС будущего ребенка совместим с жизнью, у родителей будет время подготовиться к неизбежной после его рождения операции на сердце.
В некоторых регионах России уже сейчас проводятся внутриутробные операции на сердце, позволяющие малышу родиться полностью здоровым.
Клинические проявления во время беременности
Как правило, беременность плодом с ВПС для женщины мало чем отличается от типичного варианта. Диагноз становится очевидным лишь при проведении УЗИ плода и его сердца, допплерографии или КТГ.
Плод, как правило, страдает от гипоксии и отличается отставанием в развитии. Возможно назначение беременной лекарственных средств, облегчающих работу сердца плода. Но о полной компенсации состояния речь, как правило, речь не идет.
Главная задача матери, вынашивающей ребенка с дефектом развития сердца, — максимально продлить срок беременности в динамике состояния плода.
Диагностика и детализация состояния плода
Основной показатель нормального развития плода - его сердечный ритм.
- 110-130 ударов до восьмой недели беременности;
- 175-185 до конца первого триместра;
- 145-160 до родов.
На пороки развития сердечно-сосудистой системы плода указывают:
- брадикардия или тахикардия;
- различные временные интервалы между ударами;
- приглушенные звуки сердцебиения - признак кислородного голодания плода.

Порок сердца у плода на УЗИ становится очевидным в случае визуализации дефекта камер органа. ЧСС будущего ребенка можно посчитать уже в первом триместре беременности на рутинном обследовании при помощи акушерского стетоскопа. Более полную информацию о работе сердца плода даст КТГ, которое назначается после 32 недели беременности. Оценив его результаты, акушеры определяют параметры состояния малыша.
Основные заключения анализа показателей состояния плода:
Это доступные и для пациентки, и для врача методики обследования. Они не требуют особой подготовки и не занимают много времени.
Но лидером в исследованиях гемодинамических процессов в сердце и сосудах плода считается доплер-эхокардиография.Этот метод оценивает три основных показателя -направление, скорость и характер кровотока. Процедура такова:на животе беременной устанавливается датчик УЗИ. На экран передается цветное изображение. Красным обозначается течение крови, которая двигается в сторону датчика.Синий цвет указывает на объем крови, идущий в обратном направлении. Максимальная интенсивность того или иного цвета обозначает повышенную гемодинамику.
Чрезвычайно ценную информацию о сердце и самом плоде дает ЭХО-КГ. Исследование может назначаться на любом сроке беременности, но, как правило, выполняется начиная с 12 недели после получения настораживающих показаний первого скрининга.
Это исследование определит:
- направление и скорость кровотока в сосудах;
- проходимость кровяного русла;
- соотношение объемов входящей и выходящей из сердца плода крови;
- ЧСС.
Лучше всего проводить процедуру на сроке от 18 до 24 недели, так как именно в этот срок обеспечивается максимальный визуальный эффект.
Исследования, проведенные ранее этого времени, не будут достаточно объективными из-за малых размеров сердца. К концу беременности ЭХО-КГ плода редко используется из-за большого объема живота, затрудняющего визуализацию органа.
К решению вопросов, касающихся результатов исследования плода с ВПС, привлекается детский кардиолог и кардиохирург.
Тактика ведения беременной

Акушерская тактика ведения беременной, которая вынашивает плод с ВПС представляет собой постановку вопроса об амнио- или кордоцентезе после тщательного эхокардиографического исследования. Их цель — получить материал для проведения хромосомного анализа. Если дефект выявится у нежизнеспособного эмбриона, беременной будет предложен аборт. Срок при этом не имеет никакого значения, особенно если порок сердца будет сочетаться с генетическими аномалиями.
Если ВПС совместим с жизнью, беременная будет до конца срока находится под усиленным наблюдением акушеров. По истечению сорока недель ей будет предложено госпитализироваться для родов в специализированный перинатальный центр. Как правило, у подобного плода показано родоразрешение при помощи кесарева сечения.
После родов малыш будет переведен для обследования, лечения и возможной хирургической операции в кардиологическое отделение детской больницы.
Выводы
Любой порок развития плода, выявленный при беременности, — это всегда сложная проблема и для будущей матери и для обеспечивающих ее течение врачей. Аномалия сердца — не исключение. Сейчас существует множество достоверных методик, позволяющих на ранних сроках опровергнуть или подтвердить диагноз ВПС, оценить состояние, сделать предположение о его жизнеспособности. Почти все они широко применяются и доступны пациенткам.
УЗИ сердца плода во время беременности
Ультразвуковое исследование — метод, основанный на анализе отличий отражения УЗ-волн от тканей, разных по плотности и структуре. УЗИ стало незаменимым для ранней диагностики беременности и отслеживания нормального роста и развития плода, выявления пороков или генетических аномалий. При необходимости используют дополнительные УЗ-режимы: доплерографию, эхокардиографию сердца плода.
УЗИ имеет ряд преимуществ, в отличие от других малоинвазивных методик:
- простота проведения и доступность метода;
- безопасность как для женщины, так и для плода;
- абсолютно безболезненная процедура, к которой не нужна предварительная подготовка;
- быстрое получение объективных данных о состоянии органов матери и развитии плода.
Когда делают ультразвуковое исследование плода
Поскольку УЗИ не имеет противопоказаний, количество раз его проведения может отличаться в зависимости от течения беременности, самочувствия. В среднем женщина делает 3—4 обследования во время вынашивания.
1-й триместр
Рекомендуется проводить первое исследование при задержке менструации, через 5—6 недель от последних месячных. УЗИ на этом сроке поможет подтвердить наличие эмбриона в полости матки и исключить трубную беременность, прослушать сердцебиение плода. Обязательным является проведение УЗИ на 11—13-й неделе. Именно в эти сроки можно получить достоверные данные о наличии грубых уродств плода, аномалий генетического происхождения. В первую очередь этот скрининг должны пройти женщины старше 35 лет, в анамнезе которых были выкидыши, замершая беременность, наследственные заболевания как у самой пациентки, так и по линии ее мужа, рождение детей с патологиями развития или хромосомными нарушениями.
Патологии, которые могут быть выявлены на УЗИ-скрининге:
- дефект развития нервной трубки;
- омфалоцеле (патология передней брюшной стенки);
- триплоидия (тройной набор хромосом с множеством пороков развития);
- генетические синдромы трисомии: Дауна (21 хромосома), Эдвардса (18 хромосом), Патау (13 хромосом).
2-й триместр
Второй скрининг желательно проводить на 18—20-й неделе беременности, когда уже достаточно сформированы органы и системы плода. Во время этого исследования определяются:
- размеры плода и его масса;
- состояние позвоночника, конечностей, костей черепа;
- объем и состояние околоплодных вод;
- правильность развития внутренних органов;
- оценка положения и степени зрелости плаценты.
Дополнительным методом может быть доплерометрия — метод для определения кровотока, его скорости, давления внутри артерий и вен. Доплер применяется для исследования сосудов пуповины плода, помогает оценить эффективность его кровоснабжения, диагностировать обвитие или плацентарную недостаточность.
При подозрении на наличие пороков кардиоваскулярной системы нужно пройти дополнительные исследования. УЗИ сердца плода при беременности назначают, если у матери есть врожденный порок развития сердечно-сосудистой системы или другие тяжелые заболевания, перенесенные инфекции на ранних сроках, наличие нарушений сердечного ритма плода. При необходимости применяют эхокардиограмму — более сложный метод, чем УЗИ, с использованием специального датчика. В результате можно получить полную картину строения сердца, сосудов и кровоснабжения. Данные сохраняются в электронном виде, что позволяет их повторно пересмотреть.
3-й триместр
На таком сроке задача исследования — оценить размеры плода, его положение в матке, состояние внутренних систем, наличие и степень возможной задержки развития. На поздних сроках УЗИ поможет выявить пороки органов (например, гидронефроз, мегауретер), чтобы провести устранение этих проблем прямо в полости матки.
Данные исследования помогают определить тактику родов: необходимость кесарева сечения при неправильном (ножном, поперечном) положении плода, предлежании плаценты.
Техника выполнения и расшифровка результатов
Выполнение УЗИ технически очень простое, но расшифровка и оценка результатов требуют опыта и навыков. Для процедуры применяются различные датчики, которые позволяют провести исследование через брюшную стенку (трансабдоминально) или внутри (трансвагинально). Для лучшего прохождения ультразвуковых лучей используется специальный гель.
Для получения достоверных результатов УЗИ доктор проводит измерения плода и сравнивает данные с нормами для каждой недели. Обязательно уточняется копчико-теменной (КТР) и бипариетальный размер (БПР). В первом триместре эти значения помогут точно определить срок беременности. На следующих исследованиях дополнительно измеряются окружность головки (ОГ), живота (ОЖ), длина костей конечностей и их соответствие неделям беременности.
Обязательно измерение сердцебиения плода: в 1-м триместре параметр может составлять 160—190 ударов, с 11-й недели — 140—160 уд./мин. В заключении должно указываться количество околоплодных вод, расположение плаценты, длина шейки матки.
Современные методы диагностики способны на ранних сроках выявить генетические аномалии. С помощью ЭхоКГ можно узнать о пороках сердца и быстро прооперировать ребенка. УЗИ поможет точно определить пол малыша, а такие методики, как 3D и 4D, покажут даже черты лица младенца на фото или видеозаписи.
Хоть вокруг безопасности метода и ведутся различные споры, исследование несет много полезной информации о состоянии здоровья будущей мамы и плода.
Читайте также:
