Расчет церебрального кровотока. Диффузия газов в тканях
Добавил пользователь Евгений Кузнецов Обновлено: 28.01.2026
Ежегодно у 200 млн женщин в мире наступает беременность, у 137,6 млн из них она заканчивается родами. Каждый год около 585 тыс. женщин умирает от причин, связанных с беременностью [6].
В Российской Федерации гестоз и эклампсия занимают одно из первых трех мест в структуре материнской смертности, периодически уступая первенство кровотечениям и септическим осложнениям. В последние годы отмечается увеличение частоты гестоза за счет тяжелых форм патологии. Эклампсия — крайне опасное осложнение гестоза, встречается достаточно часто: 1 случай на 2000 родов в Европе и развитых странах [16]. В развивающихся странах в среднем 1 случай эклампсии приходится на 100 родов, что в 20 раз чаще, чем в странах с высоким социальным уровнем жизни.
В мире ежегодно от эклампсии или связанных с нею осложнений погибает около 50 тыс. женщин. В отдельных странах уровень материнской смертности при эклампсии достигает 17,5%, а перинатальной смертности — от 13 до 30% [11]. Таким образом, становится очевидным тот факт, что существенного прогресса в осмыслении этиологии, патогенеза, а следовательно, и профилактики гестоза за последние несколько десятков лет не произошло. Отечественными и зарубежными авторами [4, 7, 20, 32] убедительно доказано, что классическая триада симптомов не является достоверным прогностическим критерием, а имеющиеся методы диагностики гестоза имеют ряд существенных для практической деятельности недостатков: невысокий прогностический индекс, отсутствие должной степени воспроизводимости, высокую стоимость. В связи с этим по-прежнему актуален поиск критериев тяжести гестоза, отличающихся высокой степенью корреляции с развитием тяжелых, жизнеопасных осложнений, а также характеризующихся достаточной воспроизводимостью для применения их в условиях скрининговых исследований, неинвазивностью, низкой стоимостью.
Впервые в нашей акушерской практике внедрен метод транскраниальной допплерографии (ТДГ) для оценки состояния мозгового кровообращения у беременных и рожениц с гестозом. Установлены нормативные величины отдельных показателей мозгового кровообращения у здоровых беременных и рожениц. Выявлены дополнительные критерии значимости в диагностике тяжести гестоза.
Целью настоящего исследования была оценка мозгового кровообращения у беременных и рожениц с гестозом. При этом решались следующие задачи:
- изучение перфузии мозга у беременных и рожениц с различной степенью тяжести гестоза;
- установление взаимосвязи между мозговым кровообращением и отдельными критериями, определяющими тяжесть гестоза;
- выявление дополнительных прогностических критериев тяжести гестоза.
Исследование проводилось на базе Республиканского перинатального центра Министерства здравоохранения Республики Карелия. Под наблюдением находились 232 женщины в возрасте от 16 до 37 лет (средний возраст 25,2 ± 5,5 года) с диагнозом гестоза различной степени тяжести. Группу сравнения составили 90 условно здоровых беременных женщин в возрасте от 19 до 34 лет (средний возраст 25,9 ± 4,2 года) в третьем триместре беременности, состоявших на диспансерном учете в консультативном отделении перинатального центра. Беременные основной группы были разделены на три подгруппы: в первую подгруппу входили 110 пациенток с гестозом легкой степени тяжести, во вторую — 70 женщин с гестозом средней степени тяжести, в третью — 52 пациентки с тяжелым гестозом. Средний гестационный возраст в обеих группах составил 34 ± 3 нед. Динамическое наблюдение в послеродовом периоде проводилось на вторые сутки. Диагноз гестоза был верифицирован на основании Международной статистической классификации болезней и проблем, связанных со здоровьем, 10-го пересмотра. Степень тяжести гестоза оценивалась по шкале Goecke в модификации Г. М. Савельевой. Все женщины находились на лечении в отделении патологии беременности или палате интенсивной терапии перинатального центра. В клинически тяжелых случаях детальное обследование осуществлялось после начала терапии. Из наблюдения были исключены пациентки, имеющие пороки сердца, нарушения сердечного ритма, ишемическую болезнь сердца, хроническую артериальную гипертензию, кардиомиопатию, грубые нарушения гемореологических показателей, сахарный диабет, нейроинфекции, черепно-мозговые травмы и эпизоды синкопальных состояний в анамнезе.
Артериальное давление (АД) измерялось в положении на левом боку автоматическим сфигноманометром монитора Cardiocap II фирмы DATEX, с обычной манжетой на левой руке, дважды — до и после ТДГ. Среднее артериальное давление (САД) подсчитывали по формуле Хикема: САД = дАД - пАД В 3, где дАД — диастолическое артериальное давление, пАД — пульсовое артериальное давление, согласно равенству пАД = сАД - дАД, где сАД — систолическое артериальное давление.
Парастернальным доступом в M-режиме в фазе систолы вычислялся конечно-систолический размер (КСР), в фазе диастолы — конечно-диастолический размер (КДР), установлена частота сердечных сокращений (ЧСС). На основании полученных данных встроенной программой ультразвукового сканера автоматически вычисляли по L.Teichholz конечно-систолический объем (КСО) левого желудочка, конечно-диастолический объем (КДО) левого желудочка. Подсчитаны ударный объем (УО): УО = КДО - КСО; фракция выброса (ФВ): ФВ = УО В КДО х 100 (%) , фракция укорочения (ФУ) переднезаднего размера левого желудочка в систолу: ФУ = <(КДР - КСР) В КДР>Ё 100 (%); минутный объем сердца (МОС): МОС = (УО х ЧСС) В 100; сердечный индекс (СИ): СИ = МОС В ППТ. Подсчет сердечного индекса потребовал вычисления площади поверхности тела (ППТ) согласно равенству DuBois: ППТ = 0,007184 х Р0,725 х В0,425, где Р — рост в сантиметрах, В — вес в килограммах. Общее периферическое сопротивление сосудов (ОПСС) подсчитывали по установленной формуле: ОПСС = САД х 80 В МОС.
Церебральная гемодинамика изучалась с помощью метода ТДГ. Исследование выполнялось на ультразвуковом сканере Aloka SSD-4000, в положении на спине с 15° наклоном влево для предупреждения развития синдрома аорто-кавальной компрессии. С целью исключения патологии, оказывающей потенциальное воздействие на фоновые показатели церебрального кровотока, проводилось цветовое дуплексное сканирование брахиоцефальных артерий и артерий вертебробазилярного бассейна.
При ТДГ транстемпоральным доступом с обеих сторон измерялись количественные параметры кровотока в области M1 сегмента средней мозговой артерии: пиковая систолическая скорость кровотока (PSV), конечная диастолическая скорость (EDV), усредненная по времени средняя скорость (TAV), индекс стабильности потока (SFI), систоло-диастолическое отношение (S/D), пульсационный индекс (PI) и индекс резистентности (RI). Перечисленные величины подсчитывались автоматически встроенной программой ультразвукового сканера.
Поскольку указанные выше линейные характеристики допплеровского спектра не позволили составить объективное представление об объеме перфузии мозга, был подсчитан ряд показателей, анализ которых помог уточнить состояние церебральной гемодинамики. По формуле K. P. Williams и соавторов [33] вычислялся индекс мозгового кровотока (BFI): BFI = CPP В RAP, где CPP — церебральное перфузионное давление, RAP — индекс гидродинамического сопротивления. CPP подсчитывали по формуле R. Aaslid в модификации M. A. Belfort и соавторов [28]: CPP = TAV В (TAV - EDV) х (CAД - дАД). После подсчета BFI и CPP появилась информация для объективного анализа перфузии мозга. Измерение внутричерепного давления (ICP), роль которого существенна в понимании ряда патофизиологических механизмов системы ауторегуляции сосудистого тонуса интракраниальных артерий, осуществлялось по формуле R. Aaslid [18]: ICP = САД - (1,1 сАД х TAV В PSV -5), базирующейся на показателях периферической гемодинамики. Индекс гидродинамического сопротивления в системе вычисляли по формуле: RAP = САД В TAV. Полученный согласно равенству D. H. Evans [32] результат позволил детально изучить цереброваскулярную резистентность. С целью измерения величины вазодилататорного резерва, получения представления о состоянии динамической, миогенной ауторегуляции системы церебрального кровообращения и прогнозирования ее компенсаторных возможностей на основании каротидного компрессионного теста вычислялся коэффициент овершута (OF) [3]. OF = TAV2 В TAV1, где TAV1 — исходная усредненная по времени средняя скорость до компрессии ипсилатеральной общей сонной артерии (ОСА), TAV2 — TAV первого-второго пиков после прекращения компрессии ОСА.
Тяжесть отечного синдрома оценивалась по четырехбалльной шкале. Для измерения уровня протеинурии в однократной порции и в суточном количестве мочи использовался унифицированный метод Брандберга-Робертса-Стольникова.
Достоверность различий средних значений устанавливалась методом сравнения средних значений двух выборочных совокупностей с определением t-критерия Стьюдента и уровня значимости (p). Выборка однородная, распределение нормальное, подтверждено тестом Колмогорова-Смирнова. Равенство дисперсий в группах проверялось при помощи критерия Левена. Для определения меры зависимости между переменными применялась простая линейная корреляция (r) Пирсона. Необходимые вычисления были реализованы в прикладном пакете программ STATISTICA 6.0.
Первоначально мы определили показатели мозгового кровотока у беременных с гестозом различной степени тяжести (легкая, средняя, тяжелая), и установили достоверность различий средних значений в исследуемых подгруппах и группе сравнения (табл. 1-7). Анализируя данные, полученные при ТДГ средней мозговой артерии, мы выяснили, что у беременных из основной группы при прогрессировании гестоза наблюдается достоверное, симметричное с обеих сторон снижение всех линейных показателей допплеровского спектра. У всех беременных при прогрессировании гестоза нами отмечалось снижение линейной скорости кровотока, преимущественно за счет пиковой систолической скорости. Выявлено достоверное изменение уровня цереброваскулярного сопротивления на основании снижения индекса резистентности и пульсационного индекса в подгруппе пациенток с гестозом. Показатель систоло-диастолического отношения, отражающий состояние сосудистой стенки, увеличивался при нарастании тяжести гестоза. Было отмечено достоверное различие в ряде величин, отражающих уровень давления, гидродинамического сопротивления и цереброваскулярную реактивность в сравнении с аналогичными показателями у здоровых пациенток в 3-м триместре беременности. Прогрессирование гестоза у обследуемых пациенток привело к существенному повышению уровня гидродинамического сопротивления в системе. Уровень внутричерепного давления также значительно увеличился по мере прогрессирования гестоза. Напротив, показатель церебрального перфузионного давления, индекс мозгового кровотока и индекс стабильности потока оказались достоверно ниже в группе беременных с тяжелой формой гестоза.
После родоразрешения при динамическом наблюдении в течение вторых суток послеродового периода нами вновь были изучены показатели церебральной гемодинамики. В послеродовом периоде у рожениц нами отмечалось существенное, симметричное с обеих сторон увеличение всех определяемых нами линейных величин допплеровского спектра. Родоразрешение привело к существенному снижению уровня гидродинамического сопротивления в сосудах головного мозга у рожениц, страдающих гестозом. Понижение сосудистого сопротивления в артериях мозга, возможно, свидетельствует об аномалии регуляции тонуса интракраниальных сосудов и позволяет предположить нарушение сосудистой реактивности.
В послеродовом периоде было выявлено достоверное изменение уровня цереброваскулярного сопротивления на основании увеличения индекса резистентности и пульсационного индекса в группах пациенток с гестозом. Повышение линейной скорости кровотока в мозговых артериях, преимущественно за счет пиковой систолической скорости, вероятно, обусловлено снижением периферического сосудистого сопротивления, что указывает на особую значимость нарушения сосудистого тонуса в генезе расстройств мозговой гемодинамики при гестозе. Отмечено достоверное различие в ряде величин, отражающих уровень давления и цереброваскулярную реактивность в сравнении с аналогичными показателями у здоровых рожениц. Уровень внутричерепного давления значительно снизился. Напротив, показатель церебрального перфузионного давления, индекс мозгового кровотока и индекс стабильности потока оказались достоверно выше в подгруппе рожениц с тяжелым гестозом. На основании изменения коэффициента овершута в послеродовом периоде было отмечено понижение цереброваскулярной реактивности за счет вазодилататорного резерва по мере утяжеления гестоза.
На следующем этапе настоящего исследования проводился корреляционный анализ между параметрами мозгового кровотока и тяжестью гестоза, протеинурией, тяжестью отечного синдрома, показателями центральной и периферической гемодинамики (САД, КСО, КДО, УО, ФВ, ФУ, МОС, СИ, ОПСС). Прослеживается четкая обратная взаимосвязь между отдельными индикаторами мозгового кровообращения и тяжестью отечного синдрома, уровнями САД, протеинурии. Наиболее значимый коэффициент корреляции с отечным синдромом наблюдается в отношении пиковой систолической скорости (r = -0,71), конечной диастолической скорости (r = -0,66) и усредненной по времени средней скорости (r = -0,70) (табл. 1). Следовательно, при нарастании тяжести отечного синдрома снижается скорость мозгового кровотока. Между тем чем выше индекс гидродинамического сопротивления, указывающий на уровень сосудистого сопротивления, тем более выражен отечный синдром (r = 0,75).
Наиболее значимый коэффициент корреляции с уровнем протеинурии в разовой порции мочи по-прежнему наблюдается у пиковой систолической скорости (r = -0,61), конечной диастолической скорости (r = -0,50) и усредненной по времени средней скорости (r = -0,55) (табл. 2, 3). Следовательно, при нарастании уровня протеинурии снижается скорость мозгового кровотока. При увеличении индекса гидродинамического сопротивления возрастает потеря белка с мочой (r = 0,61). Подобной взаимосвязи должно уделяться особое внимание, так как прогностически наиболее неблагоприятными принято считать формы гестоза, сопровождающиеся глубоким нарушением функции почек и выраженной протеинурией.
Корреляционный анализ выявил отчетливую, но несущественную взаимосвязь между показателями мозгового кровотока и САД (табл. 4), что вполне закономерно, так как кровообращение в головном мозге имеет собственную систему ауторегуляции, блокирующую колебания АД.
Корреляционный анализ выявил тесную взаимосвязь мозгового кровотока и отдельных показателей центральной и периферической гемодинамики. Обнаружена отчетливая прямая корреляция скоростных параметров допплеровского спектра и объемных показателей центральной гемодинамики (табл. 5). Выявленная взаимосвязь подчеркивает значимость сердечного выброса для мозгового кровообращения и необходимость учета насосной функции сердца при оценке церебральной гемодинамики. Отмечается высокая обратная линейная зависимость между скоростными характеристиками допплеровского спектра и общим периферическим сопротивлением сосудов (табл. 6). Центральное повышение уровня гидродинамического сопротивления у пациенток, страдающих гестозом, подтверждает и отчетливая прямая корреляция индекса гидродинамического сопротивления церебральных сосудов и ОПСС (r = 0,86).
При изучении данных была выявлена отчетливая отрицательная линейная взаимосвязь между отдельными индикаторами церебральной гемодинамики и степенью тяжести гестоза (табл. 7). Наиболее высокий коэффициент корреляции наблюдается в отношении пиковой систолической скорости (r = -0,95), конечной диастолической скорости (r = -0,87) и усредненной по времени средней скорости (r = -0,90). Следовательно, с нарастанием тяжести гестоза наблюдается пропорциональное усугубление нарушений церебрального кровотока.
Наиболее значимый коэффициент корреляции отмечается при сравнении отдельных критериев тяжести гестоза с линейными скоростными параметрами допплеровского спектра и индексом гидродинамического сопротивления (PSV, EDV, TAV, ИГС). Таким образом, прогностически весьма существенными следует считать указанные выше показатели церебрального кровообращения.
Наблюдаемые изменения церебральной гемодинамики, выявленные в ходе исследования в группе пациенток с гестозом, весьма характерны для сосудистых сегментов, находящихся в состоянии вазодилатации. Вероятно, изменение тока крови указывает на пассивное расширение в области M1 сегмента средней мозговой артерии, которое может отмечаться в случае комбинации повышенного АД и сбоя в системе ауторегуляции. Становится очевидным, что мозговая ауторегуляция у беременных, страдающих гестозом, оказывается «несостоятельной», поскольку не соблюдается закономерность реакции мозговой гемодинамики, состоящая в повышении скорости кровотока по магистральным артериям мозга в ответ на увеличение САД. Между тем известно, что при достижении уровня АД, превышающего верхний предел ауторегуляции, возникает феномен sausage-string, заключающийся в сегментарной дилатации артериол, что, в свою очередь, сопряжено с опасностью прорыва крови в окружающую ткань мозга. Повышение показателя коэффициента овершута подтверждает предположение о предельно напряженном резерве вазодилатации. По нашему мнению, указанные процессы ведут к увеличению внутричерепного давления, развитию вазогенного отека и формированию гипертонической энцефалопатии, что прямо и косвенно подтверждается итогами настоящего наблюдения. Между тем пассивному расширению артериол сопутствует снижение церебрального перфузионного давления. На фоне очерченных патологических процессов формируется феномен Кохера-Кушинга, направленный на восстановление церебрального перфузионного давления, за которым, предположительно, должно последовать дальнейшее прогрессивное повышение САД, усугубление артериальной гипертензии и формирование порочного круга. В том случае, когда внутричерепная гипертензия превышает компенсаторные возможности системы кровообращения, уровень мозгового кровотока и объем кровенаполнения головного мозга резко снижаются, развивается гипоксия и ишемия головного мозга, тогда как ауторегуляция нарушается или полностью утрачивается. Таким образом, наблюдается патологическая перфузия головного мозга на фоне пассивного расширения артериол. Нарушение перфузии мозга следует считать симметричным, поскольку не было выявлено достоверных различий между аналогичными величинами, измеренными с обеих сторон. Из вышеуказанного можно сделать следующие выводы.
- При любой степени тяжести гестоза у беременных и рожениц отмечается нарушение перфузии мозга.
- Наличествует тесная взаимосвязь между мозговым кровообращением и отдельными критериями, определяющими тяжесть гестоза.
- Глубина расстройств мозгового кровообращения пропорциональна тяжести гестоза.
- Прогностически наиболее значимыми являются линейные показатели допплеровского спектра, а именно скоростные характеристики потока.
Внедрение метода ТДГ в акушерскую практику позволило не только детально изучить проблему нарушения мозгового кровообращения у здоровых и страдающих гестозом беременных и рожениц, но и установить ряд весьма существенных прогностических критериев тяжести этого опасного осложнения гестации. Результаты ТДГ помогают практикующим врачам своевременно и адекватно решать вопросы диагностики гестоза и оценки его тяжести. Показатели мозгового кровотока могут с успехом использоваться для установления степени эффективности терапевтических вмешательств и целесообразности пролонгирования беременности.
Литература
А. А. Ившин
Петрозаводский государственный университет, Петрозаводск
Расчет церебрального кровотока. Диффузия газов в тканях
Кафедра неврологии Российского государственного медицинского университета
Российский национальный исследовательский медицинский университет им. Н.И. Пирогова, Москва, Россия
Кафедра факультетской хирургии Московского факультета ГОУ ВПО Российского государственного медицинского университета, Центральная клиническая больница Святителя Алексия, Москва
Состояние ауторегуляции мозгового кровотока
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. 2011;111(1): 68‑73
Федин А.И., Кузнецов М.Р., Берестень Н.Ф., Холопова Е.А., Тугдумов Б.В., Румянцева Е.И., Павочкина Е.С. Состояние ауторегуляции мозгового кровотока. Журнал неврологии и психиатрии им. С.С. Корсакова. 2011;111(1):68‑73.
Fedin AI, Kuznetsov MR, Beresten' NF, Kholopova EA, Tugdumov BV, Rumiantseva EI, Pavochkina ES. State of the brain blood flow autoregulation. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2011;111(1):68‑73. (In Russ.).
Изучалась ауторегуляция мозгового кровообращения (АМК) в норме и при различных вариантах атеросклероза у 97 человек. В 1-ю группу вошли 32 пациента с облитерирующим атеросклерозом артерий нижних конечностей с различными стадиями хронической артериальной недостаточности без гемодинамических поражений брахиоцефальных артерий; во 2-ю - 30 больных с различными формами хронической ишемии головного мозга с гемодинамически значимыми односторонними атеросклеротическими стенозами внутренней сонной артерии (от 70 до 95%). В контрольной группе было 35 здоровых мужчин 20-25 лет. Параметры АМК оценивали по разработанной авторами оригинальной методике. Установили, что в норме механизм АМК позволяет поддерживать постоянство перфузионного давления головного мозга за счет двух основных составляющих. На первом этапе - это усиление притока артериальной крови, продолжающееся на протяжении первых 1,5 мин после снятия пневматических манжет, после чего ему на смену приходит опережающее увеличение оттока венозной крови из полости черепа, снижающее тканевое давление. Более выраженные изменения АМК наблюдаются у пациентов с гемодинамически значимыми стенозами внутренней сонной артерии, менее - с периферическим атеросклерозом.
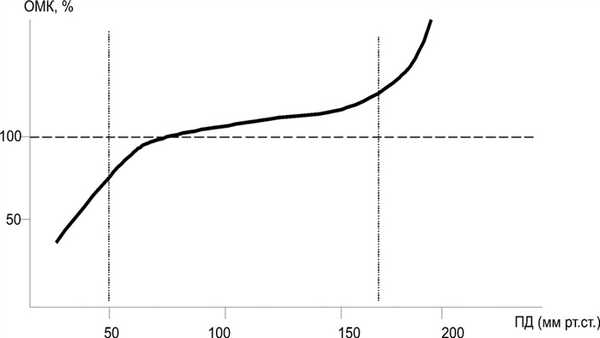
Основная функция сосудистой системы головного мозга - поддержание постоянства его гемодинамического и биохимического гомеостаза при различных физиологических и патологических состояниях, что предполагает наличие сложной структурно-функциональной организации процесса ауторегуляции мозгового кровообращения (АМК) [9, 13]. АМК - одно из фундаментальных свойств мозгового кровообращения [1, 7]. Она имеет принципиальное значение для адекватного кровоснабжения головного мозга и характеризуется способностью мозговых сосудов сохранять относительно неизменной объемную скорость мозгового кровотока при изменении перфузионного давления (разница между системным артериальным и внутричерепным) в пределах от 50 до 180 мм рт.ст. (рис. 1). Рисунок 1. Зависимость объемного мозгового кровотока (ОМК) от величины перфузионного давления (ПД) в норме. Объяснение в тексте. При выходе перфузионного давления за эти пределы наступает «срыв» ауторегуляции [5, 10, 11, 12, 15] и формируется линейная зависимость мозгового кровотока от динамики внутрисосудистого давления.
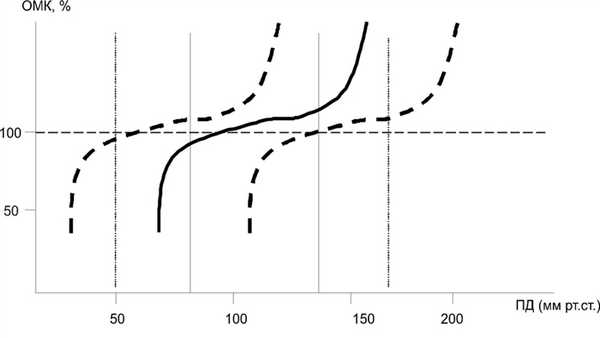
При атеросклеротическом поражении может возникать дискоординация тонуса сосудов головного мозга с изменением параметров ауторегуляции (рис. 2). Рисунок 2. Зависимость объемного мозгового кровотока (ОМК) от величины перфузионного давления (ПД) при различных патологических состояниях. Объяснение в тексте. Оперативные вмешательства, выполняемые у таких больных на сосудах головного мозга и артериях других органов (коронарные, почечные, аорта, артерии нижних конечностей), могут приводить к колебаниям перфузионного давления не только во время операции, но и в послеоперационном периоде с возможностью возникновения гемодинамического нарушения мозгового кровообращения. В связи с этим существует потребность правильной оценки возможностей АМК в предоперационном периоде, что может позволить своевременно провести терапию, направленную на нормализацию активности мозгового кровотока.
В клинической практике для оценки АМК применяются методики, как правило, основанные на применении ультразвуковой допплерографии магистральных артерий головы до и после химических, фармакологических и физических воздействий. К тестам химической природы относят гиперкапнические (ингаляция 4-8% карбогена, произвольная задержка дыхания, дыхание в замкнутом контуре, индуцированная гиповентиляция) и гипокапнические (спонтанная или индуцированная гипервентиляция) пробы. Достоинством этих тестов является то, что естественный «информационный переносчик» в сосудистой системе головного мозга - углекислый газ, а также, что они быстро выполнимы, так как насыщение крови углекислым газом наступает сравнительно быстро [6]. Недостатки: по достижении гиперкапнии обследуемый начинает испытывать ощущение нехватки воздуха, у него наступает «прилив» крови к голове, крайне нежелательный у больных с системным атеросклерозом, возможно развитие неспецифических реакций дыхательной и сердечно-сосудистой систем, способных искажать или маскировать эффект исследования.
Этих недостатков лишены физические тесты оценки АМК, в частности тест индуцированной нефармакологической гипотензии [8]. Суть данного метода заключается в сравнительном анализе изменений системного артериального давления (АД) и линейной скорости кровотока в сосудах головного мозга в ответ на острое снижение АД (на 20-25%) в результате постишемической гиперемии нижних конечностей после компрессии бедер пневматическими манжетами. В процессе мониторинга АД линейной скорости кровотока определяются относительные изменения этих параметров. Разница времени восстановления системного АД и линейной скорости кровотока в сосудах головного мозга указывает на возможности АМК. При низких функциональных возможностях АМК тренд линейной скорости кровотока когерентен динамике АД, при достаточной реактивности мозгового кровотока линейная скорость кровотока в сосудах головного мозга восстанавливается значительно быстрее системного АД. Показателем ауторегуляции АМК является RoR, который рассчитывается по следующей формуле:
RoR = ΔCVR : ΔT50·ΔCPP x 100%,
где Dgr;CVR - относительное изменение цереброваскулярного сопротивления после снижения давления в манжетах; Dgr;T50 - время, в течение которого линейная скорость кровотока после своего максимального снижения во время манжетного теста восстанавливается до 50% от исходного значения; Dgr;CPP - относительное изменение перфузионного давления после снижения давления в манжетах.
Недостаток методики в том, что при локальных нарушениях АМК в случае очаговых церебральных поражений регионарный кровоток зависит от разницы внутриартериального и локального тканевого давления. Поскольку это давление на уровне мелких артерий и артериол и в норме составляет лишь несколько мм рт.ст., даже небольшое повышение тканевого давления резко уменьшает тканевой кровоток за счет уменьшения перфузионного давления. Неравномерность тканевого давления при очаговых поражениях обусловливает неравномерную перфузию головного мозга, что усугубляет нарушения АМК и может вызвать расстройство мозгового кровообращения. В связи с этим исследования динамики лишь системного артериального давления и скорости кровотока по магистральным артериям головного мозга недостаточно, поскольку не отражает динамику тканевого давления. Применяемый же в этом методе мониторинг внутричерепного давления требует сложной специальной диагностической системы и особого программного обеспечения.
Цель исследования - разработка новых ультразвуковых критериев диагностики функциональных возможностей АМК.
Материал и методы
Параметры АМК были изучены у 97 обследованных мужчин, разделенных на 3 группы.
1-ю группу составили 32 пациента в возрасте 46-72 лет (в среднем - 57,46+5,15 года) с облитерирующим атеросклерозом артерий нижних конечностей с различными стадиями хронической артериальной недостаточности. У этих больных имелось поражение аорты, артерий таза и нижних конечностей без гемодинамических поражений брахиоцефальных артерий. У 21 из них была IIБ стадия и у 11 - III стадия ишемии по Фонтейну-Покровскому.
2-ю группу составили 30 больных с различными формами хронической ишемии головного мозга в возрасте 44-69 лет (в среднем - 55,39±6,25 года) с гемодинамически значимыми односторонними атеросклеротическими поражениями внутренней сонной артерии (ВСА). У 8 больных имелась I, у 7 - II и у 15 - III стадия ишемии. В данную группу мы не включали пациентов с IV стадией ишемии, т.е. перенесших острое нарушение мозгового кровообращения. Степень стеноза ВСА составила от 70 до 95% (в среднем 82,10±7,33%). Больные с окклюзией ВСА из исследования исключались. Функциональные возможности АМК у данной группы пациентов определяли на стороне поражения.
3-я группа была контрольной. Ее составили 35 здоровых в возрасте 20-25 лет.
Состояние АМК оценивали по специально разработанному методу [1] . Для измерения скорости кровотока в средней мозговой артерии использовали транскраниальный датчик с частотой 2 МГц, во внутренней яремной вене - линейный датчик с частотой 6-10 МГц. Исследование проводили на аппарате Philips - HDI 5000 (США). В состоянии физиологического покоя определяли АД на плечевой артерии, визуализировали среднюю мозговую артерию и внутреннюю яремную вену, измеряли средние линейные и объемные скорости кровотока. Далее пациенту на 5 мин накладывали пневматические манжеты на обе нижние конечности в верхней трети бедра до полного прекращения кровотока по артериям нижних конечностей ниже места компрессии. По истечении 5-минутного временного интервала одномоментно снимали пневматические манжеты и определяли системное АД и скорости кровотока в средней мозговой артерии и внутренней яремной вене.
После этого оценивали абсолютные показатели скоростей кровотока, а также процент их изменения после компрессионной пробы. Указанные сосуды были выбраны в связи с тем, что средняя мозговая артерия является прямым продолжением ВСА, поставляющей головному мозгу основной объем артериальной крови, а внутренняя яремная вена - основной сосуд, обеспечивающий отток крови из полости черепа.
В процессе исследования определялся диаметр средней мозговой артерии и внутренней яремной вены как до, так и после компрессионной пробы. Это исследование показало, что диаметр сосудов достоверно не меняется в зависимости от этапов исследования. Учитывая, что объемная скорость прямо пропорциональна диаметру сосуда и линейной скорости кровотока, в дальнейших исследованиях мы упростили методику ультразвуковой диагностики, ориентируясь только на линейную скорость кровотока.
Результаты и обсуждение
После устранения компрессии с бедренных артерий у пациентов контрольной группы происходит усиление артериального притока к головному мозгу вследствие двух физиологических механизмов (табл. 1). Первый связан с реперфузией головного мозга вслед за кратковременным падением системного АД после снятия пневматических манжет с бедренных артерий. Второй обусловлен раздражением хеморецепторов мозговых сосудов, появившимися в общем кровотоке недоокисленными продуктами обмена, накапливающихся в нижних конечностях во время моделированной ишемии. Это является компенсаторным механизмом, способствующим увеличению перфузионного давления в полости черепа. Максимум увеличения притока артериальной крови происходит в интервале от 60 до 90 с после прекращения компрессионной пробы. В дальнейшем интенсивность артериального кровотока падает (рис. 3). Рисунок 3. Нормальные показатели изменения максимальной скорости кровотока до и после компрессионной пробы (в %) в средней мозговой артерии (кривая 1) и внутренней яремной вене (кривая 2). Объяснение в тексте. Перфузионное давление в тканях головного мозга продолжает оставаться на высоком уровне в течение еще некоторого времени, что обусловлено опережающим увеличением оттока венозной крови из полости черепа. Максимальное увеличение скорости тока крови во внутренней яремной вене соответствует временному интервалу 90-120 с после снятия манжет с бедренных артерий (см. рис. 3).
Таким образом, в физиологических условиях проведения теста, близких к основному обмену, в течение 2 мин после прекращения 5-минутной компрессии обеих бедренных артерий отмечается рост перфузионного давления в тканях головного мозга. Причинами этого феномена можно считать, во-первых, увеличение притока артериальной крови на первом этапе и, во-вторых, опережающее повышение оттока венозной крови из полости черепа на втором этапе. Оба эти компонента, дополняя друг друга, играют значительную роль в поддержании адекватного кровоснабжения головного мозга. От взаимодействия этих компонентов зависит эффективность АМК.
У пациентов 1-й группы имелись достоверные (p <0,05) отклонения гемодинамических показателей по сравнению с контролем (табл. 2). В первую очередь это касается внутренней яремной вены, отток крови по которой косвенно отражает величину тканевого давления головного мозга. Если в контрольной группе имелось прогрессирующее увеличение данного показателя с максимальным значением в диапазоне от 90 до 120 с после снятия манжет с бедер, то у пациентов с периферическим атеросклерозом увеличение тока венозной крови носило несущественный характер с коротким пиком максимального значения на 90-й секунде компрессионной пробы (рис. 4). Рисунок 4. Показатели изменения максимальной скорости кровотока (в с) до и после компрессионной пробы (в %) в средней мозговой артерии и внутренней яремной вене в 1-й группе и контроле. Кривая 1 - средняя мозговая артерия в контрольной группе, 2 - внутренняя яремная вена в контрольной группе, 3 - средняя мозговая артерия в 1-й группе, 4 - внутренняя яремная вена в 1-й группе. На протяжении всего исследования скоростные характеристики внутренней яремной вены в 1-й группе больных были существенно меньше по сравнению с контролем (p<0,05). Это связано, по-видимому, с неадекватным функциональным состоянием сосудов микроциркуляторного русла, развивающимся на фоне атеросклероза, приводящего к увеличению микровязкости клеточных мембран как эндотелия, так и форменных элементов крови [3]. В норме основная роль мелких артериоловенулярных шунтов заключается в быстром перераспределении артериальной крови в венозное сосудистое русло для поддержания адекватного кровоснабжения органа. Физиологическое значение артериоловенулярных анастомозов заключается во включении пути юкстакапиллярного (шунтирующего) кровотока при необходимости разгрузки капиллярного русла и ускорении кровообращения органа. Гемодинамическое значение шунтирующего кровотока вытекает из того, что диаметр анастомозов почти в 10 раз больше диаметра капилляров и в перерасчете на единицу длины объем кровотока в анастомозах в 10 тыс. раз превышает его объем в капиллярах. Так, 1 мкл крови у здорового человека проходит через капилляр диаметром 10 мкм в течение 6 ч, а через артериоловенулярный анастомоз всего за 2 с [2, 14]. Таким образом, артериоловенулярные шунты в нормальных условиях служат средством борьбы с сопротивлением току крови на уровне капиллярной сети - при открытии анастомозов увеличивается давление в венозном русле и возрастает ток крови в нем. Без имеющегося биологического механизма быстрого перераспределения крови при увеличении ее притока возникало бы полнокровие органа с развитием интерстициального отека. Для головного мозга, находящегося в закрытой черепной коробке, это грозило бы смертельными осложнениями.
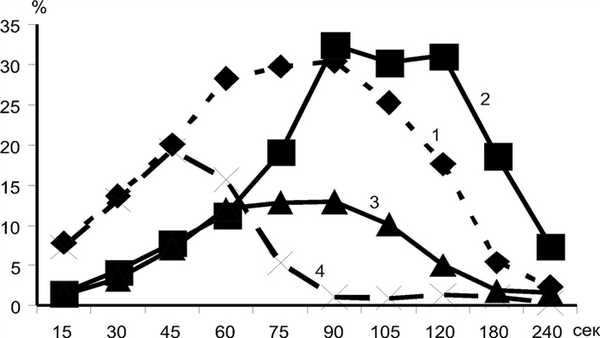
В отличие от контрольной группы, достоверное повышение кровотока во внутренней яремной вене у больных этой группы начинается уже через 15 с после снятия компрессионных манжет с бедер и сохраняется на протяжении 1-й минуты исследования (рис. 5). Рисунок 5. Показатели изменения максимальной скорости кровотока (в с)(ось абсцисс) до и после компрессионной пробы (в %) (ось ординат) в средней мозговой артерии и внутренней яремной вене в контрольной группе (кривые 1 и 2) и во 2-й группе (кривые 3 и 4). В дальнейшем, начиная с 75-й секунды, когда в норме интенсивность венозного оттока увеличивается, у больных с гемодинамическим стенозом ВСА компенсаторные возможности мозгового кровотока падают, и скоростные показатели кровотока по внутренней яремной вене возвращаются к исходным значениям.
Наше исследование показало, что в норме механизм АМК позволяет поддерживать постоянство перфузионного давления головного мозга за счет двух основных составляющих. На первом этапе - это усиление притока артериальной крови, продолжающееся на протяжении первых 1,5 мин после снятия с бедер пневматических манжет, после чего ему на смену приходит опережающее увеличение оттока венозной крови из полости черепа, снижающее тканевое давление. У больных с атеросклерозом данный адаптационный механизм может быть нарушен.
Наиболее выраженные изменения ауторегуляции мозгового кровотока наблюдаются у пациентов с гемодинамически значимыми стенозами внутренней сонной артерии как за счет низкого притока артериальной крови, так и вследствие короткого парадоксального увеличения кровотока по внутренней яремной вене. У больных с периферическим атеросклерозом нарушения ауторегуляции менее выражены, хотя и они в определенных ситуациях могут привести к развитию гемодинамического нарушения мозгового кровообращения. В их основе лежат низкие функциональные возможности микроциркуляции головного мозга, не позволяющие своевременно перераспределять артериальную кровь в венозное сосудистое русло через артериоловенулярные шунты и тем самым поддерживать перфузионное давление в необходимом диапазоне.
Перфузия мозгового кровотока
КЛИНИЧЕСКИЕ АСПЕКТЫ КЛИНИЧЕСКОГО ПРИМЕНЕНИЯ ОЦЕНКИ ПЕРФУЗИИ МОЗГОВОГО КРОВОТОКА В ДИАГНОСТИКЕ ОСТРЫХ НАРУШЕНИЙ МОЗГОВОГО КРОВООБРАЩЕНИЯ (ИШЕМИЧЕСКИХ ИНФАРКТОВ).
В последние годы после внедрения в клиническую практику методики многослойного спирального сканирования, использования протоколов с низкими скоростями введения контрастных веществ (КВ) и внедрения более совершенных программ обработки получило развитие динамическое отображение перфузии при помощи КТ (ПКТ - перфузионная КТ, РСТ- perfusion computed tomography). Методика позволяет проводить количественную оценку церебрального кровотока, выполняется быстро, является экономически эффективной и нетравматичной для пациентов. Она даёт два неоспоримых преимущества при диагностике инсультов:
- области мозга с нарушением перфузии могут обнаруживаться сразу же после появления клинической симптоматики;
- данные о состоянии кровотока в тканях по результатам КТ дают возможность врачу отличить необратимо повреждённые инфарктом ткани головного мозга и потенциально обратимые изменения, располагающиеся в области, так называемой, пенумбры или полутени.
Таким образом, появляется возможность проведения своевременного лечения инсульта с учётом индивидуальных особенностей мозгового кровотока пациента при использовании более широкого терапевтического окна. Для получения функциональной информации о церебральном кровотоке при ПКТ вводится кратковременный болюс контрастного вещества (быстрое внутривенное введение контрастного препарата, во время прохождения которого можно получать повторяющийся через одинаковый промежуток времени один или несколько (при MСКТ) срезов.
Исследование базируется на теории разведения индикатора: после внутривенного введения болюса контрастного вещества, денситометрические показатели головного мозга временно увеличиваются. Информацию о состоянии церебрального кровотока можно получить путем изучения распространенности и изменений плотности головного мозга со временем. Параметры церебральной перфузии определяются при помощи различных математических алгоритмов и предоставляются в виде изображений с кодированными цветом параметрами в виде карт основных параметров.
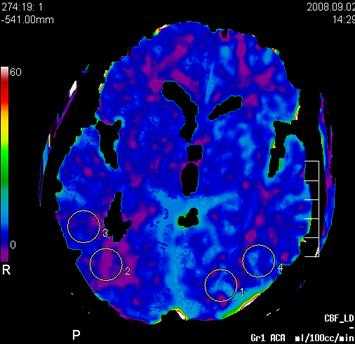
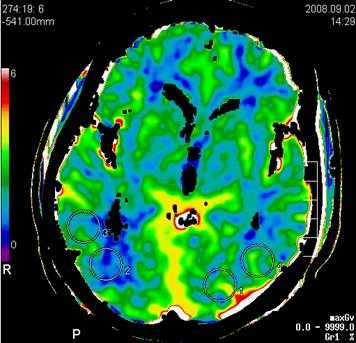
Пример: карта объема мозгового кровотока, с указанием показателей повышения плотности вещества головного мозга во время прохождения быстрого болюса контрастного вещества.
Основными параметрами являются: церебральный кровоток (ЦК), объем церебрального кровотока (ОЦК), среднее время транзита (СВТ) и время до максимума (ВМ).
1. Церебральный кровоток является самым важным параметром. Он показывает количество крови, которое проходит через ткань мозга за определённое время, и измеряется количеством миллилитров крови на 100 г ткани мозга в минуту. Обычно в норме значения для ЦК находятся в пределах 50 - 80 мл крови на 100 г ткани мозга в минуту. Области мозга с большой энергетической потребностью типа кортикальной поверхности или подкорковых узлов имеют иногда значения ЦК в 2 - 3 раза большие значений для белого вещества.
При значении ЦК менее 20 мл/100 г/мин в результате энергетической недостаточности синаптическая функция нервных клеток ухудшается и клинически возникает неврологический дефицит. Однако такая потеря может быть в значительной степени компенсирована при полном восстановлении церебрального кровотока. При значениях ЦК ниже 10 - 15 мл/100 г/мин метаболизм нервных клеток не может более поддерживаться. Если ЦК продолжает оставаться ниже уровня, так называемого значения порога ишемии, в течение 2 - 10 минут, то в результате возникает необратимое повреждение клеток.
При ишемических церебральных инфарктах вокруг необратимо повреждённой ткани ядра со значениями церебрального кровотока ниже 10 - 15 мл/100 г/мин, как правило, сохраняется ткань мозга, в которой кровоток поддерживается через коллатеральные сосуды на уровне 10 - 20 мл/100 г/мин. Клетки этой области (так называемой пенумбры инфаркта, или симптома «полутени») не функционируют, но и не являются необратимо повреждёнными, т.е. находятся на грани.
Структурного повреждения в клетках зоны пенумбры не происходит до тех пор, пока гипоперфузия поддерживается в пенумбре в течение некоторого времени. Этот период, который иногда длится много часов, не может быть четко предсказан в каждом индивидуальном случае. Лечение ишемических церебральных инфарктов не направлено на уже необратимо повреждённую ткань мозга в ядре инфаркта, а предназначено для частичного или полного восстановления потенциально спасаемой ткани (ткани риска расположенной в зоне переходного состояния) в пенумбре, которая может иметь место после восстановления значений скорости перфузии до нормальных.
Пример: Пациент С, 52 лет, исследование перфузии мозгового кровотока, немедленное (до 3 часов с момента возникновения очаговой неврологической симптоматики в виде левостороннего гемипареза с элементами моторной афазии).
При проведении стандартного нативного исследования в первые 3 часа истинных признаков развившегося инфаркта (наличия гиподенсивной зоны некроза мозговой ткани, нарушения дифференцировки серого и бело вещества, наличия отека вещества головного мозга, и признаков окклюзии правой СМА) не отмечается.
Однако при проведении немедленной перфузии мозгового кровотока на основании карты объема мозгового кровотока, определяется наличие грубой зоны локальной аперфузии (отсутствия мозгового окруженной зоной гипоперфузии в правом полушарии на уровне базальных ганглиев в проекции височно - теменных отделов правого полушария в территориальном бассейне кровоснабжения правой средней мозговой артерии (правой СМА).
2. Объем церебрального кровотока определяется как процентное содержание кровеносных сосудов в определённом объёме мозговой ткани. Поэтому высоковаскуляризированные области головного мозга типа подкорковых узлов или кортикальной поверхности имеют более высокие значения ОЦК по сравнению с менее васкуляризированным белым веществом головного мозга. Однако ОЦК является функциональным параметром и изменяется в зависимости от диаметра сосудов в контексте сосудистой ауторегуляции.
В отличие от ЦК, которое при ишемии имеет пониженное значение в ядре инфаркта и пенумбре, значение ОЦК в пенумбре обычно увеличивается. Это вызвано ауторегуляцией мозговых сосудов: уменьшение ЦК должно компенсироваться расширением соответствующих сосудов. И, наоборот, в необратимо повреждённом ядре инфаркта ауторегуляция обычно уже не действует, а значение ОЦК понижается. Это оказывает помощь в диагностике инсультов: области с пониженными значениями ОЦК в острой стадии ишемии являются, как правило, необратимо повреждёнными.
3. Самыми распространёнными параметрами для описания нарушений перфузии являются среднее время транзита (СВТ) и время до максимума (time to peak, TTP). Между этими параметрами и церебральным давлением перфузии имеется непосредственная связь. Даже небольшие нарушения в снабжении кровью могут вести к увеличению ВМ и СВТ. В клинических исследованиях по изучению инсульта было установлено, что эти параметры очень чувствительны в определении нарушений региональной перфузии головного мозга. Однако это не является специфичным для ишемии. Патологические значения параметров ВМ и СВТ присутствуют в ядре инфаркта и пенумбре, однако могут быть обусловлены клинически бессимптомным стенозом сосудов (например, во внутренней сонной артерии) или вазоспазмом.
Заключение:
Перфузионная или динамическая КТ, в настоящее время представляет собой достаточно простой, быстрый, малоинвазивный и удобный для пациента метод исследования физиологии мозгового кровообращения, необходимый для адекватной и своевременной оценки нарушений мозгового кровообращения и своевременной и полноценной терапии ОНМК с целью минимизации рисков и последствий развития инфаркта головного мозга.
Оценка церебральной и центральной гемодинамики у новорожденных с перинатальной энцефалопатией
Доступная эффективность. Универсальный ультразвуковой сканер, компактный дизайн и инновационные возможности.
Материалы и методы
Было обследовано 103 ребенка (I группа - 58 детей, родившихся недоношенными со сроком гестации 27-36 недель и массой при рождении от 910 до 1910 г, II группа - 45 детей, родившихся доношенными с массой от 2070 до 4400 г) в возрасте от 4 дней до 6 месяцев. Исследования проводились в динамике через 7-10 дней во время пребывания ребенка в стационаре на втором этапе выхаживания, а затем при явке его для наблюдения в поликлинику Научного центра здоровья детей РАМН (НЦЗД). Состояние всех детей в момент обследования было стабильным, а в клинической картине ведущей была неврологическая симптоматика различной степени тяжести. Всем пациентам проводили ультразвуковое исследование мозга и цветную допплерографию внутричерепных сосудов - передней мозговой, внутренней сонной и базиллярной артерий (рис. 1). Учитывали максимальную систолическую скорость (Vmax), среднюю скорость кровотока за время сердечного цикла (Vmean), минимальную диастолическую скорость (Vmin) и индекс резистентности RI=(Vmax-Vmin)/Vmin. Параллельно проводили ЭХО-кардиографическое исследование, определяя общий ударный объем (УО), вычисляемый как разница между диастолическим и систолическим объемами левого желудочка; эффективный ударный объем (УО эфф); минутный объем кровообращения (МО); фракцию изгнания (ФИ). Все ультразвуковые обследования проводили в одно и то же время - через 1 час после кормления детей в состоянии покоя. Регулярно оценивали пациентам соматический и неврологический статус и проводили общеклинические лабораторные исследования.
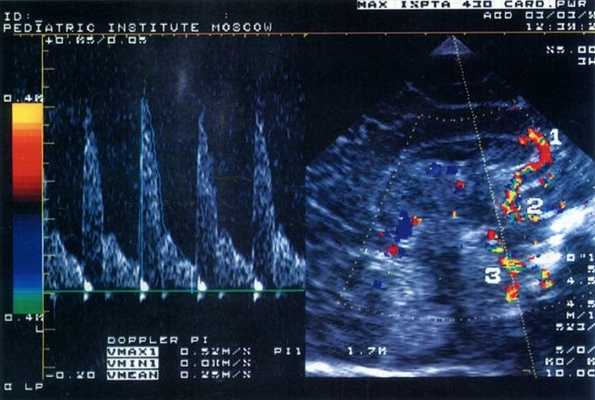
Рис. 1. Эхограмма головного мозга новорожденного (сагиттальный срез через большой родничок) и допплерограмма кровотока по базиллярной артерии.
Результаты
Для вычисления описательных характеристик показателей центральной и церебральной гемодинамики обследованные были разделены на подгруппы по возрасту и периоду перинатальной энцефалопатии: первые 28 дней - острый период, старше 28 дней - восстановительный период.
Значения скоростей мозгового кровотока во всех трех обследованных сосудах были выше у доношенных детей по сравнению с недоношенными и в восстановительном периоде по сравнению с острым периодом (табл. 1). Другими словами, абсолютные скорости кровотока в крупных мозговых артериях повышались с увеличением массы тела, гестационного и постнатального возраста ребенка, что подтвердил корреляционный анализ. Наиболее выраженной была зависимость скоростей кровотока от массы тела (табл. 2). Индексы резистентности мозговых артерий были выше в группе детей, родившихся недоношенными (в остром периоде разница была высокодостоверной с р
| Показатель | Доношенные | Недоношенные | ||
|---|---|---|---|---|
| Острый период | Восстановительный период | Острый период | Восстановительный период | |
| V max ПМА, м/сек | 0,33±0,12 | 0,49±0,14 | 0,32±0,12 | 0,48±0,18 |
| V min ПМА, м/сек | 0,09±0,04 | 0,13±0,05 | 0,07±0,04 | 0,12±0,08 |
| V mean ПМА, м/сек | 0,20±0,08 | 0,30±0,09 | 0,19±0,07 | 0,29±0,12 |
| RI ПМА | 0,72±0,08 | 0,74±0,08 | 0,77±0,09 | 0,76±0,11 |
| V max ВСА, м/сек | 0,48±0,13 | 0,71±0,11 | 0,46±0,13 | 0,58±0,15 |
| V min ВСА, м/сек | 0,12±0,05 | 0,16±0,07 | 0,09±0,06 | 0,14±0,08 |
| V mean ВСА, м/сек | 0,29±0,09 | 0,41±0,07 | 0,26±0,09 | 0,35±0,12 |
| RI ВСА | 0,75±0,07 | 0,78±0,10 | 0,81±0,09 | 0,77±0,09 |
| V max БА, м/сек | 0,46±0,14 | 0,59±0,13 | 0,40±0,12 | 0,53±0,16 |
| V min БА, м/сек | 0,11±0,05 | 0,13±0,05 | 0,07±0,04 | 0,12±0,08 |
| V mean БА, м/сек | 0,27±0,09 | 0,34±0,08 | 0,22±0,07 | 0,32±0,11 |
| RI БА | 0,75±0,08 | 0,77±0,08 | 0,81±0,09 | 0,78±0,10 |
ПМА - передняя мозговая артерия.
ВСА - внутренняя сонная артерия.
БА - базиллярная артерия.
Vmax - максимальная систолическая скорость.
Vmin - минимальная диастолическая скорость.
Vmean - средняя скорость кровотока за время сердечного цикла.
RI - индекс резистентности.
Абсолютные показатели сердечного выброса - общий ударный объем, эффективный сердечный выброс и минутный объем кровообращения были выше в группе доношенных детей как в остром, так и в восстановительном периодах (табл. 3). Так же, как и скорости мозгового кровотока, значения сердечного выброса увеличивались с увеличением массы тела у всех обследованных детей (табл. 2). Относительные показатели (сердечные индексы) - УО/кг, УО эфф/кг и МО/кг - были выше у недоношенных, что можно объяснить более высокими темпами роста, большей потребностью в кислороде и напряженностью метаболических процессов у таких детей по сравнению с доношенными.
Таблица 2. Коэффициенты корреляции между массой тела при обследовании и показателями центральной и церебральной гемодинамики (р<0,01).
| Дети | УО эфф | УО эфф/кос | МО | МО/кг | УО | УО/кг |
|---|---|---|---|---|---|---|
| Доношенные | 0,42 | -0,47 | 0,37 | -0,44 | 0,43 | -0,48 |
| Недоношенные | 0,69 | -0,31 | 0,60 | -0,36 | 0,57 | -0,42 |
| Дети | Vmax ПМА | Vmin ПМА | Vmean ПМА | RI ПМА | Vmax ВСА | Vmin ВСА |
| Доношенные | 0,27 | 0,28 | 0,30 | - | 0,35 | 0,30 |
| Недоношенные | 0,51 | 0,57 | 0,55 | -0,27 | 0,36 | 0,37 |
| Дети | Vmean ВСА | RI ВСА | Vmax ВСА | Vmin ВСА | Vmean ВСА | RI ВСА |
| Доношенные | 0,34 | - | 0,43 | 0,40 | 0,46 | - |
| Недоношенные | 0,37 | -0,23 | 0,42 | 0,54 | 0,50 | -0,34 |
ПМА - передняя мозговая артерия.
ВСА - внутренняя сонная артерия.
УО - общий ударный обьем.
УО эфф - эффективный ударный обьем.
МО - минутный объем кровообращения.
Vmax - максимальная систолическая скорость.
Vmin - минимальная диастолическая скорость.
Vmean - средняя скорость кровотока за время сердечного цикла.
RI - индекс резистентности.
Один из основных параметров сократимости миокарда - фракция изгнания - в обеих группах был одинаковым и соответствовал норме.
| Показатель | Доношенные | Недоношенные | ||||
|---|---|---|---|---|---|---|
| Острый период | Восстановительный период | Острый период | P1 | Восстановительный период | P2 | |
| УО, мл | 6,35±1,61 | 6,70±2,04 | 4,84±0,99 | 5,78±1,81 | ||
| УО/кг, мл/кг | 2,08±0,60 | 1,78±0,48 | 2,27±0,58 | 2,14±0,56 | ||
| УО эфф, мл | 6,14±1,55 | 6,85±2,16 | 4,58±1,20 | 5,90±2,22 | ||
| УО эфф/кг, мл/кг | 2,01±0,54 | 1,71±0,55 | 2,16±0,67 | >0,05 | 2,09±0,58 | |
| МО, л/мин | 0,91±0,26 | 1,04±0,31 | 0,70±0,19 | 0,92±0,33 | ||
| МО/кг, л/мин/кг | 0,30±0,09 | 0,26±0,09 | 0,33±0,11 | 0,33±0,10 | ||
| ФИ | 0,69±0,04 | 0,69±0,04 | 0,69±0,03 | - | 0,69±0,05 | - |
УО - общий ударный обьем.
УО эфф - эффективный ударный обьем.
МО - минутный объем кровообращения.
ФИ - фракция изгнания.
P1 - коэффициент достоверности по отношению к подгруппе доношенных детей в остром периоде.
Р2 - по отношению к подгруппе доношенных детей в восстановительном периоде.
Между сердечными индексами и скоростями мозгового кровотока связь была обратной в обеих группах детей.
Зависимости между показателями мозгового кровотока, в том числе и индексами резистентности, и частотой сердечных сокращений в нашем исследовании не выявлено.
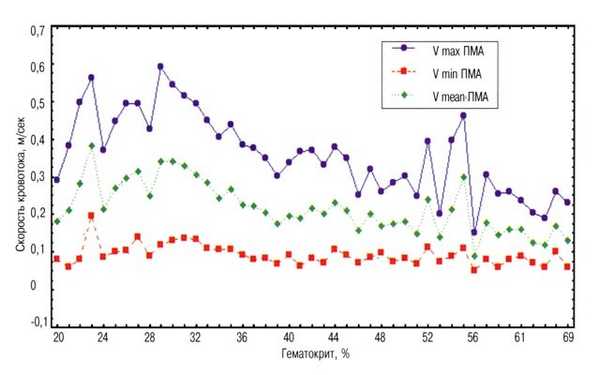
Рис. 2. Зависимость скоростей кровотока в передней мозговой артерии от величины гематокрита.
Результаты наших исследований показали, что у новорожденных детей с перинатальным гипоксическитравматическим поражением головного мозга после выхода их из критического состояния основными факторами, влияющими на показатели мозгового кровотока, были масса тела, гестационный и постнатальный возраст - так же, как и у здоровых новорожденных [3]. Это говорит о том, что нарушения мозгового кровотока без тяжелых органических изменений в головном мозге носят преходящий характер и быстро компенсируются.
Абсолютные скорости кровотока в крупных мозговых артериях растут с увеличением возраста и, в большей степени, массы тела ребенка. Индексы резистентности снижаются с увеличением гестационного возраста, т.е. у недоношенных детей, резистентность сосудов мозга в норме выше, чем у доношенных.
Сердечный выброс в обеих группах обследованных детей увеличивался с возрастанием массы тела, что также согласуется с литературными данными в отношении здоровых новорожденных [4, 5].
Обнаруженную нами положительную связь между сердечным выбросом и скоростями кровотока в передней мозговой и базиллярной артериях у недоношенных детей, на первый взгляд, можно объяснить влиянием на эти показатели массы тела. Известно, что связь между двумя физиологическими параметрами может быть не прямой, а опосредованной через третий показатель. Такое объяснение применимо к обнаруженной нами обратной связи между сердечными индексами и скоростями кровотока в мозговых артериях - с возрастанием массы происходит увеличение скоростей, но в меньшей степени, чем снижение значений сердечного выброса на килограмм веса, причем такое соотношение соблюдается в обеих группах обследованных детей.
У недоношенных детей имеется достоверная прямая зависимость абсолютных значений сердечного выброса и скоростей мозгового кровотока от массы тела. Однако такая же зависимость выявлена и у доношенных детей, но между собой показатели сердечного выброса и мозгового кровотока в этой группе не были связаны. Это означает, что зрелые новорожденные в стабильном состоянии уже со второй недели жизни обладают способностью поддерживать постоянство кровоснабжения мозга независимо от изменений центральной гемодинамики.
Н.С. Lou et al [6], обследуя доношенных и недоношенных новорожденных, находившихся в критическом состоянии (перенесших тяжелую асфиксию или имевших тяжелый синдром дыхательных расстройств), методом оценки клиренса радиоактивного ксенона, обнаружили у них прямую связь между мозговым кровотоком и изменениями артериального давления. Авторы назвали этот феномен нарушением ауторегуляции. Позже, с помощью допплерографического метода наличие такой же связи было установлено у глубоконедоношенных детей (с гестационным возрастом менее 31 недели и весом при рождении менее 1501 г) [7]. Из-за отсутствия регуляции мозговой кровоток пассивно следовал за изменениями артериального давления, увеличивая риск развития ишемических поражений при гипотензии и кровоизлияний при повышении артериального давления.
В нашем исследовании мы измеряли не артериальное давление, а непосредственно сердечный выброс у доношенных и недоношенных детей, находившихся в стабильном состоянии. Все обследованные дети живы и, более того, ни у одного ребенка с момента начала наблюдения не появилось новых патологических очагов ишемического или геморрагического генеза в головном мозге.
Мы полагаем, что выявленная нами зависимость мозгового кровотока от сердечного выброса у детей, родившихся ранее 34-й недели гестации, говорит не о тяжести состояния ребенка, а отражает морфологические особенности сосудистой системы мозга на этом этапе развития. К ним можно отнести значительную незрелость в количественном и качественном отношениях всех трех слоев стенок внутримозговых сосудов, а также наличие широких анастомозов между ветвями отдельных артерий и их связь с венами. После 30-32-й недель внутриутробного развития начинается регрессия артериальных анастомозов, бурный рост капиллярной сети, дифференцировка и созревание нервных окончаний и гладко-мышечных компонентов сосудистой стенки. Причем формирование внутримозговой ангиоархитектоники продолжается и у доношенных детей длительное время после рождения [8].
Результаты наших исследований еще раз подчеркивают необходимость максимально щадящей тактики выхаживания детей, родившихся недоношенными. Такое выхаживание должно включать в себя: придание удобного положения, поддержание стабильного уровня температуры тела (в кювезе или кроватке с подогревом), кормление через зонд (поскольку для незрелого ребенка даже акт сосания является серьезной физической нагрузкой), ограничение различных манипуляций, особенно связанных с болевыми ощущениями.
При обследовании новорожденных с перинатальным поражением головного мозга мы рекомендуем пользоваться не абсолютными значениями скоростей артериального кровотока ввиду их значительной вариабельности и зависимости от большого количества внешних факторов, а индексами резистентности, учитывая поправку на гестационный возраст. У недоношенных детей, особенно родившихся ранее 34-й недели гестации, также необходимо регулярно оценивать морфометрические и функциональные показатели сердца для раннего выявления отклонений, которые могут усугубить церебральную патологию.
Литература
УЗИ сканер HS50
Читайте также:
