РНК-вирусы как причина развития рака - вирусный канцерогенез
Добавил пользователь Morpheus Обновлено: 21.01.2026
В мире интенсивно идет разработка лекарств от онкозаболеваний на основе вирусов. В нашей стране такие работы ведутся в Новосибирском университете, ГНЦ «Вектор», Институте химической биологии и фундаментальной медицины СО РАН и Институте молекулярной биологии РАН. Нами получены рекомбинантные штаммы различных вирусов, показавшие перспективность их использования для уничтожения раковых клеток. Проблема сейчас в получении финансирования на доклинические исследования и клинические испытания.
Прогнозы писателей-фантастов редко сбываются буквально. Но с рассказом Игоря Росоховатского «Шутка госпожи природы» именно так и произошло. В нем бедняк излечился от рака, съев батат, зараженный вирусом батата, в то время как богач умирает, хотя его лечили самыми современными методами. Рассказ был опубликован в 1962 году. А в 2015 году Управление по контролю пищи и лекарств США (FDA) разрешило применение рекомбинантного герпесвируса для лечения рецидивирующей меланомы (рака кожи) и рекомбинантного ортопоксвируса для лечения опухолей печени.
Да, конечно, нынешние онколитические вирусы — не вирусы растений. Но мы видим начало сознательного использования вирусов против онкозаболеваний: к списку методов лечения рака официально добавился метод разрушения опухолей с помощью вирусов.
Сомнения и перестраховка
Метод нельзя назвать новым, потому что первая посвященная ему научная публикация появилась еще в 1904 году. В ней было описано использование так называемого «фиксированного» (ослабленного) штамма вируса бешенства для лечения онкобольных. Но широкого распространения метод не получил как из-за непредсказуемости результатов, так и весьма значительной реактогенности тогдашней вакцины против бешенства.
Тем не менее в течение всего ХХ века к этому методу неоднократно возвращались. В частности, начиная с 1950-х годов в разных странах применялись слабо- или вообще не патогенные штаммы вирусов лихорадки Западного Нила, желтой лихорадки, вируса бешенства, аденовирусы, вирус болезни Ньюкасла, энтеровирусы, парамиксовирусы и некоторые другие непатогенные или слабопатогенные вирусы. При этом порой онкобольные полностью выздоравливали, наблюдались и временные улучшения. Но опять же отсутствие предсказуемости результатов, научно обоснованных принципов действия вирусов на опухоли и предубеждение контролирующих органов привели почти к полному прекращению применения этого подхода.
Начиная с 1950-х годов в разных странах применялись слабо- или вообще не патогенные штаммы вирусов лихорадки Западного Нила, желтой лихорадки, вируса бешенства, аденовирусы, вирус болезни Ньюкасла, энтеровирусы, парамиксовирусы и некоторые другие непатогенные или слабопатогенные вирусы
У нас работы в данном направлении были начаты в 1970-х годах профессором М. К. Ворошиловой в Институте полиомиелита и вирусных энцефалитов под Москвой. Она применяла для лечения онкозаболеваний вакцинные штаммы вируса полиомиелита и другие штаммы непатогенных энтеровирусов и в ряде случаев добилась серьезных успехов. Но предубеждения руководящих онкологов привели к запрету ее работ.
И в нашей стране, и в ряде других стран недоверие к потенциально полезным противораковым вирусам до недавнего времени превалировало из-за боязни их патогенных свойств. При этом врачи хорошо знают, что многие химиотерапевтические препараты для борьбы с онкозаболеваниями дают массу вредных побочных реакций. Но их применяют, и никакого предубеждения у врачей к ним нет. Между тем механизм действия большинства таких препаратов рассчитан на разницу в метаболизме раковых и нормальных клеток. Так что поражают эти препараты и раковые, и некоторые здоровые, но активно метаболизирующие, делящиеся клетки.
Существующие на сегодня подходы к лечению онкозаболеваний
- Хирургическое удаление опухоли.
- Радиотерапия — направленное разрушение опухоли специально введенными в клетки радиоактивными препаратами или направленным лучевым воздействием.
- Химиотерапия — уничтожение опухолевых клеток специфичными к особенностям метаболизма опухолевых клеток химиопрепаратами.
- Терапия с помощью высокоспецифичных к опухолевым антигенам или к определенным клеточным белкам моноклональных антител, которые отличают клетки с этими маркерами от нормальных клеток, метят их собой и привлекают к ним клетки иммунной системы, которые благодаря этим меткам разрушают раковые клетки.
- Терапия с помощью антител, ингибирующих блокаторы иммунной системы (immune check-points). При этом выключаются «тормоза», не позволяющие иммунной системе бороться с опухолью, и начинает разворачиваться противоопухолевый иммунный ответ.
- Иммунотерапия с помощью своих же Т-клеток, активированных особым образом.
- Различные варианты лечения комбинациями упомянутых выше методов.
Первые официально испытанные вирусные онколитики
С 1990-х годов появилась теоретически намного более обоснованная концепция специальных онколитических вирусов. Впервые был выяснен, как тогда считали, механизм противораковой специфичности делеционного варианта аденовируса пятого серотипа с названием ONYX-015.
Дело в том, что в клетках человека и практически всех млекопитающих есть белок р53, который при начале каких-либо необычных процессов в клетке (в том числе при появлении в ней вирусов) запускает процесс апоптоза (запрограммированной клеточной смерти), чтобы не дать вирусу или вообще всей этой вдруг ставшей необычной клетке размножиться. Однако во многих опухолевых клетках ген белка р53 поврежден, а сам белок становится дефектным по этой своей функции, и в таких клетках ничто не сдерживает размножение вируса.
Но у аденовируса, в свою очередь, есть белок Е1В-55К, который связывает р53 и не дает ему запускать апоптоз. Таким образом, если из генома вируса удалить часть гена Е1В, где закодирован белок 55К, то такой вирус будет размножаться только в опухолевых клетках, где р53 и так не работает, а в нормальных он этого делать не сможет, так как клетки будут уходить в апоптоз и саморазрушаться.
Однако, как выяснилось позднее — в 2004 году, удаление части или целого гена E1B приводит к тому, что белок E1B-55K не выполняет еще ряд функций для размножения аденовируса. В опухолевых же клетках в его отсутствие эту функцию берет на себя не установленный до сих пор фактор. Также выяснилось, что есть много и других дефектов в клетках, которые приводят к их перерождению в раковые, и тогда такие аденовирусы не работают как лечебные препараты.
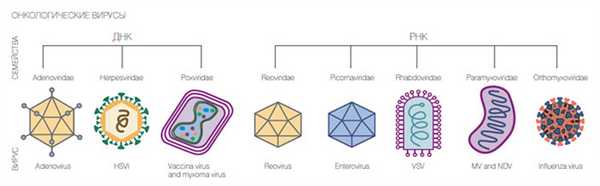
Известные на сегодня семейства вирусов, убивающих раковые клетки
В конце 1990-х эта тематика по ряду причин пошла на спад. Тем не менее аналог ONYX-015, названный Н101 (онкорин), был официально разрешен для лечения больных с опухолями головы и шеи в Китае. Другой полученный в Китае рекомбинантный аденовирус, также с делецией гена Е1В, но с дополнительной вставкой человеческого гена р53 сейчас там также применяется для лечения онкобольных под названием гендицин.
С 1998 по 2003 год в ГНЦ вирусологии и биотехнологии «Вектор» силами лаборатории автора этой статьи был получен вариант аденовируса пятого серотипа с полностью удаленным геном Е1В и частично геном Е1А. Препарат на его основе был назван канцеролизином, было показано, что он обладает сходными с американским штаммом ONYX-015 и китайским онкорином онколитическими свойствами.
Данный штамм был проведен через полный цикл доклинических испытаний под руководством профессора ГНЦ ВБ «Вектор» А. Н. Сергеева. На основе их результатов канцеролизин был допущен к клиническим испытаниям первой фазы, которые в 2007 году прошли в РОНЦ им. Н. Н. Блохина с участием восьми пациентов-добровольцев. Испытания показали хорошую переносимость пациентами канцеролизина, а в двух случаях наблюдался и лечебный эффект, несмотря на то что у всех больных добровольцев была четвертая стадия развития болезни. К сожалению, финансирования на последующие испытания выделено в те годы так и не было, а позднее это потеряло актуальность из-за публикаций по разработкам вирусных онколитиков следующих поколений.
Онколитические препараты на основе вирусов, которые разрабатываются и уже применяются
Канада: рекомбинантные аденовирусы и вирусы осповакцины.
Китай: препараты на основе рекомбинантных аденовирусов онкорин и гендицин.
Латвия: энтеровирусы.
Россия: рекомбинантные поксвирусы и аденовирусы, парамиксовирусы, энтеровирусы.
США: вирусы болезни Ньюкасла, природный и рекомбинантный вирус миксомы кроликов, рекомбинантный аттенуированный герпесвирус, рекомбинантные аттенуированные поксвирусы и аденовирусы, реовирус, вакцинный штамм вируса кори, рекомбинантный вирус везикулярного стоматита, вакцинные штаммы вирусов гриппа.
Финляндия: рекомбинантные аденовирусы.
Япония: рекомбинантные герпесвирусы.
Препараты нового поколения
В 2010 году Новосибирский государственный университет получил мегагрант на исследования под руководством известного российского молекулярного биолога П. М. Чумакова, одним из ведущих исполнителей которого стал и автор настоящей статьи. В НГУ фактически с нуля была создана хорошо оборудованная научно-исследовательская лаборатория в комплексе с практикумом по микробиологии, подготовлен и опубликован ряд обзорных статей по онколитическим вирусам, и еще в 2012 году были получены и охарактеризованы первые кандидатные онколитические штаммы.
К настоящему времени уже вне рамок мегагранта усилиями неформального коллектива из сотрудников НГУ, ГНЦ ВБ «Вектор» и ИХБФМ СО РАН получен ряд рекомбинантных штаммов вируса осповакцины с высокими онколитическими характеристиками, которые на моделях in vivo показали хорошую перспективность. Кроме того, были охарактеризованы и паспортизованы онколитические штаммы парамиксовируса Сендай и сконструированы бактериальные плазмиды с полноразмерным геномом аденовируса 6 серотипа, крайне перспективные для получения новых рекомбинантных онколитических штаммов со встройками усиливающих онколизис генов.
Таким образом, имеются все основания для проведения дальнейших работ и особенно — для полноразмерных доклинических исследований, а впоследствии и клинических испытаний этих и подобных им перспективных онколитических вирусных штаммов. Сейчас наступило время преодолеть предубеждения и дать зеленый свет для финансирования разработок этих крайне перспективных препаратов, разработанных в России.
Работы в этом направлении продолжаются не только в НГУ, профессор П. М. Чумаков развивает эти исследования на энтеровирусах и парамиксовирусах в своей лаборатории в Институте молекулярной биологии РАН им. В. А. Энгельгардта в Москве. Заинтересовались ими и в ряде клиник России.
Могут ли вирусы быть полезными
Данное направление работ за рубежом в последние десять лет получило очень мощное развитие. В октябре 2015 года в США произошел кардинальный сдвиг в отношении этого направления разработок: как уже было сказано, FDA разрешило широкие клинические испытания третьей фазы генно-инженерного штамма герпесвируса с названием имлиджик (Imlygic) для лечения больных с рецидивирующей меланомой.
Исходный штамм герпесвируса, который содержит аттенуирующие (снижающие его патогенные свойства) мутации в геноме и экспрессируемый ген гранулоцит-макрофаг-колониестимулирующего фактора человека (ГМ-КСФ или GM-CSF), был разработан американской компанией BioVex Inc. В 2011 году эту компанию вместе с правами на препарат купил фармгигант Amgen. Этот же препарат был официально разрешен к применению и в Европе в конце 2015 года, информация о нем регулярно обновляется на сайте Imlygic.
В том же 2015 году аналогичное разрешение на проведение третьей фазы клинических испытаний было получено для препарата на основе рекомбинантного штамма вируса осповакцины пекса-век (Pexa-Vec), или JX-594, в отношении лечения гепатоцеллюлярной карциномы (рака печени). Данный препарат сконструирован на основе исходного штамма вируса осповакцины Wyeth, у которого для уменьшения реактогенности удален ген тимидинкиназы и встроен ген ГМ-КСФ человека. Его сейчас интенсивно исследуют на добровольцах. Результаты нескольких независимых клинических испытаний первой и второй фазы уже известны, они положительны, и поэтому клинические испытания третьей фазы для этого препарата проходят уже в нескольких десятках стран в 86 больницах, что говорит о его большой перспективности.
На последнем, 17-м Международном конгрессе по вирусологии в Сингапуре онколитическим вирусам была посвящена пленарная лекция профессора Гранта Макфаддена из США и две секции: «Вирусы как троянские кони» и «Вирусы и рак». Так что интерес к этому направлению возрос колоссально, и финансируется оно, как никогда ранее, в Канаде, США, Японии, Финляндии и других странах.
В этой связи возникает вопрос: а не может ли быть такого, что роль по крайней мере некоторых из вирусов для человеческого организма как раз и состоит в защите от раковых клеток, и лишь иногда они вызывают заболевания, выходя из-под контроля?
Такое предположение заслуживает внимания. Человечество уже очень много полезного создало из весьма вредоносных, на первый взгляд, веществ и микробов. А вирусы как лекарства очень интересны, поскольку являются высокоспецифичными микромашинами. Некоторые из них люди уже приспособили для своих нужд и применяют в качестве живых вакцин, лечебных препаратов (например, бактериофаги — вирусы бактерий вместо антибиотиков) и для избирательной борьбы с вредными насекомыми.
Роль вирусов в канцерогенезе
Рак - бич человечества. По смертности он занимает второе место после сердечно-сосудистых заболеваний, по страху, который внушает людям - первое. Тысячи исследователей стремятся понять его причины, найти пути к его профилактике и лечению. Десятки институтов и сотни лабораторий во всем мире работают над этой проблемой, пытаясь достичь успеха в ее понимании и прогресса в профилактике и лечении этого заболевания.
Современной науке известны некоторые факторы, вызывающие развитие злокачественных опухолей и, вместе с тем, ученые вынуждены констатировать, что основная часть злокачественных опухолей возникает спонтанно, то есть без видимой связи с индуцирующими агентами. К факторам, способным вызывать развитие опухоли, относятся: различные канцерогенные вещества, наследственная предрасположенность, ионизирующее излучение и опухолеродные вирусы.
Вирусно-генетическая теория возникновения опухолей, предложенная еще в 40-х годах ХХ века Л.И. Зильбером, получила за прошедшие годы многочисленные подтверждения. В настоящее время, очевидно, что хотя вирусы и не являются единственной причиной рака, но они играют большую роль в возникновении злокачественных заболеваний как у человека, так и у животных. Характерной особенностью опухолевых заболеваний, ассоциированных с вирусами, является длительный латентный период, от момента инфекции до проявления заболевания могут пройти годы и даже десятилетия.
Согласно современным данным, этиологическими агентами около 15% опухолевых новообразований человека являются вирусы. К таким вирусам относятся: вирус Т-клеточного лейкоза/лимфомы (human T-leukemia/lymphoma virus), вирус иммунодефицита человека (ВИЧ), вирус папилломы человека (ВПЧ), вирусы гепатита В и С, вирус Эпштейна-Барр (ВЭБ) и другие. Важно отметить, что некоторые вирусы ассоциированы с опухолями только одной локализации, тогда как другие — с разными злокачественными новообразованиями, что, вероятно, обусловлено тропизмом вирусов к клеточным системам определенного типа.
Вирус Т-клеточного лейкоза/лимфомы (HTLV-1). HTLV-1 - это онкогенный вирус, способный вызывать Т-клеточный лейкоз/лимфому у взрослых, а также тропический спастический парапарез и ряд других неонкологических заболеваний.
Существуют 3 основных пути передачи инфекции от инфицированных лиц:
- с молоком матери;
- при половом контакте;
- с переливаемой кровью при гемотрансфузиях.
Основными методами диагностики вирусов гепатита В и С являются методы иммуноферментного анализа и полимеразной цепной реакции.
Вирус папилломы человека (ВПЧ, human papilloma virus). В середине 70-х гг. прошлого века было высказано предположение, что вирус папилломы человека является этиологическим агентом рака шейки матки, и эта область онкологии и вирусологии получила стремительное развитие. Действительно, к настоящему моменту роль ВПЧ в развитии рака шейки матки не вызывает сомнений. Многочисленные исследования доказали, что не менее 95% злокачественных опухолей шейки матки содержат разновидности ВПЧ, принадлежащие к так называемым типам "высокого онкогенного риска" (ВПЧ 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 типов). Среди них максимальной онкогенной активностью обладают ВПЧ 16 и 18 типов. Действительно, ВПЧ достаточно часто (примерно в 30% случаев) выявляется у абсолютно здоровых женщин. Однако не у всех женщин, зараженных вирусом папилломы человека, возникает дисплазия шейки матки и рак шейки матки. Примерно у 80% женщин иммунная система организма в течение 2 лет после инфицирования сама избавляется от вируса. Таким образом, носительство этих вирусов свидетельствует не о злокачественном процессе как таковом, а о многократно повышенном риске его возникновения.
Диагностика ВПЧ-инфекции обладает очень высокой клинической значимостью. Она позволяет выявить тех пациенток, для которых жизненно необходимы активные, комплексные меры, направленные на профилактику и раннюю диагностику рака шейки матки. Самым надежным диагностическим тестом по выявлению всех 12 онкогенных типов вируса папилломы человека в настоящее время является метод полимеразной цепной реакции в режиме реального времени.
Вирус Эпштейна-Барр (ВЭБ). Известен широкий спектр патологических состояний, представленный опухолями лимфоидного и эпителиального происхождения, в возникновении которых ВЭБ принимает непосредственное участие. Доказано, что этот вирус причастен к возникновению не только лимфомы Беркитта, но и ряда других злокачественных и доброкачественных новообразований, таких, как рак носоглотки, лимфома Ходжкина, инфекционный мононуклеоз и многие другие.
Согласно некоторым исследованиям, ВЭБ широко циркулирует среди населения, о чем свидетельствует высокий процент людей, имеющих в крови антитела к ВЭБ - 50% детей и 85% взрослых. Но поскольку инфекция, как правило, протекает бессимптомно, сложилось ошибочное мнение о невысокой заболеваемости ВЭБ-инфекцией.
Вирус герпеса человека 8 типа (HHV-8). В настоящее время считается доказанной его роль в возникновении саркомы Капоши, выпотной лимфомы полостей тела и болезни Кастельмана. В геноме HHV-8 содержится ряд генов, продукты которых играют важную роль в регуляции размножения и жизнеспособности клеток; повышение их активности приводит к возникновению опухоли.
Следует понимать, что HHV-8 является всего лишь фактором риска развития вышеуказанных заболеваний. Если человек инфицирован HHV-8, то это не означает, что у него обязательно разовьётся саркома Капоши или лимфома.
Сам по себе вирус герпеса 8 типа опасности для здорового человека практически не представляет. Большинство людей с нормальным иммунитетом, инфицированных этим вирусом, не отмечают каких-либо проявлений, и он не оказывает на них никакого вредного влияния.
Свое негативное действие HHV-8 может проявить только в случае стойкого снижения иммунитета (иммунодепрессии), и то лишь у больных СПИДом (зараженных вирусом ВИЧ) или при длительном лечении, снижающем иммунитет (после пересадки органов и тканей, лучевой терапии). По данным статистики у 45% людей, имеющих HHV-8 и ВИЧ в течение 10 лет развилась саркома Капоши. У людей с нормальным иммунитетом вирус герпеса человека никак себя не проявляет. Он не влияет на состояние здоровья.
Таким образом, несмотря на различную организацию онкогенных вирусов человека они обладают рядом общих биологических свойств, а именно:
- вирусы лишь инициируют патологический процесс, усиливая процессы деления клеток и генетическую нестабильность инфицированных ими клеток;
- у инфицированных онкогенными вирусами лиц возникновение опухоли, как правило, событие нечастое: один случай новообразования возникает среди сотен, иногда тысяч инфицированных;
- от момента инфицирования до возникновения опухоли имеет место продолжительный латентный период, длящийся годами, иногда десятилетиями;
- у большинства инфицированных лиц возникновение опухоли не является обязательным, но они могут составить группу риска, с более высокой вероятностью ее возникновения;
- для злокачественной трансформации инфицированных клеток необходимы дополнительные факторы и условия, приводящие к прогрессированию наиболее агрессивного опухолевого клона.
Такими дополнительными факторами, играющими роль сопутствующих канцерогенов, могут быть: злоупотребление алкоголем, табакокурение, коинфекция генитальным герпесом, малярия, нитрозамины в продуктах питания, пестициды.
На сегодняшний день основными методами лабораторной диагностики являются метод иммуноферментного анализа (ИФА) и метод полимеразной цепной реакции (ПЦР). Первый позволяет выявить белок вируса либо антитела к нему, которые выделяет организм в ответ на инфицирование. При помощи метода ПЦР мы можем выявить генетический материал самого вируса.
Метод иммуноферментного анализа является стандартным методом лабораторной диагностики.
Следует также отметить, что не всегда возможно определение вирусных белков в плазме крови. В таких случаях методом ИФА можно диагностировать только наличие антител в плазме крови пациента. Однако, важно помнить, что антитела могут вырабатываться в довольно длительный срок. Так, например, при инфицировании ВИЧ антитела вырабатываются в течение 6 месяцев, в случае гепатита С этот период может длиться до года, а антитела к вирусу Эпштейна-Барр (иммуноглобулины класса G) присутствуют у большого количества практически здоровых людей и их диагностика обладает низкой прогностической значимостью.
Полимеразная цепная реакция (ПЦР) — метод молекулярной биологии, позволяющий обнаружить возбудителя заболевания на основе его генетической информации.
ПЦР диагностика дает возможность существенно ускорить и облегчить диагностику различных заболеваний, в частности, вирусов гепатита В, С, D, цитомегаловирусной инфекции, вируса Эпштейна-Барр, вируса простого герпеса, а также хламидиоза, микоплазмоза, уреаплазмоза и т.п. При помощи данного метода вирусные инфекции можно обнаружить уже через 5-7 дней после заражения, за недели или месяцы до того, как появятся антитела или первые симптомы. Метод ПЦР позволяет выявить даже единичные клетки возбудителя, благодаря многократному увеличению последовательностей ДНК.
Полимеразная цепная реакция - это один из самых точных методов лабораторной диагностики. Его чувствительность составляет 95-99%, а специфичность достигает 100%.
Таким образом, достижения науки в области онкологии внесли определенную ясность в понимание механизмов возникновения некоторых злокачественных новообразований и все же большую часть из них не удается увязать с инфицированностью тем или иным вирусом, что создает большое поле деятельности современным онкологам в направлении дальнейшего изучения механизмов развития онкологических заболеваний.
Все вышеуказанные методы диагностики существуют у нас в РНПЦ онкологии и медицинской онкологии им. Н.Н.Александрова. В лаборатории клинической молекулярной генетики и иммунологических методов диагностики можно пройти обследование на вирусы герпеса,цитомегаловируса, Эпштена-Барра, вирусы гепатита В и С, а также пройти обследование на инфицирование вирусом папилломы человека, данные исследования может пройти любой человек обратившийся в центр.
Вирусологические исследования
Рак - бич человечества. По смертности он занимает второе место после сердечно-сосудистых заболеваний, по страху, который внушает людям - первое. Тысячи исследователей стремятся понять его причины, найти пути к его профилактике и лечению.
ГУ «Республиканский научно-практический центр онкологии и медицинской радиологии им. Н.Н. Александрова», Минск, Беларусь
В.А. Матусевич, И.В. Стукалова
Десятки институтов и сотни лабораторий во всем мире работают над этой проблемой, пытаясь достичь успеха в ее понимании и прогресса в профилактике и лечении этого заболевания.
Современной науке известны некоторые факторы, вызывающие развитие злокачественных опухолей и, вместе с тем, ученые вынуждены констатировать, что основная часть злокачественных опухолей возникает спонтанно, то есть без видимой связи с индуцирующими агентами.
К факторам, способным вызывать развитие опухоли, относятся:
- различные канцерогенные вещества,
- наследственная предрасположенность,
- ионизирующее излучение
- опухолеродные вирусы.
Вирусно-генетическая теория возникновения опухолей
Вирусно-генетическая теория возникновения опухолей, предложенная еще в 40-х годах ХХ века Л.И. Зильбером, получила за прошедшие годы многочисленные подтверждения.
В настоящее время, очевидно, что хотя вирусы и не являются единственной причиной рака, но они играют большую роль в возникновении злокачественных заболеваний как у человека, так и у животных. Характерной особенностью опухолевых заболеваний, ассоциированных с вирусами, является длительный латентный период, от момента инфекции до проявления заболевания могут пройти годы и даже десятилетия.
Согласно современным данным, этиологическими агентами около 15% опухолевых новообразований человека являются вирусы.
К таким вирусам относятся:
- вирус Т-клеточного лейкоза/лимфомы (human T-leukemia/lymphoma virus),
- вирус иммунодефицита человека (ВИЧ),
- вирус папилломы человека (ВПЧ),
- вирусы гепатита В и С,
- вирус Эпштейна-Барр (ВЭБ)
- и другие.
Важно отметить, что некоторые вирусы ассоциированы с опухолями только одной локализации, тогда как другие — с разными злокачественными новообразованиями, что, вероятно, обусловлено тропизмом вирусов к клеточным системам определенного типа.
Вирус Т-клеточного лейкоза/лимфомы (HTLV-1)
- с молоком матери;
- при половом контакте;
- с переливаемой кровью при гемотрансфузиях.
Вирусы гепатита В и С (Hepatitis B virus и Hepatitis C virus, HBV/HCV)
Смертность от рака печени на планете среди всех смертностей от онкологических заболеваний занимает 3-е место после смертности от рака легкого и желудка. При этом каждая пятая диагностируемая в мире опухоль - это рак печени.
Вирус папилломы человека
В середине 70-х гг. прошлого века было высказано предположение, что вирус папилломы человека является этиологическим агентом рака шейки матки, и эта область онкологии и вирусологии получила стремительное развитие.
Действительно, к настоящему моменту роль ВПЧ в развитии рака шейки матки не вызывает сомнений.
Многочисленные исследования доказали, что не менее 95% злокачественных опухолей шейки матки содержат разновидности ВПЧ, принадлежащие к так называемым типам "высокого онкогенного риска" (ВПЧ 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 типов).
Среди них максимальной онкогенной активностью обладают ВПЧ 16 и 18 типов. Действительно, ВПЧ достаточно часто (примерно в 30% случаев) выявляется у абсолютно здоровых женщин.
Однако не у всех женщин, зараженных вирусом папилломы человека, возникает дисплазия шейки матки и рак шейки матки. Примерно у 80% женщин иммунная система организма в течение 2 лет после инфицирования сама избавляется от вируса.
Таким образом, носительство этих вирусов свидетельствует не о злокачественном процессе как таковом, а о многократно повышенном риске его возникновения.
Вирус Эпштейна-Барр (ВЭБ)
Известен широкий спектр патологических состояний, представленный опухолями лимфоидного и эпителиального происхождения, в возникновении которых ВЭБ принимает непосредственное участие. Доказано, что этот вирус причастен к возникновению не только лимфомы Беркитта, но и ряда других злокачественных и доброкачественных новообразований, таких, как рак носоглотки, лимфома Ходжкина, инфекционный мононуклеоз и многие другие.
Согласно некоторым исследованиям, ВЭБ широко циркулирует среди населения, о чем свидетельствует высокий процент людей, имеющих в крови антитела к ВЭБ 50% детей и 85% взрослых. Но поскольку инфекция, как правило, протекает бессимптомно, сложилось ошибочное мнение о невысокой заболеваемости ВЭБ-инфекцией.
Вирус герпеса человека 8 типа (HHV-8)
В настоящее время считается доказанной его роль в возникновении саркомы Капоши, выпотной лимфомы полостей тела и болезни Кастельмана. В геноме HHV-8 содержится ряд генов, продукты которых играют важную роль в регуляции размножения и жизнеспособности клеток; повышение их активности приводит к возникновению опухоли.
Свое негативное действие HHV-8 может проявить только в случае стойкого снижения иммунитета (иммунодепрессии), и то лишь у больных СПИДом (зараженных вирусом ВИЧ) или при длительном лечении, снижающем иммунитет (после пересадки органов и тканей, лучевой терапии).
По данным статистики у 45% людей, имеющих HHV-8 и ВИЧ в течение 10 лет развилась саркома Капоши. У людей с нормальным иммунитетом вирус герпеса человека никак себя не проявляет. Он не влияет на состояние здоровья.
Вирус иммунодефицита человека (ВИЧ)
ВИЧ может создавать необходимые условия (иммунодефицит) для возникновения рака. Этот вирус был открыт в 1983 г. и его ассоциация с синдромом приобретенного иммунодефицита (СПИД) доказана в 1984 г.
Чаще всего у таких больных диагностируют саркому Капоши либо одну из разновидностей неходжкинских лимфом.
Биологические свойства онкогенных вирусов
Несмотря на различную организацию онкогенных вирусов человека они обладают рядом общих биологических свойств, а именно:
Основные методы диагностики
На сегодняшний день основными методами лабораторной диагностики являются метод иммуноферментного анализа (ИФА) и метод полимеразной цепной реакции (ПЦР).
Первый позволяет выявить белок вируса либо антитела к нему, которые выделяет организм в ответ на инфицирование. При помощи метода ПЦР мы можем выявить генетический материал самого вируса.
Метод иммуноферментного анализа
Следует также отметить, что не всегда возможно определение вирусных белков в плазме крови. В таких случаях методом ИФА можно диагностировать только наличие антител в плазме крови пациента. Однако, важно помнить, что антитела могут вырабатываться в довольно длительный срок.
Так, например, при инфицировании ВИЧ антитела вырабатываются в течение 6 месяцев, в случае гепатита С этот период может длиться до года, а антитела к вирусу Эпштейна-Барр (иммуноглобулины класса G) присутствуют у большого количества практически здоровых людей и их диагностика обладает низкой прогностической значимостью.
Полимеразная цепная реакция (ПЦР)
ПЦР диагностика дает возможность существенно ускорить и облегчить диагностику различных заболеваний, в частности, вирусов гепатита В, С, D, цитомегаловирусной инфекции, вируса Эпштейна-Барр, вируса простого герпеса, а также хламидиоза, микоплазмоза, уреаплазмоза и т.п.
При помощи данного метода вирусные инфекции можно обнаружить уже через 5-7 дней после заражения, за недели или месяцы до того, как появятся антитела или первые симптомы. Метод ПЦР позволяет выявить даже единичные клетки возбудителя, благодаря многократному увеличению последовательностей ДНК.
Полимеразная цепная реакция это один из самых точных методов лабораторной диагностики. Его чувствительность составляет 95-99%, а специфичность достигает 100%.
Достижения науки в области онкологии
Все вышеуказанные методы диагностики существуют у нас в РНПЦ онкологии и медицинской онкологии им. Н.Н.Александрова.
В лаборатории клинической молекулярной генетики и иммунологических методов диагностики можно пройти обследование на вирусы герпеса,цитомегаловируса, Эпштена-Барра, вирусы гепатита В и С, а также пройти обследование на инфицирование вирусом папилломы человека, данные исследования может пройти любой человек обратившийся в центр.
Вирусно-генетическая теория происхождения опухолей

Вирус - фактор генетического воздействия, наделяющий клетку способностью к безграничному размножению.

Изучение этиологии онкологических заболеваний длится уже много десятилетий. В результате этих исследований были обнаружены онкогенные вирусы. Их роль в возникновении онкологических заболеваний была продемонстрирована на многих моделях: саркоме Рауса у кур, папилломе и раке кожи у кроликов, лимфоме у цыплят. Однако еще в прежние времена у всех исследователей возникал вопрос: куда исчезает вирус после злокачественного перерождения клетки?. Ни один метод не мог его обнаружить в раковой клетке.
Противоречие удалось объяснить русскому ученому Л.А. Зильберу - создателю вирусно-генетической теории происхождения злокачественных опухолей.
Для трансформации нормальной клетки в опухолевую необходимо взаимодействие генома вируса и клетки, в результате которого образуется новый комплексный геном и вирус "исчезает" из клетки, оставаясь в ее ядре в виде провируса. Было выявлено, что процесс злокачественного перерождения зависит как от вируса, так и от клетки-хозяина.
Благодаря развитию молекулярной биологии установлено, что в нормальных клетках существует семейство генов- протоонкогенов. Эти гены необходимы для регуляции и размножения клеток. Их продуктами являются различные протеокиназы и факторы транскрипции. Различные внешние факторы могут воздействовать на протоонкоген клетки и вызывать его превращение в онкоген. Под их влиянием включается генетический механизм перерождения нормальной клетки в злокачественную.
Одним из факторов генетического воздействия на геном клетки могут быть вирусы, которые могут содержать (onc+) или не содержать онкоген (onc-). Вирус onc+, интегрируясь в хромосому клетки, одновременно вносит в нее онкоген со всеми вытекающими последствиями для клетки. Онкоген вируса, соединившись с хромосомой клетки, наделяет ее способностью к безграничному размножению.
Вирус onc-, проникнув в клетку на первом этапе взаимодействия генома с геном клетки-хозяина, не вызывает ее трансформации. Однако развитие событий зависит от локализации этого контакта. Если вирус onc- интегрируется в хромосому рядом с одним из протоонкогенов, он подчиняет его работу своему промотору. Выходя из хромосомы, вирусный геном захватывает с собой протоонкоген, который становится его составной частью и превращает вирус onc- в вирус onc+. Клеточный онкоген выходит из-под контроля материнской клетки. Интегрируясь в хромосому другой клетки, вновь образованный вирус onc+ одновременно вносит в нее онкоген и активирует трансформацию клетки в злокачественную.
В дальнейшем оказалось, что онкогенез вирусов зависит от реакции клетки. Гены p53 и Rb кодируют опухоль-супрессирующие белки. Ген р53 является супрессором опухолевого роста. В результате его деятельности происходить ограничение размножения клеток. Rb- ген кодирует белок, контролирующий клеточную пролиферацию. В результате его деятельности замедляется клеточная пролиферация.
Против вирусно-генетической теории может свидетельствовать наличие онкогенных свойств не только у ДНК-содержащих, но и у РНК-содержащих вирусов, что исключает включение РНК-генома вируса в ДНК-геном клетки хозяина. Однако это противоречие было устранено после открытия РНК-зависимой ДНК-полимеразы, которая на базе вирионных РНК синтезирует ДНК-копию, способную к интеграции с ДНК-геномом клетки. Механизм онкогенеза реализуется в результате активации протоонкогена включением в геном клетки ДНК- провируса. Роль вируса в злокачественном перерождении клеток сводится к пусковому механизму онкогенеза.
Основным направлением деятельности онкологическом отделении (вирусологии) является проведение молекулярно-биологических исследований с использованием метода полимеразной цепной реакции (ПЦР) в режиме реального времени и иммуноферментного анализа для выявления вирусного и бактериального инфицирования.
Диагностика вирусных и бактериальных инфекций позволяет:
- Выявить вирусное и бактериальное инфицирование на ранней стадии;
- Провести эффективное лечение на раннем этапе;
- Осуществлять мониторинг проводимого лечения;
- Оценивать эффективность проведённого лечения.
Вирусный канцерогенез

Молекулярно-генетические исследования с использованием методов полимеразной цепной реакции (ПЦР), позволяют диагностировать ДНК/РНК вирусных и бактериальных агентов, которые имеют немаловажное значение в преобразовании нормальной клетки в злокачественную.
Внедрение опухолеродного вируса в геном клетки, приводящее к нарушению контроля клеточного деления, является одним из инициирующих шагов многоступенчатого процесса канцерогенеза. При этом заражение онкогенным вирусом не означает однозначно, что в последующем образуется злокачественная опухоль, но сформируется вероятность ее появления.
В настоящее время можно считать установленным, что на долю опухолей, ассоциированных с вирусами, приходится около 20% всех опухолей человека. Онкогенные вирусы, принадлежащие к разным семействам, используют во многом сходную стратегию для инициации канцерогенеза.
Среди этих общих свойств можно назвать нарушения работы клеточных сигнальных путей, контролирующих пролиферацию, дифференцировку, целостность генома, миграцию клеток, апоптоз, иммунный ответ.
Механизмы реализации онкогенного потенциала вирусов включают:
- взаимодействие вирусных белков с клеточными белками - компонентами сигнальных путей;
- встраивание генома вируса в геном клетки (интеграция);
- влияние на эпигенетические механизмы регуляции экспрессии генов.
Исследования последних лет позволяют предположить, что все онкогенные вирусы успешно используют ограничение транскрипции своих генов, накладываемые метилированием ДНК, репрессивными модификациями гистонов и клеточными микроРНК, для ухода от иммунологического контроля, что способствует персистенции вирусного генома в клетке хозяина.
В настоящее время выявлено несколько групп вирусов, предрасполагающих к развитию опухолей у человека.
Опухоли человека, ассоциированные с вирусами
| Вирус | Опухоль |
|---|---|
| Вирусы папиллом (HPV) типов 3, 6, 11, 32, 72, 73 | Доброкачественные: папилломы, кондиломы кожи и слизистых |
| Вирусы папиллом (HPV) типов 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 70 | Злокачественные: рак шейки матки, рак анального канала |
| Вирус гепатита В (HBV) | Первичный рак печени |
| Вирус гепатита С (HСV) | Первичный рак печени |
| Вирус Т-клеточной лейкемии человека (HTLV-1) | Т-клеточный лейкоз у взрослых |
| Вирусы герпеса: вирус Эпштейна-Барр (EBV) вирус герпеса 8 типа (HSV-8) | Лимфомы, рак носоглотки, рак желудка Саркома Капоши (на фоне иммуносупрессии) |
Рак шейки матки (РШМ)
Рак шейки матки (РШМ) - одно из наиболее распространенных онкологических заболеваний, занимающее второе место по частоте встречаемости среди женщин в мире. Ежегодно регистрируется около 600 тыс. новых случаев РШМ и свыше 95% РШМ ассоциировано с вирусами папилломы человека (HPV) высокого онкогенного риска.
Эпидемиологические исследования показали, что заболевание могут вызывать 18 типов вируса, из которых наиболее часто (в 94 % случаев) встречаются двенадцать: 16, 18, 31, 33, 35, 39, 45, 52, 56, 58, 59, 66.
Инфицированность HPV достаточно высока: геном вируса определяется у 46% женщин и 33% мужчин. Максимальный риск заражения отмечен в возрасте от 16 до 25 лет. Однако не у всех женщин развиваются дисплазия и рак шейки матки - примерно у 80% иммунная система организма в течение 2 лет после инфицирования сама избавляется от вируса. Таким образом, носительство этих вирусов свидетельствует не о злокачественном процессе как таковом, а многократном повышении риска его возникновения. Диагностика HPV-инфекции необходима для отбора пациенток, которым показано проведение комплексных мероприятий, направленных на профилактику и раннюю диагностику рака шейки матки.
Заболеваемость раком анального канала также тесно связано с инфицированием HPV - геном вируса определяется в 80-85% случаев.
В настоящее время доказано участие и других вирусных агентов (вирусов гепатита В и С, вируса Т-клеточной лейкемии человека, вируса Эпштейна-Барр, вируса герпеса 8 типа) в развитии злокачественных опухолей различных локализаций.
Вирусные гепатиты
Инфицирование вирусными гепатитами ведет к увеличению риска развития первичного рака печени. Во всем мире хронические вирусные гепатиты В и С, зачастую имея бессимптомное течение, являются самыми значимыми факторами риска развития цирроза и рака печени.
Своевременная диагностика вирусных гепатитов позволяет не только выявить заболевание на ранней стадии, тем самым предотвратив возникновение осложнений, но и исключить возможное инфицирование окружающих Вас людей. Кроме печени вирусы гепатитов способны поражать лимфатическую ткань, вызывая развитие неходжкинских лимфом, селезенку, почки, слюнные железы и др.
Читайте также:
