Роль супероксиддисмутазы при отравлении кислородом. Образование антиокислительных ферментов
Добавил пользователь Алексей Ф. Обновлено: 01.02.2026
Супероксиддисмутаза - металлопротеин, состоящий из двух идентичных субъединиц, каждая из которых содержит по одному иону меди и цинка. Синтезирован штаммом дрожжей Saccharomyces cerevisiae Y2134, в генетический аппарат которых встроен ген Cu, Zn - супероксиддисмутазы человека.
Супероксиддисмутаза является эндогенным акцептором свободных кислородных радикалов, избыточное накопление которых в клетке играет важную роль, в развитии кислород-зависимых патологических процессов (гипоксия, воспаление, интоксикация). Супероксиддисмутаза катализирует реакцию дисмутации супероксидных радикалов и предотвращает образование других, более опасных для организма радикалов: гидроксильного радикала и синглетного кислорода. Кроме того, супероксиддисмутаза предотвращает накопление в очаге воспаления нейтрофилов, которые секретируют значительные количества лизосомальных ферментов, разрушающих близлежащие ткани; нормализует протекающие с участием свободных радикалов кислорода окислительные процессы и предупреждает окислительную модификацию белков, а также связанное с активацией перекисного окисления липидов разрушение биомембран клеток.
Фармакокинетика
При местном применении через 1 ч после введения терапевтические концентрации присутствуют в роговице и конъюнктиве, а также в сетчатке и зрительном нерве.
При в/в введении динамика его концентрации в крови соответствует двухкамерной модели. T 1/2 составляет 30+4 мин. Отношение стационарного и начального V d составляет порядка 2, т.е. хорошо распределяется в ткани.
Показания активного вещества СУПЕРОКСИДДИСМУТАЗА
При местном применении
Первичная открытоугольная глаукома; аденовирусное поражение глаз; вторичная кератопатия.
В составе комплексной профилактики развития интраоперационных осложнений при эндопротезировании крупных суставов с использованием костного цемента.
Открыть список кодов МКБ-10| Код МКБ-10 | Показание |
| B30.1 | Конъюнктивит, вызванный аденовирусом (H13.1*) |
| H13.1 | Острый конъюнктивит при болезнях, классифицированных в других рубриках |
| H18.8 | Другие уточненные болезни роговицы |
| H40.1 | Первичная открытоугольная глаукома |
| Z51.4 | Подготовительные процедуры для последующего лечения или обследования, не классифицированные в других рубриках |
Режим дозирования
При местном применении в конъюнктивальный мешок. При первичной открытоугольной глаукоме закапывают по 2 разовые дозы через каждые 5 мин в течение 30 мин 2 раза/сут (утром и вечером). Курс лечения - не менее 10 дней.
При вторичных кератопатиях по 2 разовые дозы 5-8 раз/сут; курс - 3-7 дней.
При аденовирусных поражениях глаз : по 2 разовые дозы 6-8 раз/сут с интервалом 1-2 ч; курс лечения - не менее 10 дней.
В/в, во время операции, в течение 10-15 минут непосредственно перед использованием костного цемента.
Побочное действие
Местные реакции: возможно чувство сухости глаз, покраснение, ощущение инородного тела, которое проходит по окончании курса лечения; в отдельных случаях - аллергические реакции.
Системные реакции: анафилактические реакции (в т.ч. шок).
Противопоказания к применению
Возраст до 18 лет; беременность; период лактации (грудное вскармливание).
Применение при беременности и кормлении грудью
Применение противопоказано при беременности и в период грудного вскармливания.
Применение у детей
Особые указания
При местном применении на время лечения рекомендуется отказаться от ношения контактных линз.
Влияние на способность к управлению транспортными средствами и механизмами
Не влияет на способность к управлению транспортными средствами.
Информация о препаратах, отпускаемых по рецепту, размещенная на сайте, предназначена только для специалистов. Информация, содержащаяся на сайте, не должна использоваться пациентами для принятия самостоятельного решения о применении представленных лекарственных препаратов и не может служить заменой очной консультации врача.
Свидетельство о регистрации средства массовой информации Эл № ФС77-79153 выдано Федеральной службой по надзору в сфере связи, информационных технологий и массовых коммуникаций (Роскомнадзор) 15 сентября 2020 года.
Роль супероксиддисмутазы при отравлении кислородом. Образование антиокислительных ферментов
Исследование, направленное на определение фермента суперокиддисмутазы для оценки функционирования антиоксидантной системы защиты органов и тканей человека.
Синонимы русские
СОД, антиоксидантные ферменты, антиоксидант.
Синонимы английские
Superoxide dismutase, SOD.
Единицы измерения
Ед/мл (единица на миллилитр).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
- Детям в возрасте до 1 года не принимать пищу в течение 30-40 минут до исследования.
- Не принимать пищу в течение 2-3 часов до исследования, можно пить чистую негазированную воду.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Супероксиддисмутаза (СОД) - это фермент, входящий в систему антиоксидантной защиты организма человека. Он катализирует процесс дисмутации (диспропорционирования) супероксидного радикала в пероксид водорода и молекулярный кислород. Пероксид водорода далее под действием каталазы и глутатионпероксидазы превращается в воду и молекулярный кислород. Супероксидный радикал вырабатывается в процессе окислительных энергетических реакций и является продуктом одноэлектронного восстановления молекулярного кислорода. Он продуцируется практически во всех клетках, потребляющих кислород, может воздействовать на все компоненты клеток и межклеточного вещества, а также служит предшественником более токсичного гидроксильного радикала.
Фермент СОД присутствует во всех клетках, потребляющих кислород, и участвует в поддержании баланса концентрации супероксидных радикалов для нормального функционирования клеток в кислородной среде. Известно несколько форм супероксиддисмутазы, содержащихся в эукариотических клетках: СОД, содержащая в активном центре комплекс медь/цинк, и СОД, содержащая марганец. В организме человека различают три типа СОД: СОД-1, содержащаяся в цитоплазме клеток, СОД-2, входящая в состав митохондрий, и СОД-3 - во внеклеточном матриксе. При повышении содержания патологичных активных форм кислорода увеличивается активность СОД. Активные формы кислорода могут разрушительно воздействовать на белки, липиды, нуклеиновые кислоты и другие компоненты клеток, а также на составляющие соединительных тканей, в частности гиалуроновую кислоту. При этом происходит повреждение эритроцитов, кардиомиоцитов, гепатоцитов, клеток поджелудочной железы, бронхолегочной системы и ряда других.
Повышение активности СОД отмечается при анемии, в частности гемолитической, ишемии миокарда при острых и хронических заболеваниях сердца. Увеличение продукции фермента нарастает при ряде воспалительных заболеваний: гепатите, панкреатите, цистите, бурсите, артрите, колите. Активность фермента нарастает преимущественно в начальный период патологических процессов. Впоследствии в стадии декомпенсации активность СОД начинает снижаться. Также снижение активности фермента отмечается при острой печеночной недостаточности, у лиц с патологией иммунной системы, в частности при иммунодефицитах и аутоиммунных заболеваниях.
Определение активности СОД также рекомендуется у пациентов с атеросклерозом, сахарным диабетом, кардиомиопатиями, артериальной гипертензией, неврологическими (амиотрофический склероз, ишемический инсульт) и психиатрическими заболеваниями, при сепсисе. Значительное повышение СОД отмечается при онкологических заболеваниях крови, при сепсисе. В некоторых случаях, например при неспецифическом язвенном колите, проводится оценка тяжести и активности заболевания в зависимости от ферментативной активности СОД.
Для чего используется исследование?
- Оценка активности фермента СОД для выявления нарушения работы антиоксидантной системы защиты органов и тканей.
- Оценка антиоксидантных систем организма человека в комплексе с другими показателями (витамины, микроэлементы, антиоксидантные системы).
- Оценка активности фермента СОД при анемиях, ишемических заболеваниях сердца, головного мозга, атеросклерозе, сахарном диабете.
- Оценка активности фермента СОД при воспалительных заболеваниях: гепатите, нефрите, цистите, панкреатите, артритах и ряде других.
- Оценка активности фермента СОД при неврологических и психиатрических заболеваниях.
- Оценка активности фермента СОД при сепсисе, респираторном дистресс-синдроме.
Когда назначается исследование?
- Оценка эффективности работы антиоксидантных систем организма.
- Комплексная оценка антиоксидантного статуса, включающего определение активности фермента СОД, других ферментных систем, микроэлементов, витаминов.
- При симптомах анемий, ишемических заболеваний сердца и головного мозга, при воспалительных заболеваниях, неврологических и психических заболеваниях.
Что означают результаты?
Референсные значения: 164 - 240 ед/мл.
- гемолитическая анемия;
- сердечно-сосудистые заболевания (острый инфаркт миокарда, артериальная гипертензия, кардиомиопатии);
- ишемический инсульт;
- сахарный диабет;
- атеросклероз;
- гепатит;
- заболевания почек (нефриты, нефропатии);
- сепсис;
- полиартриты;
- воспалительные заболевания кишечника, в частности колиты;
- неврологические и психиатрические заболевания.
- острая печеночная недостаточность;
- патология иммунной системы (иммунодефицитные состояния, аутоиммунные заболевания);
- патологические процессы в стадии декомпенсации.
Важные замечания
Активность фермента супероксиддисмутазы преимущественно нарастает в начальный, острый период патологических процессов. Впоследствии в стадии декомпенсации может отмечаться снижение активности фермента.
Также рекомендуется
06-242 Витамины и микроэлементы, участвующие в регуляции антиоксидантной системы (Fe, Cu, Zn, Se, S, Co, Mn, Mg, витамины A, C, E, K, B2, B5, B6, омега-3, омега-6 жирные кислоты)
Кто назначает исследование?
Терапевт, врач общей практики, гематолог, эндокринолог, гастроэнтеролог, невролог, нефролог, ревматолог, хирург.
Комплексный анализ основных витаминов и микроэлементов, необходимых для нормального функционирования антиоксидантной системы организма.
Antioxidant vitamins and trace elements.
Метод исследования
Высокоэффективная жидкостная хроматография.
- Не принимать пищу в течение 8 часов до исследования, можно пить чистую негазированную воду.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Биохимические процессы, происходящие в организме человека, сопровождаются образованием соединений, обладающих свойствами окислителей (прооксидантов). Наиболее выраженными окислительными свойствами обладают активные формы кислорода (ионы кислорода, перекиси и свободные радикалы). Прооксиданты в норме выполняют ряд важных функций, таких как обеспечение врождённого и приобретенного иммунитета, процесс передачи сигнала в клетке, регуляция диаметра артериальных сосудов, поступление глюкозы в мышечную ткань и многие другие. С другой стороны, прооксиданты способны модифицировать структуру липидов, белков и нуклеиновых кислот, что может приводить к неблагоприятным последствиям. Так, в последнее время появились данные о роли прооксидантов в возникновении ишемической болезни сердца, рассеянного склероза, сахарного диабета, злокачественных опухолей и многих других заболеваний.
В норме для предотвращения вредного воздействия прооксидантов в организме синтезируются соединения-антагонисты, обладающие мощным восстановительным потенциалом (антиоксиданты). Кроме того, антиоксидантными свойствами обладают некоторые витамины и микроэлементы, источником которых для человека являются пищевые продукты. Во многих исследованиях было показано, что люди, употребляющие большое количество фруктов и овощей, богатых пищевыми антиоксидантами, действительно реже страдают заболеваниями сердца. Кроме того, показано, что профилактическое назначение препаратов витаминов и микроэлементов также снижает риск заболеваний сердца.
Наиболее выраженными антиоксидантными свойствами обладают витамины А, С и Е и микроэлементы железо, медь, цинк и селен.
Антиоксидантные витамины E, С и A
Витамин Е входит в состав липопротеинов и клеточных мембран и препятствует перекисному окислению полиненасыщенных жирных кислот. Он является основным антиоксидантом липопротеинов низкой плотности (ЛПНП). Кроме того, витамин Е тормозит агрегацию тромбоцитов и адгезию моноцитов.
Витамин Е в больших количествах обнаруживается в растительных маслах и пшеничных зародышах, а также в мясе, рыбе, фруктах и овощах. Рекомендуемая суточная норма потребления (RDA) витамина Е составляет 30 МЕ (30 мг/сут).
Витамин С - это основной антиоксидант сыворотки крови. Этот водорастворимый витамин нейтрализует свободные радикалы плазмы крови и, таким образом, препятствует их взаимодействию с ЛПНП. Также витамин С восстанавливает активную форму витамина Е, способствует выведению холестерина, улучшает вазодилатацию сосудов и тормозит агрегацию моноцитов.
Пищевыми источниками витамина С являются цитрусовые фрукты, клубника, помидоры, капуста и зеленолистные овощи. RDAвитамина С составляет 60 мг, однако для курящих людей, пациентов с заживающими ранами, беременных и кормящих грудью женщин необходимо большее количество витамина С.
Витамин А, а точнее его предшественник β-каротин, проявляет антиоксидантные свойства как в сыворотке крови, так и в составе ЛПНП. Он тормозит захват окисленных ЛПНП макрофагами, но не препятствует их первоначальному окислению.
Витамин А в больших количествах обнаруживается во фруктах, желтых и оранжевых овощах (морковь, тыква, картофель) и темно-зеленых овощах (шпинат и брокколи). RDAвитамина А не определена.
Хотя применение препаратов витаминов Е, С и А не было ассоциировано с какими-либо выраженными токсическими эффектами, следует подчеркнуть, что в одном из исследований был выявлен повышенный риск рака легкого у курящих пациентов, получающих препарат витамина А.
Витамины E, С и A - это основные витамины, обладающие антиоксидантными свойствами. Роль других витаминов (К, группы В, омега-3 и омега-6 жирных кислот) также важна, однако не является определяющей.
Антиоксидантные микроэлементы Fe, Cu, Zn, Se
Микроэлементы являются кофакторами ферментов антиоксидантной системы, катализирующих разрушение свободных радикалов.
В работе представлены результаты исследования влияния различных доз озона на про- и антиоксидантные системы крови интактных крыс при длительном его применении. Эксперимент выполнен на крысах линии Wistar. Продолжительность эксперимента составила 30 суток, в течение которых животным ежедневно внутрибрюшинно вводили 1 мл 0,9 % раствора NaCl, с насыщающими концентрациями озона в нем 0,6 мкг, 2,0 или 8,0 мкг. Контроль представлен здоровыми интактными крысами без манипуляций и животными, которым проводили инъекции 0,9 % раствора NaCl, насыщенного кислородом. Через 30 суток животных выводили из эксперимента путем декапитации под наркозом. В плазме крови и эритроцитах изучали интенсивность перекисного окисления липидов с помощью метода индуцированной биохемилюминесценции и по уровню малонового диальдегида. В гемолизате эритроцитов определяли активность супероксиддисмутазы. Выявлено, что хроническое применение кислороднасыщенного раствора в течение 30 суток вызывает угнетение про- и антиоксидантного баланса крови. Установлено, что длительное использование озона в высоких концентрациях (2,0 и 8,0 мкг) оказывает ингибирующее влияние на перекисное окисление липидов и общий антиоксидантный статус крови, повышая активность супероксиддисмутазы. Показано, что менее выраженным токсическим эффектом обладает озон в концентрации 0,6 мкг.
1. Леонов А.Н. Гипероксия. Адаптационно-метаболическая концепция саногенеза // Бюллетень гипербарической биологии и медицины. - 1993; 1 (1-4): 61-74.
2. Меньщикова Е.Б., Ланкин В.З., Зенков Н.К. Окислительный стресс. Прооксиданты и антиоксиданты. - М.: Фирма Слово, 2006. - 556 с.
3. Павлюченко И.И., Ременякина Е.И., Панасенкова Ю.С., Ваштак И.В. Целесообразность мониторинга перекисного окисления липидов для оценки эффективности терапевтических программ в условиях санатория // Фундаментальные исследования. - 2012. - № 7-1. - С. 151-154.
4. Перетягин С.П. О многофакторном механизме лечебного действия озона // Нижегородский медицинский журнал. - 2003: 6-7.
5. Сирота Т.В. Новый подход в исследовании процесса аутоокисления адреналина и использование его для измерения активности супероксиддисмутазы // Вопросы медицинской химии 1999; 45 (3): 109-116.
6. Стряпко Н.В. Адаптация к гипоксии и гипероксии при действии токсикантов в низких дозах: свободно-радикальное окисление и компоненты редокс-сигнализации: автореф дис. … канд. мед. наук. - Москва, 2015.
7. Dawson J.M., Heatlic P.L. Lowry method of protein quantification Evidence for Photosensitivity. Analytical Biochemistry 1984; 140 (2): 391-393.
9. Guanche D., Hernandez F., Zamora Z., Alonso Y. Effect of ozone pre-conditioning on redox activity in a rat model of septic shock. Toxicol. Mech. Methods 2010; 20 (8): 466-471.
10. Peretyagin S.P., Martusevich A.K., Solovyeva A.G., Zimin Yu.V., Peretyagin P.V. Enzymological evaluation of hepatotropic effect of ozone in a subchronic experiment. Bulletin of Experimental Biology and Medicine 2013; 154 (6): 789-791.
12. Uchiyama M., Mihara М. Determination of malonaldehyde precursor in tissues by thiobarbituric acid test. Analyticac Biochemistry 1978; 86: 271.
13. Zhou N.B., Fu Z.J., Sun T. Effects of different concentrations of oxygen-ozone on rats' astrocytes in vitro. Neurosci Lett 2008; 441 (2): 178-182.
Применение любых активных форм кислорода (АФК) в биологии и медицине с саногенетическими целями неизбежно сталкивается с проблемой интенсификации свободно-радикального окисления (СРО), активации процессов перекисного окисления липидов (ПОЛ) биологических мембран, направленных на адаптивное в условиях гиперметаболизма повышение клеточной проницаемости. Поэтому использование окислительных методов терапии неразрывно связано с необходимостью исследования процессов липопероксидации, так как изменение баланса про- и антиоксидантных систем организма является одним из диагностических критериев тяжести патологического состояния, характеризуя формирование и прогрессирование окислительного стресса [1, 2, 9]. Однако при чрезмерной гиперстимуляции окислительного метаболизма может происходить не только модификация клеточной стенки, но и её альтерация, приводящая к повышению микроваскулярной проницаемости и системному поражению органов и тканей [1, 2]. В этой связи актуальна проблема изучения механизмов СРО при использовании разных концентраций АФК в условиях их хронического воздействия на организм млекопитающих.
Целью данной работы явилось изучение влияния разных доз озона (0,6; 2,0 и 8,0 мкг) на про- и антиоксидантные системы крови интактных крыс при длительном его применении.
Материалы и методы
Для исследований баланса про- и антиоксидантных систем использовали кровь, стабилизированную цитратом натрия (1:9). В плазме крови и эритроцитах изучали активность процессов СРО с помощью метода индуцированной биохемилюминесценции на биохемилюминометре БХЛ-06 (Н. Новгород). Оценивали следующие параметры хемилюминограммы: tg 2α - показатель, характеризующий скорость спада процессов СРО в плазме и свидетельствующий об общем антиоксидантном потенциале (АОА); S - светосумма хемилюминесценции за 30 сек. - отражает потенциальную способность биологического объекта к ПОЛ. Интенсивность ПОЛ определяли по уровню содержания вторичного продукта СРО - малонового диальдегида (МДА) в плазме и эритроцитах методом M.Uchiyama, M.Mihara [12], так как образующиеся в результате липопероксидации такие метаболиты, как альдегиды, кетоны, кислоты являются токсичными для организма. Карбонильные продукты подавляют синтез ДНК, вызывают внутри- и межмолекулярные сшивки полипептидов, модифицируют агрегацию тромбоцитов [2]. Среди ферментов, представляющих первое звено антиоксидантной защиты, исследовали супероксиддисмутазу (СОД), которая переводит супероксидный радикал в электронейтральную форму Н2О2. Активность СОД определяли в гемолизате отмытых эритроцитов (1:10) по ингибированию образования продукта аутоокисления адреналина [5]. Расчет удельной активности фермента осуществляли по концентрации белка, исследовавшегося модифицированным методом Лоури [7]. Результаты исследований обрабатывали с использованием программы Statistica 6.0. Значимость различий между показателями определялась с помощью t-критерия Стьюдента. Статистически значимыми считались различия при р
Результаты и обсуждение
По данным биохемилюминесценции полученные результаты свидетельствовали о снижении про- и антиокидантного баланса в плазме крови животных контрольной серии с применением кислороднасыщенного физиологического раствора (рис. 1, 2).
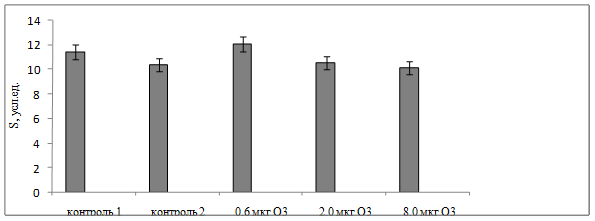
Рис. 1. Динамика изменения светосуммы хемилюминесценции в плазме крови крыс при воздействии различных доз АФК в условиях хронического эксперимента
При этом незначительное уменьшение светосуммы хемилюминисценции на 9 % по сравнению с показателем интактных животных (рис. 1) сопровождалось падением АОА на 20% (р=0,038) по сравнению с животными 1 контрольной группы (рис. 2).
Рис. 2. Динамика изменения показателя tg2α в плазме крови крыс при воздействии различных доз АФК в условиях хронического эксперимента
Примечание: * - различия статистически значимы по сравнению с контролем 1 (p<0,05); ** - различия статистически значимы по сравнению с 0,6 мкг О3 (p<0,05).
Одновременно у крыс второй контрольной группы выявлено снижение cветосуммы хемилюминисценции в эритроцитах на 19 % (р=0,032) по сравнению с интактными животными (рис. 3), что может привести в условиях длительной кислородной интоксикации к нарушениям в биологических мембранах, связанным с изменением их проницаемости, ионного транспорта и физико-химических свойств мембранных белков и липидов, изменением активности мембранно-связанных ферментов, уменьшением электрической стабильности липидного бислоя мембран [6].
Рис. 3. Динамика изменения светосуммы хемилюминесценции в эритроцитах крыс при воздействии различных доз АФК в условиях хронического эксперимента
Примечание: * - различия статистически значимы по сравнению с контролем 1 (p<0,05).
Снижение общего уровня про- и антиоксидантного баланса на фоне длительного воздействия кислороднасыщенного физиологического раствора подтверждали также данные определения МДА и СОД. Полученные результаты выявили статистически значимое уменьшение концентрации МДА в плазме крови и эритроцитах соответственно на 53 % (р=0,034) и 61 % (р=0,021) после применения кислороднасыщенного физиологического раствора по сравнению с интактными животными (рис. 4). Удельная активность СОД во 2-ой контрольной группе уменьшилась на 26 % (р=0,028) по сравнению с контролем 1 (рис. 5).
Таким образом, изменения про- и антиоксидантного статуса под влиянием кислороднасыщенного физиологического раствора при длительном его применении свидетельствовали об уменьшении окислительного потенциала на системном уровне (кровь) и могли быть одной из причин ослабления сопротивляемости организма, снижения его иммунореактивности [11].
Рис. 4. Концентрация малонового диальдегида в крови крыс при воздействии различных доз АФК в условиях хронического эксперимента
Рис. 5. Удельная активность супероксиддисмутазы в эритроцитах крови крыс при воздействии различных доз АФК в условиях хронического эксперимента
Хроническое системное воздействие (в течение 30 суток) на животных АФК с существенно большим, чем у кислорода окислительно-восстановительным потенциалом - озоном при использовании его низкой дозы (0,6 мкг), незначительно стимулируя прооксидантный потенциал плазмы крови до +5 % (р=0,098) (рис. 1), снижало светосумму хемилюминисценции эритроцитов, свидетельствуя о повышении их перекисной резистентности на 44 % (р=0,022) (рис. 3). При этом выявлено возрастание АОА плазмы на 21 % (р=0,008) по сравнению с интактными животными (рис. 2). Под влиянием низкой дозы озона (0,6 мкг) активность СОД в эритроцитах увеличилась на 11 % (р=0,061) (рис. 5). Суммарное возрастание антиоксидантных свойств плазмы и эритроцитов препятствовало развитию оксидативного стресса, что сопровождалось снижением промежуточного продукта ПОЛ - МДА на 46 % (р=0,004) в плазме крови и на 25 % (р=0,025) в эритроцитах (рис. 4). Известно, что О3 способствует синтезу и активации каталитических свойств ферментов антирадикальной защиты: глутатионпероксидазы, каталазы и СОД [4, 8].
Хроническое воздействие большего количества АФК (дозы озона 2,0 и 8,0 мкг) по данным биохемилюминисцентного анализа сопровождалось снижением общего уровня прооксидантной активности. Об этом свидетельствовало уменьшение светосуммы хемилюминисценции в плазме крови на 8 % (р=0,064) и 11 % (р=0,084) соответственно (рис. 1), а в эритроцитах показатель S был снижен на 35 % (р=0,021) при воздействии О3 в дозе 2,0 мкг и на 32 % (р=0,034) при использовании 8,0 мкг О3 по сравнению с контрольной группой 1 (рис. 3). Высокие дозы озона (2,0 и 8,0 мкг) вызвали снижение общей антиоксидантной активности в плазме крови на 28 % (р=0,023) и 24 % (р=0,031) соответственно по сравнению с применением низких доз озона (0,6 мкг), что свидетельствовало об истощении, скорее всего, неферментативного звена антиоксидантной защиты (рис. 2). На этом фоне, в отличие от хронических воздействий чистым кислородом, при использовании больших доз О3 (2,0 и 8,0 мкг) удельная активность СОД в эритроцитах увеличилась на 18 % (р=0,041) и 19 % (р=0,035) соответственно (рис. 5). Это создавало условия для обрыва процессов ПОЛ. Концентрация МДА в плазме крови уменьшилась на 26 % (р=0,041; доза О3 - 2,0 мкг) и 54 % (р=0,023; доза О3 - 8,0 мкг) по сравнению с показателями животных первой контрольной группы, в эритроцитах - на 12 % (р=0,040) и 6 % соответственно (рис. 4).
Таким образом, хроническое парентеральное введение кислороднасыщенного физиологического раствора животным в течение 30 суток оказало ингибирующее действие на про- и антиоксидантный статус крови. Подобное снижение интенсивности окислительных процессов установлено также для токсического действия кислорода в исследованиях гипероксии, связанной с вдыханием кислорода под повышенным давлением [1]. Пусковые механизмы действия гипербарического кислорода на клетку (организм) реализуются через прямое (посредством включения кислорода в электрон-транспортные сети митохондрий), опосредованное (через свободнорадикальные механизмы) и рефлекторное (через рецепторы) влияние [1, 6]. Длительное применение озонированного физиологического раствора в диапазоне высоких доз озона (2,0 и 8,0 мкг) у крыс, не увеличивая АОА, оказывало стимулирующее действие на активность СОД, что могло снижать прооксидантные физиологические возможности АФК в организме животных. В условиях моделирования хронического воздействия АФК наиболее оптимальным оказалось применение низких доз озона в физиологическом растворе (0,6 мкг), которые, поддерживая активность процессов ПОЛ несколько выше уровня, чем у интактных животных, оказали модулирующее действие как на СОД, так и в целом на АОА крови. Данные литературы о влиянии О3 на каталитические свойства СОД и содержание МДА также подтверждают дозозависимый характер ответных реакций биологических систем на низкие и высокие дозы озона [10, 13]. Ранее установлено, что длительное использование низких доз озона способствовало умеренной физиологической активации оксидоредуктаз, тогда как дозы О3, превышающие 2,0 мкг, приводили к нарастанию тканевой гипоксии и накоплению в печени токсических продуктов [10].
Результаты проведенного исследования позволяют констатировать, что длительное субхроническое воздействие кислороднасыщенным физиологическим раствором снижает в целом про- и антиоксидантный баланс в организме животных. Применение в аналогичных условиях низких доз (0,6 мкг) одной из активных форм кислорода, озона, сопровождается минимально инициирующим влиянием на ПОЛ в крови с преимущественным защитным антиоксидантным действием как на системном уровне (кровь), так и на клеточном (эритроциты). Использование более высоких доз озона (2,0 и 8,0 мкг), также стимулирующих СОД, сопровождается при этом уменьшением влияния О3 на окислительно-восстановительные процессы в организме, о чём свидетельствовали сниженные показатели хемилюминограмм и концентрации МДА в крови.
1333214_lectures
мембран. При дефиците селена и снижении активности глутатионпероксидазы повышается гемолиз эритроцитов вследствие действия перекиси водорода и липоперекисей. Восстановленный глутатион и глутатионпероксидаза превращают липоперекиси в менее токсичные оксикислоты и этим предупреждают повреждение биоструктур. Пополнение фонда глутатиона происходит за счет аминокислот, которые содержат серу.
Обнаружено, что пероксидазы обеспечивают нормальный ход окислительных процессов при различного рода неблагоприятных воздействиях на растение.
Супероксиддисмутаза (СОД, ЕС 1.15.1.1) - широко распространенный в природе фермент, он обязательно присутствует у всех аэробных организмов, а также найден у некоторых анаэробных бактерий. Супероксиддисмутаза является первым антиоксидантным ферментом, который выделили Манн и Кейлис в 1938 году.
Супероксиддисмутаза катализирует реакцию восстановления супероксид радикала до пероксида водорода:
· О 2 - + · О 2 - + 2Н + → H 2 O 2 + O 2
АФК находятся во всех клетках, потребляющих кислород. Скорость реакции чрезвычайно высока и лимитируется только скоростью диффузии О 2 .- . Каталитический цикл ферментов этой группы включает восстановление и окисление иона металла на активном центре фермента. Супероксиддисмутаза осуществляет инактивацию радикалов кислорода, которые могут возникнуть в ходе биологических реакций переноса электронов или при воздействии металлов с переменной валентностью, ионизирующего, ультрафиолетового излучения, ультразвука, гиперборической оксигенации, различных заболеваниях.
Механизм взаимодействия СОД с супероксидным радикалом точно не выяснен. Предполагается, что сначала одна молекула супероксида взаимодействует с активным центром фермента, при этом металл, входящий в активный центр, восстанавливается, а радикал окисляется до молекулярного кислорода:
СОД-Me n+ + О 2 •- → О 2 + СОД-Ме (n-1)+ ;
Затем при участии второй молекулы О 2 •- происходит обратное окисление металла, при этом образуется пероксид водорода:
СОД-Ме (n-1)+ + О 2 •- → H 2 О 2 + СОД-Me n+ .
Дальнейшее превращение пероксида до воды и молекулярного кислорода происходит с участием глутатион-аскорбатного цикла, который осуществляется в результате сопряженного действия ряда ферментов, включая глутатионредуктазу (ГР).
Фермент состоит из двух одинаковых субъединиц, соединенных дисульфидными связями. Характеризуется тем, что в своем составе может иметь различные металлы переходной валентности: Cu, Zn, Mn, Fe, в то время как аминокислотный состав мало изменяется .
В растениях присутствуют несколько СОД, содержащих в активных центрах ионы Cu-Zn, Fe или Mn. Mn-СОД локализована в основном в митохондриях, Cu-Zn-СОД - в цитоплазме, хлоропластах и пероксисомах, FeСОД- в хлоропластах. Таким образом, наиболее повышена концентрация супероксиддисмутазы в хлоропластах. СОД является центральным соединением антиоксидантной системы и выполняет защитную роль клетки от активных форм кислорода.
Глутатионредуктаза (ГР, ЕС 1.6.4.2) является важным ферментом системы антиоксидантной защиты растений. Она катализирует восстановление
окисленного глутатиона при участии НAДФH+H + в глутатион-аскорбатном цикле.
ГР у растений имеет 4 изоформы, которые ассоциированы с разными клеточными компартментами. Наибольшее количество этого фермента ассоциировано с хлоропластами, но также выявлены изозимы в цитозоле и митохондриях .
Пероксид водорода, возникающий при восстановлении супероксид радикала, разрушается в цитоплазме, хлоропластах и мембранах глиоксисом с участием аскорбатпероксидазы. При этом происходит окисление аскорбата:
2H 2 О 2 + аскорбат → дегидроаскорбат + 2H 2 О + О 2 . Дегидроаскорбат восстанавливается аскорбатредуктазой с участием
восстановленного глутатиона (ГSH):
2ГSH + дегидроаскорбат → ГSSГ + аскорбат.
В свою очередь, окисленный глутатион (ГSSГ) регенерируется
глутатионредуктазой путем НАДФН (Н + )-зависимого восстановления: ГSSГ + НАДФН + Н + → 2ГSH + НАДФ + .
6. Изменение активности антиоксидантных ферментов при загрязнении среды обитания растений
Активность вышеперечисленных ферментов может сильно меняться в зависимости от того, в каких условиях находится растение. В настоящее время существует много публикаций, посвященных выяснению адаптаций растений к стрессу, вызванному тяжелыми металлами, при помощи систем ферментов антиоксидантной защиты.
Удобнее рассмотреть, как отдельные компоненты загрязнения влияют на активность изучаемых ферментов антиоксидантной защиты.
Одним из наиболее опасных поллютантов является кадмий. При действии на растения гороха кадмия в повышенных концентрациях активность СОД возрастала на 44%, а активность пероксидаз - на 24%. В этих опытах
активность возрастала во всех вариантах, отличных от контроля. В исследованиях Шевяковой на хрустальной травке показано, что в условиях Cdстресса значительно возрастала активность гваяколовых пероксидаз.
Значительное количество публикаций посвящено действию на растительные организмы ионов меди. Деви и Прасад на Brassica juncea показали, что при обработке растений растворами меди возрастало перекисное окисление липидов - следовательно, металл индуцирует окислительный стресс. При этом наблюдалось возрастание активности таких ферментов, как пероксидазы (на 95-110%), каталазы (на 30-106%), СОД (на 9-16%). В опытах Холодовой при длительном выращивании хрустальной травки в среде с повышенным содержанием Cu и Zn отмечалось значительное возрастание активности гваяколовой пероксидазы. В ряде работ, в том числе выполненных in vivo , избыток меди стимулировал активность СОД, каталазы и пероксидаз. Однако не доказано, что данная стимуляция участвует в формировании толерантности к меди. Наоборот, по некоторым работам, увеличение концентрации СОД не приводило к изменению картины вызываемых медью токсических реакций. Показано также, что на фоне повышенного содержания меди активность СОД у толерантных и нетолерантных видов может не изменяться.
Никель, наряду с общими проявлениями токсичности, имеет ряд особенностей. При низкой концентрации его солей обнаружено повышение активности некоторых ферментов, не связанных с антиоксидантной защитой, например, уреазы. Действие ионов никеля на активность антиоксидантных ферментов растений-аккумуляторов и неаккумуляторов может сильно различаться. При выращивании негипереаккумулятора Alyssum maritinum на среде с добавлением никеля, повышалась активность СОД, пероксидаз, тогда как у гипераккумулятора A. аrgenteum активность тех же ферментов была ниже. Можно полагать, что в этом случае у гипераккумуляторов существуют механизмы, обеспечивающие эффективную детоксикацию никеля, благодаря чему необходимость в активации антиоксидантных ферментов отпадает.
В опытах на Potamogeton crispus было показано влияние повышенных концентраций свинца на активность ферментов антиоксидантной защиты. При этом было отмечено ингибирование СОД, каталазы из-за взаимодействия свинца со специфическими группами белковых компонентов этих ферментов. Увеличение активности пероксидазы, по-видимому, отражает естественный ответ растения на избыток свободных радикалов при глубоком подавлении функций СОД и каталазы.
Существуют работы, в которых показано влияние лантана на работу ферментов-антиоксидантов. При небольших концентрациях активность СОД не изменялась по сравнению с контролем, при увеличении концентрации наблюдалось возрастание активности. Активности каталазы и пероксидазы изменялись сходно, но отлично от СОД: при повышении концентрации металла их активность снижалась.
Таким образом, можно сделать вывод, что наиболее распространенные ферменты системы антиоксидантой защиты - СОД, каталаза и пероксидаза - на самые разнообразные поллютанты реагируют немного по-разному. Исследования подобного рода проводятся, в модельных опытах. При этом в качестве поллютантов выбираются наиболее токсичные (кадмий, свинец, медь) в высоких, часто летальных концентрациях. Вместе с тем, активность ферментов антиоксидантной защиты растений из природных экосистем, обитающих долгое время при повышенном, но не летальном, содержании таких металлов, как никель, цинк, железо и марганец, изучена недостаточно.
При подготовке лекции использованы следующие источники:
1. Деви С.Р., Прасад М.Н. Антиокислительная активность Brassica juncea, подвергнутых действию высоких концентраций меди //Физиология растений. - 2005. - Т.52. - № 2. - С. 233-237.
2. Кулинский В.И. Активные формы кислорода и оксидативная модификация макромолекул: польза вред и защита // Соросовский образовательный журнал. - 1999. - № 1. - С. 2-7.
3. Мерзляк М.Н. Активированный кислород и жизнедеятельность растений // Соросовский образовательный журнал. - 1999. - № 9. - С. 20-26.
4. Рубин Б.А., Ладыгина М.Е. Физиология и биохимия дыхания растений.
- М.: Изд-во МГУ, 1974. - 512 с.
5. Физиология растений: Учебник для студентов вузов /под ред. И.П. Ермакова. - М.: Издательский центр «Академия», 2005. - 640 с.
6. Ху Ц.Ц., Ши Г.С., Су Ц.С., Ван С., Юан Ц.Х., Ду. Воздействие Pb на активность антиоксидантных ферментов и ультраструктуру клеток Potamogeton crispus //Физиология растений. - Т. 54. - № 3. - С. 469-474.
7. Чиркова Т.С. Физиологические основы устойчивости растений. - СПб.:
Изд-во С.-Пб. ун-та, 2002. - 244 с.
9. Willekens H., Inze D., Van М. Montagu, M.van Camp. Catalases in plants // Molecular Breeding. - 1995. -V. 1. - P. 207-228.
Лекция 6. Низкомолекулярные компоненты системы антиоксидантной защиты растений
К низкомолекулярным компонентам системы антиоксидантной защиты растений относятся аскорбиновая кислота, токоферол, глутатион, полифенолы, каротиноиды и другие вещества.
1. Аскорбиновая кислота
L-Аскорбиновая кислота (аскорбат, витамин С) - необходимое вещество, которое находится в большом количестве в растительных тканях и играет очень важную роль. Она оказывает существенное влияние на некоторые физиологические процессы растений, включая рост, дифференциацию тканей и органов и метаболизм. Функция аскорбата - восстановление многих свободных радикалов и минимизация разрушений окислительного стресса.
Ее синтез происходит в цитозоле из D-глюкозы в несколько стадий. Сначала происходит окисление 1С атома глюкозы, затем - формирование двойной связи между 2 и 3 атомами С.
Как антиоксидант аскорбат реагирует с супероксидом кислорода, перекисью водорода и радикалом токоферола, при этом окисляясь до монодегидроаскорбиновой кислоты (МДГА) или до дегидроаскорбиновой кислоты (ДГА). Окисленные формы превращаются в аскорбат с помощью редуктаз МДГА и ДГА соответственно. В первом случае используется восстановительный эквивалент NADPH+H + , а во втором - глутатион.
Аскорбиновая кислота может прямо (без апофермента) и в качестве кофактора аскорбатоксидазы инактивировать свободные радикалы, выполняя сходную роль с супероксиддисмутазой:
2О - 2 + 2Н + + аскорбат → 2Н 2 О 2 + ДГА, а также косвенно принимать участие в детоксикации, восстанавливая
Витамин С найден в хлоропластах, цитозоле, вакуолях и внеклеточных компартментах клетки. В клеточной стенке содержится аскорбатоксидаза, катализирующая реакцию с синглетным кислородом 1 О 2 :
1 О 2 + Н + + 2аскорбат → 2ДГА + 2Н 2 О В хлоропластах мезофилла листа находится около 20-40% аскорбата. Там
же содержатся все ферменты регенерации восстановленной аскорбиновой кислоты из окисленных форм. Было выяснено, что Н 2 О 2 обезвреживается в хлоропластах в аскорбат-глутатионовом цикле при участии аскорбатпероксидазы (рис. 18). При воздействии стрессовых условий на растение за счет отдачи электронов аскорбатом на апофермент возможно усиление ее активности, что позволяет клеткам противостоять усилению окислительного стресса и обезвреживать АФК. Ферменты цикла присутствуют также и в цитозоле.
Этот цикл имеет наибольшее значение для хлоропластов. В процессе фотосинтеза образуются синглетные молекулы и супероксиды кислорода из триплетных. Они имеют высокую реакционную способность и окисляют липиды мембраны до перекисей, дестабилизируя ее.
Одна из функций этого пути - детоксикация Н 2 О 2 , которая может участвовать в реакции Фентона. Вторая - окисление NAD(P)H.
Рис. 18. Схема аскорбат-глутатионового цикла
Глутатион - это маленький пептид, состоящий из трех аминокислотных остатков ( γ -Глу, Цис, Гли), г-глутамилцистеинилглицин. Необычный структурный элемент молекулы - амидная связь, образованная взаимодействием амидной группы цистеина и γ -карбоксильной группы глутаминовой кислоты.
Синтез глутатиона из глутамата, цистеина и глицина является АТФ-
зависимым, двухстадийным процессом. Первая реакция образования γ -Гл у-Цис из глутамата и цистеина катализируется γ - глутамилцистеинсинтетазой (EC 6.3.2.2), которая кодируется gsh1 геном. Реакция, катализируемая этим ферментом, рассматривается в качестве лимитирующей стадии синтеза глутатиона. Вторая стадия синтеза глутатиона из γ - Глу-Цис и Гли катализируется глутатионсинтетазой (EC 6.3.2.3), которая кодируется геном gsh2 .
Важность глутатиона в клетке определяется его функциями. Он защищает тиольные группы белков, инактивирует радикальные частицы, разрушает перекисные соединения, реагирует с активными формами кислорода . Он может стабилизировать мембранные структуры, удаляя ацильные перекиси, образующиеся в ходе ПОЛ. При этом восстановленная форма глутатиона Г-SH превращается в окисленную ГS-SГ. Восстанавливается окисленный глутатион под действием фермента глутатионредуктаза (ГР).
Глутатион является кофактором ферментов глутатионпероксидазы (ГП) - восстанавливает H 2 O 2 до воды при окислении глутатиона:
2G-SH + H 2 O 2 → GS-SG + 2H 2 O
и глутатионредуктазы (ГР), которая постоянно находится в клетке в активном состоянии, катализируя восстановление окисленного глутатиона при участии НAДФH+H + :
НAДФH+H + + ГS-SГ → 2Г-SH + НAДФH + .
Глутатион участвует в восстановлении дегидроаскорбиновой кислоты в аскорбиновую в аскорбат-глутатионовом цикле:
дегидроаскорбат + 2Г-SH → аскорбат + ГS-SГ
Глутатион также может восстанавливать дегидроаскорбиновую кислоту без апофермента при рН>7 в клетке и концентрации глутатиона >1 мМ.
Способность глутатиона перехватывать свободные радикалы обуславливает его противодействие окислительному стрессу (GSHпероксидазы используются в процессе регенерации перекисей липидов). Кроме того, в условиях стресса, вызванного тяжелыми металлами, растения синтезируют металлосвязывающие белки, такие как фитохелатины. Наличие γ - Глу связи в этих пептидах свидетельствует о том, что они не синтезируются через мРНК, а используют молекулы глутатиона в качестве мономеров. Это уменьшает пул ГSH .
Снижение количества восстановленного глутатиона может также наблюдаться в результате недостатка глутатионредуктазы и/или снижения скорости синтеза. Это может приводить к сильным клеточным повреждениям. Уменьшение пула восстановленного глутатиона может свидетельствовать о его окислении до ГSSГ, катализируемом тяжелыми металлами, либо использовании GSH-пероксидазами в процессе ферментативной регенерации перекисей липидов.
Использование ГSH в антиоксидантной защите у разных видов может происходить по разным механизмам: с преобладанием процессов его ресинтеза или активного участия в окислительно-восстановительных процессах. Второй механизм метаболизма является более уязвимым, так как в условиях стресса при загрязнении ресурс глутатиона истощается. Это может привести к
Читайте также:
