Сцепленность генов тяжелых цепей антител. Гены тяжелых цепей IgA
Добавил пользователь Владимир З. Обновлено: 22.01.2026
Х-сцепленная агаммаглобулинемия (BTK, Брутоновская агаммаглобулинемия, OMIM 300300) - иммунодефицит, обусловленный недостаточностью фермента ВТК - Брутоновской или В-клеточной тирозинкиназы, ген которой локализован в Хq21-q22. Болеют только мальчики, гетерозиготные женщины-носительницы клинически здоровы. Заболевание проявляется отсутствием или значительным снижением в кровотоке как иммуноглобулинов, так и В-лимфоцитов, их продуцирующих. Клинически выражается в частых тяжёлых инфекционных заболеваниях, таких как пневмонии, острые вирусные инфекции, энцефалит и др. Молекулярной причиной заболевания являются различные изменения в нуклеотидной последовательности гена ВТК, начиная от замены одного нуклеотида на другой, что приводит к замене аминокислоты и синтезу менее функционального белка, и заканчивая протяжёнными делециями, которые приводят к синтезу укороченного белка или к отсутствию белка вообще. Ген состоит из 19 экзонов, которые формируют 4 функциональных домена. Мутации равномерно распределены по всей протяженности гена.
Мутации в данном гене приводят также к развитию агаммаглобулинемии с изолированным дефицитом гормона роста.
Отсутствие нормального гена btk приводит к приостановке развития В-клеток на стадии пре-В-клеток , когда уже произошла реорганизация генов для тяжелых цепей иммуноглобулинов , но не начата еще реорганизация генов для легких цепей . В результате нарушается процесс формирования антигенраспознающего рецепторного комплекса В-клеток.
Болеют только мальчики, гетерозиготные женщины-носительницы клинически здоровы. Заболевание проявляется отсутствием или значительным снижением в кровотоке как иммуноглобулинов, так и В-лимфоцитов, их продуцирующих. Клинически выражается в частых тяжелых инфекционных заболеваниях, таких как пневмонии, острые вирусные инфекции, энцефалит и др.
До 9-12-месячного возраста болезнь не проявляется, так как новорожденные получают защитные антитела с молоком матери. Однако после этого периода ребенок подвергается постоянному инфицированию такими возбудителями как Hemophilis influenza, Diplococcus pneumoniae, Staphylococcus aureus, Streptococcus pneumoniae.
Сцепленность генов тяжелых цепей антител. Гены тяжелых цепей IgA
ФГБУ "Гематологический научный центр" Минздрава России, Москва
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
Гематологический научный центр Минздрава РФ, Москва, Россия
Гематологический научный центр Минздрава России, Москва
ФГБУ «Национальный медицинский исследовательский центр гематологии» Минздрава России, Москва, Россия ,
Молекулярный анализ генов иммуноглобулина в опухолевых B-клетках при лимфоме селезенки из клеток маргинальной зоны
Журнал: Терапевтический архив. 2015;87(7): 58‑63
Цель исследования. Определение классов генов IgVH, их соматической мутации и сопоставление этих данных с клинико-лабораторными параметрами пациентов и исходами заболевания. Материалы и методы. В исследование включили 24 пациента (9 мужчин и 15 женщин, в возрасте от 32 до 77 лет, медиана 60 лет) с лимфомой селезенки из клеток маргинальной зоны (ЛСКМЗ). Диагноз ЛСКМЗ устанавливали на основании гистологического и иммуногистохимического исследования трепанобиоптата костного мозга, иммунофенотипирования лимфоидных клеток периферической крови или пунктата костного мозга. Результаты. Проанализирован мутационный статус генов IgVH у всех 24 больных. Выявлено, что у 15 (62,5%) больных ЛСКМЗ опухолевые клетки содержат мутированные гены IgVH (в большинстве случаев участвуют гены семейства VH1), а у 9 (37,5%) — немутированные. Выявлена тенденция к более частому прогрессированию опухоли у пациентов с немутированными генами IgVH по сравнению с мутированными. Заключение. Наличие случаев ЛСКМЗ как с мутированными, так и немутированными генами IgVH, а также повышенная распространенность гена VH1—2, вероятно, указывает на молекулярную гетерогенность происхождения данной лимфомы.
АИГА — аутоиммунная гемолитическая анемия
ВБП — выживаемость без прогрессирования
КМ — костный мозг
ЛСКМЗ — лимфома селезенки из клеток маргинальной зоны
ОВ — общая выживаемость
B-ХЛЛ — В-клеточный хронический лимфолейкоз
SE — стандартная ошибка
В-клеточная лимфома селезенки из клеток маргинальной зоны (ЛСКМЗ) — В-клеточная опухоль, представленная морфологически зрелыми лимфоидными клетками, по своим иммунологическим характеристикам соответствующим лимфоцитам маргинальной зоны вторичного фолликула. Клинически характеризуется спленомегалией, умеренным лимфатическим лимфоцитозом, обычно очаговым поражением костного мозга (КМ), иногда умеренной секрецией моноклонального иммуноглобулина в сыворотке (обычно IgM или IgG) и/или моче и относительно доброкачественным течением [1—4].
Сопоставления данных иммунофенотипического исследования и мутационного статуса генов IgVH показали, что в маргинальных зонах содержится по меньшей мере 4 субпопуляции В-лимфоцитов с различным мутационным статусом [5—7]. Согласно результатам анализа вариабельного региона тяжелой цепи генов иммуноглобулинов (VH) из небольшого числа случаев ЛСКМЗ большинство из них подвергались соматической гипермутации, что имеет большое значение для представления о происхождении этой лимфомы [8—14].
Приводим собственные результаты, полученные в ходе проведенного исследования, цель которого состояла в определении классов генов IgVH, их соматической мутации и сопоставление этих данных с клинико-лабораторными параметрами пациентов и исходами заболевания.
Материалы и методы
Пациенты. Анализ генов VH проведен у 24 пациентов с ЛСКМЗ. Клинический диагноз установлен на основании стандартных критериев [2, 15]: результатов гистологического и иммуногистохимического исследований КМ, а также иммунофенотипирования лимфоидных клеток периферической крови и/или КМ.
Обследуемая популяция включала 15 женщин и 9 мужчин, медиана возраста при установлении диагноза составила 60 лет (диапазон от 32 до 71 лет). Их основные клинические характеристики отражены в табл. 1.
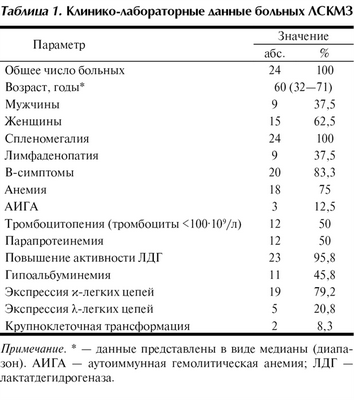
Таблица 1. Клинико-лабораторные данные больных ЛСКМЗ Примечание. * — данные представлены в виде медианы (диапазон). АИГА — аутоиммунная гемолитическая анемия; ЛДГ — лактатдегидрогеназа.
Статистический анализ. В качестве критериев («конечных точек») исходов лечения ЛСКМЗ использованы общая выживаемость (ОВ) и выживаемость без прогрессирования (ВБП). Для О.В. время отсчитывали от даты установления диагноза до летального исхода (от любой причины) или последней информации о пациенте, при ВБП — от даты спленэктомии (СЭ), рассматриваемой как начало лечения, до первой прогрессии или летального исхода (от любой причины). Согласно В. Cheson и соавт. [18] и S. Mulligan и соавт. [19], прогрессия при ЛСКМЗ заключается в появлении новых симптомов и локализаций болезни (в частности, экстранодальных очагов поражения), увеличении на 50% и более количества лимфоцитов в периферической крови или инфильтрате КМ, увеличении на 25% и более размеров исходной органомегалии, а также гистологические признаки крупноклеточной трансформации. ОВ и ВБП рассчитаны методом Каплана—Мейера, указана стандартная ошибка (SE). При однофакторном регрессионном анализе для выживаемости использована модель пропорциональных рисков Кокса. Выполнен частотный анализ для мутационного статуса генов IgVH и следующих (бинарно представленных) демографических и клинико-лабораторных характеристик: пол, возраст, В-симптомы, уровень ЛДГ, анемия, АИГА, тромбоцитопения, секреция парапротеина, гипоальбуминемия, гистологическая и крупноклеточная трансформации. Для расчетов использован статистический пакет SAS 9.1.
Результаты и обсуждение
Клиническая картина. Основные клинические характеристики показаны в табл. 1. У всех больных выполнена С.Э. Лимфаденопатия в виде увеличения лимфатических узлов ворот печени и/или селезенки имелась у 9 пациентов. Поражение К.М. выявлено у 100% больных, B-симптомы — у 20 (83,3%). Анемия, АИГА, тромбоцитопения (тромбоциты менее 100·10 9 /л) зафиксированы у 18, 3 и 12 пациентов соответственно. Парапротеинемия обнаружена у 12 пациентов, в большинстве случаев с изотипом IgM. Активность ЛДГ в сыворотке крови была повышена у 23 больных. Ни в одном случае серологических маркеров вирусных гепатитов В и С не обнаружено.
Гистологические и иммунофенотипические данные. Гистологическая картина трепанобиоптата КМ отражала разной степени выраженности поражение К.М. Морфологическая картина биоптата селезенки после СЭ соответствовала диагностическим критериям ЛСКМЗ [2, 15]. Иммунофенотипический анализ лимфоидных клеток периферической крови и/или пунктата КМ выявил характерную экспрессию пан-В-клеточных маркеров (CD20 и/или СD19 и/или CD79a) в отсутствие экспрессии дифференциально-диагностических антигенов, таких как CD10, CD5, CD23, CD103, CyclinD1. Отмечалась выраженная экспрессия легких цепей иммуноглобулинов: κ — в 19 и λ — в 5 случаях (см. табл. 1).
Лечение и наблюдение. Всем 24 пациентам выполнена СЭ в качестве терапии первого ряда, из них у 20 (83,3%) отмечено стабильное клинико-гематологическое улучшение. У 4 больных после СЭ развилась прогрессия заболевания, что обусловило необходимость проведение иммунохимиотерапии. Средний период наблюдения за больными составил 36,9 мес. От прогрессии заболевания, гистологически доказанной крупноклеточной трансформации умерли 2 больных на сроках наблюдения 68 и 70 мес соответственно.
Мутационный статус генов IgVH. Нуклеотидные последовательности генов IgVH определены у всех пациентов исследуемой группы. Если последовательность клонального гена VH совпадала с последовательностью одного из герминальных генов VH на 98% и более, данный ген VH считали немутированным. При условии сходства последовательности клонального гена VH с герминальным менее 98%, считали, что клетка — предшественница клона В-клеточного хронического лимфолейкоза (B-ХЛЛ) у данного больного подвергалась соматической гипермутации. Согласно этому критерию выявлены 9 (37,5%) пациентов с немутированными генами VH и 15 (62,5%) с мутированными. В исследуемой группе гены VH у 14 (58,4%) пациентов принадлежали к семейству VH1, у 12 (50% от общего числа) из них определен ген VH1—2, у 7 (29,1%) — гены семейства VH3 (из них у 3 ген VH3—7), в 2 (8,4%) случаях — гены семейства VH4 и в 1 (4,1%) — VH6 (табл. 2).
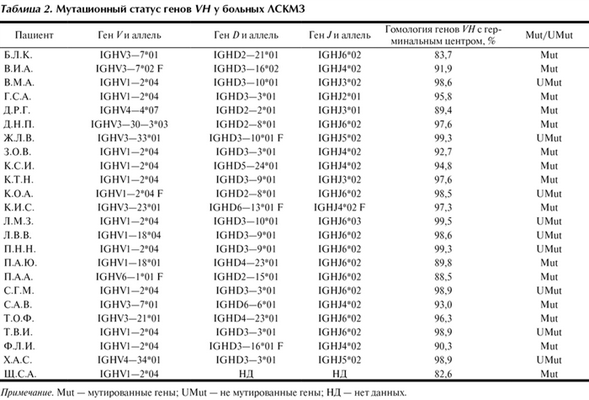
Таблица 2. Мутационный статус генов VH у больных ЛСКМЗ Примечание. Mut — мутированные гены; UMut — не мутированные гены; НД — нет данных.
ОВ за 7 лет (см. рисунок а) для всей группы больных ЛСКМЗ составила 60% (медиана общей продолжительности жизни 80 мес), 7-летняя ВБП (см. рисунок б) — 67% (медиана продолжительности жизни без прогрессирования 60 мес). Выявлена тенденция к более частому прогрессированию заболевания у пациентов с немутированными генами IgVH (n=9) по сравнению с таковой у пациентов с мутированными генами (n=15): ВБП 53 и 67% соответственно (см. рисунок в). Наличие немутированных генов IgVH ассоциировано с увеличением вероятности прогрессии заболевания примерно в 2 раза (отношение рисков 2,0 при 95% доверительном интервале от 1,1 до 3,5). В группе пациентов с мутированными генами IgVH медиана ВБП не достигнута.
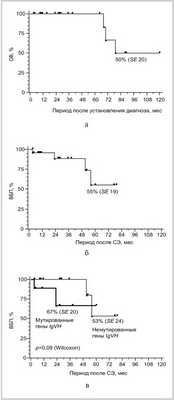
Кривые 7-летней выживаемости для пациентов с ЛСКМЗ: ОВ (а), ВБП (б) и ВБП, стратифицированная по мутационному статусу генов IgVH (в).
ЛСКМЗ, как правило, имеет неуклонно прогрессирующее клиническое течение, однако у отдельных больных имеет более агрессивное течение с признаками гистологической крупноклеточной трансформации, что ассоциируется с короткой продолжительностью жизни больных [1, 20—24]. Такая клиническая гетерогенность может отражать молекулярную гетерогенность ЛСКМЗ. Возможно, это связано с тем, что опухолевые B-клетки несут как мутированные [9, 10], так и не мутированные гены IgVH [11, 12, 25—28]. Прогностическая значимость этих молекулярных данных пока неясна, хотя в некоторых работах продемонстрированы немутированные гены IgVH при более агрессивном течении ЛСКМЗ [23, 27].
В настоящем исследовании мы проанализировали мутации генов IgVH у 24 больных ЛСКМЗ, которым диагноз установлен до СЭ на основании клинических и иммуноморфологических данных [1, 2, 29, 30]. Наши результаты показали, что у 15 (62,5%) больных ЛСКМЗ опухолевые клетки содержат мутированные гены IgVH (в большинстве случаев участвуют гены семейства VH1), а у 9 (37,5%) — немутированные.
Анализ также показал, что в 58,3% случаев при ЛСКМЗ участвуют гены семейства VH1 (в 12 случаев из 14 это ген VH1—2,), в меньшей степени — семейства VH3 и VH4. Такое избирательное участие гена VH1—2 может быть связано с патогенезом этой лимфомы.
Различные исследования при В-ХЛЛ выявили существенную неоднородность и агрессивное течение в случаях с немутированными генами [31]. Аналогичные исследования при ЛСКМЗ также показывают более агрессивное клиническое течение, гистологические признаки трансформации и плохой прогноз в случаях с немутированными генами IgVH [23—25, 27, 32].
В проведенном поисковом исследовании выявлено статистически значимое различие в группах с мутированными и немутированными генами IgVH по следующим параметрам: В-симптомы, секреция парапротеина и АИГА. В-симптомы и парапротеинемия встречались чаще у больных с мутированными, а АИГА — с немутированными генами IgVH (табл. 3). Кроме того, выявлена тенденция к более частому прогрессированию заболевания у пациентов с немутированными генами IgVH. Дальнейшее выяснение прогностической значимости мутационного статуса генов IgVH требует проведения многофакторного анализа на большем объеме выборки.
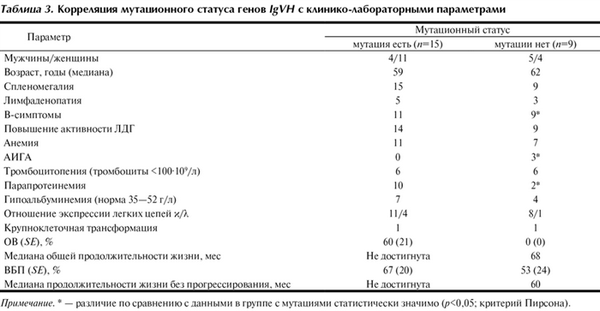
Таблица 3. Корреляция мутационного статуса генов IgVH с клинико-лабораторными параметрами Примечание. * — различие по сравнению с данными в группе с мутациями статистически значимо (р
Заключение
Данное исследование показало, что в большинстве случаев при ЛСКМЗ участвуют гены семейства VH1, могут быть случаи без мутаций генов IgVH, что указывает на молекулярную гетерогенность происхождения данной лимфомы. Следует также отметить, что выявлена тенденция к частому прогрессированию ЛСКМЗ в случаях с немутированными генами IgVH.
Что такое иммуноглобулины и зачем они нужны
зложена на разныеЧеловеческий иммунитет - это сложная многоступенчатая система защиты организма от вредоносного воздействия извне (вирусов, бактерий, аллергенов, грибков). Не существует одного органа, который бы отвечал за иммунную защиту. Эта функция возложена на разные органы иммунной системы: начиная с лимфатических узлов до кишечника и заканчивая белковыми веществами - иммуноглобулинами.
Общая характеристика иммуноглобулинов
Иммуноглобулины (Ig), или антитела, представляют собой гликопротеины, имеющие в своем составе центры специфического нековалентного связывания антигена, основанного на принципе комплементарности. Существуют растворимые формы иммуноглобулинов, которые и называют антителами, и мембранные формы иммуноглобулинов, составляющие основу В-клеточных рецепторов на поверхности В-лимфоцитов. Иммуноглобулины содержатся в крови и в некоторых секреторных жидкостях и вырабатываются как ответ на контакт с антигенами, например, бактериями или вирусами. Иногда иммуноглобулины продуцируются после контакта с собственными тканями организма, называемыми аутоантигенами.
Дефицит или избыток антител может быть признаком различных патологий, поэтому определение их количества в крови является важной частью при диагностике многих заболеваний. Кроме того, современные достижения в биомедицине позволяют использовать синтетические антитела в лечении некоторых заболеваний.
Структура антител
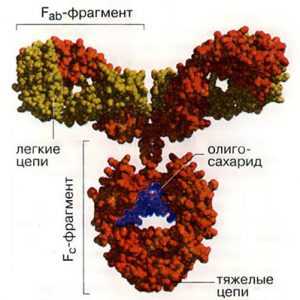
Иммуноглобулины - это симметричные Y-образные молекулы, состоящие из двух тяжелых длинных (Н) и двух коротких легких (L). цепей, которые соединены друг с другом либо дисульфидными (SS), либо водородными связями. Каждая молекула иммуноглобулина содержит не менее двух идентичных Н-цепей. Тяжелые цепи иммуноглобулинов разных классов состоят из четырех или пяти доменов и обозначаются буквами греческого алфавита соответственно латинской аббревиатуре класса. Принадлежность антитела к конкретному классу и подклассу называют изотипом, который обозначается по типу тяжелой цепи.
Легкие цепи построены из двух доменов. В их составе обязательно находится два вида доменов - вариабельный (V - variable) и константный (С-coпstaпt). Иммуноглобулины, продуцируемые разными клонами плазматических клеток, имеют разные по аминокислотной последовательности вариабельные домены. Константные домены сходны или очень близки для каждого изотипа иммуноглобулина. Вариабельные домены являются N-концевыми. В составе легкой цепи N-концевой домен является вариабельным (VL), С-концевой домен - константным (CL). Тяжелые цепи имеют один вариабельный (N-концевой) домен (Vн) и несколько константных доменов. Легкие и тяжелые цепи иммуноглобулинов гликозилированы.
Иными словами, каждое антитело подходит к антигену по принципу ключа и замка, а при соединении образуют иммунные комплексы. Но также антитела способны проявлять гибкость чужеродных агентов, благодаря чему с легкостью адаптироваться к различным антигенам. Однако эта способность иммуноглобулинов иногда провоцирует у человека перекрестные аллергические реакции - когда иммунитет человека с аллергией не может различать аллергены. Например, человек с аллергией на цветочную пыльцу вследствие “ошибки” иммуноглобулинов может также реагировать на сырые фрукты и овощи.
Разновидности иммуноглобулинов
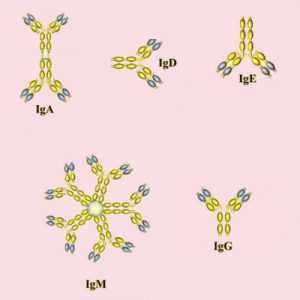
В человеческом организме иммуноглобулины представлены в двух формах:
- растворимые (продуцируются плазматическими клетками);
- связанные с наружной мембраной B-лимфоцитов, они же - рецепторные антитела.
Кроме того, существуют разные классы и подклассы (изотопы) иммуноглобулинов. Они различаются по своим биологическим особенностям, структуре и нацеленности на «мишени». На основе различий в структуре тяжелых цепей было выделено несколько классов антител. Каждый из них отличается функциями и ответными реакциями.
Кроме основных классов иммуноглобулинов существует несколько подклассов. Разница между ними основана на незначительных отличиях в типе тяжелых цепей каждого класса. В человеческом организме встречаются 4 подкласса антител. Нумерация соответствует порядку уменьшения их концентрации в сыворотке. Так, антитела IgG и IgA дополнительно группируют на подклассы IgG1, IgG2, IgG3, IgG4, а также IgA1 и IgA2.
Большинство антител (IgG, IgD, IgE) в организме представлены в форме мономера (одной молекулы). Исключение составляет антитела класса А, которые также встречается в форме димера, и IgМ, образующий форму снежинки (пентамер).
Характеристика разных классов иммуноглобулинов
Класс IgA
Около 15% антител, содержащихся в организме здорового человека, это иммуноглобулины класса IgA, которые разделяются на два подкласса IgA - IgA1 и IgA2. Они различаются молекулярной массой тяжелых цепей и концентрацией в сыворотке, где IgA представлен в основном как мономер, с молекулярной массой 160 кДа. В секреторных жидкостях иммуноглобулины присутствуют в виде димера, образованных двумя мономерами, их содержание составляет 10-15% от общего количества сывороточных иммуноглобулинов. Димерные иммуноглобулины присутствуют в большинстве секреторных жидкостей, включая слизистые оболочки дыхательных и мочеполовых путей, ЖКТ, а также слюну, слезы, молозиво и молоко у женщин. Поскольку IgA присутствует на слизистых оболочках пищеварительной системы, где он может подвергаться воздействию ферментов, в его составе есть специальный компонент, который защищает молекулу от преждевременного разрушения.
Иммуноглобулины класса A, как правило, не являются специфическими с точки зрения «подстраивания» под специфический антиген. Обычно антитела из этой группы присутствуют в уязвимых местах организма или на участках, где микробы могут легко проникнуть внутрь. Иммуноглобулины класса A обеспечивают местный гуморальный иммунитет. Это связано с их свойствами предотвращать проникновение патогенов через эпителиальные поверхности, благодаря присутствию IgA в секрете слизистых оболочек (слюна, слезы) он защищает организм от некоторых локальных инфекций.
Основная функция иммуноглобулинов этого класса состоит не в разрушении антигенов, а в предотвращении проникновения инфекционных агентов в систему кровообращения. Сами по себе IgA не способны самостоятельно разрушать бактерии, поэтому они всегда работают вместе с лизоцимами - ферментами, которые также присутствуют в секреторных жидкостях и могут разрушать бактерии.
Нарушения концентрации иммуноглобулинов класса IgA в организме способствуют его восприимчивости к инфекционным заболеваниям дыхательных путей и мочеполовой системы, в том числе нефропатии. Лица, с недостаточностью IgA, более склонны к аутоиммунным расстройствам, таким как ревматоидный артрит, волчанка, аллергия и астма.
К снижению содержания IgA могут привести разные заболевания, среди которых - гонорея. Бактерии, вызывающие гонорею, продуцируют фермент, который расщепляет IgA на две части: Fc и Fab фрагменты. Что интересно, Fab все еще может находить опасные для организма бактерии, но без взаимодействия с Fc он не способен противостоять им.
Класс IgD
Иммуноглобулины класса D в организме человека представлены в очень маленьком количестве и составляют примерно 0,2% от всех антител. Известно, что IgD прикрепляется к поверхности некоторых В-лимфоцитов как рецептор В-клеток. Тем не менее его функции в человеческом организме на сегодня до конца еще не изучены. Предполагается, что именно IgD является причиной аллергии на пенициллин, а также он может участвовать в запуске аутоиммунных реакций.
Класс IgE
Иммуноглобулин IgE в норме составляет не более 0.1% от общего количества сывороточных иммуноглобулинов. Более 90% синтезируемого плазматическими клетками IgE секретируется в слизистых экзосекретах желудочно-кишечного тракта. Биологическая функция заключается в защите от внеклеточных паразитов, хотя она полностью не выяснена, и резкое увеличение количества IgE является патогенетическим признаком при аллергических реакциях.
Иммуноглобулины этой группы связываются с поверхностью базофилов и тучных клеток. Дальше к ним присоединяется антиген, что в свою очередь ведет к выбросу в кровоток вазоактивных аминов и развитию IgE-зависимой аллергической реакции по следующему механизму.
Различные антигены, такие как пыльца, ядовитые вещества, споры грибов, пылевые клещи или перхоть домашних животных связываются с IgE и запускают высвобождение гепарина, гистамина, протеолитических ферментов, лейкотриенов и цитокинов. Это ведет к расширению сосудов и повышению их проницаемости, что способствует проникновению чужеродных агентов в капилляры, а затем и в ближайшие ткани, вследствие чего развиваются характерные для аллергической реакции симптомы. Однако, большинство типичных аллергических реакций в виде чихания, кашля, слезотечения и повышенного выделения слизи способствует выведению из организма оставшихся аллергенов.
Исследования показали, что такие расстройства, как астма, ринит, экзема, крапивница и дерматит вызывают повышение уровня IgE. Антитела Е-типа также активно продуцируются в ответ на присутствие в организме гельминтов, персистирующих инфекций (герпесвирусы, атипичные микроорганизмы) и некоторых членистоногих (например, вшей). Кроме того, IgE играет косвенную роль в иммунном ответе, стимулируя другие иммунные компоненты. Также он может защищать поверхности слизистых оболочек, вызывая, в случае опасности, воспалительные реакции.
Патологически низкий уровень антител класса IgE может возникать на фоне редкого генетического заболевания, сопровождающегося нарушением координации мышц (атаксия телеангиэктазия).
Класс IgG
Иммуноглобулины класса G являются доминирующими в человеческом организме. На их долю приходится 75% всех антител. Частично это связано с длительным периодом полураспада: от 7 до 23 дней (зависимо от подкласса). Кроме того, они могут сохраняться в крови в течение нескольких десятков лет после контакта с антигеном.
Существуют 4 подкласса IgG:
- IgG1 составляет от 60 до 65% от общего количества иммуноглобулина этого класса. Его дефицит обычно является признаком гипогаммаглобулинемии (дефицит плазматических клеток).
- IgG2 - второй по распространенности изотоп, составляет 20-25% от общего количества IgG. «Взрослые» концентрации антитела обычно появляются к 6-7-летнему возрасту. Дефицит IgG2 связывают с рецидивирующими инфекциями дыхательных путей.
- IgG3 занимает от 5 до 10% от общего IgG. Играет основную роль в иммунных реакциях против белковых или полипептидных антигенов.
- IgG4 составляет до 4% в общей доле IgG. Раньше IgG4 связывали только с пищевой аллергией, но недавние исследования показали, что повышение IgG4 в сыворотке отмечается у пациентов, страдающих склерозирующим панкреатитом, холангитом и интерстициальной пневмонией. Тем не менее точная роль IgG4 до сих пор неизвестна.
IgG играет ключевую роль в гуморальном иммунном ответе. Это основной иммуноглобулин, содержащийся в крови, а также в лимфатической, спинномозговой и брюшной жидкостях. Способность оставаться в организме в течение длительного времени делает его наиболее полезным антителом для пассивной иммунизации. Это единственное антитело, способное проникать через плаценту матери и попадать в кровообращение плода, обеспечивая послеродовую защиту новорожденного в течение первых месяцев его жизни.
Главные функции IgG:
- усиление фагоцитоза в макрофагах и нейтрофилах;
- нейтрализация токсинов;
- инактивация вирусов;
- уничтожение бактерий.
Класс IgM
IgM - это самый важный представитель семейства человеческих иммуноглобулинов, хотя он и отличается весьма коротким периодом полураспада - около 5 дней.
Иммуноглобулины класса IgM в общей доле сывороточных антител в человеческом организме составляют примерно 10-13%. Они участвуют в первичных иммунных реакциях и обладает выраженной антибактериальной активностью, способностью связывать комплемент, не проникают через плацентарный барьер. Первыми синтезируются в ответ на антигенную стимуляцию организма. Наиболее ранние антитела относятся к иммуноглобулинам класса М, что нередко используется в диагностике инфекционных заболеваний. Они же первыми появляются в процессе онтогенеза и филогенеза.
Повышение уровня IgM можно расценивать как признак недавно перенесенной инфекции или присутствия в организме антигена. На мембране В-лимфоцитов присутствует мономерная форма IgM, выполняющая функцию основной составляющей В-клеточного рецептора.
Роль иммуноглобулинов в организме
Антитела являются частью гуморального иммунного ответа и действуют очень специфично, так как всегда направлены против определенного антигена.
Задача любого антитела в организме человека - участвовать в иммунных реакциях. Иммуноглобулины обладают способностью образовывать иммунные комплексы с молекулами антигена, активировать систему комплемента (комплекс белков, содержащихся в крови, необходимых для защиты организма от чужеродных агентов) и вызывать воспаления. Все эти действия направлены на нейтрализацию антигена и безопасное удаление его из организма.
Вследствие различных структурных свойств разные классы антител могут выполнять специализированные функции:
- нейтрализовать паразитов (IgE);
- нейтрализовать микроорганизмы (IgM, IgG);
- защищать от повторных заболеваний, таких как эпидемический паротит (IgG);
- защищать слизистые оболочки (IgA);
- участвовать в синтезе лимфоцитов (IgD);
- защищать плод (IgG) и новорожденного малыша (IgA).
Антитела и иммунологическая память
Иммунный ответ делится на первичный и вторичный. Первичный ответ проявляется во время первого контакта с антигеном, после чего организм сначала вырабатывает иммуноглобулины класса IgM, которые затем замещаются более специфическими и стабильными антителами IgG.
Вторичный иммунный ответ возникает при повторном контакте с тем же антигеном. Он интенсивнее первичного, концентрация антител достигает более высоких уровней, чем в первый раз.
Такой эффект обусловлен иммунологической памятью, которая опосредована В-имфоцитами. Это долгоживущие клетки которые вступают в контакт с антигеном, начинают очень интенсивно делиться и продуцировать специфические антитела.
Как определяется количество антител
Антитела составляют от 12% до 18% сывороточных белков. Количества отдельных белковых фракций, в лабораторных условиях определяется на основании протеинограмм.
Тест на антитела методом иммуноферментного анализа (ИФА), как правило, проводится с венозной кровью (позволяет определить количество иммуноглобулинов класса IgM, IgG, IgE, IgA). Кроме того, определить количество антитела класса IgA можно путем биохимического исследования слюны или кала человека - методом полимеразной цепной реакции (ПЦР). В отдельных ситуациях тест может быть проведен с использованием другого материала, например спинномозговой жидкости.
Если в крови пациента диагностировано критическое повышение некоторых иммуноглобулинов, говорят о гипергаммаглобулинемии. Как правило, у таких пациентов чрезмерно повышаются антитела класса IgM, при этом остальные остаются в дефиците.
На фоне патологического повышения некоторых антител могут развиваться разные заболевания, в том числе:
- острые и хронические воспаления;
- паразитарные, бактериальные, вирусные или грибковые заболевания;
- аутоиммунные болезни;
- цирроз печени;
- саркоидоз; .
Патологически низкое количество антител в сыворотке может возникать на фоне:
- врожденных генетически расстройств;
- приема некоторых противомалярийных, цитостатических, глюкокортикоидных препаратов;
- недоедания;
- инфекции, в том числе ВИЧ;
- онкологических заболеваний;
- нефротического синдрома;
- обширных ожогов;
- тяжелой диареи.
Иммуноглобулины и вакцинация
Антитела играют ключевую роль в развитии иммунитета после вакцинации. В результате контакта с антигеном, содержащимся в вакцине, иммунная система вырабатывает антитела. Сначала менее стойкий и специфический IgM, а затем более стойкий IgG. Например, во время вакцинации против вируса гепатита В, вакцину вводят трижды с определенным интервалом между прививками. Это позволяет создать стойкий иммунитет к болезни. Эффективность такой вакцинации определяется изменением в организме количества антител IgG.
Антитела в медицине
Благодаря развитию биохимии, молекулярной биологии и медицины, в наше время стало возможным синтезировать иммуноглобулины в лабораторных условиях (как правило, антитела класса IgG). Такие антитела называются моноклональными, так как они происходят из клона одной клетки и работают против определенного антигена.
Сегодня моноклональные иммуноглобулины используют для лечения разных заболеваний. Впервые эта методика была применена в 1981 году для лечения лимфомы. А уже в 1984 году изобретатели моноклональных антигенов - немецкий биолог Георг Келер и британский иммунолог Сезар Мильштейн - получили Нобелевскую премию.
В современной медицине моноклональные антитела применяют для:
- уничтожения раковых клеток;
- ингибирования отдельных клеток иммунной системы после трансплантации органов (позволяет предотвратить отторжение пересаженного органа);
- подавления иммунных реакций при аутоиммунных заболеваниях.
Иммунный ответ на каждый отдельный антиген включает продукцию множества молекул антител, синтезируемых разными плазматическими клетками, и имеющих разное строение активного центра и изотип. Вследствие различий в строении активных центров образующиеся антитела имеют различную специфичность и аффинность.
Специальность: врач педиатр, инфекционист, аллерголог-иммунолог .
Болезни тяжелых цепей
Болезни тяжелых цепей являются неопластическими плазмоклеточными заболеваниями, которые характеризуются гиперпродукцией тяжелых цепей моноклональных иммуноглобулинов. Симптомы, диагностика и лечение варьируют в зависимости от конкретного заболевания.
Болезни тяжелых цепей являются плазмоклеточными заболеваниями, которые обычно носят злокачественный характер. При большинстве плазмоклеточных заболеваний образуются М-протеины (моноклональные иммуноглобулины), аналогичные по структуре нормальным молекулам антител. Напротив, при болезнях тяжелых цепей синтезируются неполные моноклональные иммуноглобулины (истинные парапротеины). Они состоят только из компонентов тяжелых цепей (альфа [ α ], гамма [ γ ], мю [ μ ] или дельта [ δ ]), легкие цепи отсутствуют (болезнь тяжелых эпсилон [ ε ]-цепей не описана). Большая часть белков тяжелых цепей является фрагментами их нормальных копий с делецией внутренних участков различной длины; эти делеции относятся к структурным генетическим мутациям. Клиническая картина в большей степени напоминает лимфому Обзор лимфомы (Overview of Lymphoma) Лимфомы представляют собой гетерогенную группу заболеваний, происходящих из клеток ретикулоэндотелиальной и лимфатической системы. Основные варианты лимфом - лимфома Ходжкина и неходжкинские. Прочитайте дополнительные сведения , чем множественную миелому Множественная миелома Множественная миелома является злокачественной плазмоклеточной опухолью, продуцирующей моноклональные иммуноглобулины, которые внедряются в прилежащую костную ткань и разрушают ее. К характерным. Прочитайте дополнительные сведенияБолезнь тяжелых цепей IgA (болезнь альфа цепей)
Болезнь тяжелых цепей IgA является наиболее распространенной формой болезни тяжелых цепей и подобна средиземноморской лимфоме (иммунопролиферативной болезни тонкой кишки).
Болезнь тяжелых цепей IgA обычно возникает в возрасте 10-30 лет и географически сконцентрирована на Ближнем Востоке. Причиной может быть неадекватный иммунный ответ на паразитарную инвазию или инфекцию. Обычно присутствует атрофия ворсинок и плазмоклеточная инфильтрация слизистой оболочки тощей кишки, иногда может наблюдаться инфильтрация мезентериальных лимфатических узлов. Периферические лимфоузлы, костный мозг, печень и селезенка обычно интактны. Формы, поражающие респираторный тракт, регистрируются редко.
Распространенные проявления включают лихорадку, легкую анемию, затрудненное глотание (дисфагию), рецидивирующие инфекции верхних дыхательных путей, а также увеличение печени и селезенки. Остеолитические повреждения нехарактерны.
Почти во всех случаях наблюдаются признаки диффузной абдоминальной лимфомы и мальабсорбции Обзор мальабсорбции (Overview of Malabsorption) Мальабсорбция характеризуется нарушением усвоения питательных веществ вследствие расстройств переваривания, всасывания или транспорта. Мальабсорбция может затрагивать нарушение усвоения основных. Прочитайте дополнительные сведения . В общем анализе крови могут определяться анемия, лейкопения Обзор лейкопений (Overview of Leukopenias) Лейкопения - это снижение числа циркулирующих лейкоцитов 4000/мкл ( 9 /л). Она обычно характеризуется уменьшением числа циркулирующих нейтрофилов, хотя может отмечаться также уменьшение. Прочитайте дополнительные сведения , тромбоцитопения, эозинофилия Эозинофилия Эозинофилия - это увеличение числа эозинофилов в периферической крови >500/мкл (> 0,5 × 10 9 /л). Причины и сопутствующие заболевания являются многочисленными, но часто представляют. Прочитайте дополнительные сведенияТечение заболевания отличается высокой вариабельностью: некоторые пациенты умирают через 1-2 года, у других наблюдается длительная ремиссия, в особенности после лечения кортикостероидами, цитотоксическими препаратами и антибиотиками широкого спектра действия.
Болезнь тяжелых цепей IgG (болезнь гамма цепей)
Болезнь тяжелых цепей IgG, как правило, имеет агрессивный характер, сходный со злокачественной лимфомой, однако в редких случаях она может протекать бессимптомно и доброкачественно.
Болезнь тяжелых цепей IgG чаще всего возникает у мужчин пожилого возраста, но может встречаться и у детей. К ассоциированным хроническим заболеваниям относятся ревматоидный артрит Ревматоидный артрит (РА) Ревматоидный артрит (РА) - хроническое системное аутоиммунное заболевание, поражающее прежде всего суставы. Патологические изменения при РА опосредовано цитокинами, хемокинами и металлопротеиназами. Прочитайте дополнительные сведения , системная красная волчанка Системная красная волчанка (СКВ) Системная красная волчанка - хроническое мультисистемное воспалительное заболевание аутоиммунной природы; поражает преимущественно молодых женщин. Наиболее часто заболевание проявляется артралгиями. Прочитайте дополнительные сведения , миастения гравис Миастения гравис Миастения характеризуется эпизодами мышечной слабости и быстрой утомляемости, в основе чего лежит деструкция ацетилхолиновых рецепторов факторами гуморального и клеточного иммунитета. Она чаще. Прочитайте дополнительные сведения , гиперэозинофильный синдром Гиперэозинофильный синдром Гиперэозинофильный синдром является состоянием, которое характеризуется эозинофилией периферической крови с проявлениями поражения или дисфункции систем органов, обусловленных непосредственно. Прочитайте дополнительные сведения , аутоиммунная гемолитическая анемия Аутоиммунная гемолитическая анемия Аутоиммунная гемолитическая анемия обусловлена аутоантителами, которые реагируют с эритроцитами при температуре ≥ 37 °С (гемолитическая анемия с тепловыми антителами) или 37 °С (болезнь холодовых. Прочитайте дополнительные сведения .
Манифестация заболевания чаще всего включает в себя следующие признаки: лимфаденопатия, гепатоспленомегалия, лихорадка, рецидивирующие инфекции. У четверти пациентов наблюдается отек неба.
В общем анализе крови могут определяться анемия, лейкопения, тромбоцитопения, эозинофилия, наличие циркулирующих атипичных лимфоцитов или плазматических клеток. Диагностика основана на выявлении фрагментов свободных моноклональных цепей IgG в сыворотке крови и моче методом иммунофиксации. У половины пациентов содержание моноклональных компонентов, которые зачастую обширные и гетерогенные, в сыворотке крови составляет > 1 г/дл ( > 10 г/л), а в половины возникает протеинурия > 1г/24 часа. Хотя белки тяжелых цепей могут относиться к любому IgG подклассу, чаще всего встречаются иммуноглобулины подкласса G3. Биопсия костного мозга или лимфатических узлов выполняется в том случае, если другие методы неинформативны, при этом выявляются различные гистопатологические изменения.
Медиана выживаемости при данном агрессивном заболевании составляет около 1 года. Летальный исход обычно обусловлен бактериальной инфекцией или прогрессированием злокачественного процесса. Применение алкилирующих препаратов, винкристина, кортикостероидов и лучевой терапии может привести к временной ремиссии.
Болезнь тяжелых цепей IgM (болезнь мю-цепей)
Болезнь тяжелых цепей IgM встречается редко, ее клиническая картина сходна с хроническим лимфолейкозом или другими лимфопролиферативными заболеваниями.
Болезнь тяжелых цепей иммуноглобулина М чаще всего поражает людей старше 50 лет. Характерно поражение висцеральных органов (селезенки, печени, абдоминальных лимфатических узлов), которое, однако, не сопровождается распространенной периферической лимфаденопатией. Могут наблюдаться патологические переломы и амилоидоз Амилоидоз Амилоидозом называют группу различных состояний, характеризующихся отложением во внеклеточном пространстве нерастворимых фибрилл, состоящих из неагрегированных белков. Эти белки могут накапливаться. Прочитайте дополнительные сведенияДиагностика, как правило, основана на исследовании костного мозга; вакуолизированные плазматические клетки, которые обнаруживаются у 2/3 пациентов, являются фактически патогномоничным признаком. Летальный исход может наступать как в течение нескольких месяцев, так и через много лет после постановки диагноза. Основной причиной смерти является неконтролируемая пролиферация клеток хронического лимфолейкоза Хронический лимфолейкоз (ХЛЛ) Хронический лимфоцитарный лейкоз (ХЛЛ) характеризуется прогрессирующим накоплением фенотипически зрелых злокачественных В-лимфоцитов. Первичные места заболевания включают периферическую кровь. Прочитайте дополнительные сведения .
Лечение зависит от состояния пациента, оно может включать в себя алкилирующие препараты в сочетании с кортикостероидами либо терапию, аналогичную лечению лимфопролиферативных заболеваний, с которыми данная патология имеет значительное сходство.
Авторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
Моноклональная гаммапатия неясного генеза

Моноклональными гаммапатиями называют увеличение концентрации моноклонального парапротеина (М-протеина) в плазме крови или моче. Чаще всего увеличивается концентрация IgG, следом по частоте возникновения идет повышение IgA, IgM или IgD. При отсутствии заболевания, лежащего в основе такого роста концентрации иммуноглобулинов, говорят о моноклональной гаммапатии неясного генеза (МГНГ, monoclonal gammopathy of undetermined significance, MGUS), что служит окончательным диагнозом, не является (пока что) признаком злокачественного заболевания и поэтому не требует лечения.
Вероятность возникновения МГНГ-заболеваний увеличивается с каждым годом жизни человека. Заболеваемость среди людей старше 50 лет составляет 1-3 %, а среди 85-летних — до 7,5 %. Мужчины заболевают немного чаще женщин. В настоящее время проводятся многочисленные исследования по выявлению причин возникновения моноклональных гаммапатий (рис. 1).
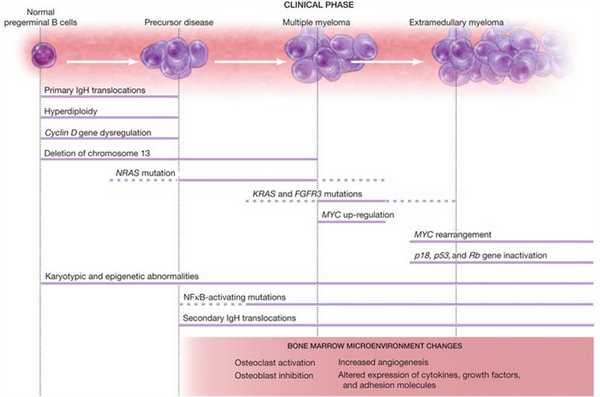
Рисунок 1 | Причины возникновения моноклональных гаммапатий
Их злокачественная трансформация может быть связана со многими патологическими процессами. При этом не все из представленных выше причин считаются обязательными для озлокачествления МГНГ. Например, гипердиплоидия клеток встречается только в 50 % случаев. Как можно увидеть на изображении, если такая трансформация происходит, то она остается на протяжении всего заболевания.
На ранних этапах особую роль играют транслокации IgH — обычно t(4;14), t(14;16), t(6;14), t(11;14) и t(14;20) — и гипердиплоидия клеток. Одна из этих трансформаций чаще всего встречается в комбинации с делецией 13-й хромосомы. В 80-90 % случаев делеция происходит при транслокации IgH t(4;14), t(14;16) и t(14;20). Также часто происходит дисрегуляция в гене циклина D. Активирующие мутации в системах NRAS и KRAS наблюдаются в 15 % случаев множественной миеломы; NRAS-мутации при этом больше характерны для МГНГ.
Постоянная активация ядерного фактора (nuclear factor κB — NFκB) является мутацией, приводящей к прогрессии заболевания; также причиной этому может стать инактивация или делеция генов, кодирующих белки p53 и p18, что чаще всего происходит в случаях внутрикостной и экстрамедуллярной множественной миеломы. Зависимость клеток от микроокружения костного мозга определяется стадией заболевания. Экстрамедуллярные опухолевые клетки, в свою очередь, приобрели в процессе мутаций свойства, делающие их независимыми от микроокружения опухоли.
Предполагается, что изменения в составе костного мозга происходят еще до возникновения гаммаглобулинемии. В предыдущих исследованиях ученым удалось доказать, что иммунная система способна распознавать нарушения гомеостаза еще на ранних стадиях, что приводит к снижению риска прогрессии заболевания. Иммуномодуляторы, такие как леналидомид и помалидомид, используемые при терапии множественной миеломы, способны предотвращать злокачественную трансформацию.
Считается, что в патологических процессах, предшествующих развитию МГНГ, принимают участие так называемые врожденные лимфатические клетки (innate lymphoid cells — ILCs). Им приписывают участие в регуляции различных процессов, в том числе аутоиммунных, защите от патогенов, поддержании тканевого гомеостаза. ILC1 способны вырабатывать большое количество Ikzf316 — белка, связывающего ДНК, что играет роль в злокачественных процессах, делая эти клетки возможной мишенью для терапии. Ученым удалось обнаружить, что у больных МГНГ количество этих клеток в костном мозге действительно увеличивается, что нельзя сказать о циркулирующей фракции этих клеток.
Диагностика МГНГ
Для диагностики МГНГ в первую очередь проводят сбор анамнеза и осмотр больного: могут быть жалобы на костные боли, частые инфекционные заболевания, симптомы анемии, пенящуюся мочу (признак протеинурии), отеки конечностей, симптомы и признаки сердечной недостаточности.
После этого начинается клиническое обследование с использованием лабораторных методов исследования. В плазме крови определяют концентрацию общего белка, альбумина, креатинина, мочевины, натрия, калия и кальция, а также проводят качественный анализ крови и мочи на иммуноглобулины IgG, IgA, IgM и свободные легкие цепи κ и λ.
Важно провести дифференциальную диагностику МГНГ с множественной миеломой, AL-амилоидозом, макроглобулинемией Вальденстрема, неходжкинскими лимфомами и солитарной плазмоцитомой. Необходимо учитывать, что при ВИЧ-инфекции и гепатите С также встречается криоглобулинемия. Похожая клиническая картина может быть у некоторых аутоиммунных заболеваний, цитомегаловирусной инфекции и лейшманиозов.
Для постановки диагноза необходимо определить в сыворотке крови наличие моноклонального пика (М-градиента) бета- или гамма-фракций глобулинов при одновременном уменьшении или отсутствии других глобулиновых фракций. После электрофореза проводится иммунофиксация иммуноглобулинов в сыворотке крови — количественный анализ посредством их инкубации с антителами, направленными против них самих (определяется количество IgG, IgA, IgM и κ- или λ-легких цепей, а также их соотношение).
Для диагностики также важно количественное определение иммуноглобулинов и их цепей в моче. Патологические низкомолекулярные белки из моноклональных легких цепей иммуноглобулинов (например, κ- или λ-цепей), которые в избыточном количестве продуцируются плазматическими клетками и выводятся почками, называются белками Бенс-Джонса и служат маркером многих иммунологических заболеваний, в том числе множественной миеломы.
Обычно проводят определение только вышеуказанных иммуноглобулинов и их частей, но при неоднозначных результатах можно выполнить анализ с помощью анти-IgD и анти-IgE антител. Количественный анализ проводится с помощью нефелометрического метода.
В противном случае рекомендуется проведение следующих дополнительных диагностических процедур:
- количественное определение протеинов и легких цепей Ig в суточной моче;
- определение β2-микроглобулина и ЛДГ (LDH) в плазме крови;
- пункция костного мозга, цитологическое и гистологическое исследование полученного аспирата, цитогенетическое исследование клеток методом проточной цитометрии;
- при наличии симптомов со стороны органов и тканей — биопсия;
- рентгенологическая диагностика в соответствии с парижской схемой (череп, позвоночник, таз, длинные кости конечностей, грудная клетка в двух проекциях). Альтернативой является проведение остео-КТ без использования контрастных веществ (преимущества: оценка стабильности, высокое разрешение). Возможно проведение МРТ (особенно при солитарной плазмоцитоме или поражении мягких тканей при множественной миеломной болезни);
- ЭХО-КГ с целью исключения кардиального амилоидоза.
Диагноз МГНГ впервые был предложен International Myeloma Working Group (IMWG) в 2015 году. Тогда же были определены следующие критерии для его постановки:
Читайте также:
